Method Article
تقييم هجرة الخلايا الليمفاوية في نظام الهجرة فيفو السابقين
In This Article
Summary
في هذا البروتوكول ، يتم وضع الخلايا الليمفاوية في الغرفة العليا لنظام الهجرة ، مفصولة عن الغرفة السفلية بواسطة غشاء مسامي. يضاف Chemokine إلى الغرفة السفلى، مما يحفز الهجرة النشطة على طول التدرج chemokine. بعد 48 ساعة، يتم حساب الخلايا الليمفاوية في كلتا الغرفتين لتكميم الهجرة.
Abstract
هنا، نقدم طريقة فعالة التي يمكن تنفيذها مع المهارات المختبرية الأساسية والمواد لتقييم الحركة الكيميائية للخلايا الليمفاوية في نظام الهجرة عبر الجسم الحي السابق. تم عزل الخلايا اللمفاوية الفطرية للمجموعة 2 (ILC2) وCD4+ T الخلايا المساعدة من الطحال والرئتين من الفئران التي تواجه بيضة الدجاج (OVA) التي تواجه تحديات BALB/c. وأكدنا التعبير عن CCR4 على كل من CD4+ T الخلايا وILC2، نسبيا. CCL17 و CCL22 هي الأربطة المعروفة لCCR4; لذلك، باستخدام هذه الطريقة الهجرة الجسم الحي السابق فحصنا CCL17- وCCL22 الناجمة عن الحركة من CCR4+ الخلايا الليمفاوية. ولإنشاء تدرجات كيميائية، وُضع كل من CCL17 وCCL22 في الغرفة السفلى لنظام الهجرة العابرة. ثم أضيفت الخلايا الليمفاوية المعزولة إلى الغرف العليا وعلى مدى فترة 48 ح هاجر الخلايا الليمفاوية بنشاط من خلال المسام 3 ميكرومتر نحو chemokine في الغرفة السفلى. هذا هو نظام فعال لتحديد الحركة الكيميائية للخلايا الليمفاوية، ولكن، من المفهوم، لا يحاكي التعقيدات الموجودة في البيئات الدقيقة للأعضاء في الجسم الحي. هذا هو أحد القيود على الطريقة التي يمكن التغلب عليها عن طريق إضافة التصوير في الموقع من الجهاز والخلايا الليمفاوية قيد الدراسة. وعلى النقيض من ذلك، فإن ميزة هذه الطريقة هي أنه يمكن أن يقوم بها فني مبتدئ بمعدل أكثر فعالية من حيث التكلفة من التصوير الحي. كما تصبح المركبات العلاجية متاحة لتعزيز الهجرة، كما هو الحال في تسرب الورم الخلايا المناعية السامة للخلايا، أو لمنع الهجرة، وربما في حالة أمراض المناعة الذاتية حيث علم الأمراض المناعية هو مصدر قلق، ويمكن استخدام هذه الطريقة باعتبارها أداة الفرز. بشكل عام، فإن الطريقة فعالة إذا كان chemokine من الفائدة هو توليد باستمرار الحركية الكيميائية على مستوى أعلى إحصائيا من السيطرة على وسائل الإعلام. وفي مثل هذه الحالات، يمكن تحديد درجة التثبيط/التعزيز من قبل مركب معين أيضاً.
Introduction
وقدم هذا الأسلوب الأصلي الهجرة من قبل ستيفن بويدن في عام 1962 في مجلة الطب التجريبي1. الكثير مما نعرفه عن الأدوية الكيميائية والحركية الكيميائية لن يكون ممكناً بدون تطوير غرفة بويدن. قبل اكتشاف أول chemokine في عام 1977، تم استخدام أنظمة الهجرة خارج الجسم الحي لمعرفة المزيد عن العوامل المصل التي يمكن أن توقف الحركة الخلوية في الضامة في حين تضخيم الحركة الخلوية في العدلات1،2. وقد وضعت ثروة هائلة من المعرفة فيما يتعلق بهجرة الخلايا المناعية، وحتى الآن، تم اكتشاف 47 chemokines الآن مع 19 مستقبلات المقابلة3،4. وبالإضافة إلى ذلك، شهدت العديد من مثبطات / محسنات هذه المسارات chemokine التنمية لأغراض علاجية5،6،7،8. وقد تم اختبار العديد من هذه المركبات في غرف الهجرة مماثلة لفهم التفاعلات المباشرة بين المركبات واستجابة الخلايا المناعية لchemokine معين9.
الهجرة، أو التبذير، إلى الأنسجة الملتهبة هي عملية أساسية لاستجابة التهابية صحية لإزالة العدوى10،11. غرفة Boyden، نظام الهجرة، أو جهاز transwell تتكون عموما من غرفتين مفصولة غشاء مسامية1،12. الغرفة السفلى في معظم الأحيان يحمل وسائل الإعلام التي تحتوي على chemokine من الفائدة، في حين يتم وضع الكريات البيض في الغرفة العليا. يمكن اختيار حجم المسام في الغشاء على أساس حجم خلية الفائدة. لهذا المشروع، اخترنا غشاء مسامية 3 ميكرومتر، كما الخلايا اللمفاوية هي 7-20 ميكرومتر في الحجم، اعتمادا على مرحلة التطور الخلوي. هذا الحجم المسام يضمن أن هذه الخلايا لا تسقط بشكل سلبي من خلال المسام، ولكن أنها تهاجر بنشاط استجابة للتدرج chemokine.
والميزة الرئيسية لهذا البروتوكول هي فعاليته من حيث التكلفة. في نقل الجسم الحي أمر صعب لأنه يتطلب تدريبا مكثفا في التعامل مع الحيوانات والجراحة، وغالبا ما ينطوي على الفحص المجهري عالية الطاقة التي ليست متاحة دائما للباحث. ويمكن إجراء فحص فعال من حيث التكلفة للمركبات التي يعتقد أنها تعزز أو تمنع الهجرة إلى الخارج قبل التصوير في الجسم الحي. لأن نظام الهجرة إلى الخارج يتم التحكم فيه بإحكام، يمكن علاج الخلايا في البداية ثم إضافتها إلى جهاز ترانسويل، أو العكس بالعكس، يمكن علاج chemokine أولا مع مثبط chemokine ثم الخلايا المضافة إلى جهاز transwell. وأخيرا، يمكن إضافة الخلايا البطانية و / أو بروتينات غشاء الطابق السفلي إلى الجزء السفلي من transwell إدراج 1-2 أيام قبل تجربة الهجرة لفهم مشاركة هذه الخلايا الحاجزة في الحركية الكيميائية. مرة أخرى، هذه التلاعبات في النظام توفر وسيلة قوية لتحديد المعلومات الهامة حول فعالية مركب معين قبل أكثر تعقيدا في الدراسات الحية.
استخدام نظام غرفة الهجرة هو وسيلة فعالة لتقييم حركة الخلايا الليمفاوية في ظل مختلف في الظروف الحية والمختبرية12،13،14. هنا، ونحن نصف طريقة الأمثل لتقييم استجابة الخلايا الليمفاوية في الجسم الحي السابق لchemokines في غرفة الهجرة. في هذه التجربة المثال، تم عزل خلايا CD4+ T والخلايا اللمفاوية الفطرية المجموعة 2 (ILC2) من الذكور والإناث، والفئران BALB /c بعد التعرض OVA-مسببات الحساسية. تم إنشاء فرضية أن CCR4+ CD45+ النسب - (LIN-) ILC2 من الفئران التي تواجه مسببات الحساسية سوف تهاجر بشكل أكثر كفاءة نحو CCL17 و CCL22 من CCR4+ CD4+ T الخلايا المساعد. CCL17 و CCL22 هي chemokines تنتج عادة من قبل الخلايا الجذعية والضامة من النمط الظاهري M2 (حساسية)، من بين خلايا أخرى، في الحساسية15،16. يمكن اعتبار CCL17 و CCL22 علامات حيوية لالتهاب الحساسية حيث يتم اكتشافها بسهولة في الرئتين أثناء تفاقم مجرى الهواء16و17و18. الأهم من ذلك، يتم رفع التعبير CCR4 بالمقارنة مع الضوابط غير المعالجة، كما هو الحال في بيانات المعلوماتية الحيوية التي تم إنشاؤها من ILC2 معزولة من الحيوانات المعالجة عث الغبار المنزل، وبالمثل ILC2 من الحيوانات السذاجة تعامل في الجسم الحي السابق مع IL-33 ( [قبرص CCR444] 19،20. وعلاوة على ذلك، وفقا لبيانات ILC2 في قاعدة بيانات مشروع الجينوم المناعي (www.immgen.org)، يتم التعبير عن CCR4 mRNA بشكل كبير في هذه الخلايا المناعية الفطرية. وحتى الآن، لا يُعرف سوى القليل فيما يتعلق بالاتجار بـ ILC2 في الأنسجة، ولكن من المرجح أن تستخدم خلايا ILC2 وCD4+ T خلايا chemokines ومستقبلات مماثلة للأجهزة الكيميائية والحركية الكيميائية لأنها تعبر عن عوامل النسخ والمستقبلات المماثلة. وهكذا، قارنا CCL17 مقابل استجابة CCL22، من ILC2 و CD4+ الخلايا الليمفاوية T، من كل من الذكور والإناث، والحيوانات التي تواجه تحديا OVA.
Protocol
تم استعراض جميع الأساليب الموضحة هنا والموافقة عليها من قبل اللجان المؤسسية لرعاية الحيوانات واستخدامها في المركز الطبي لجامعة نبراسكا (UNMC) وجامعة يوتا.
1. إعداد وإعداد الكواشف
-
إعداد كامل RPMI (روزويل بارك معهد النصب التذكاري) وسائل الإعلام.
- أضف 10 مل من مصل البقر الجنيني المعطلة حرارة الحرارة (FBS) إلى 90 مل من RPMI.
- إضافة 1 مل من 100X البنسلين-ستربيميتيوسين-الجلوتامين إلى 100 مل من 10٪ FBS RPMI.
-
إعداد وسائط توسيع ILC2.
- إضافة IL-2 و IL-33 (20 نانوغرام /مل لكل سيتوكين) إلى 10 مل من RPMI كاملة.
- إذا كانت السيتوكينات الأسهم هي 10 ميكروغرام / مل، ماصة 20 درجة مئوية من IL-2 وIL-33 في أنبوب 15 مل تحتوي على 10 مل من وسائل الإعلام RPMI كاملة.
-
إعداد وسط تفكك الرئة.
- إضافة 50 ملغ من نوع 1 كولاجيناز إلى 250 مل من RPMI غير تكميلية.
- إضافة 2.5 مل من 100X البنسلين-ستربيميتيمين-الجلوتامين إلى 250 مل من وسائل الإعلام في الخطوة 1.3.1.
- اخلط يُمزج الوسائط برفق لضمان إذابة الكولاجين من النوع 1 تمامًا قبل الاستخدام.
-
إعداد الأمفيسي خالية من المصل.
- تمييع 1 غرام من الزلال المصل البقري الليوفي (BSA) في 200 مل من RPMI.
- إضافة 2 مل من 100X البنسلين-ستربيميتسين-الجلوتامين.
- قم بمزج وسائل الإعلام برفق لضمان حل BSA تمامًا في وسائل الإعلام قبل الاستخدام.
-
إعداد وسيط ة الهجرة مع CCL17.
- احصل على 10 مل من دورة في الدقيقة الخالية من المصل وأضف CCL17 [50 نانوغرام/مل].
- إذا كان المخزون CCL17 هو 10 ميكروغرام/مل، أضف 50 ميكرولتر من مخزون CCL17 إلى 10 مل من وسائل الإعلام الخالية من الـ RPMI الخالية من المصل.
- احصل على 10 مل من دورة في الدقيقة الخالية من المصل وأضف CCL17 [50 نانوغرام/مل].
-
إعداد وسيط ة الهجرة مع CCL22.
- احصل على 10 مل من دورة في الدقيقة الخالية من المصل وأضف CCL22 [50 نانوغرام/مل].
- إذا كان المخزون CCL22 هو 10 ميكروغرام /مل، أضف 50 ميكرولتر من مخزون CCL22 إلى 10 مل من وسائل الإعلام الخالية من الـ RPMI في المصل.
-
إعداد CCR4 المضادة تلطيخ كوكتيل.
- بالنسبة لإجمالي 10 اختبارات، أضف 5 ميكرولتر لكل من الأجسام المضادة التالية إلى أنبوب 5 مل: CCR4 المضادة للماوس، CD19، CD11b، CD45، ST2، وICOS.
ملاحظة: مثال على كيفية صنع كوكتيل الأجسام المضادة لـ 10 عينات: 0.5 ميكرولتر لكل جسم مضاد × 10 عينات = 5 ميكرولتر لكل من الأجسام المضادة المدرجة في 1.7.1. - بالنسبة لإجمالي 10 اختبارات، أضف 2.5 ميكرولتر من الأجسام المضادة التالية إلى كوكتيل الأجسام المضادة من الخطوة 1.7.1: CD3 وCD11c المضادة للماوس وNK1.1.
ملاحظة: مثال لإكمال كوكتيل الأجسام المضادة لـ 10 عينات: 0.25 ميكرولتر × 10 عينات = 2.5 ميكرولتر من CD3 و CD11c وNK1.1 الأجسام المضادة. - تخزين CCR4 المضادة تلطيخ كوكتيل في 4 درجة مئوية حتى على استعداد لإضافة إلى العينات. تخلص من كوكتيل الأجسام المضادة بعد أسبوع واحد إذا لم يتم استخدامه.
- بالنسبة لإجمالي 10 اختبارات، أضف 5 ميكرولتر لكل من الأجسام المضادة التالية إلى أنبوب 5 مل: CCR4 المضادة للماوس، CD19، CD11b، CD45، ST2، وICOS.
-
إعداد 1X استقرار المثبت.
- إضافة 10 مل من الماء المقطر منزوع الأيونات إلى 5 مل من التركيز المثبت استقرار 3X
2. إعداد الفئران BALB /c التي تواجه مسببات الحساسية
ملاحظة: تم شراء فئران BALB/c من الذكور والإناث من نهر تشارلز (UNMC) أو مختبرات جاكسون (جامعة يوتا) في سن 6 إلى 8 أسابيع.
-
بعد التأقلم (أسبوع واحد)، وتوعية جميع الحيوانات إلى OVA.
- الجمع بين 100 ميكروغرام / مل OVA الامتصاص إلى هيدروكسيد الألومنيوم (20 ملغ / مل) في أنبوب البوليسترين 5 مل.
- خلط الأنبوب وعلى الفور رسم 500 درجة مئوية من تعليق OVA-الشب في 1 مل، 28 G حقنة (حقنة الأنسولين).
- ضع فأراً في جرة جرس تحتوي على الأيسوفلوران (1-2 مل تحت أرضية زائفة، بحيث لا يقف الحيوان مباشرة في الأيسوفلوران). السماح للماوس للذهاب تحت التخدير لمدة 1-2 دقيقة تقريبا، أو حتى ينخفض معدل التنفس.
- التقاط الماوس بسرعة من الفراء على الظهر والكتفين وحقن 100 درجة مئوية من OVA-الشب intraperitoneally لكل ماوس21،22.
- وضع الماوس مرة أخرى في قفصه ومشاهدة للتأكد من أنها استعادة التنقل. يجب أن يحدث هذا في غضون 2-5 دقيقة.
-
بعد سبعة أيام من التوعية، تخضع جميع الحيوانات داخل الأنف (i.n.) 1.5٪ OVA المخففة في المالحة المعقمة في غرفة السديم (علوم البيانات الدولية) لمدة 20 دقيقة.
- إزالة الفئران من أقفاصها ووضعها في غرفة السديم الحيوانية. أغلق الغطاء على الغرفة.
- إرفاق خرطوم السديم إلى صنبور الإدخال على غرفة السديم.
- أضف 30 مل من 1.5٪ OVA المخففة في المالحة المعقمة إلى كوب البخاخات على البخاخات.
- تشغيل البخاخات والسماح للغرفة لملء مع الضباب لمدة 20 دقيقة.
- إيقاف البخاخات والسماح للضباب تسوية.
- أعد الحيوانات إلى أقفاصها
- كرر الخطوة 2.2 لما مجموعه 5 مرات، في 5 أيام متتالية، للحث على التهاب الحساسية.
3. عزل CD4+ T الخلايا من الطحال والرئتين من الفئران OVA تحدى
- قتل جميع الحيوانات الذكور والإناث المعالجة بـ OVA بطريقة إنسانية عن طريق الاختناق بثانيأكسيد الكربون وفقاً لبروتوكولات IACUC المعتمدة، باستخدام 2 إلى 3 من الحيوانات لكل مجموعة، لكل تجربة.
- مكوس الرئتين والطحال من الحيوانات ووضع الأنسجة في أنابيب منفصلة التفكك على أساس نوع الأنسجة وجنس الحيوان23.
- فصل أنسجة الرئة في 500 درجة مئوية من وسائل الإعلام تفكك الرئة (25 U/mL; collagenase, نوع 1) في تفكك الأنسجة الآلي باستخدام بروتوكول 'الرئة'.
- كرر 3.2 و 3.3 ما مجموعه مرتين.
- فصل أنسجة الطحال في 500 درجة مئوية من وسائل الإعلام RPMI كاملة باستخدام بروتوكول 'الطحال' على تفكك الأنسجة الآلي.
ملاحظة: وينبغي تنفيذ الخطوات المتبقية في مجلس الوزراء السلامة البيولوجية باستخدام تقنية معقمة. - شطف أنابيب التفكك التي تحتوي على الرئة والطحال التجانس مع 5 مل من وسائل الإعلام منفصلة الرئة إضافية أو RPMI كاملة، على التوالي.
- تصفية تعليق الخلية من خلال مصفاة خلية 40 ميكرومتر وجمع في أنابيب مخروطية 50 مل.
- حضانة التجانس الرئة لمدة 15-30 دقيقة في حاضنة 37 درجة مئوية مع 5٪ CO2 لمزيد من تفكك أنسجة الرئة.
- إضافة 5 مل من RPMI كاملة إلى الرئة والطحال التجانس وبيليه الخلايا في الجزء السفلي من أنابيب 50 مل باستخدام الطرد المركزي؛ 378 × ز في درجة حرارة الغرفة (RT) لمدة 5 دقائق.
- الجمع بين الخلايا اللصقية وخلايا الرئة في أنبوب مخروطي واحد 50 مل وتحديد مجموع عدد الخلايا باستخدام عداد الخلية الآلي.
- ضبط تعليق الخلايا الذكور والإناث إلى 1 × 108 خلايا / مل في العازلة فصل وإضافة إلى أنبوب البوليسترين 5 مل.
ملاحظة: ويمكن تعديل بروتوكول الإثراء حتى أنابيب البوليستيرين التي تصل إلى 14 مل عندما يتم الحصول على المزيد من الخلايا من الطحال والرئتين. تم تصميم هذا البروتوكول للأنسجة من 2-3 الفئران لكل مجموعة; لذلك أنبوب 5 مل ينبغي أن يكفي. - استخدام ما يقرب من ثلثي الخلايا الإجمالية لعزل ILC2 وفقا لبروتوكول التخصيب ILC2.
- أضف كوكتيل الأجسام المضادة (50 ميكرولتر/مل) إلى تعليق الخلية وحضانة لمدة 5 دقائق في RT.
- دوامة المجالات السريعة لمدة 30 ثانية وإضافة إلى العينة بمعدل 75 درجة مئوية / مل من تعليق الخلية. يُمزج المزيج برفق ويُحضن لمدة 5 دقائق في RT.
- أعلى الأنبوب تصل إلى 3 مل حجم إجمالي مع فصل العازلة ومكان في 8 غرف سهلة فصل المغناطيس. حضانة لمدة 3 دقائق في RT.
- تلميح المغناطيس إلى الأمام (بعيدا عن المجمعات خلية الأجسام المضادة الكرة انضمت إلى الجزء الخلفي من الأنبوب) وماصة قبالة تعليق الخلية في أنبوب 5 مل نظيفة.
- إضافة 1.5 مل من RPMI كاملة إلى الأنابيب والطرد المركزي في 378 × ز لمدة 5 دقائق في RT.
- صب قبالة وسائل الإعلام من بيليه الخلية وإعادة تعليق ILC2 في 1 × 107 خلايا لكل مل.
- ضع 100 uL من ILC2 الذكور والإناث لكل بئر في U-أسفل، لوحة 96 جيدا وإضافة 100 درجة مئوية من ILC2 توسيع وسائل الإعلام إلى كل بئر.
- قم باحتضان الخلايا لمدة 4-5 أيام لتوسيع ILC2.
- جمع ILC2 في أنبوب 5 مل وإضافة ما يصل إلى 4.5 مل من RPMI المصل خالية. طرد مركزي الخلايا في 378 × ز لمدة 5 دقائق في RT.
- عد الخلايا باستخدام مقياس الهيماسي وتعليقه من جديد عند 1 × 107 ILC2 لكل مل في دورة في الدقيقة خالية من المصل.
- استخدم الخلايا المتبقية لإجراء عزل الخلايا CD4+ T، الذي يتم إجراؤه وفقًا لبروتوكول عزل الخلايا الماوس CD4+ T مع بعض التعديلات.
- أضف مصل الفئران (50 ميكرولتر/مل) إلى تعليق إثراء الخلايا CD4 T.
- أضف كوكتيل العزلة (50 ميكرولتر/مل) إلى العينة واحتضنه لمدة 10 دقائق في RT.
- دوامة المجالات السريعة لمدة 30 ثانية وإضافة إلى العينة بمعدل 75 درجة مئوية / مل.
- اخلطي بلطف تعليق الزنزانة وحضانة لمدة 2.5 دقيقة وRT
- أعلى العينات تصل إلى 3 مل ووضع أنابيب 5 مل في المغناطيس فصل سهلة 8 غرف وحضانة لمدة 5 دقائق في RT.
- تلميح المغناطيس إلى الأمام وماصة تعليق الخلية في أنبوب 5 مل نظيفة.
- إضافة 1.5 مل من دورة في الدقيقة خالية من المصل إلى الأنابيب والطرد المركزي في 378 × ز لمدة 5 دقائق في RT.
- صب قبالة وسائل الإعلام من بيليه الخلية وإعادة تعليق خلايا CD4+ T في 1 × 107 خلايا لكل مل في RPMI خالية من المصل.
4. تحديد التعبير CCR4 على CD4+ الخلايا T والمجموعة 2 الخلايا اللمفاوية الفطرية (ILC2) من الحيوانات التي تواجه OVA من قبل قياس التدفق
ملاحظة: يمكن تنفيذ الخطوات التالية على أعلى مقاعد البدلاء مفتوحة لأنها تقنيات غير معقمة.
-
الحصول على ما يقرب من 1-2.5 × 105 خلايا ILC2 من الخطوة 3.11.10 و 1-2.5 × 106 CD4+ T الخلايا من الخطوة 3.12.8 في أنابيب منفصلة 5 مل.
- احتفظ بأنبوب إضافي لا يقل عن 5.0 × 10خلايا CD4+ T كعنصر تحكم غير ملطخ.
- تعليق الخلايا في 100-200 درجة مئوية من المخزن المؤقت FACS وإضافة 1 μL من كتلة Fc إلى كل أنبوب، ثم احتضان على الجليد (أو في ثلاجة 4 درجة مئوية) لمدة 10 دقائق.
- أضف 1-2 مل من المخزن المؤقت FACS إلى كل أنبوب وجهاز طرد مركزي في 378 × ز لمدة 5 دقائق في RT.
- صب قبالة supernatant وإعادة تعليق الخلايا في 100-200 درجة مئوية من FACS العازلة.
- إضافة 37.5 درجة مئوية من CCR4 المضادة تلطيخ كوكتيل إلى تعليق الخلية في كل أنبوب باستثناء الأنبوب الذي يحتوي على الخلايا 'غير ملطخة'.
- احتضان الأنابيب على الجليد، أو في ثلاجة 4 درجة مئوية، لمدة 20-30 دقيقة.
- أضف 1-2 مل من المخزن المؤقت FACS إلى كل أنبوب وجهاز طرد مركزي في 378 × ز لمدة 5 دقائق في RT.
- اسكب يُمِنّي.
- كرر الخطوتين 4.7 و 4.8.
- إضافة 250-300 درجة مئوية من 1X استقرار المثبت (انظر جدول المواد)إلى كل أنبوب.
-
إعداد ضوابط حبة واحدة اللون لكل الأجسام المضادة في كوكتيل الأجسام المضادة CCR4 وفقا للبروتوكول المقدمة مع الخرز التعويض.
- دوامة الخرز التعويض.
- إضافة قطرة واحدة من الخرز إلى كل أنبوب التحكم لون واحد.
- أضف 1 ميكرولتر من كل جسم مضاد في كوكتيل الأجسام المضادة CCR4 إلى أنبوب هُم.
- يُمزج المزيج برفق ويُحضن لمدة 10 دقائق في ثلاجة بزاوية 4 درجات مئوية أو على الجليد.
- إضافة 1-2 مل من FACS العازلة إلى جميع الأنابيب والطرد المركزي في 378 × ز لمدة 5 دقائق في RT.
- صب قبالة supernatant وإعادة تعليق الخرز في 200 درجة مئوية من المخزن المؤقت FACS.
- قم بتبريد الضوابط ذات اللون الواحد حتى تكون جميع العينات ملطخة وجاهزة لتحليلها على مقياس التدفق.
- تحليل الخلايا غير الملطخة، والضوابط أحادية اللون والعينات التجريبية على مقياس التدفق في غضون 24 ساعة من التثبيت.
5. إجراء الهجرة فيفو السابق
ملاحظة: وينبغي تنفيذ الخطوات التالية في مجلس وزراء السلامة البيولوجية، لأنها تتطلب تقنية معقمة.
- الحصول على ILC2 من الخطوة 3.11.10 و CD4 T الخلايا من الخطوة 3.12.8 وتحديد عدد إدراج transwell المطلوبة للتجربة.
ملاحظة: مثال: بالنسبة لـ 1.2 مل من خلايا CD4 T المخصبة من الخطوة 3.12.8، اضرب 1.2 × 1000 ميكرولتر = 1200 ميكرولتر؛ ثم تقسيم 1200 uL على 100 μL = 12، وعدد إدراج اللازمة لCD4 T الهجرة. - نقل بلطف إدراج transwell 3 μm من الصفوف الوسطى من لوحة 24 جيدا.
- إضافة 500 درجة مئوية من وسائل الإعلام الهجرة مع CCL17 إلى ما يقرب من ثلث الآبار.
- إضافة 500 درجة مئوية من وسائل الإعلام الهجرة مع CCL22 إلى ثلث آخر من الآبار.
- إضافة 500 ميكرولتر من دورة في الدقيقة خالية من المصل لا تحتوي على chemokine إلى الثلث الأخير من الآبار.
- بوضوح تسمية الغطاء على لوحة مع وسائل الإعلام الهجرة المناسبة وضعت في الآبار السفلى.
- وضع transwell إدراج مرة أخرى في الآبار التي تحتوي على مختلف العلاجات.
- إضافة بلطف 100 درجة مئوية من خلايا CD4 T أو ILC2 إلى البئر العلوي من كل إدراج. لا تخلط أو ماصة تعليق الخلية صعودا وهبوطا في transwells، وهذا قد يخلط نتائج التجربة.
- بوضوح تسمية غطاء لوحة مع نوع الخلية وضعت في كل بئر وكتابة التاريخ والوقت من اليوم الذي تمت إضافة الخلايا.
- كرر الخطوات من 5.2 إلى 5.9 حتى يتم وضع كافة الخلايا في إدراج transwell مع الوسائط.
- وضع بلطف لوحة في حاضنة 37 درجة مئوية مع 5٪ CO2 لمدة 48 ح. تقليل الاتصال مع لوحة على مدى فترة الحضانة.
6- التحديد الكمي للهجرة فيفيفو
- قم بإزالة اللوحة بلطف من الحاضنة وإزالة جميع إدراجات transwell من الصفوف الوسطى في الآبار الفارغة فوق أو أسفل.
- جمع الخلايا من أسفل وأعلى الآبار من transwell إدراج في أنابيب المسمى مع أعلى أو أسفل، مع CCL17، CCL22، أو وسائل الإعلام، مع نوع الخلية، ومع عدد النسخ المتماثل (على الأقل 3 نسخ متماثل لكل تجربة).
- شطف الآبار السفلية مع 500 درجة مئوية من 1X PBS وجمع هذا شطف في الأنبوب المقابل.
- شطف الآبار العليا مع 250 درجة مئوية من 1X PBS وجمع هذا شطف في الأنبوب المقابل.
- بيليه الخلايا عن طريق الطرد المركزي في 378 × ز لمدة 5 دقائق في RT.
- ماصة بلطف قبالة كل supernatant من بيليه الخلية.
- إعادة تعليق الخلايا T وILC2 إلى 50 درجة مئوية من PBS 1x.
- خذ 10 ميكرولتر من تعليق الخلية وأضف إلى 90 ميكرولتر من 0.4٪ تريبان الأزرق.
-
عد الخلايا على عداد الخلية الآلي.
- تسجيل % الجدوى.
- تسجيل عدد الخلايا لكل مل لكل عينة.
- تحديد العدد الإجمالي للخلايا لكل علاج في الغرفة العليا والسفلية؛ تسجيل عدد الخلايا.
النتائج
تعبير CCR4 على خلايا CD4+ T وILC2.
لنجاح تجربة الهجرة الخارجية في الجسم الحي، لا بد من تحديد ما إذا كانت الخلايا الليمفاوية تستجيب لCCL17 و CCL22 من خلال CCR4. لذلك، حددنا التعبير CCR4 على كل من CD4+ T الخلايا وILC2 عن طريق قياس التدفق. في حين أنه من المعروف جيدا أن OVA محددة CD4+ الخلايا T المساعد التعبير عن CCR4، ومن المعروف أقل من التعبير عن CCR4 على ILC2. ويبين الشكل 1 النتائج التمثيلية للتعبير CCR4، نسبياً، على خلايا CD4+ T(الشكل 1ألف، جيم)وILC2(الشكل 1B,D)من الذكور والإناث، والذين يواجهون تحدي OVA BALB/c الفئران. تم استخدام قياس التدفق للسيتوميو للكشف عن CCR4 باستخدام جسم مضاد أحادي النسيلة مترافق مع الوفيكوسيانين (APC). باستخدام تحليل التباين في اتجاه واحد (ANOVA)، قررنا أنه لم تكن هناك اختلافات في التعبير CCR4 بين المضيفين الذكور والإناث(الشكل 1A-D)،ومع ذلك، كان التعبير عن CCR4 على أساس كل خلية (MFI) على ILC2 أعلى بالمقارنة مع CD4 + الخلايا T(الشكل 1C مقارنة مع الشكل 1D). هذه النتائج مهمة في إظهار أن خلايا ILC2 و CD4+ T يجب أن تستجيب CCL17 و CCL22 في التجربة التالية.
استجابة خلايا CD4+ T إلى الأربطة CCR4 في الغرف العلوية والسفلية لنظام الهجرة.
تم عزل خلايا CD4+ T من الذكور، والفئران BALB/c التي تواجه هافة من الرئتين والطحال ووضعها في الغرفة العليا لجهاز الهجرة العابرة مفصولة بغشاء مسامي 3 ميكرومتر(الشكل 2). ويرد ملخص لإعداد الفئران المعالجة بـ OVA في الجسم الحي(الشكل 2A)وإجراء الهجرة العابرة(الشكل 2B)للرجوع إليها. تم وضع مزيج من CCL17 (25 نانوغرام/مل) و CCL22 (25 نانوغرام/مل) في الغرفة العليا أو الغرفة السفلية أو كل من الغرف العلوية والسفلية لتأكيد(الشكل 2C)و(1) أن خلايا CD4+ T من الحيوانات التي تواجه تحدي OVA كانت تستجيب لCCR4 الأربطة، و (2) أن الهجرة الناجمة عن chemokine كانت عملية نشطة من خلالها كانت الخلايا T تتحرك من خلال المسام استجابة للتدرج chemokine، وأن الخلايا الليمفاوية لم تكن تتحرك من خلال المسام مستقلة عن chemokine. تم تضمين وسائل الإعلام (لا Chemokine) السيطرة لإظهار أن CD4+ T الخلايا لا يمكن أن تهاجر من خلال المسام 3 μM دون تحفيز. في هذه الحالة، ظلت أعلى نسبة مئوية من الخلايا في الغرفة العليا. عندما وضعت chemokines في الغرفة العليا والسفلية في وقت واحد، اكتشفنا 52٪ من مجموع الخلايا T في الغرفة السفلى و 48٪ من الخلايا في الغرفة العليا (أعلى / أسفل العلاج). كما هو متوقع، انتقل توزيع الخلايا استجابة لchemokine وضعت فقط في أعلى أو فقط في الغرفة السفلى، كما اكتشفنا أعلى نسبة مئوية من الخلايا في المقصورة حيث كان موجودا chemokine.
استجابة خلايا CD4+ T وILC2 إلى CCL17 و CCL22 في جهاز الهجرة من الجسم الحي السابق.
تم عزل خلايا CD4 T وILC2 من الذكور والإناث، والفئران التي تواجه تحدي OVA من الرئتين والطحال ثم وضعت في الغرفة العليا لجهاز الهجرة عبر الآبار(الشكل 3). تمتلئ الغرفة السفلية من الجهاز مع وسائل الإعلام ثقافة الخلية غير المعالجة، وسائل الإعلام التي تحتوي على CCL17، أو وسائل الإعلام التي تحتوي على CCL22. وتظهر النتائج التمثيلية أن أقل من 14٪ (13.37 + 6.5٪) من الخلايا التي تم ترحيلها في ظروف التحكم في الوسائط(الشكل 3A-D). ردا على CCL22، كل من أنواع الخلايا، بغض النظر عما إذا كانت من المضيفين الذكور أو الإناث، وردت على CCL22(الشكل 3A-D)،ومع ذلك، كانت النتائج لCCL17 أقل اتساقا. CCL17 تسبب فقط هجرة كبيرة لخلايا CD4 T الإناث وILC2 بالمقارنة مع وسائل الإعلام وحدها(الشكل 3C,D). لم يكن العلاج CCL17 مختلفاً عن وسائل الإعلام للذكور CD4+ T الخلايا أو الذكور ILC2(الشكل 3A, B),وCCL22 الناجمة عن هجرة أكبر من CCL17 في ILC2 الذكور(الشكل 2B).
نتائج الهجرة دون الأمثل لخلايا CD4+ T ذات القدرة على البقاء منخفضة.
وقد تم توليد نتائج دون المستوى الأمثل لتزويد الباحث مثالا ً على ما يمكن توقعه عندما لا تعمل تجربة الهجرة العابرة بشكل صحيح (الشكل 4). نحن عزلت الذكور CD4+ T الخلايا من الحيوانات وفقا لهذا البروتوكول ووضعها في البئر العليا من نظام الهجرة. بعد إضافة خلايا CD4+ T، ومع ذلك، ظلت اللوحة في درجة حرارة الغرفة لأول 24 ساعة، ثم تم نقل لوحة في الحاضنة لل24 ساعة المتبقية من فترة الحضانة. ليس من المستغرب، لم نكتشف أي هجرة نحو CCL17 و CCL22(الشكل 4A)وكانت صلاحية الخلايا منخفضة بشكل ملحوظ (<15٪) للخلايا في الجزء العلوي(الشكل 4B). وتبرز هذه النتائج المعيبة أهمية استخدام درجات الحرارة والشروط الصحيحة المفصلة في هذا البروتوكول لتحقيق أفضل النتائج.
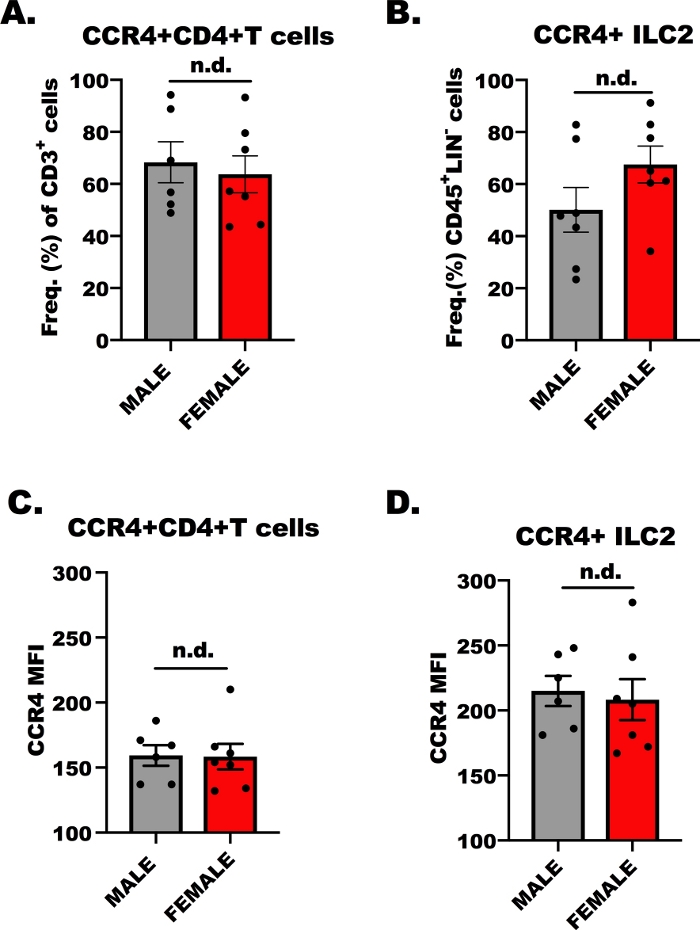
الشكل 1: تعبير CCR4 على CD4+ خلايا T وILC2. 7 إلى 9 أسابيع من العمر، ذكرا وأنثى، تم حقن الفئران BALB / ج مرة واحدة مع 100 ميكرولتر من OVA-adsorbed إلى هيدروكسيد الألومنيوم (500 ميكروغرام / مل؛ OVA و 20 ملغ / مل هيدروكسيد الألومنيوم) 7 أيام قبل الأول من 5، المتكررة، والتحديات مجرى الهواء اليومي مع 1.5٪ OVA في المالحة. تم قتل الحيوانات التي تواجه مسببات الحساسية بشكل إنساني، وتم جمع أنسجة الرئة والطحال لعزل خلايا ILC2 وCD4+ T. ثم تم تلوين aliquot صغيرة من الخلايا وتحليلها عن طريق قياس التدفق الخلوي لتحديد مستوى CCR4 على كل نوع الخلية. (أ)تردد خلايا CD4+ T التي هي CCR4+ من فئران OVA +، حيث تمثل أشرطة الخطأ الخطأ القياسي للمتوسط (+ SEM). (B)تردد ILC2 التي كانت CCR4+ (+SEM). (C, D) متوسط كثافة الفلورة (+SEM) من CCR4 على(C)CD4 + T الخلايا و(D)ILC2. وقد استخدم ما مجموعه 13 فأرا لتوليد هذه البيانات، وتكررت تجربة التدفق مرتين، مع 3 نسخ من كل علاج لكل تجربة. تم تحديد الأهمية من قبل ANOVA في اتجاه واحد؛ يشير إلى عدم وجود اختلافات بين المجموعات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: استجابة خلايا CD4+ T إلى الأربطة CCR4 في الغرف العلوية والسفلية لنظام الهجرة. تم عزل الفئران الذكور BALB / ج وتحديها مع ovalbumin بيض الدجاج (OVA) وCD4 + T الخلايا من الطحال والرئتين(A، B). لهذه التجربة الهجرة، تم تعليق خلايا CD4+ T في وسائل الإعلام خالية من المصل في 1 × 107 خلايا / مل. وأضيف تكل 17 وCCL22 إلى وسائط الإعلام الخالية من المصل بتركيز قدره 50 نانوغرام/مل (25 نانوغرام/مل من كل شيوكيكين لتحقيق ما مجموعه 50 نانوغرام/مل). تمت إضافة وسائل الإعلام التي تحتوي على Chemokine إلى الغرفة العليا فقط، إلى الغرفة السفلية فقط، أو إلى كل من الغرف العليا والسفلية. وأضيف ما مجموعه 500 درجة مئوية من وسائط الهجرة إلى الآبار السفلى وأضيف 100 درجة مئوية من التعليق الخلوي (1 x 106 6 خلايا/بئر) إلى أعلى بئر. تم قياس الهجرة بعد 48 ساعة في الثقافة(C). وقد تم توليد هذه البيانات من تجربة واحدة، واستخدمت 3 فئران من الذكور المعالجة بأوفا لجمع الأنسجة، و3 نسخ اتُكب لكل علاج. وقد تم تحديد الأهمية الإحصائية من قبل ANOVA في اتجاه واحد؛ *p < 0.05. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
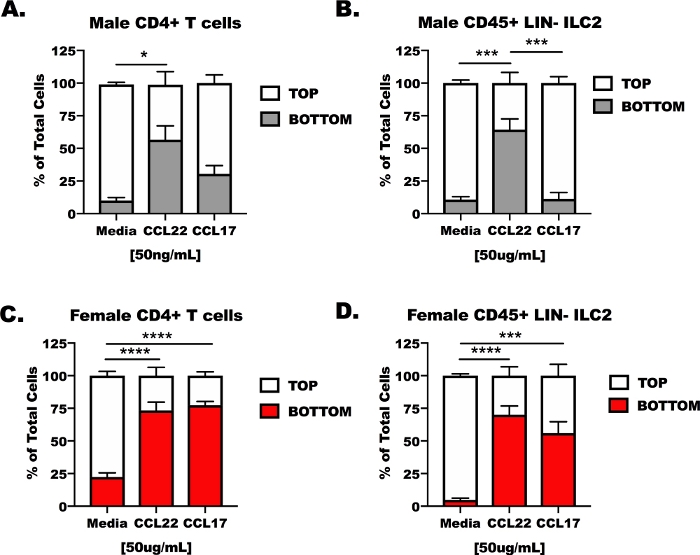
الشكل 3: استجابة خلايا CD4+ T وILC2 إلى CCL17 وCCL22 في جهاز هجرة الجسم الحي السابق. تم إعداد الفئران كما هو الحال في الشكل 1 لCD4+ T الخلية وILC2 العزلة من الطحال والرئتين. تم تعليق خلايا CD4+ T وILC2 في وسائط خالية من المصل في 1 × 107 خلايا /مل. تمت إضافة CCL17 أو CCL22 إلى وسائل الإعلام الخالية من المصل بتركيز 50 نانوغرام/مل. تمت إضافة 500 درجة مئوية من وسائل الإعلام عبر الهجرة إلى الآبار السفلية وأضيف 100 ميكرولتر من التعليق الخلوي (1 × 106 6 خلايا / جيدا) إلى أعلى بئر. تم قياس الهجرة إلى الخارج بعد 48 ساعة في الثقافة. (A)CD4+ T الخلايا و (B) تم التعامل مع ILC2 من المضيفين الذكور مع وسائل الإعلام كتحكم، CCL17، أو CCL22. وبالمثل ،(C)الإناث CD4+ T الخلايا و (D) تم التعامل مع ILC2 الإناث مع وسائل الإعلام ، CCL17 ، أو CCL22. وقد استخدم ما مجموعه 14 فأرا لتوليد هذه البيانات. تكررت تجربة الهجرة العابرة 4 مرات، مع تكرار 3-6 من كل علاج لكل تجربة. تم تحديد الأهمية من قبل ANOVA في اتجاه واحد؛ *p < 0.05, ***p < 0.001, ****p < 0.0001. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: نتائج الهجرة دون المثلى لخلايا CD4 T ذات القدرة على البقاء المنخفضة. تم الحصول على الفئران BALB/c الذكور السذاجة لجمع أنسجة الرئة والطحال وCD4+ T عزل الخلية كما هو الحال في الشكل 1، الشكل 2، والشكل 3. تمت إضافة خلايا CD4 T إلى الغرفة العليا لجهاز الهجرة العابرة ووسائط خالية من المصل تحتوي على CCL17 أو CCL22 أو لا chemokine (التحكم في وسائل الإعلام) تمت إضافتها إلى أسفل البئر. لأول 24 ساعة من التجربة تركت لوحة في درجة حرارة الغرفة، ثم تم نقلها إلى حاضنة 37 درجة مئوية مع 5٪ CO2 لمدة 24 ساعة إضافية(أ)النسبة المئوية للخلايا المتبقية في أعلى وأسفل الآبار بعد 24 ساعة (ب) جدوى C D4 + T الخلايا في الغرفة العليا والسفلية بعد ظروف الحضانة السيئة. وقد تم توليد هذه البيانات من تجربة واحدة، واستخدمت 3 فئران ذكر ساذجة لجمع الأنسجة، و3 نسخ في كل علاج. ولم تحدد الأهمية الإحصائية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا، نقدم طريقة راسخة لتقييم الهجرة الناجمة عن chemokine من الخلايا الليمفاوية في نظام الهجرة في الجسم الحي السابق. هناك عدة خطوات حاسمة في البروتوكول، أولها التحقق من التعبير عن مستقبلات chemokine الصحيح على الخلايا المناعية في التجربة. في أيدينا، اخترنا CCR4 بسبب الجسم من الأدب الذي يسلط الضوء على أهمية CCR4 على الخلايا T المساعد Th2 في التهاب الحساسية. وقد تبين في السابق التهاب Ovalbumin الناجمة عن أن تكون محدودة من قبل اثنين على الأقل من مضادات CCR424,25; ومع ذلك، كان هذا قبل اكتشاف المجموعة 2 الخلايا اللمفاوية الفطرية (ILC2)26،27. قمنا بإنشاء بيانات جديدة تبين أن خلايا ILC2 تعبر عن CCR4 أعلى من خلايا CD4+ T وأظهرت أن هذه الخلايا كانت تستجيب باستمرار لCCL22.
والخطوة الحاسمة الثانية التي ينبغي اتباعها في البروتوكول هي ضمان الاحتفاظ بالخلايا في الوسط الأمثل للثقافة قبل بدء الجزء المتعلق بالهجرة العابرة من البروتوكول. في حالة ILC2، كان علينا أن ثقافة هذه الخلايا في ILC2 توسيع الوسائط التي تحتوي على كل من IL-2 و IL-33. يتم الإبلاغ عن IL-2 و IL-7 في المؤلفات لدعم ILC2 في الثقافة لمدة تصل إلى 14 يوما28،29. إذا أصبحت الصلاحية مشكلة لخلايا CD4+ T وILC2 في التجارب المستقبلية، فإن إضافة IL-2 أو IL-7 من المرجح أن تحسن بقاء الخلايا الليمفاوية حتى نقطة النهاية للتجربة. تم تعريف كل من وسائل الإعلام المعروضة هنا على مدى عدة تجارب وتم تحسينها للاستخدام في هذا البروتوكول14،30،31. في الشكل 4،قدمنا نتائج خاطئة لإثبات أهمية استخدام حاضنة مع درجة حرارة مناسبة و 5٪ CO2. إن الاحتفاظ بلوحات الهجرة العابرة في الحاضنة حيث لن يتم إزعاجها هو خطوة حاسمة أخرى لنجاح البروتوكول.
كما ذكر سابقا، هناك مزايا لاستخدام الفحص المجهري في الجسم الحي المتاحة في معظم المؤسسات، ومع ذلك، في التصوير الجسم الحي يمكن أن تستغرق وقتا طويلا ومكلفة. إجراء تجريبي بديل أقل تكلفة يستخدم microfluidics في تركيبة مع التدرجات chemokine لفهم الاغتراب الكريات البيض وهجرة الأنسجة32،33،34. هذه النظم لها قيمة علمية لأنها تقيم تعقيدات حركية الخلية التي تنطوي على الخلايا البطانية، والتي يمكن زراعتها على الشعيرات الدموية للأنظمة microfluidic. وعلاوة على ذلك، فإن هذه النظم الدقيقة السوائل تقييم أهمية البروتينات الالتزام (على سبيل المثال، E-الكادرين) على الخلايا البطانية وintegrins على الخلايا المناعية في عملية الالتزام الخلية تحت تدفق الدم. ومع ذلك، تتطلب هذه النظم معدات متخصصة وبرمجة وإحصاءات حسابية معقدة لتحديد أهمية كل حالة من شروط العلاج. ولذلك، على الرغم من أن الحد من طريقة الهجرة العابرة المعروضة هنا هو أنها مصطنعة في طبيعتها، فإنه يمكن استخدامها كأداة فحص هامة للحد من هدر الكواشف غير الضرورية في الأساليب اللاحقة في الجسم الحي. أهمية هذه الطريقة هي أنه كما يتم اكتشاف خلايا جديدة، كما هو الحال بالنسبة لILC2، يمكننا فحص هذه الخلايا لاستجابتها لchemokines المعروفة. هذا هو واحد من التطبيقات المستقبلية التي تنطوي على ILC2 والعلاجات المحتملة التي قد تمنع هجرتهم إلى الرئتين أثناء تفاقم الربو. سيتم استخدام بروتوكول الهجرة هذا لفحص مثبطات مختلفة يمكن استخدامها للحد من CCR4 أو غيرها من الوسطاء التركيب الكيميائي المشاركين في تجنيد ILC2. وإجمالاً، سيؤدي بروتوكول الهجرة إلى الخارج إلى توليد بيانات هامة يمكن التحقق منها في المستقبل في تجارب الجسم الحي.
Disclosures
وليس لدى أصحاب البلاغ أي إقرارات مالية أو تضارب في المصالح للكشف عنها.
Acknowledgements
تم تمويل هذا العمل من قبل جمعية الرئة الأمريكية (K.J.W.)، وصندوق يوجين كيني التذكاري الذي منح لT.A.W. وK.J.W.، والدعم السخي لبدء من جامعة يوتا لK.J.W.، وجائزة وزارة شؤون المحاربين القدماء إلى T.A.W. (VA I01BX0003635). T.A.W. هو حاصل على جائزة عالم مهنة البحوث (IK6 BX003781) من وزارة شؤون المحاربين القدماء. ويود صاحبا البلاغ أن ينوه بالمساعدة التحريرية التي تقدمها السيدة ليزا تشودوميلكا. ويشكر المؤلفون نواة قياس التدفق في اللجنة على دعمهم في جمع بيانات قياس التدفق السيتومتري ة التي تم إنشاؤها لهذه المخطوطة.
Materials
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Sigma-Aldrich | 15250061 | |
| 1 mL syringe | BD Bioscience | 329424 | U-100 Syringes Micro-Fine 28 G 1/2" 1cc |
| 100x Penicillin-Streptomycin, L-Glutamine | Gibco | 10378-016 | Dilute to 1x in RPMI media |
| 15 mL conical tubes | Olympus Plastics | 28-101 | polypropylene tubes |
| 3 μm transwell inserts | Genesee Scientific | 25-288 | 24-well plate containing 12 transwell inserts |
| 3x stabilizing fixative | BD Pharmigen | 338036 | Prepare 1x solution according to manufacturers protocol |
| 5 mL polystyrene tubes | STEM Cell Technologies | 38007 | |
| 50 mL conical tubes | Olympus Plastics | 28-106 | polypropylene tubes |
| 8-chamber easy separation magnet | STEM Cell Technologies | 18103 | |
| ACK Lysing Buffer | Life Technologies Corporation | A1049201 | |
| Advanced cell strainer, 40 μm | Genesee Scientific | 25-375 | nylon mesh, 40 μm strainers |
| Aluminum Hydroxide, Reagent Grade | Sigma-Aldrich | 239186-25G | 20 mg/mL |
| anti-mouse CCR4; APC-conjugated | Biolegend | 131211 | 0.5 μg/test |
| anti-mouse CD11b | BD Pharmigen | 557396 | 0.5 μg/test |
| anti-mouse CD11c; PE eFluor 610 | Thermo-Fischer Scientific | 61-0114-82 | 0.25 μg/test |
| anti-mouse CD16/32, Fc block | BD Pharmigen | 553141 | 0.5 μg/test |
| anti-mouse CD19; APC-eFluor 780 conjugated | Thermo-Fischer Scientific | 47-0193-82 | 0.5 μg/test |
| anti-mouse CD3; PE Cy 7-conjugated | BD Pharmigen | 552774 | 0.25 μg/test |
| anti-mouse CD45; PE conjugated | BD Pharmigen | 56087 | 0.5 μg/test |
| anti-mouse ICOS (CD278) | BD Pharmigen | 564070 | 0.5 μg/test |
| anti-mouse NK1.1 (CD161); FITC-conjugated | BD Pharmigen | 553164 | 0.25 μg/test |
| anti-mouse ST2 (IL-33R); PerCP Cy5.5 conjugated | Biolegend | 145311 | 0.5 μg/test |
| Automated Cell Counter | BIORAD | 1450102 | |
| Automated Dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| Bovine Serum Albumin, Lyophilized Powder | Sigma-Aldrich | A2153-10G | 0.5% in serum-free RPMI |
| Cell Counter Clides | BIORAD | 1450015 | |
| Chicken Egg Ovalbumin, Grade V | Sigma-Aldrich | A5503-10G | 500 μg/mL |
| Collagenase, Type 1, Filtered | Worthington Biochemical Corporation | CLSS-1, purchase as 5 X 50 mg vials (LS004216) | 25 U/mL in RPMI |
| Compensation beads | Affymetrix | 01-1111-41 | 1 drop per contol tube |
| Dissociation Tubes | MACS Miltenyi Biotec | 130-096-335 | |
| FACS Buffer | BD Pharmigen | 554657 | 1x PBS + 2% FBS, w/ sodium azide; stored at 4 °C |
| Heat Inactivated-FBS | Genesee Scientific | 25-525H | 10% in complete RPMI & ILC2 Expansion Media |
| Mouse CCL17 | GenScript | Z02954-20 | 50 ng/mL |
| Mouse CCL22 | GenScript | Z02856-20 | 50 ng/mL |
| Mouse CD4+ T cell enrichment kit | STEM Cell Technologies | 19852 | |
| Mouse IL-2 | GenScript | Z02764-20 | 20 ng/mL |
| Mouse ILC2 enrichment kit | STEM Cell Technologies | 19842 | |
| Mouse recombinant IL-33 | STEM Cell Technologies | 78044 | 20 ng/mL |
| RPMI | Life Technologies Corporation | 22400071 | |
| Separation Buffer | STEM Cell Technologies | 20144 | 1x PBS + 2% FBS; stored at 4 °C |
| Small animal nebulizer and chamber | Data Sciences International | ||
| Sterile saline | Baxter | 2F7124; NDC 0338-0048-04 | 0.9% Sodium Chloride |
References
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Moser, B. Editorial: History of Chemoattractant Research. Frontiers in Immunology. 6, 548 (2015).
- Borroni, E. M., Savino, B., Bonecchi, R., Locati, M. Chemokines sound the alarmin: The role of atypical chemokine in inflammation and cancer. Seminars in Immunology. 38, 63-71 (2018).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. The New England Journal of Medicine. 354 (6), 610-621 (2006).
- Abboud, D., Hanson, J. Chemokine neutralization as an innovative therapeutic strategy for atopic dermatitis. Drug Discovery Today. 22 (4), 702-711 (2017).
- Aldinucci, D., Casagrande, N. Inhibition of the CCL5/CCR5 Axis against the Progression of Gastric Cancer. International Journal of Molecular Sciences. 19 (5), E1477 (2018).
- Chonco, L., et al. Novel DNA Aptamers Against CCL21 Protein: Characterization and Biomedical Applications for Targeted Drug Delivery to T Cell-Rich Zones. Nucleic Acid Therapy. 28 (4), 242-251 (2018).
- Trivedi, P. J., Adams, D. H. Chemokines and Chemokine Receptors as Therapeutic Targets in Inflammatory Bowel Disease; Pitfalls and Promise. Journal of Crohn's and Colitis. 12 (12), 1508 (2018).
- Pietrosimone, K. M., Bhandari, S., Lemieux, M. G., Knecht, D. A., Lynes, M. A. In vitro assays of chemotaxis as a window into mechanisms of toxicant-induced immunomodulation. Current Protocols in Toxicology. 58 (Unit 18.17), (2013).
- Davis, D. M. How studying the immune system leads us to new medicines. Lancet. 391 (10136), 2205-2206 (2018).
- Culley, F. J., Pennycook, A. M., Tregoning, J. S., Hussell, T., Openshaw, P. J. Differential chemokine expression following respiratory virus infection reflects Th1- or Th2-biased immunopathology. Journal of Virology. 80 (9), 4521-4527 (2006).
- Denney, H., Clench, M. R., Woodroofe, M. N. Cleavage of chemokines CCL2 and CXCL10 by matrix metalloproteinases-2 and -9: implications for chemotaxis. Biochemical and Biophysics Research Communications. 382 (2), 341-347 (2009).
- Burrell, B. E., et al. Lymph Node Stromal Fiber ER-TR7 Modulates CD4+ T Cell Lymph Node Trafficking and Transplant Tolerance. Transplantation. 99 (6), 1119-1125 (2015).
- Warren, K. J., Iwami, D., Harris, D. G., Bromberg, J. S., Burrell, B. E. Laminins affect T cell trafficking and allograft fate. The Journal of Clinical Investigation. 124 (5), 2204-2218 (2014).
- Hirata, H., et al. Th2 cell differentiation from naive CD4(+) T cells is enhanced by autocrine CC chemokines in atopic diseases. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. , (2018).
- Lin, R., Choi, Y. H., Zidar, D. A., Walker, J. K. L. beta-Arrestin-2-Dependent Signaling Promotes CCR4-mediated Chemotaxis of Murine T-Helper Type 2 Cells. American Journal of Respiratory Cell and Molecular Biology. 58 (6), 745-755 (2018).
- Zhang, Y., et al. A new antagonist for CCR4 attenuates allergic lung inflammation in a mouse model of asthma. Science Reports. 7 (1), 15038 (2017).
- Lu, Y., et al. Dynamics of helper CD4 T cells during acute and stable allergic asthma. Mucosal Immunology. 11 (6), 1640-1652 (2018).
- Li, B. W. S., Beerens, D., Brem, M. D., Hendriks, R. W. Characterization of Group 2 Innate Lymphoid Cells in Allergic Airway Inflammation Models in the Mouse. Methods in Molecular Biology. 1559, 169-183 (2017).
- Li, B. W. S., et al. Group 2 Innate Lymphoid Cells Exhibit a Dynamic Phenotype in Allergic Airway Inflammation. Frontiers in Immunology. 8, 1684 (2017).
- Warren, K. J., et al. Sex differences in activation of lung-related type-2 innate lymphoid cells in experimental asthma. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. , (2016).
- Warren, K. J., et al. Ovalbumin-sensitized mice have altered airway inflammation to agriculture organic dust. Respiratory Research. 20 (1), 51 (2019).
- Poole, J. A., et al. alphabeta T cells and a mixed Th1/Th17 response are important in organic dust-induced airway disease. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. 109 (4), 266-273 (2012).
- Matsuo, K., et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomedical Pharmacotherapy. 109, 1437-1444 (2019).
- Mikhak, Z., et al. Contribution of CCR4 and CCR8 to antigen-specific T(H)2 cell trafficking in allergic pulmonary inflammation. The Journal of Allergy and Clinical Immunology. 123 (1), 67-73 (2009).
- Monticelli, L. A., et al. Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nature Immunology. 12 (11), 1045-1054 (2011).
- Saenz, S. A., et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 464 (7293), 1362-1366 (2010).
- Hoyler, T., et al. The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity. 37 (4), 634-648 (2012).
- Nakajima, H., Shores, E. W., Noguchi, M., Leonard, W. J. The common cytokine receptor gamma chain plays an essential role in regulating lymphoid homeostasis. The Journal of Experimental Medicine. 185 (2), 189-195 (1997).
- Warren, K. J., et al. RSV-specific anti-viral immunity is disrupted by chronic ethanol consumption. Alcohol. , (2016).
- Warren, K. J., Poole, J. A., Sweeter, J. M., DeVasure, J. M., Wyatt, T. A. An association between MMP-9 and impaired T cell migration in ethanol-fed BALB/c mice infected with Respiratory Syncytial Virus-2A. Alcohol. , (2018).
- Molteni, R., et al. A novel device to concurrently assess leukocyte extravasation and interstitial migration within a defined 3D environment. Lab on a Chip. 15 (1), 195-207 (2015).
- Bersini, S., et al. Human in vitro 3D co-culture model to engineer vascularized bone-mimicking tissues combining computational tools and statistical experimental approach. Biomaterials. 76, 157-172 (2016).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved