Method Article
Valutazione della migrazione dei linfociti in un sistema di trasmigrazione Ex Vivo
In questo articolo
Riepilogo
In questo protocollo, i linfociti sono collocati nella camera superiore di un sistema di trasmigrazione, separato dalla camera inferiore da una membrana porosa. La chemiochina viene aggiunta alla camera inferiore, che induce una migrazione attiva lungo un gradiente di chemiochina. Dopo 48 h, i linfociti vengono contati in entrambe le camere per quantificare la trasmigrazione.
Abstract
Qui, presentiamo un metodo efficiente che può essere eseguito con competenze di laboratorio di base e materiali per valutare il movimento chemiocitico linfocitico in un sistema di trasmigrazione ex vivo. Le cellule linfoidi innate di gruppo 2 (ILC2) e le cellule helper T CD4- Le cellule helper T sono state isolate dalla milza e dai polmoni di topi BALB/c sfidati da uovo di gallina . Abbiamo confermato l'espressione di CCR4 su entrambe le cellule CD4- T e ILC2, comparativamente. CCL17 e CCL22 sono i ligandi noti per CCR4; quindi, utilizzando questo metodo di trasmigrazione ex vivo abbiamo esaminato il movimento clatuano 17- e il movimento indotto da CCL22 dei linfociti. Per stabilire i gradienti di chemiochina, CCL17 e CCL22 sono stati collocati nella camera inferiore del sistema di trasmigrazione. I linfociti isolati sono stati poi aggiunti alle camere superiori e in un periodo di 48 ore i linfociti sono migrati attivamente attraverso 3 pori di m verso la chemiochina nella camera inferiore. Si tratta di un sistema efficace per determinare la chemiocineticidei dei linfociti, ma, comprensibilmente, non imita le complessità che si trovano nei microambienti di organi in vivo. Questa è una limitazione del metodo che può essere superata con l'aggiunta di imaging in situ dell'organo e dei linfociti in fase di studio. Al contrario, il vantaggio di questo metodo è che può essere eseguito da un tecnico entry-level ad un tasso molto più conveniente rispetto all'imaging dal vivo. Man mano che i composti terapeutici diventano disponibili per migliorare la migrazione, come nel caso dell'infiltrazione del tumore delle cellule immunitarie citotossiche, o per inibire la migrazione, forse nel caso di malattie autoimmuni in cui l'immunopatologia è preoccupante, questo metodo può essere utilizzato come strumento di screening. In generale, il metodo è efficace se la chemiochina di interesse genera costantemente chemiocinetici ad un livello statisticamente superiore rispetto al controllo multimediale. In questi casi, il grado di inibizione/miglioramento da un dato composto può essere determinato pure.
Introduzione
Questo metodo di trasmigrazione originale è stato presentato da Stephen Boyden nel 1962 nel Journal of Experimental Medicine1. Gran parte di ciò che sappiamo sulla chemiotassia e sulla chemiocinetia non sarebbe possibile senza lo sviluppo della camera di Boyden. Prima della scoperta della prima chemiochina nel 1977, i sistemi di trasmigrazione ex vivo sono stati utilizzati per conoscere i fattori del siero che potrebbero arrestare il movimento cellulare nei macrofagi amplificando la motilità cellulare nei neutrofili1,2. Una massiccia ricchezza di conoscenze è stata sviluppata per quanto riguarda la migrazione delle cellule immunitarie, e ad oggi, 47 chemiochine sono state scoperte con 19 recettori corrispondenti3,4. Inoltre, moltitudini di inibitori/miglioratori di queste vie chemiochine hanno subito lo sviluppo per scopi terapeutici5,6,7,8. Molti di questi composti sono stati testati in camere di trasmigrazione simili per comprendere le interazioni dirette tra i composti e la reattività delle cellule immunitarie a una data chemiochina9.
La trasmigrazione, o diapedesi, nel tessuto infiammato è un processo essenziale per una risposta infiammatoria sana alla chiara infezione10,11. Una camera Boyden, un sistema di trasmigrazione o un apparato transwell sono generalmente composti da due camere separate da una membrana porosa1,12. La camera inferiore contiene più spesso supporti contenenti la chemiochina di interesse, mentre i leucociti sono collocati nella camera superiore. La dimensione del poro nella membrana può essere selezionata in base alle dimensioni della cella di interesse. Per questo progetto, abbiamo selezionato una membrana porosa di 3 m, poiché le cellule linfoidi hanno una dimensione di 7-20 m, a seconda dello stadio di sviluppo cellulare. Questa dimensione dei pori assicura che queste cellule non cadono passivamente attraverso i pori, ma che stanno migrando attivamente in risposta al gradiente della chemiochina.
Il principale vantaggio di questo protocollo è la sua efficacia in termini di costi. La trasmigrazione in vivo è difficile perché richiede un'ampia formazione nella manipolazione e nella chirurgia degli animali, e spesso coinvolge microscopia ad alta potenza che non è sempre disponibile per un ricercatore. Lo screening economico dei composti pensati per migliorare o inibire la trasmigrazione può essere realizzato prima dell'imaging in vivo. Poiché il sistema di trasmigrazione è strettamente controllato, le cellule possono essere trattate inizialmente e poi aggiunte all'apparato transwell, o, viceversa, la chemiochina può essere trattata prima con un inibitore della chemiochina e poi le cellule aggiunte all'apparato transwell. Infine, le cellule endoteliali e/o le proteine della membrana sotterranea possono essere aggiunte sul fondo dell'inserto transwell 1-2 giorni prima dell'esperimento di trasmigrazione per comprendere il coinvolgimento di queste cellule barrierative nella chemiocinetica. Ancora una volta, queste manipolazioni del sistema forniscono un potente mezzo per determinare importanti informazioni sull'efficacia di un dato composto prima di studi in vivo più complicati.
L'utilizzo di un sistema camera di trasmigrazione è un modo efficace per valutare la mobilità dei linfociti in varie condizioni in vivo e in vitro12,13,14. Qui, descriviamo un metodo ottimizzato per valutare la reattività dei linfociti ex vivo alle chemiochine in una camera di trasmigrazione. In questo esperimento di esempio, CD4- cellule T e cellule linfoidi innate di gruppo 2 (ILC2) sono state isolate dai topi maschi e femmine, BALB/c in seguito all'esposizione all'OVA-allergene. È stata generata un'ipotesi che CCR4- CD45- Lineage- (LIN-) ILC2 da topi con problemi di allergene migrerebbe in modo più efficiente verso CCL17 e CCL22 rispetto alle cellule helper CCR4 - CD4- T. CCL17 e CCL22 sono chemiochine comunemente prodotte da cellule dendritiche e macrofagi del fenotipo M2 (allergico), tra le altre cellule, nell'allergia15,16. CCL17 e CCL22 possono essere considerati come biomarcatori di infiammazione allergica in quanto sono prontamente rilevati nei polmoni durante le esacerbazioni delle vieaeree 16,17,18. È importante sottolineare che l'espressione di CCR4 è elevata rispetto ai controlli non trattati, come rivelato nei dati bioinformatici generati da ILC2 isolati da animali trattati con acari della polvere domestica, e allo stesso modo ILC2 da animali ingenui trattati ex vivo con IL-33 ( citochina innata che promuove gli allergeni) aumenta la regolazione CCR419,20. Inoltre, secondo i dati relativi all'ILC2 nel database del progetto immunologico del genoma (www.immgen.org), l'mRNA CCR4 è altamente espresso in queste cellule immunitarie innate. Ad oggi, poco è noto per quanto riguarda il traffico di ILC2 in tessuti, ma è probabile che le cellule ILC2 e CD4- T utilizzano chemiochine e recettori simili per chemiotassi e chemiocinetiche in quanto esprimono fattori e recettori di trascrizione simili. Così, abbiamo confrontato CCL17 e CCL22 reattività, di ILC2 e CD4- linfociti T, da entrambi gli animali maschi e femmine, OVA-sfidato.
Protocollo
Tutti i metodi qui descritti sono stati esaminati e approvati dai Comitati istituzionali per la cura e l'uso degli animali presso l'University of Nebraska Medical Center (UNMC) e l'Università dello Utah.
1. Configurazione e preparazione dei reagenti
-
Preparare i media RPMI (Roswell Park Memorial Institute).
- Aggiungere 10 mL di siero bovino fetale inattivato dal calore (FBS) a 90 mL di RPMI.
- Aggiungere 1 mL di 100x Penicillin-Streptomycin-Glutamine a 100 mL di 10% FBS RPMI.
-
Preparare il supporto di espansione ILC2.
- Aggiungere IL-2 e IL-33 (20 ng/mL ogni citochina) a 10 mL di RPMI completo.
- Se le citochine di riserva sono pari a 10 g/mL, la pipetta 20 di IL-2 e IL-33 in un tubo da 15 mL contenente 10 mL di supporti RPMI completi.
-
Preparare dissociazione polmonare medio.
- Aggiungere 50 mg di tipo 1 collagenasi a 250 mL di RPMI senza supplemento.
- Aggiungere 2,5 mL di 100x penicillina-streptomycin-glutamine a250 mL di supporto al punto 1.3.1.
- Mescolare delicatamente il supporto per garantire che il Collagenasi di tipo 1 sia completamente sciolto prima dell'uso.
-
Preparare RPMI senza siero.
- Diluire 1 g di albumina di siero bovino liofilizzato (BSA) in 200 mL di RPMI.
- Aggiungere 2 mL di 100x penicillina-streptomycin-glutamina.
- Mescolare delicatamente il supporto per garantire che la BSA sia completamente dissolta nel supporto prima dell'uso.
-
Preparare migration Medium con CCL17.
- Acquisire 10 mL di RPMI senza siero e aggiungere CCL17 [50 ng/mL].
- Se lo stock CCL17 è pari a 10 g/mL, aggiungere 50 luna di stock CCL17 a 10 mL di supporti RPMI senza siero.
- Acquisire 10 mL di RPMI senza siero e aggiungere CCL17 [50 ng/mL].
-
Preparare migration Medium con CCL22.
- Acquisire 10 mL di RPMI senza siero e aggiungere CCL22 [50 ng/mL].
- Se lo stock CCL22 è pari a 10 g/mL, aggiungere 50 luna di stock CCL22 a 10 mL di supporti RPMI senza siero.
-
Preparare CCR4 Antibody Coloring Cocktail.
- Per 10 test in totale, aggiungere 5 luna di ciascuno dei seguenti anticorpi a un tubo da 5 mL: anti-mouse CCR4, CD19, CD11b, CD45, ST2 e ICOS.
NOT: Esempio di come preparare il cocktail anticorpale per 10 campioni: 0,5 litri di ogni anticorpo x 10 campioni, 5 volte l di ciascuno degli anticorpi elencati in 1.7.1. - Per 10 test in totale, aggiungere 2,5 l di anticorpi al cocktail anticorpale dal punto 1.7.1: anti-topo CD3, CD11c e NK1.1.
NOT: Esempio per completare il cocktail anticorpale per 10 campioni: 0,25 campioni llà x 10 , 2,5 l di anticorpi CD3, CD11c e NK1.1. - Conservare il cocktail di colorazione dell'anticorpo CCR4 a 4 gradi centigradi fino a quando non è pronto per essere aggiunto ai campioni. Scartare il cocktail anticorpo dopo 1 settimana se non usato.
- Per 10 test in totale, aggiungere 5 luna di ciascuno dei seguenti anticorpi a un tubo da 5 mL: anti-mouse CCR4, CD19, CD11b, CD45, ST2 e ICOS.
-
Preparare 1x Stabilizzazione Fissativo.
- Aggiungere 10 mL di acqua distillata a 5 mL di 3 volte concentrato fissativo stabilizzante
2. Preparazione di topi BALB/c con sfida di allergeni
NOT: I topi maschi e femmine del BALB/c sono stati acquistati da Charles River (UNMC) o Jackson Laboratories (Università dello Utah) all'età di 6-8 settimane.
-
Dopo l'acclimatamento (1 settimana), sensibilizzare tutti gli animali all'OVA.
- Unire 100 adsiimposti OVA in alluminio (20 mg/mL) in un tubo di polistirolo da 5 ml.
- Mescolare il tubo e disegnare immediatamente 500 l della sospensione OVA-lume in una siringa da 1 mL, 28 G (siringa di insulina).
- Posizionare un topo in un barattolo di campana contenente isoflurane (1-2 mL sotto un falso pavimento, in modo che l'animale non sia in piedi direttamente nell'isoflurane). Lasciare che il mouse vada in anestesia per circa 1–2 min, o fino a quando il tasso di respirazione scende.
- Prendi rapidamente il mouse dalla pelliccia sulla schiena e sulle spalle e inietta 100 -L di OVA-allum intraperitoneally per topo21,22.
- Posizionare il mouse nella sua gabbia e guardare per assicurarsi che riacquistano la mobilità; questo dovrebbe avvenire entro 2-5 min.
-
Sette giorni dopo la sensibilizzazione, sottoporre tutti gli animali all'1,5% di OVA diluito in salina sterile in una camera di nebulizzazione (Data Sciences International) per 20 min.
- Togliere i topi dalle gabbie e metterli nella camera di nebulizzazione animale. Chiudere il coperchio sulla camera.
- Fissare il tubo di nebulizzazione al beccuccio di ingresso sulla camera di nebulizzazione.
- Aggiungere 30 mL di 1,5% OVA diluito in salina sterile alla tazza di nebulizzazione sul nebulizzatore.
- Accendere il nebulizzatore e lasciare che la camera si riempia di nebbia per 20 min.
- Spegnere il nebulizzatore e lasciare che la nebbia si stabilizzi.
- Riporta gli animali alle loro gabbie.
- Ripetere il passaggio 2.2 per un totale di 5 volte, per 5 giorni consecutivi, per indurre un'infiammazione allergica.
3. Isolamento di CD4- Cellule T da Spleens e polmoni di topi oVA sfidati
- Eutanasia umanamente tutti gli animali maschi e femmine trattati con OVA per asfissia di CO2 secondo i protocolli IACUC approvati, utilizzando da 2 a 3 animali per gruppo, per esperimento.
- Accise polmoni e milza da animali e posizionare i tessuti in tubi di dissociazione separati in base al tipo di tessuto e al sesso dell'animale23.
- Dissociare il tessuto polmonare in 500 -L di media di dissociazione polmonare (25 U/mL; collagenasi, tipo 1) nel dissociatore di tessuto automatizzato utilizzando il protocollo 'lung'.
- Ripetere 3.2 e 3.3 un totale di due volte.
- Dissocia il tessuto della milza in 500 -L di supporto RPMI completo utilizzando il protocollo "spleen" sul dissociatore di tessuto automatizzato.
NOT: I passaggi rimanenti devono essere eseguiti in un armadietto di sicurezza biologica utilizzando una tecnica sterile. - Sciacquare i tubi di dissociazione contenenti omogeti polmonari e spleen con 5 mL di supporti di dissociazione polmonare aggiuntivi o RPMI completi, rispettivamente.
- Filtrare le sospensioni cellulari attraverso un colino cellulare da 40 m e raccogliere in tubi conici da 50 mL.
- Incubare gli omogenei polmonari per 15-30 min in un'incubatrice di 37 gradi centigradi con il 5% di CO2 per dissociare ulteriormente il tessuto polmonare.
- Aggiungere 5 mL di RPMI completo al polmone e mleen oomogenei e pellet le cellule nella parte inferiore dei tubi 50 mL utilizzando la centrifugazione; 378 x g a temperatura ambiente (RT) per 5 min.
- Combinare splenociti e cellule polmonari in un unico tubo conico da 50 mL e determinare il numero totale di cellule utilizzando il contatore cellulare automatizzato.
- Regolare le sospensioni cellulari maschili e femminili a 1 x 108 celle/mL nel buffer di separazione e aggiungere a un tubo di polistirolo da 5 mL.
NOT: Il protocollo di arricchimento può essere regolato fino a 14 mL di tubi in polistirolo quando più cellule vengono acquisite dalla milza e dai polmoni. Questo protocollo è stato progettato per tessuti da 2-3 topi per gruppo; quindi un tubo da 5 mL dovrebbe essere sufficiente. - Utilizzare circa due terzi delle celle totali per l'isolamento di ILC2 secondo il protocollo di arricchimento ILC2.
- Aggiungere il cocktail anticorpale (50 omL) alla sospensione cellulare e incubare per 5 min a RT.
- Vortex sfere rapide per 30 s e aggiungere al campione ad una velocità di 75 l/mL di sospensione cellulare. Mescolare delicatamente e incubare per 5 min a RT.
- Top il tubo fino a 3 mL di volume totale con tampone di separazione e posizionare nel magnete di separazione facile a 8 camere. Incubare per 3 min a RT.
- Puntare il magnete in avanti (lontano dai complessi sfera-anticorpo-cellula aderito alla parte posteriore del tubo) e pipetta fuori dalla sospensione cellulare in un tubo pulito da 5 mL.
- Aggiungere 1,5 mL di RPMI completo ai tubi e centrifugare a 378 x g per 5 min a RT.
- Versare il supporto dal pellet cellulare e sospendere l'ILC2 a 1 x 107 celle per mL.
- Mettere 100 uL di ILC2 maschile e femminile in una piastra U-bottom, 96-well e aggiungere 100 l di ILC2 Expansion Media ad ogni pozzo.
- Incubare le cellule per 4-5 giorni per espandere l'ILC2.
- Raccogliere l'ILC2 in un tubo da 5 mL e aggiungere fino a 4,5 mL di RPMI senza siero. Centrifugare le cellule a 378 x g per 5 min a RT.
- Contare le cellule utilizzando un emacytometro e risospendere a 1 x 107 ILC2 per mL in RPMI senza siero.
- Utilizzare le celle rimanenti per la procedura di isolamento delle celle CD4- T, che viene eseguita secondo il protocollo di isolamento delle celle del mouse CD4- T con poche modifiche.
- Aggiungere il siero di ratto (50 o ML) alla sospensione dell'arricchimento delle cellule T CD4.
- Aggiungere il cocktail di isolamento (50 l/mL) al campione e incubare per 10 min a RT.
- Vorticare sfere rapide per 30 s e aggiungere al campione ad una velocità di 75 l/mL.
- Mescolare delicatamente le sospensioni cellulari e incubare per 2,5 min e RT
- Top i campioni fino a 3 mL e posizionare i tubi da 5 mL nel magnete di separazione facile da 8 camere e incubare per 5 min a RT.
- Puntare il magnete in avanti e pipettare la sospensione cellulare in un tubo pulito da 5 mL.
- Aggiungere 1,5 mL di RPMI senza sieri ai tubi e centrifugare a 378 x g per 5 min a RT.
- Versare il supporto dal pellet cellulare e risospendere le cellule CD4- T a 1 x 107 celle per mL in RPMI senza siero.
4. Determinare l'espressione CCR4 su CD4- Cellule T e cellule linfoidi innate di gruppo 2 (ILC2) da animali sfidati oVA da Cytometria di flusso
NOT: I seguenti passaggi possono essere eseguiti su un banco aperto in quanto sono tecniche non sterili.
-
Acquisire approssimativamente 1–2,5 x 105 celle ILC2 dai tubi step 3.11.10 e 1–2.5 x 106 CD4- T dal passaggio 3.12.8 in tubi da 5 mL separati.
- Mantenere un tubo aggiuntivo di almeno 5,0 x 104 cellule T CD4 come controllo incontaminato.
- Sospendere le cellule in 100-200 l di TAC tampone e aggiungere 1 L di Fc Block ad ogni tubo, quindi incubare sul ghiaccio (o in un frigorifero a 4 gradi centigradi) per 10 min.
- Aggiungere 1-2 mL di buffer FACS a ogni tubo e centrifugare a 378 x g per 5 min a RT.
- Versare il supernatante e risospendere le celle in 100-200 - L di FACS Buffer.
- Aggiungere 37,5 l dell'Anticorpo CCR4 Antiining Cocktail alla sospensione cellulare in ogni tubo ad eccezione del tubo contenente le cellule "incontaminate".
- Incubare i tubi sul ghiaccio, o in un frigorifero di 4 gradi centigradi, per 20-30 min.
- Aggiungere 1-2 mL di buffer FACS a ogni tubo e centrifugare a 378 x g per 5 min a RT.
- Versati dal super-natante.
- Ripetere i passaggi 4.7 e 4.8.
- Aggiungere ad ogni tubo 250-300 l di 1x di fissativo (vedere Tabella dei materiali).
-
Preparare i controlli di perline monocolore per ogni anticorpo nel cocktail anticorpo CCR4 secondo il protocollo fornito con le perline di compensazione.
- Vorticare le perline di compensazione.
- Aggiungere una goccia di perline ad ogni tubo di controllo monocolore.
- Aggiungere 1 l'uno di ogni anticorpo nel cocktail Anticorpo CCR4 al proprio tubo etichettato.
- Mescolare delicatamente e incubare per 10 min in un frigorifero a 4 gradi centigradi o sul ghiaccio.
- Aggiungere 1-2 mL di FACS Buffer a tutti i tubi e centrifugare a 378 x g per 5 min a RT.
- Versare il supernatante e risospendere le perline in 200 .L di buffer FACS.
- Conservare in frigorifero i controlli monocolore fino a quando tutti i campioni sono macchiati e pronti per essere analizzati sul citometro di flusso.
- Analizzare le cellule non colorate, i controlli monocolore e i campioni sperimentali sul citometro di flusso entro 24 ore dalla fissazione.
5. Procedura di trasmigrazione Ex Vivo
NOT: I seguenti passaggi devono essere eseguiti in un gabinetto di sicurezza biologica, in quanto richiedono una tecnica sterile.
- Acquisire il 2l2 dalle celle T step 3.11.10 e CD4 dal passaggio 3.12.8 e determinare il numero di inserti transwell necessari per l'esperimento.
NOT: Esempio: per 1,2 mL di cellule T CD4 arricchite dal passo 3,12,8, moltiplicare 1,2 x 1.000 L : 1.200 L; quindi dividere 1.200 uL per 100 l n. 12, il numero di inserti necessari per la trasmigrazione CD4 T. - Spostare delicatamente gli inserti transwell 3 m dalle file centrali di una piastra di 24 pozze.
- Aggiungete 500 l di supporti di migrazione con CCL17 a circa un terzo dei pozzi.
- Aggiungete 500 - L di supporti di migrazione con CCL22 ad un altro terzo dei pozzi.
- Aggiungete 500 l di RPMI senza siero senza che contenga chemiochina fino all'ultimo terzo dei pozzetti.
- Etichettare chiaramente il coperchio sulla piastra con il supporto di trasmigrazione appropriato posto nei pozze inferiori.
- Riposizionare gli inserti transwell nei pozzi contenenti i vari trattamenti.
- Aggiungere delicatamente 100 l di celle T CD4 o ILC2 sul pozzetto superiore di ogni inserto. Non mescolare o pipette la sospensione cellulare su e giù nei transwells, in quanto ciò potrebbe confondere i risultati dell'esperimento.
- Etichettare chiaramente il coperchio della piastra con il tipo di cella posto in ogni pozzo e scrivere la data e l'ora del giorno in cui le celle sono state aggiunte.
- Ripetere i passaggi da 5,2 a 5,9 fino a quando tutte le celle non sono state posizionate in inserti transwell con supporti.
- Posizionare delicatamente la piastra in un'incubatrice di 37 gradi centigradi con il 5% di CO2 per 48 h. Ridurre al minimo il contatto con la piastra durante il periodo di incubazione.
6. Quantificazione della trasmigrazione Ex Vivo
- Rimuovere delicatamente la piastra dall'incubatrice e rimuovere tutti gli inserti transwell dalle file centrali nei pozzi vuoti appena sopra o sotto.
- Raccogliere le celle dal basso e superiore pozzi del transwell inserti in tubi etichettati con TOP o BOTTOM, con CCL17, CCL22, o supporti, con il tipo di cella, e con il numero di replica (almeno 3 repliche per esperimento).
- Sciacquare i pozze inferiori con 500 gradi l di 1x PBS e raccogliere questo risciacquo nel tubo corrispondente.
- Sciacquare i pozzi superiori con 250 l di 1x PBS e raccogliere questo risciacquo nel tubo corrispondente.
- Pellet le cellule per centrifugazione a 378 x g per 5 min a RT.
- Delicatamente pipette off tutti supernatant dal pellet cellulare.
- Risospendere le celle T e ILC2 in 50 -L di 1x PBS.
- Prendere 10 l delle sospensioni cellulari e aggiungere a 90 gradi L dello 0,4% di trypan blu.
-
Contare le celle sul contatore cellulare automatico.
- Registrare %viability.
- Registrare il numero di celle per mL per ogni campione.
- Determinare il numero totale di cellule per trattamento nella camera superiore e inferiore; registrare i conteggi delle celle.
Risultati
Espressione CCR4 sulle celle T CD4 e ILC2.
Per il successo dell'esperimento di trasmigrazione ex vivo, è imperativo determinare se i linfociti sono reattivi a CCL17 e CCL22 attraverso CCR4; pertanto, abbiamo determinato l'espressione CCR4 suentrambe le cellule CD4 - T e ILC2 per citometria di flusso. Mentre è ben noto che il CD4 specifico dell'OVA- le cellule T helper esprimono CCR4, meno è noto dell'espressione di CCR4 su ILC2. La figura 1 mostra i risultati rappresentativi dell'espressione CCR4, comparativamente, su CD4- cellule T (Figura 1A,C) e ILC2 (Figura 1B,D) da topi BALB/c di sesso maschile e femminile. La citometria di flusso è stata utilizzata per rilevare CCR4 usando un anticorpo monoclonale coniugato all'allophycocyanina (APC). Utilizzando One-Way Analysis of Variance (ANOVA), abbiamo determinato che non c'erano differenze nell'espressione CCR4 tra host maschi e femmine (Figura 1A-D), tuttavia, l'espressione di CCR4 su base per cella (MFI) su ILC2 era superiore rispetto a CD4 + celle T (Figura 1C rispetto alla figura 1D). Questi risultati sono importanti per dimostrare che le cellule ILC2 e CD4- T dovrebbero rispondere a CCL17 e CCL22 nel seguente esperimento.
Reattività delle cellule CD4- T ai ligandi CCR4 nelle camere superiore e inferiore di un sistema di trasmigrazione.
CD4- Le cellule T di maschi, i topi BALB/c sfidati dall'OVA sono stati isolati dai polmoni e dalle milza e collocati nella camera superiore di un apparato di trasmigrazione separati da una membrana porosa di 3 M(Figura 2). Un riepilogo della preparazione in vivo dei topi trattati con OVA (Figura 2A) e della procedura di trasmigrazione (Figura 2B) sono mostrati come riferimento. Una combinazione di CCL17 (25 ng/mL) e CCL22 (25 ng/mL) sono stati posizionati nella camera superiore, nella camera inferiore o in entrambe le camere superiore e inferiore per confermare (Figura 2C), (1) che le cellule T CD4e T degli animali OVA sfidati rispondevano a CCR4 I ligandi, e (2) che la migrazione indotta dalla chemiochina era un processo attivo attraverso il quale le cellule T si muovevano attraverso i pori in risposta al gradiente della chemiocinesia e che i linfociti non si muovevano attraverso i pori indipendenti dalla chemiochina. È stato incluso un controllo dei supporti (No Chemokine) per dimostrare che le cellule CD4- T non potevano migrare attraverso i 3 pori m senza stimolazione. In questa condizione, la più alta percentuale di cellule è rimasta nella camera superiore. Quando le chemiochine sono state posizionate contemporaneamente nella camera superiore e inferiore, abbiamo rilevato il 52% delle cellule T totali nella camera inferiore e il 48% delle cellule nella camera superiore (trattamento TOP/BOTTOM). Come previsto, la distribuzione delle cellule si è mossa in risposta alla chemiochina posizionata solo nella parte superiore o solo nella camera inferiore, poiché abbiamo rilevato la più alta percentuale di cellule nel compartimento in cui era presente la chemiochina.
Reattività delle cellule CD4- T e ILC2 a CCL17 e CCL22 in un apparato di trasmigrazione ex vivo.
Le cellule T CD4 e ILC2 da uomini e femmine, i topi oVA-sfidati sono stati isolati da polmoni e milza poi collocati nella camera superiore di un apparato di trasmigrazione trasprofa (Figura 3). La camera inferiore dell'apparato era piena di mezzi di coltura cellulare non trattati, supporti contenenti CCL17 o supporti contenenti CCL22. I risultati rappresentativi mostrano che meno del 14% (13,37 x 6,5%) delle celle migrate in condizioni di controllo dei supporti (Figura 3A–D). In risposta al CCL22, entrambi i tipi di cellule, indipendentemente dal fatto che provenissero da host maschi o femmine, hanno risposto al CCL22(Figura 3A–D), tuttavia, i risultati per CCL17 erano meno coerenti. CCL17 ha indotto solo una migrazione significativa per le cellule T CD4 femminili e ILC2 rispetto alla sola media (Figura 3C,D). Il trattamento CCL17 non era diverso dai mezzi di comunicazione per i media maschi CD4- Cellule T o ILC2 maschili (Figura 3A,B) e CCL22 ha indotto una maggiore migrazione rispetto al CCL17 nell'ILC2 maschile (Figura 2B).
Risultati di trasmigrazione subottimali per le cellule CD4- T con bassa vitalità.
Sono stati generati risultati non ottimali per fornire al ricercatore un esempio di cosa aspettarsi quando l'esperimento di trasmigrazione non funziona correttamente (Figura 4). Abbiamo isolato le celluleT maschili degli animali secondo questo protocollo e le abbiamo collocate nel pozzo superiore del sistema di trasmigrazione. Dopo l'aggiunta delle cellule CD4- T, tuttavia, la piastra è rimasta a temperatura ambiente per le prime 24 h, quindi la piastra è stata spostata nell'incubatrice per le restanti 24 h del periodo di incubazione. Non sorprende che non abbiamo rilevato alcuna migrazione verso CCL17 e CCL22 (Figura 4A) e la fattibilità delle cellule era notevolmente bassa (<15%) per le celle nella parte superiore (Figura 4B). Questi risultati imperfetti evidenziano l'importanza di utilizzare le temperature e le condizioni corrette descritte in questo protocollo per ottenere risultati ottimali.
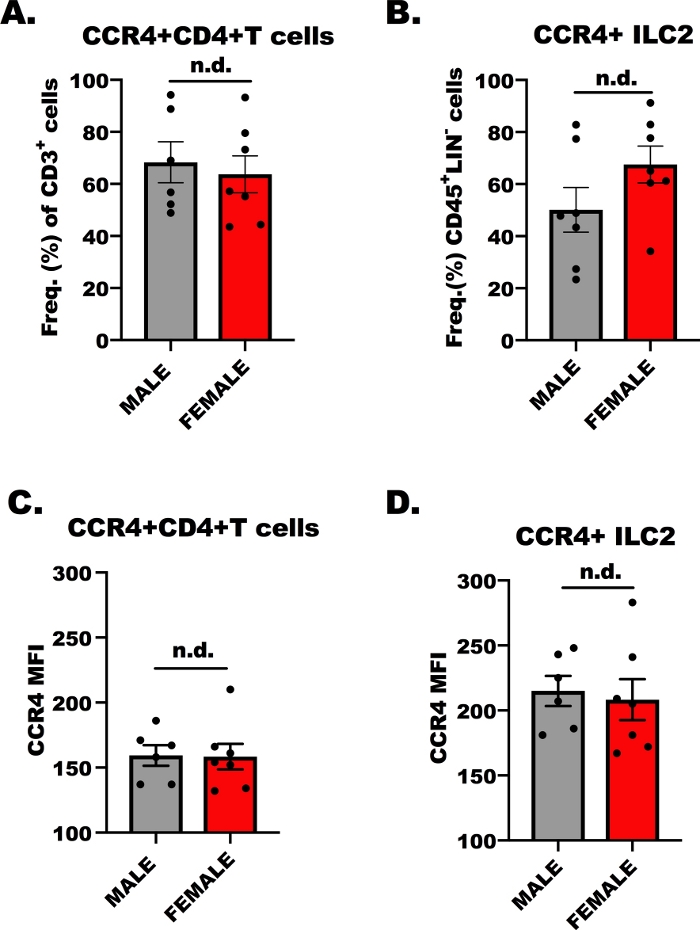
Figura 1: Espressione CCR4 sulle celle CD4e T e ILC2. Da 7 a 9 settimane, maschi e femmine, i topi BALB/c sono stati iniettati una volta con 100 -L di OVA-adsorbito all'idrossido di alluminio (500 g/mL; OVA e 20 mg/mL di idrossido di alluminio) 7 giorni prima della prima di 5, ripetitive, sfide quotidiane delle vie aeree con 1.5% OVA in salina. Gli animali con problemi di allergeni sono stati umanamente eutanasia, e il tessuto polmonare e milza è stato raccolto per l'isolamento delle celluleT ILC2 e CD4. Una piccola aliquota di cellule è stata poi macchiata e analizzata dalla citometria di flusso per determinare il livello di CCR4 su ogni tipo di cellula. (A) Frequenza delle cellule CD4- T che sono CCR4, dai topi OVA, dove le barre di errore rappresentano l'errore standard della media (SEM). (B) Frequenza di ILC2 che erano CCR4. (C, D) Intensità media di fluorescenza (SEM) delle cellule CD4 T diCCR4su ( C ) e (D) ILC2. Un totale di 13 topi sono stati utilizzati per generare questi dati, e l'esperimento di flusso è stato ripetuto due volte, con 3 repliche di ogni trattamento per esperimento. Il significato è stato determinato da ANOVA a senso unico; n.d. indica che non vi sono differenze tra i gruppi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Reattività delle celluleT CD4 ai ligandi CCR4 nelle camere superiore e inferiore di un sistema di trasmigrazione. I topi maschi BALB/c sensibilizzati e sfidati con ovalbumina di uova di gallina (OVA) e cellule T CD4 sono state isolate dalle milza e dai polmoni (A, B). Per questo esperimento di trasmigrazione, le cellule CD4- T sono state sospese in supporti senza siero a 1 x 107 cellule/mL. CCL17 e CCL22 sono stati aggiunti ai supporti senza siero a una concentrazione di 50 ng/mL (25 ng/mL di ogni chemiochina per raggiungere un totale di 50 ng/mL). I supporti chemiochine entiini sono stati aggiunti solo alla camera superiore, solo alla camera inferiore o a entrambe le camere superiore e inferiore. Un volume totale di 500 - L di supporti di trasmigrazione è stato aggiunto ai pozzi inferiori e 100 L di sospensione cellulare (1 x 106 cellule/pozzetto) è stato aggiunto al pozzo superiore. La trasmigrazione è stata misurata dopo 48 h in coltura (C). Questi dati sono stati generati da un singolo esperimento, 3 topi maschi trattati con OVA sono stati utilizzati per la raccolta dei tessuti e sono state fatte 3 repliche per trattamento. La rilevanza statistica è stata determinata da ANOVA one-way; p< 0,05. Fare clic qui per visualizzare una versione più grande di questa figura.
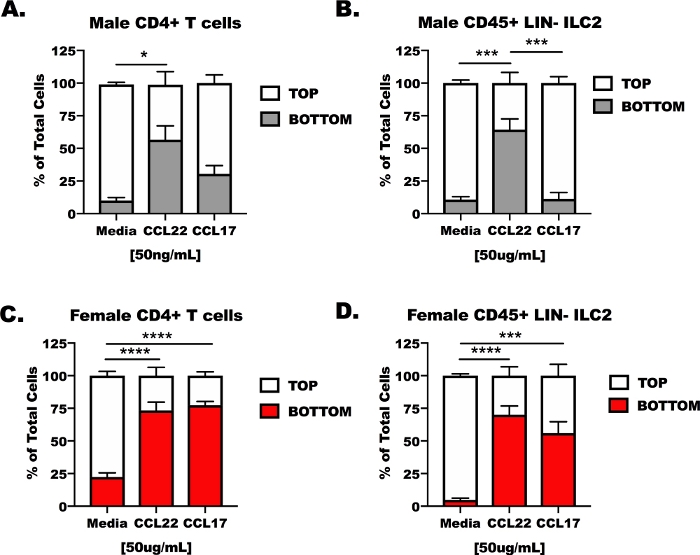
Figura 3: Reattività delle cellule T CD4 e ILC2 a CCL17 e CCL22 in un apparato di trasmigrazione ex vivo. I topi sono stati preparati come nella Figura 1 per la cellula CD4- cellula T e l'isolamento DI ILC2 da milza e polmoni. CD4- Le cellule T e ILC2 sono state sospese in supporti senza siero a 1 x 107 celle/mL. CCL17 o CCL22 sono stati aggiunti ai supporti senza siero ad una concentrazione di 50 ng/mL. 500 -L di supporti di trasmigrazione sono stati aggiunti ai pozzi inferiori e 100 l di sospensione cellulare (1 x 106 cellule/pozzo) è stato aggiunto al pozzo superiore. La trasmigrazione è stata misurata dopo 48 h in coltura. (A) CD4- Cellule T e(B)ILC2 da host maschi sono stati trattati con supporti come controllo, CCL17 o CCL22. Allo stesso modo,lecellule CD4- T femminili e (D)sono state trattate con supporti, CCL17 o CCL22. Un totale di 14 topi sono stati utilizzati per generare questi dati. L'esperimento di trasmigrazione è stato ripetuto 4 volte, con 3-6 repliche di ogni trattamento per esperimento. Il significato è stato determinato da ANOVA a senso unico; :p < 0,05, p< 0,001, p< 0,0001. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: Risultati di trasmigrazione non ottimali per le cellule T CD4 a bassa vitalità. I topi maschi nai BALB/c sono stati acquisiti per la raccolta di tessuti polmonari e di milza e per la codifica CD4- Isolamento delle cellule T come illustrato nella Figura 1, Figura 2e Figura 3. Le cellule T CD4 sono state aggiunte alla camera superiore dell'apparato di trasmigrazione e sono stati aggiunti supporti senza siero contenenti CCL17, CCL22 o nessuna chemiochina (controllo multimediale) al pozzo inferiore. Per i primi 24 h dell'esperimento la piastra è stata lasciata a temperatura ambiente, poi è stata spostata in un incubatore di 37 gradi centigradi con 5% di CO2 per un ulteriore 24 h. (A) Percentuale di cellule rimaste nei pozze superiori e inferiori dopo 24 h. (B) Viability of the C Cellule T D4 nella camera superiore e inferiore a seguito di cattive condizioni di incubazione. Questi dati sono stati generati da un singolo esperimento, sono stati utilizzati 3 topi maschi ingenui per la raccolta dei tessuti e sono state fatte 3 repliche per trattamento. La significatività statistica non è stata determinata. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Qui, presentiamo un metodo ben consolidato per valutare la migrazione indotta dalla chemiocinetta dei linfociti in un sistema di trasmigrazione ex vivo. Ci sono diversi passaggi critici nel protocollo, il primo dei quali è verificare l'espressione del corretto recettore della chemiochina sulle cellule immunitarie nell'esperimento. Nelle nostre mani, abbiamo scelto CCR4 a causa del corpo della letteratura che sottolinea l'importanza di CCR4 sulle cellule T helper Th2 nell'infiammazione allergica. L'infiammazione indotta da oalbumina è stata dimostrata in precedenza per essere limitata da almeno due antagonisti CCR424,25; tuttavia, questo era prima della scoperta del gruppo 2 cellule linfoidi innate (ILC2)26,27. Abbiamo generato nuovi dati che mostrano che le cellule ILC2 esprimono CCR4 più elevati rispetto alle celluleT CD4 e hanno dimostrato che queste cellule rispondevano costantemente al CCL22.
Un secondo passo critico da seguire nel protocollo consiste nel garantire che le cellule siano mantenute in un mezzo ottimale per la coltura prima di iniziare la parte di trasmigrazione del protocollo. Nel caso di ILC2, abbiamo dovuto coltura queste cellule in ILC2 Expansion Media che contiene sia IL-2 e IL-33. IL-2 e IL-7 sono entrambi riportati in letteratura per supportare ILC2 nella coltura per un massimo di 14 giorni28,29. Se la vitalità diventa un problema per le cellule CD4- T e ILC2 in esperimenti futuri, l'aggiunta di IL-2 o IL-7 probabilmente migliorerebbe la sopravvivenza dei linfociti fino all'endpoint dell'esperimento. Ognuno dei media qui presentati è stato definito nel corso di diversi esperimenti e sono stati ottimizzati per l'uso in questo protocollo14,30,31. Nella Figura 4, abbiamo presentato risultati difettosi per dimostrare l'importanza di utilizzare un incubatore con temperatura adeguata e 5% CO2. Mantenere le piastre di trasmigrazione nell'incubatrice dove non saranno disturbate è un altro passo fondamentale per il successo del protocollo.
Come affermato in precedenza, l'utilizzo della microscopia in vivo disponibile nella maggior parte delle istituzioni presenta vantaggi, tuttavia, l'imaging in vivo può richiedere molto tempo e denaro. Una procedura sperimentale alternativa meno costosa utilizza la microfluidica in combinazione con i gradienti di chemiochine per comprendere le stravacce di leucociti e la migrazione dei tessuti32,33,34. Questi sistemi hanno un valore scientifico perché valutano la complessità della cinetica cellulare che coinvolge le cellule endoteliali, che possono essere coltivate sui capillari dei sistemi microfluidici. Inoltre, questi sistemi microfluidici valutano l'importanza delle proteine aderenze (ad esempio, E-cadherin) sulle cellule endoteliali e le cellule immunitarie integrano le cellule immunitarie nel processo di aderenza cellulare nel flusso sanguigno. Tuttavia questi sistemi richiedono attrezzature specializzate e complesse programmazioni e statistiche computazionali per determinare l'importanza di ciascuna condizione di trattamento. Pertanto, anche se la limitazione del metodo di trasmigrazione qui presentato è che è di natura artificiale, può essere utilizzato come un importante strumento di screening per limitare lo spreco di reagenti non necessari nei successivi metodi in vivo. Il significato del metodo è che man mano che vengono scoperte nuove cellule, come nel caso di ILC2, possiamo controllare queste cellule per verificarne la reattività alle chemiochine note. Questa è una delle applicazioni future che coinvolgono ILC2 e potenziali terapie che possono inibire la loro migrazione nei polmoni durante l'esacerbazione dell'asma. Questo protocollo di trasmigrazione sarà utilizzato per vagliare vari inibitori che possono essere utilizzati per limitare CCR4 o altri mediatori chemiotattici coinvolti nel reclutamento di ILC2. Complessivamente, questo protocollo di trasmigrazione ex vivo porterà alla generazione di dati critici che possono essere verificati con futuri esperimenti in vivo.
Divulgazioni
Gli autori non hanno divulgazioni finanziarie o conflitti di interesse da divulgare.
Riconoscimenti
Questo lavoro è stato finanziato dall'American Lung Association (K.J.W.), dal fondo Memorial Eugene Kenney assegnato a T.A.W. e K.J.W., dal generoso sostegno avviato dall'Università dello Utah per K.J.W. e da un premio del Dipartimento degli affari dei veterani a T.A.W. (VA I01BX0003635). T.A.W. è stato insignito di un Research Career Scientist Award (IK6 BX003781) del Dipartimento degli Affari Veterani. Gli autori desiderano riconoscere l'assistenza editoriale della signora Lisa Chudomelka. Gli autori ringraziano il nucleo Citometry di UnMC Flow per il loro sostegno nella raccolta dei dati della citometria di flusso generati per questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Sigma-Aldrich | 15250061 | |
| 1 mL syringe | BD Bioscience | 329424 | U-100 Syringes Micro-Fine 28 G 1/2" 1cc |
| 100x Penicillin-Streptomycin, L-Glutamine | Gibco | 10378-016 | Dilute to 1x in RPMI media |
| 15 mL conical tubes | Olympus Plastics | 28-101 | polypropylene tubes |
| 3 μm transwell inserts | Genesee Scientific | 25-288 | 24-well plate containing 12 transwell inserts |
| 3x stabilizing fixative | BD Pharmigen | 338036 | Prepare 1x solution according to manufacturers protocol |
| 5 mL polystyrene tubes | STEM Cell Technologies | 38007 | |
| 50 mL conical tubes | Olympus Plastics | 28-106 | polypropylene tubes |
| 8-chamber easy separation magnet | STEM Cell Technologies | 18103 | |
| ACK Lysing Buffer | Life Technologies Corporation | A1049201 | |
| Advanced cell strainer, 40 μm | Genesee Scientific | 25-375 | nylon mesh, 40 μm strainers |
| Aluminum Hydroxide, Reagent Grade | Sigma-Aldrich | 239186-25G | 20 mg/mL |
| anti-mouse CCR4; APC-conjugated | Biolegend | 131211 | 0.5 μg/test |
| anti-mouse CD11b | BD Pharmigen | 557396 | 0.5 μg/test |
| anti-mouse CD11c; PE eFluor 610 | Thermo-Fischer Scientific | 61-0114-82 | 0.25 μg/test |
| anti-mouse CD16/32, Fc block | BD Pharmigen | 553141 | 0.5 μg/test |
| anti-mouse CD19; APC-eFluor 780 conjugated | Thermo-Fischer Scientific | 47-0193-82 | 0.5 μg/test |
| anti-mouse CD3; PE Cy 7-conjugated | BD Pharmigen | 552774 | 0.25 μg/test |
| anti-mouse CD45; PE conjugated | BD Pharmigen | 56087 | 0.5 μg/test |
| anti-mouse ICOS (CD278) | BD Pharmigen | 564070 | 0.5 μg/test |
| anti-mouse NK1.1 (CD161); FITC-conjugated | BD Pharmigen | 553164 | 0.25 μg/test |
| anti-mouse ST2 (IL-33R); PerCP Cy5.5 conjugated | Biolegend | 145311 | 0.5 μg/test |
| Automated Cell Counter | BIORAD | 1450102 | |
| Automated Dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| Bovine Serum Albumin, Lyophilized Powder | Sigma-Aldrich | A2153-10G | 0.5% in serum-free RPMI |
| Cell Counter Clides | BIORAD | 1450015 | |
| Chicken Egg Ovalbumin, Grade V | Sigma-Aldrich | A5503-10G | 500 μg/mL |
| Collagenase, Type 1, Filtered | Worthington Biochemical Corporation | CLSS-1, purchase as 5 X 50 mg vials (LS004216) | 25 U/mL in RPMI |
| Compensation beads | Affymetrix | 01-1111-41 | 1 drop per contol tube |
| Dissociation Tubes | MACS Miltenyi Biotec | 130-096-335 | |
| FACS Buffer | BD Pharmigen | 554657 | 1x PBS + 2% FBS, w/ sodium azide; stored at 4 °C |
| Heat Inactivated-FBS | Genesee Scientific | 25-525H | 10% in complete RPMI & ILC2 Expansion Media |
| Mouse CCL17 | GenScript | Z02954-20 | 50 ng/mL |
| Mouse CCL22 | GenScript | Z02856-20 | 50 ng/mL |
| Mouse CD4+ T cell enrichment kit | STEM Cell Technologies | 19852 | |
| Mouse IL-2 | GenScript | Z02764-20 | 20 ng/mL |
| Mouse ILC2 enrichment kit | STEM Cell Technologies | 19842 | |
| Mouse recombinant IL-33 | STEM Cell Technologies | 78044 | 20 ng/mL |
| RPMI | Life Technologies Corporation | 22400071 | |
| Separation Buffer | STEM Cell Technologies | 20144 | 1x PBS + 2% FBS; stored at 4 °C |
| Small animal nebulizer and chamber | Data Sciences International | ||
| Sterile saline | Baxter | 2F7124; NDC 0338-0048-04 | 0.9% Sodium Chloride |
Riferimenti
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Moser, B. Editorial: History of Chemoattractant Research. Frontiers in Immunology. 6, 548 (2015).
- Borroni, E. M., Savino, B., Bonecchi, R., Locati, M. Chemokines sound the alarmin: The role of atypical chemokine in inflammation and cancer. Seminars in Immunology. 38, 63-71 (2018).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. The New England Journal of Medicine. 354 (6), 610-621 (2006).
- Abboud, D., Hanson, J. Chemokine neutralization as an innovative therapeutic strategy for atopic dermatitis. Drug Discovery Today. 22 (4), 702-711 (2017).
- Aldinucci, D., Casagrande, N. Inhibition of the CCL5/CCR5 Axis against the Progression of Gastric Cancer. International Journal of Molecular Sciences. 19 (5), E1477 (2018).
- Chonco, L., et al. Novel DNA Aptamers Against CCL21 Protein: Characterization and Biomedical Applications for Targeted Drug Delivery to T Cell-Rich Zones. Nucleic Acid Therapy. 28 (4), 242-251 (2018).
- Trivedi, P. J., Adams, D. H. Chemokines and Chemokine Receptors as Therapeutic Targets in Inflammatory Bowel Disease; Pitfalls and Promise. Journal of Crohn's and Colitis. 12 (12), 1508 (2018).
- Pietrosimone, K. M., Bhandari, S., Lemieux, M. G., Knecht, D. A., Lynes, M. A. In vitro assays of chemotaxis as a window into mechanisms of toxicant-induced immunomodulation. Current Protocols in Toxicology. 58 (Unit 18.17), (2013).
- Davis, D. M. How studying the immune system leads us to new medicines. Lancet. 391 (10136), 2205-2206 (2018).
- Culley, F. J., Pennycook, A. M., Tregoning, J. S., Hussell, T., Openshaw, P. J. Differential chemokine expression following respiratory virus infection reflects Th1- or Th2-biased immunopathology. Journal of Virology. 80 (9), 4521-4527 (2006).
- Denney, H., Clench, M. R., Woodroofe, M. N. Cleavage of chemokines CCL2 and CXCL10 by matrix metalloproteinases-2 and -9: implications for chemotaxis. Biochemical and Biophysics Research Communications. 382 (2), 341-347 (2009).
- Burrell, B. E., et al. Lymph Node Stromal Fiber ER-TR7 Modulates CD4+ T Cell Lymph Node Trafficking and Transplant Tolerance. Transplantation. 99 (6), 1119-1125 (2015).
- Warren, K. J., Iwami, D., Harris, D. G., Bromberg, J. S., Burrell, B. E. Laminins affect T cell trafficking and allograft fate. The Journal of Clinical Investigation. 124 (5), 2204-2218 (2014).
- Hirata, H., et al. Th2 cell differentiation from naive CD4(+) T cells is enhanced by autocrine CC chemokines in atopic diseases. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. , (2018).
- Lin, R., Choi, Y. H., Zidar, D. A., Walker, J. K. L. beta-Arrestin-2-Dependent Signaling Promotes CCR4-mediated Chemotaxis of Murine T-Helper Type 2 Cells. American Journal of Respiratory Cell and Molecular Biology. 58 (6), 745-755 (2018).
- Zhang, Y., et al. A new antagonist for CCR4 attenuates allergic lung inflammation in a mouse model of asthma. Science Reports. 7 (1), 15038 (2017).
- Lu, Y., et al. Dynamics of helper CD4 T cells during acute and stable allergic asthma. Mucosal Immunology. 11 (6), 1640-1652 (2018).
- Li, B. W. S., Beerens, D., Brem, M. D., Hendriks, R. W. Characterization of Group 2 Innate Lymphoid Cells in Allergic Airway Inflammation Models in the Mouse. Methods in Molecular Biology. 1559, 169-183 (2017).
- Li, B. W. S., et al. Group 2 Innate Lymphoid Cells Exhibit a Dynamic Phenotype in Allergic Airway Inflammation. Frontiers in Immunology. 8, 1684 (2017).
- Warren, K. J., et al. Sex differences in activation of lung-related type-2 innate lymphoid cells in experimental asthma. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. , (2016).
- Warren, K. J., et al. Ovalbumin-sensitized mice have altered airway inflammation to agriculture organic dust. Respiratory Research. 20 (1), 51 (2019).
- Poole, J. A., et al. alphabeta T cells and a mixed Th1/Th17 response are important in organic dust-induced airway disease. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. 109 (4), 266-273 (2012).
- Matsuo, K., et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomedical Pharmacotherapy. 109, 1437-1444 (2019).
- Mikhak, Z., et al. Contribution of CCR4 and CCR8 to antigen-specific T(H)2 cell trafficking in allergic pulmonary inflammation. The Journal of Allergy and Clinical Immunology. 123 (1), 67-73 (2009).
- Monticelli, L. A., et al. Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nature Immunology. 12 (11), 1045-1054 (2011).
- Saenz, S. A., et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 464 (7293), 1362-1366 (2010).
- Hoyler, T., et al. The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity. 37 (4), 634-648 (2012).
- Nakajima, H., Shores, E. W., Noguchi, M., Leonard, W. J. The common cytokine receptor gamma chain plays an essential role in regulating lymphoid homeostasis. The Journal of Experimental Medicine. 185 (2), 189-195 (1997).
- Warren, K. J., et al. RSV-specific anti-viral immunity is disrupted by chronic ethanol consumption. Alcohol. , (2016).
- Warren, K. J., Poole, J. A., Sweeter, J. M., DeVasure, J. M., Wyatt, T. A. An association between MMP-9 and impaired T cell migration in ethanol-fed BALB/c mice infected with Respiratory Syncytial Virus-2A. Alcohol. , (2018).
- Molteni, R., et al. A novel device to concurrently assess leukocyte extravasation and interstitial migration within a defined 3D environment. Lab on a Chip. 15 (1), 195-207 (2015).
- Bersini, S., et al. Human in vitro 3D co-culture model to engineer vascularized bone-mimicking tissues combining computational tools and statistical experimental approach. Biomaterials. 76, 157-172 (2016).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon