Method Article
Ex Vivo 트랜스이민 시스템에서 림프구 마이그레이션 평가
요약
이 프로토콜에서 림프구는 다공성 멤브레인에 의해 하단 챔버로부터 분리 된 트랜스 이민 시스템의 상부 챔버에 배치됩니다. 케모카인은 하단 챔버에 첨가되어 케모카인 그라데이션을 따라 활발한 이동을 유도합니다. 48 시간 후, 림프구는 트랜스 이민을 정량화하기 위해 두 챔버에서 계산됩니다.
초록
본 명세서에서, 우리는 생체 내 트랜스이민 시스템에서 림프구 케모카네틱 운동을 평가하기 위한 기본적인 실험실 기술 및 물질로 실행될 수 있는 효율적인 방법을 제시한다. 그룹 2 선천림프세포(ILC2) 및CD4+ T 도우미 세포를 닭계란 ovalbumin(OVA)-도전BALB/c 마우스의 비장 및 폐로부터 분리하였다. 우리는CD4+ T 세포 및 ILC2 둘 다에서 CCR4의 발현을 비교적 확인하였다. CCL17 및 CCL22는 CCR4에 대해 공지된 리간드; 따라서, 이러한 생체 내 이주 방법을 사용하여CCL17-및 CCR22-유도 된 CCR4+ 림프구의 이동을 조사하였다. 케모카인 그라데이션을 확립하기 위해 CCL17 및 CCL22를 마이그레이션 시스템의 하단 챔버에 배치했습니다. 분리된 림프구는 상부 챔버에 첨가하고 48h 기간 동안 림프구가 3 μm 기공을 통해 활발하게 이동하여 하단 챔버의 케모카인을 향하게 했다. 이것은 림프구의 화학 요법을 결정하기위한 효과적인 시스템이지만, 당연히 생체 내 장기 미세 환경에서 발견되는 복잡성을 모방하지는 않습니다. 이것은 연구 하에 기관 및 림프구의 실화 화상 진찰에 추가함으로써 극복 될 수있는 방법의 한 가지 한계이다. 대조적으로, 이 방법의 장점은 엔트리 레벨 기술자가 라이브 이미징보다 훨씬 더 비용 효율적인 속도로 수행 될 수 있다는 것입니다. 종양이 세포독성 면역 세포에 침투하는 경우와 같이 치료 화합물이 이동을 향상시키거나 이동을 억제할 수 있게 됨에 따라, 아마도 면역병리학이 우려되는 자가면역 질환의 경우, 이 방법은 스크리닝 도구. 일반적으로, 이 방법은 관심 있는 케모카인이 미디어 제어보다 통계적으로 더 높은 수준에서 화학을 일관되게 생성하는 경우에 효과적이다. 이러한 경우에, 주어진된 화합물에 의해 억제/향상의 정도 또한 결정 될 수 있다.
서문
이 원래 이주 방법은 실험 의학의 전표에서1962년에 스티븐 보이든에 의해 제출되었습니다1. 우리가 화학 요법과 화학 요법에 대해 알고있는 많은 것은 Boyden 챔버의 개발없이 가능하지 않을 것입니다. 1977년에 첫번째 chemokine의 발견이전에, ex vivo transmigration 시스템은 호중구에 있는 세포 운동성을 증폭하는 동안 대식세포에 있는 세포 운동을 체포할 수 있던 혈청 요인에 관하여 배우기 위하여 이용되었습니다1,2. 면역 세포 이동에 관한 지식의 엄청난 재산이 개발되었습니다, 현재까지, 47 케모카인은 지금 발견되었습니다 19 해당 수용체3,4. 또한, 이러한 케모카인 경로의 억제제 / 강화제의 무리는 치료 목적을 위한 개발을 겪고있다5,6,7,8. 그 화합물의 많은 주어진된 chemokine에 화합물과 면역 세포 응답 성 간의 직접적인 상호 작용을 이해 하기 위해 유사한 마이그레이션 챔버에서 테스트 되었습니다9.
이민, 또는 diapedesis, 염증된 조직으로 명확한 감염에 건강한 선동적인 반응에 필수적인 과정10,11. 보이든 챔버, 트랜스이민 시스템, 또는 트랜스웰 장치는 일반적으로 다공성 멤브레인1,12에의해 분리된 2개의 챔버로 구성된다. 바닥 챔버는 가장 자주 관심의 케모카인을 포함하는 미디어를 보유하고, 백혈구는 상단 챔버에 배치되는 동안. 막 내의 기공의 크기는 관심 있는 세포의 크기에 기초하여 선택될 수 있다. 이 프로젝트의 경우, 우리는 림프세포의 크기가 7-20 μm이기 때문에 세포 발달 단계에 따라 3 μm 다공성 멤브레인을 선택했습니다. 이 기공 크기는 이 세포가 수동적으로 모공을 통해 떨어지는 것이 아니라 케모카인 구배에 반응하여 적극적으로 이동한다는 것을 보장합니다.
이 프로토콜의 주요 장점은 비용 효율성입니다. 생체 내 이주는 동물 취급 및 수술에 있는 광대한 훈련을 요구하기 때문에 어렵고, 수시로 연구원에게 항상 유효하지 않는 고성능 현미경 검사법을 관련시킵니다. 이주를 강화하거나 억제하기 위해 생각되는 화합물의 비용 효과적인 스크리닝은 생체 내 이미징에 앞서 달성될 수 있다. 트랜스이민 시스템은 엄격하게 조절되기 때문에, 세포는 트랜스웰 장치에 처음에 첨가된 후 처리될 수 있거나, 또는 그 반대의 경우도 마찬가지이며, 케모카인은 트랜스웰 장치에 첨가된 세포후 케모카인 억제제로 먼저 치료될 수 있다. 마지막으로, 내피 세포 및/또는 지하 막 단백질은 트랜스웰 삽입의 바닥에 첨가될 수 있다 1-2 화학학에서 이러한 장벽 세포의 참여를 이해하기 위해 이주 실험 1-2일 전에. 다시, 시스템의 이러한 조작은 생체 내 연구에서 보다 복잡한 연구에 앞서 주어진 화합물의 효과에 대한 중요한 정보를 결정하는 강력한 수단을 제공한다.
이주 챔버 시스템을 활용하는 것은 생체 내 및 체외 조건 하에서 다양한 림프구 이동성을 평가하는 효과적인방법(12,13,14)이다. 본 명세서에서, 우리는 트랜스이민 챔버에서 케모카인에 대한 생체 림프구 반응성을 평가하기 위한 최적화된 방법을 설명한다. 본 실시예 실험에서,CD4+ T 세포 및 그룹 2 선천성 림프성 세포(ILC2)는 OVA 알러지 유발 물질 노출 다음의 남성 및 여성, BALB/c 마우스로부터 분리되었다. 알레르겐 도전 마우스로부터 CCR4+ CD45+ 리니지-(LIN-) ILC2가 CCR4+ CD4+ T 도우미 세포보다 CCL17 및 CCL22로 보다 효율적으로 마이그레이션될 것이라는 가설이 생성되었다. CCL17 및 CCL22는 일반적으로 M2 (알레르기성) 표현형의 수지상 세포 및 대식세포에 의해 생성되는 케모카인이며, 다른 세포들 중에서, 알레르기15,16. CCL17 및 CCL22는 기도 악화 시 폐에서 쉽게 검출되기 때문에 알레르기 성 염증의 바이오마커로 생각될 수 있다16,17,18. 중요한 것은, CCR4 발현은 집 먼지 마이트 처리 동물로부터 분리된 ILC2로부터 생성된 생물정보학 데이터에서 밝혀진 바와 같이, 처리되지 않은 대조군과 비교하여 상승되고, 유사하게 ILC2는 IL-33으로 생체내 처리된 순진한 동물로부터 알레르겐 촉진 선천적 사이토카인) upregulates CCR419,20. 더욱이, 면역학적 게놈 프로젝트 데이터베이스(www.immgen.org)에서 ILC2에 대한 데이터에 따르면, CCR4 mRNA는 이들 선천적인 면역 세포에서 고도로 발현된다. 현재까지, 조직으로 ILC2의 인신 매매에 관하여 거의 알려져 있지 않습니다, 그러나 ILC2와 CD4+ T 세포는 유사한 전사 인자 및 수용체를 표현하기 때문에 화학요법과 화학요법을 위한 유사한 케모카인 및 수용체를 이용하기 위하여 확률이 높습니다. 따라서, 우리는 CCL17 대 CCL22 응답성, ILC2 및 CD4+ T 림프구, 남성과 여성 모두에서, OVA 도전 동물을 비교했다.
프로토콜
여기에 설명된 모든 방법은 네브래스카 대학 의료 센터(UNMC)와 유타 대학교의 기관 동물 관리 및 사용 위원회에 의해 검토되고 승인되었습니다.
1. 시약의 설치 및 준비
-
완전한 RPMI를 준비 (로스웰 공원 기념 연구소) 미디어.
- RPMI 의 90 mL에 열 불활성화 태아 소 혈청 (FBS)의 10 mL를 추가합니다.
- 100x 페니실린-스트렙토마이신-글루타민 1mL를 100 mL의 10% FBS RPMI에 추가합니다.
-
ILC2 확장 미디어를 준비합니다.
- 완전한 RPMI의 10 mL에 IL-2 및 IL-33 (각 사이토카인 20 ng/mL)을 추가합니다.
- 스톡 사이토카인이 10 μg/mL인 경우, 파이펫 20 μL의 IL-2 및 IL-33을 완전한 RPMI 매질 10 mL을 포함하는 15 mL 튜브에 넣습니다.
-
폐 해리 매체를 준비하십시오.
- 보충되지 않은 RPMI 250 mL에 1형 콜라게나아제 50 mg을 넣으세요.
- 1.3.1 단계에서 250 mL의 미디어에 100 x 페니실린 - 스트렙토 마이신 - 글루타민의 2.5 mL를 추가하십시오.
- 1형 콜라게나아제는 사용하기 전에 완전히 용해되도록 용지를 부드럽게 섞으세요.
-
세럼 프리 RPMI를 준비하십시오.
- RPMI의 200 mL에서 동독 소 혈청 알부민 (BSA)의 1 g을 희석.
- 페니실린-스트렙토마이신-글루타민 2 mL을 추가합니다.
- BSA가 사용하기 전에 미디어에 완전히 용해되도록 미디어를 부드럽게 혼합합니다.
-
CCL17을 통해 마이그레이션 미디어를 준비합니다.
- 10 mL의 무혈청 RPMI를 획득하고 CCL17 [50 ng/mL]을 추가합니다.
- 재고 CCL17이 10 μg/mL인 경우, 50 μL의 CCL17 스톡을 10 mL의 무혈청 RPMI 미디어에 추가합니다.
- 10 mL의 무혈청 RPMI를 획득하고 CCL17 [50 ng/mL]을 추가합니다.
-
CCL22를 통해 마이그레이션 미디어를 준비합니다.
- 10 mL의 무혈청 RPMI를 획득하고 CCL22 [50 ng/mL]를 추가합니다.
- 재고 CCL22가 10 μg/mL인 경우, 50 μL의 CCL22 스톡을 10 mL의 무혈청 RPMI 미디어에 추가합니다.
-
CCR4 항체 염색 칵테일을 준비합니다.
- 총 10개의 시험을 위해, 5 mL 관에 다음 항체각각의 5 μL을 추가합니다: 반대로 마우스 CCR4, CD19, CD11b, CD45, ST2 및 ICOS.
참고: 10개의 샘플에 대한 항체 칵테일을 만드는 방법의 예: 각 항체의 0.5 μL x 10 샘플 = 1.7.1에 열거된 각 항체의 5 μL. - 총 10개의 시험을 위해, 단계 1.7.1에서 항체 칵테일에 다음 항체의 2.5 μL을 추가합니다: 항마우스 CD3, CD11c 및 NK1.1.
참고: 10개의 샘플에 대한 항체 칵테일을 완성하는 예: 0.25 μL x 10 샘플 = CD3, CD11c 및 NK1.1 항체의 2.5 μL. - CCR4 항체 염색 칵테일을 시료에 첨가할 준비가 될 때까지 4°C에서 보관합니다. 사용하지 않을 경우 1주일 후에 항체 칵테일을 버리십시오.
- 총 10개의 시험을 위해, 5 mL 관에 다음 항체각각의 5 μL을 추가합니다: 반대로 마우스 CCR4, CD19, CD11b, CD45, ST2 및 ICOS.
-
안정화 고정제를 1회 준비합니다.
- 탈이온 증류수 10 mL을 3x 안정화 고정 농축액 5 mL에 추가
2. 알레르겐 도전 BALB /c 마우스의 준비
참고: 남성과 여성 BALB/c 마우스는 찰스 리버 (UNMC) 또는 잭슨 연구소 (유타 대학교)에서 구입 했다 6 받는 여자 나이의 주.
-
적응 후 (1 주), OVA에 모든 동물을 민감하게.
- 100 μg/mL OVA를 5 mL 폴리스티렌 튜브에 알루미늄 수산화물(20 mg/mL)에 흡착합니다.
- 튜브를 혼합하고 즉시 OVA-명반 현탁액의 500 μL을 1 mL, 28 G 주사기(인슐린 주사기)로 그립니다.
- 이소플루란이 들어있는 벨 항아리에 마우스를 놓습니다(1-2 mL의 거짓 바닥 아래에 동물이 이소플루란에 직접 서 있지 않도록). 마우스가 약 1-2 분 동안 또는 호흡 속도가 떨어질 때까지 마취하에 갈 수 있도록하십시오.
- 신속하게 등과 어깨에 모피에 의해 마우스를 선택하고 마우스 당 100 μL의 OVA-명반 을 주사21,22.
- 마우스를 케이지에 다시 놓고 기동성을 되찾을 수 있도록 감시하십시오. 이는 2-5분 이내에 발생합니다.
-
과민화 7일 후, 모든 동물을 비강 내(i.n.) 1.5% OVA를 분무기실(Data Sciences International)에서 멸균 식염수로 20분 동안 희석하였다.
- 새장에서 마우스를 제거하고 동물 성운 챔버에 놓습니다. 챔버의 뚜껑을 닫습니다.
- 분무기 호스를 분무기 챔버의 입력 주전자에 부착합니다.
- 분무기의 분무기 컵에 멸균 식염수로 희석된 1.5% OVA의 30 mL를 추가합니다.
- 분무기를 켜고 챔버가 20 분 동안 안개로 채워지도록하십시오.
- 분무기를 끄고 안개가 가라앉게 하십시오.
- 동물을 케이지로 되돌려 놓습니다.
- 5일 연속으로 총 5회 동안 2.2단계를 반복하여 알레르기 염증을 유발합니다.
3. OVA 도전 마우스의 비장 과 폐에서 CD4+ T 세포의 격리
- 실험당 그룹당 2~3마리의 동물을 사용하여 승인된 IACUC 프로토콜에 따라CO2 질식에 의해 모든 OVA 처리된 수컷 및 암컷 동물을 인도적으로 안락사시한다.
- 동물로부터 폐및 비장을 절제하고동물(23)의조직 유형 및 성별에 기초하여 별도의 해리관에 조직을 배치한다.
- 폐 해리 매체의 500 μL에서 폐 조직을 해리 (25 U/mL; 콜라게나제, 타입 1)는 '폐' 프로토콜을 사용하여 자동화된 조직 해리된다.
- 총 3.2번과 3.3을 두 번 반복합니다.
- 자동화된 조직 해리에 '비장' 프로토콜을 사용하여 완전한 RPMI 매체의 500 μL에서 비장 조직을 해리한다.
참고: 나머지 단계는 멸균 기술을 사용하여 생물학적 안전 캐비닛에서 수행해야합니다. - 폐 및 비장을 함유하는 해리 튜브를 각각 5 mL의 추가 폐 해리 매 또는 Complete RPMI로 헹구십시오.
- 40 μm 세포 스트레이너를 통해 셀 현탁액을 걸레질하고 50 mL 원엽 튜브로 수집합니다.
- 폐 균질배관은 37°C 인큐베이터에서 15-30분 동안 배양하고 5%CO2를 사용하여 폐 조직을 추가로 해리한다.
- 원심분리를 사용하여 50 mL 튜브의 바닥에 있는 세포를 폐 및 비장 균질제 및 펠릿에 5 mL의 완전한 RPMI를 첨가하는 단계; 실온(RT)에서 378 x g378 g(5분)
- 비장세포와 폐 세포를 단일 50 mL 원엽 튜브에 결합하고 자동화된 세포 카운터를 사용하여 총 세포 수를 결정합니다.
- 분리 버퍼에서 수컷 및 암컷 세포 현탁액을 1 x 108 셀/mL로 조정하고 5 mL 폴리스티렌 튜브에 추가합니다.
참고: 농축 프로토콜은 비장과 폐에서 더 많은 세포를 획득 할 때 14 mL 폴리스티렌 튜브까지 조정할 수 있습니다. 이 프로토콜은 그룹당 2-3마우스의 조직을 위해 고안되었습니다. 따라서 5 mL 튜브로 충분합니다. - ILC2 농축 프로토콜에 따라 ILC2 격리를 위해 전체 셀의 약 3분의 2를 사용합니다.
- 항체 칵테일 (50 μL / mL)을 세포 현탁액에 넣고 RT에서 5 분 동안 배양하십시오.
- 30 s의 소용돌이 빠른 구체및 세포 현탁액의 75 μL/mL의 속도로 샘플에 추가한다. RT에서 5분간 부드럽게 섞고 배양합니다.
- 분리 버퍼로 최대 3 mL의 튜브를 맨 위에 놓고 8 챔버 쉬운 분리 자석에 놓습니다. RT에서 3 분 동안 인큐베이션하십시오.
- 자석을 앞으로 팁 (튜브의 뒤쪽에 부착 된 구체 - 항체 세포 복합체에서 멀리) 및 깨끗한 5 mL 튜브로 세포 현탁액을 피펫.
- RT에서 5분 동안 튜브와 원심분리기에 1.5mL의 완전한 RPMI를 추가합니다.
- 세포 펠릿에서 매체를 붓고 mL당 1 x 107 셀에서 ILC2를 다시 일시 중단합니다.
- U-bottom, 96웰 플레이트에 수컷 및 암컷 ILC2 100 uL을 놓고 각 웰에 ILC2 확장 용지 100 μL을 추가합니다.
- ILC2를 확장하기 위해 4-5일 동안 세포를 배양합니다.
- ILC2를 5 mL 튜브에 넣고 최대 4.5 mL의 무혈청 RPMI를 추가합니다. RT에서 5 분 동안 378 x g의 세포를 원심 분리합니다.
- 혈청계를 사용하여 세포를 카운트하고 혈청이없는 RPMI에서 mL 당 1 x 107 ILC2에서 다시 일시 중단하십시오.
- 마우스CD4+ T 세포 분리 프로토콜에 따라 몇 가지 변형으로 수행되는CD4+ T 세포 분리 프로시저에 대해 나머지 세포를 사용한다.
- CD4 T 세포 농축 현탁액에 쥐 혈청(50 μL/mL)을 첨가합니다.
- 시료에 분리 칵테일(50 μL/mL)을 넣고 RT에서 10분 동안 배양합니다.
- 30 s의 소용돌이 빠른 구체와 75 μL / mL의 속도로 샘플에 추가합니다.
- 셀 서스펜션을 부드럽게 혼합하고 2.5 분 동안 배양하고 RT
- 샘플을 최대 3 mL까지 올려 놓고 5 mL 튜브를 8 챔버 쉬운 분리 자석에 넣고 RT에서 5 분 동안 배양하십시오.
- 자석을 앞으로 팁하고 셀 서스펜션을 깨끗한 5 mL 튜브에 파이펫하십시오.
- 1.5 mL의 무혈청 RPMI를 튜브와 원심분리기를 RT에서 5분 동안 378 x g으로 추가합니다.
- 세포 펠릿에서 미디어를 붓고 혈청이없는 RPMI에서 mL 당 1 x 107 셀에서 CD4+ T 세포를 다시 중단하십시오.
4. 유세포측정에 의한 OVA 도전 동물로부터 CD4+ T 세포 및 그룹 2 선천 림프세포(ILC2)에 대한 CCR4 발현 결정
참고: 다음 단계는 비멸균 기술이기 때문에 개방형 벤치 상판에서 수행될 수 있다.
-
단계 3.11.10 및 1-2.5 x 106 CD4+ T 셀로부터 별도의 5 mL 튜브에서 약 1-2.5 x 105 ILC2 셀을 획득합니다.
- 적어도 5.0 x 10 4CD4+ T 세포의 추가 튜브를 스테인드되지 않은 대조군으로 유지하십시오.
- FACS 완충제의 100-200 μL에서 세포를 중단하고 모든 튜브에 Fc Block 1 μL을 추가한 다음 얼음 (또는 4 °C 냉장고)에서 10 분 동안 배양하십시오.
- 모든 튜브와 원심분리기에 1-2mL의 FACS 버퍼를 넣고 RT에서 5분 동안 378 x g으로 추가합니다.
- 상급체를 붓고 FACS 버퍼의 100-200 μL에서 세포를 다시 중단하십시오.
- CCR4 항체 염색 칵테일의 37.5 μL을 '얼룩지지 않은' 세포를 함유하는 튜브를 제외한 모든 튜브의 세포 현탁액에 첨가합니다.
- 튜브를 얼음 이나 4 °C 냉장고에서 20-30 분 동안 배양하십시오.
- 모든 튜브와 원심분리기에 1-2mL의 FACS 버퍼를 넣고 RT에서 5분 동안 378 x g으로 추가합니다.
- 상급물을 붓습니다.
- 4.7 단계와 4.8단계를 반복합니다.
- 모든 튜브에 250-300 μL의 1x 안정화 고정제를 추가합니다(재료 표참조).
-
보상 비드와 함께 제공되는 프로토콜에 따라 CCR4 항체 칵테일의 각 항체에 대한 단색 비드 제어를 준비한다.
- 보상금 구슬을 소용돌이.
- 각 단일 색상 제어 튜브에 구슬 한 방울을 추가합니다.
- CCR4 항체 칵테일에 각 항체의 1 μL을 자체 표지 된 튜브에 추가하십시오.
- 4°C 냉장고 나 얼음에 10 분 동안 부드럽게 섞어서 배양하십시오.
- 모든 튜브와 원심분리기에 1-2mL의 FACS 버퍼를 넣고 RT에서 5분 동안 378 x g으로 추가합니다.
- 상급물을 붓고 FACS 버퍼의 200 μL에서 구슬을 다시 일시 중단하십시오.
- 모든 시료가 염색되고 유동 세포계에서 분석할 준비가 될 때까지 단색 컨트롤을 냉장 보관하십시오.
- 24시간 이내에 유동 세포계에서 얼룩지지 않은 세포, 단색 대조군 및 실험 샘플을 분석합니다.
5. 전 비보 이주 절차
참고: 다음 단계는 멸균 기술이 필요하므로 생물학적 안전 캐비닛에서 수행해야합니다.
- 3.11.10 단계 및 CD4 T 세포로부터 ILC2를 3.12.8 단계에서 획득하고 실험에 필요한 트랜스웰 인서트 수를 결정합니다.
참고: 예: 3.12.8단계에서 농축된 CD4 T 세포의 1.2 mL의 경우, 1.2 x 1,000 μL = 1,200 μL곱; 그런 다음 1,200 uL을 100 μL = 12로 나누고, CD4 T 트랜스마이그레이션에 필요한 인서트 수를 나눕니다. - 3 μm 트랜스웰 인서트를 24웰 플레이트의 중간 열에서 부드럽게 이동합니다.
- CCL17이 있는 마이그레이션 미디어 500μL을 우물의 약 1/3에 추가합니다.
- CCL22가 있는 마이그레이션 미디어 500μL을 우물의 3분의 1에 추가합니다.
- 500 μL의 무혈청 RPMI를 첨가하여 케모카인을 함유하지 않은 후 마지막 1/3웰에 넣습니다.
- 플레이트의 뚜껑에 적절한 이주 용지를 바닥 우물에 배치하여 명확하게 라벨을 붙입니다.
- 트랜스웰 인서트를 다양한 트리트먼트를 포함하는 웰에 다시 넣습니다.
- 각 인서트의 상단 웰에 CD4 T 세포 또는 ILC2 100 μL을 부드럽게 추가합니다. 트랜스웰에서 세포 현탁액을 위아래로 혼합하거나 피펫하지 마십시오.
- 플레이트 뚜껑에 각 우물에 배치된 세포 유형에 명확하게 라벨을 붙이고 세포가 첨가된 날짜와 시간을 기록합니다.
- 모든 세포가 트랜스웰 인서트에 미디어가 있는 곳에 배치될 때까지 5.2에서 5.9 단계를 반복합니다.
- 플레이트를 37°C 인큐베이터에 5%CO2로 48시간 동안 부드럽게 놓습니다.
6. 전 비보 트랜스이민의 정량화
- 부드럽게 인큐베이터에서 플레이트를 제거하고 바로 위 또는 아래 빈 우물에 중간 행에서 모든 트랜스 웰 삽입을 제거합니다.
- CCL17, CCL22 또는 미디어를 통해 셀 유형및 복제 수(실험당 최소 3개 복제)를 가진 상단 또는 하단으로 표지된 튜브에 트랜스웰 삽입의 하단 및 상단 웰에서 셀을 수집합니다.
- 1x PBS의 500 μL로 바닥 우물을 헹구고 이 헹구를 해당 튜브로 수집합니다.
- 1x PBS의 250 μL로 상단 우물을 헹구고 이 헹구를 해당 튜브로 수집합니다.
- RT에서 5 분 동안 378 x g에서 원심 분리에 의해 세포를 펠렛.
- 셀 펠릿의 모든 상급물질에서 부드럽게 피펫을 피펫으로 제거합니다.
- T 세포와 ILC2를 1x PBS의 50 μL로 다시 중단합니다.
- 셀 현탁액의 10 μL을 취하고 0.4% 트라이판 블루의 90 μL에 추가하십시오.
-
자동화된 셀 카운터의 셀을 계산합니다.
- %실행 가능성을 기록합니다.
- 각 샘플에 대한 mL당 셀 수를 기록합니다.
- 상부 및 하부 챔버에서 치료당 총 세포 수를 결정; 셀 수를 기록합니다.
결과
CD4+ T 세포 및 ILC2에 대한 CCR4 발현.
생체 내 이민 실험의 성공을 위해, 림프구가 CCR4를 통해 CCL17 및 CCL22에 반응하는지 여부를 결정하는 것이 필수적이다; 따라서, 우리는 유세포측정에 의한CD4+ T 세포 및 ILC2 둘 다에 CCR4 발현을 결정하였다. OVA 특이적CD4+ 도우미 T 세포가 CCR4를 발현하는 것은 잘 알려져 있지만, 덜 ILC2상에서 CCR4의 발현이 알려져 있다. 도 1은 CD4+ T세포(도 1A, C)및 ILC2(도1B,D)에서의 CCR4 발현의 대표적인 결과를 수컷 및 암컷, OVA 도전 BALB/c 마우스로부터 나타낸다. 유세포측정을 사용하여 알로피코시아닌(APC)에 공액화된 단일클론 항체를 사용하여 CCR4를 검출하였다. 편도 차이 분석(ANOVA)을 사용하여, 우리는 남성과 여성 호스트 사이의 CCR4 발현에 차이가없음을결정했습니다(그림 1A-D),그러나, ILC2에 대한 세포별(MFI)에 대한 CCR4의 발현은 CD4에 비해 더 높았습니다. + T 세포 (도 1D에비해도 1C). 이러한 결과는 다음 실험에서 ILC2 및CD4+ T 세포가 CCL17 및 CCL22에 반응해야 한다는 것을 보여주는 데 중요하다.
트랜스이민 시스템의 상부 및 하부 챔버에서 CCR4 리간드에 대한CD4+ T 셀의 응답성.
CD4+ T 세포로부터의 수컷, OVA 도전BALB/c 마우스는 폐 및 비장으로부터 분리하고 3 μM 다공성 멤브레인으로 분리된 이주 장치의 상부 챔버에 두었다(도2). OVA 처리된 마우스의 생체내 제제(도2A)및 이주 절차(도2B)의요약은 참조용으로 도시된다. CCL17 (25 ng/mL) 및 CCL22 (25 ng/mL)의 조합은 상단 챔버에 배치되었고, 상부 챔버 또는 상부 및 하부 챔버 둘 다확인(도2C),(1) OVA 도전 동물의 CD4+ T 세포가 CCR4에 반응하였다. 리간드, 및 (2) 그 케모카인 유도 이동은 T 세포가 케모카인 구이션에 반응하여 기공을 통해 이동하는 활성 과정이었고, 림프구는 케모카인과 무관하게 모공을 통해 이동하지 않았다. CD4+ T 세포가 자극 없이 3 μM 기공을 통해 이동될 수 없음을 보여주기 위해 미디어(No Chemokine) 대조군이 포함되었다. 이 조건에서, 세포의 가장 높은 비율은 상단 챔버에 남아 있었다. 케모카인을 상부 및 하부 챔버에 동시에 배치했을 때, 우리는 하단 챔버의 총 T 세포의 52 %와 상단 챔버의 세포의 48 %를 검출했습니다 (TOP / BOTTOM 치료). 예상대로, 세포의 분포는 우리가 케모카인이 존재하는 구획에 있는 세포의 가장 높은 백분율을 검출했기 때문에, 상부 또는 단지 하단 챔버에만 배치된 케모카인에 반응하여 이동했습니다.
전 생체 이주 장치에서CD4+ T 세포 및 ILC2에서 CCL17 및 CCL22의 반응성.
CD4 T 세포 및 ILC2를 수컷 및 암컷으로부터, OVA 도전마우스로부터 폐 및 비장으로부터 분리한 다음 트랜스웰 트랜스이민 장치의 상부 챔버에두었다(그림 3). 장치의 하부 챔버는 처리되지 않은 세포 배양 배지, CCL17을 함유하는 배지, 또는 CCL22를 함유하는 배지로 채워졌다. 대표적인 결과에 따르면 14% 미만(13.37 + 6.5%) 미디어 제어 조건에서 마이그레이션된 셀의경우(그림 3A-D). CCL22에 응하여, 두 세포 모형은, 남성 또는 여성 호스트에서 이었다는 것을, CCL22(그림 3A-D)에반응했습니다, 그러나, CCL17를 위한 결과는 보다 적게 일관되지 않았습니다. CCL17은 단독 미디어에 비해 여성 CD4 T 세포 및 ILC2에 대한 유의한 이동만 유도하였다(도3C,D). CCL17 치료는 수컷CD4+ T 세포 또는 수컷 ILC2에 대한 미디어와 다르지 않았다(도3A, B),및 CCL22는 수컷 ILC2에서 CCL17보다 더 큰 이동을 유도하였다(도2B).
생존율이 낮은 CD4+ T 셀에 대한 최적이 아닌 마이그레이션 결과.
최적이 아닌 결과는 연구자에게 이주 실험이 제대로 작동하지 않을 때 무엇을 기대해야 하는지의 예를 제공하기 위해 생성되었다(그림4). 우리는 이 프로토콜에 따라 동물로부터 수컷 CD4+ T 세포를 분리하고 이민 시스템의 상단 우물에 배치했습니다. CD4+ T 세포를 첨가한 후, 플레이트는 처음 24시간 동안 실온에서 유지된 후, 플레이트를 인큐베이터 내로 이동하여 잠복기의 나머지 24시간 동안 인큐베이터로 옮겼다. 당연히 CCL17 및 CCL22(그림4A)로의이동이 감지되지 않았으며 세포의 생존가능성은 현저하게 낮았습니다(<15%). 위쪽의 셀에 대해(그림 4B). 이러한 결함이 있는 결과는 최적의 결과를 얻기 위해 이 프로토콜에 자세히 설명된 올바른 온도 및 조건을 사용하는 것의 중요성을 강조합니다.
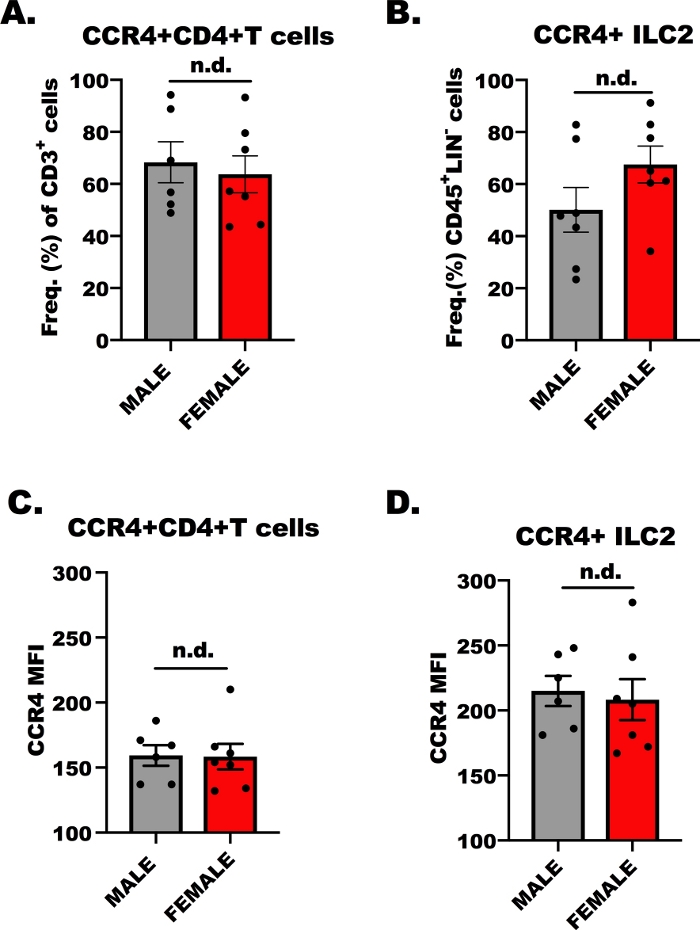
도 1:CD4+ T 세포 및 ILC2에 대한 CCR4 발현. 7~ 9주령, 수컷 및 암컷, BALB/c 마우스를 1회 1회 주입하여 100 μL의 OVA-흡착된 알루미늄 수산화물(500 μg/mL; OVA 및 20 mg/mL 알루미늄 수산화물) 7 일 전에 첫 번째 5, 반복적인, 매일 기도 도전 과 1.5% 식염수에 OVA. 알레르겐 에 도전한 동물은 인간적으로 안락사되었고, 폐 및 비장 조직은 ILC2 및CD4+ T 세포 격리를 위해 수집되었다. 세포의 작은 aliquot는 그 때 각 세포 모형에 CCR4의 수준을 결정하기 위하여 유세포 측정에 의해 염색되고 분석되었습니다. (a)CD4+ T 세포의 빈도는OVA+ 마우스에서 CCR4+이며, 여기서 오차 막대는 평균의 표준 오차를 나타낸다(+ SEM). (B)CCR4 +(+SEM)인 ILC2의 빈도입니다. (C, D) CCR4의 평균 형광 강도(+SEM)는(C)CD4+ T 세포 및(D)ILC2에 관한 것이다. 총 13마리의 마우스를 사용하여 이들 데이터를 생성하고, 유동 실험을 2회 반복하였고, 실험당 각 치료법의 3개의 복제본을 가지고 있었다. 유의는 단방향 ANOVA에 의해 결정되었다; n.d. 그룹 간에 차이가 없음을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 트랜스이민 시스템의 상부 및 하부 챔버에서 CCR4 리간드에 대한CD4+ T 셀의 응답성. 수컷 BALB/c 마우스를 민감화하고 닭 계란 ovalbumin (OVA) 및 CD4+ T 세포로 도전하고 비장 및 폐로부터 분리하였다(A, B). 이 이주 실험을 위해,CD4+ T 세포는 1 x 107 세포/mL에서 무혈청 매질에 중단되었다. CCL17 및 CCL22는 50 ng/mL의 농도로 무혈청 매체에 첨가하였다(총 50 ng/mL을 달성하기 위해 각 케모카인의 25 ng/mL). 케모카인 함유 매체는 상부 챔버에만, 하부 챔버에만, 또는 상부 및 하부 챔버 모두에 첨가되었다. 총 부피 500 μL의 이주 매체를 하단 웰에 첨가하고 100 μL의 셀룰러 현탁액(1 x 106 세포/웰)을 상부 웰에 첨가하였다. 이주는배양(C)에서48시간 후에 측정되었다. 이들 데이터는 단일 실험에서 생성되었고, 3OVA 처리, 수컷 마우스를 조직 수집에 사용하였고, 3개의 복제본을 치료당 이루어졌다. 통계적 유의는 단방향 ANOVA에 의해 결정되었다; *p < 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
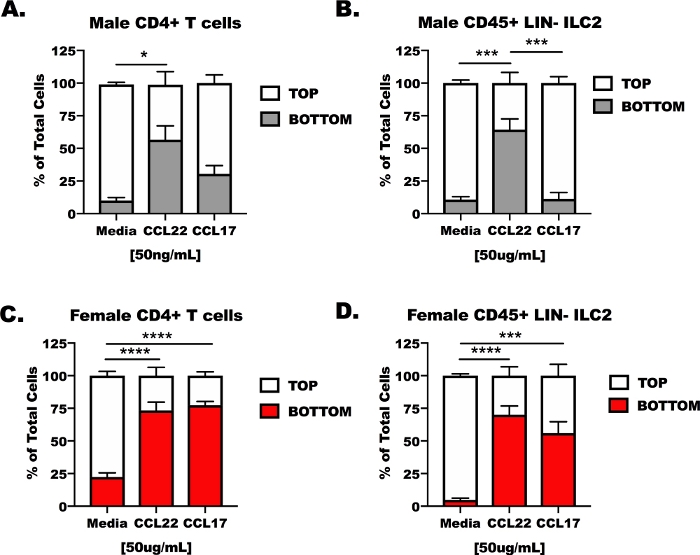
도 3: 전 생체 내 트랜스이민 장치에서 CD4+ T 세포 및 ILC2에서 CCL17 및 CCL22의 응답성. 마우스는CD4+ T 세포 및 비장 및 폐로부터의 ILC2 분리에 대해 도 1에서와 같이 제조하였다. CD4+ T 세포 및 ILC2는 1 x 107 세포/mL에서 무혈청 매질에 부유하였다. CCL17 또는 CCL22는 50 ng/mL의 농도에서 무혈청 매체에 첨가되었다. 500 μL의 이주 매체를 바닥 웰에 첨가하고 100 μL의 셀룰러 현탁액(1 x 106 세포/웰)을 상부웰에 첨가하였다. 이주는 배양에서 48시간 후에 측정되었다. (a)CD4+ T 세포 및(B)남성 숙숙자로부터의 ILC2를 대조군으로, CCL17, 또는 CCL22로 매개체로 처리하였다. 유사하게,(C)암CD4+ T 세포 및(D)암컷 ILC2를 매체, CCL17, 또는 CCL22로 처리하였다. 총 14마리의 마우스를 사용하여 이러한 데이터를 생성하였다. 이주 실험을 4회 반복하였고, 실험당 각 치료법의 3-6회 복제를 반복하였다. 유의는 단방향 ANOVA에 의해 결정되었다; *p < 0.05, ***p < 0.001, ****p < 0.0001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 생존율이 낮은 CD4 T 셀에 대한 최적이 아닌 마이그레이션 결과입니다. Naïve 남성 BALB/c 마우스는 도 1,도 2,및 도 3에서와같이 폐 및 비장 조직 수집 및CD4+ T 세포 격리를 위해 획득하였다. CD4 T 세포를 CCL17, CCL22 또는 무케모카인(media control)을 함유하는 트랜스이민 장치 및 무혈청 매물의 상부 챔버에 첨가하였고, 바닥웰에 첨가하였다. 실험의 처음 24h에 대해 플레이트를 실온에 방치한 후, 추가24h(A) 24h(B) 후 상부및 하부 웰에 남아 있는 세포의 백분율에 대해5%CO2를 가진 37°C 인큐베이터로 이동하였다. 가난한 배양 조건에 따라 상부 및 하부 챔버의 D4+ T 세포. 이들 데이터는 단일 실험에서 생성되었고, 3개의 순진한 수컷 마우스를 조직 수집에 사용하였고, 3개의 복제본은 치료당 이루어졌다. 통계적 유의는 결정되지 않았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
본 명세서에서, 우리는 생체 내 트랜스이민 시스템에서 림프구의 케모카인 유도 이동을 평가하기 위한 잘 확립된 방법을 제시한다. 프로토콜에는 몇 가지 중요한 단계가 있으며, 그 중 첫 번째는 실험에서 면역 세포에 대한 올바른 케모카인 수용체의 발현을 확인하는 것입니다. 우리의 손에, 우리는 알레르기성 염증에 있는 Th2 도우미 T 세포에 CCR4의 중요성을 강조하는 문헌의 바디 때문에 CCR4를 선택했습니다. Ovalbumin-유도염증은 이전에 적어도 2개의 CCR4길항제(24,25)에의해 제한되는 것으로 나타났다; 그러나, 이것은 그룹 2선천성 림프세포(ILC2)26,27의발견 이전에 있었다. 우리는 ILC2 세포가 CD4+ T 세포보다 더 높은 CCR4를 발현하고 이 세포가 CCL22에 일관되게 반응한다는 것을 보여주는 새로운 데이터를 생성했습니다.
프로토콜에서 따라야 할 두 번째 중요한 단계는 프로토콜의 마이그레이션 부분을 시작하기 전에 세포가 배양을 위한 최적의 배지에 보관되도록 하는 것입니다. ILC2의 경우, IL-2와 IL-33을 모두 포함하는 ILC2 확장 배지에서 이들 세포를 배양해야 했습니다. IL-2 및 IL-7은 모두 문헌에서 ILC2를 최대 14일 동안 배양하도록28,29까지보고된다. 향후 실험에서CD4+ T 세포 및 ILC2에 대한 생존가능성이 문제가 된다면, IL-2 또는 IL-7을 첨가하면 실험의 종점까지 림프구의 생존이 향상될 가능성이 높다. 본 원에 제시된 각각의 매체는 여러 실험의 과정을 통해 정의되었고, 이 프로토콜14,30,31에서사용하기 위해 최적화되었다. 그림 4에서는적절한 온도와 5 %CO2의인큐베이터 사용의 중요성을 입증하기 위해 잘못된 결과를 제시했습니다. 이주가 방해받지 않는 인큐베이터에 트랜스머이 플레이트를 보관하는 것은 프로토콜의 성공을 위한 또 다른 중요한 단계입니다.
앞서 언급했듯이, 대부분의 기관에서 사용할 수 있는 생체 내 현미경 검사법을 사용하는 이점이 있지만, 생체 내 이미징은 시간이 많이 걸리고 비용이 많이 들 수 있습니다. 비용이 적게 드는 대체 실험 절차는 화학질 그라데이션과 조합하여 미세 유체학적을 사용하여 백혈구 외설 및 조직 이동을 이해하기 위해32,33,34를사용한다. 이 시스템은 미세 유체 시스템의 모세 혈관에 성장 할 수있는 내피 세포를 포함하는 세포 역학의 복잡성을 평가하기 때문에 과학적 가치를 보유합니다. 더욱이, 이러한 미세 유체 시스템은 혈류하에서 세포 준수 과정에서 내피 세포및 면역 세포에 대한 내피 세포 및 인테그린에 부착 단백질(예를 들어, E-cadherin)의 중요성을 평가한다. 그럼에도 불구하고 이러한 시스템은 각 처리 조건의 중요성을 결정하기 위해 특수 장비와 복잡한 계산 프로그래밍 및 통계가 필요합니다. 따라서, 여기에 제시된 이민 방법의 한계는 본질적으로 인위적이라는 것이지만, 후속 생체 내 방법에서 불필요한 시약의 낭비를 제한하는 중요한 스크리닝 도구로 사용될 수 있다. 이 방법의 중요성은 ILC2의 경우와 같이 새로운 세포가 발견됨에 따라 알려진 케모카인에 대한 반응성을 위해 이러한 세포를 스크리밍할 수 있다는 것입니다. 이것은 천식 악화 도중 폐로 그들의 이주를 억제할 수 있는 ILC2 그리고 잠재적인 치료를 관련시키는 미래 응용의 한개입니다. 이 이민 프로토콜은 ILC2 모집에 관여하는 CCR4 또는 그밖 화학 물질 중재자를 제한하기 위하여 이용될 수 있는 각종 억제제를 검열하기 위하여 이용될 것입니다. 전부, 이 ex vivo 마이그레이션 프로토콜은 생체 내 실험에서 미래의 검증될 수 있는 중요한 데이터의 생성으로 이끌어 낼 것입니다.
공개
저자는 공개할 재정적 공개 나 이해 상충이 없습니다.
감사의 말
이 작품은 미국 폐 협회 (K.J.W.), T.A.W.와 K.J.W.에 수여 된 기념 유진 케니 기금, K.J.W.에 대한 유타 대학의 관대 한 창업 지원, T.A.W.에 재향 군인 업무 상 (VA I01BX003335)에 의해 지원되었다. T.A.W.는 재향 군인 국무부에서 연구 경력 과학자 상 (IK6 BX003781)의 수상자입니다. 저자는 리사 추도멜카 씨의 편집 지원을 인정하고 자합니다. 저자는 이 원고에 대해 생성된 유세포분석 데이터를 수집하는 데 도움을 준 UNMC 흐름 세포분석 코어에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Sigma-Aldrich | 15250061 | |
| 1 mL syringe | BD Bioscience | 329424 | U-100 Syringes Micro-Fine 28 G 1/2" 1cc |
| 100x Penicillin-Streptomycin, L-Glutamine | Gibco | 10378-016 | Dilute to 1x in RPMI media |
| 15 mL conical tubes | Olympus Plastics | 28-101 | polypropylene tubes |
| 3 μm transwell inserts | Genesee Scientific | 25-288 | 24-well plate containing 12 transwell inserts |
| 3x stabilizing fixative | BD Pharmigen | 338036 | Prepare 1x solution according to manufacturers protocol |
| 5 mL polystyrene tubes | STEM Cell Technologies | 38007 | |
| 50 mL conical tubes | Olympus Plastics | 28-106 | polypropylene tubes |
| 8-chamber easy separation magnet | STEM Cell Technologies | 18103 | |
| ACK Lysing Buffer | Life Technologies Corporation | A1049201 | |
| Advanced cell strainer, 40 μm | Genesee Scientific | 25-375 | nylon mesh, 40 μm strainers |
| Aluminum Hydroxide, Reagent Grade | Sigma-Aldrich | 239186-25G | 20 mg/mL |
| anti-mouse CCR4; APC-conjugated | Biolegend | 131211 | 0.5 μg/test |
| anti-mouse CD11b | BD Pharmigen | 557396 | 0.5 μg/test |
| anti-mouse CD11c; PE eFluor 610 | Thermo-Fischer Scientific | 61-0114-82 | 0.25 μg/test |
| anti-mouse CD16/32, Fc block | BD Pharmigen | 553141 | 0.5 μg/test |
| anti-mouse CD19; APC-eFluor 780 conjugated | Thermo-Fischer Scientific | 47-0193-82 | 0.5 μg/test |
| anti-mouse CD3; PE Cy 7-conjugated | BD Pharmigen | 552774 | 0.25 μg/test |
| anti-mouse CD45; PE conjugated | BD Pharmigen | 56087 | 0.5 μg/test |
| anti-mouse ICOS (CD278) | BD Pharmigen | 564070 | 0.5 μg/test |
| anti-mouse NK1.1 (CD161); FITC-conjugated | BD Pharmigen | 553164 | 0.25 μg/test |
| anti-mouse ST2 (IL-33R); PerCP Cy5.5 conjugated | Biolegend | 145311 | 0.5 μg/test |
| Automated Cell Counter | BIORAD | 1450102 | |
| Automated Dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| Bovine Serum Albumin, Lyophilized Powder | Sigma-Aldrich | A2153-10G | 0.5% in serum-free RPMI |
| Cell Counter Clides | BIORAD | 1450015 | |
| Chicken Egg Ovalbumin, Grade V | Sigma-Aldrich | A5503-10G | 500 μg/mL |
| Collagenase, Type 1, Filtered | Worthington Biochemical Corporation | CLSS-1, purchase as 5 X 50 mg vials (LS004216) | 25 U/mL in RPMI |
| Compensation beads | Affymetrix | 01-1111-41 | 1 drop per contol tube |
| Dissociation Tubes | MACS Miltenyi Biotec | 130-096-335 | |
| FACS Buffer | BD Pharmigen | 554657 | 1x PBS + 2% FBS, w/ sodium azide; stored at 4 °C |
| Heat Inactivated-FBS | Genesee Scientific | 25-525H | 10% in complete RPMI & ILC2 Expansion Media |
| Mouse CCL17 | GenScript | Z02954-20 | 50 ng/mL |
| Mouse CCL22 | GenScript | Z02856-20 | 50 ng/mL |
| Mouse CD4+ T cell enrichment kit | STEM Cell Technologies | 19852 | |
| Mouse IL-2 | GenScript | Z02764-20 | 20 ng/mL |
| Mouse ILC2 enrichment kit | STEM Cell Technologies | 19842 | |
| Mouse recombinant IL-33 | STEM Cell Technologies | 78044 | 20 ng/mL |
| RPMI | Life Technologies Corporation | 22400071 | |
| Separation Buffer | STEM Cell Technologies | 20144 | 1x PBS + 2% FBS; stored at 4 °C |
| Small animal nebulizer and chamber | Data Sciences International | ||
| Sterile saline | Baxter | 2F7124; NDC 0338-0048-04 | 0.9% Sodium Chloride |
참고문헌
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Moser, B. Editorial: History of Chemoattractant Research. Frontiers in Immunology. 6, 548 (2015).
- Borroni, E. M., Savino, B., Bonecchi, R., Locati, M. Chemokines sound the alarmin: The role of atypical chemokine in inflammation and cancer. Seminars in Immunology. 38, 63-71 (2018).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. The New England Journal of Medicine. 354 (6), 610-621 (2006).
- Abboud, D., Hanson, J. Chemokine neutralization as an innovative therapeutic strategy for atopic dermatitis. Drug Discovery Today. 22 (4), 702-711 (2017).
- Aldinucci, D., Casagrande, N. Inhibition of the CCL5/CCR5 Axis against the Progression of Gastric Cancer. International Journal of Molecular Sciences. 19 (5), E1477 (2018).
- Chonco, L., et al. Novel DNA Aptamers Against CCL21 Protein: Characterization and Biomedical Applications for Targeted Drug Delivery to T Cell-Rich Zones. Nucleic Acid Therapy. 28 (4), 242-251 (2018).
- Trivedi, P. J., Adams, D. H. Chemokines and Chemokine Receptors as Therapeutic Targets in Inflammatory Bowel Disease; Pitfalls and Promise. Journal of Crohn's and Colitis. 12 (12), 1508 (2018).
- Pietrosimone, K. M., Bhandari, S., Lemieux, M. G., Knecht, D. A., Lynes, M. A. In vitro assays of chemotaxis as a window into mechanisms of toxicant-induced immunomodulation. Current Protocols in Toxicology. 58 (Unit 18.17), (2013).
- Davis, D. M. How studying the immune system leads us to new medicines. Lancet. 391 (10136), 2205-2206 (2018).
- Culley, F. J., Pennycook, A. M., Tregoning, J. S., Hussell, T., Openshaw, P. J. Differential chemokine expression following respiratory virus infection reflects Th1- or Th2-biased immunopathology. Journal of Virology. 80 (9), 4521-4527 (2006).
- Denney, H., Clench, M. R., Woodroofe, M. N. Cleavage of chemokines CCL2 and CXCL10 by matrix metalloproteinases-2 and -9: implications for chemotaxis. Biochemical and Biophysics Research Communications. 382 (2), 341-347 (2009).
- Burrell, B. E., et al. Lymph Node Stromal Fiber ER-TR7 Modulates CD4+ T Cell Lymph Node Trafficking and Transplant Tolerance. Transplantation. 99 (6), 1119-1125 (2015).
- Warren, K. J., Iwami, D., Harris, D. G., Bromberg, J. S., Burrell, B. E. Laminins affect T cell trafficking and allograft fate. The Journal of Clinical Investigation. 124 (5), 2204-2218 (2014).
- Hirata, H., et al. Th2 cell differentiation from naive CD4(+) T cells is enhanced by autocrine CC chemokines in atopic diseases. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. , (2018).
- Lin, R., Choi, Y. H., Zidar, D. A., Walker, J. K. L. beta-Arrestin-2-Dependent Signaling Promotes CCR4-mediated Chemotaxis of Murine T-Helper Type 2 Cells. American Journal of Respiratory Cell and Molecular Biology. 58 (6), 745-755 (2018).
- Zhang, Y., et al. A new antagonist for CCR4 attenuates allergic lung inflammation in a mouse model of asthma. Science Reports. 7 (1), 15038 (2017).
- Lu, Y., et al. Dynamics of helper CD4 T cells during acute and stable allergic asthma. Mucosal Immunology. 11 (6), 1640-1652 (2018).
- Li, B. W. S., Beerens, D., Brem, M. D., Hendriks, R. W. Characterization of Group 2 Innate Lymphoid Cells in Allergic Airway Inflammation Models in the Mouse. Methods in Molecular Biology. 1559, 169-183 (2017).
- Li, B. W. S., et al. Group 2 Innate Lymphoid Cells Exhibit a Dynamic Phenotype in Allergic Airway Inflammation. Frontiers in Immunology. 8, 1684 (2017).
- Warren, K. J., et al. Sex differences in activation of lung-related type-2 innate lymphoid cells in experimental asthma. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. , (2016).
- Warren, K. J., et al. Ovalbumin-sensitized mice have altered airway inflammation to agriculture organic dust. Respiratory Research. 20 (1), 51 (2019).
- Poole, J. A., et al. alphabeta T cells and a mixed Th1/Th17 response are important in organic dust-induced airway disease. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. 109 (4), 266-273 (2012).
- Matsuo, K., et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomedical Pharmacotherapy. 109, 1437-1444 (2019).
- Mikhak, Z., et al. Contribution of CCR4 and CCR8 to antigen-specific T(H)2 cell trafficking in allergic pulmonary inflammation. The Journal of Allergy and Clinical Immunology. 123 (1), 67-73 (2009).
- Monticelli, L. A., et al. Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nature Immunology. 12 (11), 1045-1054 (2011).
- Saenz, S. A., et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 464 (7293), 1362-1366 (2010).
- Hoyler, T., et al. The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity. 37 (4), 634-648 (2012).
- Nakajima, H., Shores, E. W., Noguchi, M., Leonard, W. J. The common cytokine receptor gamma chain plays an essential role in regulating lymphoid homeostasis. The Journal of Experimental Medicine. 185 (2), 189-195 (1997).
- Warren, K. J., et al. RSV-specific anti-viral immunity is disrupted by chronic ethanol consumption. Alcohol. , (2016).
- Warren, K. J., Poole, J. A., Sweeter, J. M., DeVasure, J. M., Wyatt, T. A. An association between MMP-9 and impaired T cell migration in ethanol-fed BALB/c mice infected with Respiratory Syncytial Virus-2A. Alcohol. , (2018).
- Molteni, R., et al. A novel device to concurrently assess leukocyte extravasation and interstitial migration within a defined 3D environment. Lab on a Chip. 15 (1), 195-207 (2015).
- Bersini, S., et al. Human in vitro 3D co-culture model to engineer vascularized bone-mimicking tissues combining computational tools and statistical experimental approach. Biomaterials. 76, 157-172 (2016).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유