Method Article
外迁移系统中淋巴细胞迁移的评估
摘要
在此协议中,淋巴细胞被放置在迁移系统的顶室中,由多孔膜与底部腔室隔开。化学因子被添加到底部腔室,从而诱导沿化学基质梯度的活性迁移。48小时后,淋巴细胞在两个腔室计数,以定量迁移。
摘要
在这里,我们提出了一个有效的方法,可以执行与基本的实验室技能和材料,以评估淋巴细胞化学动力学运动在外体迁移系统。组2先天淋巴细胞(ILC2)和CD4+T助剂细胞从脾脏和肺部分离出,对受挑战的BALB/c小鼠。我们比较地确认了CCR4在CD4+T细胞和ILC2上的表达。CCL17 和 CCL22 是 CCR4 的已知配体;因此,使用这种活体迁移方法,我们检查了CCL17- CCL22诱导的CCR4+ 淋巴细胞的运动。为了建立化学梯度,CCL17和CCL22被放置在迁移系统的底部腔室。分离的淋巴细胞然后被添加到顶室,并在48小时期间淋巴细胞通过3μm孔主动迁移到底部腔室的化学素。这是一个有效的系统,以确定淋巴细胞的化学动力学,但可以理解的是,不模仿在体内器官微环境中发现的复杂性。这是通过增加正在研究的器官和淋巴细胞的原位成像来克服的方法的一个限制。相反,这种方法的优点是,入门级技术人员可以以比现场成像更具成本效益的速度执行。当治疗化合物可用于增强迁移时,如肿瘤渗透细胞毒性免疫细胞或抑制迁移,也许在免疫病理学备受关注的自身免疫性疾病中,此方法可用作筛选工具。一般来说,如果感兴趣的化学基因在统计上高于介质控制水平生成化学动力学,则该方法是有效的。在这种情况下,也可以确定给定化合物的抑制/增强程度。
引言
这种原始的迁移方法是由斯蒂芬·博伊登于1962年在《实验医学杂志1》上提出的。如果没有博伊登室的发展,我们对化学和化学动力学的了解是不可能实现的。在1977年发现第一个化学药物之前,前体迁移系统被用来了解血清因子,这些血清因子可以阻止巨噬细胞的细胞运动,同时放大中性粒细胞1、2的细胞活力。关于免疫细胞迁移,已经发展了大量的知识,到目前为止,已经发现了47个化学素与19个相应的受体3,4。此外,这些化学药物通路的多种抑制剂/增强剂已发展为治疗目的5,6,7,8。其中许多化合物已经在类似的迁移室中进行了测试,以了解化合物与免疫细胞对给定化学素9的反应之间的直接相互作用。
迁移,或二足动物,进入发炎的组织是一个必要的过程,以健康的炎症反应清除感染10,11。博伊登室、迁移系统或跨井装置一般由由多孔膜1、12隔开的两个腔室组成。底部腔通常装有含有感兴趣的化学素的介质,而白细胞则放置在顶部腔室中。可以根据感兴趣的细胞的大小选择膜中的孔隙大小。对于这个项目,我们选择了3μm多孔膜,因为淋巴细胞的大小是7-20μm,这取决于细胞发育的阶段。这种孔径大小确保这些细胞不会被动地从毛孔中掉落,而是主动迁移以响应化学素梯度。
该协议的主要优点是其成本效益。体内迁移是困难的,因为它需要动物处理和手术方面的广泛培训,并且通常涉及研究人员并不总是可用的高能显微镜。在体内成像之前,可以对被认为能增强或抑制迁移的化合物进行具有成本效益的筛选。由于迁移系统受到严格控制,细胞可以先进行处理,然后添加到转井装置中,反之亦然,可先使用化学抑制剂处理化学药物抑制剂,然后将细胞添加到转井装置中。最后,内皮细胞和/或基底膜蛋白可以在转井实验前1-2天添加到转井插入的底部,以了解这些屏障细胞在化学动力学中的参与程度。同样,这些对系统的操作提供了一种强有力的手段,用于在更复杂的体内研究之前确定有关给定化合物有效性的重要信息。
利用移外室系统是评估淋巴细胞在各种体内和体外条件下的流动性的有效方法12,13,14。在这里,我们描述了一种优化的方法,用于评估外体淋巴细胞对迁移室中化学素的反应。在此示例实验中,CD4+ T 细胞和组 2 先天淋巴细胞 (ILC2) 在 OVA 过敏原暴露后从雄性小鼠和雌性 BALB/c 小鼠中分离。生成一个假设,CCR4+ CD45+系-(LIN-) ILC2 来自过敏原挑战小鼠将比 CCR4 + CD4+ T 帮助细胞更有效地迁移到 CCL17 和 CCL22。CCL17和CCL22是一种化学素,通常由M2(过敏)表型的树突细胞和巨噬细胞等细胞产生,在过敏15、16中。CCL17和CCL22可被视为过敏性炎症的生物标志物,因为它们在气道恶化16、17、18期间很容易在肺部检测到。重要的是,CCR4的表达与未经处理的对照组相比是升高的,从从室内尘虫处理动物中分离出的生物信息数据中所揭示,同样,ILC2来自使用IL-33处理的幼化动物的ILC2(过敏原促进先天细胞因子) 上调节 CCR419,20.此外,根据免疫基因组项目数据库(www.immgen.org)中的ILC2数据,CCR4 mRNA在这些先天免疫细胞中高度表达。迄今为止,关于将ILC2贩运到组织方面鲜为人知,但ILC2和CD4+T细胞很可能使用类似的化学素和受体作为化学和化学动力学,因为它们表达类似的转录因子和受体。因此,我们比较了ILC2和CD4+T淋巴细胞的CCL17与CCL22的响应能力,这些细胞来自男性和女性,OVA挑战动物。
研究方案
这里描述的所有方法都经过内布拉斯加大学医学中心(UNMC)和犹他大学动物护理和使用委员会的审查和批准。
1. 试剂的建立和制备
-
准备完整的RPMI(罗斯威尔公园纪念研究所)媒体。
- 将10 mL的热灭活胎儿牛血清 (FBS) 添加到 90 mL 的 RPMI 中。
- 将1mL的100x青霉素-链霉素-谷氨酰胺添加到100 mL的10%FBS RPMI中。
-
准备 ILC2 扩展介质。
- 将 IL-2 和 IL-33(每个细胞因子 20 纳克/mL)添加到 10 mL 的完整 RPMI 中。
- 如果库存细胞因子为 10 μg/mL,则移液器 20 μL IL-2 和 IL-33 放入包含 10 mL 完整 RPMI 介质的 15 mL 管中。
-
准备肺分离介质。
- 将50毫克1型胶原酶添加到250 mL的未补充RPMI中。
- 在步骤1.3.1中向250 mL的介质中加入2.5 mL的100x青霉素-链霉素-谷氨酰胺。
- 轻轻混合介质,确保1型胶原酶在使用前完全溶解。
-
准备无血清 RPMI。
- 在 RPMI 的 200 mL 中稀释 1 克冻干牛血清白蛋白 (BSA)。
- 加入2 mL的100x青霉素-链霉素-谷氨酰胺。
- 轻轻混合介质,确保 BSA 在使用前完全溶解在介质中。
-
使用 CCL17 准备迁移介质。
- 获得10 mL的无血清RPMI,并加入CCL17[50纳克/mL]。
- 如果库存 CCL17 为 10 μg/mL,则将 50 μL 的 CCL17 库存添加到 10 mL 的无血清 RPMI 介质中。
- 获得10 mL的无血清RPMI,并加入CCL17[50纳克/mL]。
-
使用 CCL22 准备迁移介质。
- 获得10 mL的无血清RPMI,并加入CCL22[50纳克/mL]。
- 如果库存 CCL22 为 10 μg/mL,则将 50 μL 的 CCL22 库存添加到 10 mL 的无血清 RPMI 介质中。
-
准备CCR4抗体染色鸡尾酒。
- 对于总共 10 个测试,在 5 mL 管中添加 5 μL 以下抗体:抗小鼠 CCR4、CD19、CD11b、CD45、ST2 和 ICOS。
注:如何为 10 个样本制作抗体鸡尾酒的示例:每个抗体的 0.5 μL x 10 样本 = 1.7.1 中列出的每种抗体的 5 μL。 - 对于总共 10 个测试,从步骤 1.7.1:抗小鼠 CD3、CD11c 和 NK1.1 添加到抗体鸡尾酒中,添加 2.5 μL 以下抗体。
注:完成10个样品的抗体鸡尾酒示例:0.25 μL x 10 样本 = 2.5 μL CD3、CD11c 和 NK1.1 抗体。 - 将 CCR4 抗体染色鸡尾酒储存在 4°C,直到准备好添加到样品中。不使用,1周后丢弃抗体鸡尾酒。
- 对于总共 10 个测试,在 5 mL 管中添加 5 μL 以下抗体:抗小鼠 CCR4、CD19、CD11b、CD45、ST2 和 ICOS。
-
准备 1x 稳定固定。
- 将 10 mL 的去离子蒸馏水添加到 5 mL 的 3 倍稳定固定浓缩物中
2. 制备过敏原挑战BALB/c小鼠
注:雄性和雌性BALB/c小鼠在6至8周时从查尔斯河(UNMC)或杰克逊实验室(犹他大学)购买。
-
适应后(1周),使所有动物对OVA敏感。
- 在 5 mL 聚苯乙烯管中将 100 μg/mL OVA 吸附物与氢氧化铝 (20 mg/mL) 结合。
- 混合管并立即将 500 μL 的 OVA-lum 悬浮液抽到 1 mL、28 G 注射器(胰岛素注射器)中。
- 将鼠标放入含有异法兰的钟罐中(1⁄2 mL 置于假地板下,以便动物不会直接站在异法兰中)。让小鼠在麻醉下进行大约1⁄2分钟,或直到呼吸速率下降。
- 通过背部和肩部的毛皮快速拿起鼠标,并每只小鼠注射100 μL 的 OVA-lum 内腹。
- 将鼠标放回笼子并观察,以确保它们恢复活动能力;这应该发生在2-5分钟内。
-
致敏后七天,让所有动物在雾化室(数据科学国际)中,在无菌盐水中稀释1.5%的OVA。"
- 将老鼠从笼子里取出,放在动物雾化室。关闭造型室的盖子。
- 将雾化软管连接到雾化室上的输入出口。
- 将30 mL的1.5%OVA稀释在无菌盐水中加入雾化器上的雾化杯。
- 打开雾化器,让腔室充满雾气 20 分钟。
- 关闭雾化器,让雾气消散。
- 把动物送回笼子里。
- 连续5天重复步骤2.2共5次,引起过敏性炎症。
3. 从OVA挑战小鼠的脾脏和肺分离CD4+T细胞
- 根据批准的IACUC协议,通过CO2窒息对所有接受OVA治疗的雄性动物和雌性动物进行人道安乐死,每组使用2至3只动物。"
- 根据动物的组织类型和性别,从动物身上切除肺和脾脏,并将组织放在单独的分离管中。
- 使用"肺"方案在自动组织分离器中分离肺组织500μL肺分离介质(25 U/mL;胶原酶,类型1)。
- 重复 3.2 和 3.3 共两次。
- 使用自动组织分离器上的"脾脏"协议,在500μL的完整RPMI培养基中分离脾脏组织。
注:其余步骤应在使用无菌技术的生物安全柜中执行。 - 分别用5 mL的附加肺分离介质或完全RPMI冲洗含有肺和脾均质的分离管。
- 通过40μm细胞过滤器过滤细胞悬浮液,并收集到50 mL锥形管中。
- 在37°C的培养箱中孵育肺均质15-30分钟,CO2为5%,以进一步分离肺组织。
- 在肺和脾均质物中加入5 mL的完整RPMI,并使用离心将50 mL管底部的细胞颗粒化;378 x g在室温 (RT) 下 5 分钟
- 将鼻细胞和肺细胞合并到一个50 mL锥形管中,并使用自动细胞计数器确定总细胞计数。
- 在分离缓冲液中将男性和女性细胞悬浮液调节到1 x 108细胞/mL,并加入5mL聚苯乙烯管中。
注:当从脾脏和肺获取更多细胞时,可调节至14 mL聚苯乙烯管。该协议是为每组2~3只小鼠的组织中设计的;因此,5 mL 管就足够了。 - 根据ILC2浓缩协议,使用约三分之二的ILC2隔离电池。
- 将抗体鸡尾酒(50μL/mL)加入细胞悬浮液,在RT孵育5分钟。
- 涡旋快速球体30s,以75μL/mL的细胞悬浮液速率添加到样品中。在 RT 轻轻混合和孵育 5 分钟。
- 将管顶至总体积为 3 mL,带分离缓冲器,并放置在 8 室易分离磁铁中。在 RT 孵育 3 分钟。
- 将磁体向前倾斜(远离粘附在管背面的球体-抗体-细胞复合物),并将细胞悬浮液移至干净的 5 mL 管中。
- 在 RT 时,在 378 x g下向管和离心机添加 1.5 mL 的完整 RPMI,5 分钟。
- 从细胞颗粒中倒出介质,以每 mL 1 x 107细胞重新悬浮 ILC2。
- 将每孔 100 uL 的雄母 ILC2 置于 U 型底、96 孔板中,并在每口孔中添加 100 μL 的 ILC2 扩展介质。
- 孵育细胞4~5天,以扩大ILC2。
- 将 ILC2 收集到 5 mL 管中,并加入高达 4.5 mL 的无血清 RPMI。在RT处将细胞在378 x g下离心5分钟。
- 使用血球测量仪对细胞进行计数,并在无血清 RPMI 中以每 mL 1 x 107 ILC2 重新悬浮。
- 使用CD4+ T细胞分离过程的剩余细胞,根据小鼠CD4+T细胞分离协议进行,几乎没有修改。
- 将大鼠血清(50μL/mL)加入CD4 T细胞浓缩悬浮液。
- 将隔离鸡尾酒(50 μL/mL)加入样品,在RT孵育10分钟。
- 涡旋快速球体30s,以75μL/mL的速率添加到样品中。
- 轻轻混合细胞悬浮液,孵育2.5分钟,RT
- 将样品顶部至 3 mL,并将 5 mL 管放入 8 室易分离磁铁中,并在 RT 孵育 5 分钟。
- 将磁体向前倾斜,将电池悬架移入干净的 5 mL 管中。
- 在RT时,在378 x g的管和离心机中加入1.5 mL的无血清RPMI和离心机5分钟。
- 从细胞颗粒中倒出介质,在无血清 RPMI 中,以每 mL 1 x 107细胞重新悬浮 CD4+ T 细胞。
4. 通过流式细胞测定,确定来自OVA挑战动物的CCR4表达CD4+ T细胞和第2组先天淋巴细胞(ILC2)
注:以下步骤可以在开放式工作台上执行,因为它们是非无菌技术。
-
从步骤 3.11.10 和 1⁄2.5 x 106 CD4+ T 细胞从步骤 3.12.8 在单独的 5 mL 管中获取大约 1⁄2.5 x 105 ILC2 细胞。
- 将至少 5.0 x 104 CD4+ T 细胞的附加管作为未染色的控件保留。
- 将细胞悬浮在100~200 μL的FACS缓冲液中,并将1μL的Fc块添加到每根管中,然后在冰上(或在4°C冰箱中)孵育10分钟。
- 在每个管和离心机中加入1⁄2 mL的FACS缓冲液,在RT时以378 x g的速度向离心机5分钟。
- 倒入上清液,在100~200 μL的FACS缓冲液中重新悬浮细胞。
- 将 37.5 μL 的 CCR4 抗体染色鸡尾酒添加到每个管中的细胞悬浮液中,但包含"未染色"细胞的管除外。
- 在冰上或4°C的冰箱中孵育管子20-30分钟。
- 在每个管和离心机中加入1⁄2 mL的FACS缓冲液,在RT时以378 x g的速度向离心机5分钟。
- 倒掉上清液。
- 重复步骤 4.7 和 4.8。
- 在每个管中加入 250*300 μL 的 1x 稳定固定剂(参见材料表)。
-
根据补偿珠提供的方案,为CCR4抗体鸡尾酒中的每个抗体制备单色珠子对照。
- 涡旋补偿珠。
- 将一滴珠子添加到每个单色控制管中。
- 在CCR4抗体鸡尾酒中将每个抗体的1μL添加到其自己的标记管中。
- 在 4°C 冰箱或冰上轻轻混合和孵育 10 分钟。
- 在 RT 时,将所有管和离心机以 378 x g的速度添加 1⁄2 mL 的 FACS 缓冲液,5 分钟。
- 在 200 μL 的 FACS 缓冲液中倒出上清液并重新悬浮珠子。
- 冷藏单色控制装置,直到所有样品都染色,并准备好在流量细胞仪上进行分析。
- 在固定24小时内分析未染色的细胞、单色对照和流式细胞仪的实验样本。
5. 外迁移程序
注:以下步骤应在生物安全柜中执行,因为它们需要无菌技术。
- 从步骤 3.11.10 获取 ILC2,从步骤 3.12.8 获取 CD4 T 单元,并确定实验所需的跨井插入数。
注:示例:对于步骤 3.12.8 中 1.2 mL 的浓缩 CD4 T 细胞,乘以 1.2 x 1,000 μL = 1,200 μL;然后除以 1,200 uL 除以 100 μL = 12,CD4 T 迁移所需的插入数。 - 从 24 孔板的中间行轻轻移动 3 μm 跨孔插入件。
- 将 500 μL 的迁移介质与 CCL17 添加到大约三分之一的井中。
- 将 500 μL 的迁移介质与 CCL22 添加到另外三分之一的井中。
- 将含有无化学克辛的500μL无血清RPMI添加到最后三分之一的油井中。
- 将盖子清楚地贴在底井中,并放置适当的迁移介质。
- 将转井插入回包含各种处理的井中。
- 将 100 μL 的 CD4 T 细胞或 ILC2 轻轻添加到每个刀片的顶部井中。请勿在跨孔中上下混合或移液细胞悬浮液,因为这可能会混淆实验结果。
- 清楚地标记板的盖子,每个孔中放置细胞类型,并写出添加细胞的日期和时间。
- 重复步骤 5.2 到 5.9,直到所有单元都放置在带介质的跨井插入件中。
- 将板轻轻放入 37°C 的培养箱中,其中 5% CO2持续 48 小时,在孵育期间尽量减少与板的接触。
6. 外迁移的量化
- 轻轻地从培养箱中取出板,从中间行中取出所有跨井插入到正上方或下方的空孔中。
- 从跨井底部和顶部孔中收集细胞,插入标有TOP或BOTTOM、CCL17、CCL22或介质、细胞类型和复制数(每个实验至少3次复制)的管中。
- 用 500 μL 的 1x PBS 冲洗底井,并将此冲洗液收集到相应的管中。
- 用 250 μL 的 1x PBS 冲洗顶部井,并将此冲洗收集到相应的管中。
- 在RT处,在378 x g下通过离心将细胞进行5分钟的离心。
- 轻轻地移掉细胞颗粒中的所有上清液。
- 将 T 细胞和 ILC2 重新悬浮到 50 μL 的 1x PBS 中。
- 取10μL的细胞悬浮液,并加入90μL的0.4%试盘蓝色。
-
计算自动细胞计数器上的单元格。
- 记录 %生存能力。
- 记录每个样本的每个 mL 的细胞计数。
- 确定顶部和底部腔室中每次治疗的细胞总数;记录单元格计数。
结果
CD4+ T 细胞和 ILC2 上的 CCR4 表达。
为了进行活体迁移实验的成功,必须确定淋巴细胞是否对CCL17和CCL22通过CCR4作出反应;因此,我们通过流动细胞测定测定了CD4+T细胞和ILC2的CCR4表达。虽然众所周知,OVA 特异性 CD4+帮助器 T 细胞表示 CCR4,但对 ILC2 上 CCR4 的表达知之甚少。图1显示了来自雄性和雌性、OVA挑战BALB/c小鼠的CCR4表达的代表性结果,相对而言,在CD4+T细胞(图1A,C)和ILC2(图1B,D)上。流式细胞学用于检测CCR4,使用与均值球素(APC)结合的单克隆抗体检测CCR4。使用方差的单向分析 (ANOVA),我们确定雄母宿主之间的 CCR4 表达没有差异(图1A+D),但是,与 CD4 相比,ILC2 上每个单元的 CCR4 表达(MFI)较高+T 单元(图 1C与图1D相比 )。这些结果对于表明ILC2和CD4+T细胞在以下实验中应响应CCL17和CCL22非常重要。
CD4+ T 细胞对迁移系统顶部和底部腔室中的 CCR4 配体的响应能力。
CD4–来自雄性、OVA 挑战的 BALB/c 小鼠的 T 细胞从肺部和脾脏中分离出来,并放置在由 3 μM 多孔膜分离的迁移装置的顶部室(图 2)。显示OVA处理小鼠体内制剂的摘要(图2A)和迁移过程(图2B)供参考。CCL17 (25 纳克/mL) 和 CCL22 (25 纳克/mL) 的组合被放置在顶腔、底部腔室或顶部和底部腔室中,以确认 (图 2C),(1) OVA 挑战动物的 CD4+ T 细胞对 CCR4 有响应配体,和(2)化学素引起的迁移是一个活跃的过程,T细胞通过毛孔对化学素梯度作出反应,淋巴细胞没有在独立于化学素的毛孔中移动。包括介质(无化学素)对照,以表明CD4+ T细胞不能通过3μM孔迁移没有刺激。在这种情况下,最高百分比的细胞留在顶室。当化学基因同时放置在顶部和底部腔室时,我们检测到底部腔室中总T细胞的52%和顶腔中48%的细胞(TOP/BOTTOM处理)。正如所料,细胞的分布因对只放置在顶部或仅位于底部腔室的化学物而移动,因为我们检测到存在化学的隔间中细胞的百分比最高。
CD4+ T 细胞和 ILC2 对 CCL17 和 CCL22 在活体迁移器中的反应能力。
CD4 T细胞和ILC2从雄性和雌性,OVA挑战小鼠被分离出肺和脾脏,然后放置在一个转井转运器的顶室(图3)。仪器底部腔室充满未经处理的细胞培养基、含有CCL17的介质或含有CCL22的介质。代表性结果显示,不到14%(13.37 ~ 6.5%)在介质控制条件下迁移的细胞(图3A+D)。在响应CCL22时,两种细胞类型,无论它们来自男性还是女性宿主,都对CCL22(图3A+D)作出了响应,但是,CCL17的结果不太一致。CCL17仅诱导女性CD4 T细胞和ILC2显著迁移,与介质相比(图3C,D)。CCL17治疗与男性CD4+T细胞或男性ILC2(图3A,B)的培养基没有区别,CCL22在男性ILC2中诱导比CCL17更大的迁移(图2B)。
CD4+ T 细胞的低生存能力的次优迁移结果。
生成了次优结果,为研究人员提供了一个示例,说明当迁移实验不能正常工作时会发生什么(图4)。我们根据该协议从动物身上分离出雄性CD4+T细胞,并将其置于迁移系统的顶部。然而,在加入CD4+T细胞后,板在前24小时保持室温,然后板被移入孵化器,在孵化期的其余24小时。毫不奇怪,我们检测到没有向CCL17和CCL22迁移(图4A),细胞的存活性明显低(<15%)用于顶部的单元格 (图 4B)。这些有缺陷的结果强调了使用该协议中详述的正确温度和条件以获得最佳结果的重要性。
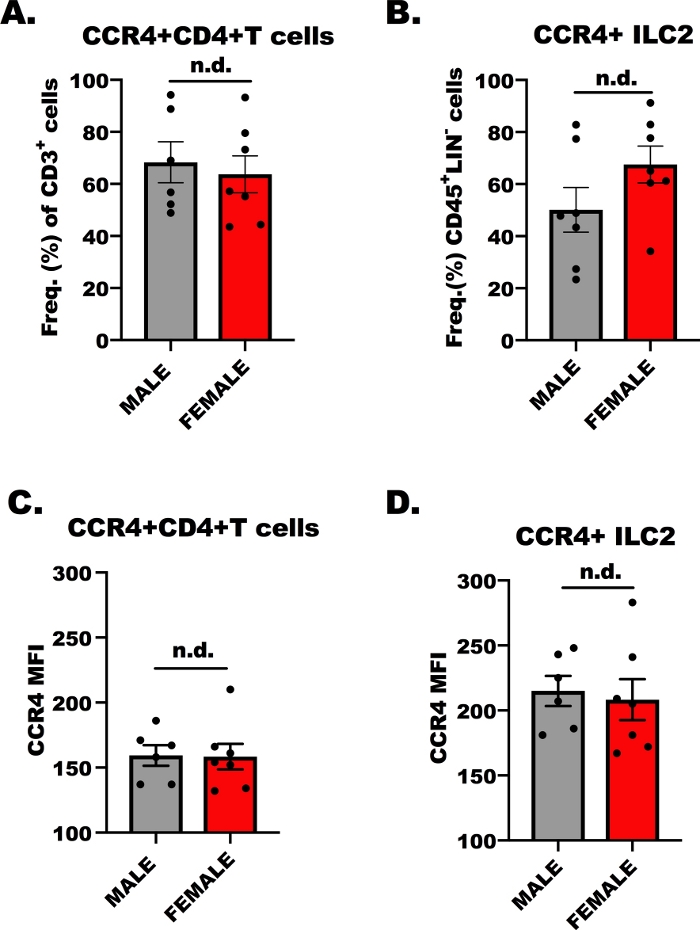
图1:CD4+T细胞和ILC2上的CCR4表达。7至9周大,男性和女性,BALB/c小鼠注射一次100μL的OVA吸附到氢氧化铝(500微克/mL;OVA 和 20 mg/mL 氢氧化铝)前 7 天,第一个 5, 重复, 每日气道挑战与 1.5% OVA 在盐水.过敏原挑战动物被人道地安乐死,肺和脾组织被收集为ILC2和CD4+T细胞分离。然后,通过流动细胞测定法对一小部分细胞进行染色和分析,以确定每种细胞类型的CCR4水平。(A) CCR4 的 CD4+ T 细胞的频率=来自 OVA+ 小鼠,其中误差条表示均值 (+ SEM) 的标准误差。(B) CCR4= (+SEM) 的 ILC2 频率。(C, D)CCR4在CD4+T细胞和(D)ILC2上的平均荧光强度([SEM)》。共有13只小鼠用于生成这些数据,流量实验重复两次,每次实验重复3次。重要性由单向方差分析确定;n.d. 表示组之间没有差异。请点击此处查看此图的较大版本。

图2:CD4+T细胞对迁移系统顶部和底部腔室CCR4配体的响应能力。雄性BALB/c小鼠对鸡蛋奥巴他丁(OVA)和CD4+T细胞进行敏感和挑战,从脾脏和肺部分离(A、B)。 对于这个迁移实验,CD4+ T细胞悬浮在1 x 107细胞/mL的无血清介质中。CCL17和CCL22被添加到无血清介质中,浓度为50纳克/mL(每种化学素25纳克/mL,共达到50纳克/mL)。含化学的介质仅添加到顶腔、仅添加到下腔或顶部和底部腔室。在井底井中加入500μL的迁移介质,将100μL的细胞悬浮液(1 x 106细胞/井)添加到顶部井中。迁移是在48小时后在文化 (C. ) 测量的。这些数据来自单个实验,3个OVA处理,雄性小鼠用于组织收集,每治疗3次复制。统计显著性由单向方差分析确定;•p < 0.05。请点击此处查看此图的较大版本。
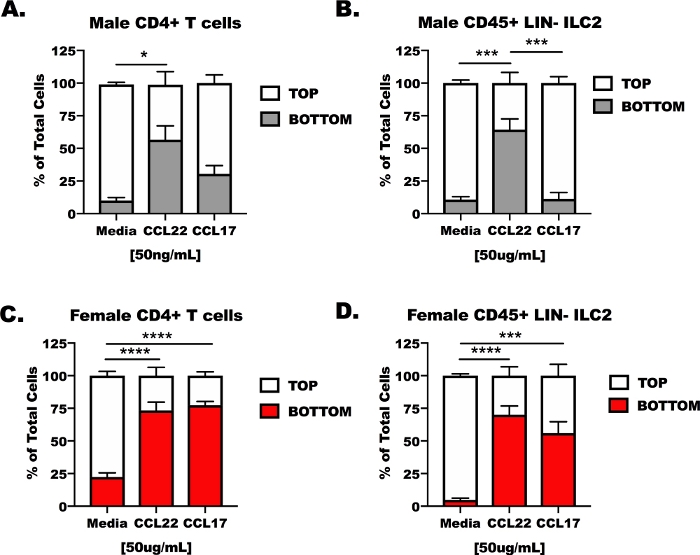
图3:CD4+T细胞和ILC2对CCL17和CCL22的响应能力。 小鼠的准备如图1CD4 + T细胞和ILC2分离脾脏和肺。CD4= T细胞和ILC2悬浮在无血清介质中,在1 x 107细胞/mL。CCL17或CCL22被添加到无血清介质中,浓度为50纳克/mL。将500μL的迁移介质添加到井底,将100μL的细胞悬浮液(1 x 106细胞/井)添加到顶部井中。迁移是在48小时后在文化中测量的。(A) CD4+ T 细胞和 (B) 来自雄性宿主的 ILC2 被作为介质处理为控制,CCL17 或 CCL22。同样, (C) 女性 CD4+ T 细胞和 (D) 女性 ILC2 使用介质 CCL17 或 CCL22 进行治疗.共有14只小鼠用于生成这些数据。迁移实验重复4次,每次实验3~6次重复。重要性由单向方差分析确定;•p < 0.05, =p < 0.001, =p < 0.0001。请点击此处查看此图的较大版本。

图4:低生存能力的CD4 T细胞的迁移结果不理想。天真的雄性BALB/c小鼠被采集肺和脾组织,CD4+T细胞分离,如图1,图2和图3。CD4 T细胞被添加到迁移装置的顶室,将含有CCL17、CCL22或无化学素(介质控制)的无血清介质添加到底井。在实验的前24小时,板在室温下保持,然后移动到37°C的孵化器与5%CO2额外24小时(A)的细胞留在顶部和底部孔后24小时(B)的可存活性在孵育条件较差后,顶部和底部腔室中的D4+T细胞。这些数据来自一个实验,3只天真的雄性小鼠用于组织收集,每次治疗进行3次复制。统计意义尚未确定。请点击此处查看此图的较大版本。
讨论
在这里,我们提出了一个成熟的方法,以评估在外体迁移系统中淋巴细胞引起的化学素迁移。该协议中有几个关键步骤,第一个步骤是验证实验中免疫细胞上正确的化学素受体的表达。在我们的手中,我们选择CCR4是因为文献中强调了CCR4在过敏性炎症中T2帮助T细胞的重要性。Ovalbumin引起的炎症先前被证明至少受到两个CCR4拮抗剂24,25的限制;然而,这是之前发现组2先天淋巴细胞(ILC2)26,27。我们生成了新的数据,表明ILC2细胞的CCR4比CD4+T细胞高,并且表明这些细胞对CCL22有持续的反应。
协议中需要遵循的第二个关键步骤是确保在开始协议迁移部分之前,将细胞保存在最佳培养基中。在 ILC2 中,我们必须在同时包含 IL-2 和 IL-33 的 ILC2 扩展介质中培养这些细胞。IL-2和IL-7都在文献中报道,以支持ILC2在文化长达14天28,29。如果在未来实验中CD4+T细胞和ILC2的存活率成为问题,那么在实验结束之前,加入IL-2或IL-7可能会提高淋巴细胞的存活率。本文介绍的每个媒体都在几个实验过程中进行了定义,并针对该协议14、30、31进行了优化。在图4中,我们提出了错误的结果,以证明使用适当温度和5%CO2的培养箱的重要性。将迁移板放在培养箱中,使它们不受干扰,是协议成功的又一关键步骤。
如前所述,在大多数机构使用体内显微镜有其优点,但是,在体内成像可能非常耗时且成本高昂。另一种实验程序,这是成本较低的使用微流体结合化学素梯度,以了解白细胞外溢和组织迁移32,33,34。这些系统具有科学价值,因为它们评估涉及内皮细胞的细胞动力学的复杂性,内皮细胞可以生长到微流体系统的毛细血管上。此外,这些微流体系统评估依从蛋白(如E-cadherin)在内皮细胞和在血流下细胞粘附过程中对免疫细胞的内皮细胞和整数的重要性。然而,这些系统需要专门的设备和复杂的计算编程和统计数据来确定每种处理条件的重要性。因此,虽然这里介绍的迁移方法的局限性是,它是人为的,它可以作为一个重要的筛选工具,以限制在后续体内方法中不必要的试剂的浪费。该方法的意义是,随着新细胞的发现,如ILC2的情况,我们可以筛选这些细胞对已知化学物的反应。这是未来涉及ILC2和潜在疗法的应用之一,这些疗法可能抑制他们在哮喘恶化期间向肺部的迁移。此迁移协议将用于筛选各种抑制剂,这些抑制剂可用于限制 CCR4 或参与招募 ILC2 的其他化学策略介质。总之,这种前活体迁移协议将导致生成关键数据,这些关键数据可以通过未来的体内实验来验证。
披露声明
作者没有财务披露或利益冲突可披露。
致谢
这项工作由美国肺脏协会(K.J.W.)、授予T.A.W.和K.J.W.的纪念尤金·肯尼基金、犹他大学为K.J.W.提供的慷慨启动支持以及退伍军人事务部授予T.A.W.(VA I01BX0003635)的资助。T.A.W. 是退伍军人事务部研究职业科学家奖 (IK6 BX003781) 的获得者。作者希望感谢丽莎·丘多梅尔卡女士的编辑协助。作者感谢UNMC流式细胞学核心在收集为本手稿生成的流式细胞学数据方面给予的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Sigma-Aldrich | 15250061 | |
| 1 mL syringe | BD Bioscience | 329424 | U-100 Syringes Micro-Fine 28 G 1/2" 1cc |
| 100x Penicillin-Streptomycin, L-Glutamine | Gibco | 10378-016 | Dilute to 1x in RPMI media |
| 15 mL conical tubes | Olympus Plastics | 28-101 | polypropylene tubes |
| 3 μm transwell inserts | Genesee Scientific | 25-288 | 24-well plate containing 12 transwell inserts |
| 3x stabilizing fixative | BD Pharmigen | 338036 | Prepare 1x solution according to manufacturers protocol |
| 5 mL polystyrene tubes | STEM Cell Technologies | 38007 | |
| 50 mL conical tubes | Olympus Plastics | 28-106 | polypropylene tubes |
| 8-chamber easy separation magnet | STEM Cell Technologies | 18103 | |
| ACK Lysing Buffer | Life Technologies Corporation | A1049201 | |
| Advanced cell strainer, 40 μm | Genesee Scientific | 25-375 | nylon mesh, 40 μm strainers |
| Aluminum Hydroxide, Reagent Grade | Sigma-Aldrich | 239186-25G | 20 mg/mL |
| anti-mouse CCR4; APC-conjugated | Biolegend | 131211 | 0.5 μg/test |
| anti-mouse CD11b | BD Pharmigen | 557396 | 0.5 μg/test |
| anti-mouse CD11c; PE eFluor 610 | Thermo-Fischer Scientific | 61-0114-82 | 0.25 μg/test |
| anti-mouse CD16/32, Fc block | BD Pharmigen | 553141 | 0.5 μg/test |
| anti-mouse CD19; APC-eFluor 780 conjugated | Thermo-Fischer Scientific | 47-0193-82 | 0.5 μg/test |
| anti-mouse CD3; PE Cy 7-conjugated | BD Pharmigen | 552774 | 0.25 μg/test |
| anti-mouse CD45; PE conjugated | BD Pharmigen | 56087 | 0.5 μg/test |
| anti-mouse ICOS (CD278) | BD Pharmigen | 564070 | 0.5 μg/test |
| anti-mouse NK1.1 (CD161); FITC-conjugated | BD Pharmigen | 553164 | 0.25 μg/test |
| anti-mouse ST2 (IL-33R); PerCP Cy5.5 conjugated | Biolegend | 145311 | 0.5 μg/test |
| Automated Cell Counter | BIORAD | 1450102 | |
| Automated Dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| Bovine Serum Albumin, Lyophilized Powder | Sigma-Aldrich | A2153-10G | 0.5% in serum-free RPMI |
| Cell Counter Clides | BIORAD | 1450015 | |
| Chicken Egg Ovalbumin, Grade V | Sigma-Aldrich | A5503-10G | 500 μg/mL |
| Collagenase, Type 1, Filtered | Worthington Biochemical Corporation | CLSS-1, purchase as 5 X 50 mg vials (LS004216) | 25 U/mL in RPMI |
| Compensation beads | Affymetrix | 01-1111-41 | 1 drop per contol tube |
| Dissociation Tubes | MACS Miltenyi Biotec | 130-096-335 | |
| FACS Buffer | BD Pharmigen | 554657 | 1x PBS + 2% FBS, w/ sodium azide; stored at 4 °C |
| Heat Inactivated-FBS | Genesee Scientific | 25-525H | 10% in complete RPMI & ILC2 Expansion Media |
| Mouse CCL17 | GenScript | Z02954-20 | 50 ng/mL |
| Mouse CCL22 | GenScript | Z02856-20 | 50 ng/mL |
| Mouse CD4+ T cell enrichment kit | STEM Cell Technologies | 19852 | |
| Mouse IL-2 | GenScript | Z02764-20 | 20 ng/mL |
| Mouse ILC2 enrichment kit | STEM Cell Technologies | 19842 | |
| Mouse recombinant IL-33 | STEM Cell Technologies | 78044 | 20 ng/mL |
| RPMI | Life Technologies Corporation | 22400071 | |
| Separation Buffer | STEM Cell Technologies | 20144 | 1x PBS + 2% FBS; stored at 4 °C |
| Small animal nebulizer and chamber | Data Sciences International | ||
| Sterile saline | Baxter | 2F7124; NDC 0338-0048-04 | 0.9% Sodium Chloride |
参考文献
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Moser, B. Editorial: History of Chemoattractant Research. Frontiers in Immunology. 6, 548(2015).
- Borroni, E. M., Savino, B., Bonecchi, R., Locati, M. Chemokines sound the alarmin: The role of atypical chemokine in inflammation and cancer. Seminars in Immunology. 38, 63-71 (2018).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. The New England Journal of Medicine. 354 (6), 610-621 (2006).
- Abboud, D., Hanson, J. Chemokine neutralization as an innovative therapeutic strategy for atopic dermatitis. Drug Discovery Today. 22 (4), 702-711 (2017).
- Aldinucci, D., Casagrande, N. Inhibition of the CCL5/CCR5 Axis against the Progression of Gastric Cancer. International Journal of Molecular Sciences. 19 (5), E1477(2018).
- Chonco, L., et al. Novel DNA Aptamers Against CCL21 Protein: Characterization and Biomedical Applications for Targeted Drug Delivery to T Cell-Rich Zones. Nucleic Acid Therapy. 28 (4), 242-251 (2018).
- Trivedi, P. J., Adams, D. H. Chemokines and Chemokine Receptors as Therapeutic Targets in Inflammatory Bowel Disease; Pitfalls and Promise. Journal of Crohn's and Colitis. 12 (12), 1508(2018).
- Pietrosimone, K. M., Bhandari, S., Lemieux, M. G., Knecht, D. A., Lynes, M. A. In vitro assays of chemotaxis as a window into mechanisms of toxicant-induced immunomodulation. Current Protocols in Toxicology. 58 (Unit 18.17), (2013).
- Davis, D. M. How studying the immune system leads us to new medicines. Lancet. 391 (10136), 2205-2206 (2018).
- Culley, F. J., Pennycook, A. M., Tregoning, J. S., Hussell, T., Openshaw, P. J. Differential chemokine expression following respiratory virus infection reflects Th1- or Th2-biased immunopathology. Journal of Virology. 80 (9), 4521-4527 (2006).
- Denney, H., Clench, M. R., Woodroofe, M. N. Cleavage of chemokines CCL2 and CXCL10 by matrix metalloproteinases-2 and -9: implications for chemotaxis. Biochemical and Biophysics Research Communications. 382 (2), 341-347 (2009).
- Burrell, B. E., et al. Lymph Node Stromal Fiber ER-TR7 Modulates CD4+ T Cell Lymph Node Trafficking and Transplant Tolerance. Transplantation. 99 (6), 1119-1125 (2015).
- Warren, K. J., Iwami, D., Harris, D. G., Bromberg, J. S., Burrell, B. E. Laminins affect T cell trafficking and allograft fate. The Journal of Clinical Investigation. 124 (5), 2204-2218 (2014).
- Hirata, H., et al. Th2 cell differentiation from naive CD4(+) T cells is enhanced by autocrine CC chemokines in atopic diseases. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. , (2018).
- Lin, R., Choi, Y. H., Zidar, D. A., Walker, J. K. L. beta-Arrestin-2-Dependent Signaling Promotes CCR4-mediated Chemotaxis of Murine T-Helper Type 2 Cells. American Journal of Respiratory Cell and Molecular Biology. 58 (6), 745-755 (2018).
- Zhang, Y., et al. A new antagonist for CCR4 attenuates allergic lung inflammation in a mouse model of asthma. Science Reports. 7 (1), 15038(2017).
- Lu, Y., et al. Dynamics of helper CD4 T cells during acute and stable allergic asthma. Mucosal Immunology. 11 (6), 1640-1652 (2018).
- Li, B. W. S., Beerens, D., Brem, M. D., Hendriks, R. W. Characterization of Group 2 Innate Lymphoid Cells in Allergic Airway Inflammation Models in the Mouse. Methods in Molecular Biology. 1559, 169-183 (2017).
- Li, B. W. S., et al. Group 2 Innate Lymphoid Cells Exhibit a Dynamic Phenotype in Allergic Airway Inflammation. Frontiers in Immunology. 8, 1684(2017).
- Warren, K. J., et al. Sex differences in activation of lung-related type-2 innate lymphoid cells in experimental asthma. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. , (2016).
- Warren, K. J., et al. Ovalbumin-sensitized mice have altered airway inflammation to agriculture organic dust. Respiratory Research. 20 (1), 51(2019).
- Poole, J. A., et al. alphabeta T cells and a mixed Th1/Th17 response are important in organic dust-induced airway disease. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. 109 (4), 266-273 (2012).
- Matsuo, K., et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomedical Pharmacotherapy. 109, 1437-1444 (2019).
- Mikhak, Z., et al. Contribution of CCR4 and CCR8 to antigen-specific T(H)2 cell trafficking in allergic pulmonary inflammation. The Journal of Allergy and Clinical Immunology. 123 (1), 67-73 (2009).
- Monticelli, L. A., et al. Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nature Immunology. 12 (11), 1045-1054 (2011).
- Saenz, S. A., et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 464 (7293), 1362-1366 (2010).
- Hoyler, T., et al. The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity. 37 (4), 634-648 (2012).
- Nakajima, H., Shores, E. W., Noguchi, M., Leonard, W. J. The common cytokine receptor gamma chain plays an essential role in regulating lymphoid homeostasis. The Journal of Experimental Medicine. 185 (2), 189-195 (1997).
- Warren, K. J., et al. RSV-specific anti-viral immunity is disrupted by chronic ethanol consumption. Alcohol. , (2016).
- Warren, K. J., Poole, J. A., Sweeter, J. M., DeVasure, J. M., Wyatt, T. A. An association between MMP-9 and impaired T cell migration in ethanol-fed BALB/c mice infected with Respiratory Syncytial Virus-2A. Alcohol. , (2018).
- Molteni, R., et al. A novel device to concurrently assess leukocyte extravasation and interstitial migration within a defined 3D environment. Lab on a Chip. 15 (1), 195-207 (2015).
- Bersini, S., et al. Human in vitro 3D co-culture model to engineer vascularized bone-mimicking tissues combining computational tools and statistical experimental approach. Biomaterials. 76, 157-172 (2016).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。