Method Article
排ビボ移行システムにおけるリンパ球移動の評価
要約
このプロトコルでは、リンパ球は、多孔質膜によって下部チャンバから分離された移行系の上部チャンバーに配置される。ケモカインは底室に添加され、ケモカイン勾配に沿って活発な移動を誘導する。48時間後、リンパ球は、移行を定量するために両方の部屋でカウントされます。
要約
本明細書では、基本的な実験室のスキルと材料を用いて、排外移動系におけるリンパ球ケモキネティック運動を評価する効率的な方法を提示する。グループ2自然リンパ球細胞(ILC2)およびCD4+Tヘルパー細胞を、鶏卵オブアルブミン(OVA)チャレンジBALB/cマウスの脾臓および肺から単離した。CD4+T細胞とILC2の両方でCCR4の発現を比較的確認した。CCL17 および CCL22 は CCR4 の既知のリガンドです。そこで、このex vivo移行法を用いて、CCCL17-およびCCL22誘発性CCR4+リンパ球の動きを調べた。ケモカイン勾配を確立するために、CCL17およびCCL22を移行システムの底室に配置した。その後、単離されたリンパ球を上のチャンバーに加え、48時間の期間にわたって、リンパ球は3μmの細孔を通って下部チャンバーのケモカインに向かって積極的に移行した。これは、リンパ球の化学化物を決定するための効果的なシステムですが、当然のことながら、生体内臓器微小環境に見られる複雑さを模倣しません。これは、研究中の臓器およびリンパ球のその中の画像化の添加によって克服することができる方法の1つの制限である。対照的に、この方法の利点は、ライブイメージングよりもはるかに費用対効果の高い速度でエントリーレベルの技術者によって行う場合です。治療化合物が移行を増強するために利用可能になるにつれて、腫瘍浸潤細胞細胞の場合のように、または移行を阻害するために、おそらく免疫病理学が懸念される自己免疫疾患の場合には、スクリーニングツール。一般に、この方法は、目的のケモカインが一貫してメディア制御よりも統計的に高いレベルでケモキネティクスを生成している場合に有効である。このような場合、所定の化合物による阻害/増強の程度も同様に決定することができる。
概要
このオリジナルの移行方法は、実験医学1のジャーナルで1962年にスティーブン・ボイデンによって提示されました。ケモタキシスとケモキネティクスについて私たちが知っていることの多くは、ボイデン室の開発なしには不可能です。1977年に最初のケモカインが発見される前に、好中球1、2の細胞運動を増幅しながらマクロファージの細胞運動を停止させることができる血清因子について学ぶために、ex vivo移行システムが使用された。免疫細胞の移動に関する膨大な知識が開発され、現在までに47のケモカインが19の対応する受容体3、4で発見されています。さらに、これらのケモカイン経路の多数の阻害剤/増強剤は、治療目的5、6、7、8の開発を受けている。これらの化合物の多くは、与えられたケモカイン9に対する化合物と免疫細胞応答性との間の直接的な相互作用を理解するために同様の移行室で試験されている。
転移、または糖尿病は、炎症を起こした組織への、明確な感染10、11に対する健康的な炎症反応に不可欠なプロセスである。ボイデン室、移動システム、またはトランスウェル装置は、一般に多孔質膜1、12によって分離された2つのチャンバーから構成される。下部チャンバーは、最も頻繁に目的のケモカインを含む媒体を保持し、一方、白血病は上部のチャンバーに配置されます。膜中の細孔の大きさは、目的の細胞の大きさに基づいて選択することができる。このプロジェクトでは、リンパ球細胞の大きさが7~20μmの3μmの多孔質膜を細胞開発の段階に応じて選択しました。この細孔の大きさは、これらの細胞が受動的に細孔を通って落ちていないことを保証するが、彼らは積極的にケモカイン勾配に応答して移動していることを保証します。
このプロトコルの主な利点は、その費用対効果です。生体内移住では、動物の取り扱いや手術に関する広範な訓練が必要であり、研究者が常に利用できるわけではない高出力顕微鏡検査が必要な場合が多いため、移住は困難です。トランスマイグレーションを増強または阻害すると考えられる化合物の費用対効果の高いスクリーニングは、生体内イメージングの前に達成することができる。移行システムが厳密に制御されているので、細胞は最初にトランスウェル装置に加え、またはその逆に、ケモカイン阻害剤で最初に処理し、次いでトランスウェル装置に添加された細胞を治療してもよい。最後に、内皮細胞および/または地下膜タンパク質は、ケモキネティクスにおけるこれらのバリア細胞の関与を理解するために、トランスウェルインサートの1〜2日前にトランスウェルインサートの底部に添加することができる。繰り返しますが、システムのこれらの操作は、生体内研究のより複雑な前に、特定の化合物の有効性に関する重要な情報を決定する強力な手段を提供します。
転移室システムを利用することは、インビボおよびインビトロ条件12、13、14の様々な下でリンパ球移動性を評価する効果的な方法である。ここで、我々は、移民室内におけるケモカインに対する外生生リンパ球応答性を評価するための最適化された方法について説明する。この実験の例では、CD4+T細胞およびグループ2の自然リンパ球細胞(ILC2)を、雄および雌から単離し、BALB/cマウスをOVA-アレルゲン曝露後に分離した。アレルゲンチャレンジマウス由来のCCR4+CD45+リネージュ-(LIN-)ILC2がCCR4+CD4+Tヘルパー細胞よりもCCL17およびCCL22に向かってより効率的に移行するという仮説が生成された。 CCL17およびCCL22は、M2(アレルギー性)表現型の樹状細胞およびマクロファージによって一般的に産生されるケモカインであり、他の細胞の中でも、アレルギー15、16において。CCL17およびCCL22は、気道悪化16、17、18の間に肺で容易に検出されるので、アレルギー性炎症のバイオマーカーと考えることができる。重要なことに、CCR4発現は未処理の対照と比較して上昇し、ハウスダストダニ処理動物から単離されたILC2から生成されたバイオインフォマティクスデータ、および同様にIL-33でex vivoを処理したナイーブ動物からのILC2(IL-33()アレルゲン促進生殖細胞カイン)は、CCR419、20をアップレギュレートします。さらに、免疫ゲノムプロジェクトデータベース(www.immgen.org)におけるILC2のデータによれば、CCR4 mRNAはこれらの自然免疫細胞において高く発現される。現在までに、ILC2の組織への人身売買に関してはほとんど知られていないが、ILC2およびCD4+T細胞は、同様の転写因子および受容体を発現する化学タキシスおよびケモキチン学に類似したケモカインおよび受容体を使用する可能性が高い。そこで、ILC2とCD4+Tリンパ球のCCL17対CCL22応答性を、雄と雌の両方から、OVAチャレンジ動物と比較した。
プロトコル
ここに記載されているすべての方法は、ネブラスカ大学医療センター(UNMC)とユタ大学の施設動物ケアおよび使用委員会によってレビューされ、承認されました。
1. 試薬のセットアップと準備
-
完全なRPMI(ロズウェルパーク記念研究所)メディアを準備します。
- RPMIの90 mLに熱不活性化胎児ウシ血清(FBS)の10 mLを追加します。
- 100xペニシリン連鎖筋筋ミン-グルタミンの1mLを100mLの100mLに10%FBS RPMIの追加します。
-
ILC2 拡張メディアを準備します。
- IL-2およびIL-33(各サイトカイン20ng/mL)を完全なRPMIの10 mLに加える。
- ストックサイトカインが10 μg/mLの場合、完全なRPMI培中の10 mLを含む15 mLチューブにIL-2およびIL-33のピペット20 μLを含む。
-
肺解離培地を調剤する。
- 1型コラゲナーゼの50mgを250mLの未補充RPMIに加える。
- ステップ1.3.1のメディアの250 mLに100倍ペニシリン連鎖筋菌-グルタミンの2.5 mLを追加します。
- メディアを穏やかに混ぜて、1型のコラゲナセが使用前に完全に溶解していることを確認します。
-
血清フリーRPMIを準備します。
- RPMIの200mLで凍結乾燥牛血清アルブミン(BSA)の1gを希釈する。
- 100倍ペニシリン連鎖筋菌-グルタミンの2 mLを追加します。
- BSAが使用前にメディアに完全に溶解していることを確認するために、メディアを穏やかに混ぜます。
-
CCL17 を使用して移行メディアを準備します。
- 無血清RPMIの10 mLを取得し、CCL17[50 ng/mL]を追加します。
- ストックCCL17が10 μg/mLの場合は、50 μLのCCL17ストックを10mLの無血清RPMI培地に加えます。
- 無血清RPMIの10 mLを取得し、CCL17[50 ng/mL]を追加します。
-
CCL22 を使用して移行メディアを準備します。
- 無血清RPMIの10 mLを取得し、CCL22[50 ng/mL]を追加します。
- ストック CCL22 が 10 μg/mL の場合は、50 μL の CCL22 ストックを 10 mL の無血清 RPMI メディアに追加します。
-
CCR4抗体染色カクテルを調調します。
- 合計10回の試験について、抗マウスCCR4、CD19、CD11b、CD45、ST2、ICOSの各抗体を5 mLチューブに加えます。
注:10サンプルに対する抗体カクテルの作る方法の例:各抗体の0.5 μL x 10サンプル=1.7.1に記載されている各抗体の5μL。 - 合計10回の試験について、ステップ1.7.1から抗体カクテルに以下の抗体の2.5 μLを加えます:抗マウスCD3、CD11c、およびNK1.1。
注:10サンプルの抗体カクテルを完成させる例:0.25 μL x 10サンプル= CD3、CD11cおよびNK1.1抗体の2.5 μL。 - CCR4抗体染色カクテルを4°Cで保存し、サンプルに添加する準備が整いました。使用しない場合は、1週間後に抗体カクテルを廃棄します。
- 合計10回の試験について、抗マウスCCR4、CD19、CD11b、CD45、ST2、ICOSの各抗体を5 mLチューブに加えます。
-
1x安定化固定を準備します。
- 脱イオン蒸留水の10 mLを3倍安定化固定濃縮物の5mLに加える
2. アレルゲンチャレンジBALB/cマウスの調製
注:雄および雌のBALB/cマウスは、生後6~8週でチャールズ川(UNMC)またはジャクソン研究所(ユタ大学)から購入した。
-
順応後(1週間)、すべての動物をOVAに感せます。
- 5 mLポリスチレンチューブで水酸化アルミニウム(20mg/mL)に吸着した100 μg/mL OVAを組み合わせます。
- チューブを混合し、すぐに1 mL、28 Gシリンジ(インスリンシリンジ)にOVA-アラム懸濁液の500 μLを引き出します。
- イソフランを含むベル瓶にマウスを入れます(偽の床の下に1~2mL、動物がイソフランに直接立たないように)。マウスが約1〜2分間、または呼吸数が低下するまで麻酔下に入るようにします。
- 背中と肩の毛皮でマウスを素早く拾い、マウス21,22につき腹腔内にOVA-alumの100 μLを注入する。
- マウスをケージに戻し、モビリティを回復させるのを確認します。これは 2 ~ 5 分以内に発生するはずです。
-
感作後7日目、全ての動物を鼻腔内(i.n.)1.5%OVAをネブ化室(データサイエンスインターナショナル)で無菌生理食動物で20分間希釈した。
- ケージからマウスを取り出し、動物の噴霧室に入れ。チャンバーの蓋を閉じます。
- 噴霧チャンバの入力スパウトにネブライゼーションホースを取り付けます。
- ネブライザーのネブライゼーションカップに無菌生理食塩で希釈した1.5%OVAの30 mLを追加します。
- ネブライザーをオンにし、チャンバーが20分間霧で満たされます。
- ネブライザーをオフにし、霧を落ち着かせてください。
- 動物をケージに戻す。
- ステップ2.2を5日間連続5回繰り返し、アレルギー性炎症を誘発する。
3. OVAチャレンジマウスの脾臓および肺からのCD4+T細胞の単離
- 承認されたIACUCプロトコルに従ってCO2窒息によってすべてのOVA処理された雄および雌動物を人道的に安楽死させ、実験ごとに1群あたり2〜3匹の動物を使用する。
- 動物からの肺および脾臓を物品切除し、動物23の組織タイプおよび性別に基づいて別々の解離管に組織を置く。
- 「肺」プロトコルを用いて自動組織解離器で500μLの肺解離培養剤(25ΜL;コラゲナーゼ、タイプ1)で肺組織を解離する。
- 3.2 と 3.3 を合計 2 回繰り返します。
- 自動組織解離体の「脾臓」プロトコルを使用して、完全なRPMI培地の500 μLで脾臓組織を解離する。
注:残りのステップは、無菌技術を使用して生物学的安全キャビネットで実行する必要があります。 - 肺と脾臓を含む解離管を、5 mLの追加肺解離培地または完全RPMIでそれぞれすすいでください。
- 40 μmの細胞ストレーナーを通して細胞懸濁液をフィルターし、50 mL円錐形の管に集める。
- 肺均質化を37°Cインキュベーターで15~30分間均質化し、5%CO2でさらに肺組織を解離します。
- 肺と脾臓の均質化に完全なRPMIの5 mLを追加し、遠心分離を使用して50 mLチューブの底部に細胞をペレット;室温(RT)で378×g、5分間
- 脾細胞と肺細胞を単一の50 mL円錐管に結合し、自動化された細胞カウンターを使用して総細胞数を決定する。
- 分離バッファー内の 1 x 108セル/mL に男性および雌細胞懸濁液を調整し、5 mL ポリスチレンチューブに追加します。
注:エンリッチメントプロトコルは、脾臓および肺からより多くの細胞が獲得されたときに、最大14 mLポリスチレンチューブを調整することができます。このプロトコルは、グループあたり2-3マウスからの組織のために設計されました。したがって、5 mLチューブで十分です。 - ILC2エンリッチメントプロトコルに従ってILC2分離のために、全セルの約3分の2を使用します。
- 細胞懸濁液に抗体カクテル(50μL/mL)を加え、RTで5分間インキュベートします。
- 30sの渦の急速な球および細胞懸濁液の75 μL/mLの率でサンプルに加える。RTで5分間静かに混合し、インキュベートします。
- 分離バッファーと3 mLまでの総容積まで管を上にし、8チャンバーの容易な分離磁石に置く。RTで3分間インキュベートします。
- 磁石を前方に(チューブの背面に付着した球体抗体細胞複合体から離れて)先端を傾け、細胞懸濁液をきれいな5 mLチューブにピペットを外します。
- チューブに1.5 mLの完全なRPMIを追加し、RTで5分間378 x gで遠心分離機を追加します。
- セルペレットから培体を注ぎ、ML当たり1 x 107セルでILC2を再中断します。
- Uボトム、96ウェルプレートに100 μLのオスとメスのILC2をウェル当てに入れ、各ウェルにILC2拡張培地の100 μLを加えます。
- 細胞を4~5日間インキュベートしてILC2を膨張させる。
- ILC2を5 mLチューブに集め、無血清RPMIを最大4.5mL加算します。RTで5分間378 x gで細胞を遠心分離します。
- 血清フリーRPMIで血清計を用いて細胞を数え、血清フリーRPMIでmL当たり1 x 107 ILC2で再中断する。
- 残りのセルは、マウス CD4+ T 細胞分離プロトコルに従って行われる CD4+ T 細胞分離手順に使用します。
- ラット血清(50 μL/mL)をCD4 T細胞濃縮懸濁液に添加する。
- サンプルに絶縁カクテル(50 μL/mL)を加え、RTで10分間インキュベートします。
- 30sの渦の急速な球および75 μL/mLの率でサンプルに加える。
- 細胞懸濁液を穏やかに混合し、2.5分とRTのインキュベート
- サンプルを3 mLまで上げ、5 mLチューブを8チャンバーの容易な分離磁石に入れ、RTで5分間インキュベートします。
- 磁石を前方に傾け、セルサスペンションをきれいな5 mLチューブにピペットします。
- RTで5分間378 x gでチューブと遠心分離機に1.5 mLの無血清RPMIを追加します。
- 細胞ペレットから培剤を注ぎ、血清フリーRPMIで1mL当たり1 x 107細胞でCD4+T細胞を再中断します。
4. 流れ細胞メトリーによるOVAチャレンジ動物からのCD4+T細胞およびグループ2先天性リンパ球細胞(ILC2)におけるCCR4発現の決定
注:以下のステップは、非滅菌技術であるオープンベンチトップ上で行うことができます。
-
ステップ 3.11.10 および 1-2.5 x 106 CD4+ T セルから、ステップ 3.12.8 から約 1-2.5 x 105 ILC2セルを別々の 5 mL チューブで取得します。
- 少なくとも5.0 x 104 CD4+T細胞の追加チューブを染色されていないコントロールとして保管してください。
- FACSバッファーの100-200 μLで細胞を中断し、すべてのチューブにFcブロックの1 μLを追加し、氷(または4°Cの冷蔵庫)で10分間インキュベートします。
- すべてのチューブにFACSバッファの1-2 mLを追加し、RTで5分間378 x gで遠心分離機を追加します。
- 上清を注ぎ、FACSバッファーの100~200μLで細胞を再中断します。
- CCR4抗体染色カクテルの37.5 μLを、「染色されていない」細胞を含むチューブを除くすべてのチューブの細胞懸濁液に添加します。
- チューブを氷の上または4°Cの冷蔵庫で20~30分間インキュベートします。
- すべてのチューブにFACSバッファの1-2 mLを追加し、RTで5分間378 x gで遠心分離機を追加します。
- 上清を注ぎます。
- 手順 4.7 と 4.8 を繰り返します。
- すべてのチューブに250~300μLの1倍安定化固定(材料の表を参照)を追加します。
-
補正ビーズを提供するプロトコルに従ってCCR4抗体カクテル内の各抗体に対して単色ビーズコントロールを調製する。
- 補正ビーズの渦。
- 各単色のコントロールチューブにビーズを1滴追加します。
- CCR4抗体カクテル中の各抗体の1 μLを独自の標識チューブに添加する。
- 4°Cの冷蔵庫または氷の上で10分間、穏やかに混合し、インキュベートします。
- すべてのチューブと遠心分離機に 1-2 mL の FACS バッファーを RT で 5 分間 378 x gで追加します。
- 上清を注ぎ、200 μLのFACSバッファーでビーズを再中断します。
- すべてのサンプルが染色され、フローサイトメーターで分析する準備が整うまで、単色のコントロールを冷蔵します。
- 固定の24時間以内に、染色されていない細胞、単色のコントロール、およびフローサイトメーター上の実験サンプルを分析します。
5. 元ビボ移民手続き
注:彼らは無菌技術を必要とするので、次の手順は、生物学的安全キャビネットで実行する必要があります。
- ステップ 3.11.10 および CD4 T セルから ILC2 をステップ 3.12.8 から取得し、実験に必要なトランスウェル挿入の数を決定します。
注:例: ステップ 3.12.8 からの濃縮 CD4 T 細胞の 1.2 mL の場合、1.2 x 1,000 μL = 1,200 μL を乗算します。次に、1,200 uL を 100 μL = 12 で除算し、CD4 T 移行に必要な挿入物の数を割ります。 - 24ウェルプレートの中央の行から3 μmトランスウェルインサートをゆっくりと動かします。
- CCL17を使用したマイグレーションメディアの500 μLをウェルの約3分の1に追加します。
- CCL22を使用して500 μLのマイグレーションメディアをウェルの3分の1に追加します。
- ウェルの最後の3分の1にケモカインを含まない無血清RPMIの500 μLを追加します。
- プレートの蓋に、下部の井戸に適切な移行媒体を貼り付けます。
- トランスウェルインサートを様々な治療法を含む井戸に戻します。
- 各インサートの上部ウェルに100 μLのCD4 T細胞またはILC2を静かに加えます。これは実験の結果を混乱させる可能性があるため、トランスウェルでセル懸濁液を上下に混合またはピペットしないでください。
- 各井戸に配置されたセルタイプでプレートの蓋を明確にラベル付けし、細胞を追加した日時を書きます。
- すべてのセルがメディアを使用してトランスウェルインサートに配置されるまで、手順 5.2 ~ 5.9 を繰り返します。
- プレートを37°Cのインキュベーターに入れ、5%CO2を48時間にわたって静かに置き、インキュベーション期間中のプレートとの接触を最小限に抑えます。
6. 排外移住の定量化
- インキュベーターからプレートをそっと取り出し、中央の行から真上または下の空の井戸にすべてのトランスウェルインサートを取り外します。
- トランスウェルの下部および上部ウェルから、セルタイプの CCL17、CCL22、またはメディアで、および反復数 (実験ごとに少なくとも 3 回) で、TOP または BOTTOM でラベル付けされたチューブにセルを集みます。
- 1x PBSの500 μLで底部ウェルをすすいで、対応するチューブにこのすすを集えます。
- 1x PBSの250 μLでトップウェルをすすいで、対応するチューブにこのすすを集えます。
- RTで5分間378 x gで遠心分離によって細胞をペレットする。
- 細胞ペレットからすべての上清をそっとピペット。
- T細胞とILC2を1x PBSの50 μLに再中断します。
- セル懸濁液の10 μLを取り、0.4%トリパンブルーの90 μLに加えます。
-
自動セル カウンタ上のセルをカウントします。
- %の実行可能性を記録します。
- 各サンプルの mL あたりのセル数を記録します。
- 上部および下部チャンバ内の治療ごとの細胞の総数を決定します。セル数を記録します。
結果
CD4+ T細胞およびILC2上のCCR4発現。
排生移行実験の成功のためには、リンパ球がCCR4を介してCCL17およびCCL22に応答するかどうかを決定することが不可欠である。そこで、流量細胞メトリーによりCD4+T細胞とILC2の両方でCCR4発現を決定した。OVA特異的CD4+ヘルパーT細胞がCCR4を発現することはよく知られているが、ILC2上のCCR4の発現についてはあまり知られていない。図1は、CCR4発現の代表的な結果を、比較的、CD4+T細胞(図1A,C)およびILC2(図1B,D)の雄および雌から、OVAチャレンジBALB/cマウスを示す。フローサイトメトリーは、アロフィコシアニン(APC)に結合したモノクローナル抗体を用いてCCR4を検出するために使用された。分散の一方通行解析(ANOVA)を用いて、男性と女性の宿主間のCCR4発現に差はないと判断した(図1A-D)が、ILC2の細胞単位(MFI)におけるCCR4の発現はCD4と比較して高かった。+T細胞(図1Cと比較して図1C)。これらの結果は、ILC2およびCD4+T細胞が以下の実験でCCL17およびCCL22に応答すべきであることを示す上で重要である。
転移システムの上下のチャンバーにおけるCCR4リガンドに対するCD4+T細胞の応答性。
雄由来のCD4+T細胞は、OVAチャレンジBALB/cマウスを肺および脾臓から単離し、3μM多孔質膜で分離した移動移動装置の上部チャンバに配置した(図2)。OVA処理マウスの生体内調(図2A)及び転移手順(図2B)の概要を参考に示す。CCL17(25 ng/mL)とCCL22(25ng/mL)の組み合わせを上部チャンバーに配置し、下部チャンバーまたは上下両方のチャンバー(図2C)、(1)OVAチャレンジ動物由来のCD4+T細胞がCCR4に応答したことを確認した。(2)ケモカイン誘発移行は、T細胞がケモカイン勾配に反応して細孔を通って移動し、リンパ球がケモカインとは無関係に細孔を通って移動しなかったという活発なプロセスであった。培地(ケモカインなし)コントロールは、CD4+T細胞が刺激なしで3μM細孔を通って移行できないことを示すために含まれていた。この状態では、細胞の最も高い割合は、上部のチャンバーに残った。ケモカインを上下のチャンバーに同時に入れると、底部チャンバ内のT細胞全体の52%、上部チャンバー内の細胞の48%を検出しました(TOP/BOTTOM処理)。予想通り、ケモカインが存在するコンパートメント内の細胞の割合が最も高いのを検出したので、ケモカインに反応して移動した細胞の分布は、上部または下部のチャンバーにのみ配置されました。
排生移行装置におけるCD4+T細胞およびILC2をCCL17およびCCL22に応答性。
CD4 T細胞およびILC2を雄および雌から、OVAチャレンジマウスを肺および脾臓から単離し、次いでトランスウェル移動装置の上部チャンバに配置した(図3)。本装置の底室には、未処理細胞培養培地、CCL17を含む培地、またはCCL22を含む培地を充填した。代表的な結果は、14%未満(13.37 + 6.5%)メディア制御条件で移行した細胞の(図3A-D)。CCL22に対して、両方の細胞型は、男性または女性の宿主のいずれであるかにかかわらず、CCL22(図3A-D)に応答したが、CCL17の結果は一貫性がなかった。CCL17は、培地単独と比較してメスCD4T細胞およびILC2に対して有意な移行を誘導しただけである(図3C,D)。CCL17治療は、雄CD4+T細胞または雄ILC2(図3A,B)およびCCL22が雄ILC2におけるCCL17よりも大きな移行を誘発した(図2B)の培地と変わらなかった。
生存率の低いCD4+T細胞に対する最適でない移行結果。
移行実験が正常に機能しない場合に何を期待するかの例を研究者に提供するために、最適でない結果が生成されました(図4)。我々は、このプロトコルに従って動物から雄のCD4+T細胞を単離し、移行システムのトップウェルに置いた。CD4+T細胞を添加した後、しかし、プレートは最初の24時間は室温にとどまり、次いで、インキュベーション期間の残りの24時間のインキュベーターにプレートを移動させた。当然のことながら、CCL17およびCCL22(図4A)への移行は検出されず、細胞の生存率は顕著に低かった(<15%)上部のセル (図4B)。これらの欠陥のある結果は、最適な結果を達成するために、このプロトコルで説明されている正しい温度と条件を使用することの重要性を強調しています。
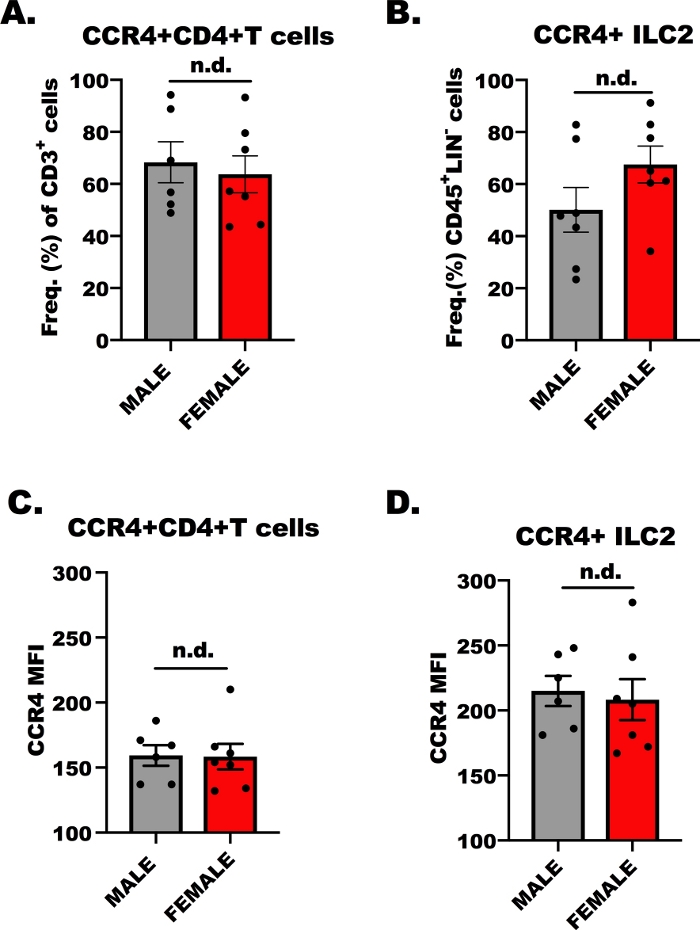
図1:CD4+T細胞およびILC2上のCCR4発現。生後7~9週、雄と雌、BALB/cマウスを100μLのOVA吸着を水酸化アルミニウム(500μg/mL)に一度注入した。OVAおよび20 mg/mL水酸化アルミニウム)5の最初の7日前に、反復的な、毎日の気道の課題は生理生理中の1.5%のOVAと。アレルゲンに挑戦した動物を人道的に安楽死させ、肺および脾臓組織をILC2およびCD4+T細胞単離のために採取した。その後、細胞の小さなアリコートを染色し、フローサイトメトリーによって分析し、各細胞タイプのCCR4のレベルを決定した。(A)OVA+マウスからのCCR4+T細胞の周波数は、誤差バーが平均(+ SEM)の標準誤差を表す。(B)CCR4+ (+SEM)であったILC2の周波数。(C, D)CCR4の平均蛍光強度(+SEM)(C)CD4+T細胞および(D)ILC2。これらのデータを生成するために合計13匹のマウスを用い、フロー実験を2回繰り返し、実験ごとに各処理を3回複製した。有意性は一方通行の分散分析によって決定された。n.d. は、グループ間に違いがないことを示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:転移システムの上下室におけるCCR4リガンドに対するCD4+T細胞の応答性。雄BALB/cマウスは、鶏卵オブアルブミン(OVA)およびCD4+T細胞を感作し、脾臓および肺から単離した(A、B)。 この移行実験では、CD4+T細胞を1x107細胞/mLで無血清培中に懸濁した。CCL17およびCCL22を50ng/mL(各ケモカインの25ng/mL)の濃度で無血清培地に添加し、合計50ng/mLを達成した。ケモカイン含有培合剤は、上部チャンバのみに、底部チャンバのみに、または上部と下部の両方のチャンバーに添加した。下部ウェルに500μLのトランスマイグレーション培養液を加え、100μLの細胞懸濁液(1 x 106細胞/ウェル)を上部ウェルに添加した。移民は、培養中の48時間後に測定した(C)。これらのデータは、単一の実験から生成され、3つのOVA処理、雄マウスを組織採取に用い、および3回の複製を処理ごとに行った。統計的有意性は、一方通行の分散分析によって決定された。*p < 0.05.この図のより大きなバージョンを表示するには、ここをクリックしてください。
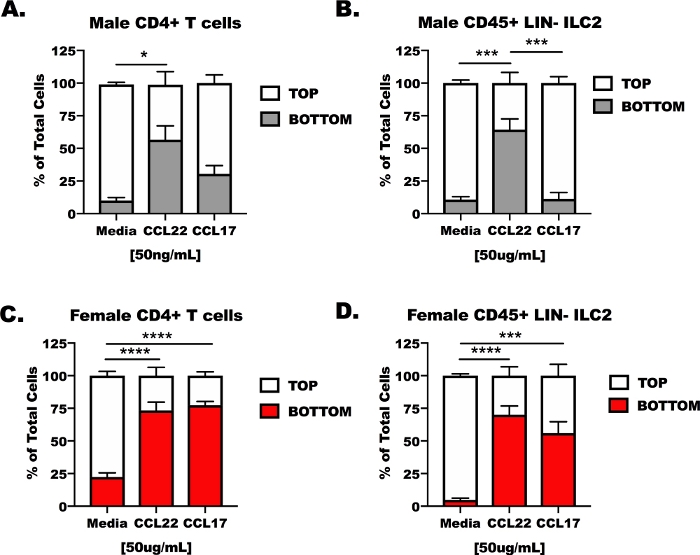
図3:排外移動装置におけるCD4+T細胞およびILC2をCCL17およびCCL22に応答性。マウスは、CD4+T細胞およびILC2を脾臓および肺から分離した図1のように調製した。CD4+T細胞およびILC2は、1 x 107細胞/mLで無血清培中に懸濁した。CCL17またはCCL22を50ng/mLの濃度で無血清培地に添加した。500μLの移行培養培養物を底部ウェルに添加し、100μLの細胞懸濁液(1x106細胞/ウェル)を上部ウェルに添加した。移民は、培養中の48時間後に測定した。(A)CD4+ T細胞および(B)オス宿からのILC2を対照、CCL17、またはCCL22として培地で処理した。同様に、(C)メスCD4+T細胞および(D)メスILC2を培地、CCL17、またはCCL22で処理した。これらのデータを生成するために合計14匹のマウスを用いた。移行実験を4回繰り返し、実験ごとに各治療を3~6回複製した。有意性は一方通行の分散分析によって決定された。*p < 0.05, ***p < 0.001, ****p < 0.0001.この図のより大きなバージョンを表示するには、ここをクリックしてください。

図4:生存率の低いCD4 T細胞に対する最適な移行結果。ナイーブ雄BALB/cマウスは、図1、図2、および図3のように肺および脾臓組織採取およびCD4+T細胞単離のために取得した。CD4T細胞を転移装置の上部チャンバに添加し、CCL17を含む無血清培地、CCL22またはケモカイン(培地制御)を下部ウェルに添加した。実験の最初の24時間は、プレートを室温で残し、次いで5%CO2で37°Cインキュベーターに移動し、さらに24時間(A)24時間後に上下の井戸に残っている細胞の割合(B)Cの生存率を高めた。悪いインキュベーション条件に続く上部および下部チャンバー内のD4+T細胞。これらのデータは、単一の実験から生成され、3匹のナイーブ雄マウスを組織採取に使用し、3回の複製を治療ごとに行った。統計的有意性は決定されなかった。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
本明細書では、排生体移行システムにおけるケモカイン誘発リンパ球の移行を評価するための確立された方法を提示する。プロトコルにはいくつかの重要なステップがあり、そのうちの1つは実験中の免疫細胞上の正しいケモカイン受容体の発現を検証することである。私たちの手の中で、我々はアレルギー性炎症におけるTh2ヘルパーT細胞上のCCR4の重要性を強調する文献の体のためですCCR4を選びました。オブアルブミン誘発性炎症は、以前に少なくとも2つのCCR4アンタゴニスト24、25によって制限されることが示された。しかしながら、これは、グループ2自然リンパ球細胞(ILC2)26、27の発見前であった。我々は、ILC2細胞がCD4+T細胞よりも高いCCR4を発現することを示す新しいデータを生成し、これらの細胞がCCL22に一貫して応答していることを示した。
プロトコルに従うべき2番目の重要なステップは、プロトコルの移行部分を開始する前に、細胞が培養に最適な媒体に保たれるようにすることです。ILC2の場合、IL-2とIL-33の両方を含むILC2拡張培養培養培養培養でこれらの細胞を培養する必要があった。IL-2およびIL-7はいずれも、14日28日、29日までの培養中のILC2をサポートする文献で報告されている。将来の実験でCD4+T細胞およびILC2の生存率が問題となる場合、IL-2またはIL-7を添加すると、実験の終点までリンパ球の生存率が向上する可能性が高い。本明細書に提示される各媒体は、いくつかの実験の過程で定義され、このプロトコル14、30、31での使用のために最適化された。図4では、適切な温度と5%CO2のインキュベーターを使用することの重要性を実証するために、欠陥のある結果を提示した。移行プレートを邪魔しないインキュベーターに保管することは、プロトコルの成功のためのもう一つの重要なステップです。
前述したように、ほとんどの機関で利用可能な生体内顕微鏡を使用することには利点がありますが、生体内イメージングでは時間とコストがかかる場合があります。より安価である代替実験手順は、化学細胞の勾配と組み合わせてマイクロ流体を使用して、白血病の散播体および組織移動32、33、34を理解する。これらのシステムは、微小流体系の毛細血管上に成長することができる内皮細胞を含む細胞動態の複雑さを評価するため、科学的価値を保持します。さらに、これらのマイクロ流体系は、血流下での細胞付着の過程で、内皮細胞および免疫細胞上のインテグリンに対するタンパク質(例えば、E-カドヘリン)の付着タンパク質の重要性を評価する。それにもかかわらず、これらのシステムは、各治療条件の重要性を決定するために、特殊な機器と複雑な計算プログラミングと統計を必要とします。従って、ここで提示される移行方法の限界は、本質的に人工的であるというものであるが、その後の生体内での不要試薬の無駄を制限する重要なスクリーニングツールとして用いることができる。この方法の重要性は、ILC2の場合と同様に、新しい細胞が発見されると、既知のケモカインに対する応答性のためにこれらの細胞をスクリーニングできることである。これは、喘息の悪化中に肺への移行を阻害する可能性のあるILC2および潜在的な治療法を含む将来のアプリケーションの一つです。この移行プロトコルは、CCR4またはILC2の募集に関与する他の化学的メディエーターを制限するために使用される可能性のある様々な阻害剤をスクリーニングするために使用されます。全体として、このex vivo移行プロトコルは、生体内実験で将来検証できる重要なデータの生成につながります。
開示事項
著者は、開示する財務情報や利益相反を持っていません。
謝辞
この作品は、米国肺協会(K.J.W.)、T.A.W.とK.J.W.に授与されたメモリアルユージーン・ケニー基金、ユタ大学からの寛大なスタートアップ支援、およびT.A.W.(VA I01BX0035)に対する退役軍人省賞によって資金提供されました。T.A.W.は退役軍人省から研究キャリアサイエンティスト賞(IK6 BX003781)を受賞しています。著者たちは、リサ・チュドメルカ氏の編集支援を認めたいと考えています。著者らは、この原稿のために生成されたフローサイトメトリーデータを収集する上での彼らのサポートのためのUNMCフローサイトメトリーコアに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Sigma-Aldrich | 15250061 | |
| 1 mL syringe | BD Bioscience | 329424 | U-100 Syringes Micro-Fine 28 G 1/2" 1cc |
| 100x Penicillin-Streptomycin, L-Glutamine | Gibco | 10378-016 | Dilute to 1x in RPMI media |
| 15 mL conical tubes | Olympus Plastics | 28-101 | polypropylene tubes |
| 3 μm transwell inserts | Genesee Scientific | 25-288 | 24-well plate containing 12 transwell inserts |
| 3x stabilizing fixative | BD Pharmigen | 338036 | Prepare 1x solution according to manufacturers protocol |
| 5 mL polystyrene tubes | STEM Cell Technologies | 38007 | |
| 50 mL conical tubes | Olympus Plastics | 28-106 | polypropylene tubes |
| 8-chamber easy separation magnet | STEM Cell Technologies | 18103 | |
| ACK Lysing Buffer | Life Technologies Corporation | A1049201 | |
| Advanced cell strainer, 40 μm | Genesee Scientific | 25-375 | nylon mesh, 40 μm strainers |
| Aluminum Hydroxide, Reagent Grade | Sigma-Aldrich | 239186-25G | 20 mg/mL |
| anti-mouse CCR4; APC-conjugated | Biolegend | 131211 | 0.5 μg/test |
| anti-mouse CD11b | BD Pharmigen | 557396 | 0.5 μg/test |
| anti-mouse CD11c; PE eFluor 610 | Thermo-Fischer Scientific | 61-0114-82 | 0.25 μg/test |
| anti-mouse CD16/32, Fc block | BD Pharmigen | 553141 | 0.5 μg/test |
| anti-mouse CD19; APC-eFluor 780 conjugated | Thermo-Fischer Scientific | 47-0193-82 | 0.5 μg/test |
| anti-mouse CD3; PE Cy 7-conjugated | BD Pharmigen | 552774 | 0.25 μg/test |
| anti-mouse CD45; PE conjugated | BD Pharmigen | 56087 | 0.5 μg/test |
| anti-mouse ICOS (CD278) | BD Pharmigen | 564070 | 0.5 μg/test |
| anti-mouse NK1.1 (CD161); FITC-conjugated | BD Pharmigen | 553164 | 0.25 μg/test |
| anti-mouse ST2 (IL-33R); PerCP Cy5.5 conjugated | Biolegend | 145311 | 0.5 μg/test |
| Automated Cell Counter | BIORAD | 1450102 | |
| Automated Dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| Bovine Serum Albumin, Lyophilized Powder | Sigma-Aldrich | A2153-10G | 0.5% in serum-free RPMI |
| Cell Counter Clides | BIORAD | 1450015 | |
| Chicken Egg Ovalbumin, Grade V | Sigma-Aldrich | A5503-10G | 500 μg/mL |
| Collagenase, Type 1, Filtered | Worthington Biochemical Corporation | CLSS-1, purchase as 5 X 50 mg vials (LS004216) | 25 U/mL in RPMI |
| Compensation beads | Affymetrix | 01-1111-41 | 1 drop per contol tube |
| Dissociation Tubes | MACS Miltenyi Biotec | 130-096-335 | |
| FACS Buffer | BD Pharmigen | 554657 | 1x PBS + 2% FBS, w/ sodium azide; stored at 4 °C |
| Heat Inactivated-FBS | Genesee Scientific | 25-525H | 10% in complete RPMI & ILC2 Expansion Media |
| Mouse CCL17 | GenScript | Z02954-20 | 50 ng/mL |
| Mouse CCL22 | GenScript | Z02856-20 | 50 ng/mL |
| Mouse CD4+ T cell enrichment kit | STEM Cell Technologies | 19852 | |
| Mouse IL-2 | GenScript | Z02764-20 | 20 ng/mL |
| Mouse ILC2 enrichment kit | STEM Cell Technologies | 19842 | |
| Mouse recombinant IL-33 | STEM Cell Technologies | 78044 | 20 ng/mL |
| RPMI | Life Technologies Corporation | 22400071 | |
| Separation Buffer | STEM Cell Technologies | 20144 | 1x PBS + 2% FBS; stored at 4 °C |
| Small animal nebulizer and chamber | Data Sciences International | ||
| Sterile saline | Baxter | 2F7124; NDC 0338-0048-04 | 0.9% Sodium Chloride |
参考文献
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Moser, B. Editorial: History of Chemoattractant Research. Frontiers in Immunology. 6, 548 (2015).
- Borroni, E. M., Savino, B., Bonecchi, R., Locati, M. Chemokines sound the alarmin: The role of atypical chemokine in inflammation and cancer. Seminars in Immunology. 38, 63-71 (2018).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. The New England Journal of Medicine. 354 (6), 610-621 (2006).
- Abboud, D., Hanson, J. Chemokine neutralization as an innovative therapeutic strategy for atopic dermatitis. Drug Discovery Today. 22 (4), 702-711 (2017).
- Aldinucci, D., Casagrande, N. Inhibition of the CCL5/CCR5 Axis against the Progression of Gastric Cancer. International Journal of Molecular Sciences. 19 (5), E1477 (2018).
- Chonco, L., et al. Novel DNA Aptamers Against CCL21 Protein: Characterization and Biomedical Applications for Targeted Drug Delivery to T Cell-Rich Zones. Nucleic Acid Therapy. 28 (4), 242-251 (2018).
- Trivedi, P. J., Adams, D. H. Chemokines and Chemokine Receptors as Therapeutic Targets in Inflammatory Bowel Disease; Pitfalls and Promise. Journal of Crohn's and Colitis. 12 (12), 1508 (2018).
- Pietrosimone, K. M., Bhandari, S., Lemieux, M. G., Knecht, D. A., Lynes, M. A. In vitro assays of chemotaxis as a window into mechanisms of toxicant-induced immunomodulation. Current Protocols in Toxicology. 58 (Unit 18.17), (2013).
- Davis, D. M. How studying the immune system leads us to new medicines. Lancet. 391 (10136), 2205-2206 (2018).
- Culley, F. J., Pennycook, A. M., Tregoning, J. S., Hussell, T., Openshaw, P. J. Differential chemokine expression following respiratory virus infection reflects Th1- or Th2-biased immunopathology. Journal of Virology. 80 (9), 4521-4527 (2006).
- Denney, H., Clench, M. R., Woodroofe, M. N. Cleavage of chemokines CCL2 and CXCL10 by matrix metalloproteinases-2 and -9: implications for chemotaxis. Biochemical and Biophysics Research Communications. 382 (2), 341-347 (2009).
- Burrell, B. E., et al. Lymph Node Stromal Fiber ER-TR7 Modulates CD4+ T Cell Lymph Node Trafficking and Transplant Tolerance. Transplantation. 99 (6), 1119-1125 (2015).
- Warren, K. J., Iwami, D., Harris, D. G., Bromberg, J. S., Burrell, B. E. Laminins affect T cell trafficking and allograft fate. The Journal of Clinical Investigation. 124 (5), 2204-2218 (2014).
- Hirata, H., et al. Th2 cell differentiation from naive CD4(+) T cells is enhanced by autocrine CC chemokines in atopic diseases. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. , (2018).
- Lin, R., Choi, Y. H., Zidar, D. A., Walker, J. K. L. beta-Arrestin-2-Dependent Signaling Promotes CCR4-mediated Chemotaxis of Murine T-Helper Type 2 Cells. American Journal of Respiratory Cell and Molecular Biology. 58 (6), 745-755 (2018).
- Zhang, Y., et al. A new antagonist for CCR4 attenuates allergic lung inflammation in a mouse model of asthma. Science Reports. 7 (1), 15038 (2017).
- Lu, Y., et al. Dynamics of helper CD4 T cells during acute and stable allergic asthma. Mucosal Immunology. 11 (6), 1640-1652 (2018).
- Li, B. W. S., Beerens, D., Brem, M. D., Hendriks, R. W. Characterization of Group 2 Innate Lymphoid Cells in Allergic Airway Inflammation Models in the Mouse. Methods in Molecular Biology. 1559, 169-183 (2017).
- Li, B. W. S., et al. Group 2 Innate Lymphoid Cells Exhibit a Dynamic Phenotype in Allergic Airway Inflammation. Frontiers in Immunology. 8, 1684 (2017).
- Warren, K. J., et al. Sex differences in activation of lung-related type-2 innate lymphoid cells in experimental asthma. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. , (2016).
- Warren, K. J., et al. Ovalbumin-sensitized mice have altered airway inflammation to agriculture organic dust. Respiratory Research. 20 (1), 51 (2019).
- Poole, J. A., et al. alphabeta T cells and a mixed Th1/Th17 response are important in organic dust-induced airway disease. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. 109 (4), 266-273 (2012).
- Matsuo, K., et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomedical Pharmacotherapy. 109, 1437-1444 (2019).
- Mikhak, Z., et al. Contribution of CCR4 and CCR8 to antigen-specific T(H)2 cell trafficking in allergic pulmonary inflammation. The Journal of Allergy and Clinical Immunology. 123 (1), 67-73 (2009).
- Monticelli, L. A., et al. Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nature Immunology. 12 (11), 1045-1054 (2011).
- Saenz, S. A., et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 464 (7293), 1362-1366 (2010).
- Hoyler, T., et al. The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity. 37 (4), 634-648 (2012).
- Nakajima, H., Shores, E. W., Noguchi, M., Leonard, W. J. The common cytokine receptor gamma chain plays an essential role in regulating lymphoid homeostasis. The Journal of Experimental Medicine. 185 (2), 189-195 (1997).
- Warren, K. J., et al. RSV-specific anti-viral immunity is disrupted by chronic ethanol consumption. Alcohol. , (2016).
- Warren, K. J., Poole, J. A., Sweeter, J. M., DeVasure, J. M., Wyatt, T. A. An association between MMP-9 and impaired T cell migration in ethanol-fed BALB/c mice infected with Respiratory Syncytial Virus-2A. Alcohol. , (2018).
- Molteni, R., et al. A novel device to concurrently assess leukocyte extravasation and interstitial migration within a defined 3D environment. Lab on a Chip. 15 (1), 195-207 (2015).
- Bersini, S., et al. Human in vitro 3D co-culture model to engineer vascularized bone-mimicking tissues combining computational tools and statistical experimental approach. Biomaterials. 76, 157-172 (2016).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved