Method Article
Bewertung der Lymphozytenmigration in einem Ex-Vivo-Transmigrationssystem
In diesem Artikel
Zusammenfassung
In diesem Protokoll werden Lymphozyten in die obere Kammer eines Transmigrationssystems gelegt, die durch eine poröse Membran von der unteren Kammer getrennt sind. Chemokin wird der unteren Kammer hinzugefügt, was eine aktive Migration entlang eines Chemokingradienten induziert. Nach 48 h werden Lymphozyten in beiden Kammern gezählt, um die Transmigration zu quantitieren.
Zusammenfassung
Hierbei präsentieren wir eine effiziente Methode, die mit grundlegenden Laborfertigkeiten und Materialien ausgeführt werden kann, um die lymphozyte chemokine Bewegung in einem Ex-vivo-Transmigrationssystem zu bewerten. Angeborene Lymphzellen der Gruppe 2 (ILC2) und CD4+ T-Helferzellen wurden aus Milz und Lunge von Hühnerei-Ovalbumin (OVA)-herausgeforderten BALB/c-Mäusen isoliert. Wir haben die Expression von CCR4 auf CD4+ T-Zellen und ILC2, vergleichsweise bestätigt. CCL17 und CCL22 sind die bekannten Liganden für CCR4; Daher haben wir mit dieser Ex-vivo-Transmigration-Methode die CCL17- und CCL22-induzierte Bewegung von CCR4+ Lymphozyten untersucht. Um Chemokin-Gradienten zu ermitteln, wurden CCL17 und CCL22 in die untere Kammer des Transmigration-Systems gelegt. Isolierte Lymphozyten wurden dann den oberen Kammern zugesetzt und über einen Zeitraum von 48 h wanderten die Lymphozyten aktiv durch 3 m Poren in Richtung Chemokin in der unteren Kammer. Dies ist ein wirksames System zur Bestimmung der Chemokinetik von Lymphozyten, imitiert aber verständlicherweise nicht die Komplexitäten, die in den in vivo Organmikroumgebungen zu finden sind. Dies ist eine Einschränkung der Methode, die durch die Zugabe von In-situ-Bildgebung des untersuchten Organs und Lymphozyten überwunden werden kann. Im Gegensatz dazu besteht der Vorteil dieser Methode darin, dass ein Einsteigertechniker viel kostengünstiger als Live-Bildgebung durchgeführt werden kann. Da therapeutische Verbindungen zur Verbesserung der Migration verfügbar werden, wie im Falle von Tumor infiltrierenden zytotoxischen Immunzellen, oder um die Migration zu hemmen, vielleicht im Falle von Autoimmunerkrankungen, bei denen die Immunpathologie von Beunruhigung ist, kann diese Methode als Screening-Tool. Im Allgemeinen ist die Methode wirksam, wenn das Chemokin von Interesse konsequent Chemokinetik auf einem statistisch höheren Niveau als die Medienkontrolle erzeugt. In solchen Fällen kann auch der Grad der Hemmung/Verbesserung durch eine bestimmte Verbindung bestimmt werden.
Einleitung
Diese ursprüngliche Transmigration-Methode wurde 1962 von Stephen Boyden im Journal of Experimental Medicine1vorgestellt. Vieles von dem, was wir über Chemotaxis und Chemokinetik wissen, wäre ohne die Entwicklung der Boydenkammer nicht möglich. Vor der Entdeckung des ersten Chemokins im Jahr 1977 wurden Ex-vivo-Transmigrationssysteme verwendet, um mehr über Serumfaktoren zu erfahren, die zelluläre Bewegungen in Makrophagen festsetzen könnten, während die zelluläre Motilität in Neutrophilen verstärkt wird1,2. Es wurde ein riesiger Wissensschatz in Bezug auf die Immunzellmigration entwickelt, und bis heute wurden 47 Chemokine mit 19 entsprechenden Rezeptoren3,4entdeckt. Darüber hinaus haben viele Inhibitoren/Enhancer dieser Chemokin-Wege eine Entwicklung zu therapeutischenZwecken5,6,7,8. Viele dieser Verbindungen wurden in ähnlichen Transmigrationskammern getestet, um direkte Wechselwirkungen zwischen den Verbindungen und immunzellige Reaktionsfähigkeit auf ein bestimmtes Chemokin zu verstehen9.
Transmigration, oder Diapedese, in entzündetes Gewebe ist ein wesentlicher Prozess für eine gesunde Entzündungsreaktion auf klare Infektion10,11. Ein Boyden-Kammer-, Transmigrationssystem oder Transwell-Apparat besteht in der Regel aus zwei Kammern, die durch eine poröse Membran1,12getrennt sind. Die untere Kammer hält am häufigsten Medien, die das Chemokin von Interesse enthalten, während Leukozyten in der oberen Kammer platziert werden. Die Größe der Pore in der Membran kann basierend auf der Größe der betreffenden Zelle ausgewählt werden. Für dieses Projekt haben wir eine poröse Membran von 3 m ausgewählt, da die Lymphzellen je nach Stadium der zellulären Entwicklung 7-20 m groß sind. Diese Porengröße stellt sicher, dass diese Zellen nicht passiv durch die Poren fallen, sondern dass sie aktiv als Reaktion auf den Chemokingradienten migrieren.
Der hauptvorteil dieses Protokolls ist seine Wirtschaftlichkeit. Die In-vivo-Transmigration ist schwierig, da sie eine umfassende Ausbildung im Umgang mit Tieren und in der Chirurgie erfordert und häufig eine hochleistungsfähige Mikroskopie erfordert, die einem Forscher nicht immer zur Verfügung steht. Kostengünstiges Screening von Verbindungen, von denen angenommen wird, dass sie die Transmigration verbessern oder hemmen, kann vor der In-vivo-Bildgebung durchgeführt werden. Da das Transmigrationssystem streng kontrolliert wird, können Zellen zunächst dem Transwell-Apparat zugesetzt werden, oder umgekehrt kann das Chemokin zuerst mit einem Chemokin-Inhibitor behandelt werden, dann mit Zellen, die dem Transwell-Apparat zugesetzt werden. Schließlich können Endothelzellen und/oder Kellermembranproteine 1-2 Tage vor dem Transmigrationsexperiment an der Unterseite des Transwell-Inserts zugesetzt werden, um die Beteiligung dieser Barrierezellen an der Chemokinetik zu verstehen. Auch diese Manipulationen des Systems bieten ein leistungsfähiges Mittel, um wichtige Informationen über die Wirksamkeit einer bestimmten Verbindung im Vorfeld komplizierterer In-vivo-Studien zu bestimmen.
Die Verwendung eines Transmigrationskammersystems ist eine effektive Möglichkeit, die Lymphozytenmobilität unter verschiedenen In-vivo- und In-vitro-Bedingungen12,13,14zu bewerten. Hierin beschreiben wir eine optimierte Methode zur Beurteilung der Ex-vivo-Lymphozytenreaktion auf Chemokine in einer Transmigrationskammer. In diesem Beispielexperiment wurden CD4+ T-Zellen und angeborene Lymphzellen der Gruppe 2 (ILC2) nach der OVA-Allergen-Exposition von männlichen und weiblichen BALB/c-Mäusen isoliert. Es wurde die Hypothese erstellt, dass CCR4+ CD45+ Lineage- (LIN-) ILC2 von allergenbekämpften Mäusen effizienter in Richtung CCL17 und CCL22 migrieren würde als CCR4+ CD4+ T-Helferzellen. CCL17 und CCL22 sind Chemokine, die häufig von dendritischen Zellen und Makrophagen des M2 (allergischen) Phänotyps unter anderen Zellen, in Allergie15,16produziert werden. CCL17 und CCL22 können als Biomarker allergischer Entzündungen betrachtet werden, da sie bei Atemwegsexazerbationen16,17,18leicht in der Lunge nachgewiesen werden können. Wichtig ist, dass die CCR4-Expression im Vergleich zu unbehandelten Kontrollen erhöht ist, wie aus bioinformatischen Daten hervorgeht, die aus ILC2 gewonnen wurden, das von Hausstaubmilben behandelten Tieren isoliert wurde, und ähnlich ILC2 von naiven Tieren, die ex vivo mit IL-33 behandelt wurden ( allergenförderndes angeborenes Zytokin) upreguliert CCR419,20. Darüber hinaus ist CCR4 mRNA nach Daten für ILC2 in der Datenbank des Immunologischen Genomprojekts (www.immgen.org) in diesen angeborenen Immunzellen stark exprimiert. Bis heute ist wenig über den Handel mit ILC2 in Gewebe bekannt, aber es ist wahrscheinlich, dass die ILC2- und CD4+ T-Zellen ähnliche Chemokine und Rezeptoren für Chemotaxis und Chemokinetik verwenden, da sie ähnliche Transkriptionsfaktoren und Rezeptoren ausdrücken. So verglichen wir CCL17 versus CCL22 Reaktionsfähigkeit, von ILC2 und CD4+ T Lymphozyten, von männlichen und weiblichen, OVA-herausgeforderten Tieren.
Protokoll
Alle hier beschriebenen Methoden wurden von den Institutional Animal Care and Use Committees am University of Nebraska Medical Center (UNMC) und der University of Utah überprüft und genehmigt.
1. Aufbau und Herstellung von Reagenzien
-
Bereiten Sie komplette RPMI (Roswell Park Memorial Institute) Medien vor.
- Fügen Sie 10 ml hitzeinaktiviertes fetales Rinderserum (FBS) zu 90 ml RPMI hinzu.
- 1 ml 100x Penicillin-Streptomycin-Glutamin zu 100 ml von 10% FBS RPMI hinzufügen.
-
Bereiten Sie ILC2-Erweiterungsmedien vor.
- Fügen Sie IL-2 und IL-33 (20 ng/ml pro Zytokin) zu 10 ml vollständigem RPMI hinzu.
- Wenn die Zytokine der Lager 10 g/ml betragen, werden die Pipette 20 l IL-2 und IL-33 in ein 15 ml-Rohr mit 10 ml kompletten RPMI-Medien pipetten.
-
Vorbereiten der Lungendissoziation Medium.
- Fügen Sie 50 mg Typ 1 Kollagenase zu 250 ml unsupplementiertes RPMI hinzu.
- 2,5 ml 100x Penicillin-Streptomycin-Glutamin in Schritt 1.3.1 zu den 250 ml Medien hinzufügen.
- Mischen Sie die Medien vorsichtig, um sicherzustellen, dass die Typ-1-Collagenase vor der Anwendung vollständig aufgelöst wird.
-
Bereiten Sie serumfreies RPMI vor.
- 1 g lyophilisiertes Rinderserumalbumin (BSA) in 200 ml RPMI verdünnen.
- 2 ml 100x Penicillin-Streptomycin-Glutamin hinzufügen.
- Mischen Sie die Medien vorsichtig, um sicherzustellen, dass die BSA vor dem Gebrauch vollständig in den Medien aufgelöst wird.
-
Bereiten Sie Migration Medium mit CCL17 vor.
- Erwerben Sie 10 ml serumfreies RPMI und fügen Sie CCL17 [50 ng/mL] hinzu.
- Wenn der Lager-CCL17 10 g/ml beträgt, fügen Sie 50 L CCL17-Bestand auf 10 ml serumfreies RPMI-Medium hinzu.
- Erwerben Sie 10 ml serumfreies RPMI und fügen Sie CCL17 [50 ng/mL] hinzu.
-
Bereiten Sie Migration Medium mit CCL22 vor.
- Erwerben Sie 10 ml serumfreies RPMI und fügen Sie CCL22 [50 ng/mL] hinzu.
- Wenn der Lager-CCL22-Bestand 10 g/ml beträgt, fügen Sie 50 L CCL22-Bestand auf 10 ml serumfreies RPMI-Medium hinzu.
-
Bereiten Sie CCR4 Antikörper Staining Cocktail.
- Fügen Sie für insgesamt 10 Tests 5 l der folgenden Antikörper zu einem 5 ml-Rohr hinzu: Anti-Maus-CCR4, CD19, CD11b, CD45, ST2 und ICOS.
HINWEIS: Beispiel für die Herstellung von Antikörpercocktails für 10 Proben: 0,5 l jeder Antikörper x 10 Proben = 5 l jedes der in 1.7.1 aufgeführten Antikörper. - Für insgesamt 10 Tests fügen Sie dem Antikörpercocktail aus Schritt 1.7.1: Anti-Maus-CD3, CD11c und NK1.1 2,5 l der folgenden Antikörper hinzu.
HINWEIS: Beispiel zum Vervollständigen des Antikörpercocktails für 10 Proben: 0,25 l x 10 Proben = 2,5 l CD3- und NK1.1-Antikörper. - Den CCR4 Antikörper Staining Cocktail bei 4 °C aufbewahren, bis er bereit ist, den Proben hinzuzufügen. Entsorgen Sie Antikörpercocktail nach 1 Woche, wenn sie nicht verwendet werden.
- Fügen Sie für insgesamt 10 Tests 5 l der folgenden Antikörper zu einem 5 ml-Rohr hinzu: Anti-Maus-CCR4, CD19, CD11b, CD45, ST2 und ICOS.
-
Bereiten Sie 1x Stabilisierende Fixierung vor.
- 10 ml deionisiertes destilliertes Wasser zu 5 ml 3x stabilisierendem Fixierkonzentrat hinzufügen
2. Zubereitung allergenbewehrter BALB/c-Mäuse
HINWEIS: Männliche und weibliche BALB/c-Mäuse wurden im Alter von 6 bis 8 Wochen im Alter von 6 bis 8 Wochen von Charles River (UNMC) oder Jackson Laboratories (University of Utah) gekauft.
-
Nach der Akklimatisierung (1 Woche), sensibilisieren alle Tiere zu OVA.
- Kombinieren Sie 100 g/ml OVA adsorbiert auf Aluminiumhydroxid (20 mg/ml) in einem 5 ml Polystyrol-Rohr.
- Mischen Sie das Rohr und ziehen Sie sofort 500 l der OVA-AlumSuspension in eine 1 ml, 28 G Spritze (Insulinspritze).
- Legen Sie eine Maus in ein Glockenglas mit Isofluran (1-2 ml unter einem falschen Boden, damit das Tier nicht direkt in Isofluran steht). Lassen Sie die Maus unter Anästhesie für etwa 1-2 min gehen, oder bis die Rate der Atmung sinkt.
- Nehmen Sie schnell die Maus am Fell auf dem Rücken und den Schultern und injizieren Sie 100 l OVA-Alum intraperitoneally pro Maus21,22.
- Legen Sie die Maus wieder in den Käfig und achten Sie darauf, dass sie wieder beweglich sind; dies sollte innerhalb von 2-5 min erfolgen.
-
Sieben Tage nach der Sensibilisierung unterziehen Sie alle Tiere intranasalen (d.h.) 1,5% OVA in steriler Salin in einer Vernebelungskammer (Data Sciences International) für 20 min verdünnt.
- Entfernen Sie Mäuse aus ihren Käfigen und legen Sie sie in die tierische Vernebelungskammer. Schließen Sie den Deckel auf der Kammer.
- Befestigen Sie den Nebelschlauch am Eingangsauslauf an der Vernebelungskammer.
- 30 ml 1,5% OVA in steriler Salin verdünnt in den Verneblerbecher geben.
- Schalten Sie den Vernebler ein und lassen Sie die Kammer 20 min lang mit Nebel füllen.
- Schalten Sie den Vernebler aus und lassen Sie den Nebel absetzen.
- Bringen Sie die Tiere in ihre Käfige zurück.
- Wiederholen Sie Schritt 2.2 für insgesamt 5 Mal, an 5 aufeinanderfolgenden Tagen, um allergische Entzündungen zu induzieren.
3. Isolierung von CD4+ T-Zellen aus Milz und Lunge von OVA-herausgeforderten Mäusen
- Humane Euthane alle OVA-behandelten männlichen und weiblichen Tiere durch CO2-Erstickung nach zugelassenen IACUC-Protokollen, mit 2 bis 3 Tieren pro Gruppe, pro Experiment.
- Verbrauchen Von Lungen und Milz von Tieren und legen Gewebe in getrennten Dissoziationsröhren basierend auf gewebeartund geschlechtdes Tier23.
- Dissoziieren Sie Lungengewebe in 500 L Lungendissoziation Medien (25 U/ml; Kollagenase, Typ 1) im automatisierten Gewebedissoziator mit dem "Lungen"-Protokoll.
- Wiederholen Sie 3.2 und 3.3 insgesamt zweimal.
- Dissoziieren Sie Milzgewebe in 500 L vollständiger RPMI-Medien mit dem "Milz"-Protokoll auf dem automatisierten Gewebedissoziator.
HINWEIS: Die restlichen Schritte sollten in einem Biological Safety-Schrank mit steriler Technik durchgeführt werden. - Spülen Sie die dissoziationsröhren, die Lungen- und Milzhomogenate enthalten, mit 5 ml zusätzlichem Lungendissoziationsmedium bzw. Complete RPMI.
- Filtern Sie Zellsuspensionen durch ein 40-m-Zellsieb und sammeln Sie in 50 ml konische Schläuche.
- Inkubieren Sie die Lunge für 15–30 min in einem 37 °C-Inkubator mit 5%CO2, um das Lungengewebe weiter zu dissoziieren.
- Fügen Sie 5 ml Complete RPMI in die Lunge und Milzhomogenate und Pellet der Zellen an der Unterseite der 50 ml-Rohre mit Zentrifugation; 378 x g bei Raumtemperatur (RT) für 5 min.
- Kombinieren Sie Splenozyten und Lungenzellen zu einem einzigen 50 ml konischen Rohr und bestimmen Sie die Gesamtzellzahl mit dem automatisierten Zellzähler.
- Männliche und weibliche Zellsuspensionen im Trennpuffer auf 1 x 108 Zellen/ml einstellen und zu einem 5 ml Polystyrolrohr hinzufügen.
HINWEIS: Das Anreicherungsprotokoll kann bis zu 14 ml Polystyrolröhren eingestellt werden, wenn mehr Zellen aus Milz und Lunge gewonnen werden. Dieses Protokoll wurde für Gewebe von 2–3 Mäusen pro Gruppe entwickelt; daher sollte ein 5 ml Rohr ausreichen. - Verwenden Sie etwa zwei Drittel der gesamten Zellen für die ILC2-Isolierung gemäß dem ILC2-Anreicherungsprotokoll.
- Fügen Sie der Zellsuspension einen Antikörpercocktail (50 l/ml) hinzu und brüten Sie 5 min bei RT.
- Wirbel-Schnellkugeln für 30 s und fügen Sie der Probe mit einer Rate von 75 l/ml Zellsuspension hinzu. Sanft mischen und inkubieren für 5 min bei RT.
- Das Rohr mit Trennpuffer auf bis zu 3 ml Gesamtvolumen aufstellen und in den 8-Kammer-Leichttrennmagneten legen. 3 min bei RT inkubieren.
- Tippen Sie den Magneten nach vorne (weg von den Kugel-Antikörper-Zell-Komplexen, die an der Rückseite des Rohres haften) und Pipette von der Zellsuspension in ein sauberes 5 ml-Rohr.
- Fügen Sie 1,5 ml komplettes RPMI in die Rohre und Zentrifuge bei 378 x g für 5 min bei RT.
- Gießen Sie die Medien aus dem Zellpellet und setzen Sie den ILC2 mit 1 x 107 Zellen pro ml wieder aus.
- Platzieren Sie 100 uL männlicher und weiblicher ILC2 pro Brunnen in eine U-Boden-, 96-Well-Platte und fügen Sie jedem Bohrwert 100 l ILC2-Erweiterungsmedien hinzu.
- Inkubieren Sie die Zellen für 4-5 Tage, um den ILC2 zu erweitern.
- Sammeln Sie den ILC2 in ein 5 ml Rohr und addieren Sie bis zu 4,5 ml serumfreies RPMI. Zentrifugieren Sie die Zellen bei 378 x g für 5 min bei RT.
- Zählen Sie Zellen mit einem Hemacytometer und setzen Sie bei 1 x 107 ILC2 pro ml im serumfreien RPMI wieder auf.
- Verwenden Sie die verbleibenden Zellen für die CD4+ T-Zellisolation, die gemäß dem Maus-CD4+ T-Zellisolationsprotokoll mit wenigen Modifikationen durchgeführt wird.
- Fügen Sie der CD4 T-Zellanreicherungsuspension Rattenserum (50 l/ml) hinzu.
- Isolationscocktail (50 l/ml) in die Probe geben und 10 min bei RT brüten.
- Wirbel-Schnellkugeln für 30 s und fügen Sie der Probe mit einer Rate von 75 l/ml hinzu.
- Die Zellsuspension vorsichtig mischen und 2,5 min und RT inkubieren
- Die Proben auf 3 ml aufstellen und die 5 ml-Rohre in den 8-Kammer-Leichttrennmagneten legen und 5 min bei RT inkubieren.
- Tippen Sie den Magneten nach vorne und pipette die Zellsuspension in ein sauberes 5 ml Rohr.
- 1,5 ml serumfreies RPMI bei 378 x g für 5 min bei RT in die Rohre und Zentrifuge geben.
- Gießen Sie die Medien aus dem Zellpellet und setzen Sie die CD4+ T-Zellen bei 1 x 107 Zellen pro ml in serumfreiem RPMI wieder auf.
4. Bestimmung der CCR4-Expression auf CD4+ T-Zellen und Gruppe 2 angeborener lymphoider Zellen (ILC2) von OVA-herausgeforderten Tieren durch Durchflusszytometrie
HINWEIS: Die folgenden Schritte können auf einer offenen Tischplatte ausgeführt werden, da es sich um nicht-sterile Techniken handelt.
-
Erfassen Sie ca. 1–2,5 x 105 ILC2-Zellen aus Schritt 3.11.10 und 1–2,5 x 106 CD4+ T-Zellen aus Schritt 3.12.8 in separaten 5 ml-Röhren.
- Bewahren Sie eine zusätzliche Röhre mit mindestens 5,0 x 104 CD4+ T-Zellen als unbefleckte Steuerung auf.
- Die Zellen in 100–200 L FACS-Puffer aufhängen und jeder Röhre 1 L Fc Block hinzufügen, dann 10 min auf Eis (oder in einem 4 °C-Kühlschrank) inkubieren.
- Fügen Sie 1–2 ml FACS-Puffer in jedes Rohr und jede Zentrifuge bei 378 x g für 5 min bei RT.
- Gießen Sie den Überstand ab und suspendieren Sie die Zellen in 100–200 L FACS Buffer.
- Fügen Sie der Zellsuspension in jeder Röhre außer dem Rohr, das die "unbefleckten" Zellen enthält, 37,5 l des CCR4 Antikörper-Färbecocktails hinzu.
- Die Rohre auf Eis oder in einem 4 °C-Kühlschrank für 20–30 min inkubieren.
- Fügen Sie 1–2 ml FACS-Puffer in jedes Rohr und jede Zentrifuge bei 378 x g für 5 min bei RT.
- Gießen Sie den Überstand ab.
- Wiederholen Sie die Schritte 4.7 und 4.8.
- Fügen Sie jedem Rohr 250–300 l 1x stabilisierende Fixierung (siehe Materialtabelle)hinzu.
-
Bereiten Sie einfarbige Perlensteuerungen für jeden Antikörper im CCR4-Antikörpercocktail gemäß dem protokollierten Protokoll vor, das mit den Kompensationsperlen versehen ist.
- Wirbel die Kompensation Sabe.
- Fügen Sie jedem einfarbigen Steuerrohr einen Tropfen der Perlen hinzu.
- Fügen Sie 1 l von jedem Antikörper im CCR4 Antikörper-Cocktail zu seinem eigenen beschrifteten Rohr hinzu.
- 10 min im 4 °C-Kühlschrank oder auf Eis sanft mischen und bebrüten.
- Fügen Sie 1–2 ml FACS-Puffer in alle Rohre und Zentrifuge bei 378 x g für 5 min bei RT.
- Gießen Sie den Überstand ab und setzen Sie die Perlen in 200 L FACS-Puffer wieder aus.
- Kühlen Sie die einfarbigen Steuerungen, bis alle Proben gebeizt sind und auf dem Durchflusszytometer analysiert werden können.
- Analysieren Sie die ungefärbten Zellen, einfarbigen Steuerungen und die experimentellen Proben auf dem Durchflusszytometer innerhalb von 24 h der Fixierung.
5. Ex-Vivo-Transmigrationsverfahren
HINWEIS: Die folgenden Schritte sollten in einem biologischen Sicherheitsschrank durchgeführt werden, da sie sterile Technik erfordern.
- Erfassen Sie die ILC2-Zellen aus Schritt 3.11.10 und CD4 T-Zellen aus Schritt 3.12.8 und bestimmen Sie die Anzahl der transwell-Einsätze, die für das Experiment benötigt werden.
HINWEIS: Beispiel: Bei 1,2 ml angereicherten CD4-T-Zellen ab Schritt 3.12.8 1,2 x 1.000 l = 1.200 l multiplizieren; dann 1.200 uL durch 100 l = 12 teilen, die Anzahl der Einsätze, die für die CD4 T-Transmigration benötigt werden. - Bewegen Sie die 3 m Transwell-Einsätze vorsichtig aus den mittleren Reihen einer 24-Well-Platte.
- Fügen Sie mit CCL17 500 L Migrationsmedien zu etwa einem Drittel der Brunnen hinzu.
- Fügen Sie 500 L Migrationsmedien mit CCL22 zu einem weiteren Drittel der Brunnen hinzu.
- Fügen Sie dem letzten Drittel der Brunnen 500 L serumfreies RPMI ohne Chemokin hinzu.
- Beschriften Sie den Deckel auf der Platte eindeutig mit den entsprechenden Transmigrationsmedien, die in den unteren Brunnen platziert sind.
- Legen Sie die Transwell-Einsätze wieder in die Brunnen mit den verschiedenen Behandlungen.
- Fügen Sie vorsichtig 100 L CD4-T-Zellen oder ILC2 an den oberen Brunnen jedes Inserts. Mischen oder pipetten Sie die Zellsuspension in den Transwells nicht nach oben und unten, da dies die Ergebnisse des Experiments verwirren kann.
- Kennzeichnen Sie den Deckel der Platte eindeutig mit dem In jedem Brunnen platzierten Zelltyp und schreiben Sie das Datum und die Uhrzeit, zu der die Zellen hinzugefügt wurden.
- Wiederholen Sie die Schritte 5.2 bis 5.9, bis alle Zellen in Transwell-Inserts mit Medien platziert wurden.
- Legen Sie die Platte vorsichtig in einen 37 °C-Inkubator mit 5%CO2 für 48 h. Minimieren Sie den Kontakt mit der Platte über die Inkubationszeit.
6. Quantifizierung der Ex-Vivo-Transmigration
- Entfernen Sie die Platte vorsichtig aus dem Inkubator und entfernen Sie alle Transwell-Einsätze aus den mittleren Reihen in die leeren Brunnen direkt darüber oder unten.
- Sammeln Sie die Zellen von den unteren und oberen Brunnen der Transwell-Einsätze in Röhren mit TOP oder BOTTOM, mit CCL17, CCL22 oder Medien, mit dem Zelltyp und mit der Replikationsnummer (mindestens 3 Replikationen pro Experiment).
- Spülen Sie die unteren Brunnen mit 500 l 1x PBS und sammeln Sie diese Inspülung in das entsprechende Rohr.
- Spülen Sie die oberen Brunnen mit 250 l 1x PBS und sammeln Sie diese Spülung in das entsprechende Rohr.
- Pellet die Zellen durch Zentrifugation bei 378 x g für 5 min bei RT.
- Sanfte Pipette aus allen Überstand aus dem Zellpellet.
- Resuspend T-Zellen und ILC2 in 50 l von 1x PBS.
- Nehmen Sie 10 l der Zellsuspensionen und fügen Sie zu 90 l von 0,4% Trypan blau hinzu.
-
Zählen Sie die Zellen auf dem automatisierten Zellenzähler.
- Datensatz %Lebensfähigkeit.
- Zeichnen Sie die Zellenanzahl pro ml für jede Probe auf.
- Bestimmen Sie die Gesamtzahl der Zellen pro Behandlung in der oberen und unteren Kammer; die Zellenanzahl aufzeichnen.
Ergebnisse
CCR4-Expression auf CD4+ T-Zellen und ILC2.
Für den Erfolg des Ex-vivo-Transmigrationsexperiments ist es unerlässlich, zu bestimmen, ob die Lymphozyten auf CCL17 und CCL22 über CCR4 reagieren; Daher haben wir die CCR4-Expression sowohl auf CD4+ T-Zellen als auch auf ILC2 durch Durchflusszytometrie bestimmt. Obwohl bekannt ist, dass OVA-spezifische CD4+ Helfer-T-Zellen CCR4 exprimieren, ist weniger über die Expression von CCR4 auf ILC2 bekannt. Abbildung 1 zeigt repräsentative Ergebnisse der CCR4-Expression, vergleichsweise, auf CD4+ T-Zellen (Abbildung 1A,C) und ILC2 (Abbildung 1B,D) von männlichen und weiblichen, OVA-herausgeforderten BALB/c-Mäusen. Die Durchflusszytometrie wurde verwendet, um CCR4 mit einem monoklonalen Antikörper zu erkennen, der mit Allophycocyanin (APC) konjugiert ist. Anhand der One-Way Analysis of Variance (ANOVA) stellten wir fest, dass es keine Unterschiede in der CCR4-Expression zwischen männlichen und weiblichen Hosts gab (Abbildung 1A–D), jedoch war die Expression von CCR4 pro Zelle (MFI) auf ILC2 höher als bei CD4. + T-Zellen (Abbildung 1C im Vergleich zu Abbildung 1D). Diese Ergebnisse sind wichtig, um zu zeigen, dass die IlC2- und CD4+ T-Zellen im folgenden Experiment auf CCL17 und CCL22 reagieren sollten.
Reaktionsfähigkeit von CD4+ T-Zellen auf CCR4 Liganden in den oberen und unteren Kammern eines Transmigration-Systems.
CD4+ T-Zellen von männlichen, OVA-herausgeforderten BALB/c-Mäusen wurden aus der Lunge und Milz isoliert und in die obere Kammer eines Transmigrationsapparates gelegt, der durch eine poröse Membran von 3 m getrennt ist (Abbildung 2). Eine Zusammenfassung der In-vivo-Vorbereitung von OVA-behandelten Mäusen (Abbildung 2A) und des Transmigrationsverfahrens (Abbildung 2B) sind als Referenz dargestellt. Eine Kombination aus CCL17 (25 ng/mL) und CCL22 (25 ng/mL) wurde in der oberen Kammer, der unteren Kammer oder sowohl der oberen als auch in der unteren Kammer platziert, um zu bestätigen (Abbildung 2C), (1), dass die CD4+ T-Zellen von OVA-herausgeforderten Tieren auf CCR4 Liganden und (2) dass chemokininduzierte Migration ein aktiver Prozess war, bei dem sich T-Zellen als Reaktion auf den Chemokingradienten durch die Poren bewegten und dass sich die Lymphozyten nicht unabhängig von Chemokin durch die Poren bewegten. Eine Mediensteuerung (No Chemokine) wurde eingeschlossen, um zu zeigen, dass CD4+ T-Zellen nicht ohne Stimulation durch die 3-M-Poren migrieren konnten. In diesem Zustand verblieb der höchste Prozentsatz der Zellen in der oberen Kammer. Wenn die Chemokine gleichzeitig in der oberen und unteren Kammer platziert wurden, entdeckten wir 52% der gesamten T-Zellen in der unteren Kammer und 48% der Zellen in der oberen Kammer (TOP/BOTTOM-Behandlung). Wie erwartet, bewegte sich die Verteilung der Zellen als Reaktion auf Chemokin, das nur in der oberen oder nur in der unteren Kammer platziert wurde, da wir den höchsten Prozentsatz von Zellen im Kompartiment entdeckten, in dem Chemokin vorhanden war.
Reaktionsfähigkeit von CD4+ T-Zellen und ILC2 zu CCL17 und CCL22 in einem Ex-vivo-Transmigrationsapparat.
CD4-T-Zellen und ILC2 von männlichen und weiblichen, OVA-herausgeforderten Mäusen wurden aus Lunge und Milz isoliert und dann in die obere Kammer eines Transwell-Transmigrationsapparates(Abbildung 3) gelegt. Die untere Kammer des Geräts war mit unbehandelten Zellkulturmedien, Medien, die CCL17 enthielten, oder Medien, die CCL22 enthielten, gefüllt. Die repräsentativen Ergebnisse zeigen, dass weniger als 14% (13,37 + 6,5%) der Zellen, die unter Mediensteuerungsbedingungen migriert wurden (Abbildung 3A–D). Als Reaktion auf CCL22 antworteten beide Zelltypen, unabhängig davon, ob sie von männlichen oder weiblichen Hosts stammten, auf CCL22 (Abbildung 3A–D), die Ergebnisse für CCL17 waren jedoch weniger konsistent. CCL17 induzierte nur eine signifikante Migration für die weiblichen CD4-T-Zellen und ILC2 im Vergleich zu Medien allein(Abbildung 3C,D). Die CCL17-Behandlung war nicht anders als die Medien für männliche CD4+ T-Zellen oder männliche ILC2 (Abbildung 3A,B) und CCL22 induzierte eine größere Migration als CCL17 bei männlichen ILC2 (Abbildung 2B).
Suboptimale Transmigrationsergebnisse für CD4+ T-Zellen mit geringer Lebensfähigkeit.
Suboptimale Ergebnisse wurden generiert, um dem Forscher ein Beispiel dafür zu geben, was zu erwarten ist, wenn das Transmigrationsexperiment nicht richtig funktioniert (Abbildung 4). Wir isolierten männliche CD4+ T-Zellen von Tieren nach diesem Protokoll und platzierten sie in den oberen Brunnen des Transmigration-Systems. Nachdem die CD4+ T-Zellen hinzugefügt wurden, blieb die Platte jedoch für die ersten 24 h bei Raumtemperatur, dann wurde die Platte für die restlichen 24 h der Inkubationszeit in den Inkubator verschoben. Es überrascht nicht, dass wir keine Migration zu CCL17 und CCL22 (Abbildung 4A) festgestellt haben und die Lebensfähigkeit der Zellen war besonders gering (<15%) für die Zellen oben (Abbildung 4B). Diese fehlerhaften Ergebnisse unterstreichen, wie wichtig es ist, die in diesem Protokoll beschriebenen richtigen Temperaturen und Bedingungen zu verwenden, um optimale Ergebnisse zu erzielen.
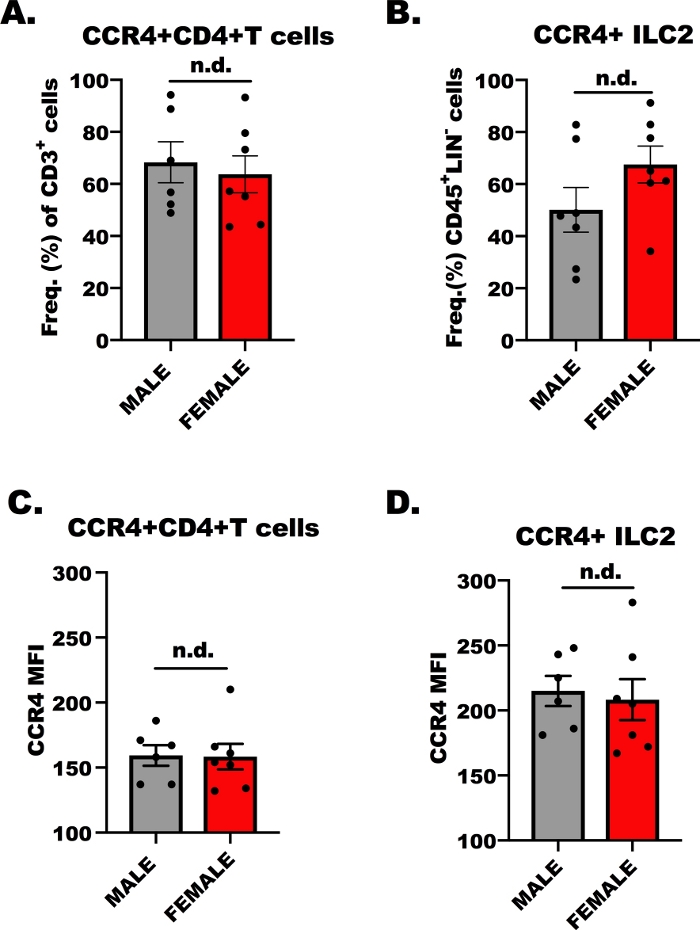
Abbildung 1: CCR4-Expression auf CD4+ T-Zellen und ILC2. 7 bis 9 Wochen alt, männlich und weiblich, wurden BALB/c-Mäuse einmal mit 100 l OVA-adsorbiert in Aluminiumhydroxid injiziert (500 g/ml; OVA und 20 mg/ml Aluminiumhydroxid) 7 Tage vor dem ersten von 5, sich wiederholenden, täglichen Atemwegsherausforderungen mit 1,5% OVA in der Saline. Allergen-herausgeforderte Tiere wurden human eingeschläfert, und Lungen- und Milzgewebe wurden für die ISOLIERUNG von ILC2 und CD4+ T-Zellen gesammelt. Ein kleines Aliquot von Zellen wurde dann gefärbt und durch Durchflusszytometrie analysiert, um den CCR4-Gehalt auf jedem Zelltyp zu bestimmen. (A) Häufigkeit von CD4+ T-Zellen, die CCR4+ von OVA+ Mäusen sind, wobei die Fehlerbalken den Standardfehler des Mittelwerts (+ SEM) darstellen. (B) Frequenz von ILC2, die CCR4+ (+SEM) waren. (C, D) Mittlere Fluoreszenzintensität (+SEM) von CCR4 auf (C) CD4+ T-Zellen und (D) ILC2. Insgesamt 13 Mäuse wurden verwendet, um diese Daten zu generieren, und das Strömungsexperiment wurde zweimal wiederholt, mit 3 Replikationen pro Behandlung pro Experiment. Die Bedeutung wurde von One-Way ANOVA bestimmt; n.d. gibt an, dass es keine Unterschiede zwischen den Gruppen gab. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Reaktionsfähigkeit von CD4+ T-Zellen auf CCR4-Liganden in den oberen und unteren Kammern eines Transmigrationssystems. Männliche BALB/c-Mäuse, die mit Hühnerei-Ovalbumin (OVA) und CD4+ T-Zellen sensibilisiert und herausgefordert wurden, wurden aus milden und lunge isoliert (A, B). Für dieses Transmigrationsexperiment wurden CD4+ T-Zellen in serumfreien Medien bei 1 x 107 Zellen/ml suspendiert. CCL17 und CCL22 wurden serumfreien Medien in einer Konzentration von 50 ng/ml (25 ng/ml jedes Chemokins hinzugefügt, um insgesamt 50 ng/ml zu erreichen). Chemokinhaltige Medien wurden nur der oberen Kammer, nur der unteren Kammer oder der oberen und unteren Kammer hinzugefügt. Den unteren Brunnen wurde ein Gesamtvolumen von 500 l Transmigrationsmedien und 100 l zelluläre Suspension (1 x 106 Zellen/Well) zugesetzt. Die Transmigration wurde nach 48 h in der Kultur gemessen (C). Diese Daten wurden aus einem einzigen Experiment generiert, 3 OVA-behandelte, männliche Mäuse wurden für die Gewebesammlung verwendet, und 3 Replikationen wurden pro Behandlung gemacht. Die statistische Signifikanz wurde von One-Way ANOVA bestimmt; *p < 0,05. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
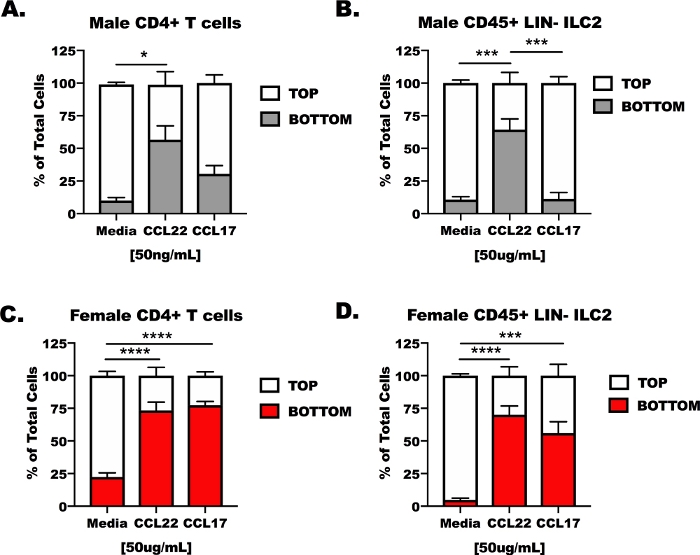
Abbildung 3: Reaktionsfähigkeit von CD4+ T-Zellen und ILC2 zu CCL17 und CCL22 in einem Ex-vivo-Transmigrationsapparat. Mäuse wurden wie in Abbildung 1 für CD4+ T-Zelle und ILC2-Isolierung von Milz und Lunge vorbereitet. CD4+ T-Zellen und ILC2 wurden in serumfreien Medien bei 1 x 107 Zellen/ml suspendiert. CCL17 oder CCL22 wurden serumfreien Medien in einer Konzentration von 50 ng/ml hinzugefügt. 500 L Transmigrationsmedien wurden den unteren Brunnen zugesetzt und 100 l zelluläre Suspension (1 x 106 Zellen/Well) wurden dem oberen Brunnen zugesetzt. Die Transmigration wurde nach 48 h in der Kultur gemessen. (A) CD4+ T-Zellen und (B) ILC2 von männlichen Hosts wurden mit Medien als Steuerung, CCL17 oder CCL22 behandelt. In ähnlicher Weise wurden (C) weibliche CD4+ T-Zellen und (D) weibliche senK-ILC2 mit Medien, CCL17 oder CCL22 behandelt. Insgesamt 14 Mäuse wurden verwendet, um diese Daten zu generieren. Das Transmigrationsexperiment wurde viermal wiederholt, wobei 3–6 Wiederholungen jeder Behandlung pro Experiment durchgeführt wurden. Die Bedeutung wurde von One-Way ANOVA bestimmt; *p < 0,05, ***p < 0,001, ****p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Suboptimale Transmigration-Ergebnisse für CD4-T-Zellen mit geringer Lebensfähigkeit. Für die Lungen- und Milzgewebesammlung und die CD4+ T-Zellisolierung wurden naive männliche BALB/c-Mäuse erworben, wie in Abbildung 1, Abbildung 2und Abbildung 3. CD4-T-Zellen wurden der oberen Kammer des Transmigrationsapparates hinzugefügt und serumfreie Medien, die CCL17, CCL22 oder kein Chemokin (Mediensteuerung) enthielten, wurden dem unteren Brunnen hinzugefügt. Für die ersten 24 h des Experiments wurde die Platte bei Raumtemperatur belassen, dann wurde sie auf einen 37 °C-Inkubator mit 5%CO2 für weitere 24 h verschoben. (A) Prozentsatz der Zellen, die nach 24 h in den oberen und unteren Brunnen verbleiben. (B) Lebensfähigkeit des C D4+ T-Zellen in der oberen und unteren Kammer nach schlechten Inkubationsbedingungen. Diese Daten wurden aus einem einzigen Experiment generiert, 3 naive männliche Mäuse wurden für die Gewebesammlung verwendet, und 3 Repliken wurden pro Behandlung gemacht. Statistische Signifikanz wurde nicht bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Hierbei stellen wir eine etablierte Methode zur Beurteilung der chemokininduzierten Migration von Lymphozyten in einem Ex-vivo-Transmigrationssystem vor. Es gibt mehrere kritische Schritte im Protokoll, von denen der erste die Überprüfung der Expression des richtigen Chemokinrezeptors auf die Immunzellen im Experiment ist. In unseren Händen haben wir uns für CCR4 entschieden, weil die Literatur die Bedeutung von CCR4 auf Th2-Helfer-T-Zellen bei allergischen Entzündungen hervorhebt. Ovalbumin-induzierte Entzündung wurde zuvor gezeigt, dass durch mindestens zwei CCR4-Antagonisten24,25begrenzt werden; dies war jedoch vor der Entdeckung der Gruppe 2 angeborene lymphoide Zellen (ILC2)26,27. Wir haben neuartige Daten generiert, die zeigen, dass ILC2-Zellen höhere CCR4-Zellen als CD4+ T-Zellen ausdrücken, und zeigten, dass diese Zellen konsistent auf CCL22 reagierten.
Ein zweiter wichtiger Schritt im Protokoll besteht darin, sicherzustellen, dass Zellen in einem optimalen Medium für Kultur gehalten werden, bevor der Transmigrationsteil des Protokolls beginnt. Im Fall von ILC2 mussten wir diese Zellen in ILC2 Expansion Media kulturieren, die sowohl IL-2 als auch IL-33 enthält. IL-2 und IL-7 werden beide in der Literatur berichtet, um ILC2 in Kultur für bis zu 14 Tage28,29zu unterstützen. Wenn die Lebensfähigkeit in zukünftigen Experimenten zu einem Problem für CD4+ T-Zellen und ILC2 wird, würde die Zugabe von IL-2 oder IL-7 wahrscheinlich das Überleben der Lymphozyten bis zum Endpunkt des Experiments verbessern. Jedes der hier vorgestellten Medien wurde im Laufe mehrerer Experimente definiert und für den Einsatz in diesem Protokoll14,30,31optimiert. In Abbildung 4haben wir fehlerhafte Ergebnisse präsentiert, um die Bedeutung der Verwendung eines Inkubators mit der richtigen Temperatur und 5%CO2zu demonstrieren. Die Transmigration-Platten im Inkubator zu halten, wo sie nicht gestört werden, ist ein weiterer wichtiger Schritt für den Erfolg des Protokolls.
Wie bereits erwähnt, hat die Verwendung der in vivo Mikroskopie, die an den meisten Institutionen verfügbar ist, Vorteile, jedoch kann die In-vivo-Bildgebung zeitaufwändig und kostspielig sein. Ein alternatives experimentelles Verfahren, das kostengünstiger ist, verwendet Mikrofluidik in Kombination mit Chemokin-Gradienten, um Leukozyten-Extravasation und Gewebemigration32,33,34zu verstehen. Diese Systeme haben wissenschaftlichen Wert, weil sie die Komplexität der Zellkinetik bewerten, bei der Endothelzellen beteiligt sind, die auf die Kapillaren der mikrofluidischen Systeme angebaut werden können. Darüber hinaus bewerten diese mikrofluidischen Systeme die Bedeutung von Adhärenproteinen (z.B. E-Cadherin) an den Endothelzellen und Integrinen an den Immunzellen im Prozess der Zellbindung unter Blutfluss. Nichtsdestotrotz erfordern diese Systeme spezielle Ausrüstung und komplexe Computerprogrammierung und Statistiken, um die Bedeutung der einzelnen Behandlungsbedingungen zu bestimmen. Obwohl die hier vorgestellte Methode der Transmigration zwar auf künstliche Weise beschränkt ist, kann sie daher als wichtiges Screening-Instrument eingesetzt werden, um die Verschwendung unnötiger Reagenzien in nachfolgenden In-vivo-Methoden zu begrenzen. Die Bedeutung der Methode besteht darin, dass wir, wenn neue Zellen entdeckt werden, wie es bei ILC2 der Fall ist, diese Zellen auf ihre Reaktionsfähigkeit auf bekannte Chemokine untersuchen können. Dies ist eine der zukünftigen Anwendungen mit ILC2 und potenziellen Therapien, die ihre Migration in die Lunge während der Asthmaexazerbation hemmen können. Dieses Transmigrationsprotokoll wird verwendet, um verschiedene Inhibitoren zu überprüfen, die verwendet werden können, um CCR4 oder andere chemotaktische Mediatoren zu begrenzen, die an der Rekrutierung von ILC2 beteiligt sind. Insgesamt wird dieses Ex-vivo-Transmigrationsprotokoll zur Generierung kritischer Daten führen, die mit zukünftigen In-vivo-Experimenten verifiziert werden können.
Offenlegungen
Die Autoren haben keine finanziellen Angaben oder Interessenkonflikte offenzulegen.
Danksagungen
Diese Arbeit wurde von der American Lung Association (K.J.W.), dem Memorial Eugene Kenney Fund an T.A.W. und K.J.W., großzügiger Start-up-Unterstützung der University of Utah für K.J.W. und einem Department of Veterans Affairs Award an T.A.W. (VA I01BX0003635) finanziert. T.A.W. ist Träger des Research Career Scientist Award (IK6 BX003781) des Department of Veterans Affairs. Die Autoren möchten die redaktionelle Unterstützung von Frau Lisa Chudomelka würdigen. Die Autoren danken dem UNMC Flow Cytometry Core für ihre Unterstützung bei der Erfassung der für dieses Manuskript generierten Flow-Zytometrie-Daten.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan Blue | Sigma-Aldrich | 15250061 | |
| 1 mL syringe | BD Bioscience | 329424 | U-100 Syringes Micro-Fine 28 G 1/2" 1cc |
| 100x Penicillin-Streptomycin, L-Glutamine | Gibco | 10378-016 | Dilute to 1x in RPMI media |
| 15 mL conical tubes | Olympus Plastics | 28-101 | polypropylene tubes |
| 3 μm transwell inserts | Genesee Scientific | 25-288 | 24-well plate containing 12 transwell inserts |
| 3x stabilizing fixative | BD Pharmigen | 338036 | Prepare 1x solution according to manufacturers protocol |
| 5 mL polystyrene tubes | STEM Cell Technologies | 38007 | |
| 50 mL conical tubes | Olympus Plastics | 28-106 | polypropylene tubes |
| 8-chamber easy separation magnet | STEM Cell Technologies | 18103 | |
| ACK Lysing Buffer | Life Technologies Corporation | A1049201 | |
| Advanced cell strainer, 40 μm | Genesee Scientific | 25-375 | nylon mesh, 40 μm strainers |
| Aluminum Hydroxide, Reagent Grade | Sigma-Aldrich | 239186-25G | 20 mg/mL |
| anti-mouse CCR4; APC-conjugated | Biolegend | 131211 | 0.5 μg/test |
| anti-mouse CD11b | BD Pharmigen | 557396 | 0.5 μg/test |
| anti-mouse CD11c; PE eFluor 610 | Thermo-Fischer Scientific | 61-0114-82 | 0.25 μg/test |
| anti-mouse CD16/32, Fc block | BD Pharmigen | 553141 | 0.5 μg/test |
| anti-mouse CD19; APC-eFluor 780 conjugated | Thermo-Fischer Scientific | 47-0193-82 | 0.5 μg/test |
| anti-mouse CD3; PE Cy 7-conjugated | BD Pharmigen | 552774 | 0.25 μg/test |
| anti-mouse CD45; PE conjugated | BD Pharmigen | 56087 | 0.5 μg/test |
| anti-mouse ICOS (CD278) | BD Pharmigen | 564070 | 0.5 μg/test |
| anti-mouse NK1.1 (CD161); FITC-conjugated | BD Pharmigen | 553164 | 0.25 μg/test |
| anti-mouse ST2 (IL-33R); PerCP Cy5.5 conjugated | Biolegend | 145311 | 0.5 μg/test |
| Automated Cell Counter | BIORAD | 1450102 | |
| Automated Dissociator | MACS Miltenyi Biotec | 130-093-235 | |
| Bovine Serum Albumin, Lyophilized Powder | Sigma-Aldrich | A2153-10G | 0.5% in serum-free RPMI |
| Cell Counter Clides | BIORAD | 1450015 | |
| Chicken Egg Ovalbumin, Grade V | Sigma-Aldrich | A5503-10G | 500 μg/mL |
| Collagenase, Type 1, Filtered | Worthington Biochemical Corporation | CLSS-1, purchase as 5 X 50 mg vials (LS004216) | 25 U/mL in RPMI |
| Compensation beads | Affymetrix | 01-1111-41 | 1 drop per contol tube |
| Dissociation Tubes | MACS Miltenyi Biotec | 130-096-335 | |
| FACS Buffer | BD Pharmigen | 554657 | 1x PBS + 2% FBS, w/ sodium azide; stored at 4 °C |
| Heat Inactivated-FBS | Genesee Scientific | 25-525H | 10% in complete RPMI & ILC2 Expansion Media |
| Mouse CCL17 | GenScript | Z02954-20 | 50 ng/mL |
| Mouse CCL22 | GenScript | Z02856-20 | 50 ng/mL |
| Mouse CD4+ T cell enrichment kit | STEM Cell Technologies | 19852 | |
| Mouse IL-2 | GenScript | Z02764-20 | 20 ng/mL |
| Mouse ILC2 enrichment kit | STEM Cell Technologies | 19842 | |
| Mouse recombinant IL-33 | STEM Cell Technologies | 78044 | 20 ng/mL |
| RPMI | Life Technologies Corporation | 22400071 | |
| Separation Buffer | STEM Cell Technologies | 20144 | 1x PBS + 2% FBS; stored at 4 °C |
| Small animal nebulizer and chamber | Data Sciences International | ||
| Sterile saline | Baxter | 2F7124; NDC 0338-0048-04 | 0.9% Sodium Chloride |
Referenzen
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of Experimental Medicine. 115, 453-466 (1962).
- Moser, B. Editorial: History of Chemoattractant Research. Frontiers in Immunology. 6, 548(2015).
- Borroni, E. M., Savino, B., Bonecchi, R., Locati, M. Chemokines sound the alarmin: The role of atypical chemokine in inflammation and cancer. Seminars in Immunology. 38, 63-71 (2018).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. The New England Journal of Medicine. 354 (6), 610-621 (2006).
- Abboud, D., Hanson, J. Chemokine neutralization as an innovative therapeutic strategy for atopic dermatitis. Drug Discovery Today. 22 (4), 702-711 (2017).
- Aldinucci, D., Casagrande, N. Inhibition of the CCL5/CCR5 Axis against the Progression of Gastric Cancer. International Journal of Molecular Sciences. 19 (5), E1477(2018).
- Chonco, L., et al. Novel DNA Aptamers Against CCL21 Protein: Characterization and Biomedical Applications for Targeted Drug Delivery to T Cell-Rich Zones. Nucleic Acid Therapy. 28 (4), 242-251 (2018).
- Trivedi, P. J., Adams, D. H. Chemokines and Chemokine Receptors as Therapeutic Targets in Inflammatory Bowel Disease; Pitfalls and Promise. Journal of Crohn's and Colitis. 12 (12), 1508(2018).
- Pietrosimone, K. M., Bhandari, S., Lemieux, M. G., Knecht, D. A., Lynes, M. A. In vitro assays of chemotaxis as a window into mechanisms of toxicant-induced immunomodulation. Current Protocols in Toxicology. 58 (Unit 18.17), (2013).
- Davis, D. M. How studying the immune system leads us to new medicines. Lancet. 391 (10136), 2205-2206 (2018).
- Culley, F. J., Pennycook, A. M., Tregoning, J. S., Hussell, T., Openshaw, P. J. Differential chemokine expression following respiratory virus infection reflects Th1- or Th2-biased immunopathology. Journal of Virology. 80 (9), 4521-4527 (2006).
- Denney, H., Clench, M. R., Woodroofe, M. N. Cleavage of chemokines CCL2 and CXCL10 by matrix metalloproteinases-2 and -9: implications for chemotaxis. Biochemical and Biophysics Research Communications. 382 (2), 341-347 (2009).
- Burrell, B. E., et al. Lymph Node Stromal Fiber ER-TR7 Modulates CD4+ T Cell Lymph Node Trafficking and Transplant Tolerance. Transplantation. 99 (6), 1119-1125 (2015).
- Warren, K. J., Iwami, D., Harris, D. G., Bromberg, J. S., Burrell, B. E. Laminins affect T cell trafficking and allograft fate. The Journal of Clinical Investigation. 124 (5), 2204-2218 (2014).
- Hirata, H., et al. Th2 cell differentiation from naive CD4(+) T cells is enhanced by autocrine CC chemokines in atopic diseases. Clinical and Experimental Allergy: Journal of the British Society for Allergy and Clinical Immunology. , (2018).
- Lin, R., Choi, Y. H., Zidar, D. A., Walker, J. K. L. beta-Arrestin-2-Dependent Signaling Promotes CCR4-mediated Chemotaxis of Murine T-Helper Type 2 Cells. American Journal of Respiratory Cell and Molecular Biology. 58 (6), 745-755 (2018).
- Zhang, Y., et al. A new antagonist for CCR4 attenuates allergic lung inflammation in a mouse model of asthma. Science Reports. 7 (1), 15038(2017).
- Lu, Y., et al. Dynamics of helper CD4 T cells during acute and stable allergic asthma. Mucosal Immunology. 11 (6), 1640-1652 (2018).
- Li, B. W. S., Beerens, D., Brem, M. D., Hendriks, R. W. Characterization of Group 2 Innate Lymphoid Cells in Allergic Airway Inflammation Models in the Mouse. Methods in Molecular Biology. 1559, 169-183 (2017).
- Li, B. W. S., et al. Group 2 Innate Lymphoid Cells Exhibit a Dynamic Phenotype in Allergic Airway Inflammation. Frontiers in Immunology. 8, 1684(2017).
- Warren, K. J., et al. Sex differences in activation of lung-related type-2 innate lymphoid cells in experimental asthma. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. , (2016).
- Warren, K. J., et al. Ovalbumin-sensitized mice have altered airway inflammation to agriculture organic dust. Respiratory Research. 20 (1), 51(2019).
- Poole, J. A., et al. alphabeta T cells and a mixed Th1/Th17 response are important in organic dust-induced airway disease. Annals of Allergy, Asthma, Immunology: Official Publication of the American College of Allergy, Asthma, Immunology. 109 (4), 266-273 (2012).
- Matsuo, K., et al. A CCR4 antagonist ameliorates atopic dermatitis-like skin lesions induced by dibutyl phthalate and a hydrogel patch containing ovalbumin. Biomedical Pharmacotherapy. 109, 1437-1444 (2019).
- Mikhak, Z., et al. Contribution of CCR4 and CCR8 to antigen-specific T(H)2 cell trafficking in allergic pulmonary inflammation. The Journal of Allergy and Clinical Immunology. 123 (1), 67-73 (2009).
- Monticelli, L. A., et al. Innate lymphoid cells promote lung-tissue homeostasis after infection with influenza virus. Nature Immunology. 12 (11), 1045-1054 (2011).
- Saenz, S. A., et al. IL25 elicits a multipotent progenitor cell population that promotes T(H)2 cytokine responses. Nature. 464 (7293), 1362-1366 (2010).
- Hoyler, T., et al. The transcription factor GATA-3 controls cell fate and maintenance of type 2 innate lymphoid cells. Immunity. 37 (4), 634-648 (2012).
- Nakajima, H., Shores, E. W., Noguchi, M., Leonard, W. J. The common cytokine receptor gamma chain plays an essential role in regulating lymphoid homeostasis. The Journal of Experimental Medicine. 185 (2), 189-195 (1997).
- Warren, K. J., et al. RSV-specific anti-viral immunity is disrupted by chronic ethanol consumption. Alcohol. , (2016).
- Warren, K. J., Poole, J. A., Sweeter, J. M., DeVasure, J. M., Wyatt, T. A. An association between MMP-9 and impaired T cell migration in ethanol-fed BALB/c mice infected with Respiratory Syncytial Virus-2A. Alcohol. , (2018).
- Molteni, R., et al. A novel device to concurrently assess leukocyte extravasation and interstitial migration within a defined 3D environment. Lab on a Chip. 15 (1), 195-207 (2015).
- Bersini, S., et al. Human in vitro 3D co-culture model to engineer vascularized bone-mimicking tissues combining computational tools and statistical experimental approach. Biomaterials. 76, 157-172 (2016).
- Jeon, J. S., et al. Human 3D vascularized organotypic microfluidic assays to study breast cancer cell extravasation. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 214-219 (2015).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
ISSN 2689-3649
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten
Wir verwenden Cookies, um Ihre Erfahrung auf unserer Website zu verbessern.
Indem Sie unsere Website weiterhin nutzen oder auf „Weiter“ klicken, stimmen Sie zu, unsere Cookies zu akzeptieren.
