Method Article
Fita de estomas-casca: Um método melhorado para preparação de amostras de células de guarda
Neste Artigo
Resumo
Este protocolo descreve um método de preparação estomáticas enriquecidas guarda células que é útil para estudos biológicos fisiológicos e outros.
Resumo
O estudo das células guarda é essencial para o conhecimento das contribuições específicas deste tipo de célula para a função global de plantas. No entanto, muitas vezes é difícil isolar e, portanto, estudá-los muitas vezes fornece um desafio.
Este estudo estabelece um método de enriquecimento de célula estomática de guarda. O protocolo utiliza fita adesiva para isolar as células guarda e extrair as proteínas das células. Esse método melhora a integridade e o rendimento da célula guarda durante o isolamento e fornece uma amostra confiável para o estudo dos processos de sinalização celular e como eles se correlacionam com fenótipos movimento estomático. Neste método, as folhas da planta foram particionadas entre duas partes da fita e pedaços descascadas para remover o lado abaxial. Este protocolo foi aplicado ao tecido de folha de Arabidopsis para isolar as células guarda. As células foram tratadas com diacetato de fluoresceína (FDA) para determinar a viabilidade e com ácido abscísico (ABA) para avaliar o movimento de estômatos em resposta a ABA. Em conclusão, este protocolo prova útil para preparar células de guarda estomáticas enriquecidas e isolar proteínas. A qualidade das células e proteínas obtidas aqui enable fisiológico e outros estudos biológicos.
Introdução
Estomas desempenham um papel importante na fisiologia geral e adequação das plantas. Estas estruturas específicas de pequena planta são formadas por duas células epidérmicas especializadas conhecidas como células de guarda e são encontradas mais abundantemente na superfície abaxial das folhas. Estomas são necessárias para a troca de gases entre a planta e a atmosfera, bem como o controle da perda de água através da transpiração. Guarda as células regulam a abertura de estômatos, através da integração de diferente externa (por exemplo, luz, umidade, contato do patógeno, os níveis de dióxido de carbono) e interna (ex., hormônios endógenos) estímulos1,2. Nos últimos 20 anos, este tipo de célula tornou-se um modelo de sistema para sinalização de processos em plantas de celular estudando. Essas células compõem uma pequena fração das células totais em uma folha; assim, para investigar seu celular exclusivo, propriedades bioquímicas e moleculares de uma célula única forma, é necessário isolá-los de outros tipos de células da folha. No passado, estudos de célula guarda muitas vezes envolveram a preparação da célula guarda protoplastas (GCP)3,4,5. Isto normalmente requer o uso de grandes quantidades de enzimas degradantes de parede celular e/ou ruptura mecânica através de mistura e tem provado ser dispendioso e demorado, que geralmente leva muitas horas para preparar uma amostra GCP, muitas vezes vezes com pouco rendimento. Mais importante, porque as células guarda atuar como pares completas para regular a abertura de estômatos, o uso do GCP pode ser visto como um sistema artificial para estudar a sinalização da pilha de guarda.
Aqui, nós desenvolvemos um método para preparar estomas na qual células intactas de guarda são enriquecidas e manter respostas fisiológicas aos estímulos. Este método foi inspirado por um método que foi usado para isolar o mesofilo célula protoplastas6,7. Em nosso método, estomas são preparadas com clara de fita adesiva para separar primeiro a maioria das células do mesofilo anexado à camada adaxial da folha da camada abaxial contendo o pavimento e as células de guarda. Isso é feito pela aposição de um pedaço de fita para cada lado da folha e descascá-las separadas. As células da camada abaxial podem recuperar sob a luz em um buffer de estomas-abertura. Mais tarde, as células restantes do pavimento são removidas usando uma pequena quantidade de parede celular degradante enzimas, deixando para trás células guarda que são enriquecidos na fita.
Neste método simples, estomáticas células guarda que sejam viáveis e responsivo pode rapidamente e eficientemente ser preparado, tendo menos de uma hora para obter células de guarda estomáticas enriquecidas de 50 cascas com um custo mínimo. O método aqui impõe menos danos às células da planta do que métodos anteriores, onde os protoplastas são preparados. Além disso, materiais colhidos este quantidades de proteína desejável de rendimento de método. O mais importante, porque a folha não está sujeita a mistura ou tempos de digestão demorada e guarda as células permanecem intactas, os resultados dos estudos mais estreita será relevantes para que um guarda do natural da biologia das células. Com este método, estomáticas movimentos possam ser correlacionados em tempo real com as mudanças a nível molecular. Assim, o conhecimento adquirido com estudos usando esse método de preparação seria importante para uma compreensão mais abrangente da sinalização celular de guarda.
Usamos a planta Arabidopsis thaliana como modelo; no entanto, este protocolo pode ser aplicado para o enriquecimento das células de guarda estomáticas em outras espécies de plantas tais como Brassica napus com pequenas modificações no tempo de digestão. Como uma prova de conceito, temos demonstrado que células de guarda estomáticas enriquecidas através deste método são viáveis e responsivo a estímulos como mostrado pelo ensaio de fluoresceína diacetato (FDA) e estudos utilizando hormônio vegetal ácido abscísico (ABA), respectivamente. Além disso, Nós demonstramos que proteínas de alta qualidade podem ser isoladas destas células guarda. Aqui, descrevemos um protocolo detalhado desse processo.
Protocolo
1. cultivo de plantas
- Germinar as sementes na mistura de potting. Cultivar plantas em uma câmara de crescimento com uma intensidade luminosa de 140 µmol fótons m− 2 s − 1 e um fotoperíodo de luz h 8 a 22 ° C e 16 h escuro a 18 ° C durante 2 semanas.
- Transplante de mudas de tamanhos similares individualmente em 4" potenciômetros de diâmetro contendo o solo e crescer para um adicional 3 semanas nas mesmas condições descritas no passo 1.1.
Nota: Regar plantas com água da torneira duas vezes por semana para manter o solo úmido.
2. preparação dos estomas enriquecidas
- Retire as folhas de plantas da . thaliana 5 - semana de idade individuais com um bisturi.
- Anexe cada folha a dois pedaços de fita adesiva clara, com uma peça aderindo ao lado abaxial (inferior) e o outro pedaço, aderindo ao lado (superior) adaxial da folha. Deixe a fita da folha para 5 s.
- Suave peel separado os dois pedaços de fitas usando o dedo indicador e o polegar em cada mão para separar o lado abaxial com pavimento e guarda as células e o lado adaxial com células do mesofilo.
- Lugar as cascas do lado abaxial das folhas em 60 mL de estomas abertura de buffer (50 mM KCl, 10mm MES-KOH, ajustado ao pH 6.2 com 1m KOH) no tamanho de 40 mm × 12 mm Petri pratos como eles são coletados.
- Repita os passos acima até que todas as cascas de amostra são coletadas.
- Coloque os pratos de Petri contendo as cascas para a câmara de crescimento sob condições de luz indicado no passo 1.1. Deixe as cascas sob a luz para 2h abrir completamente os estomas.
- Lugar de cascas em uma 150 x 20 mm placa de Petri contendo 50 mL de parede celular, digerindo a mistura de enzimas (celulase 0,7% R-10, macerozyme de 0.025% R-10, 0,1% (p/v) polivinilpirrolidona-40 e albumina de soro bovino 0.25% (p/v) em solução básica de 55% (0,55 M sorbitol, 0.5 mM CaCl2, 0,5 mM MgCl2, ácido ascórbico de 0,5 mM, 10 µM KH2PO4, 5mm 4-morpholineethanesulfonic ácido (MES) em pH 5,7 ajustado com 1m KOH).
- Agite as cascas num agitador recíproco em uma placa de Petri a 50 rpm por 20 min.
- Retire as cascas solução enzimática com pinça depois de 20 min. Transfira as cascas para um prato de Petri 150 x 20 mm tamanho contendo 50 mL de água.
- Utilizando uma pipeta de transferência, lave as cascas por 15 s duas vezes com 10 mL de água para remover qualquer solução de enzima residual.
- Use uma pinça para colocar as cascas em um prato de Petri tamanho 150 x 20 mm com 50 mL de estomas frescas abrindo reserva como usado na etapa 2.4. Incube durante 1 h em condições de luz indicado no passo 1.1 para permitir que os estomas recuperar.
3. ácido abscísico (ABA) tratamento e ensaio de movimento de estomas
- Em um prato de Petri tamanho 150 x 20 mm. Incube as cascas de estomas enriquecido a 30° C por 15 min em 50 mL de tampão de abertura estomática ou em 50 mL de tampão de abertura estomática, com uma concentração final de 10 µM ABA para o tempo de tratamento adequado.
- Coloque as cascas num agitador a 50 rpm para 5, 15 e 30 min. Depois de cada intervalo de tempo remover a casca com uma pinça e siga os passos da imagem latente na etapa 3.3.
- Com imagens dos estomas antes do tratamento ABA e nos vários pontos de tempo após o tratamento ABA com um microscópio de luz.
- Pegue uma casca e coloque-a sobre uma lâmina de vidro de microscópio.
- Coloque o slide no palco microscópio e ajustar o estágio para que a imagem da casca pode ser visualizada.
- Ajustar a multa e curso foco no microscópio para obter uma imagem clara das células guarda.
- Com várias imagens dos estomas múltiplos ampliação de 40 X.
- Medir 60 aberturas estomáticas usando o ImageJ8.
- Calcule o erro padrão e o significado em um p-valor < 0,05 das 60 medições abertura estomática.
4. proteína extração e separação de SDS-Page
- Triture as cascas por 15 s em suficiente nitrogênio líquido para cobrir as cascas usando um pilão refrigerados.
- Por 50 cascas, adicionar 3 mL de fenol saturado de Tris (pH 8,8) e 3 mL de tampão de extração da proteína (0,9 M de sacarose, 0.1 M Tris-HCl, EDTA 0,01 M, 0,4% 2-Mercaptoetanol, 10 µ l de inibidor de protease e fosfatase de 1mm) com uma pipeta para o almofariz e depois triturar as cascas para 5 addi cional de minutos em uma coifa.
- O extrato usando uma pipeta de transferência e as cascas usando uma pinça de metal para um Oakridge centrifugar o tubo e agitar um agitador a 50 rpm durante 1 h a 4 ° C.
- Retire as cascas do tubo de centrífuga Oakridge e centrifugar o extrato em 5.000 x g durante 10 minutos. Em seguida, a fase superior fenólica de transferência para um novo tubo limpo microcentrífuga usando uma pipeta.
- Precipitado o fenol extraído de proteínas adicionando 5 volumes de acetato de amônio 0,1 M gelado em metanol 100%. Vórtice brevemente e incubar durante uma noite a-20 ° C.
- Centrifugar a 20.000 x g a 4 ° C por 20 min, decante o sobrenadante derramando lentamente fora do tubo e reter a pelota de proteína no tubo.
- Lavar o sedimento de proteína, duas vezes com acetato de amônio 0,1 M em metanol e então duas vezes com acetona 80% e uma vez com 100% de acetona gelada.
Nota: Lavagens são feitas pela adição de 10 mL do reagente especificado para o tubo de proteína. Agite em uma coqueteleira a 50 rpm por 5 min, seguido por centrifugação a 15.000 x g a 4 ° C por 10 min. Em seguida, despeje o reagente fora do tubo, mantendo apenas a pelota de proteína. - Adicionar 1 mL de acetona gelada de 100% para a pelota e ressuspender pipetando lentamente subindo e descendo.
- Transferência de suspensão de proteínas via pipeta para um tubo de microcentrífuga de 2 mL, em seguida, centrifugar a 20.000 x g a 4 ° C por 5 min.
- Remover a acetona por decantação é de tubo e secar a pelota em coifa por 10 min.
- Dissolver a proteína em um tubo de centrífuga de micro com 200 µ l de tampão de dissolução (8 M de ureia, 0,5% SDS, 30 mM Tris-HCl pH 8,5) e vórtice de 30 min. centrifugar a 20.000 x g a 15 ° C por 20 min e recolher o sobrenadante em um novo tubo.
- Quantificar a concentração de proteína, seguindo o protocolo de quantificação de proteína9.
- Use amostras da proteína para separação de proteínas por eletroforese em gel seguindo o protocolo de10.
Resultados
Uma imagem representativa de Arabidopsis guarda células antes e após a digestão do mesofilo e as células epidérmicas é mostrado na Figura 1. Viabilidade celular de guarda antes e após a remoção do mesofilo e as células epidérmicas pode ser observada usando o FDA para medir a atividade enzimática e a integridade da membrana celular (figura 1B e 1D). A Figura 2 ilustra o movimento estomático de Arabidopsis em resposta ao tratamento de ABA. Abertura estomática diminui mais de 50% após 30 minutos de tratamento com ABA. Figura 2A é um curso de tempo do movimento de estomas. Em vários pontos do tempo, as fotos foram tiradas com um microscópio de luz. Abertura estomática foi medida com ImageJ e os resultados foram apresentados como a média de 60 a 80 abertura medições ± erros-padrão. Uma imagem representativa da abertura estômatos em cada momento do tempo é mostrada na Figura 2B. Deteção de proteínas, a separação e a abundância relativa são observados por SDS-PAGE (Figura 3). Quatro repetições biológicas são incluídas para enfatizar a reprodutibilidade de extração da proteína deste método.
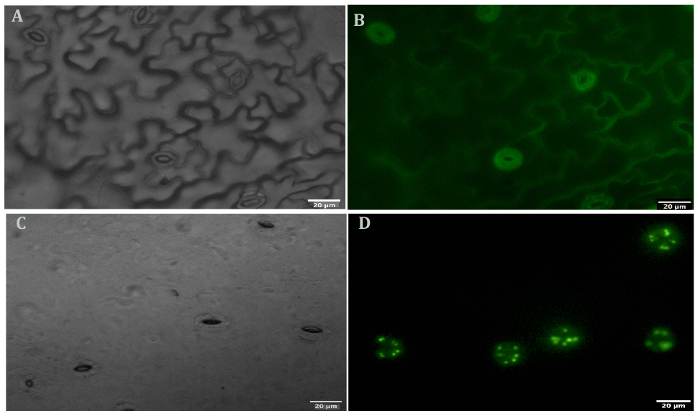
Figura 1 . Fluoresceína diacetato viabilidade coloração das células guarda antes e após a remoção do mesofilo e as células epidérmicas. (A) peelings (não digeridas) sob campo brilhante. (B) as cascas (não digeridas) e corados com FDA. (C) as cascas (digeridas) sob brilhante campo (D) as cascas (digeridas) e corados com FDA. Todas as fotos foram tiradas em ampliação de 40 X. Clique aqui para ver uma versão maior desta figura.
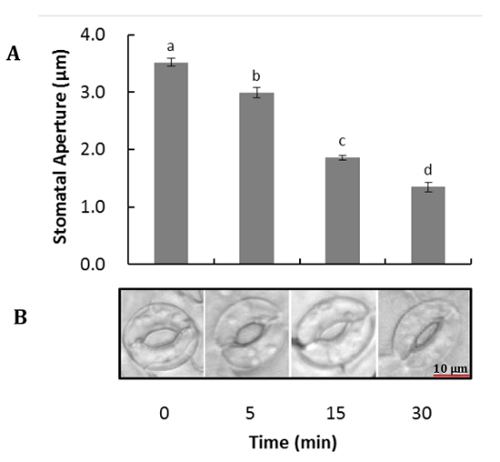
Figura 2 . Movimento estomático de Arabidopsis em resposta à ABA. Epiderme foram descascados de folhas totalmente expandidas, com células epidérmicas removido e pré-incubados sob a luz com o buffer de abertura (50 mM KCl, 10mm MES-KOH, pH 6.2) por 2 h e em seguida incubadas com água ou com tratamento de ABA 10 µM para 5, 10 e 30 min. (A) Curso de tempo do movimento estomático. (B) imagem representativa dos estomas em cada ponto. Os dados são mostrados como média ± SE de três experimentos independentes. Análise de variância (ANOVA) foi realizado para analisar as diferenças. Letras diferentes indicam valores médios significativamente diferentes em p < 0,05. Clique aqui para ver uma versão maior desta figura.
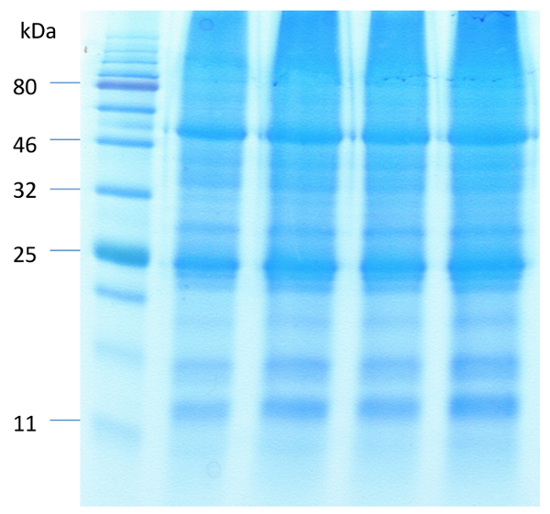
Figura 3 . Separação de SDS-PAGE das proteínas do enriquecido guarda células usando o método da extração da proteína baseada em fenol. Quantidades iguais (40 µ g) de proteínas foram resolvidas usando o gel de poliacrilamida de 12,5% e visualizado com a CBB. Clique aqui para ver uma versão maior desta figura.
Discussão
Guarda as células são um sistema de modelo para estudar os mecanismos de transdução de sinal nas plantas e é importante garantir que a preparação de amostras utilizadas no estudo é o mais adequado para responder às perguntas biológicas. Apesar do crescente interesse em células de guarda dentro da comunidade de pesquisa de planta, não existe nenhum método universal sobre como preparar estomáticas células guarda que permita o movimento estomático e fisiologia bem como as alterações moleculares para ser estudado em um sistema. O desafio para isolá-los pode ser atribuído em grande parte ao seu tamanho pequeno, baixa abundância e estrutura original, que pode tornar mais ou menos difícil removê-los do toda folhas.
Este protocolo fornece um método sobre como superar esses obstáculos, isolando-as usando um método desenvolvido fita-casca. O método apresentado neste protocolo fornece uma maneira para isolar intactas estomáticas guarda as células, que permanecem fisiologicamente sensíveis a estímulos. A preparação destas amostras torna possível para a extração de proteínas de célula guarda que poderia servir como matéria-prima para estudos em profundidade proteomic, tais como estudos de proteômica quantitativa utilizando Tags de massa em Tandem (TMT) e/ou isobárica tag para 11,de quantificação relativa e absoluta (iTRAQ)12. Além disso, este método pode ser ligeiramente modificado e otimizado para tornar possível o estudo de pequenas moléculas, tais como metabólitos encontrados nas células de guarda. O experimento aqui utilizou o phytohormone ABA como um elicitor para o movimento estomático em Arabidopsis, no entanto, outros tratamentos podem ser utilizados em conformidade. Esse método também é adaptável para outras espécies de plantas.
Devido o delineamento experimental e a natureza dos materiais utilizados neste protocolo, existem algumas etapas críticas. Enquanto descascando desmoronar as faces abaxial e adaxial da folha (passo 2.2), é importante que seja feito sem hesitação e aplicando uma pressão suave igual para ambas as partes da fita para que a camada abaxial é uniforme após ele é removido. É importante otimizar o tempo de técnica e digestão de peeling individuais para as espécies de plantas no estudo como eles podem ter tempos diferentes de digestão óptima. Durante a digestão enzimática (etapas 2.8-2.10), as cascas devem ser vigiadas de perto e verificadas a cada 3-5 minutos. Isto é importante porque pequenas diferenças nas camadas das cascas resultará em tempos de digestão mais rápido ou mais lento. Ao tratar as cascas com ABA ou outros estímulos (passo 3.1), as cascas devem ser igualmente espaçadas, flutuante e agitando suavemente para que eles nunca se sobreponham. As cascas que se juntam ou se sobrepõem podem produzir resultados diferentes devido à falta de contato com a solução.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos a Daniel Chen na Digital vídeo produção equipe de Buchholz High School para assistência na edição do vídeo. Esta pesquisa sobre estomáticas células de guarda, proteómica e metabolómica no laboratório de Chen foi apoiada por concessões nos National Science Foundation (0818051, 1158000 e 1412547). Wenwen Kong é suportado pelo Conselho da bolsa de China. Dr. Qiuying Pang é suportado pela China Scholarship Council e Fundação Nacional de ciências naturais da China (31570396).
Materiais
| Name | Company | Catalog Number | Comments |
| Stainless Steel Surgical Scalpel | Feather | NC9999403 | |
| Scotch Tape (3M) | ULINE | S-9781 | |
| Petri Dish | Sigma-Aldrich | BR455701 | |
| Cellulase (Onozuka R-10) | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-3 | |
| Macerozyme R-10 | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-4 | |
| DM6000B Microscope | Leica Microsystems | ||
| Protease and Phosphatase Inhibitor Cocktails | Thermo Fisher Scientific | PI78443 | |
| Oak Ridge High-Speed PPCO Centrifuge Tubes | Thermo Fisher Scientific | 3119-0030 | |
| EZQ Protein Quantitation Kit | Thermo Fisher Scientific | R33200 | |
| Fluorescein Diacetate (FDA) | Thermo Fisher Scientific | F1303 | |
| Abscisic Acid | Sigma-Aldrich | A4906 | |
| Metro Mix 500 | BWI Companies | TX-500 | |
| Laemmli Sample Buffer | Bio-Rad | 161-0737 | |
| Bio-Safe Comassie (G-250) | Bio-Rad | 161-0786 | |
| Microcentrifuge Tube (2mL) | USA Scientific, Inc. | 1620-2700 | |
| ImageJ software | National Institute of Health | ||
| Tweezers | Sigma-Aldrich | F4017-1EA | |
| 12% Mini-PROTEAN TGX Precast Gel | Bio-Rad | 456-1043 | |
| Microscope slides | Fisherbrand | 12-550-A3 |
Referências
- Acharya, B., Assmann, S. Hormone interactions in stomatal function. Plant Molecular Biology. 69 (4), 451-462 (2009).
- Schroeder, J. I., Allen, G. J., Hugouvieux, V., Kwak, J. M., Waner, D. Guard cell signal transduction. Annual Review of Plant Physiology and Plant Molecular Biology. 52, 627-658 (2001).
- Obulareddy, N., Panchal, S., Melotto, M. Guard Cell Purification and RNA Isolation Suitable for High-Throughput Transcriptional Analysis of Cell-Type Responses to Biotic Stresses. Molecular Plant-Microbe Interactions. 26 (8), 844-849 (2013).
- Pandey, S., Wang, X. Q., Coursol, S. A., Assmann, S. M. Preparation and applications of Arabidopsis thaliana guard cell protoplasts. New Phytologist. 153 (3), 517-526 (2002).
- Schroeder, J. I., Raschke, K., Neher, E. Voltage Dependence Of K+ Channels In Guard-Cell Protoplasts. Proceedings of the National Academy of Sciences of the United States of America. 84 (12), 4108-4112 (1987).
- Wu, F. H., et al. Tape-Arabidopsis Sandwich - a simpler Arabidopsis protoplast isolation method. Plant Methods. 5, 10(2009).
- Svozil, J., Gruissem, W., Baerenfaller, K. Proteasome targeting of proteins in Arabidopsis leaf mesophyll, epidermal and vascular tissues. Frontiers in Plant Science. 6, (2015).
- Schneider, C., Rasband, W., Eliceiri, K. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Agnew, B., Murray, D., Patton, W. A rapid solid-phase fluorescence-based protein assay for quantitation of protein electrophoresis samples containing detergents, chaotropes, dyes, and reducing agents. Electrophoresis. 25 (15), 2478-2485 (2004).
- He, F. Laemmli-SDS-PAGE. Bio-protocol. Bio101 (80), (2011).
- Thompson, A., et al. Tandem mass tags: A novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS (vol 75, pg 1895). Analytical Chemistry. 78 (12), 4235-4235 (2006).
- Wiese, S., Reidegeld, K. A., Meyer, H. E., Warscheid, B. Protein labeling by iTRAQ: A new tool for quantitative mass spectrometry in proteome research. Proteomics. 7 (3), 340-350 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados