Method Article
气孔带皮: 一种改进的防护细胞样品制备方法
摘要
本协议描述了一种制备富含气孔保护细胞的方法, 用于生理学和其他生物研究。
摘要
保护细胞的研究对于了解这种细胞类型对植物整体功能的特殊贡献是至关重要的。然而, 通常很难分离, 因此研究它们往往会带来挑战。
本研究建立了气孔保护细胞的富集方法。该协议利用透明胶带分离出保护细胞并从细胞中提取蛋白质。该方法在隔离过程中提高了保护细胞的完整性和产量, 为细胞信号过程的研究以及它们与气孔运动表型的相关性提供了可靠的样本。在这种方法中, 植物叶被分成两部分的胶带和剥离分开, 以消除背面的一侧。本协议适用于拟南芥叶组织分离保护细胞。用荧光素双乙酸 (FDA) 对细胞进行治疗, 以确定活性和脱落酸 (aba), 以评估 aba 对气孔运动的反应。最后, 该协议对制备富含气孔保护细胞和分离蛋白质具有重要意义。这里获得的细胞和蛋白质的质量使生理学和其他生物研究得以实现。
引言
气孔在植物的整体生理和健身中起着重要的作用。这些微小的植物特定的结构是由两个专门的表皮细胞组成的, 称为守卫细胞, 在叶的背面最丰富的发现。气孔是在植物和大气之间交换气体和通过蒸腾控制水分损失所必需的。保护细胞通过不同外部 (例如, 光, 湿度, 病原体接触, 二氧化碳水平) 和内部 (e., 内源激素) 的整合来调节气孔孔径,刺激 1,2。在过去的20年中, 这种细胞类型已经成为研究植物细胞信号过程的模型系统。这些细胞构成了叶中总细胞的一小部分;因此, 以单细胞的方式研究其独特的细胞、生物化学和分子特性, 就有必要将它们与其他叶细胞类型分离。在过去, 守卫细胞研究经常介入了卫兵细胞原生质体的准备 (GCP)3,4,5。这通常需要使用大量的细胞壁降解酶和或通过混合的机械干扰, 并证明是昂贵和耗时, 因为它通常需要很多小时来准备一个 GCP 样品, 往往是很少的产量。更重要的是, 由于保护细胞作为完全对调节气孔孔径, 使用 GCP 可以被视为一个人工系统, 研究保护细胞信号。
在这里, 我们开发了一种方法来制备气孔, 其中完整的保护细胞丰富和保持生理反应的刺激。这种方法的灵感来自于分离叶肉细胞原生质体6,7的方法。在我们的方法, 气孔是准备使用透明的透明胶带, 首先分离的大部分叶肉细胞的正面层的叶子从背面层包含路面和守卫细胞。这是通过贴一块胶带到叶子的两侧, 并剥离它们分开。在气孔开放的缓冲区中, 允许从背面层的细胞恢复到光下。后来, 其余的路面细胞被删除使用少量的细胞壁降解酶, 留下保护细胞, 丰富的磁带。
在这种简单的方法中, 气孔保护细胞既可行又反应灵敏, 可以快速有效地制备, 花不到一小时就能从50皮中获得丰富的气孔保护细胞, 成本最低。这里的方法对植物细胞的损伤比以前的原生质体制备方法少。此外, 从这种方法收集的材料产生理想的蛋白质量。最重要的是, 由于叶子不受混合或长时间的消化, 并且保护细胞保持不变, 研究结果将更接近于保护细胞的自然生物学。利用这种方法, 气孔运动可以与分子水平的变化实时相关。因此, 从研究中获得的知识使用这种制备方法, 对于更全面地了解防护细胞信号是非常重要的。
我们用植物拟南芥作为模型;但该协议可应用于其他植物中的气孔保护细胞的富集, 如甘蓝型油菜的消化时间小改性。作为概念的证明, 我们已经证明, 通过这种方法丰富的气孔保护细胞是可行的, 并响应的刺激, 如荧光素二乙酸 (FDA) 的研究, 并利用植物激素脱落酸 (ABA), 分别。此外, 我们已经证明, 高质量的蛋白质可以从这些守卫细胞分离。在这里, 我们描述了这个过程的详细协议。
研究方案
1. 种植植物
- 在灌封混合物中发芽种子。在生长室种植植物在一个光强度的140µmol 光子 m−2 s −1和光周期8小时在22°c 和 16 h 黑暗在18°c 2 星期。
- 将类似大小的移栽苗单独放入4英寸直径的花盆中, 并在步骤1.1 所述相同条件下生长3周。
注: 自来水厂每周两次, 以保持土壤湿润。
2. 制备富气孔
- 用手术刀把5周大的叶子移开.
- 将每片叶子附着在两片透明的透明胶带上, 一条附着在背面 (下部) 一侧, 另一块附着在叶子正面 (上部) 一侧。把带子留在叶子上5秒。
- 用食指和拇指分别将两片带子分开, 将背面与人行道、守卫细胞、正面与叶肉细胞分开。
- 将果皮从叶背面的60毫升气孔开放缓冲器 (50 毫米氯化钾, 10 毫米 MES, 调整到 pH 6.2 与1米 koh) 在40毫米 x 12 毫米大小的培养皿, 因为他们收集。
- 重复上述步骤, 直到收集所有样品皮。
- 在步骤1.1 所述的光条件下, 将含有果皮的培养皿置于生长室中。把果皮放在光下2小时, 完全打开气孔。
- 将果皮放入150毫米 x 20 毫米培养皿中, 含有50毫升细胞壁消化酶混合物 (0.7% 纤维素酶 R-10, 0.025% 离析酶 R-10, 0.1% (w/v) polyvinylpyrrolidone-40, 0.25% (w/v) 牛血清白蛋白55% 基本溶液 (0.55 米山梨醇, 0.5 毫米CaCl2, 0.5 毫米氯化镁2, 0.5 毫米抗坏血酸, 10 µM, 2PO4, 5 毫米 4-morpholineethanesulfonic 酸 (MES) 在 pH 5.7 调整与 1 M KOH)。
- 在50转20分钟的培养皿中, 在一个相互的振动筛上摇动果皮。
- 20分钟后用镊子从酶溶液中取出果皮. 将果皮转移到150毫米 x 20 毫米大小的培养皿中, 含50毫升水。
- 使用转移吸管, 冲洗果皮十五年代两次与10毫升的水, 以消除任何残留酶溶液。
- 使用镊子将果皮放置在150毫米 x 20 毫米尺寸的培养皿中, 50 毫升的新鲜气孔开启缓冲液在步骤2.4 中使用。在步骤1.1 中所述的光条件下孵育1小时, 以允许气孔恢复。
3. 脱落酸 (ABA) 治疗及气孔运动测定
- 在150毫米 x 20 毫米大小的培养皿。在30°c 上孵育富气孔果皮15分钟, 在气孔开启缓冲器的50毫升或气孔开启缓冲器的50毫升内, 以10µM ABA 的最后浓度为适当的处理时间。
- 将果皮放在 50 rpm 的振动筛上, 5, 15 和30分钟。每隔一段时间间隔后用镊子去除果皮, 然后按照步骤3.3 中的成像步骤操作。
- 采用光镜观察 aba 治疗前的气孔图像和不同的时间点。
- 把果皮放在玻璃显微镜滑梯上。
- 将幻灯片放在显微镜的舞台上, 调整舞台, 使果皮的图像可以可视化。
- 调整在显微镜上的精细和课程重点, 以获得一个清晰的形象的守卫细胞。
- 以40X 倍放大倍数的多种气孔图像。
- 使用 ImageJ8测量60气孔光圈。
- 在60气孔孔径测量的 p 值 < 0.05 中计算标准误差和意义。
4. 蛋白质提取和 SDS 分页分离
- 十五年代用足够的液氮研磨果皮, 用冷冻砂浆和杵盖住果皮。
- 每50果皮, 添加3毫升的三饱和苯酚 (pH 8.8) 和3毫升蛋白质提取缓冲 (0.9 米蔗糖, 0.1 米三盐酸, 0.01 米 EDTA, 0.4% 2-巯基乙醇, 10 µL 的1毫米蛋白酶和磷酸酶抑制剂) 与一个吸管的砂浆, 然后研磨的果皮5此外在通风罩分钟。
- 使用吸管和果皮用金属镊子将萃取物转移到欧克瑞奇离心管上, 并在 50 rpm 1 小时的振动筛上搅动4摄氏度。
- 从欧克瑞奇离心管中取出果皮, 离心萃取物在 5000 x g 处10分钟。然后用吸管将顶酚相转移到新的清洁微离心管上。
- 在100% 甲醇中加入5卷冰冷0.1 米醋酸铵, 沉淀苯酚提取蛋白。漩涡简要地和孵化隔夜在-20 °c。
- 离心机在 2万 x g 在4°c 为20分钟, 醒酒在上清液慢慢地倾吐它从管子并且保留蛋白质药丸在管子里。
- 用0.1 米醋酸铵在甲醇中两次洗涤蛋白颗粒, 然后两次用80% 丙酮, 一次用100% 冷丙酮。
注: 通过将10毫升的指定试剂添加到蛋白质管中进行洗涤。在 50 rpm 5 分钟的振动筛上搅拌, 其次为 1.5万 x g 的离心, 4 摄氏度为10分钟。然后将试剂倒入试管中, 只保留蛋白颗粒。 - 加入1毫升100% 冷丙酮的颗粒, 并通过缓慢吹打的向上和向下重新暂停。
- 通过吸管转移蛋白质悬浮液到2毫升微离心管, 然后离心机在 2万 x g 在4°c 5 分钟。
- 将丙酮醒酒从管中取出, 在通风罩中干燥10分钟。
- 用200µL 溶解缓冲液 (8 米尿素、0.5% SDS、30毫米三盐酸盐在 pH 值 8.5) 和涡旋为 30 x g 在2万摄氏度为15度, 在新管中收集上清, 将蛋白质溶解在微离心管中。
- 根据蛋白质量化协议9, 量化蛋白质浓度。
- 在10号议定书之后使用蛋白质样品进行蛋白质分离。
结果
图 1显示了拟南芥保护细胞在叶肉和表皮细胞消化前后的代表性图像。使用 FDA 测量酶活性和细胞膜完整性 (图 1B和1D) 可以观察到叶肉和表皮细胞去除前后的保护细胞活力。图 2说明拟南芥的气孔运动对 ABA 的治疗反应。与 ABA 治疗30分钟后气孔孔径减少50% 以上。图 2A是气孔运动的时间过程。在不同的时间点, 图片用光显微镜拍摄。用 ImageJ 测量气孔孔径, 结果显示为标准误差的60到80孔径测量的平均值。图 2B显示了每个时间点的气孔孔径的代表性图像。蛋白质检测、分离和相对丰度由 SDS 页面观察 (图 3)。四生物复制被包括在强调蛋白质提取的重现性从这个方法。
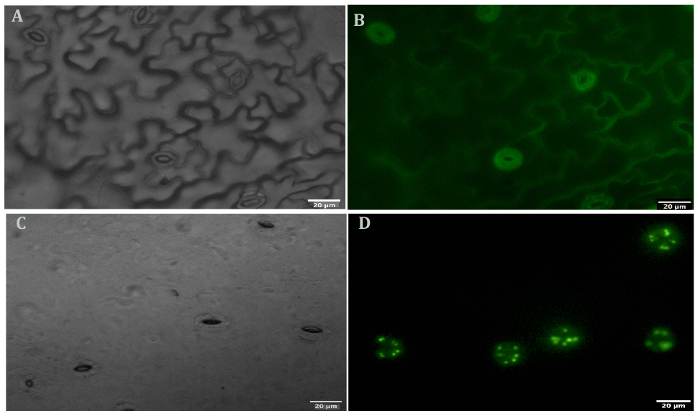
图 1.荧光素双乙酸在叶肉和表皮细胞去除前后保护细胞的活性染色.(A)在明亮的田野下去皮 (未消化)。(B)果皮 (未消化), 并染有 FDA。(C)果皮 (消化) 在明亮的领域(D)果皮 (消化) 和染色与 FDA。所有图片都是以40X 放大倍数拍摄的。请单击此处查看此图的较大版本.
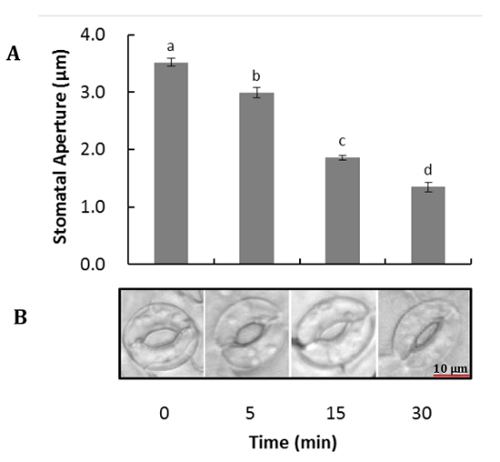
图 2.拟南芥的气孔运动对 ABA 的反应.表皮被完全膨胀的叶子剥去, 与表皮细胞去除, 并在光照下预孵化 (50 毫米氯化钾, 10 毫米 MES, pH 6.2) 为2小时, 然后用水孵化或10µM ABA 治疗 5, 10 和30分钟. (A)气孔运动的时间过程。(B)每个时间点有代表性的气孔图象。这些数据显示为三独立实验的手段。对方差分析进行了研究, 以分析平均差异。不同的字母在 p < 0.05 中表示显著不同的平均值。请单击此处查看此图的较大版本.
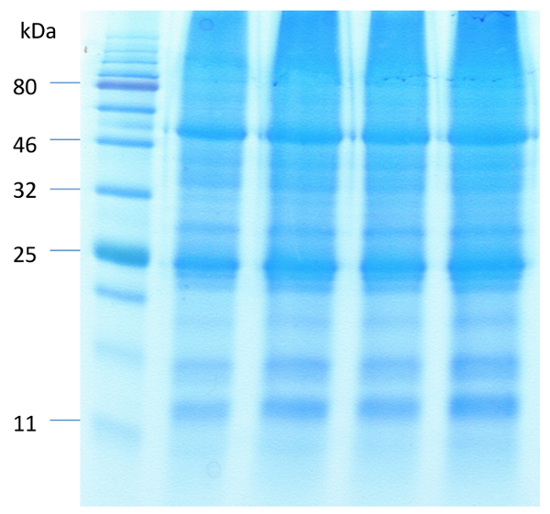
图 3.用苯酚为基础的蛋白质提取方法对富集保护细胞中蛋白质的 SDS 分页分离.用12.5% 聚丙烯酰胺凝胶和 CBB, 对蛋白质的等量 (40 µg) 进行了解析。请单击此处查看此图的较大版本.
讨论
保护细胞是研究植物信号转导机制的模型系统, 重要的是要确保研究中使用的样品的制备最适合回答生物学问题。尽管植物研究界对保护细胞的兴趣越来越浓厚, 但对于如何制备气孔保护细胞, 使气孔运动和生理以及分子变化在一个研究中都没有普遍的方法系统。隔离它们的挑战在很大程度上归因于小规模、低丰度和独特的结构, 这可以使它们或多或少难以从整个树叶中移除。
该协议提供了如何克服这些障碍的方法, 使用开发的磁带剥离方法将它们隔离开来。本协议中提出的方法为隔离完整的气孔保护细胞提供了一种方法, 它保持生理上对刺激的反应。这些样品的制备使其能够提取出可以作为深度蛋白质组研究的起始材料的保护细胞蛋白, 例如利用串联质量标签 (TMT) 和或等压标记的定量蛋白质组学研究相对和绝对定量 (iTRAQ)11,12。此外, 这种方法可以稍加修改和优化, 使研究小分子, 如代谢物在保护细胞中发现。本实验利用植物激素 ABA 作为诱导在拟南芥气孔运动中的应用, 但可以相应地使用其他治疗方法。这种方法也适用于其他植物种类。
由于实验设计和本协议所用材料的性质, 有一些关键步骤。当剥离叶子的背面和正面的边时 (步骤 2.2), 重要的是, 它是毫不犹豫地完成, 并对两块磁带施加同样的温和压力, 以便在移除后, 背面的层是均匀的。在研究中, 对植物物种的个体剥离技术和消化时间进行优化是非常重要的, 因为它们可能具有不同的最佳消化时间。在酶消化过程中 (步骤 2.8-2.10), 应密切观察果皮, 每3-5 分钟检查一次。这一点很重要, 因为果皮层的细微差别会导致消化时间更快或更慢。当用 ABA 或其他刺激 (步骤 3.1) 处理果皮时, 果皮应均匀地间隔, 浮动和摇晃, 使它们永远不会重叠。由于缺乏与溶液的接触, 被粘在一起或重叠的果皮可能产生不同的结果。
披露声明
没有宣布利益冲突。
致谢
我们感谢布赫兹数字视频制作团队的丹尼尔. 陈, 协助编辑视频。该研究的气孔保护细胞, 蛋白质组学和新陈代谢在陈实验室得到了资助, 美国国家科学基金会 (0818051, 1158000 和 1412547)。文文香港获中国奖学金委员会支持。Qiuying 博士获得中国奖学金委员会和国家自然科学基金 (31570396) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| Stainless Steel Surgical Scalpel | Feather | NC9999403 | |
| Scotch Tape (3M) | ULINE | S-9781 | |
| Petri Dish | Sigma-Aldrich | BR455701 | |
| Cellulase (Onozuka R-10) | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-3 | |
| Macerozyme R-10 | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-4 | |
| DM6000B Microscope | Leica Microsystems | ||
| Protease and Phosphatase Inhibitor Cocktails | Thermo Fisher Scientific | PI78443 | |
| Oak Ridge High-Speed PPCO Centrifuge Tubes | Thermo Fisher Scientific | 3119-0030 | |
| EZQ Protein Quantitation Kit | Thermo Fisher Scientific | R33200 | |
| Fluorescein Diacetate (FDA) | Thermo Fisher Scientific | F1303 | |
| Abscisic Acid | Sigma-Aldrich | A4906 | |
| Metro Mix 500 | BWI Companies | TX-500 | |
| Laemmli Sample Buffer | Bio-Rad | 161-0737 | |
| Bio-Safe Comassie (G-250) | Bio-Rad | 161-0786 | |
| Microcentrifuge Tube (2mL) | USA Scientific, Inc. | 1620-2700 | |
| ImageJ software | National Institute of Health | ||
| Tweezers | Sigma-Aldrich | F4017-1EA | |
| 12% Mini-PROTEAN TGX Precast Gel | Bio-Rad | 456-1043 | |
| Microscope slides | Fisherbrand | 12-550-A3 |
参考文献
- Acharya, B., Assmann, S. Hormone interactions in stomatal function. Plant Molecular Biology. 69 (4), 451-462 (2009).
- Schroeder, J. I., Allen, G. J., Hugouvieux, V., Kwak, J. M., Waner, D. Guard cell signal transduction. Annual Review of Plant Physiology and Plant Molecular Biology. 52, 627-658 (2001).
- Obulareddy, N., Panchal, S., Melotto, M. Guard Cell Purification and RNA Isolation Suitable for High-Throughput Transcriptional Analysis of Cell-Type Responses to Biotic Stresses. Molecular Plant-Microbe Interactions. 26 (8), 844-849 (2013).
- Pandey, S., Wang, X. Q., Coursol, S. A., Assmann, S. M. Preparation and applications of Arabidopsis thaliana guard cell protoplasts. New Phytologist. 153 (3), 517-526 (2002).
- Schroeder, J. I., Raschke, K., Neher, E. Voltage Dependence Of K+ Channels In Guard-Cell Protoplasts. Proceedings of the National Academy of Sciences of the United States of America. 84 (12), 4108-4112 (1987).
- Wu, F. H., et al. Tape-Arabidopsis Sandwich - a simpler Arabidopsis protoplast isolation method. Plant Methods. 5, 10(2009).
- Svozil, J., Gruissem, W., Baerenfaller, K. Proteasome targeting of proteins in Arabidopsis leaf mesophyll, epidermal and vascular tissues. Frontiers in Plant Science. 6, (2015).
- Schneider, C., Rasband, W., Eliceiri, K. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Agnew, B., Murray, D., Patton, W. A rapid solid-phase fluorescence-based protein assay for quantitation of protein electrophoresis samples containing detergents, chaotropes, dyes, and reducing agents. Electrophoresis. 25 (15), 2478-2485 (2004).
- He, F. Laemmli-SDS-PAGE. Bio-protocol. Bio101 (80), (2011).
- Thompson, A., et al. Tandem mass tags: A novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS (vol 75, pg 1895). Analytical Chemistry. 78 (12), 4235-4235 (2006).
- Wiese, S., Reidegeld, K. A., Meyer, H. E., Warscheid, B. Protein labeling by iTRAQ: A new tool for quantitative mass spectrometry in proteome research. Proteomics. 7 (3), 340-350 (2007).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。