Method Article
気孔テープ剥離: 細胞試料の調製法の改良
要約
このプロトコルでは、生理学的およびその他の生物学的研究に役立つ濃縮細胞を準備する方法について説明します。
要約
細胞の研究は、植物の全体的な機能にこのセルの型の特定の貢献の知識に不可欠です。多くの場合分離することは困難だし、挑戦を提供する従ってそれらをもっと勉強します。
本研究では、細胞濃縮法を確立します。プロトコルは、スコッチ ガードのセルを隔離し、セルからの蛋白質の抽出を採用しています。このメソッドは、分離中に整合性と細胞の収量を向上し、細胞シグナリング プロセスと気孔の表現型の関連性の研究に信頼性の高いサンプルを提供します。この方法では植物の葉はテープの 2 つの部分間で分割され背軸側を削除するには、離れて皮をむいた。このプロトコルは、シロイヌナズナ葉の組織細胞を分離するために適用されました。セルは、フルオレセイン ・ ジアセテートの生存率を決定する (FDA) とアブシジン酸 (ABA) ABA に気孔運動を評価するために扱われました。結論としては、このプロトコルは蛋白質の分離と濃縮細胞を準備するため有用証明します。有効にする生理学的およびその他の生物学的研究とタンパク質・細胞の品質はここで得られました。
概要
気孔は、全体の生理学と植物のフィットネスに重要な役割を果たします。これらの小さな植物の特定の構造、細胞として知られている 2 つの特殊な表皮細胞によって形成され、葉の切断面に最も豊富にあります。気孔は、蒸散による水損失の制御と同様、植物と大気間のガス交換の必要があります。細胞調節する異なる外部 (例えば光、湿度、病原体の接触、二酸化炭素のレベル) の統合により気孔開口部および内部 (e.g。、内因性ホルモン) 刺激1,2。過去 20 年間で、この型のセルを勉強セルシグナ リング プロセス植物のためのモデル システムとなりました。これらの細胞は葉; 総細胞のごく一部を構成します。したがって、彼らのユニークな携帯を調べるためには、生化学的および分子プロパティ単一セルにそれ、他の葉の細胞型からそれらを分離する必要。過去には、そのガード細胞研究はしばしば細胞プロトプ ラスト (GCP)3,4、5の準備を関与しています。これは通常大量のブレンドによる機械的破壊や、細胞壁分解酵素の使用を必要とし、少し収量を倍のコストと時間のかかる一般的に GCP サンプルを頻繁に準備に多くの時間がかかるように証明されています。もっと重大に、細胞は、気孔開口を調節する完全なペアとして機能、GCP の使用は細胞シグナリングを勉強するための人工的なシステムとして見ることができます。
ここでは、気孔そのまま細胞が濃縮されているし、刺激に対する生理反応を維持を準備する方法を開発しました。このメソッドは、葉肉細胞プロトプ ラスト6,7を分離するために使用された方法に触発されました。本手法は, 気孔は、明確な舗装と細胞を含む裏面層から葉の向軸レイヤーに接続されている最初葉肉細胞の大半を分離するスコッチ テープを使用して用意しています。これは葉の両側にテープを貼付し、それらを離れて剥離です。裏面層から細胞が気孔開口部バッファー内の光の下で回復が許可されます。後残りの舗装の細胞が細胞壁分解酵素、テープに濃縮されているガード細胞を残しての少量を使用して削除されます。
このシンプルなメソッドで応答性の高い有効な気孔のガード細胞迅速かつ効率的に、最小限のコストで 50 の皮から濃縮細胞を取得するより少ない時間を取って準備します。ここにメソッドは、植物細胞のプロトプ ラストが用意されて、従来よりも以下のダメージを課しています。さらに、材料はこのメソッド収量の望ましい蛋白質量から収集されます。最も重要なは、葉がブレンドにさらされていないか、長い消化時間と細胞のまま、ための研究結果より密接にガード セルの自然な生物学に関連します。この方法では、気孔運動関連付けることができますリアルタイムで分子レベルで変更します。したがって、この製法を用いた研究から得られた知識は、ガード細胞シグナル伝達のより包括的な理解のため重要となります。
モデルとして植物のシロイヌナズナを用いてください。ただしこのプロトコルは消化時間の若干の修正をナタネなど他の植物の気孔のガード細胞の濃縮に適用できます。概念の証拠として、このメソッドを介して濃縮細胞は、実行可能なフルオレセイン ・ ジアセテート (FDA) 試金および植物ホルモンのアブシジン酸 (ABA) をそれぞれ活用研究に示すように刺激に反応しました。さらに、高品質のタンパク質がこれらのガードの細胞から分離することができますを確認しました。ここでは、このプロセスの詳細なプロトコルについて述べる。
プロトコル
1. 成長する植物
- Potting の混合物の種を発芽させます。植物を育てる成長室 140 µmol 光子 m− 2の− 1の光強度と光速で 8 h 22 ° C で 16 時間日長で暗い、18 ° C で 2 週間。
- 4"直径の鍋土を含むに個別に類似サイズの苗を移植し、手順 1.1 で説明した追加同じ条件で 3 週間の成長します。
注: は、湿った土壌を維持する週 2 回水道水で植物を水します。
2. 豊かな気孔の準備
- 5 週間の古いシロイヌナズナ植物メスと個々 の葉を削除します。
- 裏面 (下側) に付着したワンピースと葉の向軸 (上) 側に付着した他の作品と明確スコッチ テープの 2 つの部分に各葉を取り付けます。5 葉のテープを残す s。
- 優しい皮をむく離れて舗装と細胞と葉肉細胞の向軸側背軸側を別々 にそれぞれの手の人差し指と親指を使用してテープの 2 つの部分。
- 気孔を開くの 60 mL に葉の背軸側から皮バッファー (50 mM KCl、10 mM MES 島、pH 6.2 1 M コに調整) 40 × 12 mm サイズ ペトリネットの場所は、収集された料理します。
- すべてのサンプルの皮が収集されるまでは、上記の手順を繰り返します。
- 手順 1.1 で述べた光の条件下で生育室に皮シャーレを配置します。気孔が全開に 2 h の光の下で皮を残します。
- 場所は、150 mm × 20 mm にペトリ皿細胞壁の消化酵素の混合 (0.7% セルラーゼ R-10、0.025% macerozyme R-10、0.1% (w/v) ポリビニルピロリドン-40、および 55% 基本的なソリューション (0.55 M ソルビトール、0.5 mM で 0.25% (w/v) ウシ血清アルブミン 50 mL を含む皮します。CaCl2, 0.5 mM MgCl2、0.5 mM アスコルビン酸, 10 μ M KH2PO4, 5 mM 4-morpholineethanesulfonic 酸 (MES) ph 5.7 1 M コで調整)。
- 20 分間 50 rpm でシャーレに相互シェーカーで皮を振る。
- 20 分は、50 mL の水を含む 150 × 20 mm サイズのシャーレに皮を転送した後、皮をピンセットで酵素液から削除します。
- 15 の皮を洗う転送ピペットを使用して、任意の残留酵素液を削除する水 10 mL で 2 回 s。
- 手順 2.4 で使用されるバッファーを開いて新鮮な気孔の 50 mL の 150 mm × 20 mm サイズのシャーレに皮を配置するのにピンセットを使用します。手順を回復する気孔を許可する 1.1 で述べた光の条件で 1 時間インキュベートします。
3. アブシジン酸 (ABA) 処理と気孔運動アッセイ
- で 150 mm × 20 mm サイズ シャーレ。15 分 50 mL の気孔開口バッファーまたは適切な治療時間の 10 μ M の ABA の最終濃度と気孔開口バッファーの 50 mL 30 ° C で豊かな気孔皮を孵化させなさい。
- 5, 15, 30 分間で 50 rpm シェーカーに皮を配置します。各時間間隔後ピンセットで皮を削除、手順 3.3 で画像処理の手順に従います。
- ABA 処理後光学顕微鏡で気孔 ABA 処理前に、と様々 な時点での画像を取る。
- 皮を取るし、ガラス顕微鏡スライド上に置きます。
- 顕微鏡ステージにスライドを配置し、皮のイメージを視覚化できるので、ステージを調整します。
- 罰金を調整し、ガード細胞の鮮明な画像を得るために、顕微鏡の焦点をコースします。
- 40 倍の倍率で複数の気孔のいくつかの画像を取る。
- ImageJ8を使用して 60 の気孔開口部を測定します。
- 標準のエラーおよび p 値 < 0.05 60 の気孔開度測定の意義を計算します。
4. 蛋白質の抽出および SDS ページの分離
- 15 の皮を挽くチルド乳鉢と乳棒を使用して皮をカバーする十分な液体窒素で s。
- 50 皮ごと Tris 飽和フェノール (pH 8.8) の 3 mL を加えると 3 mL タンパク質抽出バッファー (0.9 M ショ糖 0.1 M トリス-HCl、0.01 M EDTA, 0.4 %2-メルカプトエタノール、プロテアーゼ、ホスファターゼ阻害剤は 1 mM の 10 μ L)、モルタルにピペットで 5 エディーの皮を挽くとヒューム フードに至り分。
- ピペットを使用して抽出を転送し、皮、オークリッジに金属製のピンセットを使用してチューブを遠心し、4 ° C で 1 時間を 50 rpm でシェーカーの扇動
- オークリッジ遠心管から皮を外し、5,000 × g で 10 分間で抽出物を遠心分離します。ピペットを使用して新しいきれいなマイクロ遠心チューブ トップのフェノール相を転送します。
- フェノールの沈殿物は 100% メタノールで冷たい 0.1 M 酢酸アンモニウム 5 ボリュームを追加することによってタンパク質を抽出しました。渦を簡潔にし、-20 ° C で一晩インキュベート
- 4 ° C、20 分で 20,000 × g で遠心分離機、ゆっくりとチューブからそれを注ぐことによって、上清をデカントし、管内の蛋白ペレットを保持します。
- メタノール、酢酸アンモニウム 0.1 M で二回蛋白質餌を洗浄し、80% アセトンで 2 回と 100% 冷アセトン。
注: 洗浄は、タンパク質のチューブに指定された試薬 10 mL を追加することによって行われます。5 分、10 分の 4 ° C で 15,000 × g で遠心分離後 50 回転でシェーカーを揺り動かしなさい。その後、蛋白ペレットのみを保持チューブから試薬を注ぐ。 - ペレットに 100% 冷アセトン 1 mL を追加し、上下にゆっくりとピペッティングによって再サスペンドします。
- タンパク質サスペンション ピペット 2 mL マイクロ遠心チューブに転送し、5 分のための 4 ° C で 20,000 × g で遠心分離機します。
- チューブからデカントでアセトンを削除し、10 分の発煙のフードでペレットを乾燥します。
- 溶解バッファー (8 M 尿素、0.5 %sds、ph 8.5 30 mM トリス-HCl) の 200 μ L マイクロ遠心チューブにタンパク質を溶解とで 30 分間遠心 15 ° C 20 分、収集新しい管の上澄みで 20,000 × g、渦。
- 次のタンパク質定量プロトコル9タンパク質濃度を定量化します。
- プロトコル10次ゲル電気泳動蛋白質の分離のための蛋白質のサンプルを使用します。
結果
シロイヌナズナの代表的なイメージは前に、と後、葉肉細胞や表皮細胞の消化は、図 1に示すセルをガードします。ガード セル実行可能性前に、と葉肉細胞と表皮細胞の除去後は、酵素活性と細胞膜の完全性 (図 1 bと1 D) を測定する FDA を使用して観察できます。図 2は、ABA の処置への応答でシロイヌナズナの気孔を示しています。気孔は、ABA 処理での 30 分後に 50% 以上が減少します。図 2 aは、気孔運動の時間のコースです。さまざまな時点での写真は光学顕微鏡で撮影されました。ImageJ で気孔を測定し、60 ~ 80 口径測定値 ± 標準誤差平均値が示されました。各時点で気孔開口部の代表的な画像を図 2 bに示します。蛋白質の検出、分離および相対的な豊かさは SDS のページ (図 3) で観測されました。4 生物的複製は、このメソッドからの蛋白質の抽出の再現性を強調する含まれます。
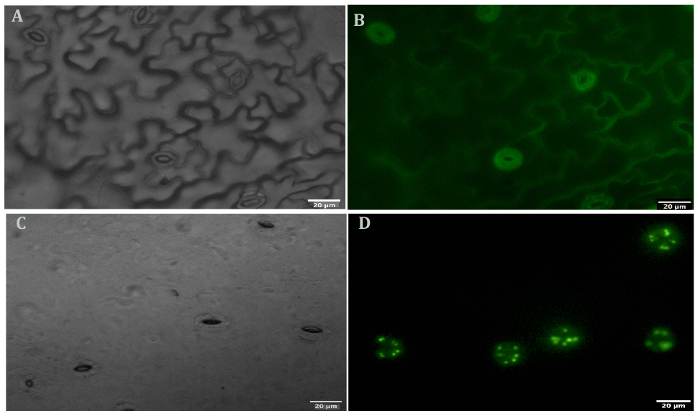
図 1.フルオレセイン ジアセテート生存染色細胞の葉肉細胞と表皮細胞の摘出前後。(A)皮 (未消化) 明るいフィールドの下。(B)皮 (未消化) し、FDA とステンド グラスします。(C)の皮 (消化) の下で明るいフィールド(D)皮 (消化) と FDA とステンド グラスします。すべての写真は、40 倍の倍率で撮影されました。この図の拡大版を表示するのにはここをクリックしてください。
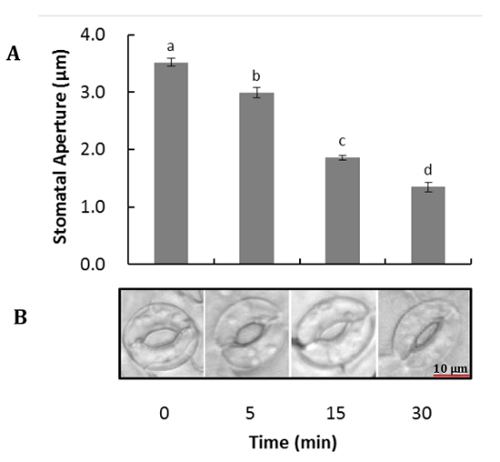
図 2.ABA に応えてシロイヌナズナの気孔。完全展開葉、削除と 2 h のオープニング バッファー (50 mM KCl、10 mM MES-島、pH 6.2) と光の下でプレインキュベートした水または 5、10 μ M の ABA 処理を培養表皮細胞から表皮を剥いで 10 と 30 分(A)気孔開閉の時間コース。(B)各時気孔の代表的な画像をポイントします。± SE を 3 つの独立実験の手段として、データが表示されます。分散分析 (ANOVA) は、平均差異予め形成された.別の文字を示す p で大幅に異なる平均値 < 0.05。この図の拡大版を表示するのにはここをクリックしてください。
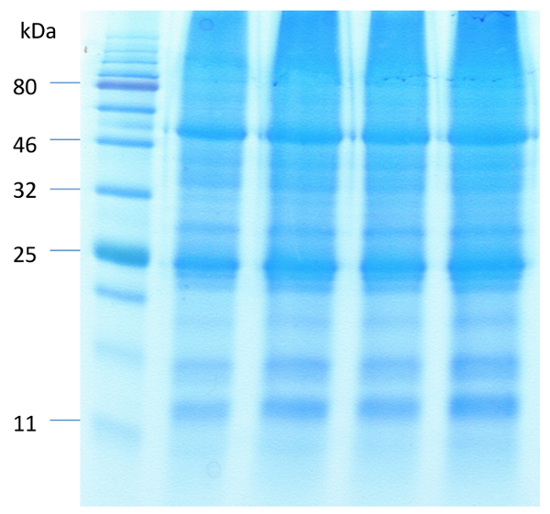
図 3.フェノール ベースのタンパク質抽出法を用いて濃縮細胞からタンパク質の SDS ページ分離。同量 (40 μ g) 蛋白質の 12.5% のポリアクリルアミドゲルを使用して解決、CBB で可視化します。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ガード細胞は植物におけるシグナル伝達機構を研究するためのモデル システムを研究で使用される試料の調製が生物的質問に答えるに最も適切なことを確認することが重要です。植物研究コミュニティの中で細胞の増加の関心にもかかわらずは普遍的な方法が気孔運動と生理の両方できるようになる細胞を準備する方法の 1 つで検討する分子レベルの変化だけでなく、システム。それらを分離する挑戦は、その小型サイズ、低豊かさとそれをもっとまたはより少なく全体の葉からそれらを削除することは困難ことができるユニークな構造に大部分の帰することが。
このプロトコルでは、分離開発テープ皮メソッドを使用して、これらの障害を克服する方法のメソッドを提供します。このプロトコルでメソッドは、生理学的刺激に対する応答性を維持そのまま気孔ガード細胞を分離する方法を提供します。タンデム質量タグ (TMT) と定圧のまたはタグを利用した定量的プロテオミクス解析などの詳細なプロテオーム研究の出発材料として役立つことができる細胞蛋白質の抽出が可能なこれらのサンプルの準備相対パスと絶対定量 (iTRAQ)11,12。さらに、この方法少し変更できガード細胞で見つけられた代謝物などの小分子の研究を可能にする最適化されました。ここでの実験は、他の治療法が使用されるしかし、シロイヌナズナの気孔のエリシターとして植物ホルモン ABA を利用しました。この方法は、他の植物種に適応します。
実験的なデザインとこのプロトコルで使用される材料の性質のためにいくつかの重要なステップがあります。間葉 (手順 2.2) および側面剥離離れて、ためらうことがなく、それが削除された後、裏面層が均一、テープの両方の部分に等しい穏やかな圧力を適用することによってされることが重要です。似ている別の最適な消化時間における植物種の個々 の剥離技術と消化時間を最適化することが重要です。(手順 2.8-2.10)、酵素の消化力の間に皮を密接に監視し、3-5 分ごとにチェックください。皮の層のわずかな違いは、高速または低速の消化時間になりますので、これは重要です。ABA やその他の刺激 (ステップ 3.1) と皮を治療する際の皮をする等間隔に、フローティングと重なることがないように、優しく揺れ。一緒にはまり、重なる皮は、ソリューションとの接触の不足のために異なる結果をもたらす可能性があります。
開示事項
利害の対立が宣言されていません。
謝辞
ダニエル陳からデジタル ビデオ生産チームのブッフホルツ高校編集ビデオで支援に感謝いたします。この気孔細胞・ プロテオミクス ・ メタボロミクス陳の実験室での研究は、米国国立科学財団 (0818051、1158000、1412547) からの補助金によってサポートされています。Wenwen 香港は中国公費によってサポートされます。博士 Qiuying パンをサポートするには、中国の奨学金委員会と国家自然科学基金、中国の (31570396)。
資料
| Name | Company | Catalog Number | Comments |
| Stainless Steel Surgical Scalpel | Feather | NC9999403 | |
| Scotch Tape (3M) | ULINE | S-9781 | |
| Petri Dish | Sigma-Aldrich | BR455701 | |
| Cellulase (Onozuka R-10) | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-3 | |
| Macerozyme R-10 | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-4 | |
| DM6000B Microscope | Leica Microsystems | ||
| Protease and Phosphatase Inhibitor Cocktails | Thermo Fisher Scientific | PI78443 | |
| Oak Ridge High-Speed PPCO Centrifuge Tubes | Thermo Fisher Scientific | 3119-0030 | |
| EZQ Protein Quantitation Kit | Thermo Fisher Scientific | R33200 | |
| Fluorescein Diacetate (FDA) | Thermo Fisher Scientific | F1303 | |
| Abscisic Acid | Sigma-Aldrich | A4906 | |
| Metro Mix 500 | BWI Companies | TX-500 | |
| Laemmli Sample Buffer | Bio-Rad | 161-0737 | |
| Bio-Safe Comassie (G-250) | Bio-Rad | 161-0786 | |
| Microcentrifuge Tube (2mL) | USA Scientific, Inc. | 1620-2700 | |
| ImageJ software | National Institute of Health | ||
| Tweezers | Sigma-Aldrich | F4017-1EA | |
| 12% Mini-PROTEAN TGX Precast Gel | Bio-Rad | 456-1043 | |
| Microscope slides | Fisherbrand | 12-550-A3 |
参考文献
- Acharya, B., Assmann, S. Hormone interactions in stomatal function. Plant Molecular Biology. 69 (4), 451-462 (2009).
- Schroeder, J. I., Allen, G. J., Hugouvieux, V., Kwak, J. M., Waner, D. Guard cell signal transduction. Annual Review of Plant Physiology and Plant Molecular Biology. 52, 627-658 (2001).
- Obulareddy, N., Panchal, S., Melotto, M. Guard Cell Purification and RNA Isolation Suitable for High-Throughput Transcriptional Analysis of Cell-Type Responses to Biotic Stresses. Molecular Plant-Microbe Interactions. 26 (8), 844-849 (2013).
- Pandey, S., Wang, X. Q., Coursol, S. A., Assmann, S. M. Preparation and applications of Arabidopsis thaliana guard cell protoplasts. New Phytologist. 153 (3), 517-526 (2002).
- Schroeder, J. I., Raschke, K., Neher, E. Voltage Dependence Of K+ Channels In Guard-Cell Protoplasts. Proceedings of the National Academy of Sciences of the United States of America. 84 (12), 4108-4112 (1987).
- Wu, F. H., et al. Tape-Arabidopsis Sandwich - a simpler Arabidopsis protoplast isolation method. Plant Methods. 5, 10(2009).
- Svozil, J., Gruissem, W., Baerenfaller, K. Proteasome targeting of proteins in Arabidopsis leaf mesophyll, epidermal and vascular tissues. Frontiers in Plant Science. 6, (2015).
- Schneider, C., Rasband, W., Eliceiri, K. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Agnew, B., Murray, D., Patton, W. A rapid solid-phase fluorescence-based protein assay for quantitation of protein electrophoresis samples containing detergents, chaotropes, dyes, and reducing agents. Electrophoresis. 25 (15), 2478-2485 (2004).
- He, F. Laemmli-SDS-PAGE. Bio-protocol. Bio101 (80), (2011).
- Thompson, A., et al. Tandem mass tags: A novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS (vol 75, pg 1895). Analytical Chemistry. 78 (12), 4235-4235 (2006).
- Wiese, S., Reidegeld, K. A., Meyer, H. E., Warscheid, B. Protein labeling by iTRAQ: A new tool for quantitative mass spectrometry in proteome research. Proteomics. 7 (3), 340-350 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved