Method Article
Spaltöffnungen Tape-Peel: Ein verbessertes Verfahren zur Wache Zelle Probenvorbereitung
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Methode des Vorbereitens angereicherten Stomata Schließzellen, die nützlich für physiologische und andere biologische Studien.
Zusammenfassung
Das Studium der Schließzellen ist wichtig, das Wissen um die spezifischen Beiträge dieser Zelle Art die Gesamtfunktion der Pflanzen. Allerdings ist es oft schwierig, zu isolieren und damit oft zu studieren, stellt eine Herausforderung dar.
Diese Studie legt eine Stomata Guard Zelle Bereicherung Methode. Das Protokoll nutzt Tesafilm um die Schließzellen isolieren und Proteine aus den Zellen zu extrahieren. Diese Methode verbessert die Integrität und den Ertrag der Guard Zelle während der Isolierung und bietet eine zuverlässige Probe für die Untersuchung der Signalisierung Zellprozesse und wie sie mit Stomata Bewegung Phänotypen korrelieren. Bei dieser Methode wurden die Blätter der Pflanze zwischen beiden Teilen der Band partitioniert und geschält auseinander um der abaxial Seite zu entfernen. Dieses Protokoll wurde an Arabidopsis Blattgewebe Schließzellen isolieren angewendet. Die Zellen wurden mit Fluorescein Diacetat (FDA) Lebensfähigkeit zu bestimmen und Abscisic Säure (ABA) einzuschätzen Spaltöffnungen Bewegung als Reaktion auf ABA behandelt. Dieses Protokoll ist zusammenfassend erweist sich als nützlich für die Vorbereitung angereicherten Stomata Schließzellen und Proteine zu isolieren. Die Qualität der Zellen und Proteine erhalten Sie hier aktivieren physiologische und andere biologische Studien.
Einleitung
Spaltöffnungen spielen eine wichtige Rolle in der allgemeinen Physiologie und Fitness Pflanzen. Diese kleine Pflanze bestimmte Strukturen von zwei spezialisierten epidermalen Zellen bekannt als Schließzellen gebildet werden und befinden sich meist reichlich auf der abaxial Oberfläche der Blätter. Spaltöffnungen sind notwendig für den Austausch der Gase zwischen der Anlage und der Atmosphäre sowie die Kontrolle der Wasserverlust durch Transpiration. Schließzellen regulieren Stomata Blende durch die Integration von verschiedenen externen (z.B., Licht, Feuchtigkeit, Erreger Kontakt, Kohlendioxid-Konzentration) und internen (zB., endogenen Hormonen) Reize1,2. In den letzten 20 Jahren ist dieser Zellentyp Modellsystem für Studium Zelle signalisieren Prozesse in Pflanzen geworden. Diese Zellen bilden einen kleinen Bruchteil der gesamten Zellen in ein Blatt; so muss um ihre einzigartige Mobilfunk zu untersuchen, biochemischen und molekularbiologischen Eigenschaften in eine einzelne Zelle Art und Weise, um sie von anderen Zelltypen Blatt zu isolieren. In der Vergangenheit haben Wache Zelle Studien häufig die Vorbereitung der Guard Zelle Protoplasten (GCP)3,4,5beteiligt. Dies in der Regel erfordert die Verwendung von großen Mengen an Zellwand entwürdigende Enzyme und oder mechanische Störungen über mischen und hat bewiesen, kostspielig und zeitaufwendig sein, dauert in der Regel viele Stunden zur Vorbereitung einer GCP-Probe, oft mit wenig Ertrag Zeiten. Noch wichtiger ist, weil Schließzellen als komplette Paare, Spaltöffnungen Blende Regeln handeln, die Verwendung von GCP als ein künstliches System zu studieren, Guard Zelle Signalisierung ersichtlich.
Hier entwickelten wir eine Methode um Spaltöffnungen vorzubereiten, in denen intakt Schließzellen sind bereichert und physiologische Reaktionen auf Reize zu erhalten. Diese Methode wurde eine Methode, die verwendet wurde, um Mesophyll Zelle Protoplasten6,7zu isolieren. In unserer Methode sind Spaltöffnungen vorbereitet mit klarem Tesafilm, zunächst die Mehrheit der Mesophyll Zellen trennen die adaxial Schicht des Blattes aus der abaxial Schicht mit dem Pflaster und der Schließzellen beigefügt. Dies geschieht durch Anbringung ein Stück Klebeband auf beiden Seiten des Blattes und schälen sie auseinander. Die Zellen aus dem abaxial Layer dürfen unter Licht in einem Spaltöffnungen-Eröffnung-Puffer zu erholen. Später werden die verbleibenden Zellen Pflaster entfernt mit einer kleinen Menge der Zellwand entwürdigende Enzyme, Guard-Zelle, die angereichert werden, auf dem Band zu hinterlassen.
In dieser einfachen Methode Stomata Schließzellen, die tragfähig und reaktionsfähig sind schnell und effizient werden vorbereitet, dauert weniger als eine Stunde angereicherten Stomata Schließzellen von 50 Schalen mit minimalen Kosten zu erhalten. Die Methode hier erlegt weniger Schäden an den Pflanzenzellen als bisherige Methoden dem Protoplasten zubereitet werden. Darüber hinaus Materialien von dieser Methode Ertrag wünschenswert Protein Mengen gesammelt. Vor allem, weil das Blatt nicht mischen unterliegt oder langwierige Verdauung Zeiten und die Schließzellen intakt sind, die Ergebnisse der Studien genauer werden darauf ein Guard natürliche Zellbiologie relevant sein. Mit dieser Methode können die Stomata Bewegungen mit Veränderungen auf molekularer Ebene in Echtzeit korreliert werden. Erkenntnisse aus Studien mit dieser Vorbereitung Methode wäre so wichtig für ein umfassenderes Verständnis der Guard Zelle Signalisierung.
Wir verwendeten die Pflanze Arabidopsis Thaliana als Vorbild; jedoch kann dieses Protokoll zur Bereicherung der Stomata Schließzellen in andere Pflanzenarten wie Brassica Napus mit kleinen Änderungen in der Verdauung Zeit angewendet werden. Als ein Proof of Concept haben wir bewiesen, dass Stomata Schließzellen, angereichert mit dieser Methode lebensfähig und reagieren auf Reize wie Fluorescein Diacetat (FDA) Assay und Studien unter Verwendung der Pflanzenhormon Abscisic Acid (ABA), bzw. zeigen. Darüber hinaus haben wir bewiesen, dass qualitativ hochwertige Proteine von diesen Schließzellen isoliert werden können. Hier beschreiben wir ein detailliertes Protokoll dieses Prozesses.
Protokoll
1. Anbau von Pflanzen
- Keimen Sie die Samen in Blumenerde Mischung. Wachsen Sie Pflanzen in einer Kammer Wachstum mit einer Lichtintensität von 140 µmol Photonen m−2 s −1 und eine Photoperiode von 8 h Licht bei 22 ° C und 16 h dunkel bei 18 ° C für 2 Wochen.
- Transplantation Sämlinge ähnlicher Größe individuell in 4" Durchmesser Töpfe mit den Boden und wachsen für weitere 3 Wochen unter den gleichen Bedingungen im Schritt 1.1 beschrieben.
Hinweis: Wasserpflanzen Sie mit Leitungswasser zweimal in der Woche um den Boden feucht zu halten.
2. Vorbereitung des angereicherten Spaltöffnungen
- Entfernen Sie die Blätter des 5 - Wochen alten A. Thaliana Pflanzen einzelne mit einem Skalpell.
- Legen Sie jedes Blatt auf zwei Stücke von klaren Tesafilm mit Einteiler der abaxial (unteren) Seite an und das andere Stück adaxial (oberen) Seite des Blattes an. Lassen Sie das Band auf dem Blatt für 5 s.
- Sanfte Peel auseinander die beiden Teile der Bänder mit dem Zeigefinger und dem Daumen an jeder Hand die abaxial Seite mit Pflaster und Schließzellen und die adaxial Seite mit Mesophyll Zellen zu trennen.
- Ort die Schalen von der abaxial Seite der Blätter in 60 mL der Stomata öffnen (50 mM KCl, 10 mM MES-KOH, angepasst auf pH 6.2 mit 1 M KOH) in 40 mm × 12 mm Größe Petri Puffer Speisen während sie erfasst werden.
- Wiederholen Sie die obigen Schritte, bis alle Probe Schalen gesammelt werden.
- Legen Sie die Petrischalen mit den Schalen in die Wachstums-Kammer unter leichten Bedingungen in Schritt 1.1. Lassen Sie die Schalen unter dem Licht für 2 h Stomata öffnen.
- Ort schält sich in einer 150 mm x 20 mm Petrischale mit 50 mL der Zellwand Verdauung Enzym Mischung (0,7 % Cellulase r-10, 0,025 % Macerozyme r-10, 0,1 % (w/V) Polyvinylpyrrolidon-40 und 0,25 % (w/V) Rinderserumalbumin in 55 % Basislösung (0,55 M Sorbit, 0,5 mM CaCl2, 0,5 mM MgCl2, 0,5 mM Ascorbinsäure, 10 µM KH2PO4, 5 mM 4-Morpholineethanesulfonic Säure (MES) bei pH 5,7 mit 1 M KOH eingestellt).
- Schütteln Sie die Schalen auf eine wechselseitige Shaker in einer Petrischale bei 50 u/min für 20 Minuten.
- Herausnehmen Sie Schalen mit einer Pinzette aus Enzymlösung, nach 20 min. die Schalen auf eine 150 x 20 mm Größe Petrischale mit 50 mL Wasser übertragen.
- Spülen mit einer transferpipette, Schalen für 15 s zweimal mit 10 mL Wasser, alle restlichen Enzymlösung zu entfernen.
- Benutzen Sie eine Pinzette, um Schalen in einer Petrischale 150 x 20 mm Größe mit 50 mL frische Stomata öffnen Puffer wie in Schritt 2.4 verwendet zu platzieren. Inkubation für 1 h bei Lichtverhältnissen erklärt in Schritt 1.1 erlauben die Stomata zu erholen.
3. Abscisic Säure (ABA) Behandlung und Spaltöffnungen Bewegung Assay
- In einer Petrischale 150 x 20 mm Größe. Inkubieren Sie die angereicherten Spaltöffnungen Schalen bei 30° C für 15 min in 50 mL des Puffers Stomata öffnen oder in 50 mL des Puffers Stomata öffnen mit einer Endkonzentration von 10 µM ABA für die angemessene Behandlungszeit.
- Ein Shaker bei 50 u/min für 5, 15 und 30 min Schalen aufsetzen. Nach jedem Zeitintervall eine Schale mit einer Pinzette zu entfernen und die bildgebenden Schritte in Schritt 3.3.
- Nehmen Sie Bilder von Spaltöffnungen vor ABA Behandlung und zu verschiedenen Zeitpunkten nach der ABA-Behandlung mit einem Lichtmikroskop.
- Nehmen Sie eine Schale und legen Sie es auf einen Glas-Objektträger.
- Legen Sie die Folie auf der Mikroskop-Bühne und stellen Sie die Bühne so ein, dass das Bild der Schale visualisiert werden kann.
- Passen Sie die feinen und natürlich Fokus auf das Mikroskop um ein klares Bild von den Schließzellen zu erhalten.
- Nehmen Sie mehrere Bilder von mehreren Spaltöffnungen bei 40 X Vergrößerung.
- Messen Sie 60 Stomata Öffnungen mit ImageJ-8.
- Berechnen Sie die Standardfehler und Bedeutung bei einem p-Wert < 0,05 der Stomata Blende 60 Messungen.
(4) Protein Extraktion und Trennung der SDS-Page
- Schleifen Sie die Schalen für 15 s in genug flüssigem Stickstoff um die Schalen mit einem gekühlten Mörser und Stößel zu decken.
- Pro 50 Schalen hinzufügen 3 mL Tris gesättigt Phenol (pH 8,8) und 3 mL Protein Extraktionspuffer (0,9 M Saccharose, 0,1 M Tris-HCl, 0,01 M EDTA, 0,4 % 2-Mercaptoethanol, 10 µL 1 mM Protease und Phosphatase-Inhibitor) mit einer Pipette vermischen und dann Schleifen die Schalen für 5 Addi nale Minuten unter einem Abzug.
- Den Extrakt mit einer Pipette zu übertragen und die Schalen mit einer Pinzette aus Metall zu einem Oakridge Zentrifugieren Rohr und agitieren auf einem Schüttler bei 50 u/min für 1 h bei 4 ° c
- Entfernen Sie die Schalen aus der Oakridge Zentrifugenröhrchen und Zentrifugieren Sie den Extrakt bei 5.000 x g für 10 min. Übertragen Sie dann die obere phenolische Phase auf eine neue saubere Mikro-Zentrifugenröhrchen mit einer Pipette.
- Niederschlag der Phenol extrahiert Proteine durch Zugabe von 5 Bänden der eiskalte 0,1 M Ammoniumacetat in 100 % Methanol. Vortex kurz und Inkubation über Nacht bei-20 ° C.
- Bei 20.000 x g bei 4 ° C für 20 min zentrifugieren, Dekantieren des Überstands durch langsam aus dem Schlauch Gießen und das Protein Pellet in das Rohr zu behalten.
- Das Protein Pellet zweimal mit 0,1 M Ammoniumacetat in Methanol, Waschen und dann zweimal mit 80 % Aceton und einmal mit 100 % kaltem Aceton.
Hinweis: Waschungen erfolgt durch Zugabe von 10 mL der angegebene Reagenz auf das Rohr des Proteins. Auf einem Schüttler bei 50 u/min für 5 min, gefolgt von Zentrifugation bei 15.000 x g bei 4 ° C für 10 min schütteln. Dann Gießen Sie das Reagenz aus der Tube behalten nur das Protein Pellet. - Das Pellet 1 mL kaltem Aceton 100 % hinzu und wieder aussetzen durch pipettieren langsam rauf und runter.
- Bei 20.000 x g bei 4 ° C für 5 min zentrifugieren dann Protein Federung per Pipette auf eine 2 mL Mikro-Zentrifugenröhrchen übertragen.
- Das Aceton durch Dekantieren es aus Rohr zu entfernen und das Pellet in Abzug für 10 min trocknen.
- Das Protein in einem Mikro-Zentrifugenröhrchen mit 200 µL Puffer Auflösung (8 M Harnstoff, 0,5 % SDS, 30 mM Tris-HCl bei pH 8,5) auflösen und Vortex für 30 min. Zentrifuge bei 20.000 x g bei 15 ° C für 20 min und Sammeln der Überstand in einen neuen Schlauch.
- Die Proteinkonzentration nach Protein Quantifizierung Protokoll9zu quantifizieren.
- Verwenden Sie Proteinproben für Protein Trennung durch Gelelektrophorese nach Protokoll10.
Ergebnisse
Ein repräsentatives Bild von Arabidopsis Schließzellen vor und nach der Verdauung des Mesophyll und Epidermiszellen in Abbildung 1dargestellt ist. Guard Zellviabilität vor und nach der Entfernung des Mesophyll und epidermalen Zellen kann mit der FDA um zu messen, enzymatische Aktivität und Integrität der Zellmembran (Abb. 1 b und 1D) beobachtet werden. Abbildung 2 veranschaulicht Stomata Bewegung von Arabidopsis in Reaktion auf die Behandlung von ABA. Stomata Blende nimmt mehr als 50 Prozent nach 30 Minuten Behandlung mit ABA. Abbildung 2A ist ein zeitlicher Verlauf der Spaltöffnungen Bewegung. Aufnahmen wurden zu verschiedenen Zeitpunkten mit einem Lichtmikroskop gemacht. Stomata Blende wurde mit ImageJ gemessen und die Ergebnisse wurden als des Durchschnitts von 60 bis 80 Blende Messungen ± Standardfehler. Ein repräsentatives Bild der Spaltöffnungen Blende zu jedem Zeitpunkt ist in Abbildung 2 bdargestellt. Proteindetektion, Trennung und relative Häufigkeit werden von SDS-PAGE (Abbildung 3) eingehalten. Vier biologischen Wiederholungen sind enthalten, um die Reproduzierbarkeit der Proteingewinnung aus dieser Methode zu betonen.
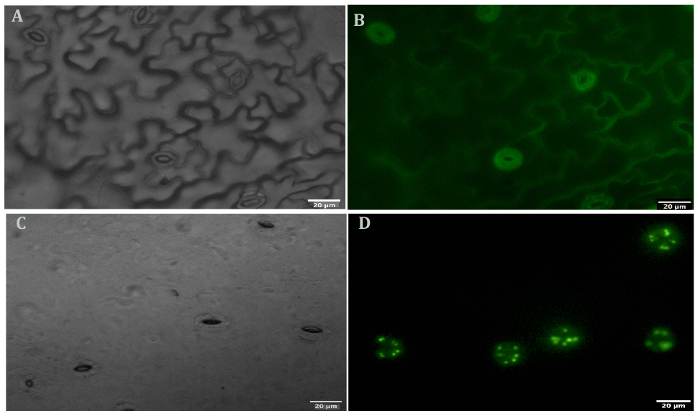
Abbildung 1 . Fluorescein Diacetat Lebensfähigkeit Färbung der Schließzellen vor und nach der Entfernung des Mesophyll und Epidermiszellen. (A) Schalen (unverdaut) unter Hellfeld. (B) Schalen (unverdaut) und gefärbt mit FDA. (C) Schalen (verdaut) unter hell Feld (D) Schalen (verdaut) und gefärbt mit FDA. Alle Bilder wurden bei 40 X Vergrößerung. Bitte klicken Sie hier für eine größere Version dieser Figur.
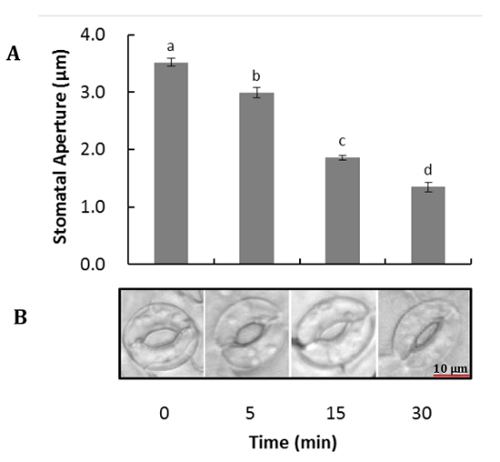
Abbildung 2 . Stomata Bewegung von Arabidopsis als Reaktion auf ABA. Epidermis wurden geschält aus voll entfalteten Blättern, mit epidermalen Zellen entfernt, und vorher unter Licht mit der Eröffnung Puffer (50 mM KCl, 10 mM MES-KOH pH 6.2) für 2 h inkubiert und dann inkubiert, mit Wasser oder mit 10 µM ABA Behandlung für 5, 10 und 30 min. (A) Zeitlicher Verlauf der Stomata Bewegung. (B) repräsentatives Bild der Spaltöffnungen bei jedes Mal darauf. Die Daten werden als Mittel ± SE von drei unabhängigen Experimenten gezeigt. Varianzanalyse (ANOVA) war vorgeformt, um durchschnittliche Unterschiede zu analysieren. Verschiedene Buchstaben zeigen deutlich verschiedene Mittelwerte bei p < 0,05. Bitte klicken Sie hier für eine größere Version dieser Figur.
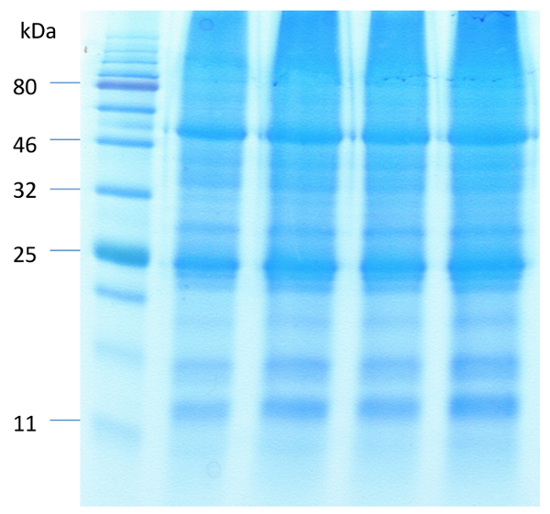
Abbildung 3 . SDS-PAGE Trennung von Proteinen angereicherten Schließzellen mit Phenol-basierte Protein Extraktionsmethode. Gleiche Mengen (40 µg) von Proteinen mit 12,5 % Polyacrylamid-Gel aufgelöst wurden und mit CBB visualisiert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Schließzellen sind ein Modellsystem zur Untersuchung von Signal Transduction Mechanismen in Pflanzen und es ist wichtig, um sicherzustellen, dass die Vorbereitung der Proben, die in der Studie verwendeten die am besten geeignete biologische Fragen zu beantworten. Trotz des zunehmenden Interesses an Schließzellen innerhalb der Pflanze Forschungsgemeinschaft, gibt es keine universelle Methode zum Stomata Schließzellen vorbereiten, die sowohl die Physiologie der Stomata Bewegung erlauben würde sowie der molekularen Veränderungen in einem untersucht werden System. Die Herausforderung, sie zu isolieren werden zum großen Teil auf ihre geringe Größe, geringe Fülle und einzigartige Struktur, die es mehr oder weniger schwierig zu entfernen aus ganzen Blättern zurückzuführen.
Dieses Protokoll enthält eine Methode zur Überwindung dieser Hindernisse, isolieren mit einer entwickelten Band-Peel-Methode. In diesem Protokoll vorgestellte Methode bietet eine Möglichkeit für die Isolierung intakt Stomata Schließzellen, die physiologisch reagieren auf Reize bleiben. Die Vorbereitung dieser Proben macht es möglich für die Gewinnung von Guard Zelle Proteine, die als Ausgangsmaterial für eingehende Proteomic Studien, wie z.B. Verwendung von Tandem Mass Tags (TMT) und oder Isobare Tag für quantitative Proteomik-Studien dienen könnte relative und absolute Quantifizierung (iTRAQ)11,12. Darüber hinaus kann diese Methode leicht modifiziert und optimiert, um die Untersuchung von kleinen Molekülen, wie Metaboliten in die Schließzellen gefunden zu ermöglichen. Das Experiment hier das Phytohormon ABA als ein Auslöser für die Stomata Bewegung in Arabidopsis, genutzt, jedoch andere Behandlungen entsprechend benutzt werden können. Diese Methode kann auch an anderen Pflanzenarten.
Aufgrund der Versuchsplanung und die Art der Materialien, die in diesem Protokoll verwendeten gibt es einige wichtige Schritte. Während der abaxial und adaxial Seite des Blattes (Schritt 2.2) auseinander zu schälen, ist es wichtig, dass es ohne zu zögern und durch sanften Druck auf beide Teile des Bandes Anwendung, so dass die abaxial Schicht gleichmäßig ist, nachdem sie entfernt wurde. Es ist wichtig, individuelle Peeling Technik und Verdauung Zeit für die Pflanzenarten in der Studie zu optimieren, da sie unterschiedliche optimale Verdauung Zeiten haben. Bei der Enzym-Verdauung (Schritte 2,8-2.10) sollten die Schalen genau beobachtet und überprüft alle 3-5 Minuten. Dies ist wichtig, da leichte Unterschiede in den Schichten der die Schalen in Zeiten schneller oder langsamer Verdauung führt. Wenn Sie die Schalen mit ABA oder andere Reize (Schritt 3.1) zu behandeln, sollte Schalen gleichmäßig verteilt werden schwebend und sanft schütteln, so dass sie nicht überlappen. Schalen, die zusammen stecken bleiben oder überlappen können zu abweichenden Ergebnissen aufgrund fehlender Kontakt mit Lösung führen.
Offenlegungen
Keine Interessenkonflikte erklärt.
Danksagungen
Wir danken Daniel Chen aus der Digital Video Produktion Team von Buchholz High School für die Unterstützung bei der Videobearbeitung. Diese Forschung auf Stomata Schließzellen, Proteomik und Metabolomik in der Chen-Labor wurde durch Zuschüsse aus den US National Science Foundation (0818051, 1158000 und 1412547) unterstützt. Wenwen Kong wird von der China Scholarship Council unterstützt. Dr. Qiuying Pang wird von der China Scholarship Council und der National Natural Science Foundation of China (31570396) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Stainless Steel Surgical Scalpel | Feather | NC9999403 | |
| Scotch Tape (3M) | ULINE | S-9781 | |
| Petri Dish | Sigma-Aldrich | BR455701 | |
| Cellulase (Onozuka R-10) | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-3 | |
| Macerozyme R-10 | Yakult Pharmaceutical Industry Co., Ltd. | 21560003-4 | |
| DM6000B Microscope | Leica Microsystems | ||
| Protease and Phosphatase Inhibitor Cocktails | Thermo Fisher Scientific | PI78443 | |
| Oak Ridge High-Speed PPCO Centrifuge Tubes | Thermo Fisher Scientific | 3119-0030 | |
| EZQ Protein Quantitation Kit | Thermo Fisher Scientific | R33200 | |
| Fluorescein Diacetate (FDA) | Thermo Fisher Scientific | F1303 | |
| Abscisic Acid | Sigma-Aldrich | A4906 | |
| Metro Mix 500 | BWI Companies | TX-500 | |
| Laemmli Sample Buffer | Bio-Rad | 161-0737 | |
| Bio-Safe Comassie (G-250) | Bio-Rad | 161-0786 | |
| Microcentrifuge Tube (2mL) | USA Scientific, Inc. | 1620-2700 | |
| ImageJ software | National Institute of Health | ||
| Tweezers | Sigma-Aldrich | F4017-1EA | |
| 12% Mini-PROTEAN TGX Precast Gel | Bio-Rad | 456-1043 | |
| Microscope slides | Fisherbrand | 12-550-A3 |
Referenzen
- Acharya, B., Assmann, S. Hormone interactions in stomatal function. Plant Molecular Biology. 69 (4), 451-462 (2009).
- Schroeder, J. I., Allen, G. J., Hugouvieux, V., Kwak, J. M., Waner, D. Guard cell signal transduction. Annual Review of Plant Physiology and Plant Molecular Biology. 52, 627-658 (2001).
- Obulareddy, N., Panchal, S., Melotto, M. Guard Cell Purification and RNA Isolation Suitable for High-Throughput Transcriptional Analysis of Cell-Type Responses to Biotic Stresses. Molecular Plant-Microbe Interactions. 26 (8), 844-849 (2013).
- Pandey, S., Wang, X. Q., Coursol, S. A., Assmann, S. M. Preparation and applications of Arabidopsis thaliana guard cell protoplasts. New Phytologist. 153 (3), 517-526 (2002).
- Schroeder, J. I., Raschke, K., Neher, E. Voltage Dependence Of K+ Channels In Guard-Cell Protoplasts. Proceedings of the National Academy of Sciences of the United States of America. 84 (12), 4108-4112 (1987).
- Wu, F. H., et al. Tape-Arabidopsis Sandwich - a simpler Arabidopsis protoplast isolation method. Plant Methods. 5, 10(2009).
- Svozil, J., Gruissem, W., Baerenfaller, K. Proteasome targeting of proteins in Arabidopsis leaf mesophyll, epidermal and vascular tissues. Frontiers in Plant Science. 6, (2015).
- Schneider, C., Rasband, W., Eliceiri, K. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Agnew, B., Murray, D., Patton, W. A rapid solid-phase fluorescence-based protein assay for quantitation of protein electrophoresis samples containing detergents, chaotropes, dyes, and reducing agents. Electrophoresis. 25 (15), 2478-2485 (2004).
- He, F. Laemmli-SDS-PAGE. Bio-protocol. Bio101 (80), (2011).
- Thompson, A., et al. Tandem mass tags: A novel quantification strategy for comparative analysis of complex protein mixtures by MS/MS (vol 75, pg 1895). Analytical Chemistry. 78 (12), 4235-4235 (2006).
- Wiese, S., Reidegeld, K. A., Meyer, H. E., Warscheid, B. Protein labeling by iTRAQ: A new tool for quantitative mass spectrometry in proteome research. Proteomics. 7 (3), 340-350 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten