Method Article
Microtissues 3D para terapia regenerativa injetável e triagem de drogas de alto rendimento
Neste Artigo
Resumo
Este protocolo descreve a fabricação de microcryogels elástica 3D se integrando microfabrication com tecnologia cryogelation. Durante o carregamento com células, microtissues 3D são gerados, que pode ser facilmente injetado em vivo para facilitar a terapia regenerativa ou montadas em matrizes para em vitro triagem de drogas de alto rendimento.
Resumo
Para atualizar a cultura celular 2D tradicional para cultura de células 3D, integramos microfabrication com tecnologia cryogelation para produzir se microescala cryogels (microcryogels), que pode ser carregado com uma variedade de tipos de células para formar o microtissues 3D. Aqui, apresentamos o protocolo para fabricar microtissues 3D versátil e suas aplicações em terapia regenerativa e de despistagem de drogas. Tamanho e forma-controláveis microcryogels podem ser fabricados em um chip de matriz, que pode ser colhido fora do chip como transportadoras carregados de células individuais para terapia regenerativa injetável ou ainda ser montados em-microplaqueta em 3D microtissue matrizes para alta produtividade triagem de drogas. Devido à natureza elástica elevada destes cryogels de microescala, os microtissues 3D exibem grande Injectabilidade para terapia celular minimamente invasiva, protegendo as células de força de cisalhamento mecânico durante a injeção. Isso garante a sobrevivência celular melhorada e efeito terapêutico no modelo de isquemia do membro do rato. Enquanto isso, montagem de matrizes de microtissue 3D em um formato padrão de 384-multi-bem facilita o uso do comum instalações laboratoriais e equipamentos, permitindo que sobre esta plataforma de cultura de células 3D versátil de despistagem de drogas de alto rendimento.
Introdução
Cultura celular tradicional superfícies achatadas bidimensional (2D), como um prato de cultura ou placas multi bem, dificilmente pode eliciar comportamentos de celular perto de seus Estados nativos. Recapitulação exata do microambiente celular nativo, que são compostos por vários tipos de células, matrizes extracelulares e bioativos fatores solúveis em tridimensional (3D) arquiteturas1,2,3 ,4, é essencial para construir biomimicking tecidos em vitro para aplicações na medicina regenerativa, engenharia de tecidos, biologia fundamental pesquisa e droga descoberta5,6,7 ,8,9.
Em vez de cultura de células 2D, cultura de células 3D é amplamente utilizada para avançar biomimetic microarquitetura e características funcionais das células cultivadas em vitro. É um método de cultura de células 3D popular células agregadas em esferoides7,8,9,10. Esferoides celulares podem ser injetados para tecidos feridos com maior retenção de celular e sobrevivência em comparação com a injeção de células dispersas. No entanto, não-uniforme esferoide tamanhos e inevitável lesão mecânica imposta sobre as células pela força de cisalhamento do fluido durante a injeção levam a pobre célula efeitos terapêuticos11,12,13. Da mesma forma, a não-uniformidade inerente durante a agregação de esferoides fez sua tradução para 3D baseada em célula elevado-throughput de despistagem de drogas desafiador10.
Outro método para cultura de células 3D é alcançado com a ajuda de biomateriais, que encapsula normalmente células em hidrogel aquosa ou andaimes porosas. Permite maior flexibilidade na construção de arquiteturas 3D. Para a terapia, células encapsuladas em andaimes em massa geralmente são entregues ao corpo animal através da implantação cirúrgica, que é invasivo e traumático, portanto, restringindo sua tradução ampla para o leito. Por outro lado, aquosa hidrogel permitem terapia minimamente invasiva através da injeção de células suspendidas em solução de precursor de hidrogel em corpos de animais, permitindo em situ gelificação através do thermo-, reticulação química ou enzimática11. No entanto, como as células são entregues enquanto os precursores de hidrogel ainda estão em um estado aquoso, eles estão também expostos a cisalhamento mecânico durante a injeção. Não só isso, reticulação química ou enzimática durante em situ gelificação de hidrogel também pode impor danos às células dentro. Para triagem de drogas, culturas de células de biomaterial assistida enfrentam problemas com taxa de transferência, controlabilidade e uniformidade. Usando o hidrogel, células são normalmente envolvidos durante a gelificação, pelo qual o processo pode afetar a função e viabilidade celular. Gelificação durante a semeadura da célula também dificulta o uso pela maioria dos equipamentos de alto rendimento, desde que o hidrogel pode precisar de ser mantido no gelo para evitar gelificação antes célula semeadura, e o hidrogel pode jam aplicadora dicas, que são geralmente muito finas, para garantir a precisão para seleção da elevado-produção. Pré-formado andaimes potencialmente poderiam separar os procedimentos de fabricação do biomaterial de cultura de células, porém a maioria produtos baseados em andaime estão disponíveis como produtos a granel com relativamente baixa taxa de transferência14.
Para superar algumas das deficiências dos métodos de cultura 3D atual, nós desenvolvemos uma tecnologia integrada microfabrication-cryogelation para fabricar uma prateleira e user-friendly microcryogel matriz microplaqueta15. Neste protocolo, a gelatina é selecionada para exemplificar a técnica de fabricação de microcryogel como é biocompatível, biodegradável, cost-effective, e nenhuma modificação adicional é necessária para a fixação da célula. Outros polímeros de fontes naturais ou sintéticas também podem ser usados para a fabricação, dependendo da aplicação. Através desta tecnologia, nós podemos fabricar microcryogels miniaturizados e altamente elástica com tamanho controlável, forma e layout. Quando carregado com uma variedade de tipos de células, microtissues 3D poderia ser formado para várias aplicações. Estas características únicas permitem Injectabilidade desejada, protecção celular e retenção local-dirigido após injeção na vivo para efeitos terapêuticos reforçadas. Não só isso, o microcryogels poderia ser tratados posteriormente para formar matrizes de microtissue 3D que são compatíveis com equipamentos comuns de laboratório e instrumentos para realizar a cultura de células de alto rendimento para triagem de drogas versátil e outros ensaios celulares. Neste documento, serão detalhamos o processo de fabricação de microcryogels e seu tratamento pós como individuais microtissues 3D ou 3D microtissue matrizes para duas importantes aplicações, terapia celular e despistagem de drogas, respectivamente10,15 .
Protocolo
as experiências com animais seguiram rigoroso protocolo aprovado pelo Comitê de ética Animal no centro de análise biomédica, Universidade de Tsinghua. Sob aprovação do Comitê de ética, o tecido adiposo humano foi obtido do departamento de cirurgia plástica de Peking Union Hospital com consentimento informado dos pacientes.
1. fabricação de 3D Microcryogels
- Design e fabricação de chips de matriz microstencil
- uso um software comercial para matrizes de desenho das geometrias específicas, tais como círculos, elipses, triângulos ou trevos 14, dependendo do aplicativo subsequente.
Nota: Consulte a secção 2 do protocolo para a medicina regenerativa e secção 3 do protocolo para a seleção de drogas para detalhes do projeto. - Importar o desenho para o software que acompanha a máquina de gravura do laser de gravura do laser. Usando as configurações do laser de acordo com as recomendações de fábrica para a máquina de gravura do laser, laser-grava o desenho importado para poli (methymethacrylate) (PMMA) folhas.
- Lavar as fichas de matriz microstencil com água desionizada para limpar os restos de gravura do laser. Seca a matriz microstencil fichas em 60 ° C. loja em um saco fechado à temperatura ambiente para meses.
- uso um software comercial para matrizes de desenho das geometrias específicas, tais como círculos, elipses, triângulos ou trevos 14, dependendo do aplicativo subsequente.
- Fabricação de chips de matriz microcryogel
- microstencil coloque 4 fichas sobre o tabuleiro de amostra de matriz e inserir o plasma líquido de limpeza. Feche a porta da lavadora e ligue a bomba de vácuo por 2 min e, em seguida, ligue a potência máxima de RF (18 W) para tratar as fichas de matriz microstencil no plasma líquido de limpeza para 3 min à temperatura ambiente para aumentar a Hidrofilia.
- Adicionar gelatina de 0,06 g de 1 mL de água desionizada para formar solução 6% (wt/vol) gelatina precursor (o suficiente para fazer 5 fichas). Quente a 60 ° C em banho-maria para dissolver adequadamente. Incubar no gelo por 5 min.
- Adicionar 3 µ l de solução gelatina precursor para uma concentração final de 0,3% de glutaraldeído. Homogeneiza.
- Solução de precursor Pipetar 200 µ l com glutaraldeído para a superfície superior do chip matriz microstencil.
Nota: 200 µ l é suficiente para um chip de 75 mm × 25 mm independentemente do projeto. Aumentar a quantidade proporcionalmente quando a área de superfície do chip é aumentada. - Manualmente distribuir a solução uniformemente sobre o chip por raspagem de volta e adiante com uma vareta de vidro curvada 2 a 3 vezes.
Nota: Cada micropoço no chip microstencil pode ser preenchido com solução de precursor, devido à sua natureza hidrofílica após tratamento plasma. - Imediatamente, coloque o chip de matriz precursor-solução-preenchido em um congelador-20 ° C durante 16 h para cryogelation.
- Ajustar o liofilizador de-40 ° C durante 30 min. Coloque os chips de matriz após cryogelation no Liofilizador e lyophilize as fichas de matriz para 2h no vácuo.
Nota: Microcryogels de gelatina com macroporos interligados formam-se porque o gelo formado durante cryogelation sublimes no liofilizador. - Proceder à seção 2 para tratamento de isquemia crítica de membro (CLI) e seção 3 para triagem de drogas de alto rendimento.
2. Colheita de Microcryogels individuais de forma injetável 3D Microtissues para tratamento de CLI
- microcryogels individual de colheita
- Design matrizes (75 mm × 25 mm) de 600 círculos, cada um com 400 µm de diâmetro, em software comercial para construção de microtissue 3D injetável. Usar o PMMA de 300 µm de espessura para fabricação do chip de matriz microstencil, conforme detalhado na secção 1.1.
- Fabricar chips de matriz microcryogel como no ponto 1.2.
- Fabricar uma matriz de pinos do ejetor de PDMS com o mesmo design como no passo 2.1.1 por litografia macia padrão 16 , 17.
- Sobrepor o chip de matriz microcryogel em cima a matriz de pinos do ejetor de PDMS, alinhando cada microcryogel com um pino ejetor no array. Pressione o chip de matriz microcryogel em direção a matriz de pino ejetor para empurrar o microcryogels fora aos micropoços com os pinos salientes na matriz de pino ejetor PDMS a colheita individual microcryogels.
- Colher de microcryogel em água e coletá-los com o auxílio de filtros de célula. Usar um filtro para recolher microcryogels de um único chip (ou seja, 600 microcryogels).
- Microcryogels de lavagem com 0,1 M NaBH 4 no gelo por 20 min saciar qualquer resíduo de aldeído uncross vinculado. Use 5 mL de 0.1 M NaBH 4 pela microplaqueta. Descartar NaBH 4 e lavar com 5 mL de água desionizada durante 3 a 5 vezes, 15 minutos cada vez.
- Descartar a água do filtro célula e se microcryogels em um cluster por filtro de célula, coloque um cluster em um prato de Petri 35mm usando uma pinça curvada. Adicione 50-70 µ l de água deionizada para cada cluster de água e cobrir a tampa da caixa de Petri. Bata levemente a placa de Petri sobre a mesa para igualar todos os microcryogels, para que não microcryogels estão deitando em cima de outra microcryogel para formar uma monocamada de microcryogels na superfície da caixa de Petri.
- Congelar a microcryogels colhidos em-20 ° C por 4 a 16 h antes de liofilização-los por 2 h (consulte a etapa 1.2.7). Loja microcryogels em um vácuo à temperatura ambiente até ulterior utilização.
- Caracterização de microcryogels
- avaliar os poros do microcryogels por digitalização de imagem de microscopia eletrônica de varredura (MEV).
- Imobilizar o microcryogels colhidos e liofilizada em um porta-amostras por fita adesiva de dupla-lado e casaco com ouro com um sputter coater para 90 s, antes de imagem por SEM 11. Avaliar e analisar a distribuição dos diâmetros dos poros no microcryogel de sete diferentes imagens SEM usando software de análise de imagem.
- Pesa a um cluster de 600 microcryogels liofilizados em um prato de Petri-35mm para o peso da gelatina secas microcryogels (GMs). Adicione 60 µ l de água deionizada água para o cluster de microcryogels liofilizado e esperar por 30 s para microcryogels inteiramente absorver água e inchar. Pese o microcryogels inchado.
- Determinar o equilíbrio relação inchaço e porosidade de microcryogels, como a relação do peso de inchadas microcryogels de microcryogels de gelatina secas e a relação do peso da água realizada em microcryogels ao de microcryogels hidratado, respectivamente 13.
- Injectabilidade medida de microcryogels usando uma bomba de seringa programável integrada com uma força digital calibre 14.
- Mancha 600 peças de microcryogels por Trypan azul e suspender em 600 µ l 15% gelatina solução para obter distribuição homogênea. Suspensão de microcryogel 1 mL na seringa de 1 mL de carga. Injetar a mistura através de uma agulha de calibre 27 anexada para a seringa de 1 mL, utilizando uma bomba de seringa programável em taxa de fluxo de 1 mL/min.
- Injeção de monitor em tempo real força pela força digital medidor de teste e traçar a curva de força-tempo. Após a injeção, observar a integridade do microcryogels sob um microscópio.
Nota: GMs suspendidos em 15% (wt/vol) solução de gelatina podem ser suavemente injetados e manteve-se intacta após a injeção.
- Caracterizam a degradabilidade de microcryogels.
- Primeiro, medir o peso de um cluster de 600 microcryogels liofilizados em um prato de Petri 35mm como peso seco. Em seguida, mergulhe 600 microcryogels liofilizados em 2 mL 0,025% (vol/vol) tripsina/EDTA. Microcryogels
- coleta da solução usando um coador de célula em pontos de tempo diferente (i.e., 10, 20, 30, 40, 50, 60 e 70 min). Pavio fora solução em excesso com um lenço de papel. Medir o peso de microcryogels em pontos de tempo diferentes e calcular o grau de degradação, como a relação do peso de microcryogel em um certo ponto do tempo ao de microcryogel no tempo zero.
- avaliar os poros do microcryogels por digitalização de imagem de microscopia eletrônica de varredura (MEV).
- Autoloading de células em microcryogels a forma 3D microtissues
- microcryogels da etapa 2.1.8 por sistema de esterilização de óxido de etileno com exposição de gás de 12 h, seguida por 12 h desgaseificação sob vac de esterilizarUum.
- Escolha humanas adiposo-derivado do estroma células mesenquimais (hMSCs) para o tratamento de membro isquêmico posterior de rato. Células isoladas seguindo os procedimentos como anteriormente relataram 18.
- Cultura hMSCs no crescimento médio contendo 2% de soro fetal bovino (FBS) ng/mL 10 fator de crescimento epidérmico (EGF), 10 ng/mL fator de crescimento derivado de plaquetas bb (PDGF-bb), 1 X selênio de transferrina de insulina (ITS), 10 -8 M dexametasona, 10 -4 M ácido ascórbico 2-fosfato, 100 U/mL penicilina e estreptomicina 100 de µ g/mL em DMEM/F12. Passagem das células para a relação de 1:3 Quando confluentes. Usar células de passagem de 3 a 5 nos experimentos seguintes.
- Colher hMSCs com tripsina e quantificar o número de células utilizando uma câmara de contagem de Fuchs-Rosenthal e ressuspender a uma densidade de 8 x 10 6 células/mL em meio de crescimento hMSCs.
- Suspensão de hMSCs pipeta 60 µ l para a monocamada de 600 microcryogels com diâmetro de 400 µm em um prato de 35 mm da seção 2.1. As células são absorvidas automaticamente as microestruturas porosas do microcryogels.
- Manutenção em uma câmara umidificada e incubar a 37 ° C por 2 h permitir que as células anexar. Após 2 h de incubação, adicione 2 mL de meio de cultura. Altere o meio em 2 dias. Cultura microcryogels hMSCs-carregado por 2 dias formar o 3D microtissues.
- Depois de 2 dias de cultivo, Pipetar 100 microcryogels hMSCs-carregado por alvéolo em uma placa de 96 poços, adicione 120 µ l de solução de trabalho de resazurina preparada de acordo com o fabricante ' instrução s em cada poço. Incubar durante 2 h a 37 ° C.
- Detectar fluorescência de resazurina metabolizada pelas células viáveis em um leitor de microplacas com um comprimento de onda de luz da excitação de 560 nm e emissão de luz de comprimento de onda de 590 nm. Estabelecer uma curva padrão de número de celular vs fluorescência usando hMSCs para interpolar o número do celular da intensidade de fluorescência para futura experiência de acordo com o protocolo do kit 13.
- Avaliar o número de hMSCs em microcryogels do dia 0 ao dia 4 usando resazurina como descrito no passo 2.3.7 do dia 0 ao dia 4.
- Mancha células em microcryogels com diluição de 1: 500 de calceína AM e diluição de 1: 250 de iodeto de Propidium (conhecido como coloração viva/morta) na salina tamponada fosfato (PBS) e observar sob o microscópio de fluorescência ou microscópio de fluorescência confocal.
- Injeção de microtissues 3D na vivo para tratamento da CLI no modelo do rato
- estabelecer isquemia crítica de membro posterior de camundongos BALB/c femininos como relatado 11 , 19 para determinar o efeito terapêutico da terapia 3D baseada em microtissue.
- Transferir o microtissues da etapa 2.3.6 usando uma pipeta de 5 mL em um coador de célula e filtrar fora do meio de cultura.
- Resuspenda o microtissues 3D hMSCs-carregado em solução de gelatina de 15%, com uma densidade de 100 microcryogels por solução de 100 µ l.
- Antes da cirurgia, esterilizar instrumentos cirúrgicos por autoclave e realizar uma cirurgia em uma sala de cirurgia de animais em uma central de facilidade de Animal.
- Posicione o mouse dentro da câmara de indução de anestesia contendo 1-3% de isoflurano em 100% de oxigênio em uma taxa de fluxo de 1 L/min. eritromicina aplicar sobre os olhos do rato para impedir a secagem. Através de uma incisão na pele de 1 cm de comprimento, ligate a artéria femoral e seus ramos com suturas de seda de 5-10 e impostos especiais de consumo 19. Injeção de
- Inject indocianina verde (ICG) (0,1 mL de 100 µ g/mL) na veia da cauda para monitorar o fluxo de sangue. Realizar imagens de fluorescência ICG usando uma sistema de imagens de fluorescência (aqui, sistema caseiro) na reflectância geometria 11.
- Por via intramuscular, injetar microtissues em três locais do músculo grácil em volta da incisão de artéria utilizando uma seringa de 1 mL com uma agulha de calibre 23.
- Após a cirurgia, aquecer o mouse com uma almofada aquecida na gaiola recuperação. Injectar por via subcutânea meloxicam para aliviar a dor e monitorar continuamente até acordado.
- Depois de 28 dias, monitorar a eficácia terapêutica do membro 3D microtissue-tratada por fluorescência de imagem 11.
Nota: Injectar por via subcutânea meloxicam para aliviar a dor quando o mouse mostrou amputação espontânea. - Euthanize ratos com dióxido de carbono após a conclusão dos experimentos.
Nota: Aqui, eutanásia com dióxido de carbono foi realizada de acordo com rigoroso protocolo aprovado pelo Comitê de ética Animal no centro de análise biomédica, Universidade de Tsinghua.
3. Montagem de Microtissue matriz Chip para triagem de drogas de alta produtividade
- Assembleia da microcryogel matriz para cultura de células no chip
- Modificar o design na seção 1.1, de acordo com as dimensões da placa multi bem convencional, ou seja, para o formato de 384-multi-bem, desenha uma matriz de 16 × 24 poços (linha por coluna), cada um espaçamento de 2 mm de diâmetro e 4,5 mm centro--.
- Laser grava em uma folha de PMMA grossa 500 µm, conforme descrito na seção 1.1.
- Fabricação microcryogels, conforme descrito na seção 1.2 usando de que o chip de matriz 384-multi-assim obtido passo 3.1.2. Essa matriz contendo microcryogel é designado como o chip de matriz microcryogel.
- Lavar o chip de matriz microcryogel com 50 mL 0,1 M NaBH 4 saciar qualquer aldeído residual uncross ligados, repetidamente Enxagúe com 50 mL de água desionizada para h 2 3 vezes, cada hora.
- Descartar a água, congelar o chip de matriz microcryogel a-20 ° C para 4 a 16 h antes de liofilização conforme item 1.2.7.
- Projeto de matriz de modificar o 384-multi-bem na etapa 3.1.1 para conter 16 × 24 poços, cada um espaçamento de 3 mm de diâmetro e 4,5 mm centro--.
- Remover um lado do apoio de uma folha de ultra-fino (10 µm) biocompatível-fita dupla face adesiva e colá-lo ao lado de um pedaço de folha de PMMA-3 milímetros de espessura. Laser grava o design da etapa 3.1.4 para esta folha PMMA de 3-mm de espessura de acordo com a seção 1.1. Esta matriz é designada como a matriz de reservatório.
- Alinhar a matriz microcryogel chip com o chip de matriz de reservatório e aderir juntos firmemente para montar o chip de matriz 3D microcryogel para cultura de células no chip. Esterilizar por radiação ultravioleta para 1 h.
- Matriz de armazenamento de microcryogel 3D chips no vácuo à temperatura ambiente para novas experiências.
- Droga de triagem em matrizes 3D microtissue
- encher uma caixa molhada com 25 mL de água desionizada estéril para servir como uma câmara de umidade para cultura de células. Pré-aqueça em um 5% umidificado incubadora de CO 2 a 37 ° C.
- Colheita de células de câncer de pulmão não-pequenas células (NCI-H460) e células de carcinoma hepatocelular (HepG2) das placas de cultura de tecidos de acordo com o protocolo padrão e ressuspender em meios de cultura para uma densidade final de 1,0 x 10 6 células/mL. Homogeneiza.
Nota: RPM1640 com 10% FBS, 100 U/mL penicilina e estreptomicina 100 µ g/mL é utilizada para ICN-H460. Use DMEM com 10% FBS, 100 U/mL penicilina e estreptomicina 100 µ g/mL para HepG2. - Remova a câmara de humidade da incubadora. Use uma pinça para cuidadosamente lugar 3D montada microcryogel matriz chip da etapa 3.1.9 na câmara de umidade. Tome cuidado para não molhar o microcryogels com água na câmara de.
- Misturar a suspensão de células completamente, então alíquota µ l 3 da suspensão de células diretamente sobre o microcryogel em cada poço.
Nota: A ponta da pipeta deve tocar levemente a superfície da microcryogel antes de expulsar a suspensão de células. As células são carregados automaticamente para o microcryogel por absorção. Não semear células nas áreas periféricas.
Adicionar 10 μL de mídia para cada poço, depois que as células são semeadas em microcryogel com pipeta multicanal, tais como um manipulador de líquido 96-canal de - . Médio também é adicionado ao periféricos poços.
Nota: Uso RPM1640 meios de comunicação social com 10% FBS, 100 U/mL penicilina e 100 µ g/mL streptomycin de células H460. Use mídia DMEM com 10% FBS, 100 U/mL penicilina e estreptomicina 100 µ g/mL para as células de HepaG2. - Cultura da matriz celular-carregado microcryogel chip na câmara de umidade por 24 h em um 5% umidificado incubadora de CO 2 a 37 ° C, a matriz de forma 3D microtissue.
- Dissolver doxorrubicina e IMMLG-8439 9 em dimetilsulfóxido (DMSO) para formar uma solução stock de 10 mM. Diluir a drogas com meio de cultura para formar um gradiente de concentração de 10 vezes a diluição de 2 nM a 200 µM.
- Adicionar 10 µ l de soluções da droga em cada poço. Use 0,1% DMSO (diluído em meio) como o controle. Incubar a matriz de microtissue 3D carregado de drogas em um 5% umidificado incubadora de CO 2 a 37 ° C por 24 h.
- Adicionar 4 µ l de solução-mãe resazurina para cada poço. Incubar a 37 ° C por 2 h. lugar o 3D microtissue a matriz o leitor de microplacas e detectar fluorescência de resazurina metabolizada pelas células viáveis em um comprimento de onda de luz da excitação de 560 nm e emissão de luz de comprimento de onda de 590 nm.
- Subtrair o sinal de linha de base resazurina de todos os poços antes ainda mais o processamento de dados. Calcular a fração de viabilidade celular de cada poço dividindo seu sinal de fluorescência pelo sinal de fluorescência média dos poços controle.
- Traçar a curva de dose-resposta no software de plotagem com a fração de viabilidade celular como o eixo y e o logaritmo de base 10 da concentração de fármaco como o eixo x. Interpolar a concentração de inibição de 50% (IC50) na fração de 0,5 viabilidade celular.
Resultados
Fabricação e caracterização de microcryogels para a formação de microtissue 3D.
De acordo com este protocolo, microcryogels foram fabricados para o 3D de forma microtissues e microcryogels individuais ou matrizes de microcryogel e foram aplicados à terapia regenerativa e de despistagem, respectivamente de drogas (Figura 1). Fichas de matriz Microstencil fabricadas a partir de PMMA foram aplicadas como micromolds para microcryogel fichas de matriz. Desenhos geométricos variáveis poderiam ser preparados para o chip de matriz microstencil. Escolhemos um representante 45 x 14 mm microstencil matriz chip como exemplo, que continha várias formas (ou seja, círculo, elipse, triângulo e trevo) e um chip de matriz em forma de círculo microstencil com diferentes tamanhos (diâmetros = 100, 200, 400 e 800 µ m). para aumentar a visibilidade da micromolds sobre os chips de matriz, imagens de epi-iluminação luz foram observadas (Figura 2A, B). Microcryogels colhidos os chips de matriz exibiu desejado de formas e tamanhos (Figura 2, D). Tais microcryogels com características geométricas desejadas possivelmente poderiam ser aplicados como modelos para formar diferentes unidades celulares que imitam certas arquiteturas de tecidos nativos. As GMs colhidos (gelatina microcryogels) tinham previamente definido de formas e tamanhos (Figura 3A). Observação SEM demonstrou que microcryogels continham estruturas se interligado com o tamanho dos poros na faixa de 30-80 µm (Figura 3B).
Injectabilidade aprimorada de microtissues hMSCs-carregado para o salvamento de membro isquêmico melhorada
Usando a bomba de seringa programável integrado com um medidor de força digital14, a Injectabilidade de GMs foi avaliada quantitativamente. A uma taxa de fluxo de 1 mL/min, os GMs com uma densidade de 1.000 microcryogels por mL foram injetados sob 6 N, que foi menor do que a força clinicamente aceitável de 10 N20 (Figura 3F). Baseando-se na protecção celular habilitada por GMs, hMSCs em GMs tinha alta viabilidade e mantido grande capacidade proliferativa após injeção durante 5 dias de cultura (Figura 3-H).
O modelo de isquemia do membro do rato foi escolhido para avaliar a eficácia terapêutica do microtissues injetável hMSC-carregado. Estado fisiológico de membros isquêmicos foi examinado a 28 dias após a cirurgia (Figura 4A). Nenhum salvamento de membro foi observado no grupo de controle de GMs ou grupo de Souza. No grupo de 105 célula livre tratamento, amputação de dedo total de 50%, amputação parcial do dedo do pé de 25% e 25% amputação parcial foram observados dentro de 7 dias, resultando em perda de 80% dos membros e amputação de dedo total 20% depois de 28 dias. Em contraste, o tratamento microtissues com 10 hMSCs5 alcançado salvamento de membro melhorada (75%) com só 25% camundongos mostraram amputação espontânea do dedo do pé após 28 dias... 10 hMSCs6 , o número mínimo eficaz célula usado na maioria dos estudos anteriores, foi escolhido como o controlo positivo de21. Apenas 2 dos 4 ratos mostrou o salvamento do membro, mas todos tiveram menor necrose.
Perfusão sanguínea foi monitorado e avaliado em auxílio de indocianina verde (ICG), um agente de contraste angiográfico aprovado pela FDA. O resultado mostrou que os sinais de fluorescência aparecem nos ratos tratados com microtissue e nos 106 livre tratada hMSCs ratos. Não há nenhum sinal de fluorescência evidente nos membros traseiros isquêmicos no grupo GM ou farsa até dia 28 (Figura 4B).
Estes resultados ainda mais confirmaram que hMSCs 3D microtissue-assistida terapia alcançado superiores efeitos terapêuticos para o tratamento de CLI que representa a dosagem mínima eficaz para a terapia baseada em célula no modelo do rato até agora.
Triagem de drogas de alto rendimento citotoxicidade no chip de matriz 3D microtissue
Uma matriz de microcryogel 3D ready-to-use para cultura de células no chip poderia ser facilmente fabricado por microcryogels do chip de PMMA de retenção após a liofilização e combinando com o chip bem-matriz correspondente com fitas adesivas biocompatíveis (Figura 1 e Figura 5A). Nessa matriz de cultura de células de duas partes, o chip bem-matriz superior serviu como reservatórios para o meio de cultura, soluções de drogas e reagentes do ensaio, enquanto as células foram cultivadas no microcryogel 3D imobilizada no chip matriz inferior. As fitas adesivas entre o chip de matriz superior e inferior permitiu a geração de 384 poços individuais para cultura celular 3D de alta produtividade (Figura 5B), portanto, fornecendo uma ferramenta prática para a descoberta de medicamentos.
Conforme descrito no protocolo, matriz 3D microtissue foi formada por semeadura diretamente as células em microcryogels antes de adicionar médio para os reservatórios. Usando células NIH-3T3 RFP-etiquetadas, temos demonstrado que as células eram uniformemente distribuídas com multi-camadas a arquitetura 3D das microcryogels (Figura 5, D). SEM imagens mostraram que as células se adere firmemente às paredes dos poros e ainda exibiram filopodia estendido ao longo ou entre paredes adjacentes de macroporos no microcryogels (Figura 5E).
Em seguida, mostramos a viabilidade da aplicação dessa matriz 3D microtissue para alta produtividade usando duas linhas de células de câncer e dois compostos de testes de drogas. Células de carcinoma hepatocelular (HepG2) foram tratadas com doxorrubicina, enquanto células de câncer de pulmão não-pequenas células (NCI-H460) foram tratadas com IMMLG-8439, um novo inibidor de tumor. Cinco a nove concentrações distintas de cada droga foram administradas a seis poços adjacentes como repetições, com 0,1% DMSO em meio de cultura como controlo negativo. Da mesma forma realizou-se um ensaio de citotoxicidade de células cultivadas em placas de multi bem tradicionais 2D. Após 24h de incubação, o ensaio da viabilidade celular foi usado para avaliar as respostas de drogas de células em 2D e 3D. Curvas de resposta de drogas foram plotadas usando taxas de viabilidade celular normalizado em concentrações diferentes drogas, e o IC50 foi então interpolated a partir destas curvas. Um valor mais alto de IC50 indicaria que as células são mais resistentes aos medicamentos. Da Figura 5F e 5I, observamos um aumento significativo na resistência a drogas quando as células foram cultivadas na matriz de microtissue 3D do que em 2D. O IC50 de doxorrubicina contra células HepG2 alcançou 165.959 µM, em relação a 18.239 nM em 2D; o IC50 de IMMLG-8439 em células NCI-H460 da mesma forma foi elevada a 331.894 nM em 3D, exigindo apenas 1.294 nM em 2D. Tal observação acabou em concordância com relatos de resistência de droga aumentou na cultura 3D 2D cultura por outros pesquisadores22,23.
Nós atribuído esse aumento na resistência a drogas para a complexidade do microambiente 3D em comparação com oconfiguração planar da cultura 2D. SEM imagens revelaram que as células HepG2 reuniram como esferoides decorar as superfícies de macroporos no microcryogel. Estas células estão firmemente agrupadas e tal interação célula-célula reforçada poderia ser uma fonte de resistência às drogas em HepG222. Foi também interessante observar que esses aglomerados de células não foram livremente suspensas esferoides, como ainda mantiveram alguma adesão à matriz (Figura 5, H). Por outro lado, especulou-se ter ocorrido quando as células de câncer de pulmão não-pequenas, NCI-H460, foram cultivadas em 3D microcryogels epitelial-mesenquimal-transição (EMT). NCJ-H460 células espalham como fibroblastos (Figura 5J, K) em vez de cluster como HepG2. Daí, deduzimos que o aumento da resistência às drogas pode ser resultado de uma transição de células epiteliais do ICN-H460 para um mais maligno estado18,19,20,21,22 ,23.
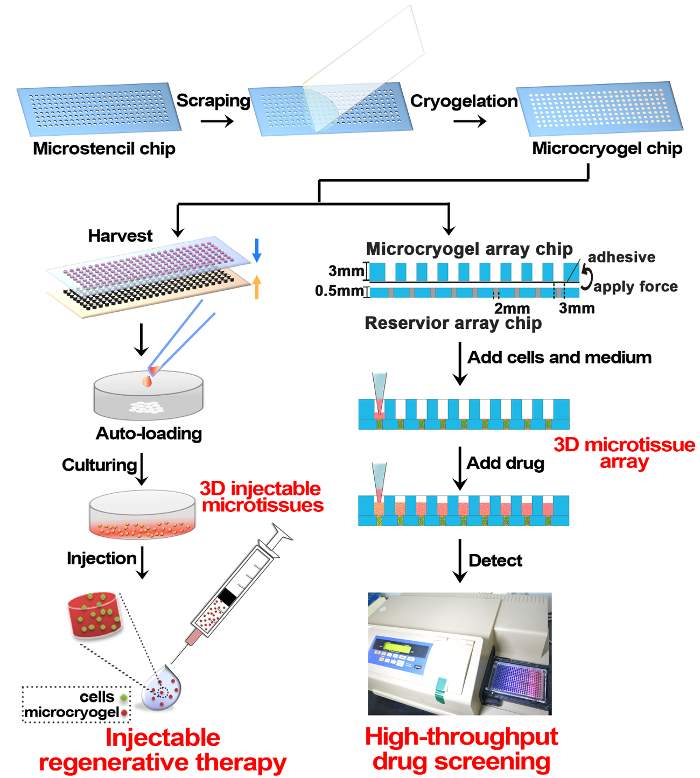
Figura 1 : Esquemático da fabricação de Microtissue 3D e aplicação na terapia regenerativa e de despistagem de drogas. Brevemente, chip de tamanho e forma-controláveis microcryogel foi fabricada em uma microplaqueta PMMA de matriz por cryogelation de gelatina. Os chips de microcryogel podem ser colhido fora do chip como microcryogels individuais e microcryogels mais, individual pode ser carregado automaticamente com células e cultivadas para formar microtissues 3D para terapia regenerativa injetável. Outra aplicação de chips de microcryogel é montar com um chip de matriz de reservatório e então ainda mais, carregar células e cultura em matrizes de microtissue 3D para triagem de drogas de alto rendimento. Clique aqui para ver uma versão maior desta figura.
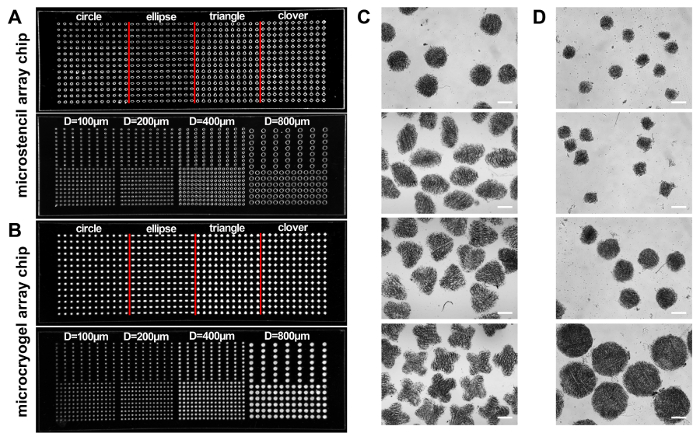
Figura 2:Chips de matriz Microstencil. (, B) Fotografias de dois chips microstencil PMMA contendo vestiu micropoços com formas diferentes (ou seja, círculo, elipse, triângulo e trevo) e a forma circular com tamanhos diferentes (diâmetro: 100, 200, 400 e 800 µm), respectivamente (A), e dois chips correspondente de matriz de microcryogel (B). (C, D) Imagens microscópicas do microcryogels individual colhidas da matriz dois microcryogels chips. Barra de escala = 500 µm. Esta figura foi modificada com a permissão de referência14. Clique aqui para ver uma versão maior desta figura.

Figura 3 : Caracterização de 3D injetável Microtissues. Fotografias do (A) de microcryogels colhida. (B) micrografia eletrônica (SEM) imagens de microcryogels mostrando interligados e se estruturas. (C, D) Fluorescência microscópica e 3D reconstruída imagens confocal de hMSCs-carregado microtissues manchadas pelo vivo/morto e rodamina faloidina. (E) quantificação de auto-carregamento hMSCs e proliferação em GMs com densidades diferentes de carregamento inicial. Injeção em tempo real (F) força curvas de medição para injeções triplas de 1.000 gramas em 1 mL de solução de gelatina de 15% (wt/vol) a taxa de injeção de 1 mL/min (1.000-1-15%). Ensaio da viabilidade de hMSCs-carregado microtissues pré- injeção e pós-injeção de células (G) Live/mortos. (H) proliferação de hMSCs carregado no pós-injeção de GMs após 1, 3 e 5 dias de cultura (n = 3). * p < 0.05, ANOVA One-Way em relação ao dia 1. Os dados são apresentados como média ± SEM. Esta figura foi modificada com a permissão de referência11. Clique aqui para ver uma versão maior desta figura.
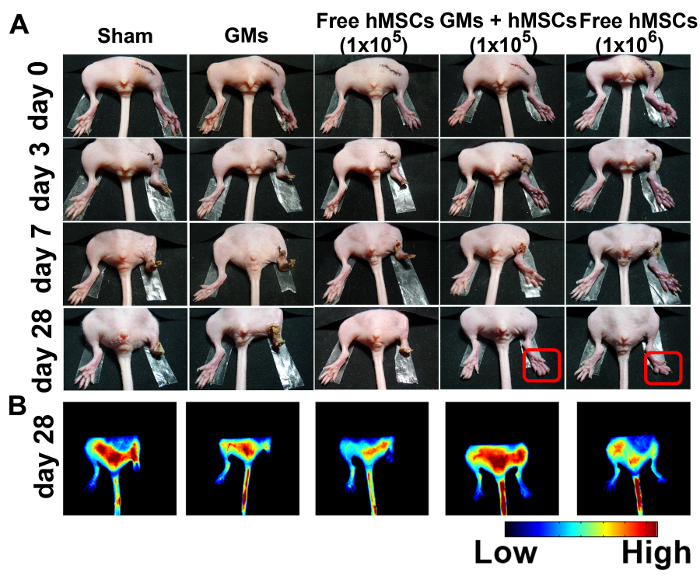
Figura 4:melhorado Salvage e reforçada a angiogênese em membros traseiros isquêmicos tratados com Microtissues de injetáveis 3D. (A) representante fotografias de sham (n = 4), em branco microcryogels (n = 4), livre de hMSCs (105) (n = 8), hMSCs (105)-carregado microtissues (n = 8) e livre de hMSCs (106) (n = 4) em 0, 3, 7 e 28 dias após o tratamento. Imagens de fluorescência (B) obtidos 100 s após a injeção do ICG no dia 28. Esta figura foi modificada com a permissão de referência11. Clique aqui para ver uma versão maior desta figura.

Figura 5 : 3D Microtissue matriz para triagem de drogas de alto rendimento. (A) fotografia de matriz microtissue 3D no formato de 384-multi-bem após a montagem e (B) ensaio da viabilidade celular resazurina realizada na matriz. (C) RFP-3T3 células dentro microcryogel pós-semeadura (barra de escala = 200 µm). (D) reconstrução 3D de núcleos coloração retratando uma distribuição homogênea de células em multi-camadas em microcryogel. (E) imagem de micrografia eletrônica de digitalização de RFP-3T3 células espalhando extensivamente sobre se as paredes em microcryogels (barra de escala = 20 µm). Teste de citotoxicidade de doxorrubicina (F) nas células HepG2 e (eu) IMMLG-8439 no NCI-H460 células na matriz de microtissue 3D mostrando aumento IC50 comparando com os seus homólogos 2D. Dados são apresentados como média ± esferoides pequeno de SD. (G) de células HepG2 em microcryogel (barra de escala = 100 µm), com a adesão parcial (asteriscos em H) na parede de microcryogel (barra de escala = 20 µm). (J) ICN-H460 células aderidas e se espalhou dentro do microcryogel (barra de escala = 100 µm). (K) ICN-H460 células exibem fibrmorfologia oblastic (barra de escala = 20 µm). Esta figura foi modificada com a permissão de referência9. Clique aqui para ver uma versão maior desta figura.
Discussão
Regenerativos modelos medicina e in vitro de despistagem de drogas são dois importantes aplicações para tecido engenharia5,6,7,8,9. Enquanto esses dois aplicativos têm necessidades muito diferentes, um terreno comum entre eles encontra-se na necessidade de um mais biomimetic condição de cultivo para aumentar celular funções19. Só com funções de celular melhorada em pesquisa podemos tratar doenças melhor20,21, e se pilhas cultivadas refletem respostas de drogas com mais precisão pode acelerar droga descoberta6,7. Célula de sobrevivência após a enxertia na vivo é um requisito fundamental para a medicina regenerativa, enquanto a taxa de transferência é importante para triagem de drogas para identificador milhares de compostos de uma só vez. Estes dois requisitos são específicos para seus respectivos aplicativos, e raramente pode uma tecnologia cumpra ambos os requisitos. Assim, temos exclusivamente integrado microfabrication tecnologia com cryogel preparação para produzir se microcryogels, que pode ser colhido fora do chip como transportadoras carregado com células individuais para terapia regenerativa, ou retidos no chip para mais montagem em matriz para triagem de drogas de alto rendimento. A microescala e macroporosidade destes microcryogels novela permitam homogênea de células de carga por absorção simples e automática. Usando o romance microstencil fabricação de chips de matriz microcryogel, centenas e milhares de microescala cryogels com características geométricas uniformes e reprodutíveis poderiam ser facilmente e eficientemente geradas. O microcryogels poderia ser preparado e armazenado por vácuo embalagem como um produto de prateleira, ready-to-use para facilitar a preparação de microtissues 3D em comum laboratórios para aplicações subsequentes. Usando esta técnica de fabricação, fomos capazes de encontrar o terreno comum (condição de cultura 3D para melhor biomimetismo) e requisitos específicos para as duas aplicações diferentes (elasticidade para proteger as células durante a injeção para medicina regenerativa e alta produtividade em um formato de matriz de despistagem de drogas).
Terapia baseada em células é uma grande promessa para reparação de vários tecidos danificados ou órgãos24. No entanto, a célula de retenção, sobrevivência da pilha e reprodutibilidade do tratamento são ainda pobres devido a danos mecânicos durante a injeção, escapamento alta para tecidos circundantes e isquemia e inflamação no ambiente na vivo no interior da lesão tecidos25. Alguns pesquisadores utilizaram pré-formadas agregados celulares para melhorar a injeção de célula livre. No entanto, requer uma grande quantidade de células para agregados de células de forma, que leva ao alto custo, tamanho não-uniforme e incontrolável números agregados26. Além disso, danos mecânicos e morte celular são ainda inevitáveis durante a injeção. Como alternativa, terapia assistida por biomaterial celular foi desenvolvida em que biomateriais responsivos (por exemplo, hidrogel térmica ou sensíveis ao pH) podem ser misturados com células e gelificação em situ para perceber a célula de retenção27. No entanto, em situ reticulado biomateriais não permitem escorva de células in vitro e resultado na exposição imediata das células para um microambiente isquêmico e inflamatório no local da lesão. É urgente para resolver estes problemas para aumentar a eficiência terapêutica. Uma grande vantagem do microcryogels fabricado usando este protocolo é seu desejada Injectabilidade decorrentes do tamanho miniaturizado e excepcional elasticidade, facilitando a sua aplicação na entrega de célula. A Injectabilidade de microcryogels permite protecção celular durante a entrega do celular, daí eles poderiam ser organizados em 3D microtissues injetável após a escorva em vitro de células no microcryogel para aumentar a proteína da matriz extracelular (ECM) deposição, bem como interações célula-célula. Os microtissues de injetáveis 3D resultam em microescala conjuntos de tecido-como representando uma estratégia de entrega ideal para facilitar a protecção celular, enxertia, sobrevivência e, consequentemente, melhorar os efeitos terapêuticos finais no local da lesão.
Além de efeitos terapêuticos aprimorados para terapia celular, nossos resultados também foram indicativos do complexo impacto do microambiente 3D nas respostas celulares drogas. Utilizando as condições de cultura biomimicking, seria possível extrair em vitro celular droga respostas mais representativas de na vivo respostas, acelerando, portanto, droga descoberta6,7, 28. Esferoides são uma escolha popular de configuração de cultura de células 3D e muitas técnicas foram desenvolvidas para ajudar os investigadores geram esferoides. Cultura de tecidos de baixo-adesivo placas29 ou placa de superfícies que são modificadas com nano-impressões8 também foram usadas para forçar as células para agregar, impedindo a adesão célula-matriz. Enquanto estas técnicas são relativamente simples de usar, problemas tais como perda de esferoides durante o câmbio médio e outras operações, bem como a variabilidade de tamanho dos esferoides são problemas que impedem a adoção em larga escala de tal tecnologia6. Esferoides mais homogêneas poderiam ser formadas usando suspensão cair30,31,32,33, no entanto é trabalhoso se não usando especializada placas. Usando especializada multi bem soltar placas de suspensão e integração com líquido automatizado, manipulação de sistemas6,31, seleção da elevado-produção poderia ser realizada. A maior desvantagem da cultura esferoide é a falta de ECM, que tenha sido identificado que desempenham papéis vitais em todos os tecidos fisiológicos e patológicos desenvolvimentos34. Um estudo de modelo de cérebro revelou que esferoides cultivadas dentro de um andaime de ECM, em comparação com puros esferoides, tinham aumentado de resistência às drogas, reforçada acidose devido à maior produção de lactato e melhorado angiogênese com o aumento da expressão de relacionados fatores34. Outros estudos também têm demonstrado que a presença da matriz poderia fornecer mechano-sinalização necessário para promover a EMT e suporta recapitulação das características do tumor como invasão e metástase3,35,36 , 37.
Com o aumento da compreensão da importância do ECM em desenvolvimento patológico, não há dúvida que incorporando ECM em métodos de cultura 3D poderia ajudar a imitar na vivo situações melhor6. Hidrogel de materiais naturais ou sintéticos foram aplicados para gerar vários em vitro tumor 3D modelos para avaliação de chemotherapeutics devido à sua flexibilidade e controlabilidade de propriedades biofísicas (tais como rigidez)38 , 39 , 40 , 41 , 42. enquanto hidrogel com propriedades biofísicas sintonizáveis na verdade tinha modelado importantes características biológicas de células tumorais para facilitar a triagem de drogas mais precisa, várias desvantagens desse método tem dificultado seu uso difundido em drogas triagem. Reticulação de polímeros na presença de células é necessária encapsular células dentro da matriz de hidrogel, que potencialmente poderia danificar as células. Não só isso, hidrogel de diferentes propriedades biofísicas apresenta desafios diferentes de células encapsuladas dentro. Em hidrogel suave, alto teor de água poderia apoiar o crescimento de células, mas tal hidrogel degrada rapidamente, dando apoio a curto prazo para cultura de células 3D. Por outro lado, mais aguerrida hidrogel com cross-linking alta poderia retardar a degradação mas conteúdo de água de baixo não podia apoiar o crescimento celular e crosslinker alta concentração geralmente induz a alta cytotoxicity43,44. Não, só então, preparar a cultura de células 3D com hidrogel é trabalhoso e não é compatível com o líquido de alta produtividade a maioria dos sistemas de tratamento, como controle de temperatura da solução de precursor de hidrogel é importante e empastelamento de pontas finas aplicadora pode resultar de gelificação de hidrogel dentro as pontas. Essas desvantagens, portanto, tem solicitado a busca de alternativas ECM substitutos, ou seja, baseada em andaime ECM34.
Usando andaimes pré-formado, células poderiam ser isentos do processo de fabricação do biomaterial e, portanto, prevejam a possibilidade de mais controle sobre a fabricação de andaime como condições mais duras podem ser usadas sem medo de danificar as células. Várias investigações mostraram que as células tumorais cultivadas em andaimes 3D exibem maior resistência de droga, em comparação com células cultivadas em 2D, devido ao aumento da malignidade e célula reforçada-ECM interação45,46, 47. tais observações são consistentes com os resultados aqui apresentados. Em nossos outros trabalhos, Nós demonstramos ainda mais a versatilidade da matriz de microtissue 3D e suas vantagens sobre as outras técnicas mencionadas acima. Em um recente trabalho, fomos capazes de melhorar a função hepática, promovendo o fenótipo epitelial de células HepaRG pelo cultivo em uma matriz de microtissue 3D e tal matriz foi aplicado a droga hepatotoxicidade avaliação47. Devido à uniformidade de tamanho dos poros dentro os 3D se andaimes, fomos capazes de controlar o tamanho de esferoides de células hepáticas a cair dentro de 50 a 80 µm, independentemente da densidade de semeadura de célula inicial. Isso fornece uma vantagem significativa sobre livre-formando esferoides com tamanhos de não-uniforme. Não só fazem esferoides crescer uniformemente dentro de cada andaime, células entre poços também uniformemente são semeadas, dando o coeficiente de variação (CV) comparável com células semeadura em 2D (ou seja, CV = 0,09 em 3D microtissue matriz e CV = 0,05 em 2D placa comercial ; dados não mostrados). Em outro trabalho, demonstrámos que fomos capazes de formar fígado microtumor na matriz de microtissue 3D para recapitular-tumor estromal interações para rastreio de terapia combinatória reprogramou o estroma48. Microtumores fígados foram gerados pela cultura co de longo prazo (5 dias) de fibroblastos com células tumorais em alta densidade. Observamos as barreiras para a difusão de drogas devido ao compacta célula e estrutura de ECM formada no fígado microtumor, que da mesma forma foi observado na vivode32. Usando células cancerosas do luciferase-etiquetadas e células estromais preparado mecanicamente, combinadas com luminescência de luciferina como a leitura específica para as células do câncer, triagem de novos agentes terapêuticos ou combinações contra tumor estromal da elevado-produção interação é tornada possível.
As muitas vantagens únicas da nossa técnica, apesar de uma desvantagem de microcryogels atual é falta de transparência, dificultando a observação detalhada de óptica de células em microcryogels. Novas melhorias para estes microcryogels que incluem ajustando suas propriedades ópticas para melhorar a imagem das células em microcryogels para observação. Também, importantes Propriedades biofísicas tais como rigidez não tem sido exploradas em nossa técnica, que precisaria ser tratada, se queremos melhor imitar tecidos fisiológicos e patológicos de diferentes propriedades biofísicas.
Enquanto nossa técnica permite simples geração de microtissues 3D, devem-se tomar alguns cuidados para experiências bem sucedidas. Quando microcryogels 3D no chip de matriz microstencil de fabricação, é importante assegurar que os microcryogels permanecem congelados quando colocado no liofilizador. Portanto, é essencial pre-arrefecer o liofilizador e transferir microcryogels do congelador a-20 ° C para o liofilizador rapidamente. O derretimento de microcryogels antes de liofilização ou durante a liofilização fará com que os poros entrar em colapso e, portanto, afetam a porosidade de microcryogels fabricado. Quando o cultivo microtissues 3D no formato de matriz, atenção é necessária para garantir que a aderência entre as duas matrizes é suficiente para evitar a contaminação cruzada entre os poços. Também, enquanto cultura celular de miniaturização tem sua vantagem em aumentar a produtividade e reduzindo o consumo de reagente, sua desvantagem é que o volume de baixa cultura poderia não suporte cultura de pilha a longo prazo sem reposição frequente de mídia. Não só então, é fundamental para manter a umidade do ambiente cultura para impedir a influência na viabilidade celular devido a evaporação de mídia, desde apenas alguns microlitros de suspensão de células ou mídia é adicionada. Evaporação também afetará a viabilidade das células nas áreas periféricas, por isso é vital para evitar o cultivo de células nesses poços.
No entanto, nossa técnica robusta fornece uma opção para gerar o microtissues 3D de uma forma fácil de usar, que potencialmente poderia fazer cultura 3D um método de manipulação de célula comum para a maioria dos laboratórios, para acelerar a ciência básica e translacional avanços.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi apoiado financeiramente pela Fundação Nacional de ciências naturais da China (subvenções: 81522022, 51461165302). Os autores gostaria de reconhecer todos os membros do laboratório Du para assistência geral.
Materiais
| Name | Company | Catalog Number | Comments |
| Gelatin | sigma | G7041 | All other reagents were purchased from Sigma-Aldrich (St. Louis, MO) unless otherwise indicated. |
| Glutaraldehyde | J&K | 902042 | Used as crosslinker in preparation of material. |
| Glass cover slip (24 x 50 mm) | CITOGLASS, China | 10212450C | To scrape prcursor solution onto microstencils array chips. |
| Sodium borohydride, NaBH4 | Beijing Chemical Works | 116-8 | To wash remaining glutaraldehyde away after gelation. |
| Vacuum jar | asperts, China | VC8130 | To preserve microgels under vacuum. |
| Polymethylmethacrylate (PMMA) sheets | Sunjin Electronics Co., Ltd, China | Ordinary PMMA sheets. | |
| Rayjet laser system | Rayjet, Australia | Rayjet 50 C30 | To engrave PMMA sheets to form wells. |
| Plasma Cleaner | Mycro Technologies, USA | PDC-32G | To make PMMA hyphophilic. |
| Lyophilizer | Boyikang, China | SC21CL | To lyophilize materials. |
| Trypan Blue solution (0.4%) | Zhongkekeao, China | DA0065 | To dye microgels. |
| Doxorubicin hydrochloride | ENERGY CHEMICAL, China | A01E0801360010 | To test drug resistance of cells in 2D or 3D microgel. |
| Live/dead assay | Dojindo Molecular Technologies (Kumamoto, Japan) | CS01-10 | To distinguish alive and dead cells. |
| Cell Titer-Blue | Promega (Wisconsin, USA). | G8080 | To test cell viability. |
| Cell strainer | BD Biosciences, USA | 352360 | To collect microgels. |
| D-Luciferin | SYNCHEM (Germany) | s039 | To tack cells. |
| Scanning electron microscope | FEI, USA | Quanta 200 | To characterize microgel morphology. |
| Mechanical testing machine | Bose, USA | 3230 | To measure mechanical features. |
| Programmable syringe pump | World Precision Instruments, USA | ALADINI 1000 | To test injactabiliy. |
| Digital force gauge | HBO, Yueqing Haibao Instrument Co., Ltd., China | H-50 | To test injactabiliy. |
| Ethylene oxide sterilization system | Anprolene, Anderson Sterilization, Inc., Haw River, NC | AN74i | To sterilize microgels with ethylene oxide gas. |
| Microplate reader | Molecular Devices,USA | M5 | To measure fluorescence intensity in micro-array. |
| Confocal microscope | Nikon, Japan | A1Rsi | To observe cell distribution in 3D. |
| Xenogen Lumina II imaging system | Caliper Life Sciences, USA | IVIS | To track cell in animals. |
| Liquid work stataion | Apricot design,USA | S-pipette | To load medium or cell suspension high-throuputly. |
Referências
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Abbott, A. Cell culture: biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Fischbach, M. A., Bluestone, J. A., Lim, W. A. Cell-based therapeutics: the next pillar of medicine. Sci Transl Med. 5 (179), 179(2013).
- Kuraitis, D., Giordano, C., Ruel, M., Musaro, A., Suuronen, E. J. Exploiting extracellular matrix-stem cell interactions: a review of natural materials for therapeutic muscle regeneration. Biomaterials. 33 (2), 428-443 (2012).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discov Today. 18 (5-6), 240-249 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay Drug Dev Technol. 11 (7), 435-448 (2013).
- Yoshii, Y., et al. High-throughput screening with nanoimprinting 3D culture for efficient drug development by mimicking the tumor environment. Biomaterials. 51, 278-289 (2015).
- Li, X., et al. Micro-scaffold array chip for upgrading cell-based high-throughput drug testing to 3D using benchtop equipment. Lab Chip. 14 (3), 471-481 (2014).
- Qi, C., Yan, X., Huang, C., Melerzanov, A., Du, Y. Biomaterials as carrier, barrier and reactor for cell-based regenerative medicine. Protein Cell. 6 (9), 638-653 (2015).
- Li, Y., et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia. Proc Natl Acad Sci U S A. 111 (37), 13511-13516 (2014).
- Liu, W., et al. Magnetically controllable 3D microtissues based on magnetic microcryogels. Lab Chip. 14 (15), 2614-2625 (2014).
- Zhao, S., Zhao, H., Zhang, X., Li, Y., Du, Y. Off-the-shelf microsponge arrays for facile and efficient construction of miniaturized 3D cellular microenvironments for versatile cell-based assays. Lab Chip. 13 (12), 2350-2358 (2013).
- Liu, W., et al. Microcryogels as injectable 3-D cellular microniches for site-directed and augmented cell delivery. Acta Biomater. 10 (5), 1864-1875 (2014).
- Hakanson, M., et al. Controlled breast cancer microarrays for the deconvolution of cellular multilayering and density effects upon drug responses. PLoS One. 7 (6), e40141(2012).
- Du, Y., et al. Rapid generation of spatially and temporally controllable long-range concentration gradients in a microfluidic device. Lab Chip. 9 (6), 761-767 (2009).
- He, J., et al. Microfluidic synthesis of composite cross-gradient materials for investigating cell-biomaterial interactions. Biotechnol Bioeng. 108 (1), 175-185 (2011).
- Zeng, Y., et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing. Acta Biomater. 25, 291-303 (2015).
- Yang, F., et al. Genetic engineering of human stem cells for enhanced angiogenesis using biodegradable polymeric nanoparticles. Proc Natl Acad Sci U S A. 107 (8), 3317-3322 (2010).
- Zhang, L., et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia. Stroke. 42 (5), 1437-1444 (2011).
- Kinnaird, T., et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms. Circulation. 109 (12), 1543-1549 (2004).
- Fischbach, C., et al. Engineering tumors with 3D scaffolds. Nat Methods. 4 (10), 855-860 (2007).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Gimble, J. M., Guilak, F., Bunnell, B. A. Clinical and preclinical translation of cell-based therapies using adipose tissue-derived cells. Stem Cell Res Ther. 1 (2), (2010).
- Thai, H. M., et al. Implantation of a three-dimensional fibroblast matrix improves left ventricular function and blood flow after acute myocardial infarction. Cell Transplant. 18 (3), 283-295 (2009).
- Moreira Teixeira, L. S., et al. High throughput generated micro-aggregates of chondrocytes stimulate cartilage formation in vitro and in vivo. Eur Cell Mater. 23, 387-399 (2012).
- Ifkovits, J. L., et al. Injectable hydrogel properties influence infarct expansion and extent of postinfarction left ventricular remodeling in an ovine model. Proc Natl Acad Sci U S A. 107 (25), 11507-11512 (2010).
- Murphy, A. R., Laslett, A., O'Brien, C. M., Cameron, N. R. Scaffolds for 3D in vitro culture of neural lineage cells. Acta Biomater. , (2017).
- Cheng, V., et al. High-content analysis of tumour cell invasion in three-dimensional spheroid assays. Oncoscience. 2 (6), 596-606 (2015).
- Huber, J. M., et al. Evaluation of assays for drug efficacy in a three-dimensional model of the lung. J Cancer Res Clin Oncol. 142 (9), 1955-1966 (2016).
- Lamichhane, S. P., et al. Recapitulating epithelial tumor microenvironment in vitro using three dimensional tri-culture of human epithelial, endothelial, and mesenchymal cells. BMC Cancer. 16, 581(2016).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Monjaret, F., et al. Fully Automated One-Step Production of Functional 3D Tumor Spheroids for High-Content Screening. J Lab Autom. 21 (2), 268-280 (2016).
- Shologu, N., et al. Recreating complex pathophysiologies in vitro with extracellular matrix surrogates for anticancer therapeutics screening. Drug Discov Today. 21 (9), 1521-1531 (2016).
- Ho, W. J., et al. Incorporation of multicellular spheroids into 3-D polymeric scaffolds provides an improved tumor model for screening anticancer drugs. Cancer Sci. 101 (12), 2637-2643 (2010).
- Pathak, A., Kumar, S. Independent regulation of tumor cell migration by matrix stiffness and confinement. Proc Natl Acad Sci U S A. 109 (26), 10334-10339 (2012).
- Wei, S. C., et al. Matrix stiffness drives epithelial-mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway. Nat Cell Biol. 17 (5), 678-688 (2015).
- Romero-Lopez, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Xu, X., Sabanayagam, C. R., Harrington, D. A., Farach-Carson, M. C., Jia, X. A hydrogel-based tumor model for the evaluation of nanoparticle-based cancer therapeutics. Biomaterials. 35 (10), 3319-3330 (2014).
- Xu, X., et al. Recreating the tumor microenvironment in a bilayer, hyaluronic acid hydrogel construct for the growth of prostate cancer spheroids. Biomaterials. 33 (35), 9049-9060 (2012).
- Nyga, A., Loizidou, M., Emberton, M., Cheema, U. A novel tissue engineered three-dimensional in vitro colorectal cancer model. Acta Biomater. 9 (8), 7917-7926 (2013).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochem Biophys Res Commun. 433 (3), 327-332 (2013).
- Hoare, T. R., Kohane, D. S. Hydrogels in drug delivery: Progress and challenges. Polymer. 49 (8), 1993-2007 (2008).
- Delgado, L. M., Bayon, Y., Pandit, A., Zeugolis, D. I. To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. Tissue Eng Part B Rev. 21 (3), 298-313 (2015).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In vitro three-dimensional (3D) models in cancer research: an update. Mol Carcinog. 52 (3), 167-182 (2013).
- Zhang, M., Boughton, P., Rose, B., Lee, C. S., Hong, A. M. The use of porous scaffold as a tumor model. Int J Biomater. 2013, 396056(2013).
- Wang, J., et al. Engineering EMT using 3D micro-scaffold to promote hepatic functions for drug hepatotoxicity evaluation. Biomaterials. 91, 11-22 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados