Method Article
ميكروتيسويس 3D للعلاج عن طريق الحقن بالتجدد وفحص المخدرات الفائق
In This Article
Summary
ويصف هذا البروتوكول تلفيق ميكروكريوجيلس ماكروبوروس 3D مطاطا من خلال دمج ميكروفابريكيشن مع تكنولوجيا كريوجيلاتيون. عند تحميل مع الخلايا، يتم إنشاء ميكروتيسويس 3D، الذي يمكن أن يسهل حقن فيفو في تيسير العلاج التجديدي أو تجميعها في صفائف لفحص المخدرات الفائق في المختبر .
Abstract
لترقية الثقافة التقليدية 2D خلية إلى خلية 3D ثقافة، أدمجنا ميكروفابريكيشن مع تكنولوجيا كريوجيلاتيون لإنتاج ماكروبوروس microscale كريوجيلس (ميكروكريوجيلس)، التي يمكن تحميلها مع مجموعة متنوعة من أنواع الخلايا لتشكيل ميكروتيسويس ثلاثي الأبعاد. وهنا، نقدم البروتوكول اختﻻق ميكروتيسويس ثلاثية الأبعاد متعددة الاستخدامات والتطبيقات الخاصة بهم في العلاج بالتجدد وفحص المخدرات. الحجم والشكل يمكن السيطرة عليها ميكروكريوجيلس يمكن أن تكون ملفقة في صفيف رقاقة إلكترونية، التي يمكن حصادها قبالة رقاقة كناقلات تحميل الخلية الفردية للعلاج عن طريق الحقن بالتجدد أو تكون زيادة مجمعة على شريحة في صفائف ميكروتيسوي 3D للفائق فحص المخدرات. نظراً لطبيعة هذه كريوجيلس microscale مرونة عالية، يحمل ميكروتيسويس 3D إينجيكتابيليتي كبيرة للعلاج مينيملي الخلية عن طريق حماية الخلايا من قوة القص الميكانيكية أثناء الحقن. وهذا يضمن بقاء الخلية المحسنة والتأثير العلاجي في طراز الاسكيمية أطرافهم الماوس. وفي الوقت نفسه، يسهل الجمعية صفائف ميكروتيسوي ثلاثية الأبعاد في شكل موحد 384-multi-كذلك استخدام مرافق المختبرات المشتركة والمعدات، تمكين المخدرات الفائق الفرز على هذا النظام الأساسي في ثقافة الخلية 3D تنوعاً.
Introduction
يمكن الحصول الخلية التقليدية والثقافة على مسطح ثنائي الأبعاد (2D) السطوح، مثل طبق ثقافة أو لوحات متعددة جيدا، لا يكاد السلوكيات خلية قريبة من دولهم الأصلية. خلاصة دقيقة من ميكرونفيرونمينتس الخلوية الأصلية، التي تشمل مختلف أنواع الخلايا ومصفوفات خارج الخلية النشطة بيولوجيا العوامل القابلة للذوبان في أبنية ثلاثية الأبعاد (3D)1،2،3 ،4، أمر أساسي لبناء بيوميميكينج الأنسجة في المختبر للتطبيقات في الطب التجديدي، وهندسة الأنسجة، البيولوجيا الأساسية للبحث والمخدرات اكتشاف5،6،7 ،،من89.
بدلاً من ثقافة الخلية 2D، ثقافة الخلية 3D يستخدم على نطاق واسع للنهوض بالمحاكاة البيولوجية الجزئية المعمارية والسمات الوظيفية للخلايا المزروعة في المختبر. أسلوب ثقافة شعبية 3D خلية إلى خلايا الكلية إلى الماغنيسيوم7،،من89،10. يمكن حقن الماغنيسيوم الخلوية للأنسجة المصابين مع الاحتفاظ الخلوية المحسنة والبقاء على قيد الحياة بالمقارنة مع حقن الخلايا المتفرقة. ومع ذلك، أحجام كروي غير موحدة والإصابات الميكانيكية حتمية تفرضها قوة القص السوائل في الخلايا أثناء الحقن يؤدي إلى خلية الفقراء الآثار العلاجية11،،من1213. وبالمثل، جعلت الأصيل غير التماثل أثناء تجميع الماغنيسيوم ترجمتها إلى 3D يستند إلى الخلية الفائق المخدرات فحص التحدي10.
أسلوب آخر لثقافة خلية ثلاثية الأبعاد تحقق مع تقديم المساعدة الحيوية، التي عادة ما تقوم بتغليف الخلايا في الهلاميات المائية مائي أو السقالات المليئة بالثغرات. أنه يسمح بمرونة أكبر في تشييد أبنية ثلاثية الأبعاد. للعلاج، وعادة ما يتم تسليم الخلايا مغلفة في السقالات الجزء الأكبر إلى جسم الحيوان عن طريق غرس الجراحية، والغازية والصدمة، ومن ثم تقيد ترجمة واسعة للسرير. من ناحية أخرى، تمكن الهلاميات المائية المائية العلاج مينيملي عن طريق حقن الخلايا التي علقت في حل السلائف المائية إلى الهيئات الحيوانية، مما يسمح جيلاتيون في الموقع عن طريق-الحرارية، الكيميائية أو الانزيمية كروسلينكينج11. ومع ذلك، كما يتم تسليم الخلايا بينما السلائف المائية لا تزال في حالة مائي، كما تعرضوا للقص الميكانيكية أثناء الحقن. ليس ذلك فقط، يمكن أن تفرض crosslinking الكيميائية أو الانزيمية أثناء جيليشن في الموقع من المائية أيضا الضرر للخلايا داخل. لفحص المخدرات، وثقافات ساعدت مادة بيولوجية الخلية تواجه مشاكل مع الاتساق وقابلية التحكم والإنتاجية. استخدام الهلاميات المائية، الخلايا عادة ما تشارك خلال جيليشن، التي قد تؤثر على العملية بقاء الخلية ووظيفتها. جيليشن خلال بذر الخلية كما يعوق استخدام معظم المعدات الفائق، منذ المائية قد تحتاج إلى أن تبقى على الجليد لمنع جيليشن قبل الخلية البذر، وربما جام المائية الاستغناء عن النصائح، وعادة ما تكون ضعيفة للغاية لضمان الدقة الفرز الفائق. يمكن فصل السقالات شكلت قبل يحتمل أن تكون إجراءات تصنيع مادة بيولوجية من الثقافة الخلية، ولكن معظم المنتجات المستندة إلى سقالة متاحة كالمواد السائبة مع أقل نسبيا من الناتج14.
للتغلب على بعض أوجه قصور أساليب 3D الثقافة الحالية، قمنا بتطوير تكنولوجيا ميكروفابريكيشن-كريوجيلاتيون المتكاملة لاختلاق رقاقة صفيف ميكروكريوجيل الجاهزة للاستخدام وسهلة الاستخدام15. في هذا البروتوكول، ويتم تحديد الجيلاتين لتجسيد تقنية تصنيع ميكروكريوجيل كما متوافق حيويا، والقابلة للتحلل، وفعالة من حيث التكلفة، وأي تعديل آخر مطلوب لمرفق خلية. يمكن أيضا استخدام البوليمرات الأخرى من المصادر الطبيعية أو الاصطناعية للتصنيع، استناداً إلى التطبيق. عن طريق هذه التكنولوجيا، ونحن اختﻻق ميكروكريوجيلس المنمنمة ومرونة عالية مع حجم يمكن السيطرة عليها، والشكل والتخطيط. عند تحميل مع مجموعة متنوعة من أنواع الخلايا، ويمكن تشكيل ميكروتيسويس 3D لمختلف التطبيقات. تمكين هذه الميزات الفريدة إينجيكتابيليتي المرجوة وحماية الخلايا والاحتفاظ بموقع الموجه بعد الحقن في فيفو لتعزيز الآثار العلاجية. ليس ذلك فقط، يمكن معالجتها في ميكروكريوجيلس كذلك لتشكيل المصفوفات ميكروتيسوي 3D متوافقة مع معدات المختبرات المشتركة وأدوات لتحقيق ثقافة الخلية الفائق للكشف عن المخدرات تنوعاً وفحوصات الخلوية الأخرى. هنا، نحن التفصيل عملية تصنيع ميكروكريوجيلس وما بعد المعالجة ميكروتيسويس ثلاثي الأبعاد الفردية أو صفائف ميكروتيسوي ثلاثي الأبعاد لاثنين من التطبيقات الهامة وخلية العلاج وفحص المخدرات، على التوالي10،15 .
Protocol
التجارب على الحيوانات يتبع صارمة بروتوكول أقرته "لجنة أخلاقيات الحيوان" في مركز التحليل البيولوجية الطبية، جامعة تسينغهوا. إطار موافقة "لجنة الأخلاقيات"، الأنسجة الدهنية البشرية تم الحصول عليها من "قسم للجراحة التجميلية لبكين الاتحاد المستشفى" بموافقة مستنيرة من المرضى-
1-تلفيق 3D ميكروكريوجيلس
- ، تصميم وتصنيع رقائق الصفيف ميكروستينسيل
- استخدام برمجيات تجارية لتصميم صفائف من الهندسات محددة، مثل الدوائر والأشكال البيضاوية، ومثلثات أو البرسيم 14، تبعاً للطلب اللاحق.
ملاحظة: تشير إلى المادة 2 من البروتوكول للطب التجديدي، والمادة 3 بروتوكول لفحص المخدرات للحصول على تفاصيل التصميم. - استيراد التصميم الليزر النقش البرمجيات المصاحبة لالة النقش الليزر. باستخدام إعدادات الليزر وفقا لتوصيات مصنع لالة النقش الليزر، الليزر-نقش تصميم المستوردة إلى بولي (ميثيميثاكريلاتي) (البولي ميثيل ميثا اكريلات) أوراق.
- تغسل رقائق ميكروستينسيل الصفيف مع المياه لتنظيف الحطام من النقش الليزر. الجافة الصفيف ميكروستينسيل الرقائق في 60 ° C. مخزن في حقيبة مختومة في درجة حرارة الغرفة لمدة أشهر.
- استخدام برمجيات تجارية لتصميم صفائف من الهندسات محددة، مثل الدوائر والأشكال البيضاوية، ومثلثات أو البرسيم 14، تبعاً للطلب اللاحق.
- تصنيع رقائق الصفيف ميكروكريوجيل
- ميكروستينسيل 4 مكان مجموعة رقائق على علبة عينة وإدراج في البلازما أنظف. أغلق باب نظافة وتشغيل مضخة فراغ لمدة 2 دقيقة، ثم تشغيل الطاقة الترددات اللاسلكية كحد أقصى (18 ث) لعلاج رقائق الصفيف ميكروستينسيل في البلازما أنظف ل 3 دقيقة في درجة حرارة الغرفة لزيادة هيدروفيليسيتي- منزوع
- الجيلاتين ز 0.06 إضافة إلى 1 مل من الماء لتشكل 6% (wt/المجلد) الجيلاتين السلائف الحل (ما يكفي لجعل رقائق 5). الحارة في 60 درجة مئوية في حمام مائي إلى أن يحل على نحو كاف. تبني على الجليد للحد الأدنى 5
- إضافة 3 ميليلتر من جلوتارالديهيدي إلى حل السلائف الجيلاتين بتركيز 0.3% نهائي. مزيج دقيق.
- ماصة 200 ميليلتر السلائف الحل مع جلوتارالديهيدي على السطح العلوي للرقاقة الصفيف ميكروستينسيل.
ملاحظة: 200 ميليلتر كاف لشريحة 75 مم × 25 مم بغض النظر عن التصميم. زيادة مقدار التناسب عندما يتم زيادة المساحة السطحية لرقاقة. - يدوياً بتوزيع الحل بالتساوي على الرقاقة بإلغاء الخلفي والمنصوص عليها بقضيب زجاج عازمة 2 إلى 3 مرات.
ملاحظة: يمكن ملء كل الصغرى-جيدا على رقاقة ميكروستينسيل مع الحل السلائف نظراً لطبيعتها ماء بعد المعالجة بالبلازما. - فورا بوضع رقاقة السلائف-الحل-ملء صفيف في ثلاجة-20 درجة مئوية ح 16 عن كريوجيليشن-
- ضبط ليوفيليزير إلى-40 درجة مئوية للحد الأدنى 30 مكان رقائق الصفيف بعد كريوجيليشن في ليوفيليزير وليوفيليزي رقائق الصفيف ح 2 في فراغ.
ملاحظة: ميكروكريوجيلس الجيلاتين مع ماكروبوريس مترابطة يتم تشكيلها لأن الجليد الذي تشكل خلال سوبليميس كريوجيليشن في ليوفيليزير. - انتقل إلى الباب 2 لعلاج الاسكيمية الحرجة أطرافهم (CLI) والباب 3 لفحص المخدرات الفائق.
2. حصاد "ميكروكريوجيلس الفردية" إلى ميكروتيسويس 3D "النماذج القابلة للحقن" لعلاج CLI
- ميكروكريوجيلس الفردية حصاد
- تصميم صفائف (75 مم × 25 مم) 600 الدوائر، وكل منها 400 ميكرون القطر، في البرمجيات التجارية للبناء ميكروتيسوي 3D القابلة للحقن. استخدام البولي ميثيل ميثا اكريلات من 300 ميكرون سمك لتصنيع الرقائق الصفيف ميكروستينسيل مفصلة في الفرع 1-1-
- تلفيق ميكروكريوجيل صفيف رقائق كما في القسم 1.2.
- تلفيق مجموعة PDMS القاذف Pin مع نفس التصميم كما هو الحال في خطوة 2.1.1 من الطباعة الحجرية الناعمة القياسية 16 ، 17-
- تراكب رقاقة مجموعة ميكروكريوجيل على رأس الصفيف PDMS القاذف Pin، محاذاة كل ميكروكريوجيل مع دبوس قاذف في الصفيف. اضغط على رقاقة الصفيف ميكروكريوجيل نحو الصفيف دبوس القاذف لدفع ميكروكريوجيلس من أصل ميكروويلس بدبابيس بارزة في الصفيف دبوس PDMS القاذف لحصاد ميكروكريوجيلس الفردية.
- الحصاد في ميكروكريوجيل في المياه وجمعها مع معونة مصافي الخلية. استخدام مصفاة واحدة لجمع ميكروكريوجيلس من شريحة واحدة (أي، ميكروكريوجيلس 600)-
- ميكروكريوجيلس الغسيل مع نأبه 0.1 م 4 على الجليد لمدة 20 دقيقة إخماد أي بقايا ألدهيد uncross-مرتبط. استخدم 5 مل من 0.1 متر نأبه 4 لكل شريحة. تجاهل نأبه 4 وتغسل مع منزوع 5 مل من الماء لمدة 15 دقيقة من 3 إلى 5 مرات، في كل مرة.
- تجاهل المياه من مصفاة الخلية وجمع ميكروكريوجيلس في مجموعة واحدة كل مصفاة الخلية ووضع كتلة واحدة في طبق بتري 35 ملم واحد استخدام الملاقط منحنى. إضافة 50-70 ميليلتر منزوع الماء لكل مجموعة وتغطي غطاء طبق بيتري. اضغط برفق طبق بيتري على الطاولة إلى مستوى من جميع ميكروكريوجيلس، حيث أن ميكروكريوجيلس لا يكذبون على رأس ميكروكريوجيل أخرى لتشكيل المونولاير ميكروكريوجيلس على سطح طبق بيتري. تجميد
- ميكروكريوجيلس المقطوع في-20 درجة مئوية ح 4 إلى 16 قبل ليوفيليزينج منهم 2 ح (راجع الخطوة 1.2.7). تخزين ميكروكريوجيلس في فراغ في درجة حرارة الغرفة حتى استخدامها مرة أخرى.
- وصف ميكروكريوجيلس
- تقييم المسام ميكروكريوجيلس عن طريق فحص التصوير بالمجهر الإلكتروني (SEM).
- إيموبيليزي ميكروكريوجيلس المقطوع والمجففة بالتبريد على حامل عينة بالشريط اللاصق المزدوج الجانب ومعطف مع الذهب المغطى الرش ل 90 ثانية، قبل التصوير بواسطة SEM 11. تقييم وتحليل توزيع لأقطار مسام في ميكروكريوجيل من سبع صور SEM مختلفة باستخدام برنامج تحليل الصور-
- تزن كتلة واحدة من 600 ميكروكريوجيلس المجففة بالتبريد في طبق بتري 35 ملم الوزن الجيلاتين المجففة ميكروكريوجيلس (GMs). إضافة 60 ميليلتر منزوع الماء إلى مجموعة ميكروكريوجيلس المجففة بالتبريد، وانتظر لمدة 30 ثانية ميكروكريوجيلس بالكامل امتصاص المياه والانتفاخ. وزن ميكروكريوجيلس منتفخة.
نسبة تضخم
- تحديد التوازن والمساميه ميكروكريوجيلس، كالنسبة الوزن من تورم ميكروكريوجيلس ميكروكريوجيلس الجيلاتين المجففة ونسبة الوزن للمياه الذي عقد في ميكروكريوجيلس ميكروكريوجيلس رطب، على التوالي 13-
- إينجيكتابيليتي قدر من ميكروكريوجيلس باستخدام مضخة حقنه لبرمجة المتكاملة مع قوة رقمية قياس 14.
- وصمة عار 600 قطعة من ميكروكريوجيلس تريبان الأزرق وتعليق في 600 ميليلتر 15% جيلاتين الحل لتحقيق توزيع متجانس. تحميل 1 مل ميكروكريوجيل تعليق في حقنه 1 مل. حقن الخليط من خلال إبرة 27-قياس تعلق بحقنه 1 مل باستخدام مضخة الحقن لبرمجة في معدل التدفق من 1 مل/دقيقة
- الحقن في الوقت الحقيقي رصد القوة بالقوة الرقمية قياس الاختبار وارسم منحنى القوة-الزمن. بعد الحقن، مراقبة سلامة ميكروكريوجيلس تحت مجهر.
ملاحظة: منطقة الميكونج الكبرى معلقة في محلول الجيلاتين 15% (wt/المجلد) يمكن بسلاسة حقن وبقيت سليمة بعد حقن.
- تميز التحلل ميكروكريوجيلس.
- أولاً، قياس وزن كتلة واحدة من 600 ميكروكريوجيلس المجففة بالتبريد في طبق بتري 35 ملم كوزن جاف. ثم تزج 600 ميكروكريوجيلس المجففة بالتبريد في 2 مل 0.025% (المجلد/المجلد) التربسين/يدتا- ميكروكريوجيلس
- جمع من الحل باستخدام مصفاة خلية عند نقاط زمنية مختلفة (أي، 10، 20، 30، 40، 50 و 60 و 70 دقيقة). الحل الفتيل الزائد بعيداً مع أنسجة. قياس وزن ميكروكريوجيلس في نقاط زمنية مختلفة وحساب درجة التدهور، كالنسبة وزن ميكروكريوجيل عند نقطة معينة وقت لمن ميكروكريوجيل في الساعة صفر-
- تقييم المسام ميكروكريوجيلس عن طريق فحص التصوير بالمجهر الإلكتروني (SEM).
- Autoloading الخلايا في ميكروكريوجيلس لنموذج ثلاثي الأبعاد ميكروتيسويس
- تعقيم ميكروكريوجيلس من الخطوة 2.1.8 بنظام التعقيم أكسيد الإيثيلين مع التعرض لغاز 12 h تليها ح 12 ولﻵﻻت تحت فولت تيار مترددالعراقية هذه. اختر
- البشرية المستمدة من الدهنية stromal الخلايا الوسيطة (همسكس) لتلقي علاج اللكتات الدماغية الماوس. عزل الخلايا بالإجراءات التالية كما سبق ذكره 18- متوسطة
- همسكس الثقافة في النمو الذي يحتوي على 2% مصل بقرى الجنين (FBS)، 10 نانوغرام/مل عامل النمو المشتقة من الصفيحات bb (PDGF-bb)، 1 X الأنسولين ترانسفيرين السيلينيوم (البحث عن) الديكساميتازون -8 م 10، 10، 10 عامل نمو البشرة من نانوغرام/مليلتر (لو) -4 م حمض الأسكوربيك 2-الفوسفات والبنسلين يو/مليلتر 100 100 ميكروغرام/مل ستربتوميسين في DMEM/F12. مرور الخلايا في نسبة 1:3 عندما المتلاقية. استخدام خلايا سن 3 إلى 5 في التجارب التالية.
- حصاد همسكس مع التربسين والتحديد الكمي لعدد الخلايا باستخدام دائرة عد فوخس-روزنتال وريسوسبيند بكثافة 8 × 10 6 خلايا/مل في المتوسطة النمو همسكس.
- ماصة 60 ميليلتر همسكس تعليق على أحادي الطبقة من 600 ميكروكريوجيلس مع قطر 400 ميكرون في طبق 35 ملم من الفرع 2-1. يتم امتصاص الخلايا تلقائياً في مسامية الصغرى-هياكل ميكروكريوجيلس-
- المحافظة على في دائرة هوميديفيد واحتضان في 37 درجة مئوية ح 2 السماح بإرفاق الخلايا. بعد 2 ساعة حضانة، إضافة 2 مل الثقافة المتوسطة. تغيير في المتوسط كل يومين. الثقافة محملة همسكس ميكروكريوجيلس لمدة يومين لتشكيل 3D ميكروتيسويس-
- بعد 2 أيام استزراع، "الماصة؛" ميكروكريوجيلس همسكس-تحميل 100 كل بئر على لوحة 96-جيدا، وإضافة ميليلتر 120 ريسازورين العامل الحل أعد وفقا للشركة المصنعة ' s تعليمات إلى كل بئر. احتضانها ح 2 في 37 درجة مئوية.
الأسفار
- كشف من ريسازورين استقلاب خلايا قابلة للحياة في قارئ ميكروسكوبية مع الطول موجي ضوء إثارة من 560 نانومتر وانبعاث الضوء الطول الموجي 590 نانومتر. إنشاء منحنى قياسي من عدد الخلايا مقابل الأسفار باستخدام همسكس أن اقحم عدد الخلايا من شدة الأسفار للتجربة المقبلة وفقا لبروتوكول مجموعة 13-
- تقييم عدد من همسكس في ميكروكريوجيلس من اليوم 0 يوم 4 باستخدام ريسازورين كما هو موضح في الخطوة 2.3.7 من اليوم 0 يوم 4-
- وصمة عار الخلايا في ميكروكريوجيلس مع تمييع 1: 500 من كالسين صباحا وتمييع 1: 250 من يوديد Propidium (المعروف تلطيخ يعيش الميت) في الفوسفات مخزنة المالحة (PBS) ومراقبة تحت مجهر الأسفار أو مجهر الأسفار [كنفوكل]-
- حقن ميكروتيسويس 3D في فيفو للعلاج من المبادرة القطرية في طراز الماوس
- إنشاء اللكتات الحرجة الاسكيمية من الإناث بالب/ج الفئران عارية كما ذكرت 11 ، 19 لتحديد التأثير العلاجي 3D العلاج القائم على ميكروتيسوي-
- نقل ميكروتيسويس من الخطوة 2.3.6 استخدام ماصة 5 مل إلى مصفاة خلية وتصفية بعيداً في مستنبت.
- ريسوسبيند ميكروتيسويس 3D تحميل همسكس في الحل الجيلاتين 15%، في كثافة 100 ميكروكريوجيلس الواحد 100 ميليلتر الحل.
- قبل الجراحة، وتعقيم الأدوات الجراحية اﻷوتوكﻻف وإجراء عمليات جراحية في غرفة العمليات في مركز مرفق الحيوان لحيوان.
- ضع الماوس في قاعة تحريض التخدير التي تحتوي على إيسوفلوراني 1-3% في الأكسجين 100% بمعدل 1 لتر/دقيقة تطبيق الاريثروميسين في عيون الماوس لمنع تجفيف تدفق. من خلال شق جلد طوله 1 سم، سد شريان فخذي وفروعها مع خيوط الحرير 5-10 والمكوس 19- حقن
- إدخال إيندوسيانيني الخضراء (ICG) (0.1 مل من 100 ميكروغرام/مل) عن طريق الوريد الذيل لمراقبة تدفق الدم. القيام بتصوير fluorescence ICG الأسفار نظام التصوير باستخدام (هنا، نظام محلي الصنع) في هندسة الانعكاس 11-
- ميكروتيسويس حقن العضل ثلاثة مواقع للعضلات مرهف حول شق الشريان باستخدام حقنه 1 مل بإبرة عيار 23-
- بعد عملية جراحية، الدفء الماوس مع وسادة ساخنة في قفص الانتعاش. حقن تحت الجلد ميلوكسيكام تخفيف الألم، وترصد باستمرار حتى مستيقظا.
- بعد 28 يوما، رصد الفعالية العلاجية من أطرافهم تعامل ميكروتيسوي 3D بالأسفار التصوير 11-
ملاحظة: حقن تحت الجلد ميلوكسيكام لتخفيف الألم عند الماوس بينت بتر عفوية. - الفئران يوثانيزي مع ثاني أكسيد الكربون بعد انتهاء تجارب-
ملاحظة: هنا، القتل الرحيم مع ثاني أكسيد الكربون وأجرى وفقا للبروتوكول الصارم أقرته "لجنة أخلاقيات الحيوان" في مركز التحليل البيولوجية الطبية، جامعة تسينغهوا.
3. الجمعية ميكروتيسوي صفيف شريحة "فحص المخدرات" الفائق
- الجمعية العامة لمجموعة ميكروكريوجيل لثقافة الخلية على شريحة
- تعديل التصميم في القسم 1-1 وفقا لإبعاد لوحة متعددة كذلك التقليدية، أي، لتنسيق 384-متعددة--حسنا، تصميم مجموعة من 16 × 24 بئرا (صف من العمود)، كل من تباعد مركز إلى مركز 4.5 مم وقطرها 2 مم-
- ليزر نقش على ورقة البولي ميثيل ميثا اكريلات 500 ميكرومتر سميكة كما هو موضح في القسم 1-1- ميكروكريوجيلس
- فابريكاتي كما هو موضح في القسم 1-2 استخدام رقاقة الصفيف 384-multi-كذلك تم الحصول عليها من الخطوة 3.1.2. هذا الصفيف الذي يحتوي على ميكروكريوجيل تم تعيينه كرقاقة الصفيف ميكروكريوجيل.
- تغسل الرقاقة الصفيف ميكروكريوجيل مع 50 مل م 0.1 نأبه 4 لإخماد أي ألدهيد المتبقية uncross-المرتبطة، ثم مرارا وتكرارا شطف بماء منزوع 50 مل ح 2 3 مرات، لكل الوقت.
- تجاهل الماء، تجميد رقاقة مجموعة ميكروكريوجيل في-20 درجة مئوية ح 4 إلى 16 قبل ليوفيليزينج وفقا للخطوة 1.2.7-
- الآبار تعديل 384-multi-البئر في خطوة 3.1.1 تصميم الصفيف تحتوي على 16 × 24، كل من تباعد مركز إلى مركز 4.5 مم وقطرها 3 مم- إزالة أحد جانبي بمساندة من ورقة رقيقة جداً (10 ميكرون) متوافق حيويا على الوجهين شريط لاصق
- ولصقها على جانب واحد من قطعة من ورقة البولي ميثيل ميثا اكريلات 3-مم-سميكة. ليزر نقش التصميم من الخطوة 3.1.4 هذا ورقة البولي ميثيل ميثا اكريلات 3-مم-سميكة ووفقا للفرع 1-1. عينت هذا الصفيف الصفيف الخزان.
- محاذاة الصفيف ميكروكريوجيل رقاقة مع رقاقة الصفيف الخزان والالتزام معا محكم لتجميع رقاقة صفيف 3D ميكروكريوجيل لثقافة الخلية على شريحة. تعقيم بالإشعاع فوق البنفسجي على حاء 1
- رقائق تخزين الصفيف ميكروكريوجيل 3D في فراغ في درجة حرارة الغرفة لإجراء المزيد من التجارب.
- فحص المخدرات على صفائف ميكروتيسوي 3D
- ملء مربع رطب مع الماء المتأين دي عقيمة 25 مل لتكون بمثابة غرفة رطوبة لثقافة الخلية. قبل الحرارة في 5% هوميديفيد CO 2 حاضنة إلى 37 درجة مئوية.
- حصاد خلايا سرطان الرئة الخلية الصغيرة غير (NCI-H460) وسرطانه الخلية الكبدية الخلايا (HepG2) من لوحات زراعة الأنسجة وفقا لبروتوكول قياسي وإعادة تعليق في ثقافة وسائل الإعلام بكثافة نهائية 1.0 × 10 6 خلايا/مل. مزيج دقيق.
ملاحظة: يتم استخدام RPM1640 مع 10% FBS و 100 يو/مليلتر البنسلين والستربتوميسين 100 ميكروغرام/مل ل NCI-H460. استخدام دميم مع 10% FBS و 100 يو/مليلتر البنسلين والستربتوميسين 100 ميكروغرام/مل ل HepG2- - إزالة الدائرة الرطوبة من الحاضنة. استخدام الملقط لرقاقة الصفيف ميكروكريوجيل مكان 3D تجميعها بعناية من الخطوة 3.1.9 في قاعة الرطوبة. أخذ الحيطة والحذر ليس الرطب ميكروكريوجيلس مع الماء في الدائرة-
- ميكس تعليق خلية جيدا، ثم الكوة ميليلتر 3 من تعليق خلية مباشرة على ميكروكريوجيل في كل بئر-
ملاحظة: نصيحة ماصة ينبغي طفيفة لمس سطح ميكروكريوجيل قبل طرد تعليق خلية. خلايا يتم تحميلها تلقائياً في ميكروكريوجيل بامتصاص. لا البذور الخلايا في الآبار الهامشية. - إضافة 10 ميكروليتر من وسائل الإعلام لكل بئر بعد الخلايا هي تبذر في ميكروكريوجيل باستخدام ماصة متعددة القنوات، مثل معالج 96-قناة سائل. المتوسطة أيضا إضافة إلى الآبار الهامشية.
ملاحظة: RPM1640 استخدام الوسائط مع 10% FBS والبنسلين يو/مليلتر 100 100 ميكروغرام/مل ستريبتوميسيn للخلايا H460. استخدام الوسائط دميم مع 10% FBS و 100 يو/مليلتر البنسلين والستربتوميسين 100 ميكروغرام/مل للخلايا HepaG2- - رقاقة الثقافة الصفيف تحميل الخلية ميكروكريوجيل في غرفة 24 ساعة في هوميديفيد 5% رطوبة CO 2 حاضنة في 37 درجة مئوية لنموذج صفيف 3D ميكروتيسوي- ميتوتريكسات
- حل و إيملج-8439 9 في ثنائي ميثيل سلفوكسيد ([دمس]) أن يشكل حلاً أسهم من 10 ملم. تمييع المخدرات مع الثقافة المتوسطة شكل تدرج تركيز تمييع الوقت من 2 نانومتر إلى 200 مليميكرون. إضافة 10 ميليلتر من حلول المخدرات إلى كل
- بشكل جيد. استخدام [دمس] 0.1% (مخففة في المتوسط) كعنصر التحكم. احتضان الصفيف ميكروتيسوي 3D تحميل المخدرات في 5% هوميديفيد CO 2 حاضنة في 37 درجة مئوية ل 24 h.
- ميليلتر 4 إضافة إلى حل ريسازورين الأسهم لكل بئر. احتضان في 37 درجة مئوية حاء 2 مكان 3D ميكروتيسوي الصفيف في القارئ الميكروسكوبية وكشف الأسفار ريسازورين استقلاب خلايا قابلة للحياة في الطول موجي ضوء إثارة من 560 نانومتر وانبعاث الضوء الطول الموجي 590 نانومتر. طرح
- إشارة ريسازورين خط الأساس من جميع الآبار قبل مواصلة تجهيز البيانات. حساب الكسر بقاء الخلية لكل بئر بتقسيم الإشارات الأسفار بإشارة fluorescence متوسط الآبار التحكم.
- رسم منحنى الاستجابة للجرعة في رسم البرامج مع الكسر بقاء الخلية كلوغاريتم الأساس 10 تركيز المخدرات كالمحور السيني والصادي. اقحم تركيز تثبيط 50% (IC50) في خلية بقاء جزء صغير من 0.5-
النتائج
تصنيع وتوصيف ميكروكريوجيلس لتشكيل ميكروتيسوي ثلاثي الأبعاد.
ووفقا لهذا البروتوكول، ميكروكريوجيلس كانت ملفقة للنموذج الثلاثي الأبعاد ميكروتيسويس وميكروكريوجيلس الفردية أو صفائف ميكروكريوجيل، وطبقت على العلاج بالتجدد والمخدرات الفرز، على التوالي (الشكل 1). وطبقت ميكروستينسيل صفيف رقائق ملفقة من البولي ميثيل ميثا اكريلات ميكرومولدس لرقائق مصفوفة ميكروكريوجيل. ويمكن إعداد تصاميم هندسية متغيرة لرقاقة مجموعة ميكروستينسيل. لقد اخترنا شريحة صفيف ميكروستينسيل ممثل 45 x 14 مم على سبيل مثال، التي تتضمن الأشكال المختلفة (أي، الدائرة والقطع الناقص، والمثلث والبرسيم) وشريحة مصفوفة على شكل دائرة ميكروستينسيل بأحجام مختلفة (أقطار = 100، و 200، و 400، و 800 μ m)-لتعزيز وضوح ميكرومولدس على رقائق الصفيف، لوحظت صور برنامج التحصين الموسع-الإضاءة الخفيفة (الشكل 2 أ، ب). ميكروكريوجيلس تحصد من رقائق الصفيف معارضها الأشكال المطلوبة والأحجام (الشكل 2، د). ربما يمكن تطبيق مثل هذه ميكروكريوجيلس مع ميزات هندسية المطلوب كقوالب لتشكيل وحدات الخلوية المختلفة التي تحاكي أبنية معينة من الأنسجة الأصلية. وكان GMs المقطوع (الجيلاتين ميكروكريوجيلس) الأشكال المعرفة مسبقاً والأحجام (الشكل 3A). أظهرت المراقبة وزارة شؤون المرأة أن ميكروكريوجيلس تتضمن هياكل ماكروبوروس مترابطة مع أحجام المسام في نطاق 30-80 ميكرون (الشكل 3B).
إينجيكتابيليتي المعززة لتحميل همسكس ميكروتيسويس لإنقاذ أطرافهم الدماغية محسنة
استخدام مضخة الحقن للبرمجة المتكاملة مع قياس قوة رقمية14، إينجيكتابيليتي لمنطقة الميكونج الكبرى وقيمت كمياً. معدل تدفق من 1 مل/دقيقة، تم حقن منطقة الميكونج الكبرى بكثافة ميكروكريوجيلس 1,000 كل مل تحت 6 ن، الذي كان أقل من مقبولة سريرياً قوة 10 ن20 (3F الشكل). مستندة على حماية الخلية ممكنة بمنطقة الميكونج الكبرى، همسكس في منطقة الميكونج الكبرى قد صلاحية عالية والحفاظ على قدرة التكاثري كبيرة بعد الحقن خلال 5 أيام للثقافة (ح الشكل 3).
تم اختيار الطراز الاسكيمية أطرافهم الماوس لتقييم فعالية ميكروتيسويس همسك-تحميل الحقن العلاجية. تم فحص الحالة الفسيولوجية لأطرافه الدماغية 28 يوما بعد الجراحة (الشكل 4 أ). لم يلاحظ أي إنقاذ أطرافهم في الشام المجموعة أو مجموعة مراقبة منطقة الميكونج الكبرى. في مجموعة العلاج الخلية الحرة5 10، لوحظت بتر إصبع مجموع 50% وبتر إصبع القدم جزئي 25%، وبتر جزئي 25% في غضون 7 أيام، مما أدى إلى فقدان أطرافهم 80% وبتر إصبع إجمالي 20% بعد 28 يوما. على النقيض من ذلك، حقق العلاج ميكروتيسويس مع 105 همسكس إنقاذ أطرافهم المحسنة (75%) مع فقط 25% الفئران أظهرت بتر إصبع القدم عفوية بعد 28 يوما. 106 همسكس، كان عدد الحد الأدنى الخلية الفعالة المستخدمة في معظم الدراسات السابقة، اختيرت مراقبة إيجابية21. 2 فقط من الفئران 4 أظهرت إنقاذ أطرافهم، ولكن الجميع قد نخر طفيفة.
التروية الدموية رصد وتقييم في معونة إيندوسيانيني الخضراء (ICG)، عامل تباين angiographic إدارة الأغذية والعقاقير المعتمدة. وأظهرت النتائج يبدو أن الإشارات fluorescence في الفئران المعالجة ميكروتيسوي وفي الفئران المعالجة همسكس الحرة6 10. لا يوجد أي إشارة fluorescence واضحا في هيندليمبس الدماغية في الشام أو مجموعة جنرال موتورز حتى يوم 28 (الشكل 4 باء).
وأكدت هذه النتائج كذلك أن يتحقق العلاج همسكس ميكروتيسوي-بمساعدة 3D متفوقة الآثار العلاجية لعلاج مؤشرها الذي يمثل الحد الأدنى الجرعة الفعالة للعلاج يستند إلى الخلية في طراز الماوس حتى الآن.
الفحص سيتوتوكسيسيتي المخدرات الفائق على رقاقة الصفيف ميكروتيسوي 3D
مجموعة ميكروكريوجيل 3D جاهزة للاستخدام للثقافة على رقاقة الخلية يمكن أن تكون ملفقة بسهولة الاحتفاظ ميكروكريوجيلس على رقاقة البولي ميثيل ميثا اكريلات بعد ليوفيليزيشن والجمع بين رقاقة جيدا--الصفيف المقابلة مع أشرطة لاصقة متوافق حيويا (الرقم 1 و الشكل 5A). في هذا الصفيف ثقافة الخلية يتكون من جزئين، رقاقة جيدا--الصفيف أعلى بمثابة خزانات للثقافة المتوسطة، وحلول المخدرات والمقايسة الكواشف، بينما كانت مثقف الخلايا في ميكروكريوجيل 3D معطلة على رقاقة الصفيف السفلي. يسمح شريط لاصق بين رقاقة الصفيف أعلى وأسفل الجيل 384 الآبار الفردية للثقافة الفائق خلية ثلاثية الأبعاد (الشكل 5 (ب))، ومن ثم توفير أداة عملية لاكتشاف المخدرات.
كما ورد في البروتوكول، شكلت الصفيف ميكروتيسوي 3D مباشرة البذر الخلايا في ميكروكريوجيلس قبل إضافة المتوسطة للخزانات. باستخدام الخلايا المسماة RFP المعاهد الوطنية للصحة-3T3، أثبتنا أن الخلايا وزعت في شكل موحد مع طبقات متعددة داخل بنية ثلاثية الأبعاد من ميكروكريوجيلس (الشكل 5، د). وقد أظهرت الصور وزارة شؤون المرأة أن الخلايا التقيد بشدة بجدران المسام ومعارضها حتى فيلوبوديا الممتدة على طول أو عبر الجدران المتاخمة من ماكروبوريس في ميكروكريوجيلس (الشكل 5E).
ثم أننا أظهرت جدوى تطبيق هذا الصفيف ميكروتيسوي 3D لاختبار باستخدام اثنين من خطوط خلايا السرطان ومجمعين للمخدرات الفائق. سرطانه الخلية الكبدية الخلايا (HepG2) تعامل مع ميتوتريكسات بينما عولج خلايا سرطان الرئة الخلية الصغيرة غير (NCI-H460) مع إيملج-8439، مثبط ورم جديد. كانت تدار خمسة إلى تسعة تجمعات منفصلة من كل المخدرات إلى ستة آبار متجاورة ك replicates, مع [دمس] 0.1% في المتوسط الثقافة كعنصر سلبي. وأجرى الإنزيم سيتوتوكسيسيتي المثل للخلايا المزروعة في لوحات متعددة جيدا 2D التقليدية. بعد 24 ساعة حضانة، استخدمت مقايسة بقاء الخلية لتقييم الردود المخدرات من الخلايا في 2D و 3D. تم رسم منحنيات الاستجابة المخدرات استخدام معدلات بقاء الخلية تم تسويتها بتركيزات مختلفة من المخدرات ومن ثم كان محرف IC50 من هذه المنحنيات. قيمة IC50 أعلى تشير إلى أن الخلايا أكثر مقاومة للعقاقير. من 5F الشكل و 5I، لاحظنا زيادة كبيرة في مقاومة المخدرات عندما كان مثقف خلايا صفيف 3D ميكروتيسوي مما في 2D. بلغ IC50 ميتوتريكسات ضد الخلايا HepG2 مكم 165.959، بالنسبة إلى 18.239 شمال البحر الأبيض المتوسط في 2D؛ وبالمثل تم رفع IC50 إيملج-8439 في الخلايا NCI-H460 إلى 331.894 شمال البحر الأبيض المتوسط في 3D بينما تتطلب فقط 1.294 شمال البحر الأبيض المتوسط في 2D. كان هذه المراقبة في التوافق مع تقارير المقاومة للأدوية زيادة في الثقافة 3D على ثقافة 2D الأخرى22،الباحثين23.
نحن تعزى هذه الزيادة في المقاومة للعقاقير إلى تعقيد المكروية 3D مقارنةمستو من تكوين ثقافة 2D. الصور SEM كشفت أن الخلايا HepG2 تجمع الماغنيسيوم تزيين أسطح ماكروبوريس في ميكروكريوجيل. تتجمع هذه الخلايا محكم وهذا التفاعل المعزز خلية-خلية يمكن أن تكون مصدرا لمقاومة المخدرات في HepG222. كما كان من المثير للاهتمام أن نلاحظ أن هذه المجموعات الخلية لم تكن الماغنيسيوم بحرية مع وقف التنفيذ كما أنها لا تزال بعض التصاق للمصفوفة (الشكل 5، ح). على العكس من ذلك، كان تكهن طلائي-الوسيطة-الانتقال (EMT) قد حدثت عندما كان مثقف خلايا سرطان الرئة غير الصغيرة، NCI-H460، في ميكروكريوجيلس ثلاثي الأبعاد. انتشرت H460 نكج الخلايا مثل الخلايا الليفية (الشكل 5 ياء، ك) بدلاً من تجميع مثل HepG2. ومن ثم فإننا تكهن بأن الزيادة في المقاومة للعقاقير يمكن أن تكون نتيجة من انتقالاً خلايا الظهارية NCI-H460 خبيثة أكثر دولة18،19،،من2021،22 ،23.
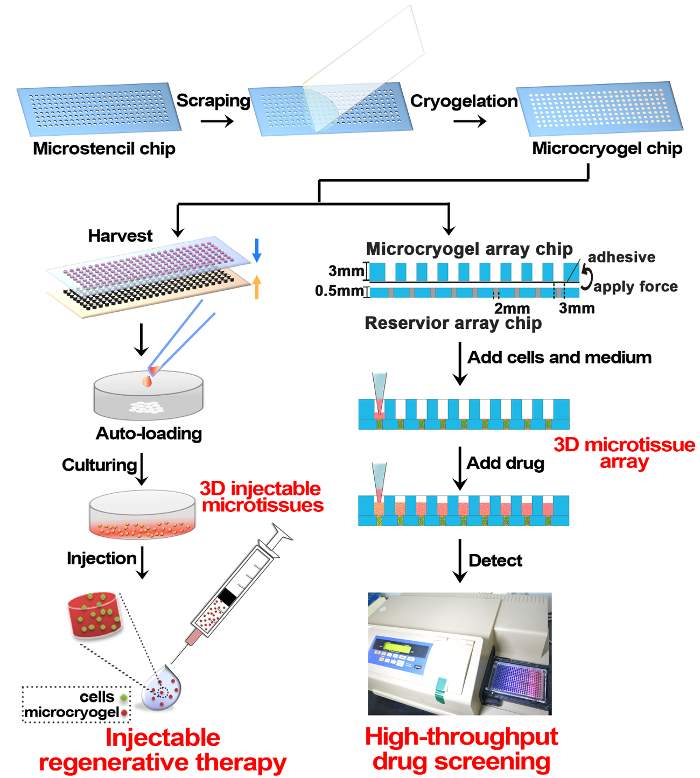
الشكل 1 : التخطيطي تلفيق ميكروتيسوي ثلاثي الأبعاد وتطبيقها في العلاج بالتجدد وفحص المخدرات- باختصار، كانت مختلقة رقاقة ميكروكريوجيل الحجم والشكل يمكن السيطرة عليها على رقاقة إلكترونية البولي ميثيل ميثا اكريلات صفيف قبل كريوجيليشن جيلاتين. رقائق ميكروكريوجيل يمكن حصادها قبالة رقاقة ميكروكريوجيلس الفردية، ويمكن أن يكون ميكروكريوجيلس علاوة على ذلك، كل السيارات محملة بالخلايا ومثقف لتشكيل ميكروتيسويس 3D للعلاج عن طريق الحقن بالتجدد. تطبيق آخر من رقائق ميكروكريوجيل هو تجميع مع شريحة صفيف خزان وثم كذلك، تحميل خلايا والثقافة في صفائف ميكروتيسوي ثلاثية الأبعاد لفحص المخدرات الفائق. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
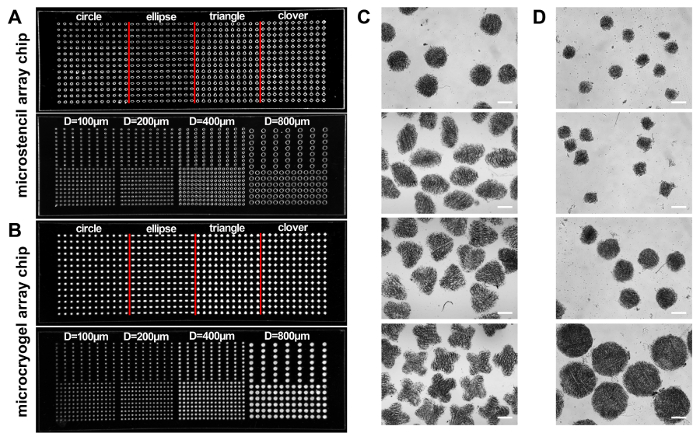
الشكل 2:رقائق مصفوفة ميكروستينسيل- (أ، ب) صفت صوراً لاثنين من رقائق ميكروستينسيل البولي ميثيل ميثا اكريلات التي تحتوي على ميكروويلس بأشكال مختلفة (أيالدائرة والقطع الناقص، والمثلث والبرسيم) والشكل الدائري بأحجام مختلفة (القطر: 100، 200، 400 و 800 ميكرون)، على التوالي (A)، وهما المقابلة ميكروكريوجيل صفيف رقائق (ب). (ج، د) صور مجهرية من ميكروكريوجيلس الفردية التي تحصد من رقائق الصفيف ميكروكريوجيلس اثنين. شريط المقياس = 500 ميكرومتر. لقد تم تعديل هذا الرقم بإذن من المرجع14. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 3 : وصف ميكروتيسويس الحقن 3D- (أ) الصور الفوتوغرافية من حصاد ميكروكريوجيلس. (ب) مسح الصور إلكترون صورة مجهرية (SEM) ميكروكريوجيلس عرض مترابطة والهياكل ماكروبوروس. (ج، د) بناؤها fluorescence مجهرية و 3D صور [كنفوكل] لتحميل همسكس ميكروتيسويس ملطخة بالعيش الموتى ووالرودامين فالويدين. (ﻫ) القياس الكمي همسكس autoloading والانتشار في منطقة الميكونج الكبرى بكثافات مختلفة تحميل الأولى. الحقن في الوقت الحقيقي (و) قوة منحنيات القياس لحقن الثلاثي 1000 منطقة الميكونج الكبرى في 1 مل 15% (wt/المجلد) الجيلاتين حل الحقن بمعدل 1 مل/دقيقة (1,000-1-15%). (ز) لايف/الميت خلية فحص صلاحية لتحميل همسكس ميكروتيسويس الحقن ما قبل وما بعد الحقن. (ح) انتشار همسكس تحميل في منطقة الميكونج الكبرى بعد الحقن بعد أيام 1 و 3 و 5 من الثقافة (n = 3). * ف < ANOVA أحادي الاتجاه 0.05، مقارنة باليوم الأول. وترد البيانات يعني ± sem. لقد تم تعديل هذا الرقم بإذن من المرجع11. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
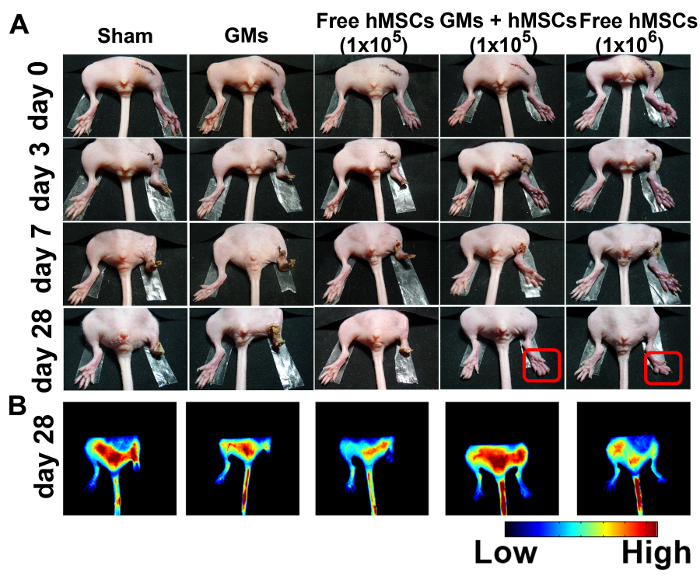
الشكل 4:تحسين إنقاذ وتعزيز الأوعية الدماغية هيندليمبس تعامل مع 3D ميكروتيسويس القابلة للحقن في. صور الممثل (A) من الشام (n = 4)، فارغة ميكروكريوجيلس (ن = 4)، مجاناً همسكس (105) (ن = 8)، همسكس (105)-تحميل ميكروتيسويس (ن = 8)، والحرة همسكس (106) (ن = 4) 0, 3, 7 و 28 يوم بعد العلاج. الصور الفلورية (ب) حصل على 100 s بعد حقن ICG في يوم 28. لقد تم تعديل هذا الرقم بإذن من المرجع11. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 5 : مجموعة ميكروتيسوي 3D لفحص المخدرات الفائق. (أ) صورة فوتوغرافية لمصفوفة 3D ميكروتيسوي في تنسيق 384-multi-جيدا بعد الجمعية العامة، و (ب) ريسازورين خلية جدوى الفحص المنجز في الصفيف. (ج) طلب تقديم العروض-3T3 الخلايا داخل ميكروكريوجيل بعد البذر (شريط المقياس = 200 ميكرومتر). (د) إعادة الإعمار 3D نويات تلطيخ تصور توزيع متجانس للخلايا في طبقات متعددة في ميكروكريوجيل. (ه) صورة صورة مجهرية إلكترون المسح RFP-3T3 الخلايا تنتشر على نطاق واسع في ماكروبوروس الجدران في ميكروكريوجيلس (مقياس بار = 20 ميكرومتر). اختبار سيتوتوكسيسيتي من ميتوتريكسات (F) في HepG2 الخلايا والخلايا (أنا) إيملج-8439 في NCI-H460 في ميكروتيسوي 3D مصفوفة تبين زيادة IC50 مقارنة بنظرائهم في 2D. وترد البيانات يعني ± التنمية المستدامة. (ز) الماغنيسيوم صغيرة من الخلايا HepG2 في ميكروكريوجيل (شريط مقياس = 100 ميكرومتر)، مع الالتزام الجزئي (العلامات النجمية في ح) على الجدار ميكروكريوجيل (شريط مقياس = 20 ميكرومتر). (ي) NCI-H460 الخلايا التقيد بها وانتشرت داخل ميكروكريوجيل (مقياس بار = 100 ميكرومتر). (ك) NCI-H460 الخلايا فيبر العارضةمورفولوجيا أوبلاستيك (مقياس بار = 20 ميكرومتر). لقد تم تعديل هذا الرقم بإذن من المرجع9. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
نماذج التجدد في الطب و في المختبر لفحص المخدرات هي اثنين من التطبيقات الهامة للأنسجة الهندسة5،،من67،،من89. بينما هذه التطبيقات اثنين لديها احتياجات مختلفة إلى حد كبير، وأرضية مشتركة بينهما يكمن في الحاجة المحاكاة البيولوجية أكثر استزراع شرط لتعزيز مهام الخلية19. فقط مع مهام الخلية المحسنة في مجال البحوث يمكن أن نعالج الأمراض أفضل20،21، وإذا كانت الخلايا المستزرعة تعكس الردود المخدرات أكثر دقة يمكن أن نسرع المخدرات اكتشاف6،7. بقاء الخلية بعد انجرافتمينت في فيفو شرط حاسم للطب التجديدي، بينما الإنتاجية هامة لفحص المخدرات للتعامل مع الآلاف من المركبات في وقت واحد. هذه المتطلبات اثنين محددة للتطبيقات الخاصة بكل منها، ونادراً ما يمكن تكنولوجيا واحدة تلبية كل المتطلبات. وهكذا، فريد أدمجنا تكنولوجيا ميكروفابريكيشن مع إعداد كريوجيل لإنتاج ميكروكريوجيلس ماكروبوروس، الذي يمكن أن يكون رقاقة قبالة المقطوع كناقلات تحميل الخلية الفردية للعلاج التجديدي، أو الإبقاء على رقاقة للمزيد الجمعية إلى صفيف لفحص المخدرات الفائق. Microscale وماكروبوروسيتي من هذه ميكروكريوجيلس رواية السماح التلقائي ومتجانسة تحميل الخلايا بامتصاص بسيط. استخدام اختﻻق رواية ميكروستينسيل ميكروكريوجيل مجموعة رقائق، مئات الآلاف من كريوجيلس microscale مع ميزات هندسية موحدة واستنساخه ويمكن بسهولة وكفاءة توليد. يمكن إعداد ميكروكريوجيلس وتخزينها بواسطة الفراغ التغليف كمنتج الجاهزة، وجاهزة للاستعمال لتسهيل إعداد ميكروتيسويس 3D المشتركة مختبرات للطلبات اللاحقة. باستخدام هذا الأسلوب تلفيق، كنا قادرين على تلبية كل من أرضية مشتركة (شرط الثقافة 3D لأفضل بيوميميكري) والمتطلبات المحددة لمختلف التطبيقات اثنين (مرونة لحماية الخلايا أثناء الحقن للطب التجديدي و الفائق في صيغة صفيف لفحص المخدرات).
العلاج يستند إلى الخلية يحمل وعدا كبيرا لإصلاح لمختلف الأنسجة التالفة أو الأجهزة24. الاحتفاظ بالخلية وبقاء الخلية، وإمكانية تكرار نتائج العلاج غير الفقراء لا يزال سبب الأضرار الميكانيكية أثناء الحقن، عالية من التسرب إلى الأنسجة المحيطة بها، والاسكيميه، والتهاب في البيئة في فيفو داخل الآفة 25من الأنسجة. واستخدمت بعض الباحثين بريفورميد المجاميع الخلوية لتحسين حقن الخلية الحرة. ومع ذلك، فإنه يتطلب كمية كبيرة من الخلايا على شكل خلية المجاميع، الأمر الذي يؤدي إلى ارتفاع تكلفة وحجم غير موحدة ولا يمكن السيطرة عليها الأرقام الإجمالية26. وعلاوة على ذلك، الإصابات الميكانيكية وموت الخلية لا مفر منها لا يزال أثناء الحقن. بدلاً من ذلك، تم وضع العلاج بمساعدة مادة بيولوجية الخلية التي تستجيب الحيوية (مثلاً، المائية الحرارية أو حساسة لدرجة الحموضة) يمكن أن تكون مختلطة مع الخلايا وجيلاتيون في الموقع لتحقيق خلية الإبقاء على27. ومع ذلك، الحيوية cross-linked في الموقع لا تسمح فتيلة من الخلايا في المختبر والنتيجة في التعرض الفوري للخلايا المكروية الدماغية والتهابات في موقع الآفة. ومن الملح لحل هذه المشاكل تعزيز الكفاءة العلاجية. ومن مزايا رئيسية ميكروكريوجيلس ملفقة باستخدام هذا البروتوكول هو بهم إينجيكتابيليتي المطلوب نتيجة لحجم المنمنمة ومرونة استثنائية، تيسير تطبيقها في إيصال خلية. تمكن إينجيكتابيليتي ميكروكريوجيلس حماية الخلايا أثناء الولادة الخلية، ومن ثم يمكن تشكيل في 3D ميكروتيسويس القابلة للحقن بعد فتيلة في المختبر من خلايا في ميكروكريوجيل لتعزيز كل البروتين المصفوفة خارج الخلية (ECM) الترسيب، فضلا عن تفاعلات خلية خلية. ميكروتيسويس الحقن 3D يؤدي microscale الأنسجة مثل الفرق يمثل استراتيجية تسليم أمثل لتيسير حماية الخلايا، انجرافتمينت، والبقاء على قيد الحياة، وتحسين الآثار العلاجية في نهاية المطاف في موقع الآفة ومن ثم.
إلى جانب تعزيز الآثار العلاجية للعلاج بالخلايا، كانت النتائج التي توصلنا إليها أيضا يدل على تأثير 3D المكروية في الاستجابات الخلوية المخدرات المعقدة. الاستفادة من شروط الثقافة بيوميميكينج، سيكون من الممكن الحصول على في المختبر ردود المخدرات الخلوية أكثر تمثيلاً في فيفو الاستجابات، ومن ثم التعجيل بالمخدرات اكتشاف6،7، 28. الماغنيسيوم خيار شعبي لتكوين ثقافة خلية ثلاثية الأبعاد وقد تم تطوير العديد من التقنيات لمساعدة الباحثين توليد الماغنيسيوم. كما استخدمت اللاصقة منخفضة زراعة الأنسجة لوحات29 أو لوحة الأسطح التي يتم تعديلها مع بصمات نانو8 لإكراه الخلايا للتجميع عن طريق منع التصاق الخلايا المصفوفة. في حين بسيطة نسبيا لاستخدام هذه التقنيات، هي مشاكل مثل فقدان الماغنيسيوم أثناء تبادل المتوسطة وغيرها من العمليات، فضلا عن تباين حجم الماغنيسيوم المشاكل التي تعوق اعتماد واسع النطاق لهذه التكنولوجيا6. يمكن أن يكون تشكيل الماغنيسيوم أكثر تجانساً باستخدام معلقة قطره30،31،،من3233، إلا أنها كثيفة العمالة إذا لم تكن تستخدم المتخصصة لوحات. استخدام المتخصصة شنقاً إسقاط لوحات متعددة جيدا، وتكامل مع سائل الآلي التعامل مع نظم6،31، يمكن تحقيق الفرز الفائق. والعيب أكبر من ثقافة كروي هو عدم وجود إدارة المحتوى في المؤسسة، التي تم تحديدها لتلعب دوراً حيويا في جميع التطورات الفسيولوجية والمرضية أنسجة34. كشفت دراسة نموذج الدماغ أن الماغنيسيوم مثقف داخل سقالة إدارة المحتوى في المؤسسة، بالمقارنة مع الماغنيسيوم نقية، زادت المقاومة للعقاقير، والمحسن الحماض بسبب ارتفاع إنتاج لاكتات وتحسن الأوعية مع زيادة التعبير عن ذات الصلة 34من العوامل. كما أظهرت دراسات أخرى أن وجود مصفوفة يمكن أن توفر إشارة mechano اللازمة النهوض بالخلاصة EMT ويدعم ميزات الورم مثل الغزو وورم خبيث3،،من3536 , 37.
ومع تزايد فهم أهمية إدارة المحتوى في المؤسسة في التنمية المرضية، لا شك في أن إدماج إدارة المحتوى في المؤسسة في أساليب الثقافة ثلاثي الأبعاد يمكن أن يساعد تقليد في فيفو حالات أفضل6. الهلاميات المائية للمواد الطبيعية أو الاصطناعية التي طبقت على إنشاء عدة في المختبر الورم 3D نماذج لتقييم تشريعات نظراً لما أبدته من مرونة وقابلية التحكم الخصائص الفيزيائية الحيوية (مثل صلابة)38 , 39 , 40 , 41 , 42-وبينما كان الهلاميات المائية مع الخصائص الفيزيائية الانضباطي في الواقع على غرار السمات البيولوجية الهامة للخلايا السرطانية لتسهيل فحص المخدرات أكثر دقة، عدة مساوئ هذا الأسلوب أعاقت استخدامه على نطاق واسع في المخدرات الفحص. كروسلينكينج البوليمرات حضور الخلايا ضروري لتغليف الخلايا ضمن مصفوفة المائية، التي يمكن أن يحتمل أن تلف الخلايا. ليس ذلك فقط، الهلاميات المائية خصائص الفيزيائية الحيوية المختلفة تحديات مختلفة مغلفة داخل الخلايا. في الهلاميات المائية الناعمة، محتوى المياه العالية يمكن أن تدعم نمو الخلايا ولكن هذه الهلاميات المائية تتحلل بسرعة وإعطاء دعم قصير الأجل للثقافة خلية ثلاثية الأبعاد. من ناحية أخرى، الهلاميات المائية أكثر صرامة مع العابرة للربط عالية يمكن أن تبطئ التدهور لكن محتوى المياه المنخفضة يمكن أن لا تدعم نمو الخلايا ويستحث crosslinker عالية التركيز عادة سيتوتوكسيسيت عالية43،ص44. ليس فقط هكذا، إعداد ثقافة خلية ثلاثية الأبعاد مع الهلاميات المائية ذات العمالة الكثيفة وغير متوافق مع معظم السائل الفائق التعامل مع نظم التحكم في درجة الحرارة المائية السلائف الحل مهم ويمكن أن يؤدي إلى التشويش على نصائح الاستغناء عن رقيقة من جيليشن المائية ضمن النصائح. وأدت هذه العيوب وبالتالي البحث عن بديل ECM البدائل، أيإدارة المحتوى المؤسسي القائم على سقالة34.
استخدام السقالات شكلت مسبقاً، يمكن أن تستثني من عملية تصنيع مادة بيولوجية الخلايا وبالتالي توفير إمكانية للمزيد من السيطرة على تصنيع السقالة كما يمكن استخدام أقسى الظروف دون الخوف من إتلاف الخلايا. وأظهرت العديد من التحقيقات أن الخلايا السرطانية المستزرعة في السقالات 3D عرض أعلى مقاومة للأدوية مقارنة مع الخلايا المستزرعة في 2D بسبب زيادة خبيثة و ECM الخلية تعزيز التفاعل45،46، 47. هذه الملاحظات تتسق مع النتائج المعروضة هنا. في أعمالنا الأخرى، أثبتنا كذلك براعة في الصفيف ميكروتيسوي ثلاثية الأبعاد ولها مزايا أكثر من غيرها من التقنيات المذكورة أعلاه. في حديثة العمل وكنا قادرين على تعزيز وظيفة الكبد عن طريق تشجيع النمط الظاهري طلائي الخلايا هيبرج باستزراع في صفيف 3D ميكروتيسوي وطبق هذا الصفيف على المخدرات الكبدي التقييم47. نظراً لتماثل أحجام مسام داخل السقالات ماكروبوروس 3D، كنا قادرين على التحكم في حجم خلية الكبد الماغنيسيوم تندرج في 50-80 ميكرون، بغض النظر عن كثافة البذر الخلية الأولى. وهذا يوفر ميزة كبيرة على مدى حرية تشكيل الماغنيسيوم مع أحجام غير موحدة. ليس فقط القيام الماغنيسيوم تنمو بشكل موحد داخل كل سقالة، الخلايا بين الآبار أيضا شكل موحد المصنف، إعطاء معامل للاختلاف (CV) قابلة للمقارنة مع الخلايا البذر في 2D (أيCV = 0.09 في صفيف 3D ميكروتيسوي والسيرة الذاتية = 0.05 في 2D لوحة تجارية ; البيانات لا تظهر). في عمل آخر، لقد أظهرنا أن كنا قادرين على تشكيل ميكروتومور الكبد في صفيف 3D ميكروتيسوي الخص التفاعلات ورم stromal للفحص للعلاج التوافقي برمجتها ستروما48. ميكروتومورس الكبد تم إنشاؤها بواسطة ثقافة الليفية مع الخلايا السرطانية في الكثافة العالية المشاركة الطويلة الأجل (5 أيام). لاحظنا الحواجز نحو انتشار المخدرات نظراً للخلية المدمجة وهيكل إدارة المحتوى في المؤسسة شكلت في ميكروتومور الكبد، الذي لوحظ كذلك في فيفو32. باستخدام الخلايا السرطانية المسمى لوسيفراس والخلايا اللحمية معبي ميكانيكيا، جنبا إلى جنب مع التﻷلؤ لوسيفرين كقراءة محددة للخلايا السرطانية، فحص العوامل العلاجية رواية أو تركيبات ضد ورم stromal الفائق التفاعل ممكناً.
وعلى الرغم من العديد من المزايا الفريدة لدينا تقنية، عيب ميكروكريوجيلس الحالية عدم الشفافية، التي تعوق المراقبة البصرية مفصلة للخلايا في ميكروكريوجيلس. وتشمل إدخال مزيد من التحسينات على هذه ميكروكريوجيلس صقل تلك الخصائص البصرية لتعزيز تصوير خلايا في ميكروكريوجيلس للمراقبة. أيضا، لم تستكشف الخصائص الفيزيائية الحيوية الهامة مثل الصلابة في أعمالنا التقنية، التي سوف تحتاج إلى معالجة إذا كنا نريد أن تحاكي أفضل الأنسجة الفسيولوجية والمرضية للخصائص الفيزيائية الحيوية المختلفة.
بينما لدينا أسلوب يسمح لتوليد ميكروتيسويس 3D بسيطة، يجب أن تؤخذ بعض التحذيرات للتجارب الناجحة. عندما اختﻻق ميكروكريوجيلس 3D على رقاقة مجموعة ميكروستينسيل، المهم لضمان بقاء المجمدة ميكروكريوجيلس عندما وضعت في ليوفيليزير. ومن ثم من الضروري لتبرد قبل ليوفيليزير ونقل ميكروكريوجيلس من الثلاجة-20 درجة مئوية إلى ليوفيليزير بسرعة. سوف يتسبب ذوبان ميكروكريوجيلس قبل ليوفيليزينج أو أثناء ليوفيليزينج المسام الانهيار ومن ثم تؤثر على التسلل ميكروكريوجيلس ملفقة. عند استزراع ميكروتيسويس 3D في صيغة صفيف، مطلوب الاهتمام لضمان أدهيسيفينيس بين الصفيفين كافياً لمنع التلوث المتبادل بين الآبار. أيضا، بينما التصغير خلية ثقافة ميزته في زيادة الإنتاجية وتقليل استهلاك الكاشف، العيب فيها أن حجم الثقافة منخفضة لا تستطيع تأييد ثقافة خلية طويلة الأجل دون التجديد المتكرر في وسائل الإعلام. ليس فقط لذا، من الأهمية بمكان للحفاظ على رطوبة البيئة الثقافة للحيلولة دون تأثير على بقاء الخلية بسبب التبخر وسائل الإعلام، منذ سوى بضع ميكروليتيرس من تعليق خلية أو يتم إضافة وسائل الإعلام. التبخر سوف تؤثر أيضا على بقاء الخلايا في الآبار الهامشية، ومن ثم من الضروري تجنب استزراع الخلايا في هذه الآبار.
ومع ذلك، لدينا تقنية قوية يوفر خياراً لتوليد ميكروتيسويس ثلاثي الأبعاد بطريقة سهلة الاستخدام، التي يمكن أن تجعل الثقافة 3D أسلوب تلاعب خلية مشتركة لمعظم المختبرات، للتعجيل بالعلوم الأساسية ومتعدية التقدم.
Disclosures
الكتاب ليس لها علاقة بالكشف عن.
Acknowledgements
هذا العمل دعم مالي من "مؤسسة العلوم الطبيعية الوطنية الصينية" (المنح: 81522022، 51461165302). الكتاب تود أن تقر جميع أعضاء مختبر دو للمساعدة العامة.
Materials
| Name | Company | Catalog Number | Comments |
| Gelatin | sigma | G7041 | All other reagents were purchased from Sigma-Aldrich (St. Louis, MO) unless otherwise indicated. |
| Glutaraldehyde | J&K | 902042 | Used as crosslinker in preparation of material. |
| Glass cover slip (24 x 50 mm) | CITOGLASS, China | 10212450C | To scrape prcursor solution onto microstencils array chips. |
| Sodium borohydride, NaBH4 | Beijing Chemical Works | 116-8 | To wash remaining glutaraldehyde away after gelation. |
| Vacuum jar | asperts, China | VC8130 | To preserve microgels under vacuum. |
| Polymethylmethacrylate (PMMA) sheets | Sunjin Electronics Co., Ltd, China | Ordinary PMMA sheets. | |
| Rayjet laser system | Rayjet, Australia | Rayjet 50 C30 | To engrave PMMA sheets to form wells. |
| Plasma Cleaner | Mycro Technologies, USA | PDC-32G | To make PMMA hyphophilic. |
| Lyophilizer | Boyikang, China | SC21CL | To lyophilize materials. |
| Trypan Blue solution (0.4%) | Zhongkekeao, China | DA0065 | To dye microgels. |
| Doxorubicin hydrochloride | ENERGY CHEMICAL, China | A01E0801360010 | To test drug resistance of cells in 2D or 3D microgel. |
| Live/dead assay | Dojindo Molecular Technologies (Kumamoto, Japan) | CS01-10 | To distinguish alive and dead cells. |
| Cell Titer-Blue | Promega (Wisconsin, USA). | G8080 | To test cell viability. |
| Cell strainer | BD Biosciences, USA | 352360 | To collect microgels. |
| D-Luciferin | SYNCHEM (Germany) | s039 | To tack cells. |
| Scanning electron microscope | FEI, USA | Quanta 200 | To characterize microgel morphology. |
| Mechanical testing machine | Bose, USA | 3230 | To measure mechanical features. |
| Programmable syringe pump | World Precision Instruments, USA | ALADINI 1000 | To test injactabiliy. |
| Digital force gauge | HBO, Yueqing Haibao Instrument Co., Ltd., China | H-50 | To test injactabiliy. |
| Ethylene oxide sterilization system | Anprolene, Anderson Sterilization, Inc., Haw River, NC | AN74i | To sterilize microgels with ethylene oxide gas. |
| Microplate reader | Molecular Devices,USA | M5 | To measure fluorescence intensity in micro-array. |
| Confocal microscope | Nikon, Japan | A1Rsi | To observe cell distribution in 3D. |
| Xenogen Lumina II imaging system | Caliper Life Sciences, USA | IVIS | To track cell in animals. |
| Liquid work stataion | Apricot design,USA | S-pipette | To load medium or cell suspension high-throuputly. |
References
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Abbott, A. Cell culture: biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Fischbach, M. A., Bluestone, J. A., Lim, W. A. Cell-based therapeutics: the next pillar of medicine. Sci Transl Med. 5 (179), 179(2013).
- Kuraitis, D., Giordano, C., Ruel, M., Musaro, A., Suuronen, E. J. Exploiting extracellular matrix-stem cell interactions: a review of natural materials for therapeutic muscle regeneration. Biomaterials. 33 (2), 428-443 (2012).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discov Today. 18 (5-6), 240-249 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay Drug Dev Technol. 11 (7), 435-448 (2013).
- Yoshii, Y., et al. High-throughput screening with nanoimprinting 3D culture for efficient drug development by mimicking the tumor environment. Biomaterials. 51, 278-289 (2015).
- Li, X., et al. Micro-scaffold array chip for upgrading cell-based high-throughput drug testing to 3D using benchtop equipment. Lab Chip. 14 (3), 471-481 (2014).
- Qi, C., Yan, X., Huang, C., Melerzanov, A., Du, Y. Biomaterials as carrier, barrier and reactor for cell-based regenerative medicine. Protein Cell. 6 (9), 638-653 (2015).
- Li, Y., et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia. Proc Natl Acad Sci U S A. 111 (37), 13511-13516 (2014).
- Liu, W., et al. Magnetically controllable 3D microtissues based on magnetic microcryogels. Lab Chip. 14 (15), 2614-2625 (2014).
- Zhao, S., Zhao, H., Zhang, X., Li, Y., Du, Y. Off-the-shelf microsponge arrays for facile and efficient construction of miniaturized 3D cellular microenvironments for versatile cell-based assays. Lab Chip. 13 (12), 2350-2358 (2013).
- Liu, W., et al. Microcryogels as injectable 3-D cellular microniches for site-directed and augmented cell delivery. Acta Biomater. 10 (5), 1864-1875 (2014).
- Hakanson, M., et al. Controlled breast cancer microarrays for the deconvolution of cellular multilayering and density effects upon drug responses. PLoS One. 7 (6), e40141(2012).
- Du, Y., et al. Rapid generation of spatially and temporally controllable long-range concentration gradients in a microfluidic device. Lab Chip. 9 (6), 761-767 (2009).
- He, J., et al. Microfluidic synthesis of composite cross-gradient materials for investigating cell-biomaterial interactions. Biotechnol Bioeng. 108 (1), 175-185 (2011).
- Zeng, Y., et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing. Acta Biomater. 25, 291-303 (2015).
- Yang, F., et al. Genetic engineering of human stem cells for enhanced angiogenesis using biodegradable polymeric nanoparticles. Proc Natl Acad Sci U S A. 107 (8), 3317-3322 (2010).
- Zhang, L., et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia. Stroke. 42 (5), 1437-1444 (2011).
- Kinnaird, T., et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms. Circulation. 109 (12), 1543-1549 (2004).
- Fischbach, C., et al. Engineering tumors with 3D scaffolds. Nat Methods. 4 (10), 855-860 (2007).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Gimble, J. M., Guilak, F., Bunnell, B. A. Clinical and preclinical translation of cell-based therapies using adipose tissue-derived cells. Stem Cell Res Ther. 1 (2), (2010).
- Thai, H. M., et al. Implantation of a three-dimensional fibroblast matrix improves left ventricular function and blood flow after acute myocardial infarction. Cell Transplant. 18 (3), 283-295 (2009).
- Moreira Teixeira, L. S., et al. High throughput generated micro-aggregates of chondrocytes stimulate cartilage formation in vitro and in vivo. Eur Cell Mater. 23, 387-399 (2012).
- Ifkovits, J. L., et al. Injectable hydrogel properties influence infarct expansion and extent of postinfarction left ventricular remodeling in an ovine model. Proc Natl Acad Sci U S A. 107 (25), 11507-11512 (2010).
- Murphy, A. R., Laslett, A., O'Brien, C. M., Cameron, N. R. Scaffolds for 3D in vitro culture of neural lineage cells. Acta Biomater. , (2017).
- Cheng, V., et al. High-content analysis of tumour cell invasion in three-dimensional spheroid assays. Oncoscience. 2 (6), 596-606 (2015).
- Huber, J. M., et al. Evaluation of assays for drug efficacy in a three-dimensional model of the lung. J Cancer Res Clin Oncol. 142 (9), 1955-1966 (2016).
- Lamichhane, S. P., et al. Recapitulating epithelial tumor microenvironment in vitro using three dimensional tri-culture of human epithelial, endothelial, and mesenchymal cells. BMC Cancer. 16, 581(2016).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Monjaret, F., et al. Fully Automated One-Step Production of Functional 3D Tumor Spheroids for High-Content Screening. J Lab Autom. 21 (2), 268-280 (2016).
- Shologu, N., et al. Recreating complex pathophysiologies in vitro with extracellular matrix surrogates for anticancer therapeutics screening. Drug Discov Today. 21 (9), 1521-1531 (2016).
- Ho, W. J., et al. Incorporation of multicellular spheroids into 3-D polymeric scaffolds provides an improved tumor model for screening anticancer drugs. Cancer Sci. 101 (12), 2637-2643 (2010).
- Pathak, A., Kumar, S. Independent regulation of tumor cell migration by matrix stiffness and confinement. Proc Natl Acad Sci U S A. 109 (26), 10334-10339 (2012).
- Wei, S. C., et al. Matrix stiffness drives epithelial-mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway. Nat Cell Biol. 17 (5), 678-688 (2015).
- Romero-Lopez, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Xu, X., Sabanayagam, C. R., Harrington, D. A., Farach-Carson, M. C., Jia, X. A hydrogel-based tumor model for the evaluation of nanoparticle-based cancer therapeutics. Biomaterials. 35 (10), 3319-3330 (2014).
- Xu, X., et al. Recreating the tumor microenvironment in a bilayer, hyaluronic acid hydrogel construct for the growth of prostate cancer spheroids. Biomaterials. 33 (35), 9049-9060 (2012).
- Nyga, A., Loizidou, M., Emberton, M., Cheema, U. A novel tissue engineered three-dimensional in vitro colorectal cancer model. Acta Biomater. 9 (8), 7917-7926 (2013).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochem Biophys Res Commun. 433 (3), 327-332 (2013).
- Hoare, T. R., Kohane, D. S. Hydrogels in drug delivery: Progress and challenges. Polymer. 49 (8), 1993-2007 (2008).
- Delgado, L. M., Bayon, Y., Pandit, A., Zeugolis, D. I. To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. Tissue Eng Part B Rev. 21 (3), 298-313 (2015).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In vitro three-dimensional (3D) models in cancer research: an update. Mol Carcinog. 52 (3), 167-182 (2013).
- Zhang, M., Boughton, P., Rose, B., Lee, C. S., Hong, A. M. The use of porous scaffold as a tumor model. Int J Biomater. 2013, 396056(2013).
- Wang, J., et al. Engineering EMT using 3D micro-scaffold to promote hepatic functions for drug hepatotoxicity evaluation. Biomaterials. 91, 11-22 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved