Method Article
주 사용 재생 치료와 높은 처리량 마약 검사에 대 한 3D Microtissues
요약
이 프로토콜 cryogelation 기술로 제작을 통합 하 여 탄력 있는 3D macroporous microcryogels의 제작을 설명 합니다. 재생 치료를 촉진 하기 위하여 쉽게 주입된 비보 수 또는 생체 외에서 높은 처리량 마약 검사에 대 한 배열로 조립 셀 로딩 시 3D microtissues 생성 됩니다.
초록
3D 세포 배양에 전통적인 2D 셀 문화를 업그레이드 하려면 우리 cryogelation 기술로 3D microtissues를 형성 하기 위하여 세포 유형의 다양 한 적재 될 수 있다 macroporous 미 cryogels (microcryogels), 생산 소를 통합 했습니다. 여기, 우리는 다양 한 3D microtissues와 재생 치료와 약물 검사에 응용 프로그램을 조작 하는 프로토콜을 제시. 크기와 모양을 제어할 수 microcryogels 하거나 수 있는 수확된 칩 재생 주사 치료에 대 한 개별 셀 로드 사업자로 조립된 온-칩 높은 처리량에 대 한 3D microtissue 배열에 추가 되는 배열 칩에 날조 될 수 있다 의약품 심사입니다. 높은 탄성의 특성상 이러한 미 cryogels, 3D microtissues 주입 시 기계적 전단 힘에서 세포를 보호 하 여 최소 침 습 세포 치료에 대 한 큰 injectability를 전시 한다. 이 향상 된 세포 생존 및 마우스 사지 허 혈 모델에서 치료 효과 보장합니다. 한편, 3D microtissue 배열 표준 384-멀티-잘 형식에의 높은 처리량 약물이 다양 한 3D 셀 문화 플랫폼에 상영 활성화 일반적인 실험실 시설 및 장비, 사용 용이.
서문
문화 요리 등 다 잘 접시, 일반된 2 차원 (2D) 표면에 전통적인 세포 배양 수 거의 그들의 원시 상태에 가까운 셀 동작을 유도 했다. 다양 한 세포 유형, 세포 외 매트릭스 및 3 차원 (3D) 아키텍처1,2,3 에에서 생리 활성 성 요인의 구성 하는 기본 세포 microenvironments의 정확한 재현 부 4, biomimicking 조직에서을 체 외에서 조직 공학, 재생 의학, 응용 프로그램 생성에 필수적 이다 기본적인 생물학 연구 및 약물 검색5,6,7 ,,89.
2 차원 세포 배양, 대신 3D 세포 배양은 널리 biomimetic 마이크로 건축을 이용 하 고 생체 외에서배양 세포의 기능적 특징. 인기 있는 3 차원 셀 문화 방법은 spheroids7,,89,10로 집계 셀 것 이다. 세포질 spheroids 향상 된 세포 보존 및 분산 된 세포의 주입에 비해 생존 부상된 조직에 주입 수 있습니다. 그러나, 비균일 회전 타원 체 크기와 세포에 주입 하는 동안 유체 전단 힘에 의해 부과 하는 피할 수 없는 기계 부상 이어질 가난한 셀 치료 효과11,,1213. 마찬가지로, spheroids의 집계 하는 동안 고유의 비 균일 그들의 번역을 3D 셀 기반 높은 처리량 마약 도전10상영을 했다.
3D 세포 배양에 대 한 또 다른 방법은 일반적으로 수성 hydrogels 또는 다공성 건설 기계 셀을 캡슐화 바이오의 도움으로 이루어집니다. 그것은 3D 아키텍처를 구축에 더 큰 융통성을 허용 한다. 치료, 세포 대량 건설 기계에는 침략 적 이며 외상, 머리 맡에는 다양 한 번역을 따라서 제한 수술 주입을 통해 동물의 시체에 보통 전달 된다. 다른 한편으로, 수성 hydrogels 제자리에서 겔 화 온도-, 화학 또는 효소 가교11를 통해 수 있도록 동물 시체로 히드로 전조 솔루션에 정지 세포를 주입 하 여 최소 침 습 치료를 사용 합니다. 그러나, 셀 하이드로 겔 선구자 수성 상태에 아직도 있는 하는 동안 전달 됩니다, 그들은 또한 노출 됩니다 기계적 전단에 주입 하는 동안. 만 그리 하이드로 겔의 겔 화 현장에서 중 화학 또는 효소 가교 내 세포에 손상을 부과 또한 수 있습니다. 약물 검사에 대 한 소재를 이용한 세포 배양 균일성, 제어력 및 처리량 문제를 얼굴. Hydrogels 사용 하 여, 세포는 일반적으로 참여 겔 화, 동안는 프로세스 영향을 미칠 수 세포 생존 능력 및 기능. 셀 시드 동안 겔 화 또한 저해 사용 대부분 높은 처리량 장비는 히드로 셀 시드 전에 겔 화를 방지 하기 위해 얼음에 보관 해야 할 수 있기 때문에 히드로 정확도 보장 하기 위해 일반적으로 매우 얇은 분배 팁 잼 수 있습니다. 높은 처리량 심사입니다. 그러나 미리 형성 된 건설 기계 수 잠재적으로 별도 소재 제조 절차 세포 배양에서 가장 비 계 기반 제품은 상대적으로 낮은 처리량14대량 자료로 사용할 수 있습니다.
현재 3D 문화 방법의 단점 들을 극복 하기 위해 상용 하 고 사용자 친화적인 microcryogel 배열 칩15조작 하 소-cryogelation 통합 기술을 개발 했습니다. 이 프로토콜에 젤라틴으로 생체, 분해성, 비용, 추가 수정에 필요한 및 셀 첨부 파일 microcryogel 제조 기법을 예증 선택 합니다. 천연 또는 합성 근원의 다른 고분자 어플리케이션 제작을 위해 사용 될 수 있습니다. 이 기술을 통해 우리는 소형 및 높은 탄력 있는 microcryogels 제어 크기, 모양 및 레이아웃을 조작 수 있습니다. 다양 한 세포 유형으로 로드 될 때 3D microtissues 다양 한 응용 프로그램에 대 한 형성 될 수 있습니다. 이러한 독특한 기능은 가능 원하는 injectability, 셀 보호 및 보존 사이트 감독 주입에서 vivo에서 향상 된 치료 효과 대 한 후 만 그리는 microcryogels 일반적인 실험실 장비 및 다양 한 마약 검사 및 다른 세포질 분석 실험에 대 한 높은-처리량 셀 문화를 실현 하기 위해 악기와 호환 되는 3D microtissue 어레이를 더 처리할 수 수 없습니다. 여기, 우리 microcryogels과 개별 3D microtissues 또는 두 가지 중요 한 응용 프로그램, 세포 치료 및 의약품 심사, 각각10,15 3D microtissue 배열 후 치료의 제작 과정을 자세히 한다 .
프로토콜
동물 실험 동물 윤리 위원회에 센터의 생물 분석, 칭화 대학에 의해 찬성 하는 엄격한 프로토콜을 따 랐 다. 윤리 위원회의 승인 아래 인간 지방 조직에서 환자 동의와 부의 성형 수술의 북경 연합 병원에서 얻은 했다.
1. 3D Microcryogels의 제조
- microstencil 배열 칩의 설계 및 제조
- 디자인 배열 특정 형상, 원 등의 상용 소프트웨어를 사용 하 여 타원, 삼각형 또는 클로버 14, 후속 응용 프로그램에 따라.
참고: 재생 의학에 대 한 프로토콜 섹션 2 참조 하 고 섹션 디자인 세부 사항에 대 한 마약 검사에 대 한 프로토콜의 3. - 는 레이저 레이저 조각 기계를 동반 하는 소프트웨어를 조각으로 디자인을 가져옵니다. 레이저 조각 기계에 대 한 공장 권장 사항에 따라 레이저 설정을 사용 하 여 레이저-오목 폴 리 (methymethacrylate) (PMMA)에 가져온된 디자인 시트.
- 는 Microstencil 배열 칩 레이저 조각에서 청결 한 파편에 이온을 제거 된 물으로 씻는 다. 건조 microstencil 배열 칩 실내 온도에 봉인된 된 봉투에 60 ° c.가 게에서 개월.
- 디자인 배열 특정 형상, 원 등의 상용 소프트웨어를 사용 하 여 타원, 삼각형 또는 클로버 14, 후속 응용 프로그램에 따라.
- Microcryogel 배열 칩의 제조
- 장소 4 microstencil 샘플 쟁반에 칩을 배열 하 고 청소기 플라스마로 삽입. 청소기의 문을 닫고 하 고 2 분 동안 진공 펌프를 켜고 다음 최대 RF 전력 화란 증가를 실 온에서 3 분 동안 플라스마에 microstencil 배열 칩 청소기 치료 (18 승)에.
- 추가 0.06 g 젤라틴 형태로 1 mL 이온된 물 6% (wt/vol) 젤라틴 전조 솔루션 (만들 정도로 5 칩). 따뜻한 물 목욕을 적절 하 게 해산에 60 ° C에서. 5 분 ice에 품 어
- 추가 3 µ L의 0.3%의 최종 농도에 젤라틴 전조 솔루션으로도. 철저 하 게 혼합.
- 피펫은 200 µ L 전조 솔루션 microstencil 어레이 칩의 상부 표면에 글.
참고: 200 µ L 75 m m × 25 m m 칩 디자인에 대 한 충분 하다. 칩의 표면 영역을 증가 하는 경우 금액을 비례 증가. - 수동으로 균등 솔루션 칩에 다시 된다고 하 여 앞뒤로 구부러진된 유리 막대와 2 ~ 3 회.
참고: 각 마이크로-microstencil 칩에 잘 채워질 수 있다 그들의 친수성 특성상 전조 솔루션 플라즈마 처리 후. - 즉시 선구자-솔루션-채워진 어레이 칩 cryogelation에 대 한 16 h-20 ° C 냉장고에 배치.
- 조정 30 분-40 ° C에 lyophilizer 배열 칩은 lyophilizer에서 cryogelation 후 고 진공 상태에서 2 시간에 대 한 배열 칩 lyophilize.
참고: 상호 macropores와 젤라틴 microcryogels는 lyophilizer에서 cryogelation sublimes 동안 얼음 형성 때문에 형성 된다. - 중요 한 사지 허 혈 (CLI)의 처리를 위한 2 섹션 3 높은 처리량 마약 검사에 대 한 섹션을 진행.
2. CLI의 치료에 대 한 개별 Microcryogels 양식을 주사 3D Microtissues 수확
- 수확 개별 microcryogels
- 디자인에 각각 400 µ m 직경, 600 원의 (75 m m × 25 m m) 배열 주 사용 3D microtissue 건설에 대 한 상용 소프트웨어입니다. 에 섹션 1.1 microstencil 어레이 칩의 제작을 위해 300 µ m 두께의 아크릴을 사용 하 여.
- 섹션 1.2에서 microcryogel 배열 칩 조작.
- 단계 2.1.1 표준 소프트 리소 그래피 16 , 하 여 17에서 동일한 디자인을 가진 PDMS 이젝터 핀 배열 조작.
- 오버레이 PDMS 이젝터 핀 배열, 정렬 배열에 이젝터 핀 각 microcryogel 위에 microcryogel 어레이 칩. Microcryogel 배열 칩 개별 microcryogels 수확 PDMS 이젝터 핀 배열에 튀어나온 핀 microwells에서 microcryogels를 밀어 이젝터 핀 배열 쪽으로 누릅니다.
- 물으로는 microcryogel을 수확 하 고 세포 멤브레인의 도움으로 그들을 수집 합니다. 한 스 트레이너를 사용 하 여 하나의 칩 (즉, 600 microcryogels)에서 microcryogels 수집.
- 워시 microcryogels uncross-연결 된 알데하이드 잔류물을 풀기 위해 20 분 동안 얼음에 0.1 m M NaBH 4. 칩 당 0.1 M NaBH 4의 5 mL을 사용 합니다. NaBH 4를 삭제 하 고 각 시간 3 ~ 5 번, 15 분 동안 5 mL 이온을 제거 된 물으로 씻어.
- 셀 여과기에서 물 삭제 및 셀 여과기 당 하나의 클러스터로 microcryogels를 수집 하 고 곡선된 족집게를 사용 하 여 한 35 mm 페 트리 접시에 하나의 클러스터를 배치. 50-70 µ L 이온된 각 클러스터에 물 및 페 트리 접시의 뚜껑을 커버를 추가 합니다. 아무 microcryogels 페 트리 접시의 표면에 microcryogels의 단층을 형성 하는 또 다른 microcryogel 위에 누워 있도록 모든 microcryogels, 밖으로 단계로 탁상에 페 트리 접시를 부드럽게 누릅니다.
- 2 h (단계 1.2.7 참조)에 대 한 그들을 lyophilizing 하기 전에 4 ~ 16 h-20 ° C에서 수확된 microcryogels를 고정 합니다. 추가 사용 때까지 실 온에서 진공 상태에서 microcryogels 저장.
- Microcryogels의
- 전자 현미경 (SEM) 이미지를 스캔 하 여 평가 하는 microcryogels의 숨 구멍.
- Immobilize 더블 측면 접착 테이프와 90 스퍼터 coater 골드와 코트 샘플 홀더에 수확 하 고 동결 건조 된 microcryogels
- s, SEM 11 이미징 하기 전에. 평가 및 이미지 분석 소프트웨어를 사용 하 여 7 다른 SEM 이미지에서 microcryogel에 있는 숨 구멍의 직경의 분포 분석.
- 말린된 젤라틴 microcryogels (GMs)의 무게에 대 한 35 mm 페 트리 접시에 600 동결 건조 된 microcryogels에의 한 클러스터를 무게. 60 µ L 이온된 물 동결 건조 된 microcryogels의 클러스터에 추가 하 고 30까지 기다리는 완전히 물을 흡수 하 고 팽창 하는 microcryogels에 대 한 s. 무게 부 microcryogels.
- 결정 평형 팽 윤 비와 건조 젤라틴 microcryogels과 수 화 microcryogels의 microcryogels에서 개최 물의 무게의 비율을 부 어 microcryogels의 무게의 비율으로 microcryogels의 다공성 각각 13.
- 디지털 힘으로 통합 하는 프로그래밍 가능한 주사기 펌프를 사용 하 여 microcryogels의 측정 injectability 14 게이지.
Trypan에 의해 microcryogels의
- 얼룩 600 조각 블루 그리고 균질 배포를 달성 하기 위해 600 µ L 15% 젤라틴 해결책에서 중단 했다. 1 mL microcryogel 현 탁 액 1 mL 주사기에 로드 합니다. 1 mL/분의 유량에서 프로그래밍 가능한 주사기 펌프를 사용 하 여 1 mL 주사기에 부착 된 27 게이지 바늘을 통해 혼합물을 주사
- 모니터 실시간 주입 힘 디지털 힘에 의해 테스트 게이지 그리고 힘-시간 곡선을 플롯. 주입 후 관찰 현미경 microcryogels의 무결성.
참고: GMs 15% (wt/vol) 젤라틴 솔루션에 원활 하 게 주입 하 고 수 주입 후 그대로 남아.
- Microcryogels의 분해성 특징.
- 먼저, 건조 중량으로 35 mm 페 트리 접시에 600 동결 건조 된 microcryogels에의 한 클러스터의 무게를 측정. 다음, 담가 2 mL 0.025% (vol/vol) 트립 신/EDTA에에서 600 동결 건조 된 microcryogels. 다른 시간 지점에서 셀 스 트레이너를 사용 하 여 솔루션에서
- 수집 microcryogels (즉, 10, 20, 30, 40, 50, 60, 그리고 70 분). 심지는 조직으로 멀리 초과 솔루션. 다른 시간 지점에서 microcryogels의 무게를 측정 하 고 특정 시점 시간 시간 0에서 microcryogel의 microcryogel의 무게의 비율으로 저하도 계산.
- Autoloading 양식 3D microtissues microcryogels로 셀의
- vac에서 12 h degassing 뒤 에틸렌 산화 살 균 시스템 12 h 가스 노출에 의해 단계의 2.1.8 microcryogels 소독uum.
- 는 마우스 허 혈 성 hindlimb의 처리를 위한 인간 지방이 많은 파생 mesenchymal stromal 세포 (hMSCs)을 선택합니다. 다음 절차에 의해 격리 셀 이전 보고 18.
- 성장에 문화 hMSCs 매체 포함 하는 2% 태아 둔감 한 혈 청 (FBS), 10 ng/mL 표 피 성장 인자 (EGF), 10 ng/mL 혈소판 유래 성장 인자 bb (PDGF-bb), 인슐린 처리가 셀레늄 (ITS) X 1, 10 -8 M dexamethasone, 10 -4 M ascorbic 산 2 인산, 100 U/mL 페니실린과 DMEM/F12에서 100 µ g/mL 스. 때 confluent 1: 3의 비율로 셀 통로 다음 실험에 통과 3 ~ 5 셀을 사용 하 여.
- Trypsin으로 hMSCs을 수확 하 고 계량 Fuchs 로젠 탈 세 챔버를 사용 하 여 셀 번호 8 x 10 6 셀/mL hMSCs 성장 매체에서의 밀도를 resuspend.
- 400의 직경이 600 microcryogels의 단층에 피펫으로 60 µ L hMSCs 정지 섹션 2.1에서에서 35 mm 접시에 µ m. 세포는 microcryogels의 다공성 마이크로 구조에 자동으로 흡수 됩니다.
- 습도 챔버에 유지와 연결할 셀 수 있도록 2 h 37 ° C에서 품 어. 외피의 2 시간 후 2 mL 문화 매체를 추가 합니다. 매체 매 2 일 변경. HMSCs 로드 microcryogels 3D microtissues를 2 일 동안 문화.
- 후 2 일 경작, 96 잘 접시에 잘 당 100 hMSCs 로드 microcryogels 플라스틱, resazurin 작업 솔루션 제조 업체에 따라 준비의 120 µ L를 추가 ' 각 우물에 s 명령. 2 h 37 ° c.에 대 한 품 어
590의 560 nm 및 방출 빛 파장의 여기 광 파장 microplate 리더에서 실행 가능한 세포 대사 resazurin의
- 검색 형광 nm. 표준 곡선 보간 키트 프로토콜 13에 따라 미래 실험을 위한 형광 강도에서 휴대폰 번호를 hMSCs를 사용 하 여 형광 대 휴대폰 번호의 설정.
- Resazurin를 사용 하 여 4에 설명 된 대로 단계 4 데 하루 0에서에서 2.3.7 하루 하루 0에서에서 microcryogels에 hMSCs의 수 평가.
- 셀 microcryogels Calcein 오전의 1: 500 희석 및 버퍼링 하는 인산 염 (PBS)에 Propidium 요오드 화물 (라이브/죽은 얼룩으로 알려진)의 1: 250 희석에에서 얼룩 및 형광 현미경 또는 공초점 형광 현미경 관찰.
- 3D microtissues에 vivo에서 CLI 마우스 모델에서의 치료를 위해 주사
- 보고 11 ,로 중요 한 hindlimb 허 혈 여성 BALB/c 누드 마우스의 설정 3D microtissue에 기초를 둔 치료의 치료 효과 결정 하기 위해 19.
- 단계의 2.3.6 5 mL 피 펫을 사용 하 여 셀 스 트레이너에 있는 microtissues를 전송 하 고 문화 매체를 멀리 필터링.
- 100 µ L 솔루션 당 100 microcryogels의 밀도에서 15% 젤라틴 용액에서 hMSCs 로드 3D microtissues resuspend.
- 수술 전에 압력솥에 의해 수술 도구를 소독 하 고 동물 시설 센터에 동물 수술 실에서 수술을 수행.
- 1-3 %isoflurane 적용 건조 방지 하기 위해 마우스의 눈에 리스로 마이 신 1 L/분의 유량에서 100% 산소에서를 포함 하는 마 취 유도 챔버에 마우스를 놓습니다. 1 cm 긴 피부 절 개를 통해 선 대 퇴 동맥 및 그것의 분 지 5-10 실크 봉합 하 고 소비 세 19. 혈액의 흐름을 모니터링 하는
- 넣기 indocyanine 녹색 (ICG) (100 µ g/mL 0.1 mL) 꼬리 정 맥을 통해 주입 ICG 형광 이미징 형광 이미징 시스템을 사용 하 여 수행 (여기, 수 제 시스템) 반사율 형상 11.
- 피하 주입 동맥 절 개 23 게이지 바늘 1 mL 주사기를 사용 하 여 주위 gracilis 근육의 3 개의 사이트 microtissues.
- 수술 후 따뜻하게 마우스 온수 패드와 함께 복구 장에. 통증을 완화 하 고 깨어 때까지 계속 모니터 meloxicam 피하 주사.
- 후 28 일, 형광 이미징 11 여 3D microtissue 치료 다리의 치료 효능을 모니터링.
참고: 마우스 자발적인 사지 절단 때 통증을 완화 하 meloxicam 피하 주사. - 실험의 완료 후 이산화탄소와 Euthanize 쥐.
참고: 여기, 이산화탄소로 안락사 수행 되었다 동물 윤리 위원회에 센터의 생물 분석, 칭화 대학에 의해 찬성 하는 엄격한 프로토콜에 따라.
3. 높은 처리량 마약 검사에 대 한 Microtissue 어레이 칩의 조립
- 칩에 세포 배양에 대 한 microcryogel 배열의 어셈블리
- 수정 섹션 1.1 기존의 멀티 잘 접시 크기에 따라 디자인 즉, 384-멀티-잘 형식에 대 한 디자인 다양 한 16 × 24 웰 스 (행 열), 2 mm 직경 및 4.5 m m 센터-센터 간격의 각.
- 1.1 섹션에 설명 된 대로 500 µ m 두께 PMMA 시트에 레이저는 새긴다.
- Fabricate microcryogels 섹션 1.2 384-멀티-잘 배열 칩에서 얻은 사용에 설명 된 대로 3.1.2 단계. 이 포함 하는 microcryogel 배열 microcryogel 어레이 칩으로 지정 됩니다.
- Microcryogel 어레이 칩을 씻고 50 mL의 0.1 M NaBH 4 어떤 잔여 알데하이드를 끄다 uncross-연결, 다음 반복 해 서 물으로 헹 구 50 mL 이온된 3 회, 2 시간에 대 한 각 시간.
- 물, 4 ~ 16 h-20 ° C에서 microcryogel 어레이 칩 단계 1.2.7 따라 lyophilizing 전에 동결.
- 16 × 24 포함 단계 3.1.1에서에서 수정 384-멀티-잘 배열 디자인 우물, 3 m m 직경 및 4.5 m m 센터-센터 간격의 각.
- 초박형 (10 µ m) 생체 양면 접착 테이프의 시트에서 지지의 한쪽을 제거 하 고 조각 3 mm 두께 PMMA 시트의 1 개의 측에 그것을 붙여. 레이저는 단계의 3.1.4 섹션 1.1에 따라이 3 mm 두께 PMMA 시트에 설계를 새긴다. 이 배열은 저수지 배열로 지정 됩니다.
- 맞춤 microcryogel 배열 저수지 어레이 칩과 칩과 함께 준수 단단히 칩에 세포 배양에 대 한 3D microcryogel 어레이 칩을 조립 하는 것. 1 헤에 대 한 자외선 방사선에 의해 소독
- 저장소 차원 microcryogel 배열을 추가 실험을 위한 실내 온도에서 진공에서 칩.
- 마약 3D microtissue 배열에 상영
- 세포 배양을 위한 습도 챔버로 25 mL 무 균 드 이온된 물으로 젖은 상자를 채우기. 사전 열 습도 5% CO 2 배양 기 37 ° c.
- 비 작은 세포 폐 암 세포 (NCI H460) 및 간세포 암 종 세포 (HepG2) 표준 프로토콜에 따라 조직 배양 배지에서 수확 하 고 다시 10 6 셀/mL x 1.0의 최종 밀도에 문화 미디어 일시 중지. 철저 하 게 혼합.
참고: 10% FBS 100 U/mL 페니실린, 100 µ g/mL 스 RPM1640 NCI H460 사용 됩니다. 10% FBS 100 U/mL 페니실린, 100 µ g/mL 스 HepG2 DMEM 사용. - 는 인큐베이터에서 습도 챔버를 제거합니다. 3.1.9 습도 챔버에 단계에서 신중 하 게 장소 조립된 3D microcryogel 어레이 칩을 핀셋을 사용 합니다. Microcryogels 챔버에 물 젖은 않기로 주의.
- 혼합 세포 현 탁 액 각 우물에 microcryogel에 직접 세포 현 탁 액의 철저 하 게, 다음 aliquot 3 µ L.
참고: 피 펫 팁 해야 가볍게 터치는 microcryogel의 표면 세포 현 탁 액을 추방 하기 전에. 흡수에 의해 microcryogel에 자동 로드 됩니다. 주변 스에서 셀 씨 하지 마십시오. - 각 잘 세포는 96 채널 액체 처리기 같은 다중 채널 피 펫을 사용 하 여 microcryogel으로 시드를 미디어의 추가 10 μ. 매체는 주변 웰 스에도 추가 됩니다.
참고: 사용 RPM1640 미디어와 10 %FBS, 100 U/mL 페니실린 100 µ g/mL streptomyciH460 셀에 대 한 n입니다. 10% FBS 100 U/mL 페니실린, 100 µ g/mL 스 DMEM 미디어를 사용 하 여 HepaG2 셀. - 문화 셀 로드 microcryogel 배열 습도 5%에서 24 h 습도 챔버에 칩 형태로 3D microtissue 배열에 37 ° C에서 CO 2 인큐베이터.
- 분해 독 소 루비 그리고 IMMLG-8439 9 디 메 틸 sulfoxide 10 m m 재고 솔루션 (DMSO). 2에서 10 희석 농도 기온 변화도를 문화 매체와 약물을 희석 nM ~ 200 µ M.
- 각 마약 솔루션의 추가 10 µ L 음. (중간에 희석) 0.1 %DMSO 사용 하 여 제어. 습도 5%에서 약물 로드 3D microtissue 배열 품 어 24 h. 위해 37 ° C에서 CO 2 인큐베이터
- 각 잘 resazurin 재고 솔루션의 추가 4 µ L. 2 헤 장소 3D microtissue 배열 microplate 리더에서 37 ° C에서 품 어와 590의 560 nm 및 방출 빛 파장의 여기 광 파장에서 실행 가능한 세포 대사 resazurin의 형광을 검출 nm.
- 추가 데이터 처리 하기 전에 모든 우물에서 resazurin 기준 신호를 뺍니다. 제어 우물의 평균 형광 신호에 의해 형광 신호를 분할 하 여 각의 세포 생존 분수 계산.
- Y 축과 x 축으로 약물 농도의 밑수 10으로 세포 생존 분수와 함께 그리기 소프트웨어에 복용량 응답 곡선을 플롯. 0.5의 세포 생존 능력 부분에서 50% 금지 농도 (IC50) 보간.
결과
제조 그리고 3D microtissue 형성에 대 한 microcryogels의 특성.
이 프로토콜에 따라 microcryogels 형태로 3D microtissues 및 개별 microcryogels 또는 microcryogel 배열 조작 했다 고 재생 치료와 약물 검사, 각각 (그림 1)에 적용 했다. Microstencil 배열 칩 PMMA에서 조작 microcryogel 어레이 칩에 대 한 micromolds로 적용 되었다. 가변 기하학적 디자인 microstencil 어레이 칩에 대 한 준비 수 있습니다. 우리는 예를 들어, (즉, 원, 타원, 삼각형 및 클로버) 다양 한 형태와 다양 한 크기와 원형 microstencil 어레이 칩 포함 대표 45 x 14 mm microstencil 어레이 칩 선택 (직경 = 100, 200, 400, 800 µ m). 배열 칩에 micromolds의 가시성을 향상 시키기 위해, 빛 피 조명 이미지 (그림 2A, B)을 관찰 했다. Microcryogels 배열 칩에서 수확 전시 원하는 모양과 크기 (그림 2C, D). 원하는 기하학적 기능 같은 microcryogels 가능 하 게 템플릿으로 기본 조직의 특정 아키텍처를 모방 하는 다른 세포 단위를 적용할 수 있습니다. 수확된 GMs (젤라틴 microcryogels) 미리 정의 된 모양과 크기 (그림 3A) 했다. SEM 관찰 설명 microcryogels (그림 3B) 30-80 µ m의 범위에 있는 기 공 크기와 상호 macroporous 구조를 포함 했다.
향상 된 허 혈 성 다리 구조에 대 한 microtissues hMSCs 로드의 향상 된 injectability
디지털 포스 게이지14통합 프로그래밍 가능한 주사기 펌프를 사용 하 여, GMs의 injectability를 양적으로 평가. 1 mL/min의 유량에 mL 당 1000 microcryogels의 밀도와 GMs 10 N20 (그림 3 층)의 임상적으로 허용 가능한 힘 보다 낮은 N 6은 주입 했다. GMs를 설정한 셀 보호 기준, GMs에 hMSCs 높은 생존 했다 하 고 문화 (그림 3 H)의 5 일 동안 주사 후 큰 증식 능력을 유지.
마우스 사지 허 혈 모델 주사 hMSC 로드 microtissues의 치료 효능을 평가 하기 위해 선정 되었다. 허 혈 성 사지의 생리 상태 (그림 4A) 수술 후 28 일 시험 되었다. 아니 사지 인양 가짜 그룹 또는 GMs 제어 그룹에서 관찰 되었다. 105 무료 셀 처리 그룹에서 50% 총 발가락 절단, 25% 부분 발가락 절단, 그리고 25% 부분 사지 절단 관찰 되었다 7 일 이내 80% 사지 손실 및 28 일 후 20% 총 발가락 절단의 결과로. 105 hMSCs microtissues 치료 향상 된 다리 구조 (75%)를 달성 하는 반면,만 25% 마우스 보여 자발적인 발가락 절단 후 28 일. 106 hMSCs, 대부분의 이전 연구에서 사용 되는 최소 효과적인 셀 번호 했다 긍정적인 통제21선정. 4 쥐의 유일한 2 사지 인양, 보여주지만 모든 부 괴 사를 했다.
혈액 관류 모니터링 되었고 indocyanine 녹색 (ICG), FDA 승인 angiographic 대조 대리인의 원조에서 평가. 결과 형광 신호 microtissue 치료 쥐 및 106 무료 hMSCs 치료 쥐 등장 했다. (그림 4B) 28 일까 분명 형광 신호가 가짜 또는 GM 그룹에 허 혈 성 hindlimbs에 있다.
이러한 결과 추가 3D microtissue 기반 hMSCs 치료 까지는 마우스 모델에서 셀 기반 치료에 대 한 최소 효과적인 복용량을 나타내는 CLI 치료에 대 한 우수한 치료 효과 달성 확인.
3D microtissue 어레이 칩에 높은 처리량 약물 세포 독성 검사
온 칩 세포 배양에 대 한 준비-사용 3D microcryogel 배열 동결은 후 PMMA 칩에 microcryogels를 유지 하 고 생체 접착제 테이프 (그림 1 해당 잘 어레이 칩과 결합 하 여 쉽게 조작 될 수 있습니다. 및 그림 5A). 이 두 부분 셀 문화 배열에서 최고 잘 배열 칩 셀 아래쪽 어레이 칩에 움직일 3D microcryogel에서 경작 했다 하는 동안 문화 매체, 마약 솔루션 및 분석 실험 시 약에 대 한 저수지로 제공 됩니다. 위쪽 및 아래쪽 어레이 칩 사이 접착 테이프 세대 약물 발견에 대 한 실질적인 도구를 제공 따라서 높은 처리량 3D 세포 배양 (그림 5B), 대 한 384 개별 우물의 허용.
프로토콜에 설명 된 대로 3D microtissue 배열은 직접 microcryogels에 저수지에 매체를 추가 하기 전에 셀을 뿌리기에 의해 형성 되었다. RFP 표시 NIH-3T3 세포를 사용 하 여, 우리는 셀 microcryogels (그림 5C, D)의 3D 아키텍처 내에서 여러 층으로 균일 하 게 배포 했다 설명 했다. SEM 이미지 셀 숨 구멍의 벽에 단단히 부착 하 고도 확장된 filopodia 따라 또는 microcryogels (그림 5E)에 macropores의 인접 벽에 걸쳐 전시 보였다.
우리는 다음 두 암 세포 선 및 2 개의 화합물을 사용 하 여 테스트 처리량이 높은 약물이 3D microtissue 배열을 적용의 타당성을 보였다. 비 작은 세포 폐 암 세포 (NCI H460) IMMLG-8439, 새로운 종양 억제제로 치료 했다 하는 동안 간세포 암 종 세포 (HepG2) 독 소 루비와 함께 치료 했다. 각 약물의 5 ~ 9 개별 농도 6 인접 한 웰 스에 부정적인 컨트롤로 문화 매체에 0.1 %DMSO 복제로 관리 되었다. 세포 독성 분석 결과 마찬가지로 전통적인 2D 다중 잘 접시에 배양 세포에 대 한 수행 했습니다. 외피의 24 h 후 세포 생존 능력 분석 실험 모두 2D 및 3D에서 셀의 약 응답을 평가 하기 위해 사용 되었다. 마약 응답 곡선이 다른 약물 농도에서 정규화 된 세포 생존 율을 사용 하 여 플롯 했다 그리고는 IC50 다음 이러한 곡선에서 보간 되었다. 높은 IC50 값 셀은 약물 저항을 나타내는 것 이다. 그림 5 층 및 5I, 관찰 크게 증가 약물 저항에 셀 2d에서 보다 3D microtissue 배열에 교양 있었다 때 합니다. HepG2 세포에 대 한 독 소 루비의 IC50 도달 165.959 µ M, 18.239 기준으로 2D;에 nM IC50의 IMMLG-8439 NCI H460 셀에는 상승 된 마찬가지로 331.894만 1.294 요구 하면서 3d에서 nM 2D에 nM. 이러한 관찰 다른 연구원 은22,232D 문화 3D 문화에서 증가 약물 저항의 보고서와 일치에 있었다.
우리에 비해 3D microenvironment의 복잡성에 마약 저항에 같은 증가 때문 이라고는평면 구성의 2D 문화입니다. SEM 이미지 HepG2 세포 spheroids는 microcryogel에 macropores의 표면 장식으로 모여 밝혔다. 이 셀 클러스터 단단히 고 같은 향상 된 셀 상호 작용 HepG222에서 약물 저항의 원천이 될 수 있습니다. 또한 재미는 이러한 셀 클러스터 되지 않은 자유롭게 중단된 spheroids 그들은 여전히 몇 가지 접착 (그림 5G, H)를 유지 했다. 반대로, 상피-중간 엽-전환 (응급) 비 작은 폐 암 세포, NCI H460, 3D microcryogels에 교양 있었다 때 발생 한 것으로 추측 했다. NCJ H460 세포 섬유 아 세포 (그림 5J, K) HepG2 처럼 클러스터링 하는 대신 같은 밖으로 퍼졌다. 따라서, 우리는 약물 저항 증가는 더 악성 상태18,,1920,21,22 NCI H460 상피 세포의 전환에서 결과 수 추측 ,23.
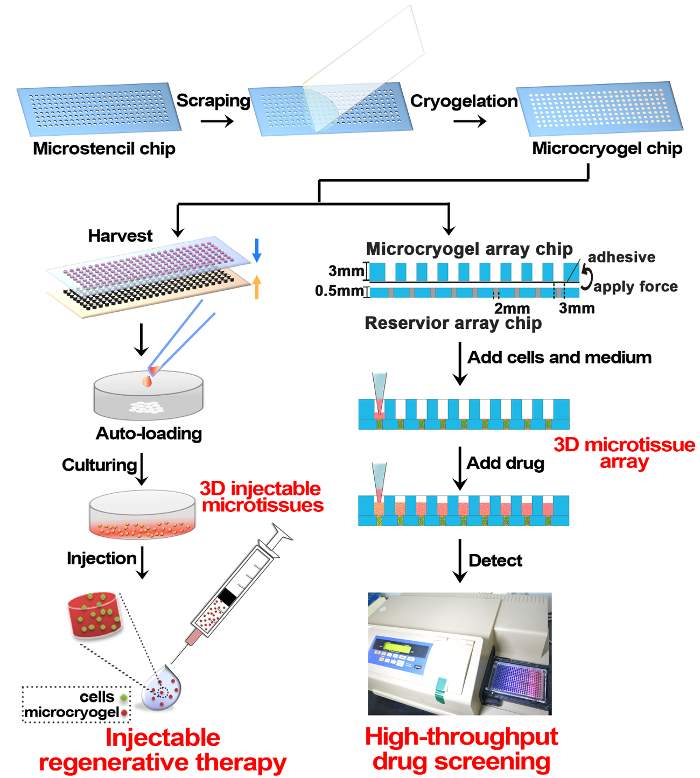
그림 1 : 3D Microtissue 제조 및 재생 치료와 약물 검사에 응용 프로그램의 도식. 간단히, 크기와 모양을 제어할 수 있는 microcryogel 칩 어레이 PMMA 칩에 젤라틴의 cryogelation에 의해 조작 되었다. Microcryogel 칩 수확된 칩 개별 microcryogels로 수 있으며 추가, 개별 microcryogels 셀 자동 로드 및 재생 주사 치료에 대 한 3D microtissues를 경작 될 수 있습니다. 저수지 배열 칩 조립 및 다음 추가, 로드 셀 문화 높은 처리량 마약 검사에 대 한 3D microtissue 배열에 microcryogel 칩의 다른 응용 프로그램이입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
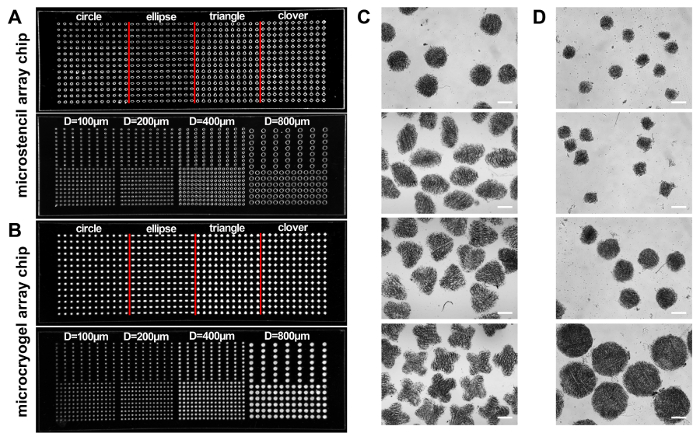
그림 2:Microstencil 배열 칩. (A, B) 포함 된 두 개의 PMMA microstencil 칩의 사진 배열 (즉, 원, 타원, 삼각형 및 클로버) 다른 모양 및 크기 여러가지 원형 모양으로 microwells (직경: 100, 200, 400, 800 µ m), 각각 (A), 그리고 두 개의 해당 microcryogel 배열 칩 (B). (C, D) 개별 microcryogels 2 microcryogels 배열 칩에서 수확의 현미경 이미지. 눈금 막대 = 500 µ m. 이 그림은 허가 기준14에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3 : 3D 주사 Microtissues의. 수확된 microcryogels의 (A) 사진. (B) microcryogels 상호 보여주는 macroporous의 전자 현미경 사진 (SEM) 이미지 스캔. (C, D) 형광 현미경과 3D 재구성 hMSCs 로드 microtissues 라이브/죽은 및 rhodamine 스테인드의 공초점 이미지 phalloidin. HMSCs 자동 로딩 및 다른 초기 로드 밀도와 GMs에 확산 (E) 정량화. (F) 실시간 주입 강제로 1000의 트리플 주사에 대 한 측정 곡선 1 mL/min 주입 속도 (1000-1-15%)에서 15% (wt/vol) 젤라틴 용액 1 mL에 GMs. (G) 라이브/죽은 세포 생존 능력 분석 결과 hMSCs 로드 microtissues 사전 주입 및 포스트 주입의. HMSCs의 (H) 확산 로드 문화의 1, 3, 그리고 5 일 후 GMs 포스트 주입 (n = 3). * p < 0.05, 일방통행 ANOVA 하루 1에 비해. 데이터는 ± SEM.를 의미 하는 대로 표시 됩니다. 이 그림은 참조11에서 허가로 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
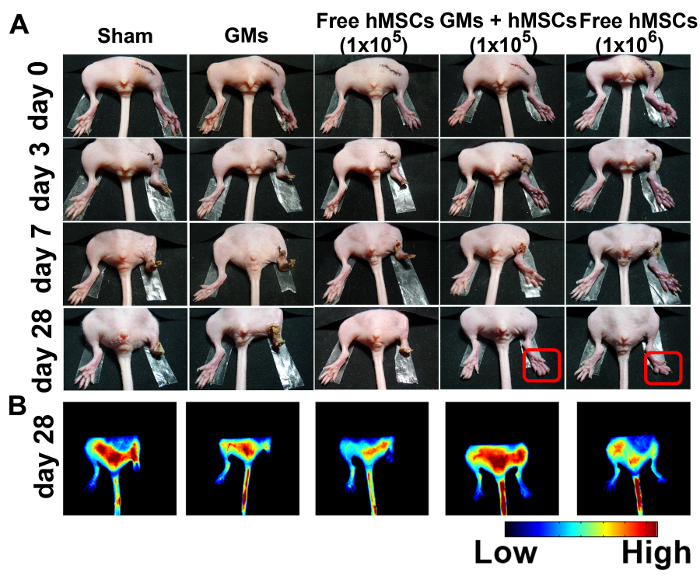
그림 4:구조를 개선 하 고 향상 된 3D 주사 Microtissues로 치료 하는 허 혈 성 Hindlimbs에 신생. 가짜의 대표 사진 (A) (n = 4), 빈 microcryogels (n = 4), hMSCs 무료 (105) (n = 8), hMSCs (105)-로드 microtissues (n = 8), hMSCs 무료 (106) (n = 4) 0, 3, 7, 및 28 일 치료 후에. (B) 형광 이미지 획득된 100 일 28에 ICG 주입 후 s. 이 그림은 참조11에서 허가로 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5 : 높은 처리량 마약 검사에 대 한 3D Microtissue 배열. 384-멀티-잘 형식 어셈블리, 그리고 (B) resazurin 세포 생존 능력 분석 실험 배열에 수행 후 3D microtissue 배열 (A) 사진. (C) RFP-3T3 세포 내 microcryogel 후 시드 (눈금 막대 = 200 µ m). (D) 핵 microcryogel 멀티 레이어 셀의 균일 분포를 묘사한 얼룩의 3D 개조. (E) macroporous에 광범위 하 게 확산 하는 RFP 3T3 세포의 스캐닝 전자 현미경 사진 이미지 microcryogels에 벽 (눈금 막대 = 20 µ m). (F) 독 소 루비 HepG2 세포 및 (나) IMMLG-8439 NCI H460에 보여주는 3D microtissue 배열에 있는 셀의 세포 독성 테스트 IC50 2D 그들의 대조 물에 비교 증가. 의미 ± sd (G). 작은 spheroids microcryogel HepG2 세포의 데이터 표시 됩니다 (눈금 막대 = 100 µ m), ( H에 별표) microcryogel 벽에 부분 준수와 (눈금 막대 = 20 µ m). (J) NCI H460 세포 준수와 microcryogel 내에서 확산 (눈금 막대 = 100 µ m). (K) NCI H460 세포 전시 fibroblastic 형태학 (눈금 막대 = 20 µ m). 이 그림은 참조9에서 허가로 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
마약 검사에 대 한 재생 의학 및 생체 외에서 모델은 조직 공학5,6,7,,89에 대 한 두 가지 중요 한 응용 프로그램입니다. 이러한 두 응용 프로그램을가지고 있지만 다른 요구, 그들 사이의 공통 분모를 셀 기능19를 향상 시키기 위해 더 많은 biomimetic 경작 조건에 대 한 필요에 있다. 만 향상 된 세포 기능 연구에서 질병 더 나은20,21, 취급 수와 배양된 세포 약물 응답 더 정확 하 게 반영 하는 경우 우리가 마약 발견6,7을 가속화할 수 있습니다. 처리량은 화합물의 수천 핸들 한 번에 마약 차단에 대 한 중요 한 후 engraftment에 vivo에서 세포 생존은 재생 의학에 대 한 중요 한 요건 이다. 이러한 두 가지 요구 사항을 그들의 각각 응용 프로그램에 관련 되며 드물게 하나의 기술 모두 요구 사항을 충족 수 있습니다. 따라서, 우리는 유일 하 게 통합 제작 기술 cryogel 준비 macroporous microcryogels, 재생 치료에 대 한 개별 셀 로드 사업자로 수확된 오프 칩 수 또는 유지에 대 한 칩에 추가 생산 높은 처리량 마약 검사에 대 한 배열에 조립. 미 고이 소설 microcryogels의 macroporosity 자동 균질 간단한 흡수 하 여 세포의 로드 허용 합니다. Microcryogel 배열 칩의 소설 microstencil 제작에 사용 하 여, 균일 하 고 재현성 기하학적 기능 미 cryogels의 수백 그리고 수천 수 쉽고 효율적으로 생성. microcryogels 준비 하 고 실험실 후속 응용 프로그램에 대 한 일반적인 3D microtissues의 준비를 용이 하 게 하는 상용, 준비-사용 제품으로 포장 진공에 의해 저장 된 수 있습니다. 이 제조 기술을 사용 하 여, 우리는 공통 분모 (더 나은 biomimicry 3D 문화 조건) 및 두 개의 서로 다른 응용 프로그램에 대 한 특정 요구 사항에 맞게 수 있었다 (탄력 재생 의학에 대 한 주입 동안 세포를 보호 하 고 높은-약물 검사에 대 한 배열 형태로 처리량).
세포 기반 치료 다양 한 손상 된 조직이 나 장기24의 수리에 대 한 위대한 약속을 보유 하고있다. 그러나, 세포 보존, 세포 생존, 그리고 치료의 재현성은 여전히 기계적 손상 불량 주입, 주변 조직, 그리고 허 혈 및 염증 병 변 내에서 vivo에서 환경에서 높은 누설 시 조직25. 일부 연구 자들은 무료 세포 주입을 개선 하기 위해 미리 형성한 세포 집계를 사용 했습니다. 그러나, 많은 양의 셀 폼 셀 집계, 높은 비용, 비균일 크기, 그리고 지나치게 집계 숫자26에 이르게 필요 합니다. 또한, 기계적 손상 및 세포 죽음 아직도 불가피 하다 주입 하는 동안. 또는, 소재를 이용한 세포 치료는 반응 생체 재료 (예를 들어, 열 또는 pH에 민감한 히드로) 섞일 수 있다 세포와 겔 화에서 현장에서 셀 보존27을 실현 하기 위해 개발 되었습니다. 그러나, 제자리에서 복사해올된 생체는 병 변 사이트에서 허 혈 성 및 염증 성 microenvironment 셀의 즉각적인 노출에 못쓰게 세포에 생체 외에서 그리고 결과의 허용 하지 않습니다. 그것은 치료 효율을 향상 시키기 위해 이러한 문제를 해결 하기 위해 긴급입니다. 이 프로토콜을 사용 하 여 조작 하는 microcryogels의 주요 이점은 그들의 소형된 크기와 뛰어난 신축성, 세포 전달에서 응용 프로그램을 용이 하 게 그들의 원하는 injectability 이다. Microcryogels의 injectability 세포 전달 중 셀 보호, 따라서 그들은 수 구성 될 3D 주사 microtissues로 두 세포 외 기질 (ECM) 단백질을 강화 하는 microcryogel에 있는 세포의 생체 외에서 못쓰게 후 세포 세포 상호 작용 뿐만 아니라 증 착입니다. 3D 주사 microtissues 미 조직 같은 앙상블 셀 보호, engraftment, 생존, 촉진 하는 최적의 배달 전략을 나타내는 고 따라서 병 변 사이트에서 궁극적인 치료 효과 향상.
세포 치료에 대 한 향상 된 치료 효과, 게다가 우리의 결과 세포 약물 반응에 3D microenvironment의 복잡 한 영향을 나타내는 했다. Biomimicking 문화 조건에 활용 하 여, 그것 이끌어내는 응답이 더 비보에 응답, 따라서 약물 발견6,7, 가속의 대표적인 세포 약물 생체 외에서 수 있을 것 이다 28. Spheroids은 3 차원 셀 문화 구성의 대중적인 선택 및 많은 기술이 개발 되어 지원 연구원 생성 spheroids. 낮은 접착제 조직 문화 접시29 또는 격판덮개 표면 나노 인쇄물8 수정 했다 또한 세포를 강제 하는 데 사용 됩니다 세포-매트릭스 접착을 방지 하 여 집계를. 이러한 기술을 사용 하는 비교적 간단한 동안, 매체 교환 및 다른 작업 하는 동안 spheroids의 손실 뿐만 아니라 spheroids의 크기 가변성 문제 같은 기술6의 대규모 채용을 방해 하는 문제가 있습니다. 그러나 더 균질 spheroids 교수형을 사용 하 여 형성 될 수 있는 드롭30,31,,3233, 플레이트 전문 그것은 노동 집약적인 사용 하지 않는 경우. 다 잘 걸려 드롭 접시, 그리고 자동 액체 처리 시스템6,31통합 전문 사용 하 여, 높은 처리량 검열을 실현 될 수 있는. 회전 타원 체 문화의 가장 큰 단점은 모든 생리 적 및 병 적인 조직 개발34에 중요 한 역할을 발견 되었습니다 ECM의 부족 이다. 뇌 모델 연구가 밝혔다 spheroids 비교 순수 spheroids ECM 발판 안에 경작 했다 약물 저항 증가, 증 때문에 높은 젖 산 생산을 향상 개선 식 관련의 증가 함께 신생 34요인. 다른 연구는 또한 매트릭스의 존재 필요 메카노 내 습 및 전이3,,3536 같은 종양 기능 응급 및 재현 부 홍보 신호 제공할 수 나타났습니다. , 37.
병 적인 개발에 ECM의 중요성의 이해를 증가 함께 3D 문화 방법으로 ECM 통합 도울 수 있는 비보에 상황 더 나은6모방 의심의 여지가 있다. 천연 또는 합성 재료의 Hydrogels 여러 생체 외에서 3D 종양 모델에 대 한 그들의 유연성으로 인해 chemotherapeutics의 평가 생물 속성 (예: 강성)38 의 제어를 생성에 적용 된 , 39 , 40 , 41 , 42. 가변 생물 속성 hydrogels 더 정확한 약물 검사를 촉진 하기 위하여 종양 세포의 중요 한 생물 학적 기능 모델링 실제로 했다,이 방법의 몇 가지 단점이 약에 그것의 광범위 한 사용 방해는 심사입니다. 셀 존재 고분자의 가교는 세포를 손상 될 수 있습니다 잠재적으로 히드로 매트릭스 내에서 셀을 캡슐화 하는 데 필요한. 만 그리 다른 생물 속성의 hydrogels 캡슐화 하는 셀에 다른 도전을 제시. 부드러운 hydrogels 높은 함량 세포 성장을 지원할 수 하지만 이러한 hydrogels 3D 세포 배양에 대 한 단기 지원 주는 신속 하 게 저하. 다른 한편으로, 높은 cross-linking와 엄격한 hydrogels 수 저하를 천천히 하지만 낮은 함량 세포의 성장을 지원 하지 수 및 높은 crosslinker 농도 일반적으로 높은 cytotoxicit를 유도y43,44. 뿐만 아니라, 많은 hydrogels와 3D 세포 배양을 준비 하 고 히드로 전조 솔루션의 온도 제어는 중요 하 고 얇은 분배 팁의 방해 될 수 있습니다 시스템을 처리 하는 대부분 높은 처리량 액체와 호환 되지 않습니다. 팁 내 하이드로 겔의 겔 화. 이러한 단점에 대체 ECM 대리 모 알선, 즉, 비 계 기반 ECM34에 대 한 검색 따라서 라는 메시지가 있다.
미리 형성 된 건설 기계를 사용 하 여 셀 소재 제조 공정에서 제외 될 수 하 고 따라서 세포 손상의 두려움 없이 엄격한 조건에 사용 될 수 제어할 비 계 제조에 대 한 가능성을 제공 합니다. 여러 조사 3D 건설 기계에 경작 하는 종양 세포 증가 악성 및 향상 된 세포-ECM 상호 작용45,46, 2D에서 경작 하는 세포에 비해 더 높은 약물 저항 표시 나타났습니다 47. 이러한 관측은 여기 우리의 결과와 일치. 우리의 다른 작품에서 우리가 더 3D microtissue 배열 및 위에서 언급 한 다른 기술에 그것의 이점의 다양성을 증명 하고있다. 최근 일, 우리 HepaRG 세포의 상피 형 3D microtissue 배열에 배양 하 여 홍보 하 여 간 기능을 향상 시킬 수 있었고 같은 배열 마약 hepatotoxicity 평가47에 적용 되었다. 3D macroporous 건설 기계 내의 기 공 크기의 균일성, 때문에 초기 셀 시드 밀도에 50-80 μ m 내에서을 간 셀 spheroids의 크기를 제어할 수 있었습니다. 이 무료-형성에 중요 한 이점을 제공 한다 비 균일 크기와 spheroids. 뿐만 아니라 할 spheroids 각 비 계 내에서 균일 하 게 성장, 우물 사이 세포는 또한 균일 하 게 시드 주는 계수의 편차 (CV) 세포 차원에서 시드 대 등 (즉, 이력서 3D microtissue 배열에 이력서 0.09 = = 2D 상업 플레이트에 0.05 ; 데이터에 표시 되지 않음)입니다. 다른 작품에서 우리는 기질 재설정 조합 치료48의 심사에 대 한 종양 stromal 상호 작용을 정리를 3D microtissue 배열에 간 microtumor 형성 수 있었습니다 증명 하고있다. 간 microtumors 높은 밀도에서 종양 세포와 섬유 아 세포의 장기 (5 일) 공동 문화에 의해 생성 했다. 소형 셀과 마찬가지로 vivo에서32를 관찰 했다 간 microtumor에 형성 하는 ECM 구조 마약 확산으로 장벽을 관찰 합니다. Luciferase 표시 된 암 세포와 기계적으로 액 stromal 세포, 암 세포에 대 한 특정 읽기로 소의 발광과 함께 사용 하 여 높은 처리량의 비 발한 치료 대리인 또는 조합 stromal 종양에 대 한 심사 상호 작용 하는 것이 가능은 합니다.
우리의 기술의 많은 독특한 장점에도 불구 하 고 현재 microcryogels의 결점은 비-투명도, microcryogels 셀의 상세한 광학 관측을 방해. 이 microcryogels에 대 한 추가 개선 관찰에 대 한 microcryogels 셀의 이미지를 향상 시키기 위해 그들의 광학 속성을 미세 조정 포함 됩니다. 또한, 강성 등 중요 한 생물 속성 있다 하지 만약 우리가 더 나은 다른 생물 속성의 생리 및 병 적인 조직을 모방 해결 되어야 할 것 이다 우리의 기술에서 탐험 되었습니다.
3D microtissues의 간단한 세대 우리의 기술을 사용 하면, 성공적인 실험에 대 한 몇 가지 주의 기울여야 합니다. Microstencil 배열 칩에 3D microcryogels, 조작 하는 경우는 microcryogels는 lyophilizer에 배치 하는 경우 냉동 유지 되도록 중요 하다. 따라서 사전에 lyophilizer를 냉각 하 고 microcryogels에서-20 ° C 냉장고는 lyophilizer 신속 하 게 전송 필수적 이다. 전에 lyophilizing 또는 lyophilizing 중 microcryogels의 녹는 모 공 축소 및 따라서 microcryogels 조작의 다공성에 영향을 일으킬 것입니다. 배열 형식에서 3D microtissues 경작, 두 배열의 사이의 접착 력 우물 사이의 교차 오염을 방지 하기 위해 충분 한 되도록 주의 필요 합니다. 또한, 처리량 증가에 그것의 이점이 있다 miniaturizing 세포 배양 시 소비를 줄이고, 그것의 단점은 그 동안 낮은 문화 볼륨 수 없습니다 자주 미디어 보충 없이 장기 세포 배양을. 뿐만 아니라, 세포 현 탁 액의 단지 약간 microliters 이후 미디어 증발으로 인해 세포 생존 능력에 영향을 방지 하기 위해 문화 환경의 습도 유지 하는 것이 중요 하 또는 미디어 추가. 증발 또한 주변 우물에서 세포의 생존 능력에 영향을 미칠 것 이다, 따라서 그것은이 우물에서 세포 배양을 피하기 위해 중요 한.
우리의 강력한 기술 잠재적으로 3D 문화에 게 모두 기본 및 변환 과학에 속하는 대부분 실험실에 대 한 일반적인 세포 조작 방법을 만들 수 있는 사용 하기 쉬운 방식으로, 3D microtissues를 생성 하는 옵션을 제공 하는 그럼에도 불구 하 고, 발전입니다.
공개
저자는 공개 없다.
감사의 말
이 작품은 중국의 국가 자연과학 기초에 의해 재정적으로 지원 (보조금: 81522022, 51461165302). 저자 일반 지원에 대 한 모든 뒤 연구소 회원을 인정 하 고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Gelatin | sigma | G7041 | All other reagents were purchased from Sigma-Aldrich (St. Louis, MO) unless otherwise indicated. |
| Glutaraldehyde | J&K | 902042 | Used as crosslinker in preparation of material. |
| Glass cover slip (24 x 50 mm) | CITOGLASS, China | 10212450C | To scrape prcursor solution onto microstencils array chips. |
| Sodium borohydride, NaBH4 | Beijing Chemical Works | 116-8 | To wash remaining glutaraldehyde away after gelation. |
| Vacuum jar | asperts, China | VC8130 | To preserve microgels under vacuum. |
| Polymethylmethacrylate (PMMA) sheets | Sunjin Electronics Co., Ltd, China | Ordinary PMMA sheets. | |
| Rayjet laser system | Rayjet, Australia | Rayjet 50 C30 | To engrave PMMA sheets to form wells. |
| Plasma Cleaner | Mycro Technologies, USA | PDC-32G | To make PMMA hyphophilic. |
| Lyophilizer | Boyikang, China | SC21CL | To lyophilize materials. |
| Trypan Blue solution (0.4%) | Zhongkekeao, China | DA0065 | To dye microgels. |
| Doxorubicin hydrochloride | ENERGY CHEMICAL, China | A01E0801360010 | To test drug resistance of cells in 2D or 3D microgel. |
| Live/dead assay | Dojindo Molecular Technologies (Kumamoto, Japan) | CS01-10 | To distinguish alive and dead cells. |
| Cell Titer-Blue | Promega (Wisconsin, USA). | G8080 | To test cell viability. |
| Cell strainer | BD Biosciences, USA | 352360 | To collect microgels. |
| D-Luciferin | SYNCHEM (Germany) | s039 | To tack cells. |
| Scanning electron microscope | FEI, USA | Quanta 200 | To characterize microgel morphology. |
| Mechanical testing machine | Bose, USA | 3230 | To measure mechanical features. |
| Programmable syringe pump | World Precision Instruments, USA | ALADINI 1000 | To test injactabiliy. |
| Digital force gauge | HBO, Yueqing Haibao Instrument Co., Ltd., China | H-50 | To test injactabiliy. |
| Ethylene oxide sterilization system | Anprolene, Anderson Sterilization, Inc., Haw River, NC | AN74i | To sterilize microgels with ethylene oxide gas. |
| Microplate reader | Molecular Devices,USA | M5 | To measure fluorescence intensity in micro-array. |
| Confocal microscope | Nikon, Japan | A1Rsi | To observe cell distribution in 3D. |
| Xenogen Lumina II imaging system | Caliper Life Sciences, USA | IVIS | To track cell in animals. |
| Liquid work stataion | Apricot design,USA | S-pipette | To load medium or cell suspension high-throuputly. |
참고문헌
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Abbott, A. Cell culture: biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Fischbach, M. A., Bluestone, J. A., Lim, W. A. Cell-based therapeutics: the next pillar of medicine. Sci Transl Med. 5 (179), 179(2013).
- Kuraitis, D., Giordano, C., Ruel, M., Musaro, A., Suuronen, E. J. Exploiting extracellular matrix-stem cell interactions: a review of natural materials for therapeutic muscle regeneration. Biomaterials. 33 (2), 428-443 (2012).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discov Today. 18 (5-6), 240-249 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay Drug Dev Technol. 11 (7), 435-448 (2013).
- Yoshii, Y., et al. High-throughput screening with nanoimprinting 3D culture for efficient drug development by mimicking the tumor environment. Biomaterials. 51, 278-289 (2015).
- Li, X., et al. Micro-scaffold array chip for upgrading cell-based high-throughput drug testing to 3D using benchtop equipment. Lab Chip. 14 (3), 471-481 (2014).
- Qi, C., Yan, X., Huang, C., Melerzanov, A., Du, Y. Biomaterials as carrier, barrier and reactor for cell-based regenerative medicine. Protein Cell. 6 (9), 638-653 (2015).
- Li, Y., et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia. Proc Natl Acad Sci U S A. 111 (37), 13511-13516 (2014).
- Liu, W., et al. Magnetically controllable 3D microtissues based on magnetic microcryogels. Lab Chip. 14 (15), 2614-2625 (2014).
- Zhao, S., Zhao, H., Zhang, X., Li, Y., Du, Y. Off-the-shelf microsponge arrays for facile and efficient construction of miniaturized 3D cellular microenvironments for versatile cell-based assays. Lab Chip. 13 (12), 2350-2358 (2013).
- Liu, W., et al. Microcryogels as injectable 3-D cellular microniches for site-directed and augmented cell delivery. Acta Biomater. 10 (5), 1864-1875 (2014).
- Hakanson, M., et al. Controlled breast cancer microarrays for the deconvolution of cellular multilayering and density effects upon drug responses. PLoS One. 7 (6), e40141(2012).
- Du, Y., et al. Rapid generation of spatially and temporally controllable long-range concentration gradients in a microfluidic device. Lab Chip. 9 (6), 761-767 (2009).
- He, J., et al. Microfluidic synthesis of composite cross-gradient materials for investigating cell-biomaterial interactions. Biotechnol Bioeng. 108 (1), 175-185 (2011).
- Zeng, Y., et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing. Acta Biomater. 25, 291-303 (2015).
- Yang, F., et al. Genetic engineering of human stem cells for enhanced angiogenesis using biodegradable polymeric nanoparticles. Proc Natl Acad Sci U S A. 107 (8), 3317-3322 (2010).
- Zhang, L., et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia. Stroke. 42 (5), 1437-1444 (2011).
- Kinnaird, T., et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms. Circulation. 109 (12), 1543-1549 (2004).
- Fischbach, C., et al. Engineering tumors with 3D scaffolds. Nat Methods. 4 (10), 855-860 (2007).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Gimble, J. M., Guilak, F., Bunnell, B. A. Clinical and preclinical translation of cell-based therapies using adipose tissue-derived cells. Stem Cell Res Ther. 1 (2), (2010).
- Thai, H. M., et al. Implantation of a three-dimensional fibroblast matrix improves left ventricular function and blood flow after acute myocardial infarction. Cell Transplant. 18 (3), 283-295 (2009).
- Moreira Teixeira, L. S., et al. High throughput generated micro-aggregates of chondrocytes stimulate cartilage formation in vitro and in vivo. Eur Cell Mater. 23, 387-399 (2012).
- Ifkovits, J. L., et al. Injectable hydrogel properties influence infarct expansion and extent of postinfarction left ventricular remodeling in an ovine model. Proc Natl Acad Sci U S A. 107 (25), 11507-11512 (2010).
- Murphy, A. R., Laslett, A., O'Brien, C. M., Cameron, N. R. Scaffolds for 3D in vitro culture of neural lineage cells. Acta Biomater. , (2017).
- Cheng, V., et al. High-content analysis of tumour cell invasion in three-dimensional spheroid assays. Oncoscience. 2 (6), 596-606 (2015).
- Huber, J. M., et al. Evaluation of assays for drug efficacy in a three-dimensional model of the lung. J Cancer Res Clin Oncol. 142 (9), 1955-1966 (2016).
- Lamichhane, S. P., et al. Recapitulating epithelial tumor microenvironment in vitro using three dimensional tri-culture of human epithelial, endothelial, and mesenchymal cells. BMC Cancer. 16, 581(2016).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Monjaret, F., et al. Fully Automated One-Step Production of Functional 3D Tumor Spheroids for High-Content Screening. J Lab Autom. 21 (2), 268-280 (2016).
- Shologu, N., et al. Recreating complex pathophysiologies in vitro with extracellular matrix surrogates for anticancer therapeutics screening. Drug Discov Today. 21 (9), 1521-1531 (2016).
- Ho, W. J., et al. Incorporation of multicellular spheroids into 3-D polymeric scaffolds provides an improved tumor model for screening anticancer drugs. Cancer Sci. 101 (12), 2637-2643 (2010).
- Pathak, A., Kumar, S. Independent regulation of tumor cell migration by matrix stiffness and confinement. Proc Natl Acad Sci U S A. 109 (26), 10334-10339 (2012).
- Wei, S. C., et al. Matrix stiffness drives epithelial-mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway. Nat Cell Biol. 17 (5), 678-688 (2015).
- Romero-Lopez, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Xu, X., Sabanayagam, C. R., Harrington, D. A., Farach-Carson, M. C., Jia, X. A hydrogel-based tumor model for the evaluation of nanoparticle-based cancer therapeutics. Biomaterials. 35 (10), 3319-3330 (2014).
- Xu, X., et al. Recreating the tumor microenvironment in a bilayer, hyaluronic acid hydrogel construct for the growth of prostate cancer spheroids. Biomaterials. 33 (35), 9049-9060 (2012).
- Nyga, A., Loizidou, M., Emberton, M., Cheema, U. A novel tissue engineered three-dimensional in vitro colorectal cancer model. Acta Biomater. 9 (8), 7917-7926 (2013).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochem Biophys Res Commun. 433 (3), 327-332 (2013).
- Hoare, T. R., Kohane, D. S. Hydrogels in drug delivery: Progress and challenges. Polymer. 49 (8), 1993-2007 (2008).
- Delgado, L. M., Bayon, Y., Pandit, A., Zeugolis, D. I. To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. Tissue Eng Part B Rev. 21 (3), 298-313 (2015).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In vitro three-dimensional (3D) models in cancer research: an update. Mol Carcinog. 52 (3), 167-182 (2013).
- Zhang, M., Boughton, P., Rose, B., Lee, C. S., Hong, A. M. The use of porous scaffold as a tumor model. Int J Biomater. 2013, 396056(2013).
- Wang, J., et al. Engineering EMT using 3D micro-scaffold to promote hepatic functions for drug hepatotoxicity evaluation. Biomaterials. 91, 11-22 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유