Method Article
3D Microtissues für injizierbare Regenerative Therapie und Hochdurchsatz-Drogen-Screening
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt die Herstellung von elastischen 3D makroporöse Microcryogels durch die Integration von Microfabrication mit Cryogelation Technologie. Beim Laden mit Zellen, entstehen 3D Microtissues, die kann leicht injizierte in Vivo , regenerative Therapie zu erleichtern oder zu Arrays für in-vitro- Hochdurchsatz-Drogen-Screening montiert.
Zusammenfassung
Um traditionelle 2D Zellkultur auf 3D Zellkultur zu aktualisieren, haben wir Microfabrication integriert, mit Cryogelation Technologie, makroporösen Microscale Cryogels (Microcryogels), zu produzieren, die mit einer Vielzahl von Zelltypen, 3D Microtissues bilden geladen werden kann. Hier präsentieren wir Ihnen das Protokoll um vielseitige 3D Microtissues und ihre Anwendungen in regenerative Therapie und Drogentest zu fabrizieren. Größe und Form-steuerbare Microcryogels kann auf ein Array Chip fabriziert werden die geernteten off-Chip als einzelne Zelle geladen Träger für injizierbare regenerative Therapie oder weiter auf dem Chip in 3D Microtissue Arrays für Hochdurchsatz-montiert werden Drogen-Screening. Aufgrund der hohen elastischen diese Microscale Cryogels weisen die 3D Microtissues große Injectability für die minimal-invasiv-Therapie durch Schutz der Zellen vor mechanischen Querkraft beim Einspritzen. Dadurch verstärkte Zelle überleben und therapeutische Wirkung im Mausmodell Extremität Ischämie. Unterdessen erleichtert die Montage des 3D Microtissue Arrays in einem Standardformat 384-Multi-Well die Verwendung von gemeinsamen Laboreinrichtungen und Geräte, Hochdurchsatz-Drogen-screening auf dieser vielseitigen 3D Zelle-Kultur-Plattform ermöglicht.
Einleitung
Traditionelle Zellkultur auf abgeflachte zweidimensionale (2D) Oberflächen, wie z.B. einer Kulturschale oder Multi-well-Platten, kann kaum Zelle Verhaltensweisen in der Nähe ihrer Heimat Bundesstaaten entlocken. Genaue Rekapitulation der native zellulären Mikroumgebungen, die von verschiedenen Zelltypen, extrazellulären Matrizen und bioaktiven lösliche Faktoren im dreidimensionalen (3D) Architekturen1,2,3 umfassen ,4, unbedingt Biomimicking Gewebe in Vitro für Anwendungen im Tissue engineering, regenerative Medizin, konstruieren grundlegende Biologie Forschung und Drug Discovery5,6,7 ,8,9.
Anstelle von 2D Zellkultur 3D Zellkultur ist weit verbreitet, biomimetische mikroarchitektonische voraus und funktionelle Merkmalen der Zellen in Vitrokultiviert. Eine beliebte 3D Cell-Kultur-Methode ist es, aggregierte Zellen in Sphäroide7,8,9,10. Zelluläre Sphäroide könnte zu verletzten Gewebe mit verstärkten zelluläre Retention und Überleben im Vergleich zur Injektion von verteilten Zellen injiziert werden. Jedoch führen ungleichmäßige Sphäroid Größen und unvermeidliche mechanische Verletzungen Zellen beim Einspritzen von Flüssigkeit Querkraft auferlegt zu schlechte Zelle therapeutische Effekte11,12,13. In ähnlicher Weise hat der inhärenten Ungleichförmigkeit während der Anhäufung der Sphäroide ihre Übersetzung in 3D zellbasierten Hochdurchsatz-Drogen-screening-anspruchsvolle10gemacht.
Ein weiteres Verfahren zur 3D Zellkultur wird mit Hilfe von Biomaterialien, die in der Regel Zellen in wässrige Hydrogele oder poröse Gerüste kapselt erreicht. Es ermöglicht eine größere Flexibilität bei der Konstruktion 3D Architekturen. Für Therapie werden Zellen, die in loser Schüttung Gerüste gekapselt in der Regel tierischen Körper über chirurgische Implantation geliefert, die invasive und traumatisch, daher seine große Übersetzung ins Bett zu beschränken ist. Auf der anderen Seite ermöglichen wässrige Hydrogele minimal-invasive Therapie durch die Injektion von Zellen in tierische Körper, so dass in Situ Gelierung über Thermo-chemische oder enzymatische Vernetzung11in Hydrogel-Vorläufer-Lösung suspendiert. Jedoch da Zellen geliefert werden, während die Hydrogel-Vorläufer noch in einem wässrigen Zustand sind, sind sie auch mechanische Scherkräfte beim Einspritzen ausgesetzt. Nicht nur so, könnte chemische oder enzymatische Vernetzung während in Situ Gelierung Hydrogel auch Schäden an den Zellen innerhalb verhängen. Für Drogen-Screening Probleme Biomaterial-gestützte Zellkulturen mit Gleichförmigkeit, Kontrollierbarkeit und Durchsatz. Mit Hydrogele, Zellen in der Regel während der Gelierung, engagieren sich der Prozess kann durch die Zellviabilität und Funktion beeinträchtigen.. Gelierung während der Aussaat Zelle behindert auch Nutzung durch die meisten Hochdurchsatz-Ausrüstung, da das Hydrogel kann auf Eis, Gelbildung vor Zelle Aussaat zu verhindern gehalten werden müssen, und das Hydrogel könnte Abgabe Tipps, die in der Regel sehr dünn um Genauigkeit zu gewährleisten sind Marmelade Hochdurchsatz-Screening. Vorgeformte Gerüste könnte potenziell Biomaterial Herstellung Verfahren aus Zellkultur, trennen aber die meisten Gerüst-basierten Produkten als Schüttgüter mit relativ niedriger Durchsatz14zur Verfügung stehen.
Um einige der Mängel des aktuellen 3D Kulturmethoden zu überwinden, haben wir eine Microfabrication-Cryogelation integriert-Technologie, um eine handelsübliche und benutzerfreundliche Microcryogel Array Chip15fabrizieren entwickelt. In diesem Protokoll wird Gelatine ausgewählt, um die Microcryogel Herstellung Technik veranschaulichen, wie es biokompatibel, abbaubar, kostengünstig ist, und keine weitere Änderung für Zellhaftung erforderlich ist. Andere Polymere natürlicher oder synthetischer Herkunft könnte auch für die Fertigung, abhängig von der Anwendung verwendet werden. Über diese Technologie können wir fabrizieren, miniaturisierte und hochelastische Microcryogels mit steuerbaren Größe, Form und Layout. Wenn Sie mit einer Vielzahl von Zelltypen geladen, könnte 3D Microtissues für verschiedene Anwendungen gebildet werden. Diese einzigartigen Eigenschaften ermöglichen gewünschte Injectability, Zellschutz und Site-verwiesene Retention nach Injektion in Vivo für verbesserte therapeutische Effekte. Nicht nur so, könnte die Microcryogels weiter verarbeitet werden, 3D Microtissue Arrays zu bilden, die kompatibel mit gemeinsamen Laborgeräte und Instrumente, Hochdurchsatz-Zellkultur für vielseitige Wirkstoff-Screening und andere zelluläre Assays zu realisieren sind. Hierin werden wir ausführlich den Fertigungsprozess des Microcryogels und die Nachbehandlung als individuelle 3D Microtissues oder 3D Microtissue Arrays für zwei wichtige Anwendungen, Zelltherapie und Drogen-Screening, bzw.10,15 .
Protokoll
Tierversuche folgte strengen Protokoll von der Tier-Ethik-Kommission auf Zentrum Biomedizinische Analytik, Tsinghua Universität zugelassen. Unter Zustimmung der Ethik-Kommission, menschlichen Fettgewebe aus Abteilung der plastischen Chirurgie von Peking Union Hospital mit Einwilligung der Patienten gewonnen.
1. Herstellung von 3D Microcryogels
- , Konstruktion und Fertigung von Microstencil Array Chips
- Verwendung einer kommerziellen Software Design Arrays von bestimmten Geometrien wie Kreise, Ellipsen, Dreiecke oder Kleeblätter 14, je nachdem Nachanmeldung.
Hinweis: Finden Sie im Abschnitt 2 des Protokolls für die regenerative Medizin und Abschnitt 3 des Protokolls für Drogen-Screening für Designdetails. - Das Design in der Laser-Gravur Laser Graviermaschine beiliegende Software importieren. Mit Hilfe der Lasereinstellungen entsprechend den Empfehlungen der Fabrik für die Laser-Gravur-Maschine, Laser-Gravur des importierten Designs auf Poly (Methymethacrylate) (PMMA) Blätter.
- Waschen die Microstencil Array Chips mit entionisiertem Wasser, um Schmutz von der Laser-Gravur reinigen. Trockene Microstencil Array-chips bei 60 ° c-Store in einem versiegelten Beutel bei Raumtemperatur monatelang.
- Verwendung einer kommerziellen Software Design Arrays von bestimmten Geometrien wie Kreise, Ellipsen, Dreiecke oder Kleeblätter 14, je nachdem Nachanmeldung.
- Herstellung von Microcryogel Array Chips
- Platz 4 Microstencil array-Chips auf dem Probenteller und Einfügen in das Plasma Reiniger. Schließen Sie die Tür des Reinigers und schalten Sie die Vakuumpumpe für 2 min, dann schalten Sie die maximale HF-Leistung (18 W), zur Behandlung von Microstencil Array Chips im Plasma Reiniger für 3 min bei Raumtemperatur, Hydrophilie erhöhen.
- Add 0,06 g Gelatine auf 1 mL entionisiertem Wasser um 6 % (wt/Vol) Vorläufer Gelatinelösung (genug, um 5 Chips) zu bilden. Bei 60 ° C in einem Wasserbad aufzulösen ausreichend warm. Inkubation auf Eis für 5 min.
- Add 3 µL Glutaraldehyd in Vorläufer Gelatinelösung, eine Endkonzentration von 0,3 %. Gründlich mischen.
- Pipette 200 µL Vorläufer Lösung mit Glutaraldehyd auf der Oberseite des Microstencil Array Chip.
Hinweis: 200 µL ist ausreichend für eine 75 mm × 25 mm Chip unabhängig von Gestaltung. Erhöhen Sie die Menge proportional, wenn Fläche des Chips erhöht wird. - Manuell verteilen die Lösung gleichmäßig über den Chip durch Schaben zurück und her mit einem gebogenen Glasstab 2-bis 3-Mal.
Hinweis: Jedes Mikro-Brunnen auf dem Microstencil Chip befüllbar mit Vorläufer-Lösung durch ihre hydrophile Natur nach Plasmabehandlung. - Sofort platzieren Sie den Vorläufer-Lösung gefüllt Array-Chip in einem Gefrierschrank-20 ° C für 16 h für Cryogelation.
- Anpassen der Gefriertrockner bis-40 ° C für 30 min. die Array-Chips nach Cryogelation in den Gefriertrockner und die Array-Chips für 2 h im Vakuum lyophilize.
Hinweis: Gelatine Microcryogels mit vernetzten Makroporen werden gebildet, weil Eis während Cryogelation defilieren in den Gefriertrockner gebildet. - Fahren Sie mit Abschnitt 2 für die Behandlung von kritischen Extremität Ischämie (CLI) und Abschnitt 3 für Hochdurchsatz-Drogentest.
2. Individuelle Microcryogels, injizierbare Form 3D Microtissues für Behandlung der CLI Ernte
- Ernte einzelner Microcryogels
- Design arrays (75 mm × 25 mm) 600 Kreise, mit 400 µm Durchmesser, jeweils kommerzielle Software für injizierbare 3D Microtissue Bau. Verwenden PMMA 300 µm Dicke für die Herstellung von Microstencil Array Chip als detaillierte in Abschnitt 1.1.
- Fabrizieren Microcryogel Array Chips wie in Abschnitt 1.2.
- Fabrizieren eine Auswerferstift PDMS-Array mit dem gleichen Design wie in Schritt 2.1.1 standard weichen Lithographie 16 , 17.
- Overlay Microcryogel Array Chip auf das PDMS Auswerferstift Array, jedes Microcryogel mit einem Auswerferstift auf dem Array ausrichten. Drücken Sie den Microcryogel Array Chip gegenüber dem Auswerfer Stift Array, drücken Sie die Microcryogels aus Mikrovertiefungen mit hervorstehenden Pins auf dem PDMS Auswerfer Stift Array, individuelle Microcryogels zu ernten.
- Die Microcryogel ins Wasser zu ernten und sammeln sie mit Hilfe der Zelle Siebe. Verwenden Sie ein Sieb, um Microcryogels von einem Chip (d. h. 600 Microcryogels) zu sammeln.
- Wash Microcryogels mit 0,1 M NaBH 4 auf Eis für 20 min uncross-verknüpften Aldehyd Rückstände zu stillen. Verwenden Sie 5 mL 0,1 M NaBH 4 pro Chip. NaBH 4 zu verwerfen und mit 5 mL entionisiertem Wasser für 3 bis 5 mal 15 min jedes Mal waschen.
- Entsorgen Sie Wasser aus der Zelle Sieb und Microcryogels in einem Cluster pro Zelle Sieb zu sammeln und ein Cluster in einer 35-mm-Petrischale mit einer gebogenen Pinzette. Fügen Sie 50-70 µL deionisiertes Wasser zu jedem Cluster und den Deckel der Petrischale zu decken. Klopfen Sie leicht die Petrischale auf der Tischplatte zu nivellieren alle Microcryogels, so dass keine Microcryogels auf eine andere Microcryogel zu einer Monoschicht von Microcryogels auf der Oberfläche der Petrischale bilden liegen.
- Fixieren die geernteten Microcryogels bei-20 ° C für 4 bis 16 h vor lyophilizing sie für 2 h (siehe Punkt 1.2.7). Microcryogels bis zur Weiterverwendung in einem Vakuum bei Raumtemperatur lagern.
- Charakterisierung von Microcryogels
- die Poren der Microcryogels durch das Scannen Rasterelektronenmikroskopie (SEM) Bildgebung zu bewerten.
- Fixieren die geernteten und gefriergetrockneten Microcryogels auf einem Probenhalter durch doppelseitige Klebeband und Mantel mit Gold mit einem Sputter Coater für 90 s, vor Bildgebung durch SEM 11. Auswerten und analysieren die Verteilung der Durchmesser der Poren in der Microcryogel von sieben verschiedenen SEM-Bilder mit Bildanalysesoftware.
- Wiegen ein Cluster von 600 lyophilisierten Microcryogels in einer 35-mm-Petrischale für das Gewicht des getrockneten Gelatine Microcryogels (GMs). Die Ansammlung von lyophilisierten Microcryogels 60 µL deionisiertes Wasser hinzu und warten Sie 30 s für Microcryogels voll Wasser aufsaugen und aufquellen. Wiegen Sie das geschwollene Microcryogels.
- Bestimmen das Gleichgewicht Schwellung Verhältnis und Porosität des Microcryogels, als das Verhältnis des Gewichts des geschwollenen Microcryogels, getrocknete Gelatine Microcryogels und das Verhältnis von Gewicht statt Wasser in Microcryogels mit der hydratisierten microcryogels jeweils 13.
- Maßnahme Injectability des Microcryogels über eine programmierbare Spritzenpumpe integriert mit einer digitalen Kraft messen 14.
- Stain 600 Stück des Microcryogels von Trypan blau und hängen Sie in 600 µL 15 % Gelatine-Lösung, eine homogene Verteilung zu erreichen. 1 mL Microcryogel Aufhängung in 1 mL Spritze zu laden. Die Mischung durch ein 27-Gauge Nadel eine programmierbare Spritzenpumpe bei Durchfluss von 1 mL/min mit 1 mL-Spritze injizieren
- Monitor in Echtzeit Injektion Gewalt durch digitale Kraft messen, testen und Plotten die Kraft-Zeit-Kurve. Nach der Injektion, die Integrität des Microcryogels unter dem Mikroskop beobachten.
Hinweis: GMs in 15 % (wt/Vol) Gelatine-Lösung suspendiert können reibungslos injiziert und nach der Injektion intakt geblieben.
- Charakterisieren die Abbaubarkeit des Microcryogels.
- Zuerst messen das Gewicht von einem Cluster von 600 lyophilisierten Microcryogels in einer 35-mm-Petrischale als das Trockengewicht. Dann tauchen 600 lyophilisierten Microcryogels in 2 mL 0,025 % (Vol/Vol) Trypsin/EDTA.
- Sammeln Microcryogels aus der Lösung mit einer Zelle Sieb zu verschiedenen Zeitpunkten (d.h., 10, 20, 30, 40, 50, 60 und 70 min.). Docht entfernt überschüssige Lösung mit einem Tuch ab. Das Gewicht des Microcryogels zu verschiedenen Zeitpunkten messen und berechnen den Abbau Grad als das Verhältnis des Gewichts des Microcryogel an einem bestimmten Zeitpunkt, dass Microcryogel zum Zeitpunkt Null.
- die Poren der Microcryogels durch das Scannen Rasterelektronenmikroskopie (SEM) Bildgebung zu bewerten.
- Autoloading von Zellen in Microcryogels, Form 3D Microtissues
- Microcryogels aus Schritt 2.1.8 durch Ethylen Oxid Sterilisationssystem mit 12 h Gas Exposition gefolgt von 12 h Entgasung unter Vac zu sterilisierenUum.
- Wählen Sie menschliche Fettgewebe abgeleitet mesenchymale Stromazellen Zellen (hMSCs) für die Behandlung von ischämischen Megalosauridae Maus. Isolieren Zellen durch folgende Verfahren wie bereits berichtet 18.
- Kultur hMSCs im Wachstum 10 -8 M Dexamethason, 10, 10 ng/mL epidermalen Wachstumsfaktor (EGF), 2 % fetalen bovine Serum (FBS) und 10 ng/mL Wachstumsfaktor Platelet-derived bb (PDGF-bb), 1 X Insulin Transferrin Selen (ITS)-haltigem Medium -4 M Ascorbinsäure 2-Phosphat, 100 U/mL Penicillin und 100 µg/mL Streptomycin in DMEM/F12. Die Zellen im Verhältnis von 1:3 Wenn konfluierende Durchgang. Zellen der Passage 3 bis 5 in den folgenden Experimenten benutzen.
- HMSCs mit Trypsin zu ernten und die Anzahl von Zellen mit einem Fuchs-Rosenthal-Zählkammer quantifizieren und eine Dichte von 8 x 10 6 Zellen/mL in hMSCs Wachstumsmedium Aufschwemmen.
- Pipette 60 µL hMSCs Suspension auf der Monolage von 600 Microcryogels mit Durchmesser von 400 µm in einer 35-mm-Schale aus Abschnitt 2.1. Zellen werden automatisch aufgenommen, in die poröse Mikro-Strukturen der Microcryogels.
- Pflegen in eine feuchte Kammer und Inkubation bei 37 ° C für 2 h damit Zellen befestigen. Fügen Sie nach 2 h Inkubation 2 mL Kulturmedium. Verändern Sie alle 2 Tage das Medium. Kultur hMSCs geladen Microcryogels für 2 Tage zu 3D Microtissues.
- Nach 2 Tagen Kultivierung, pipette 100 hMSCs geladen Microcryogels pro Bohrloch auf einer 96-Well-Platte, fügen Sie 120 µL Arbeitslösung Resazurin nach Angaben des Herstellers vorbereitet ' s Einweisung in jede Vertiefung. 2 h bei 37 ° c inkubieren
- Detect Fluoreszenz von Resazurin metabolisiert entwicklungsfähigen Zellen in einem Mikrotestplatte Reader mit einer Anregung Licht Wellenlänge von 560 nm und Emission Lichtwellenlänge von 590 nm. Etablieren eine Standardkurve Zellzahl vs. Fluoreszenz mit hMSCs Handynummer von Fluoreszenzintensität für zukünftige Experiment nach Kit Protokoll 13 interpolieren.
- Anzahl der hMSCs in Microcryogels vom Tag 0, Tag wie unter 4 mit Resazurin 2.3.7 von Tag 0, Tag 4 Schritt.
- Beflecken Zellen in Microcryogels mit Calcein AM Verdünnung 1: 500 und 1: 250 Verdünnung der Propidium Jodid (bekannt als lebenden/Toten Färbung) in Phosphat gepufferte Kochsalzlösung (PBS) und unter Fluoreszenzmikroskop oder konfokale Fluoreszenzmikroskop beobachten.
- Injektion von 3D Microtissues in Vivo für die Behandlung von CLI im Mausmodell
- kritische Megalosauridae Ischämie des weiblichen BALB/c nackten Mäusen als gemeldete 11 , etablieren 19 zu bestimmen, die therapeutische Wirkung von 3D Therapie auf der Basis von Microtissue.
- Die Microtissues von Schritt 2.3.6 mit einer 5-mL-Pipette in eine Zelle Sieb übertragen und Filtern entfernt das Kulturmedium.
- Die hMSCs geladen 3D Microtissues in 15 % Gelatine-Lösung, bei einer Dichte von 100 Microcryogels pro 100 µL Lösung Aufschwemmen.
- Vor der Operation, chirurgische Instrumente von Autoklaven sterilisieren und operieren in einem Tier OP-Saal in einem Tier Anlage Center.
- Platzieren Sie den Mauszeiger in die Anästhesie-Induktion-Kammer mit 1-3 % Isofluran in 100 % Sauerstoff mit einer Durchflussrate von 1 L/min. anwenden Erythromycin auf die Augen der Maus, um Austrocknen zu verhindern. Durch einen 1 cm langen Hautschnitt verbinden die Femoral Arterie und seine Niederlassungen mit seidenen Fäden ca. 5-10 und Verbrauchsteuern 19.
- Inject Indocyanine grün (ICG) (0,1 mL 100 µg/mL) durch den Schweif Vene Injektion Blutfluss zu überwachen. ICG-Fluoreszenz-Bildgebung mit einer Fluoreszenz-imaging-System durchführen (hier hausgemachte System) in der Reflexion Geometrie 11.
- Intramuskulär injizieren Microtissues in drei Standorten des Muskels um die Arterie Schnitt mit einer 1 mL Spritze mit einer 23-Gauge-Nadel Gracilis.
- Nach der Operation, die Maus warm halten mit einem beheizten Pad in den Recovery-Käfig. Injektion subkutan Meloxicam um die Schmerzen zu lindern und überwachen kontinuierlich, bis Sie wach.
- Nach 28 Tagen, überwachen die therapeutische Wirksamkeit der 3D Microtissue behandelten Extremität durch Fluoreszenz imaging 11.
Hinweis: Spritzen subkutan Meloxicam, die Schmerzen zu lindern, wenn die Maus spontan Gliedmaße Amputation zeigte. - Einschläfern Mäuse mit Kohlendioxid nach Abschluss der Experimente.
Hinweis: Hier, Euthanasie mit Kohlendioxid durchgeführt wurde nach strengen Protokoll genehmigt von der Tier-Ethik-Kommission auf Zentrum Biomedizinische Analytik, Tsinghua University.
3. Montage von Microtissue Array Chip für Hochdurchsatz-Screening-Medikament
- Montage der Microcryogel Array für die Zellkultur - Chip
- ändern das Design in Abschnitt 1.1 nach herkömmlichen Multi-well-Platte Abmessungen, d. h., für 384-Multi-Well-Format, entwerfen ein Array von 16 × 24 Brunnen (Zeile spaltenweise), jeweils 2 mm Durchmesser und 4,5 mm Abstand von Mitte zu Mitte.
- Laser Gravieren auf ein 500 µm dicken PMMA Blatt wie in Abschnitt 1.1 beschrieben.
- Fabricate Microcryogels wie beschrieben in Abschnitt 1.2 mit 384-Multi-Well-Array Chip entnommen Schritt 3.1.2. Dieses Microcryogel-haltigen Array bezeichnet man als Microcryogel Array Chip.
- Waschen Microcryogel Array Chip mit 50 mL 0,1 M NaBH 4 uncross-um jede verbleibende Aldehyd zu stillen verbunden, dann wiederholt Spülen mit 50 mL entionisiertem Wasser für 2 h 3 Mal, jedes Mal.
- Das Wasser wegschütten, Einfrieren den Microcryogel Array Chip bei-20 ° C für 4 bis 16 h vor Lyophilisation gemäß Schritt 1.2.7.
- Ändern die 384-Multi-Well Array Design im Schritt 3.1.1 bis 16 × 24 enthalten Brunnen, jeweils 3 mm Durchmesser und 4,5 mm Abstand von Mitte zu Mitte.
- Einseitig die Unterstützung aus einem Blatt von ultra-dünnen (10 µm) biokompatible doppelseitiges Klebeband zu entfernen und fügen Sie ihn auf der einen Seite von einem Stück von 3 mm Dicke PMMA Blatt. Laser Gravieren Design aus Schritt 3.1.4 auf dieser 3 mm Dicke PMMA Blatt nach Abschnitt 1.1. Dieses Array ist als das Reservoir Array bezeichnet.
- Ausrichten das Microcryogel-Array mit dem Reservoir Array Chip chip und zusammen halten fest an den 3D Microcryogel Array Chip für die Zellkultur-Chip montieren. Sterilisieren durch ultraviolette Strahlung für 1 h
- Store 3D Microcryogel Array chips im Vakuum bei Raumtemperatur für weitere Experimente.
- Drug screening am 3D Microtissue Arrays
- füllen Sie einen nassen Feld mit 25 mL sterilem deionisiertes Wasser als eine feuchte Kammer für die Zellkultur dienen. Pre-Wärme in einem befeuchteten 5 % CO 2 Inkubator auf 37 ° c
- Nicht-kleinzelligem Lungenkrebs Krebszellen (NCI-H460) und hepatozellulären Karzinomzellen (HepG2) aus der Gewebekultur Platten nach Standardprotokoll zu ernten und neu in Kulturmedien zu einer endgültigen Dichte von 1,0 x 10 6 Zellen/mL aussetzen. Gründlich mischen.
Hinweis: RPM1640 mit 10 % FBS, 100 U/mL Penicillin und 100 µg/mL Streptomycin wird für NCI-H460 verwendet. Verwenden Sie DMEM mit 10 % FBS, 100 U/mL Penicillin und 100 µg/mL Streptomycin für HepG2. - Entfernen Sie die feuchte Kammer aus Inkubator. Benutzen Sie eine Pinzette sorgfältig Ort montierten 3D Microcryogel Array Chip aus Schritt 3.1.9 in die feuchte Kammer. Vorsicht nicht zu den Microcryogels mit Wasser in der Kammer nass.
- Mischen die Zellsuspension gründlich, dann aliquoten 3 µL Zellsuspension direkt auf der Microcryogel in jede Vertiefung.
Hinweis: Die Pipettenspitze sollte die Oberfläche der Microcryogel berühren Sie leicht vor Ausweisung Zellsuspension. Zellen sind in der Microcryogel durch Absorption Auto geladen. Zellen in den peripheren Schächten nicht Samen. - Fügen Sie 10 μL der Medien in jede Vertiefung nach Zellen in Microcryogel mit Multi-Kanal-Pipette, wie z. B. einen 96-Kanal liquid Handler ausgesät werden. Medium wird auch periphere Brunnen hinzugefügt.
Hinweis: Verwenden RPM1640 Medien mit 10 % FBS, 100 U/mL Penicillin und 100 µg/mL streptomycin für H460 Zellen. Verwenden Sie Medien DMEM mit 10 % FBS, 100 U/mL Penicillin und 100 µg/mL Streptomycin für HepaG2 Zellen. - Kultur der Zelle geladen Microcryogel Array chip in die feuchte Kammer für 24 h in einer befeuchteten 5 % CO 2 Inkubator bei 37 ° C in Form 3D Microtissue Array.
- Auflösen Doxorubicin und IMMLG-8439- 9 in Dimethyl Sulfoxid (DMSO), eine Stammlösung von 10 mM zu bilden. Verdünnen Sie Drogen mit Nährmedium zu bilden ein Konzentrationsgradient 10-divisibel Verdünnung von 2 nM bis 200 µM.
- Fügen Sie 10 µL der Droge Lösungen in jedem gut. Verwenden Sie 0,1 % DMSO (in Medium verdünnt) als das Steuerelement. Inkubieren Sie das Medikament geladen 3D Microtissue Array in eine befeuchtete 5 % CO 2 Inkubator bei 37 ° C für 24 h
- Fügen Sie 4 µL der Stammlösung Resazurin in jede Vertiefung. Inkubation bei 37 ° C für 2 h. Ort der 3D Microtissue Array in der Mikrotestplatte Leser und erkennen Fluoreszenz von Resazurin metabolisiert lebensfähige Zellen bei einer Anregung Licht Wellenlänge von 560 nm und Emission Lichtwellenlänge von 590 nm.
- Subtrahieren Resazurin Baseline Signal aus allen Brunnen vor der Weiterverarbeitung der Daten. Zelle Lebensfähigkeit Teil jedes gut zu berechnen, indem man seine Fluoreszenzsignal durch das durchschnittliche Fluoreszenzsignal von der Kontroll-Vertiefungen.
- Plotten die Dosis-Wirkungs-Kurve Plotten Software mit der Zelle Lebensfähigkeit Bruch als die Y-Achse und die Basis 10 Logarithmus der Wirkstoffkonzentration als der X-Achse. 50 % Hemmung Konzentration (IC50) zu der Zelle Lebensfähigkeit Bruchteil von 0,5 zu interpolieren.
Ergebnisse
Herstellung und Charakterisierung von Microcryogels für 3D Microtissue Bildung.
Nach diesem Protokoll Microcryogels Form der 3D Microtissues und individuellen Microcryogels oder Microcryogel Arrays hergestellt wurden, und wurden in regenerative Therapie und Drogen-screening bzw. (Abbildung 1) angewendet. Microstencil Array Chips aus PMMA hergestellt wurden als Micromolds für Microcryogel Array Chips angewendet. Variable geometrische Mustern konnte für den Microstencil Array Chip vorbereitet werden. Wir entschieden uns für einen repräsentativen 45 x 14 mm Microstencil Array Chip beispielsweise enthielt verschiedene Formen (d.h., Kreis, Ellipse, Dreieck und Klee) und eine kreisförmige Microstencil Array Chip mit verschiedenen Größen (Durchmesser = 100, 200, 400 und 800 µ (m). um die Sichtbarkeit der Micromolds auf die Array-Chips zu erhöhen, Epi-Beleuchtung Bilder wurden beobachtet (Abb. 2A, B). Microcryogels, geerntet von den Array-Chips ausgestellt gewünschten Formen und Größen (Abbildung 2, D). Solche Microcryogels mit gewünschten geometrischen Eigenschaften könnte möglicherweise als Vorlagen zu verschiedene zelluläre Einheiten bilden, die bestimmte Architekturen der nativen Gewebe nachahmen angewandt werden. Die geernteten GMs (Gelatine Microcryogels) hatte vorher definierten Formen und Größen (Abb. 3A). SEM Beobachtung zeigte, dass Microcryogels vernetzten makroporöse Strukturen mit Porengrößen im Bereich von 30-80 µm (Abb. 3 b) enthalten.
Verbesserte Injectability von hMSCs geladen Microtissues für verbesserte ischämischen Extremität Bergung
Mit der programmierbare Spritzenpumpe mit einem digitalen Kraft Gauge14integrierten, Injectability von GMs wurde quantitativ bewertet. Bei einer Durchflussmenge von 1 mL/min waren die GMs mit einer Dichte von 1.000 Microcryogels pro mL unter 6 N, die was niedriger als die klinisch akzeptabel Kraft von 10 N20 (Abbildung 3F war) injiziert. Basierend auf Zellschutz durch GMs ermöglicht, hMSCs in GMs hohe Tragfähigkeit und großen proliferativen Kapazität nach Injektion während der 5 Tage der Kultur (Abbildung 3 H).
Die Extremität Ischämie Mausmodell wurde gewählt, um die therapeutische Wirksamkeit der injizierbaren Stammzellenreserve geladen Microtissues zu beurteilen. Physiologischer Zustand der ischämischen Gliedmaßen wurde 28 Tage nach der Operation (Abb. 4A) untersucht. Kein Glied Bergung wurde in der Sham-Gruppe oder GMs Kontrollgruppe beobachtet. In der 105 freie Zelle Behandlungsgruppe beobachtet was Glied Verlust von 80 % und 20 % insgesamt Zeh Amputation nach 28 Tagen 50 % total Zeh Amputation, 25 % teilweise Zeh Amputation und 25 % teilweise Gliedmaße Amputation innerhalb von 7 Tagen. Im Gegensatz dazu Microtissues Behandlung mit 105 hMSCs verbesserte Limb Salvage (75 %) erreicht mit nur 25 % Mäuse zeigten spontan Zeh Amputation nach 28 Tagen. 106 hMSCs, die minimale effektive Zellzahl verwendet in den meisten bisherigen Studien wurde als Positivkontrolle21gewählt. Nur 2 der 4 Mäuse zeigte Bein retten, aber alle hatten kleinere Nekrose.
Durchblutung war überwacht und bewertet in der Hilfe von Indocyanine grün (ICG), eine FDA-Zulassung angiographischen Kontrastmittel. Das Ergebnis zeigte, dass Fluoreszenz-Signale in der Microtissue-behandelten Mäusen und in den 106 frei hMSCs-behandelten Mäusen erschienen. In der ischämischen Hintergliedmaßen im Schein oder GM-Gruppe gibt es keine offensichtlich Fluoreszenzsignal bis Tag 28 (Abbildung 4 b).
Diese Ergebnisse bestätigt weiter, dass 3D Microtissue-gestützte hMSCs Therapie überlegene therapeutische Wirkungen für CLI Behandlung erreicht die minimale effektive Dosierung für zellbasierte Therapien im Mausmodell bisher darstellt.
Hochdurchsatz-Zytotoxizität Drogentest auf 3D Microtissue Array chip
Eine 3D Ready-to-Use Microcryogel-Array für die Zellkultur-Chip könnte leicht hergestellt werden, durch Beibehaltung der Microcryogels auf dem PMMA-Chip nach Gefriertrocknung und kombiniert mit den entsprechenden Brunnen-Array-Chip mit biokompatiblen Klebebänder (Abbildung 1 und Abb. 5A). In diesem zweiteiligen Zelle Kultur Array serviert Top gut-Array-Chip als Reservoir für das Kulturmedium, Medikament Lösungen und Assay Reagenzien, während die Zellen in der 3D Microcryogel auf dem unteren Array Chip immobilisiert gezüchtet wurden. Die Klebebänder zwischen der oberen und unteren Reihe Chip erlaubt Generation von 384 individuelle Vertiefungen für Hochdurchsatz-3D Zellkultur (Abb. 5 b), daher bietet ein praktisches Werkzeug für die Arzneimittelforschung.
Wie im Protokoll beschrieben, wurde 3D Microtissue Array von Aussaat direkt Zellen in Microcryogels vor der Zugabe von Medium zu den Stauseen gebildet. RFP-Label NIH-3 t 3 Zellen verwenden, haben wir bewiesen, dass die Zellen mit mehreren Schichten innerhalb der 3D Architektur des Microcryogels (Abbildung 5, D) gleichmäßig verteilt waren. REM-Bilder zeigten, dass Zellen fest an den Wänden der Poren eingehalten und sogar erweiterte Filopodien entlang oder über den angrenzenden Wänden von Makroporen in die Microcryogels (Abbildung 5E) ausgestellt.
Wir haben dann die Möglichkeit der Anwendung dieses 3D Microtissue Array für Hochdurchsatz-Drogentests mit zwei Krebszelllinien und zwei Verbindungen gezeigt. Hepatozellulären Karzinomzellen (HepG2) wurden mit Doxorubicin behandelt, während nicht-kleinzelligem Lungenkrebs Krebszellen (NCI-H460) mit IMMLG-8439, einen neuen Tumor-Hemmer behandelt wurden. Fünf bis neun diskrete Konzentrationen jedes Medikament wurden sechs angrenzenden Brunnen als Wiederholungen mit 0,1 % DMSO in Kulturmedium als negative Kontrolle verabreicht. Ein Zytotoxizität-Assay wurde ebenso für Zellen kultiviert in traditionellen 2D Multi-well-Platten durchgeführt. Nach 24 h Inkubation wurde die Zelle Lebensfähigkeit Assay verwendet, um die Droge Reaktionen der Zellen in 2D und 3D zu bewerten. Medikament Wirkungs-Kurven wurden mit normalisierten Zelle Lebensfähigkeit Preise bei verschiedenen Droge Konzentrationen aufgetragen und die IC50 war dann von diesen Kurven interpoliert. Ein höherer Wert IC50 würde bedeuten, dass mehr Medikamenten-resistenten Zellen. Aus Abbildung 5F und 5Ibeobachtet wir eine deutliche Steigerung in Resistenzen, wenn Zellen auf 3D Microtissue Array als in 2D kultiviert wurden. Die IC50 Doxorubicin gegen HepG2-Zellen erreicht 165.959 µM im Vergleich zu 18.239 nM auf 2D; die IC50 IMMLG-8439 auf NCI-H460 Zellen wurde in ähnlicher Weise erhöht, um 331.894 nM in 3D nur erfordert 1.294 nM auf 2D. Diese Beobachtung wurde in Übereinstimmung mit Berichten über erhöhte Resistenzen in 3D Culture über 2D Kultur durch andere Forscher22,23.
Wir zugeschrieben solche Erhöhung in Resistenzen auf die Komplexität der 3D Mikroumgebung im Vergleich zu denplanare Konfiguration der 2D Kultur. REM-Bilder zeigten, dass HepG2-Zellen als Sphäroide dekorieren die Oberflächen von Makroporen in der Microcryogel gesammelt. Diese Zellen sind eng gruppiert und so verbesserte Zell-Zell-Interaktion könnte eine Quelle von Resistenzen in HepG222. Es war auch interessant festzustellen, dass diese Zellcluster nicht frei schwebende Sphäroide wurden, da sie noch einige Haftung der Matrix (Abbildung 5, H) gepflegt. Im Gegensatz dazu wurde epitheliale-mesenchymale-Transition (EMT) spekuliert eingetreten, wenn die nicht kleine Lungenkrebszellen, NCI-H460 auf 3D Microcryogels gezüchtet wurden. NCJ-H460 Zellen verteilt wie Fibroblasten (Abbildung 5J, K) statt wie HepG2 Cluster. Daher spekulierten wir, dass der Anstieg der Resistenzen könnte ein Ergebnis von einem Übergang des NCI-H460 Epithelzellen zu einer mehr bösartigen Zustand18,19,20,21,22 ,23.
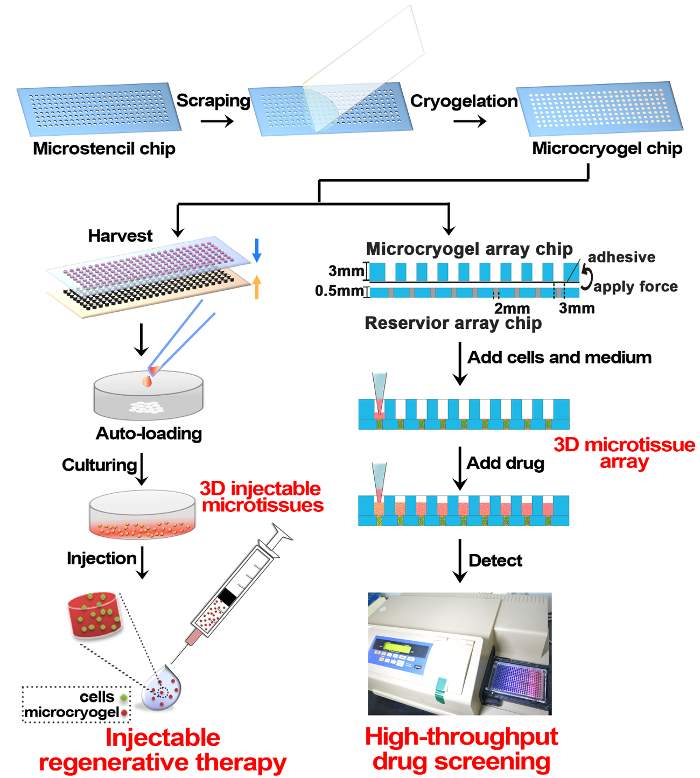
Abbildung 1 : Schematische 3D Microtissue Herstellung und Anwendung in der regenerativen Therapie und Drogentest. Größe und Form-steuerbare Microcryogel Chip war kurz, auf ein Array-PMMA-Chip von Cryogelation von Gelatine hergestellt. Die Microcryogel-Chips können geernteten off-Chip als individuelle Microcryogels und weitere, individuelle Microcryogels kann sein Auto mit Zellen geladen und kultivierten, 3D Microtissues für injizierbare regenerative Therapie zu bilden. Eine weitere Anwendung der Microcryogel-Chips ist es, mit einem Reservoir Array Chip montieren und dann laden Sie weitere, Zellen und Kultur in 3D Microtissue Arrays für Hochdurchsatz-Drogen-Screening. Bitte klicken Sie hier für eine größere Version dieser Figur.
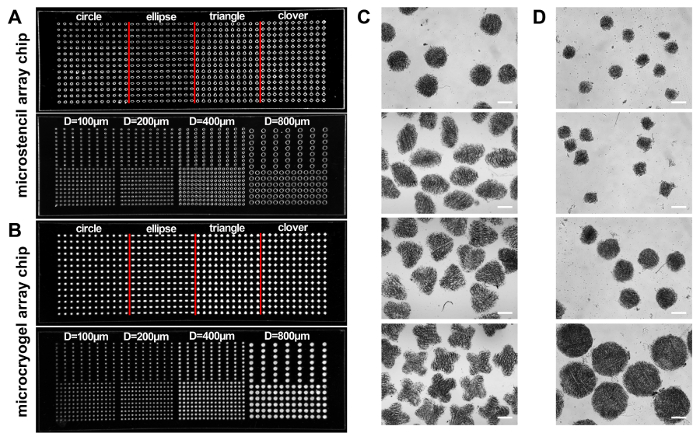
Abbildung 2:Microstencil Array Chips. (A, B) Fotos von zwei PMMA-Microstencil-Chips mit aufgestellten Mikrovertiefungen mit verschiedenen Formen (d.h., Kreis, Ellipse, Dreieck und Klee) und Runde Form mit verschiedenen Größen (Durchmesser: 100, 200, 400 und 800 µm) bzw. (A), und zwei entsprechende Microcryogel Array-Chips (B). (C, D) Mikroskopische Aufnahmen von den einzelnen Microcryogels aus den beiden Microcryogels Array Chips geerntet. Maßstabsleiste = 500 µm. Diese Zahl wurde mit freundlicher Genehmigung von Referenz14geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 3 : Charakterisierung von 3D injizierbaren Microtissues. (A) Fotografien des geernteten Microcryogels. (B) Scanning Electron Schliffbild (SEM) Bilder von Microcryogels zeigen, miteinander verbundenen und makroporöse Strukturen. (C, D) Fluoreszenz mikroskopisch und 3D rekonstruiert konfokale Bilder von hMSCs geladen Microtissues befleckt von lebenden/Toten und Rhodamine Phalloidin. (E) Quantifizierung der hMSCs autoloading und Verbreitung in GMs mit verschiedenen ursprünglichen Ladedichten. (F) Echtzeit-Injektion zwingen Messkurven für dreifache Injektionen von 1.000 GMs in 1 mL 15 % (wt/Vol) Gelatine-Lösung mit 1 mL/min Injektionsrate (15 / 1 / 1.000 %). (G) Live/Dead cell Lebensfähigkeit Assay von hMSCs geladen Microtissues Voreinspritzung und nach der Injektion. (H) Verbreitung von hMSCs geladen in GMs nach der Injektion nach 1, 3 und 5 Tage der Kultur (n = 3). * p < 0,05, einfache ANOVA im Vergleich zum Tag 1. Daten werden als ± SEM bedeuten präsentiert Diese Zahl wurde mit freundlicher Genehmigung von Referenz11geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
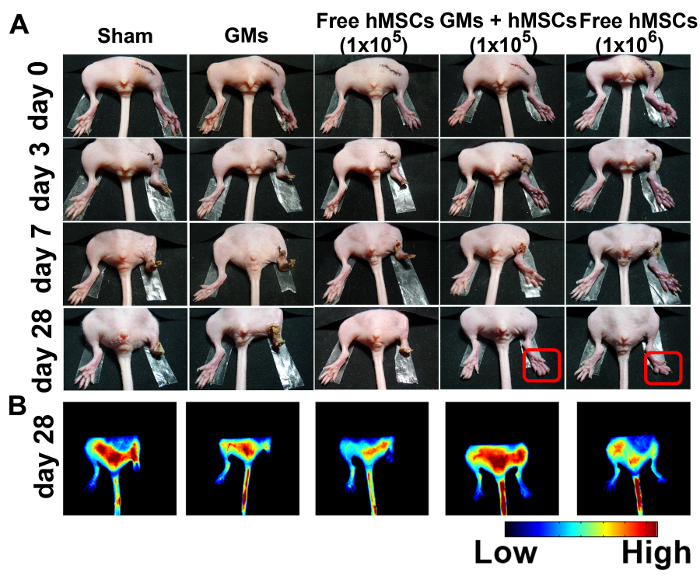
Abbildung 4:verbessert Bergung und Angiogenese in ischämischen Hintergliedmaßen behandelt mit 3D injizierbaren Microtissues. (A) repräsentative Fotografien von Sham (n = 4), leere Microcryogels (n = 4), frei hMSCs (105) (n = 8), hMSCs (105)-Microtissues geladen (n = 8), und freie hMSCs (106) (n = 4) bei 0, 3, 7 und 28 Tage nach der Behandlung. (B) Fluoreszenz Bilder erhalten 100 s nach ICG Injektion am 28. Tag. Diese Zahl wurde mit freundlicher Genehmigung von Referenz11geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 5 : Microtissue 3D-Anordnung für Hochdurchsatz-Drogentest. (A) Foto des 3D Microtissue Arrays in 384-Multi-Well-Format nach Montage und (B) Resazurin Zelle Lebensfähigkeit Assay auf dem Array durchgeführt. (C) RFP-3 t 3 Zellen innerhalb von Microcryogel nach dem seeding (Maßstabsleiste = 200 µm). (D) 3D-Rekonstruktion der Kerne Färbung homogene Verteilung der Zellen in mehreren Schichten in Microcryogel Darstellung. (E) Scanning Electron Schliffbild Bild des RFP-3 t 3 Zellen Verbreitung weitgehend auf makroporöse Wände in Microcryogels (Maßstabsleiste = 20 µm). Zytotoxizität Testen von Doxorubicin (F) auf HepG2-Zellen und (ich) IMMLG-8439 auf NCI-H460 Zellen in 3D Microtissue Array zeigen erhöhte IC50 2D Pendants verglichen. Daten werden angezeigt, da ± SD (G) kleine Sphäroide HepG2-Zellen im Microcryogel bedeuten (Maßstabsleiste = 100 µm), mit (Sternchen in H) teilweise festhalten an der Microcryogel Wand (Maßstabsleiste = 20 µm). (J) NCI-H460 Zellen eingehalten und Verbreitung innerhalb der Microcryogel (Maßstabsleiste = 100 µm). (K) NCI-H460 Zellen ausstellenden fibroblastic Morphologie (Maßstabsleiste = 20 µm). Diese Zahl wurde mit freundlicher Genehmigung von Referenz9geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Regenerative Medizin und in-vitro- Modelle für Drogen-Screening sind zwei wichtige Anwendungen für Tissue engineering5,6,7,8,9. Während diese beiden Anwendungen sehr unterschiedliche Bedürfnisse haben, liegt eine Gemeinsamkeit zwischen ihnen in der Notwendigkeit für eine weitere biomimetische Kultivierung Zustand Zelle Funktionen19. Nur mit verbesserten Zellfunktionen in der Forschung können wir behandeln Krankheiten besser20,21, und wenn kultivierte Zellen Medikament Antworten besser widerspiegeln können wir beschleunigen Drug Discovery6,7. Überleben der Zellen nach Engraftment in Vivo ist eine entscheidende Voraussetzung für die regenerative Medizin, Durchsatz ist zwar wichtig für Drogen-Screening, Griff Tausende von Verbindungen gleichzeitig. Diese beiden Anforderungen sind spezifisch für die jeweiligen Applikation und selten kann eine Technologie erfüllen beide Anforderungen. So haben wir eindeutig integriert Microfabrication Technik mit Cryogel Vorbereitung makroporösen Microcryogels zu produzieren, die möglicherweise als einzelne Zelle geladen Träger für regenerative Therapie geernteten off-Chip, oder beibehalten auf Chip für weitere Montage in Array für Hochdurchsatz-Drogen-Screening. Microscale und Macroporosity diese neuartige Microcryogels ermöglichen automatische und homogene Belastung der Zellen durch einfache Absorption. Verwendung von neuartigen Microstencil Herstellung von Microcryogel Array Chips konnten Hunderte und Tausende von Microscale Cryogels mit einheitlichen und reproduzierbare geometrischen Eigenschaften einfach und effizient generiert werden. Die Microcryogels könnten vorbereitet und durch Vakuum Verpackung als handelsübliche, Ready-to-Use Produkt zur Erleichterung der Ausarbeitung von 3D Microtissues gemein Laboratorien für spätere Anwendungen gespeichert. Mit dieser Technik Fertigung konnten wir die Gemeinsamkeiten (3D Culture Voraussetzung für bessere Biomimetik) und spezifischen Anforderungen für die zwei verschiedenen Anwendungen zu erfüllen (Elastizität zum Schutz der Zellen während der Einspritzung für regenerative Medizin und Hochdurchsatz-in einem Array-Format für Drogen-Screening).
Zellbasierte Therapien verspricht großes für die Reparatur von verschiedenen geschädigte Gewebe oder Organe24. Allerdings sind Zelle Aufbewahrung, Zelle überleben und Reproduzierbarkeit der Behandlung immer noch schlecht aufgrund mechanischer Beschädigung beim Einspritzen, hohe Leckage zu umgebenden Gewebe und Ischämie und Entzündungen in der Umgebung in Vivo in der Läsion Gewebe-25. Einige Forscher haben vorgeformte zellulären Aggregate verwendet, um freie Zelle Injektion zu verbessern. Es erfordert jedoch eine große Menge an Zellen, die Form Zelle Aggregate, führt zu hohen Kosten, ungleichmäßige Größe und unkontrollierbare aggregierte Zahlen26. Darüber hinaus sind mechanische Verletzungen und Zelltod während der Injektion immer noch unverzichtbar. Alternativ wurde Biomaterial-gestützte Zelltherapie entwickelt, in denen reaktionsschnelle Biomaterialien (z.B. thermische oder pH-Sensitive Hydrogel) mit Zellen und Gelierung in Situ Zelle Aufbewahrung27realisieren gemischt werden können. In Situ vernetzte Biomaterialien erlauben jedoch nicht Grundieren der Zellen in Vitro und Ergebnis in unmittelbaren Exposition von Zellen zu einer ischämischen und entzündlichen Mikroumgebung am Standort Läsion. Es ist dringend zur Lösung dieser Probleme um therapeutische Effizienz zu erhöhen. Ein großer Vorteil von Microcryogels hergestellt unter Verwendung dieses Protokolls ist ihre gewünschte Injectability aufgrund ihrer miniaturisierten Größe und außergewöhnliche Elastizität, ihre Anwendung in Zelle Lieferung erleichtert. Die Injectability des Microcryogels ermöglicht Zellschutz während Zelle Lieferung, daher könnten sie nach dem in-vitro- Grundieren der Zellen in die Microcryogel zu beiden extrazelluläre Matrix (ECM) Protein in 3D injizierbaren Microtissues bildeten Ablagerung als auch Zell-Zell-Interaktionen. 3D injizierbaren Microtissues führen Microscale Gewebe-ähnliche Ensembles repräsentieren eine optimale Strategie zur Förderung Zellschutz, Engraftment, überleben und verbessern somit die ultimative therapeutischen Wirkungen auf der Seite der Läsion.
Neben der verbesserten therapeutischen Effekte für die Zelltherapie waren unsere Ergebnisse auch bezeichnend für die komplexen Auswirkungen der 3D Mikroumgebung auf zelluläre Drogen Antworten. Mit Hilfe Biomimicking Kulturbedingungen, wäre es möglich, in-vitro- zelluläre Droge Reaktionen repräsentativer für in Vivo Antworten, daher beschleunigt Drug Discovery6,7auslösen, 28. Sphäroide sind beliebte Wahl der 3D Zelle Kultur Konfiguration und viele Techniken wurden entwickelt zur Unterstützung Forscher erzeugen Sphäroide. Low-Klebstoff Gewebekultur Platten29 oder Platte Oberflächen, die mit Nano-Abdrücke8 geändert werden wurden auch verwendet, um Zellen zu zwingen zum Aggregieren von Zelle-Matrix-Haftung zu verhindern. Während diese Techniken relativ einfach sind zu bedienen, sind Probleme wie Verlust der Sphäroide bei Datenträgeraustausch und andere Operationen sowie Größe Variabilität der Sphäroide Probleme behindern die großflächige Einführung von solchen Technologie-6. Homogener Sphäroide gebildet werden könnte, mit hängenden Tropfen30,31,32,33, aber es ist arbeitsintensiv, wenn nicht mit Platten spezialisiert. Mit spezialisierten Multi-Drop-Platten hängen, sowie Integration in automatisierte Liquid handling Systeme6,31, Hochdurchsatz-Screening konnte realisiert werden. Der größte Nachteil der Sphäroid Kultur ist das Fehlen von ECM, die lebenswichtige Rolle alle physiologischen und pathologischen Gewebes Entwicklungen34identifiziert wurde. Eine Brain-Modell-Studie ergab, dass Sphäroide innerhalb einer ECM-Gerüst, im Vergleich zu reinen Sphäroide kultiviert hatte Resistenzen erhöhte, Azidose aufgrund der höheren Laktat-Produktion erweitert und Angiogenese verbessert mit zunehmender Ausdruck der damit verbundenen Faktoren-34. Andere Studien haben auch gezeigt, dass die Präsenz der Matrix erforderlichen Mechano-Signalisierung zur Förderung der EMT und unterstützt Reprise des Tumor-Features wie Invasion und Metastasierung3,35,36 bieten könnte , 37.
Mit zunehmendem Verständnis für die Bedeutung von ECM in der pathologischen Entwicklung, gibt es keinen Zweifel, dass Integration von ECM in 3D Kulturmethoden helfen konnte in Vivo Situationen besser6zu imitieren. Hydrogele aus natürlichen oder synthetischen Materialien wurden angewendet, um verschiedene in-vitro- 3D Tumor Modelle zur Bewertung von Chemotherapeutika aufgrund ihrer Flexibilität und Kontrollierbarkeit der biophysikalischen Eigenschaften (z. B. Steifigkeit)38 zu generieren , 39 , 40 , 41 , 42. während Hydrogele mit einstellbaren biophysikalischen Eigenschaften in der Tat wichtige biologische Funktionen von Tumorzellen modelliert hatte, genauere Drogentest zu erleichtern, haben einige Nachteile dieser Methode behindert seine weit verbreitete Verwendung in Medikamenten Screening. Vernetzung von Polymeren in Anwesenheit von Zellen ist notwendig, die Zellen innerhalb von Hydrogelmatrix, Kapseln, die potenziell Zellen beschädigen könnten. Nicht nur so, Hydrogele von verschiedenen biophysikalischen Eigenschaften Zellen eingekapselt in verschiedenen Herausforderungen. In weichen Hydrogele hohem Wassergehalt könnte Zellwachstum unterstützen aber solche Hydrogele verschlechtern schnell, kurzfristige Unterstützung für 3D Zellkultur. Auf der anderen Seite steifere Hydrogele mit hohen Vernetzung könnte Abbau verlangsamen aber niedrigen Wassergehalt konnte nicht unterstützen, Zellwachstum und hohe Vernetzer Konzentration induziert in der Regel hohe cytotoxicity-43,-44. Nicht nur so, Vorbereitung 3D Zellkultur mit Hydrogele ist arbeitsintensiv und ist nicht kompatibel mit den meisten Hochdurchsatz-Liquid handling Systeme, wie Temperierung von Hydrogel-Vorläufer-Lösung wichtig ist und Verklemmen der dünnen Abgabe Tipps führen könnte von Gelierung Hydrogel in die Spitzen. Diese Nachteile haben somit die Suche nach Alternativen ECM Surrogate, d. h., Gerüst-basierte ECM34aufgefordert.
Mit vorgeformten Gerüste, Zellen von Biomaterial Fertigungsprozess befreit werden konnte und daher bieten die Möglichkeit für mehr Kontrolle über Gerüst Herstellung, da härtere Bedingungen ohne Angst vor einer Beschädigung der Zellen verwendet werden könnte. Mehrere Untersuchungen haben gezeigt, dass die Tumorzellen in 3D Gerüste kultiviert höhere Resistenz gegenüber Zellen kultiviert in 2D aufgrund erhöhter Malignität und verstärkte Zelle-ECM Interaktion45,46, zeigen 47. solche Beobachtungen stehen im Einklang mit unserer hier vorgestellten Ergebnisse. In unseren anderen Werken haben wir weiter die Vielseitigkeit des 3D Microtissue Arrays und seine Vorteile gegenüber den anderen oben genannten Techniken demonstriert. In einer kürzlich durchgeführten Arbeiten, konnten wir Leberfunktion zu verbessern durch die Förderung des epithelialen Phänotyps von HepaRG Zellen durch Kultivierung auf einem 3D Microtissue-Array und solches Array auf Droge Hepatotoxizität Bewertung47angewendet wurde. Aufgrund der Einheitlichkeit der Porengrößen innerhalb der 3D makroporöse Gerüste konnten wir die Größe der Leberzelle Sphäroide in 50-80 µm, unabhängig von der Zelle-säen Anfangsdichte fallen Steuern. Dies bietet einen erheblichen Vorteil gegenüber Freiformen Sphäroide mit ungleichmäßigen Größen. Nicht nur wachsen Sphäroide einheitlich innerhalb jedes Gerüst, Zellen zwischen Brunnen auch gleichmäßig ausgesät werden, geben die Koeffizienten der Variation (CV) vergleichbar mit Zellen, die Aussaat in 2D (d.h., CV = 0,09 in 3D Microtissue Array und CV = 0,05 in 2D kommerzielle Platte ; (Daten nicht gezeigt). Eine andere Arbeit haben wir bewiesen, dass wir Leber Microtumor auf 3D Microtissue Array, Tumor-Stromazellen Interaktionen für das Screening von Stroma umprogrammiert kombinatorischen Therapie48rekapitulieren bilden konnten. Leber Microtumors wurden durch langfristige (5 Tage) Kokulturen von Fibroblasten mit Tumorzellen in hoher Dichte erzeugt. Wir beobachteten Barrieren gegenüber Drogen Diffusion durch die Kompaktzelle und ECM-Struktur gebildet, die in der Leber Microtumor, die in ähnlicher Weise in Vivo32beobachtet wurde. Mit Luciferase-markierten Krebszellen und mechanisch grundiert Stromazellen Zellen, kombiniert mit Lumineszenz von Luciferin als das spezifische Auslesen für Krebszellen, Hochdurchsatz-screening von neuartiger Therapeutika oder Kombinationen gegen Tumor-Stromatumoren Interaktion ist möglich.
Trotz der vielen einzigartigen Vorteile unseres Verfahrens ist ein Nachteil der aktuellen Microcryogels nicht-Transparenz, detaillierte optische Beobachtung von Zellen in Microcryogels zu behindern. Weitere Verbesserungen für diese Microcryogels wären Feinabstimmung ihrer optischen Eigenschaften zur Verbesserung der Darstellung von Zellen in Microcryogels zur Beobachtung. Darüber hinaus haben wichtigere Biophysikalische Eigenschaften wie Steifigkeit nicht in unsere Technik erforscht die angesprochen werden, will man die physiologischen und pathologischen Gewebe von verschiedenen biophysikalischen Eigenschaften besser nachahmen müssten.
Während unsere Technik zur einfachen Erzeugung von 3D Microtissues kann, müssen einige Vorsichtsmaßnahmen für erfolgreiche Experimente getroffen werden. Bei der Herstellung von 3D Microcryogels auf Microstencil Array Chip ist es wichtig, sicherzustellen, dass die Microcryogels eingefroren bleiben, wenn Sie in den Gefriertrockner platziert. Daher ist es wichtig, den Gefriertrockner Vorkühlen und Microcryogels aus dem Tiefkühler-20 ° C auf den Gefriertrockner schnell übertragen. Das Schmelzen des Microcryogels vor Lyophilisation oder während der Lyophilisation verursacht Poren zu reduzieren und somit Einfluss auf die Porosität des Microcryogels hergestellt. Wenn 3D Microtissues in das Array Format zu züchten, ist Aufmerksamkeit erforderlich, um sicherzustellen, dass die Haftfähigkeit zwischen die beiden Arrays ausreicht, um Kreuzkontaminationen zwischen Brunnen zu vermeiden. Auch konnte während Zellkultur Miniaturisierung seinen Vorteil hat bei der Steigerung des Durchsatzes und Reagenzienverbrauch zu reduzieren, der Nachteil, dass ist die niedrigen Kulturvolumen langfristige Zellkultur ohne häufige Medien Nachschub nicht unterstützen. Nicht nur so, ist es wichtig, die Luftfeuchtigkeit der Kultur Umwelt Einfluss auf die Zellviabilität durch Medien Verdunstung, da nur wenige Mikroliter der Zellsuspension zu verhindern oder Medien hinzugefügt. Verdunstung wird auch Auswirkungen auf die Lebensfähigkeit der Zellen in den peripheren Schächten, daher ist es entscheidend für die Kultivierung von Zellen in diese Vertiefungen zu vermeiden.
Dennoch, unsere robuste Technik bietet die Möglichkeit, 3D Microtissues in eine einfach zu bedienende Weise erzeugen, die potenziell 3D Culture eine gemeinsame Zelle Manipulation Methode für die meisten Labors, Grundlagen- und translationale Wissenschaft beschleunigen machen könnte Fortschritte.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Arbeit wurde finanziell unterstützt von der National Natural Science Foundation of China (Stipendien: 81522022, 51461165302). Die Autoren möchten alle Du Lab-Mitglieder für allgemeine Unterstützung zu erkennen.
Materialien
| Name | Company | Catalog Number | Comments |
| Gelatin | sigma | G7041 | All other reagents were purchased from Sigma-Aldrich (St. Louis, MO) unless otherwise indicated. |
| Glutaraldehyde | J&K | 902042 | Used as crosslinker in preparation of material. |
| Glass cover slip (24 x 50 mm) | CITOGLASS, China | 10212450C | To scrape prcursor solution onto microstencils array chips. |
| Sodium borohydride, NaBH4 | Beijing Chemical Works | 116-8 | To wash remaining glutaraldehyde away after gelation. |
| Vacuum jar | asperts, China | VC8130 | To preserve microgels under vacuum. |
| Polymethylmethacrylate (PMMA) sheets | Sunjin Electronics Co., Ltd, China | Ordinary PMMA sheets. | |
| Rayjet laser system | Rayjet, Australia | Rayjet 50 C30 | To engrave PMMA sheets to form wells. |
| Plasma Cleaner | Mycro Technologies, USA | PDC-32G | To make PMMA hyphophilic. |
| Lyophilizer | Boyikang, China | SC21CL | To lyophilize materials. |
| Trypan Blue solution (0.4%) | Zhongkekeao, China | DA0065 | To dye microgels. |
| Doxorubicin hydrochloride | ENERGY CHEMICAL, China | A01E0801360010 | To test drug resistance of cells in 2D or 3D microgel. |
| Live/dead assay | Dojindo Molecular Technologies (Kumamoto, Japan) | CS01-10 | To distinguish alive and dead cells. |
| Cell Titer-Blue | Promega (Wisconsin, USA). | G8080 | To test cell viability. |
| Cell strainer | BD Biosciences, USA | 352360 | To collect microgels. |
| D-Luciferin | SYNCHEM (Germany) | s039 | To tack cells. |
| Scanning electron microscope | FEI, USA | Quanta 200 | To characterize microgel morphology. |
| Mechanical testing machine | Bose, USA | 3230 | To measure mechanical features. |
| Programmable syringe pump | World Precision Instruments, USA | ALADINI 1000 | To test injactabiliy. |
| Digital force gauge | HBO, Yueqing Haibao Instrument Co., Ltd., China | H-50 | To test injactabiliy. |
| Ethylene oxide sterilization system | Anprolene, Anderson Sterilization, Inc., Haw River, NC | AN74i | To sterilize microgels with ethylene oxide gas. |
| Microplate reader | Molecular Devices,USA | M5 | To measure fluorescence intensity in micro-array. |
| Confocal microscope | Nikon, Japan | A1Rsi | To observe cell distribution in 3D. |
| Xenogen Lumina II imaging system | Caliper Life Sciences, USA | IVIS | To track cell in animals. |
| Liquid work stataion | Apricot design,USA | S-pipette | To load medium or cell suspension high-throuputly. |
Referenzen
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Abbott, A. Cell culture: biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Fischbach, M. A., Bluestone, J. A., Lim, W. A. Cell-based therapeutics: the next pillar of medicine. Sci Transl Med. 5 (179), 179 (2013).
- Kuraitis, D., Giordano, C., Ruel, M., Musaro, A., Suuronen, E. J. Exploiting extracellular matrix-stem cell interactions: a review of natural materials for therapeutic muscle regeneration. Biomaterials. 33 (2), 428-443 (2012).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discov Today. 18 (5-6), 240-249 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay Drug Dev Technol. 11 (7), 435-448 (2013).
- Yoshii, Y., et al. High-throughput screening with nanoimprinting 3D culture for efficient drug development by mimicking the tumor environment. Biomaterials. 51, 278-289 (2015).
- Li, X., et al. Micro-scaffold array chip for upgrading cell-based high-throughput drug testing to 3D using benchtop equipment. Lab Chip. 14 (3), 471-481 (2014).
- Qi, C., Yan, X., Huang, C., Melerzanov, A., Du, Y. Biomaterials as carrier, barrier and reactor for cell-based regenerative medicine. Protein Cell. 6 (9), 638-653 (2015).
- Li, Y., et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia. Proc Natl Acad Sci U S A. 111 (37), 13511-13516 (2014).
- Liu, W., et al. Magnetically controllable 3D microtissues based on magnetic microcryogels. Lab Chip. 14 (15), 2614-2625 (2014).
- Zhao, S., Zhao, H., Zhang, X., Li, Y., Du, Y. Off-the-shelf microsponge arrays for facile and efficient construction of miniaturized 3D cellular microenvironments for versatile cell-based assays. Lab Chip. 13 (12), 2350-2358 (2013).
- Liu, W., et al. Microcryogels as injectable 3-D cellular microniches for site-directed and augmented cell delivery. Acta Biomater. 10 (5), 1864-1875 (2014).
- Hakanson, M., et al. Controlled breast cancer microarrays for the deconvolution of cellular multilayering and density effects upon drug responses. PLoS One. 7 (6), e40141 (2012).
- Du, Y., et al. Rapid generation of spatially and temporally controllable long-range concentration gradients in a microfluidic device. Lab Chip. 9 (6), 761-767 (2009).
- He, J., et al. Microfluidic synthesis of composite cross-gradient materials for investigating cell-biomaterial interactions. Biotechnol Bioeng. 108 (1), 175-185 (2011).
- Zeng, Y., et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing. Acta Biomater. 25, 291-303 (2015).
- Yang, F., et al. Genetic engineering of human stem cells for enhanced angiogenesis using biodegradable polymeric nanoparticles. Proc Natl Acad Sci U S A. 107 (8), 3317-3322 (2010).
- Zhang, L., et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia. Stroke. 42 (5), 1437-1444 (2011).
- Kinnaird, T., et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms. Circulation. 109 (12), 1543-1549 (2004).
- Fischbach, C., et al. Engineering tumors with 3D scaffolds. Nat Methods. 4 (10), 855-860 (2007).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Gimble, J. M., Guilak, F., Bunnell, B. A. Clinical and preclinical translation of cell-based therapies using adipose tissue-derived cells. Stem Cell Res Ther. 1 (2), (2010).
- Thai, H. M., et al. Implantation of a three-dimensional fibroblast matrix improves left ventricular function and blood flow after acute myocardial infarction. Cell Transplant. 18 (3), 283-295 (2009).
- Moreira Teixeira, L. S., et al. High throughput generated micro-aggregates of chondrocytes stimulate cartilage formation in vitro and in vivo. Eur Cell Mater. 23, 387-399 (2012).
- Ifkovits, J. L., et al. Injectable hydrogel properties influence infarct expansion and extent of postinfarction left ventricular remodeling in an ovine model. Proc Natl Acad Sci U S A. 107 (25), 11507-11512 (2010).
- Murphy, A. R., Laslett, A., O'Brien, C. M., Cameron, N. R. Scaffolds for 3D in vitro culture of neural lineage cells. Acta Biomater. , (2017).
- Cheng, V., et al. High-content analysis of tumour cell invasion in three-dimensional spheroid assays. Oncoscience. 2 (6), 596-606 (2015).
- Huber, J. M., et al. Evaluation of assays for drug efficacy in a three-dimensional model of the lung. J Cancer Res Clin Oncol. 142 (9), 1955-1966 (2016).
- Lamichhane, S. P., et al. Recapitulating epithelial tumor microenvironment in vitro using three dimensional tri-culture of human epithelial, endothelial, and mesenchymal cells. BMC Cancer. 16, 581 (2016).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Monjaret, F., et al. Fully Automated One-Step Production of Functional 3D Tumor Spheroids for High-Content Screening. J Lab Autom. 21 (2), 268-280 (2016).
- Shologu, N., et al. Recreating complex pathophysiologies in vitro with extracellular matrix surrogates for anticancer therapeutics screening. Drug Discov Today. 21 (9), 1521-1531 (2016).
- Ho, W. J., et al. Incorporation of multicellular spheroids into 3-D polymeric scaffolds provides an improved tumor model for screening anticancer drugs. Cancer Sci. 101 (12), 2637-2643 (2010).
- Pathak, A., Kumar, S. Independent regulation of tumor cell migration by matrix stiffness and confinement. Proc Natl Acad Sci U S A. 109 (26), 10334-10339 (2012).
- Wei, S. C., et al. Matrix stiffness drives epithelial-mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway. Nat Cell Biol. 17 (5), 678-688 (2015).
- Romero-Lopez, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Xu, X., Sabanayagam, C. R., Harrington, D. A., Farach-Carson, M. C., Jia, X. A hydrogel-based tumor model for the evaluation of nanoparticle-based cancer therapeutics. Biomaterials. 35 (10), 3319-3330 (2014).
- Xu, X., et al. Recreating the tumor microenvironment in a bilayer, hyaluronic acid hydrogel construct for the growth of prostate cancer spheroids. Biomaterials. 33 (35), 9049-9060 (2012).
- Nyga, A., Loizidou, M., Emberton, M., Cheema, U. A novel tissue engineered three-dimensional in vitro colorectal cancer model. Acta Biomater. 9 (8), 7917-7926 (2013).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochem Biophys Res Commun. 433 (3), 327-332 (2013).
- Hoare, T. R., Kohane, D. S. Hydrogels in drug delivery: Progress and challenges. Polymer. 49 (8), 1993-2007 (2008).
- Delgado, L. M., Bayon, Y., Pandit, A., Zeugolis, D. I. To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. Tissue Eng Part B Rev. 21 (3), 298-313 (2015).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In vitro three-dimensional (3D) models in cancer research: an update. Mol Carcinog. 52 (3), 167-182 (2013).
- Zhang, M., Boughton, P., Rose, B., Lee, C. S., Hong, A. M. The use of porous scaffold as a tumor model. Int J Biomater. 2013, 396056 (2013).
- Wang, J., et al. Engineering EMT using 3D micro-scaffold to promote hepatic functions for drug hepatotoxicity evaluation. Biomaterials. 91, 11-22 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten