Method Article
注射の再生療法と高スループットの薬剤のスクリーニングのための 3 D への放射能
要約
このプロトコルは、cryogelation の技術で微細加工を統合することにより弾性三次元多孔体 microcryogels の作製をについて説明します。セルの読み込み、時に、容易に注入の生体内再生治療を容易にすることができますまたは高スループット薬剤スクリーニングの in vitroの配列に組み立てに 3 D への放射能を生成します。
要約
伝統的な 2 D 細胞培養を 3 D 細胞培養にアップグレードするには、多孔質マイクロ cryogels (microcryogels)、様々 な 3 D への放射能を形成する細胞の種類を読み込むことができますを生成する cryogelation 技術が微細加工を統合されている私たち。ここで、多彩な 3 D への放射能と再生医療および創薬スクリーニングに応用を作製するプロトコルを提案する.サイズと形状制御 microcryogels アレイ チップ、またはことができる収穫のオフチップ注射再生療法の個別セル ロード キャリアとして高スループットの 3 D 微少配列にアセンブルされたオンチップ更なる加工できます。薬剤のスクリーニング。これらのマイクロ スケール cryogels の高弾性性質のため 3 D への放射能は射出中に機械的せん断力から細胞を保護することにより低侵襲細胞療法のための素晴らしい injectability を展示します。これにより強化された細胞の生存とマウス下肢虚血モデルにおいて治療効果。一方、標準的なマルチ 384 ウェル フォーマットで 3 D 微少配列のアセンブリは高スループット薬剤のスクリーニングのこの汎用性の高い 3 D 細胞培養プラットフォームで有効にする共通研究施設や設備の使用を促進します。
概要
培養皿やウェル プレートなどの平面的な 2次元 (2 D) 表面に従来の携帯文化はほとんどのネイティブ状態に近い細胞の挙動を引き出すことができます。様々 な種類の細胞、細胞外マトリックス三次元 (3 D) アーキテクチャ1,2,3 の生理活性の可溶性因子を構成するネイティブの細胞微小の正確な反復、4、、リニアアクチュエータ組織体外組織工学・再生医学のアプリケーションの構築に不可欠な基礎的生物学および創薬探索5,6,7 ,8,9。
2 D の細胞培養の代わりに生体模倣マイクロ アーキテクチャを事前に 3 D 細胞培養を用い、培養細胞の機能。人気の 3 D 細胞培養法は、集計細胞スフェロイド7,8,9,10にすることです。細胞スフェロイドは、高度な細胞保存と分散した細胞の注入と比較する生存と負傷者の組織に注入できること。ただし、非一様回転楕円体サイズと注入中に流体せん断力によって細胞に課された必然的な機械的損傷が悪い細胞治療効果11,12,13に します。同様に、回転楕円体の集計中に固有の不均一 3 D 細胞を用いた高スループット薬剤のスクリーニングの挑戦10への翻訳をしました。
3 D 細胞培養のための別の方法は、通常水性ゲルまたは多孔質のセルをカプセル化する生体材料学分野の援助によって達成されます。3 D アーキテクチャを構築する上で大きな柔軟性が可能です。治療のため一括足場にカプセル化細胞通常外科的移植、侵襲性、外傷性、それゆえに枕元にその翻訳を制限することで動物の体に配信されます。その一方で、水性ゲルは、熱 - 化学か酵素架橋11経由の in situゲルを許可する、動物の体にヒドロゲル前駆体溶液中に浮遊細胞を注入することにより低侵襲治療を有効にします。ただし、ヒドロゲル前駆物質水溶液の州はまだながら、細胞が配信されると彼らにさらされている機械的せん断注入中。ない限り、その場でゲル化ハイドロゲルの中に化学か酵素の架橋も内細胞への損傷を課す可能性があります。薬剤スクリーニングのため生体材料による細胞培養の均一性、制御性とスループットの問題に直面します。ヒドロゲルを使用すると、細胞の通常関与するゲル化、中にセル実行可能性と機能、プロセスを影響可能性があります。ヒドロゲルの細胞、播種前にゲル化を防ぐために氷の上に保持する必要がありますのでヒドロゲルの精度を確保するため通常非常に薄い調剤のヒント ・ ジャムが、細胞中にゲル化もほとんどの高スループット装置によって使用を妨げ高スループット スクリーニング。前もって形成された足場でした可能性のある個別の生体材料作製手順細胞培養から足場ベースの製品が比較的低いスループット14バルク材料として利用できるしかし、ほとんど。
現在の 3 D 培養法の欠点のいくつかを克服するために市販で使いやすい microcryogel アレイ チップ15を作製する微細加工 cryogelation 統合技術を開発しました。このプロトコルでは、それは生体適合性、分解性、費用対効果と細胞接着に必要なそれ以上の変更はない microcryogel 作製技術を実証するためゼラチンが選択されます。天然または合成のソースの他のポリマーは、作製、アプリケーションによっても使用できます。この技術を使って制御可能なサイズ、形状、レイアウトと小型と高弾性 microcryogels 作製することができます。さまざまな種類の細胞と共に読み込まれる、3 D への放射能は様々 なアプリケーションに対して作成でした。これらのユニークな特徴は、噴射に生体内で強化された治療効果について希望 injectability、セルの保護およびサイト指示された保存を有効にします。ない限り、一般的な実験装置と多彩な薬剤のスクリーニングおよび他の細胞アッセイのハイスループットの細胞培養を実現する機器と互換性のある 3 D 微少アレイを形成するため、microcryogels をさらに処理でした。ここで、我々 もの microcryogels と個々 の 3 D への放射能または 2 つの重要なアプリケーション、細胞治療、創薬スクリーニング、それぞれ10,15 の 3 D 微少配列とその後の治療の作製プロセスを詳細します。.
プロトコル
動物実験後清華大学バイオメディカル分析センターの動物倫理委員会によって承認された厳密なプロトコル。倫理委員会の承認を得て、ひと脂肪組織は北京連合病院の整形外科の部門から患者からインフォームド コンセントの得られた
。1 です 3 d Microcryogels の作製
- microstencil アレイ チップの設計と試作
- 円など、特徴的な形状のデザイン配列に商業ソフトウェアを使用楕円、三角形または。クローバー 14、後続のアプリケーションに応じて
。 注: 再生医療用のプロトコルのセクション 2 を参照してください、詳細についてはデザイン創薬スクリーニングのためのプロトコルのセクション 3. - は、デザインをレーザー彫刻レーザー彫刻機に付属するソフトウェアにインポートします。レーザー彫刻機の工場の勧告に従ってレーザー設定を使用してレーザー彫刻ポリ (methymethacrylate) (PMMA) にインポートされたデザイン シート 。
- は、microstencil アレイ チップをレーザー彫刻からの残骸をきれいに脱イオン水を洗ってください。乾燥 microstencil アレイ チップを常温で密封された袋の 60 ° C 店でヶ月 。
- 円など、特徴的な形状のデザイン配列に商業ソフトウェアを使用楕円、三角形または。クローバー 14、後続のアプリケーションに応じて
- Microcryogel アレイ チップの作製
- 場所 4 microstencil サンプル トレイ上のチップを配列、プラズマ クリーナーに挿入します。掃除機のドアを閉じるし、2 分間の真空ポンプをオンに最大 RF 電源 (18 W) 親水性を高めるため室温で 3 分間クリーナー プラズマ microstencil アレイ チップを治療するために.
- フォームに 1 mL の脱イオン水に追加 0.06 g ゼラチン 6% (重量/巻) ゼラチン前駆体溶液 (5 チップを作るのに十分な)。十分に溶解する水浴の 60 ° C で暖かい。氷上で 5 分間インキュベート
- 0.3% の最終的な集中にゼラチン前駆体溶液にグルタルアルデヒドの追加 3 μ L。ミックス徹底的 。
- ピペット 200 μ L 前駆体溶液 microstencil アレイ チップの上面にグルタルアルデヒド
。 注: 200 μ L で 75 mm × 25 mm チップ設計に関係なく十分です。チップの面積の増加量に比例して増加します 。
- 手動で均等にソリューション チップ上後ろを削って、前後曲げガラス棒で 2 倍から 3 倍します
。 注: 各ウェル microstencil チップ上満たすことができる前駆体溶液の親水性の性質プラズマ治療後 。
- すぐに cryogelation の 16 時間-20 ° C のフリーザーに前駆体ソリューションいっぱいアレイ チップを配置します 。
- 調整 30 分-40 ° C にエアカーテン、エアカーテンで cryogelation 後アレイ チップを配置し、真空中で 2 h のアレイ チップを凍乾します
。 注: 相互接続された水ガラス ゼラチン microcryogels が形成される氷 cryogelation 気高く、エアカーテンの中に形成されているためです 。
- セクション (CLI) 重症虚血肢の治療のため 2 と高スループットの薬剤のスクリーニングの 3 セクションに進んでください 。
2。CLI の治療のフォーム注射用 3 D への放射能に個々 の Microcryogels を収穫
- 収穫個別 microcryogels
- デザイン アレイ (75 mm × 25 mm) 600 円、400 μ m の直径、それぞれの注射 3 D 微少建設のための商用ソフトウェア。詳細なセクション 1.1 として microstencil アレイ チップの作製の 300 μ m 厚の PMMA を使用します 。
- セクション 1.2 のように microcryogel アレイ チップを作製します 。
- ステップ 2.1.1 標準ソフト ・ リソグラフィー 16 , 17 と同様のデザインを持つ PDMS 突き出しピン配列を作製します 。
- は、各 microcryogel アレイ上の突き出しピンとを合わせ、PDMS 突き出しピン配列の上に microcryogel アレイ チップをオーバーレイします。個々 の microcryogels を収穫する PDMS エジェクタ ピン配列の突出ピンとマイクロウェルから microcryogels をプッシュするエジェクタ ピン配列に向かって microcryogel アレイ チップを押します 。
- は、水の中に、microcryogel を収穫し、セル ストレーナーの助けを借りてそれらを収集します。1 チップ (すなわち、600 microcryogels) から microcryogels を収集するために 1 つのストレーナを使用します 。
- ウォッシュ microcryogels 0.1 M NaBH 4 uncross-リンク アルデヒド残余を癒やすために 20 分間氷の上で。チップ当たり 0.1 M NaBH 4 の 5 mL を使用します。NaBH 4 を破棄し、3 〜 5 回、15 分間 5 mL の脱イオン水で洗うたびにします 。
- はセル ストレーナーから水を捨てるとセル ストレーナーあたり 1 つのクラスターに microcryogels を収集し、曲がりピンセットを使用して 1 つの 35 mm のペトリ皿に 1 つのクラスターを配置します。50-70 μ L の脱イオン水を各クラスターに、シャーレのふたのカバーを追加します。ペトリ皿の表面に microcryogels の単分子膜を形成するための別の microcryogel の上に横たわっている microcryogels がないので、すべて microcryogels を卓上にペトリ皿を軽く 。
- は、2 h (1.2.7 のステップを参照)、それらを lyophilizing する前に 4 に 16 時間-20 ° C で収穫された microcryogels をフリーズします。さらに使用するまで室温で真空 microcryogels を格納します 。
- Microcryogels の
- 、microcryogels の細孔を走査電子顕微鏡 (SEM) イメージングによる評価。
- 固定両面粘着テープと 90 用スパッタ コーターとゴールド コートのサンプル ホルダーに収穫と凍結乾燥 microcryogels s、SEM 11 によるイメージングの前に。評価し、画像解析ソフトを用いた 7 異なる SEM 画像から microcryogel の細孔径の分布を分析します 。
- Microcryogels 乾燥ゼラチン (GMs) の重量の 35 mm のペトリ皿に 600 の凍結乾燥 microcryogels の 1 つのクラスターの重量を量る。凍結乾燥 microcryogels のクラスターに 60 μ L の脱イオン水を追加し、30 を待つ完全に膨張水を吸収し microcryogels の s。腫れの microcryogels の重量を量る。
- を決定する平衡膨潤率と乾燥ゼラチン microcryogels と水和物 microcryogels の microcryogels で開催された水の重量の比率に腫れ microcryogels の重量の比率として、microcryogels の気孔率それぞれ 13.
- Microcryogels デジタルの力と統合されたプログラム可能なシリンジ ポンプを使用しての測定 injectability ゲージ 14。
トリパンによって microcryogels の
- 染色 600 個セット青し、600 μ L 15% のゼラチン溶液を均一に分布を達成するための中断します。1 mL の注射器 1 mL microcryogel サスペンションをロードします。1 mL 注射器 1 mL/分の流量でプログラム可能なシリンジ ポンプを使用してに接続されている 27 ゲージの針を通して混合物を注入 デジタル力によって
- モニター リアルタイム注入強制的にテストをゲージし、力-時間曲線をプロットします。注入後、顕微鏡下で microcryogels の整合性を確認します
。 注: 15% (重量/巻) ゼラチン溶液中に浮遊 GMs スムーズに注入でき注射後がそのまま残っています 。
- Microcryogels の分解性を特徴付けます。
- は、まず、乾燥重量として 35 mm のペトリ皿に 600 の凍結乾燥 microcryogels の 1 つのクラスターの体重を測定します。没頭する 600 の凍結乾燥 microcryogels 2 mL 0.025% (巻/巻)/トリプシン EDTA 。 異なる時点でのセルのストレーナーを使用してソリューションから
- 収集 microcryogels (すなわち 10、20、30、40、50、60、70 分)。芯ティッシュで離れて余分なソリューションです。異なる時点で microcryogels の重量を測定し、劣化度を一定時間 0 で microcryogel の時点で microcryogel の重量の比率として計算します 。
- 、microcryogels の細孔を走査電子顕微鏡 (SEM) イメージングによる評価。
- Microcryogels フォーム 3 D への放射能にセルのオートローディング
- vac 下で脱ガス 12 h に続いて 12 h ガス暴露エチレン酸化殺菌システムによるステップ 2.1.8 から microcryogels を滅菌サウナがあります 。
- は、マウス虚血性後肢の治療のためのひと脂肪由来間葉系間質細胞 (hMSCs) を選択します。手順に従って、特定のセルが以前に 18 を報告します 。
- 成長における文化 hMSCs 培 -8 M のデキサメタゾンを 10、10、10 ng/mL 血小板由来成長因子 bb (PDGF bb)、インシュリン ・ トランスフェリン ・ セレニウム (ITS) × 1、10 ng/mL 上皮成長因子 (EGF) 2% ウシ胎児血清 (FBS) -4 M アスコルビン酸 2-リン酸、100 の U/mL ペニシリン、DMEM/f12 キーで 100 μ g/mL ストレプトマイシン。合流時の 1:3 の割合で細胞を通路します。次の実験で通路 3 に 5 のセルを使用します 。
- トリプシン hMSCs を収穫しフックス-ローゼン タール カウント チャンバーを用いて細胞数を定量化し、hMSCs 培地に 8 x 10 6 セル/ml の密度に再懸濁します 。 セクション 2.1 から 35 mm ディッシュ
- 600 microcryogels の直径 400 の単分子膜にピペット 60 μ L hMSCs サスペンション μ m。セルは、microcryogels のマイクロ構造の多孔質体に吸収されて自動的にします 。
- 加湿チャンバーに維持し, セルを付けるように 2 h の 37 ° C で。2 時間後、2 mL 培養液を追加します。2 日ごとに媒体を変更します。文化の 3 D への放射能を形成する 2 日の hMSCs ロード microcryogels.
- 後 2 日間培養、ピペットの 96 ウェル プレートのウェルあたり 100 hMSCs ロード microcryogels、メーカーによればレサズリン作業溶液の 120 μ L を追加 ' を各ウェルに s 命令。37 ° C で 2 時間インキュベートします。
- 検出蛍光レサズリン 590 の 560 nm、発光波長の励起光の波長をマイクロ プレート リーダーで実行可能な細胞代謝の nm。キットのプロトコル 13 によると今後の実験のための蛍光強度からの携帯番号を補間する hMSCs を使用して蛍光セル数の標準曲線を確立します 。
- 日レサズリンを使用して 4 に従ってステップ 0 日目から 4 日目に 2.3.7 に 0 日目から microcryogels で hMSCs の数を把握します 。
- カルセイン AM 1: 500 希釈とリン酸緩衝生理食塩水 (PBS) で Propidium ヨウ化 (ライブ/デッド染色として知られている) の 1: 250 希釈 microcryogels で細胞を染色し、蛍光顕微鏡や共焦点レーザー蛍光顕微鏡下で観察します 。
- 3 D への放射能 体内 マウス モデルにおける CLI の治療のための注射
- として報告された 11 , 雌性 balb/c ヌードマウスの重要な後肢虚血を確立 19 3 D 微少基づかせていた療法の治療効果を判定します 。
- 手順 2.3.6 セル ストレーナーに 5 mL のピペットを使用してへの放射能を転送し、離れて培養液中にフィルターを適用します 。
- 100 microcryogels 100 μ L ソリューションごとの密度で、15% のゼラチン液で、hMSCs ロード 3 D への放射能を再懸濁します 。
- 術前にオートクレーブで手術器具を滅菌、動物施設センターで動物の手術室で手術を実行します 。
- は、乾燥を防止するのには、マウスの目に適用エリスロマイシンを 1 L/分の流量で酸素を 100% で 1-3% イソフルランを含む麻酔誘導の商工会議所にマウスを配置します。長さ 1 cm の皮膚切開を通して大腿動脈とその枝 5 10 シルク縫合糸で縛るし、消費税 19. 血流を監視する
- 注入インドシアニン グリーン (ICG) (100 μ g/mL の 0.1 mL) 尾静脈注射。蛍光イメージング システムを用いた ICG 蛍光イメージングを実行します (ここでは、自家製のシステム) 反射ジオメトリ 11 。
- 筋肉内への放射能を 23 g 針、1 mL の注射器を使用して動脈切開周り薄筋の 3 つのサイトに注入します 。
- 手術後マウスを暖かく保つ加熱パッドで回復檻の中。痛みを和らげるために、目を覚ましまで継続的に監視メロキシカムを皮下注入します 。
- 後 28 日 11 蛍光による 3 D 微少治療肢の治療の効果を監視します
。 注: 挿入皮下マウスは自発の肢切断を示したときに、痛みを和らげるためにメロキシカム 。
- 安楽死マウス実験が完了した後の二酸化炭素と
。 注: ここでは、炭酸ガスで安楽死を行った 清華大学バイオメディカル分析センターの動物倫理委員会によって承認された厳密なプロトコルに従ってします 。
3。高スループット薬物をスクリーニングするための微少アレイ チップの組立
- オンチップ細胞培養のための microcryogel 配列のアセンブリ
- 従来のウェル プレート寸法に従ってセクション 1.1 でデザインを編集すなわち、マルチ 384 ウェル フォーマット、16 × 24 の井戸 (列によって行) の配列をデザイン各 2 mm 径・ 4.5 mm センター-センターの間隔 。
- 1.1 節で説明したようにレーザーが 500 μ m 厚の PMMA シートに刻むです 。
- 作製 microcryogels 前述のセクション 1.2 を使用してから得られるマルチ 384 ウェル アレイ チップは、3.1.2 をステップ実行します。Microcryogel アレイ チップとしてこの microcryogel を含む配列を指定します 。
- Microcryogel アレイ チップを洗う 50 mL 0.1 M NaBH 4 と uncross-リンク任意の残留アルデヒドを癒やすため、各時間を 3 回、2 h の 50 mL の脱イオン水で繰り返しすすぎします 。
- 水を捨てて、1.2.7 のステップによると lyophilizing の前に 4 に 16 時間-20 ° C で microcryogel アレイ チップを凍結します 。
- 16 × 24 を含むステップ 3.1.1 の変更 384 マルチよく配列設計井戸、3 mm 径・ 4.5 mm センター - 間隔の各します 。
- 極薄 (10 μ m) 生体適合性両面粘着テープのシートから、バッキングの片側を削除、3 mm 厚のアクリル シートの部分の 1 つの側面に貼り付けます。レーザーは、1.1 節によるとこの 3 mm 厚のアクリルにステップ 3.1.4 からデザインを刻みます。この配列は、貯留層配列として指定されます 。
- Microcryogel 配列整列貯水池アレイ チップとチップし、一緒に準拠 3 D microcryogel アレイ チップのオンチップ細胞培養のための組み立てに密に。1 h. の紫外放射による殺菌
- ストア 3 D microcryogel アレイ チップをさらに実験のための部屋の温度で真空 。
- 3 D 微少配列に薬物のスクリーニング
- 細胞培養のための湿度チャンバーとして 25 mL 滅菌脱イオン水と湿式ボックスを埋めます。予熱で加湿 5% CO 2 インキュベーター 37 ° C
- は、非小細胞肺癌細胞 (NCI H460) と標準プロトコルに従って組織培養皿から肝細胞癌細胞 (HepG2) を収穫し、再最終濃度 10 6 セル/mL x 1.0 に培地にサスペンドします。ミックス徹底的
。 注: 10 %fbs、100 U/mL ペニシリン ストレプトマイシン 100 μ g/mL と RPM1640 は、NCI H460 に使用されます。Hepg2 細胞の 10 %fbs、100 U/mL ペニシリン ストレプトマイシン 100 μ g/mL と DMEM を使用します 。
- は、インキュベーターから湿度チャンバーを削除します。3.1.9 湿度チャンバー内のステップから慎重に組み立てられた 3 D の場所 microcryogel アレイ チップをピンセットを使用します。商工会議所で水を microcryogels を濡らさないように注意してください 。
- 混合細胞懸濁液、分注 3 μ を徹底的に、細胞懸濁液を各ウェルに microcryogel に直接します
。 注: ピペット チップは軽く、細胞懸濁液を追放する前に、microcryogel の表面を触れる必要があります。セルは吸収によって microcryogel に自動ロードです。周辺の井戸のセルをシードしないようにします 。
- 96 ch 液体ハンドラーなどのマルチ チャンネル ピペットを使用して microcryogel 細胞が播種後もメディアの追加 10 μ L。中は、周辺の井戸にも追加されます
。 注: 使用 RPM1640 メディア 10 %fbs、100 U/mL ペニシリン 100 μ g/mL streptomycin H460 細胞。HepaG2 細胞 10 %fbs、100 U/mL ペニシリン ストレプトマイシン 100 μ g/mL と DMEM メディアを使用します 。
- 文化セル ロード microcryogel アレイ チップ加湿 5% で 24 時間湿度チャンバー フォーム 3 D 微少配列に 37 ° C で CO 2 インキュベーター 。
- 溶解ドキソルビシンと IMMLG 8439 9 ジメチルスルホキシド (DMSO) 10 mM のストック溶液を形成します。2 から 10 倍希釈濃度勾配を形成するための培養培地で薬を希釈 200 μ M に nM 。
- 追加 10 μ L 各薬液の井戸。コントロールとして 0.1 %dmso (培地で希釈) を使用します。5% の加湿で薬物読み込まれた 3D 微少配列を孵化させなさい 37 ° C で 24 時間のための CO 2 インキュベーター
- 追加 4 μ L を各ウェル レサズリン原液の。マイクロ プレート リーダーの 2 場所 3 D 微少アレイの 37 ° C で、590 の 560 nm、発光波長の励起光の波長で実行可能な細胞代謝レサズリンの蛍光を検出 nm 。
- は、さらにデータ処理の前にすべての井戸からレサズリン基準信号を減算します。その蛍光信号制御井戸の平均蛍光信号を分割して各ウェルの細胞生存率を計算します 。
- は、印刷ソフトウェア y 軸と x 軸として薬物濃度の 10 を底とする対数として細胞生存率の用量-反応曲線をプロットします。0.5 の細胞生存率で 50% 阻害濃度 (IC50) を補間します 。
結果
作製と 3 D の微少の形成のための microcryogels の評価。
このプロトコルによれば microcryogels はフォーム 3 D への放射能と個々 の microcryogels または microcryogel アレイを作製し、再生治療や創薬スクリーニング、それぞれ (図 1) に適用されました。PMMA から作製した Microstencil アレイ チップは、microcryogel アレイ チップの micromolds として適用されました。可変の幾何学的なデザインは、microstencil アレイ チップの準備でした。我々 は (すなわち円、楕円、三角形、およびクローバー) 様々 な形やサイズの異なる円形の microstencil アレイ チップを含んだ例として代表的な 45 mm × 14 mm microstencil アレイ チップを選んだ (直径 = 100、200、400、800 μm). micromolds アレイ チップ上の可視性を高めるためには、光射画像 (図 2 a、 B) が観察されました。Microcryogels アレイ チップから収穫は、所望の形状とサイズ (図 2、 D) を出展しました。必要な幾何学的な機能とそのような microcryogels は、ネイティブの組織の特定のアーキテクチャを模倣する別の細胞単位を形成するためのテンプレートとしておそらく適用でした。定義済みの図形とサイズ (図 3 a) 収穫の GMs (ゼラチン microcryogels) があった。SEM 観察では、microcryogels に相互接続された多孔構造 (図 3 b) 30-80 μ m の範囲の細孔径が含まれていることを示した。
改良された虚血性肢サルベージの hMSCs ロードへの放射能の強化 injectability
デジタルフォース ゲージ14統合プログラム可能なシリンジ ポンプを使用して、GMs の injectability を定量的に評価します。1 mL/分の流量で 1 mL あたり 1,000 microcryogels の密度と GMs は下 6 N, 10 N20 (図 3 f) の臨床的な許容力低かったを注入されました。セルの保護により、GMs に基づい、GMs で hMSCs 高い生存率を持っていたし、文化 (図 3 H) の 5 日間投与後偉大な増殖能力を維持します。
マウス下肢虚血モデルは注射立体的ロードへの放射能の治療効果を評価するために選ばれました。虚血肢の生理学的状態は、28 日後手術 (図 4 a) を検討しました。偽のグループまたは GMs コントロール グループで下肢救済は認められなかった。105無料細胞治療グループで 50% トータルトー切断、25% 部分的足趾切断 25% 部分的な下肢切断観察された 7 日以内 80% 肢の損失および 28 日後 20% トータルトー切断に終っています。対照的に、10 の5 hMSCs への放射能治療達成向上肢サルベージ (75%) 25% のマウスを示した自発足切断 28 日後 106 hMSCs だけほとんどの以前の研究で使用される効果的なセルの最小番号だった。肯定的な制御21として選ばれました。4 マウスの唯一の 2 肢サルベージがすべてのマイナーな壊死があった。
血液灌流は監視され、インドシアニン グリーン (ICG)、FDA 承認された血管造影の造影剤の援助の評価。その結果, 蛍光信号登場および微少扱われるマウス 106無料 hMSCs 投与マウスのこと。(図 4 b) 28 日目まで偽または GM グループ内虚血性後肢で明白である蛍光信号はありません。
これらの結果はさらに、3 D 微少アシスト hMSCs 療法がこれまでマウス モデル細胞を用いた治療のため最低限の有効投与量を表す CLI 治療優れた治療効果を達成を確認しました。
3 D 微少アレイ チップの高スループット薬剤毒性スクリーニング
オンチップ細胞培養のためのすぐに使える 3 D microcryogel 配列を凍結乾燥後 PMMA チップ microcryogels を保持し、生体適合性の粘着テープ (図 1 に対応するよくアレイチップとを組み合わせることによって簡単に作製できます。と図 5 a)。この 2 つの部分セル文化配列のトップもアレイ チップは、下部アレイ チップ上に固定された 3 D microcryogel で、細胞を培養しながら培養液、薬液、アッセイ用試薬用タンクとして役立った。上下配列チップ間粘着テープは、創薬のための実用的なツールを提供するための高速 3 D 細胞培養 (図 5 b) の 384 個々 の井戸の世代を許可しました。
プロトコルに従って、3 D 微少配列は直接 microcryogels に貯水池にメディアを追加する前に細胞を播種によって結成されました。RFP ラベル NIH 3T3 細胞を使用して、microcryogels (図 5、 D) の 3 D アーキテクチャ内で複数のレイヤーで、細胞は, 一様にデモンストレーションを行った。SEM 像を示した細胞が毛穴の壁にしっかりと付着し、も拡張糸状に沿ってまたは (図 5 e) microcryogels で隙の隣の壁全体を展示します。
我々 は、高スループット薬物の検査の 2 つの癌細胞ラインおよび 2 つの化合物を使用して、この 3 D の微少配列を適用することの可能性を示した。肝細胞癌細胞 (HepG2) は、非小細胞肺癌細胞 (NCI H460) は IMMLG-8439、新しい腫瘍抑制剤で治療されたドキソルビシンと扱われました。各薬品の 5 ~ 9 離散濃度はネガティブ コントロールとして培養培地に 0.1 %dmso の複製として六つの隣接する井戸投与。伝統的な 2 D ウェル プレートで培養された細胞の細胞毒性の試金を同様に行った。培養 24 時間後セル実行可能性の試金は、2 D と 3 D の両方で細胞の薬物反応を評価するために使用されました。薬物応答曲線が異なる薬物濃度で正規化された細胞生存率を使用してプロットされ、IC50 は、これらの曲線から補間されます。高い IC50 値は、セルより耐性があることを示します。図 5 階 5Iから、2 D よりも 3 D の微少アレイ上培養細胞に薬剤耐性で大幅な増加を観察しました。HepG2 細胞に対するドキソルビシン IC50 165.959 μ M、18.239 を基準に達した 2 D の nMIC50 の IMMLG-8439 NCI H460 細胞同様に 331.894 に昇格だけ 1.294 を必要としながら 3 D で nM 2 D の nM。そのような観測は他研究者22,232D 文化を越えて三次元培養に増加薬剤耐性の報告と一致にあった。
我々 は薬物抵抗性と比較すると 3 D の微小環境の複雑さのような増加を帰因させる、二次元文化の平面構成は。SEM 像では、HepG2 細胞収集として回転楕円体、microcryogel のマクロ孔の表面を飾ることを明らかにしました。これらの細胞が密集し、HepG222薬剤抵抗性の源になりうるこのような強化された細胞間の相互作用。これらのセルのクラスターはなかったこと自由に中断された回転楕円体、彼らはまだマトリックス (図 5、 H) にいくつかの接着を維持しても面白かった。逆に、上皮-間葉-移行 (EMT) が、NCI H460 非小肺癌がん細胞は 3 D microcryogels で培養したときに発生したと推測されました。NCJ H460 細胞 HepG2 のようなクラスタ リングの代わりに繊維芽細胞 (図 5 j, K) のように広がっていった。それ故に、我々 は薬剤耐性の増加がより悪性状態18,19,20,21,22 に NCI H460 細胞の転移に起因できると推測 ,23。
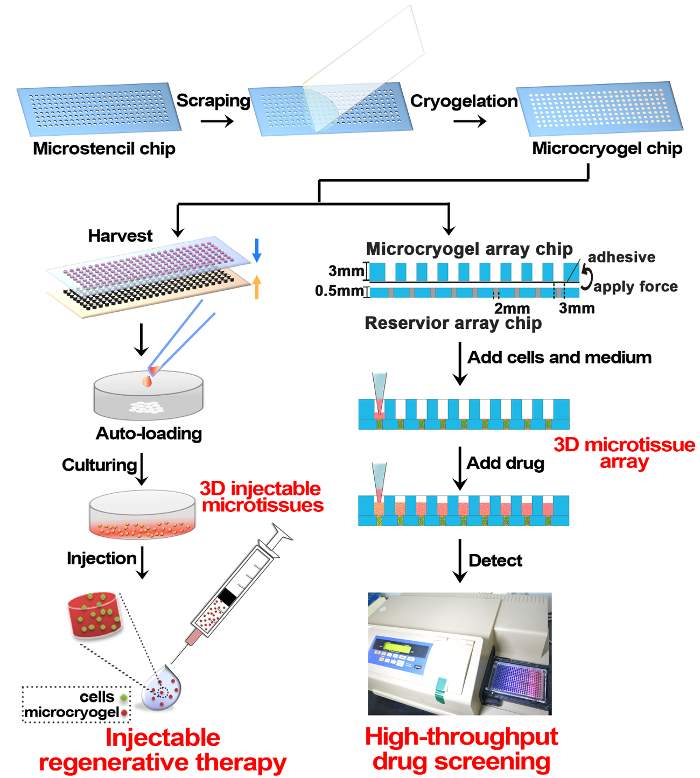
図 1: 3 D 微少作製と再生療法、薬剤スクリーニングでの応用模式。簡単に言えば、サイズと形状制御可能な microcryogel チップがゼラチンの cryogelation アレイチップ PMMA 上に作製しました。Microcryogel チップは、個々 の microcryogels として収穫をオフ チップをすることができます、さらに、個々 の microcryogels はセル搭載自動車と注射の再生療法の 3 D への放射能を形成する培養することができます。Microcryogel チップの別のアプリケーションは、貯水池アレイ チップを組み立てるし、さらに、読み込むセルと文化 3 D 微少配列高スループットの薬剤のスクリーニングのためにです。この図の拡大版を表示するのにはここをクリックしてください。
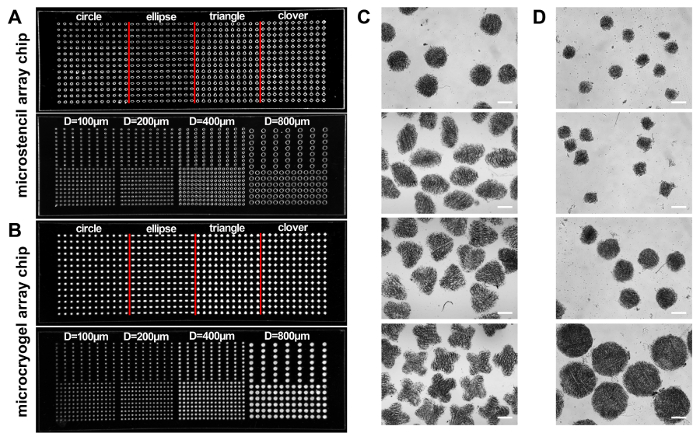
図 2:Microstencil アレイ チップします。(A, B)含む 2 つの PMMA microstencil チップの写真は (すなわち円、楕円、三角形およびクローバー) さまざまな形とサイズの異なる円形マイクロウェル アレイ (直径: 100、200、400、800 μ m)、それぞれ (A)2 つの対応する microcryogel アレイ チップ (B)。(C、 D)2 つの microcryogels アレイ チップから収穫される個々 の microcryogels の顕微鏡画像。スケール バー = 500 μ m。この図は、参照14からの許可と変更されています。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 3 D 注射への放射能の特性。(A) 収穫 microcryogels の写真。(B) 相互接続を示す microcryogels と多孔体構造の電子顕微鏡像 (SEM) イメージをスキャンします。(C、 D)蛍光顕微鏡と 3 D 再生ライブ/デッドとローダミンに染まる hMSCs ロードへの放射能の共焦点像ファロイジン。(E) の定量化 hMSCs オートローディングと密度の異なる初期読み込み GMs で増殖。(F) リアルタイム射出力 1,000 のトリプル注射用測定曲線 1 mL/分噴射率 (1,000-1-15%) で 15% (重量/巻) ゼラチン溶液の 1 mL の GMs。(G) Live/デッド セル hMSCs ロードへの放射能プレ噴射やポスト噴射の実行可能性の試金。GMs 文化の 1、3、および 5 日後投与後に読み込まれた hMSCs の (H) 増殖 (n = 3)。* p < 1 日目に比べて 0.05、瞳孔。± SEM. を意味するようにデータが表示されます。この図は、参照11からの許可と変更されています。この図の拡大版を表示するのにはここをクリックしてください。
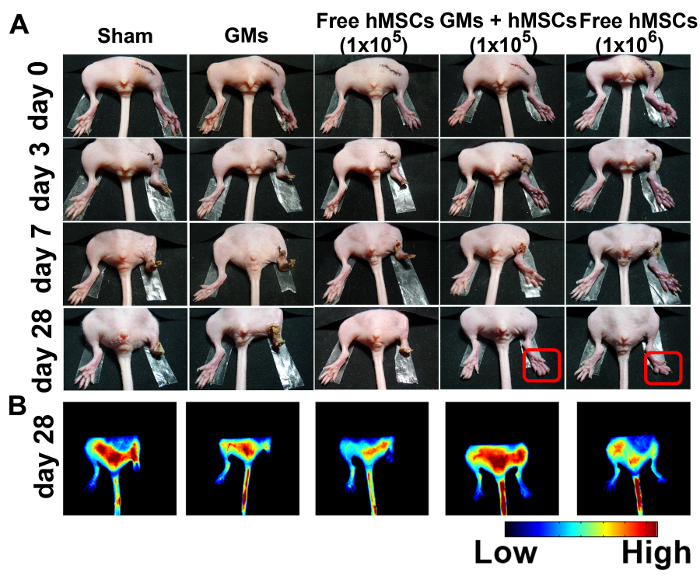
図 4:サルベージを改善し、虚血性後肢 3 D 注射への放射能処理における血管新生を強化します。(A) 偽の代表的な写真 (n = 4)、空白の microcryogels (n = 4)、hMSCs を無料 (105) (n = 8)、hMSCs (105)-ロードへの放射能 (n = 8)、無料の hMSCs (106) (n = 4) 治療後 0、3、7、28 日。(B) 蛍光画像を取得した 100 ICG 投与 28 日目で s。この図は、参照11からの許可と変更されています。この図の拡大版を表示するのにはここをクリックしてください。

図 5: 高スループット薬剤スクリーニングのための 3 D の微少配列。(A) 3 D 微少配列アセンブリ、および (B) レサズリン細胞生存率試験、アレイ上で実行後に 384 ウェル マルチ形式での写真。(C) RFP 3T3 細胞内 microcryogel 後播種 (スケールバー = 200 μ m)。(D) 三次元核染色細胞 microcryogel の多層膜で均一に分布を描いたの。(E) microcryogels 壁の多孔体に広く広がって RFP 3T3 細胞の走査型電子顕微鏡写真画像 (スケールバー = 20 μ m)。(F) ドキソルビシン HepG2 細胞とを示す 3 D 微少配列 (私) IMMLG 8439 NCI H460 の細胞での細胞毒性評価 IC50 に比べ、2 D 対応増加。意味 ± SD. (G) microcryogel HepG2 細胞の小さな回転楕円体としてデータが表示されます (スケールバー = 100 μ m)、microcryogel の壁 ( H内のアスタリスク) 部分的な遵守 (スケールバー = 20 μ m)。(J) NCI H460 細胞付着と、microcryogel 内で広がる (スケールバー = 100 μ m)。(K) NCI H460 細胞出展 fibroblastic の形態 (スケールバー = 20 μ m)。この図は、参照9からの許可と変更されています。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
薬剤スクリーニングのための再生医学との in vitroモデルは、組織工学5,6,7,8,9の 2 つの重要なアプリケーションです。これらの 2 つのアプリケーションは、非常に異なるニーズを持って、それらの間の共通点ある培養条件詳細バイオミメティックのセル関数19を強化する必要があります。研究で改良されたセル関数のみを我々 は病気より20,21, を扱うことができるし、我々 が薬物探索6,7を加速することが培養細胞は薬物応答をより正確に反映している場合。生体内で生着後の細胞の生存は、スループットは一度に大量化合物の創薬スクリーニングの重要な再生医療の重要な要件です。これらの 2 つの要件は、それぞれのアプリケーションに固有とほとんど 1 つの技術は要件を満たすことができます。したがって、我々 は一意に多孔体 microcryogels、再生療法の個別セル ロード キャリアとして収穫オフチップことができるまたはチップにさらに保持されますを生成するレゾルシノールーアセトアルデヒド準備と微細加工技術を統合して高スループット薬剤スクリーニングのためのアレイにまとめたもの。マイクロ スケール、これらの新しい microcryogels の macroporosity 自動と同種の単純な吸収による細胞の読み込みを許可します。新規 microstencil microcryogel アレイ チップの作製を使用すると、数百人と均一で再現性のある幾何学的な機能を持つマイクロ cryogels の何千も簡単かつ効率的に生成でした。Microcryogels は準備でき、真空包装共通の 3 D への放射能の準備を容易にする市販、すぐに使用できる製品として後続のアプリケーション研究所によって保存されています。この加工技術を使用して、共通点 (良いバイオミミ クリーの 3次元培養条件) と 2 つの異なるアプリケーションの特定の要件の両方を満たすことができました (再生医療の注入中に細胞を保護する弾力性と高スループットの薬剤のスクリーニングを配列形式で)。
細胞を用いた治療法は、様々 な損傷した組織や臓器の24の修理のための大きい約束を保持しています。ただし、セルの保持、細胞生存率と治療の再現性機械的損傷のためまだ貧しい中には注入、周囲の組織と虚血、炎症病変内の体内環境に高い漏れ組織25。一部の研究者は、無料の細胞の注入を改善するために前もって形成された細胞の集合体を使用しています。しかし、手に負えない集計番号26不均一サイズ、高コストにつながる細胞の集合体を形成する細胞の大量が必要です。また、機械的損傷および細胞死避けられないがまだ注入中です。また、細胞とゲル化その場で細胞保存27を実現するためと混合できます応答性生体材料 (例えば、熱や pH に敏感なヒドロゲル)、生体材料による細胞療法を開発しました。ただし、その場で架橋材料は細胞の病変サイトで虚血性および炎症性微小環境への即時の露出で細胞の in vitroと結果のプライミングを許さない。治療効率を高めるためにこれらの問題を解決するために急務です。このプロトコルを用いて作製した microcryogels の主な利点は、その小型サイズと優れた弾力性、携帯配信への応用を促進することの結果として、必要な injectability です。Microcryogels の injectability は携帯配信中に細胞保護を有効、ことができる両方の細胞外マトリックス (ECM) タンパク質を強化する microcryogel のセルの生体外でプライミング後 3 D 注射への放射能に構成される彼らがそれゆえ細胞間相互作用と同様、蒸着。3 D の注射への放射能生存率、生着セルの保護を容易にするために最適な配信戦略を表すミクロ組織のようなアンサンブルしたがって病変サイトで究極の治療効果を向上させます。
細胞療法の治療効果は強化、ほか我々 の結果は細胞の薬剤に対する 3次元微小環境の複雑な影響を示唆したも。リニアアクチュエータ培養条件を利用して、体外細胞薬剤応答より生体内の反応、薬物探索6,7、加速の代表者を引き出すために可能になります。 28。3 D の細胞の文化構成の普及した選択であり、多くの技術が開発されている回転楕円体を支援する研究者は、回転楕円体を生成します。ナノ出版社8変更低付着性組織培養プレート29またはプレート表面の細胞を強制する使用されたまた細胞-マトリックス接着を防止することにより集計します。これらの技術が比較的簡単に使えますが、回転楕円体のサイズ変動と同様、メディア交換およびその他の操作中に回転楕円体の損失などの問題はこのような技術6の大規模な採用を妨げる問題が。吊りを使用してより均一な回転楕円体を形成することができる30,31,32,33をドロップするを使用していない場合、しかしそれは労働集約的な専門板。ウェル ドロップ プレートをぶら下げ、リキッドハンド リング システム6,31との統合を使用して特化、高スループット スクリーニングを実現できます。回転楕円体の文化の最大の欠点は、すべての生理学的および病理学的組織開発34で重要な役割を果たすに識別されている ECM の欠如です。脳モデル研究は、純粋な回転楕円体と比較しての ECM 足場内培養スフェロイドいた薬剤耐性を増加、高い乳酸生産のためアシドーシスを強化、関連の表現を増やすことによる血管新生の改善を明らかにしました。34をを要因します。他の研究では、マトリックスの存在が腫瘍浸潤転移3,35,36などの反復を EMT とサポートを促進するために必要な機械シグナリングを提供できることも示されています。,37。
ECM の病理学的開発の重要性の理解とともに、3 D 培養法に ECM を組み込むことで体内の状況より良い6を模倣を助けることができる疑いがないです。天然または合成材料のゲルは、モデルを生成するいくつかの in vitro 3 D 腫瘍の柔軟性のための化学療法の評価および生物物理プロパティ (剛性) など38の可制御性のために適用されています。,39,40,41,42このメソッドのいくつかの欠点が薬物での普及を妨げている生物物理特性ヒドロゲルいた確かに腫瘍細胞より正確な創薬スクリーニングのための重要な生物学的機能をモデル化、中。スクリーニング。細胞の存在下でポリマーの架橋ゲルのマトリックスは、細胞損害を与えるかもしれない内のセルをカプセル化する必要があります。ない限り、異なる生物物理プロパティのヒドロゲルは細胞内にカプセル化するさまざまな課題を提示します。柔らかいゲルの高含水率は、細胞の成長をサポートできるが、このようなハイドロゲルが低下する、すぐに 3 D 細胞培養のために短期的なサポートを与えてします。その一方で、高架橋と硬めのゲルが低下低下する低含水率は細胞の成長をサポートできませんでした、高架橋剤の濃度は通常、高 cytotoxicit を誘導します。y43,44。だから、ハイドロゲルと 3 D 細胞培養を準備する手間がかかり、ヒドロゲル前駆体溶液の温度制御は重要な可能性が薄い調剤ヒントの妨害とシステムを扱うほとんどの高スループット液体と互換性がないだけでなくハイドロゲルのヒント内のゲル化。これらの欠点はこのように代替 ECM サロゲート、すなわち、足場ベース ECM34の検索を求めています。
前もって形成された足場を使用すると、細胞は生体材料作製プロセスを免除することができるし、厳しい条件は、細胞の損傷を恐れることがなく使用できる足場製作をより細かく制御の可能性を提供するため。いくつかの調査は、3 D 足場で培養腫瘍細胞が悪性腫瘍の増加と拡張セル ECM 相互作用45,46,による 2 D で培養した細胞と比較してより高い耐性を表示示されている47です。 そのような観察はここで示した結果と一致しています。他の作品、我々 はさらに 3 D 微少配列と他の技術は、上記以上の利点の汎用性を実証しました。最近の仕事、3 D 微少配列培養 HepaRG 細胞の上皮性の表現型を促進することによって肝機能を強化することができました、このような配列を行った薬剤肝毒性評価47。おかげで 3次元多孔質足場内細孔径の均一性、初期細胞播種密度に関係なく、50-80 μ m 内に肝細胞スフェロイドのサイズを制御することができました。これは無料の形成上重要な利点を提供します不均一サイズの回転楕円体。回転楕円体成長均一に各足場内だけでなく、井戸間のセルも一様に、係数の変化 (CV) 2 D で播種細胞に匹敵するを与えるシードされて (すなわちCV = 0.09 3 D 微少配列と CV = 2 D 商業板 0.05;データは表示されません)。別の仕事で実質再プログラム組合せ療法48のスクリーニングのため腫瘍間質相互作用を要約する 3 D 微少配列の肝 microtumor を形成することができたことを確認しました。肝の腸壁は、長期 (5 日) 高密度の腫瘍細胞と線維芽細胞の共培養によって生成されました。コンパクトなセルと同様に生体内で32が観察された肝の microtumor に形成された ECM 構造により薬物拡散への障壁を見ました。ルシフェラーゼ ラベルがん細胞と機械的にプライミング間質細胞、がん細胞の特定の読み出しとしてルシフェリン発光と組み合わせて使用して高スループットの新規治療薬または腫瘍間質に対しての組み合わせスクリーニング相互作用が可能です。
私たちの技術の多くのユニークな利点にもかかわらずは、現在 microcryogels の欠点は、非透明性、microcryogels のセルの詳細な光学的観測を妨げることです。Microcryogels 観察のための細胞のイメージングを強化する光学特性を微調整、これらの microcryogels のさらなる改良が含まれます。また、剛性など重要な生物物理学的特性より異なった生物物理特性の生理学的および病理学的組織を模倣する場合に対処する必要があります私たちの手法で検討されていません。
私たちの技術は、3 D への放射能を簡易に生成できますが中、実験の成功のいくつかの注意を取られなければなりません。3 D microcryogels microstencil アレイ チップを製造、エアカーテンに置かれたとき、microcryogels がフリーズすることが重要です。したがって、エアカーテンをあらかじめ冷たい、エアカーテンに-20 ° C のフリーザーから microcryogels をすばやく転送するに不可欠です。Lyophilizing 時に lyophilizing する前に、microcryogels の融解は、毛穴を縮小し、したがって作製した microcryogels の気孔率に影響する原因となります。配列形式の 3 D への放射能を培養、2 つの配列間の接着性が井戸間の交差汚染を防ぐために十分なことを確認する注意が必要です。また、スループットを増やすことでその利点がある細胞培養の小型化、試薬消費量の削減、その欠点は、低文化ボリュームはメディアを頻繁に補充することがなく長期的な細胞培養をサポートできませんでした。だけでなく、細胞懸濁液のだけいくつかマイクロリットル以来、メディアの蒸発による細胞生存率に及ぼす影響を防ぐために文化環境の湿度を維持することが重要またはメディアが追加されます。蒸発は、周辺井戸の細胞の生存率にも影響します、したがってこれらの井戸で細胞を培養を避けるために重要です。
それにもかかわらず、当社の堅牢な技術は潜在的 3次元培養基本並進の科学を加速するため、ほとんどの実験室の一般的な細胞操作法を作ることができる使いやすい方法で 3 D への放射能を生成するオプションを提供します進歩。
開示事項
著者が明らかに何もありません。
謝辞
この作品は中国国家自然科学基金によって財政上支えられる (補助金: 81522022、51461165302)。著者は、デュ研究室メンバーの一般的な支援を認めたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Gelatin | sigma | G7041 | All other reagents were purchased from Sigma-Aldrich (St. Louis, MO) unless otherwise indicated. |
| Glutaraldehyde | J&K | 902042 | Used as crosslinker in preparation of material. |
| Glass cover slip (24 x 50 mm) | CITOGLASS, China | 10212450C | To scrape prcursor solution onto microstencils array chips. |
| Sodium borohydride, NaBH4 | Beijing Chemical Works | 116-8 | To wash remaining glutaraldehyde away after gelation. |
| Vacuum jar | asperts, China | VC8130 | To preserve microgels under vacuum. |
| Polymethylmethacrylate (PMMA) sheets | Sunjin Electronics Co., Ltd, China | Ordinary PMMA sheets. | |
| Rayjet laser system | Rayjet, Australia | Rayjet 50 C30 | To engrave PMMA sheets to form wells. |
| Plasma Cleaner | Mycro Technologies, USA | PDC-32G | To make PMMA hyphophilic. |
| Lyophilizer | Boyikang, China | SC21CL | To lyophilize materials. |
| Trypan Blue solution (0.4%) | Zhongkekeao, China | DA0065 | To dye microgels. |
| Doxorubicin hydrochloride | ENERGY CHEMICAL, China | A01E0801360010 | To test drug resistance of cells in 2D or 3D microgel. |
| Live/dead assay | Dojindo Molecular Technologies (Kumamoto, Japan) | CS01-10 | To distinguish alive and dead cells. |
| Cell Titer-Blue | Promega (Wisconsin, USA). | G8080 | To test cell viability. |
| Cell strainer | BD Biosciences, USA | 352360 | To collect microgels. |
| D-Luciferin | SYNCHEM (Germany) | s039 | To tack cells. |
| Scanning electron microscope | FEI, USA | Quanta 200 | To characterize microgel morphology. |
| Mechanical testing machine | Bose, USA | 3230 | To measure mechanical features. |
| Programmable syringe pump | World Precision Instruments, USA | ALADINI 1000 | To test injactabiliy. |
| Digital force gauge | HBO, Yueqing Haibao Instrument Co., Ltd., China | H-50 | To test injactabiliy. |
| Ethylene oxide sterilization system | Anprolene, Anderson Sterilization, Inc., Haw River, NC | AN74i | To sterilize microgels with ethylene oxide gas. |
| Microplate reader | Molecular Devices,USA | M5 | To measure fluorescence intensity in micro-array. |
| Confocal microscope | Nikon, Japan | A1Rsi | To observe cell distribution in 3D. |
| Xenogen Lumina II imaging system | Caliper Life Sciences, USA | IVIS | To track cell in animals. |
| Liquid work stataion | Apricot design,USA | S-pipette | To load medium or cell suspension high-throuputly. |
参考文献
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Abbott, A. Cell culture: biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Fischbach, M. A., Bluestone, J. A., Lim, W. A. Cell-based therapeutics: the next pillar of medicine. Sci Transl Med. 5 (179), 179(2013).
- Kuraitis, D., Giordano, C., Ruel, M., Musaro, A., Suuronen, E. J. Exploiting extracellular matrix-stem cell interactions: a review of natural materials for therapeutic muscle regeneration. Biomaterials. 33 (2), 428-443 (2012).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discov Today. 18 (5-6), 240-249 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay Drug Dev Technol. 11 (7), 435-448 (2013).
- Yoshii, Y., et al. High-throughput screening with nanoimprinting 3D culture for efficient drug development by mimicking the tumor environment. Biomaterials. 51, 278-289 (2015).
- Li, X., et al. Micro-scaffold array chip for upgrading cell-based high-throughput drug testing to 3D using benchtop equipment. Lab Chip. 14 (3), 471-481 (2014).
- Qi, C., Yan, X., Huang, C., Melerzanov, A., Du, Y. Biomaterials as carrier, barrier and reactor for cell-based regenerative medicine. Protein Cell. 6 (9), 638-653 (2015).
- Li, Y., et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia. Proc Natl Acad Sci U S A. 111 (37), 13511-13516 (2014).
- Liu, W., et al. Magnetically controllable 3D microtissues based on magnetic microcryogels. Lab Chip. 14 (15), 2614-2625 (2014).
- Zhao, S., Zhao, H., Zhang, X., Li, Y., Du, Y. Off-the-shelf microsponge arrays for facile and efficient construction of miniaturized 3D cellular microenvironments for versatile cell-based assays. Lab Chip. 13 (12), 2350-2358 (2013).
- Liu, W., et al. Microcryogels as injectable 3-D cellular microniches for site-directed and augmented cell delivery. Acta Biomater. 10 (5), 1864-1875 (2014).
- Hakanson, M., et al. Controlled breast cancer microarrays for the deconvolution of cellular multilayering and density effects upon drug responses. PLoS One. 7 (6), e40141(2012).
- Du, Y., et al. Rapid generation of spatially and temporally controllable long-range concentration gradients in a microfluidic device. Lab Chip. 9 (6), 761-767 (2009).
- He, J., et al. Microfluidic synthesis of composite cross-gradient materials for investigating cell-biomaterial interactions. Biotechnol Bioeng. 108 (1), 175-185 (2011).
- Zeng, Y., et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing. Acta Biomater. 25, 291-303 (2015).
- Yang, F., et al. Genetic engineering of human stem cells for enhanced angiogenesis using biodegradable polymeric nanoparticles. Proc Natl Acad Sci U S A. 107 (8), 3317-3322 (2010).
- Zhang, L., et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia. Stroke. 42 (5), 1437-1444 (2011).
- Kinnaird, T., et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms. Circulation. 109 (12), 1543-1549 (2004).
- Fischbach, C., et al. Engineering tumors with 3D scaffolds. Nat Methods. 4 (10), 855-860 (2007).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Gimble, J. M., Guilak, F., Bunnell, B. A. Clinical and preclinical translation of cell-based therapies using adipose tissue-derived cells. Stem Cell Res Ther. 1 (2), (2010).
- Thai, H. M., et al. Implantation of a three-dimensional fibroblast matrix improves left ventricular function and blood flow after acute myocardial infarction. Cell Transplant. 18 (3), 283-295 (2009).
- Moreira Teixeira, L. S., et al. High throughput generated micro-aggregates of chondrocytes stimulate cartilage formation in vitro and in vivo. Eur Cell Mater. 23, 387-399 (2012).
- Ifkovits, J. L., et al. Injectable hydrogel properties influence infarct expansion and extent of postinfarction left ventricular remodeling in an ovine model. Proc Natl Acad Sci U S A. 107 (25), 11507-11512 (2010).
- Murphy, A. R., Laslett, A., O'Brien, C. M., Cameron, N. R. Scaffolds for 3D in vitro culture of neural lineage cells. Acta Biomater. , (2017).
- Cheng, V., et al. High-content analysis of tumour cell invasion in three-dimensional spheroid assays. Oncoscience. 2 (6), 596-606 (2015).
- Huber, J. M., et al. Evaluation of assays for drug efficacy in a three-dimensional model of the lung. J Cancer Res Clin Oncol. 142 (9), 1955-1966 (2016).
- Lamichhane, S. P., et al. Recapitulating epithelial tumor microenvironment in vitro using three dimensional tri-culture of human epithelial, endothelial, and mesenchymal cells. BMC Cancer. 16, 581(2016).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Monjaret, F., et al. Fully Automated One-Step Production of Functional 3D Tumor Spheroids for High-Content Screening. J Lab Autom. 21 (2), 268-280 (2016).
- Shologu, N., et al. Recreating complex pathophysiologies in vitro with extracellular matrix surrogates for anticancer therapeutics screening. Drug Discov Today. 21 (9), 1521-1531 (2016).
- Ho, W. J., et al. Incorporation of multicellular spheroids into 3-D polymeric scaffolds provides an improved tumor model for screening anticancer drugs. Cancer Sci. 101 (12), 2637-2643 (2010).
- Pathak, A., Kumar, S. Independent regulation of tumor cell migration by matrix stiffness and confinement. Proc Natl Acad Sci U S A. 109 (26), 10334-10339 (2012).
- Wei, S. C., et al. Matrix stiffness drives epithelial-mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway. Nat Cell Biol. 17 (5), 678-688 (2015).
- Romero-Lopez, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Xu, X., Sabanayagam, C. R., Harrington, D. A., Farach-Carson, M. C., Jia, X. A hydrogel-based tumor model for the evaluation of nanoparticle-based cancer therapeutics. Biomaterials. 35 (10), 3319-3330 (2014).
- Xu, X., et al. Recreating the tumor microenvironment in a bilayer, hyaluronic acid hydrogel construct for the growth of prostate cancer spheroids. Biomaterials. 33 (35), 9049-9060 (2012).
- Nyga, A., Loizidou, M., Emberton, M., Cheema, U. A novel tissue engineered three-dimensional in vitro colorectal cancer model. Acta Biomater. 9 (8), 7917-7926 (2013).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochem Biophys Res Commun. 433 (3), 327-332 (2013).
- Hoare, T. R., Kohane, D. S. Hydrogels in drug delivery: Progress and challenges. Polymer. 49 (8), 1993-2007 (2008).
- Delgado, L. M., Bayon, Y., Pandit, A., Zeugolis, D. I. To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. Tissue Eng Part B Rev. 21 (3), 298-313 (2015).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In vitro three-dimensional (3D) models in cancer research: an update. Mol Carcinog. 52 (3), 167-182 (2013).
- Zhang, M., Boughton, P., Rose, B., Lee, C. S., Hong, A. M. The use of porous scaffold as a tumor model. Int J Biomater. 2013, 396056(2013).
- Wang, J., et al. Engineering EMT using 3D micro-scaffold to promote hepatic functions for drug hepatotoxicity evaluation. Biomaterials. 91, 11-22 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved