Method Article
Microtissues 3D pour thérapie régénérative Injectable et de dépistage des drogues de haut débit
Dans cet article
Résumé
Ce protocole décrit la fabrication de microcryogels élastique macroporeux 3D en intégrant la microfabrication avec la technologie cryogelation. Lorsqu’il se charge avec des cellules, microtissues 3D sont générés, qui peut être facilement injecté in vivo pour faciliter la thérapie régénérative ou assemblés dans des tableaux pour in vitro le dépistage des drogues de haut débit.
Résumé
Pour mettre à niveau de culture cellulaire 2D traditionnel pour la culture cellulaire 3D, nous avons intégré microfabrication avec technologie cryogelation pour produire macroporeux microscale criogels (microcryogels), qui peuvent être chargés avec une variété de types de cellules pour former des microtissues 3D. Ici, nous présentons le protocole pour fabriquer polyvalent microtissues 3D et leurs applications en thérapie régénératrice et de dépistage des drogues. Taille et forme contrôlable microcryogels peuvent être fabriqués sur une puce de tableau, qui peut être récoltée hors puce comme individuels transporteurs chargés en cellule pour la thérapie régénérative injectable ou être plus assemblé sur puce en tableaux micro-culture 3D à haut débit dépistage des drogues. En raison de la nature élastique haute de ces criogels a petite Echelle, les 3D microtissues pièce grande injectabilité de thérapie cellulaire mini-invasive en protégeant les cellules de la force de cisaillement mécanique pendant l’injection. Cela garantit la survie cellulaire accrue et un effet thérapeutique chez la souris limb ischémie. Pendant ce temps, assemblage des matrices 3D micro-culture dans un format standard de multi-384 puits facilite l’utilisation de laboratoires communs et l’équipement, permettant à haut débit drug screening sur cette plate-forme de culture cellulaire 3D polyvalent.
Introduction
La culture cellulaire traditionnel sur aplatie à deux dimensions (2D) des surfaces comme une boîte de Petri ou plaques multipuits, peut susciter guère les comportements de cellule à proximité de leurs États indigènes. Précise récapitulation des micro-environnements cellulaires natives, qui comprennent des divers types de cellules, matrices extracellulaires et bioactifs facteurs solubles dans des architectures en trois dimensions (3D)1,2,3 ,4, il est essentiel de construire biomimicking tissus in vitro pour des applications en médecine de génie, régénératrice tissulaire, biologie fondamentale recherche et drogue découverte5,6,7 ,8,9.
Au lieu de la culture de cellules 2D, culture cellulaire 3D est employé couramment pour faire avancer la biomimétique micro-architecturales et des caractéristiques fonctionnelles des cellules cultivées in vitro. Une méthode de culture cellulaire 3D populaire est aux cellules agrégées en sphéroïdes7,8,9,10. Sphéroïdes cellulaires pourraient être injectés à des tissus lésés avec rétention cellulaire améliorée et la survie en comparaison de l’injection de cellules dispersées. Toutefois, tailles de sphéroïde non uniforme et une lésion mécanique inévitable imposée sur des cellules par la force de cisaillement fluide pendant l’injection de conduisent à cellule pauvres effets thérapeutiques11,12,13. De même, la non-uniformité inhérente au cours de l’agrégation des sphéroïdes a fait sa traduction à base de cellules 3D haut débit médicament dépistage difficile10.
Une autre méthode pour la culture cellulaire 3D est réalisée avec l’aide de biomatériaux, qui généralement encapsule les cellules d’hydrogels aqueux ou échafaudages poreux. Il permet une plus grande marge de manœuvre dans la construction d’architectures 3D. Pour la thérapie, les cellules encapsulées dans les échafaudages en vrac sont généralement livrées à corps animal par implantation chirurgicale, qui est envahissant et traumatique, limitant par conséquent sa traduction large au chevet du patient. En revanche, hydrogels aqueuses permettent la thérapie mini-invasive en injectant des cellules en suspension dans la solution de précurseur d’hydrogel dans des organes animaux, permettant en situ gélification par thermo-, réticulation chimique ou enzymatique11. Cependant, comme les cellules sont livrées tandis que les précurseurs de l’hydrogel sont encore dans un État aqueux, ils sont également exposés à cisaillement mécanique pendant l’injection. Non seulement cela, réticulation chimique ou enzymatique au cours in situ la gélification de l’hydrogel pourrait aussi imposer des dommages aux cellules à l’intérieur. Pour le dépistage des drogues, des cultures de cellules de biomatériau assistée rencontrent des difficultés uniformité, de débit et de contrôlabilité. Utilisent de l’hydrogel, cellules sont généralement impliqués au cours de la gélification, par laquelle le processus peut affecter de fonction et la viabilité cellulaire. Gélification au cours de l’ensemencement de la cellule entrave également l’utilisation par la plupart des équipements haut débit, car l’hydrogel peut doivent rester sur la glace pour empêcher la gélification avant l’ensemencement de cellule, et l’hydrogel peut se coincent conseils de distribution, qui sont généralement très minces pour assurer l’exactitude des criblage à haut débit. Échafaudages préformés pourraient séparer potentiellement des procédures de fabrication biomatériau de culture cellulaire, mais la plupart produits axés sur l’échafaudage sont disponibles en vrac avec relativement plus faible débit14.
Pour surmonter certains des inconvénients des méthodes de culture 3D actuelles, nous avons développé une technologie de microfabrication-cryogelation intégré pour fabriquer un tableau de microcryogel standard et convivial puce15. Dans ce protocole, la gélatine est sélectionnée pour illustrer la technique de fabrication de microcryogel car il est biocompatible, dégradable et rentable, et aucune modification supplémentaire n’est nécessaire pour la fixation des cellules. Autres polymères de sources naturelles ou synthétiques pourraient également être utilisés pour la fabrication, selon l’application. Grâce à cette technologie, nous pouvons fabriquer microcryogels miniaturisée et très élastique avec mise en page, la forme et la taille contrôlable. Lors du chargement d’une variété de types de cellules, microtissues 3D pourrait être formé pour diverses applications. Ces caractéristiques uniques permettent d’injectabilité désirée, de la protection des cellules et de rétention dirigée après injection en vivo pour des effets thérapeutiques. Non seulement cela, les microcryogels pourraient être traitées ultérieurement pour former des tableaux micro-culture 3D compatibles avec les équipements communs de laboratoire et instruments pour réaliser la culture de cellules de haut débit pour le dépistage des drogues polyvalent et autres analyses cellulaires. Ici, nous allons détailler le processus de fabrication de microcryogels et son post traitement individuel microtissues 3D ou 3D micro-culture tableaux pour deux applications importantes, de thérapie cellulaire et de dépistage des drogues, respectivement10,15 .
Protocole
l’expérimentation animale suivi strict protocole approuvé par le Comité d’éthique animale sur le centre d’analyse biomédicale, Université de Tsinghua. En vertu de l’approbation du Comité d’éthique, le tissu adipeux humain a été obtenu du département de chirurgie plastique de Peking Union Hospital avec le consentement éclairé des patients.
1. fabrication de 3D Microcryogels
- conception et la fabrication de puces de tableau de microstencil
- utiliser un logiciel commercial à des tableaux de conception de géométries spécifiques, tels que les cercles, ellipses, triangles ou trèfles à 14, selon la demande ultérieure.
Remarque : Reportez-vous à l’article 2 du protocole pour la médecine régénérative et de l’article 3 du protocole de dépistage des drogues pour plus de détails de conception. - Importer la conception dans le logiciel livré avec la machine de gravure laser de gravure au laser. En utilisant les paramètres laser conformément aux recommandations de l’usine pour la machine de gravure laser, laser-graver le motif importé sur Poly (Méthyméthacrylat) (PMMA) feuilles.
- Laver les microstencil tableau puces avec de l’eau déminéralisée pour nettoyer les débris de la gravure laser. Sec le tableau microstencil puces à 60 ° C. magasin dans un sac scellé à température ambiante pendant des mois.
- utiliser un logiciel commercial à des tableaux de conception de géométries spécifiques, tels que les cercles, ellipses, triangles ou trèfles à 14, selon la demande ultérieure.
- Fabrication de puces de tableau de microcryogel
- microstencil 4 Place tableau sculpté sur le plateau de l’échantillon et introduire dans le plasma nettoyeur. Fermer la porte de l’appareil et tourner sur la pompe à vide pendant 2 min, puis allumez la puissance RF (18 W) pour traiter les puces de tableau de microstencil dans le plasma nettoyant pendant 3 min à température ambiante pour augmenter hydrophilicité.
- Ajouter 0,06 g de gélatine à 1 mL d’eau désionisée pour former 6 % (wt/vol) solution de précurseur gélatine (assez pour faire les 5 jetons). Chaude à 60 ° C dans un bain d’eau pour dissoudre correctement. Incuber sur glace pendant 5 min.
- Ajouter 3 µL de glutaraldéhyde dans la solution de précurseur de gélatine pour une concentration finale de 0,3 %. Mélanger soigneusement.
- Pipette 200 µL de solution de précurseur au glutaraldéhyde sur l’extrados de la puce de tableau de microstencil.
NOTE : 200 µL est suffisant pour une puce de 75 × 25 mm indépendamment de conception. Surface de la puce est augmentée augmente le montant proportionnellement. - Manuellement répartir la solution sur la puce en grattant le dos et vient avec une tige de verre courbé à 2 à 3 fois.
NOTE : Chaque micro-puits sur la puce de microstencil peut être rempli de solution de précurseur en raison de leur nature hydrophile après traitement plasma. - Placer immédiatement la puce tableau rempli de solution-précurseur dans un congélateur à-20 ° C pendant 16 h pour les cryogelation.
- Régler le lyophilisateur à-40 ° C pendant 30 min. Placer les jetons de tableau après cryogelation dans le lyophilisateur et lyophiliser les puces tableau pendant 2 h dans le vide.
Remarque : Microcryogels de gélatine avec des macropores interconnectés se forment parce que la glace s’est formée au cours de la cryogelation sublimes dans le lyophilisateur. - Passez à la section 2 pour le traitement de l’ischémie des membres critiques (CLI) et l’article 3 pour le dépistage de drogue de haut débit.
2. Récolte des Microcryogels individuels à Microtissues 3D forme Injectable pour le traitement de la CLI
- récolte microcryogels individuel
- Design tableaux (75 × 25 mm) de 600 cercles, chacun avec 400 µm de diamètre, en logiciels commerciaux pour injectable micro-culture 3D construction. Utilisez le PMMA de 300 µm d’épaisseur pour la fabrication de microstencil tableau puce comme indiqué au point 1.1.
- Fabriquer des puces tableau microcryogel qu’à l’article 1.2.
- Fabriquer un tableau de PDMS goupille d’éjection avec le même design que dans l’étape 2.1.1 par Lithographie douce standard 16 , 17.
- De superposition la puce de tableau de microcryogel sur le dessus du tableau de la goupille d’éjection de PDMS, alignant chaque microcryogel avec une goupille d’éjection sur le tableau. Appuyez sur la puce de tableau de microcryogel vers le tableau de broche éjecteur pour pousser la microcryogels hors les puits avec les broches qui dépasse sur la baie de broche PDMS éjecteur de récolter individuels microcryogels.
- Récolter la microcryogel dans l’eau et à leur rassemblement à l’aide de tamis cellulaire. Une crépine d’aspiration permet de recueillir les microcryogels d’une seule puce (c.-à-d., 600 microcryogels).
- Microcryogels de lavage avec 0,1 M NaBH 4 sur la glace pendant 20 min étancher tout résidu d’aldéhyde réticulé. Utiliser 5 mL de 0.1 M NaBH 4 par puce. Jetez NaBH 4 et laver avec 5 mL d’eau désionisée pendant 3 à 5 fois, 15 minutes chaque fois.
- Jeter l’eau de la crépine de la cellule et rassembler microcryogels dans un seul cluster par tamis cellulaire et placer un bouquet dans un plat de Pétri de 35 mm à l’aide d’une pince courbe. Ajouter 50-70 µL désionisée à chaque groupe de l’eau et couvrir le couvercle de la boîte de Pétri. Tapoter le plat de Pétri sur la table pour égaliser tous les microcryogels, ce qu’aucun microcryogels ne reposent sur le dessus une autre microcryogel pour former une monocouche de microcryogels sur la surface de la boîte de Pétri.
- Geler la microcryogels récolté à-20 ° C pendant 4 à 16 h avant de les déposer pour 2 h (voir étape 1.2.7). Conserver microcryogels sous vide à température ambiante jusqu'à l’utilisation ultérieure.
- Characterization of microcryogels
- évaluer les pores de la microcryogels en analysant l’imagerie microscopie électronique (SEM).
- Immobiliser la microcryogels récoltés et lyophilisées sur un porte-échantillon de ruban adhésif double-face et manteau d’or avec une coucheuse par pulvérisation cathodique pour 90 s, avant de l’imagerie par SEM 11. Évaluer et analyser la distribution des diamètres de pores dans la microcryogel de sept différentes images de SEM à l’aide de logiciels d’analyse image.
- Peser un bouquet de 600 microcryogels lyophilisées dans un plat de Pétri de 35 mm pour le poids de gélatine séchées microcryogels (GMs). Ajouter de la grappe de microcryogels lyophilisé 60 µL d’eau désionisée eau et attendre 30 s pour microcryogels pleinement absorber l’eau et gonflent. Peser les microcryogels gonflées.
Ratio de gonflement
- déterminer l’équilibre et la porosité des microcryogels, comme le rapport du poids du microcryogels gonflées à celui de la gélatine séchées microcryogels et le ratio du poids de l’eau qui s’est tenue en microcryogels à celle de microcryogels hydraté, respectivement 13.
- Injectabilité de mesure de microcryogels à l’aide d’un pousse-seringue programmable intégré avec une force numérique de calibre 14.
- Tache 600 morceaux de microcryogels de Trypan blue et suspendre dans 600 µL de solution de gélatine 15 % pour atteindre une répartition homogène. Charger la suspension microcryogel 1 mL dans la seringue de 1 mL. Injecter le mélange à travers une aiguille de calibre 27 attachée à la seringue de 1 mL à l’aide d’un pousse-seringue programmable au débit de 1 mL/min.
- Injection en temps réel de moniteur de force par la force numérique/po² essais et tracer la courbe force-temps. Après injection, respecter l’intégrité des microcryogels sous un microscope.
NOTE : GMs suspendus dans une solution de gélatine de 15 % (wt/vol) peuvent être facilement injectés et est demeurées intactes après l’injection.
- Caractérisent la dégradabilité de microcryogels.
- Tout d’abord, mesurer le poids d’un groupe de 600 microcryogels lyophilisés dans une boîte de Petri 35 mm comme le poids sec. Ensuite, plonger 600 microcryogels lyophilisés dans 2 mL 0.025 % (vol/vol) la trypsine/EDTA. Microcryogels
- à frais virés de la solution en utilisant un tamis cellulaire à des moments différents (p. ex., 10, 20, 30, 40, 50, 60 et 70 min). Mèche solution away excédent avec un mouchoir. Mesurer le poids des microcryogels à différents moments et de calculer le degré de dégradation, comme le rapport du poids du microcryogel à un certain moment à celle de microcryogel au temps zéro.
- évaluer les pores de la microcryogels en analysant l’imagerie microscopie électronique (SEM).
- Auto-chargement de cellules en microcryogels à la forme 3D microtissues
- microcryogels from step 2.1.8 de système de stérilisation oxyde d’éthylène avec exposition de gaz de 12 h, suivie de 12 h de dégazage sous vac de stériliserUUM.
- Choisir humaines dérivées adipeux stromales cellules mésenchymateuses (CSM) pour le traitement de souris ischémique membre postérieur. Les cellules souche par suite des procédures comme indiqué précédemment 18.
- Culture CSM dans la croissance moyenne contenant 2 % sérum fœtal (SVF), ng/mL 10 bb de facteur de croissance dérivé des plaquettes (PDGF-bb), 1 X sélénium de la transferrine de l’insuline (ITS), 10 facteur de croissance épidermique (EGF) ng/mL, 10 -8 M dexaméthasone, 10 -4 M 2-phosphate de l’acide ascorbique, 100 U/mL de pénicilline et 100 µg/mL de streptomycine en DMEM/F12. Le passage des cellules selon le ratio de 1:3 lorsque confluentes. Utiliser des cellules de passage de 3 à 5 dans les expériences suivantes.
- Récolter CSM avec de la trypsine et de quantifier le nombre de cellules en utilisant une chambre de comptage de Fuchs-Rosenthal et de remettre en suspension à une densité de 8 x 10 6 cellules/mL dans le milieu de croissance CSM.
- Pipette 60 µL de la suspension CSM sur la monocouche de 600 microcryogels avec diamètre de 400 µm dans un plat de 35 mm de section 2.1. Les cellules sont automatiquement absorbés dans les structures de micro-poreuses de le microcryogels.
- Maintenir dans une chambre humidifiée et incuber à 37 ° C pendant 2 h permettre aux cellules d’attacher. Après 2 h d’incubation, ajouter 2 mL de milieu de culture. Changer le milieu tous les 2 jours. Culture microcryogels CSM-chargé pendant 2 jours former microtissues 3D.
- Après 2 jours de culture, Pipetter 100 microcryogels CSM-chargé par puits sur une plaque à 96 puits, ajoutez 120 µL de solution de travail de résazurine préparée selon le fabricant ' instruction s dans chaque puits. Incuber pendant 2 h à 37 ° C.
- Détecter la fluorescence de résazurine métabolisé par les cellules viables dans un lecteur de microplaques avec une longueur d’onde légère excitation d’onde de lumière 560 nm et d’émission de 590 nm. Tracer une courbe d’étalonnage du nombre de cellules par rapport à fluorescence à l’aide de CSM pour interpoler le nombre de cellules de l’intensité de la fluorescence pour l’expérience future selon le kit protocole 13.
- Évaluer le nombre de CSM dans microcryogels du jour 0 au jour 4 à l’aide de résazurine tel que décrit dans l’étape 2.3.7 du jour 0 au jour 4.
- Cellules en microcryogels avec la dilution 1/500 de calcéine AM et une dilution de 1/250 de l’iodure de Propidium (appelé live/dead coloration) dans une solution saline tamponnée au phosphate (PBS) et d’observer sous microscope à fluorescence ou microscope confocal fluorescence.
- Injection de microtissues 3D in vivo pour le traitement du CLI dans le modèle de souris
- établir une ischémie critique membre postérieur de souris nus femelles BALB/c comme signalé 11 , 19 pour déterminer l’effet thérapeutique de la thérapie axée sur la micro-culture 3D.
- Transférer la microtissues de l’étape 2.3.6 à l’aide d’une pipette de 5 mL dans une crépine de cellule et filtrer loin du milieu de culture.
- Remettre en suspension le microtissues 3D CSM chargés dans une solution de gélatine de 15 %, à une densité de 100 microcryogels par 100 µL de solution de.
- Avant la chirurgie, stériliser les instruments chirurgicaux par autoclave et pratiquer une intervention chirurgicale dans une salle d’exploitation animale dans un centre d’installation Animal.
- Placer la souris dans la chambre d’induction de l’anesthésie contenant 1-3 % isoflurane dans 100 % d’oxygène à un débit de 1 L/min. érythromycine appliquer sur les yeux de la souris pour éviter le dessèchement. Par une incision de la peau de 1 cm de long, ligaturer l’artère fémorale et ses branches avec 5-10 sutures en soie et d’accise 19.
- Inject vert d’indocyanine (ICG) (0,1 mL de 100 µg/mL) par l’intermédiaire de la veine caudale injection à contrôler le flux de sang. Effectuer l’imagerie de fluorescence ICG en utilisant une fluorescence système d’imagerie (ici, système maison) dans la géométrie de réflectance 11.
- D’injecter par voie intramusculaire microtissues dans trois sites du muscle gracilis autour de l’incision de l’artère à l’aide d’une seringue de 1 mL avec une aiguille de calibre 23.
- Après l’opération, garder la souris chaude avec un coussin chauffant dans la cage de récupération. Injecter par voie sous-cutanée meloxicam pour soulager la douleur et de surveiller en continu jusqu'à éveillé.
- Après 28 jours, suivi de l’efficacité thérapeutique du membre de traités micro-culture 3D par fluorescence imaging 11.
Remarque : Injecter par voie sous-cutanée meloxicam pour soulager la douleur quand la souris a montré l’amputation d’un membre spontanée. - Souris euthanasier au dioxyde de carbone issue des expériences.
NOTE : Ici, l’euthanasie avec le dioxyde de carbone a été effectuée selon un protocole strict approuvé par le Comité d’éthique animale sur le centre d’analyse biomédicale, Université de Tsinghua.
3. Montage de puce tableau micro-culture pour High-throughput Screening de drogue
- montage du tableau de microcryogel pour la culture cellulaire sur puce
- modifier la conception dans la section 1.1 selon dimensions plaque multipuits conventionnel, c'est-à-dire, pour le format multi-384 puits, concevoir un tableau de 16 × 24 puits (ligne par colonne), chacune de 2 mm de diamètre et 4,5 mm--entraxe.
- Laser graver sur une plaque PMMA épaisseur 500 µm, tel que décrit à la section 1.1. Microcryogels
- fabriquer comme décrit dans la section 1.2 utilisant de que la puce multi-384 puits tableau obtenue étape 3.1.2. Cette baie contenant du microcryogel est désignée comme la puce de tableau de microcryogel.
- Laver la puce de tableau microcryogel avec 50 mL de NaBH 0,1 M 4 pour étancher une aldéhyde résiduelle réticulé, à plusieurs reprises rincer ensuite avec 50 mL d’eau désionisée pendant 2 h 3 fois, chaque fois que.
- Jeter l’eau, de geler la puce de tableau de microcryogel à-20 ° C pendant 4 à 16 h avant lyophilisation selon étape 1.2.7.
- Modifier le 384-multi-puits conception de tableau à l’étape 3.1.1 pour contenir 16 × 24 puits, chacune de 3 mm de diamètre et 4,5 mm--entraxe.
- Supprimer un côté de l’appui d’une feuille d’ultra-mince (10 µm) biocompatible ruban double-face adhésif et collez-le sur le côté d’un morceau de feuille de PMMA de 3 mm d’épaisseur. Laser graver la conception de l’étape 3.1.4 sur cette feuille de PMMA épaisseur de 3 mm conformément au point 1.1. Cette baie est désignée comme le tableau de réservoir.
- Aligner le tableau microcryogel puce avec la puce de tableau de réservoir et adhérer ensemble étroitement pour assembler la puce 3D microcryogel de tableau pour la culture cellulaire sur puce. Stérilisation par rayons ultraviolets pendant 1 h.
- Tableau de microcryogel 3D magasin puces sous vide à température ambiante pour plus amples expériences.
- Drug screening sur baies micro-culture 3D
- remplir une boîte humide avec 25 mL d’eau désionisée stérile pour servir une chambre humide pour la culture cellulaire. Préchauffez un humidifié 5 % CO 2 incubateur à 37 ° C.
- Prises en cellules de cancer du poumon non à petites cellules (NCI-H460) et de cellules de carcinome hépatocellulaire (HepG2) sur les plaques de culture de tissu selon le protocole standard et remettre en suspension dans des milieux de culture à une densité finale de 1,0 x 10 6 cellules/mL. Mélanger soigneusement.
NOTE : RPM1640 avec 10 % FBS, 100 U/mL de pénicilline et la streptomycine 100 µg/mL est utilisé pour NCI-H460. Utilisez DMEM avec 10 % FBS, 100 U/mL de pénicilline et la streptomycine 100 µg/mL pour HepG2. - Retirer la chambre d’humidité de l’incubateur. Utiliser des pinces à soigneusement place la 3D assemblé microcryogel tableau puce étape 3.1.9 dans la chambre de l’humidité. Attention de ne pas mouiller le microcryogels avec de l’eau dans la chambre de prendre.
- Mélanger la suspension cellulaire soigneusement, puis aliquote 3 µL de suspension cellulaire directement sur le microcryogel dans chaque puits.
NOTE : L’embout de la pipette devrait toucher légèrement la surface de la microcryogel avant d’expulser la suspension cellulaire. Les cellules sont chargé automatiquement dans le microcryogel par absorption. Ne pas semer de cellules dans les puits périphériques. - Ajouter 10 μL de médias dans chaque puits après que les cellules sont ensemencées en microcryogel à l’aide de la pipette multicanaux, comme un gestionnaire liquid 96 voies. Moyen est également ajouté au puits périphériques.
AVIS : Utilisation RPM1640 médias avec 10 % FBS, 100 U/mL de pénicilline et 100 µg/mL streptomycin pour les cellules H460. Utiliser des médias DMEM avec 10 % FBS, 100 U/mL de pénicilline et la streptomycine 100 µg/mL pour les cellules de HepaG2. - Le tableau microcryogel de cellules chargées de la culture à puce dans la chambre humide pendant 24 h dans une humidifié 5 % CO 2 incubateur à 37 ° C à la forme 3D micro-culture array.
- Dissoudre doxorubicine et IMMLG-8439 9 dans le diméthylsulfoxyde (DMSO) pour former une solution stock de 10 mM. Diluer les drogues avec milieu de culture pour former un gradient de concentration 10 fois dilution de 2 nM à 200 µM.
- Ajouter 10 µL des solutions de drogue dans chaque puits. Utiliser 0,1 % DMSO (dilué dans un milieu) que le contrôle. Incuber le tableau de micro-culture 3D chargés de drogue dans humidifié 5 % CO 2 incubateur à 37 ° C pendant 24 h.
- Ajouter 4 µL de la solution mère de résazurine dans chaque puits. Incuber à 37 ° C pendant 2 h. Place la 3D micro-culture array dans le lecteur de microplaques et détecter la fluorescence de résazurine métabolisé par les cellules viables à une longueur d’onde légère excitation d’onde de lumière 560 nm et d’émission de 590 nm.
- Soustraire le signal de référence de résazurine provenant de tous les puits avant traitement ultérieur de données. Calculer la fraction de la viabilité cellulaire de chaque puits en divisant son signal de fluorescence par le signal de fluorescence moyenne des puits control.
- Tracer la courbe de dose-réponse dans le logiciel de traçage avec la fraction de viabilité cellulaire comme l’axe des y et le logarithme de base 10 de la concentration du médicament dans l’axe des abscisses. Interpoler la concentration de 50 % d’inhibition (CI50) à la fraction de la viabilité cellulaire de 0,5.
Résultats
Fabrication et caractérisation des microcryogels pour la formation de micro-culture 3D.
Selon ce protocole, microcryogels ont été fabriqués à forme la 3D microtissues et des microcryogels individuels ou des tableaux de microcryogel et ont été appliquées à la thérapie régénérative et drogue, dépistage, respectivement (Figure 1). Puces de tableau Microstencil fabriqués en PMMA ont été appliquées comme micromolds pour microcryogel tableau chips. Les motifs géométriques variables pourraient être élaborées pour la puce de tableau de microstencil. Nous avons choisi une puce de tableau de microstencil représentant 45 x 14 mm par exemple, qui contenait des formes variées (p. ex., cercle, ellipse, triangle et trèfle) et une puce en forme de cercle microstencil de tableau avec différentes tailles (diamètres = 100, 200, 400 et 800 µ m). afin d’améliorer la visibilité des micromolds sur les tableau des jetons, des images de lumière épi-illumination ont été observés (Figure 2 a, B). Microcryogels récoltées sur les puces de tableau exposé désiré de formes et de tailles (Figure 2, D). Ces microcryogels avec fonctions géométriques souhaitées éventuellement pourrait être appliquée qu’en tant que modèles pour former différentes unités cellulaires qui imitent certaines architectures des tissus natifs. Les GMs récoltés (gélatine microcryogels) avaient prédéfinis de formes et de tailles (Figure 3 a). Observation en MEB a démontré que microcryogels contient des structures interconnectées macroporeux avec la taille des pores de l’ordre de 30 à 80 µm (Figure 3 b).
Injectabilité améliorée de CSM-chargé de microtissues pour la récupération améliorée membre ischémique
Utiliser le pousse-seringue programmable intégré avec une force numérique jauge14, l’injectabilité de GMs a été évaluée quantitativement. À un débit de 1 mL/min, les GMs avec une densité de 1 000 microcryogels / mL ont été injectés à moins de 6 ans N, qui était plus faible que la force cliniquement acceptable de 10 N20 (Figure 3F). Se fondant sur la protection des cellules activée par GMs, CSM en GMs avait grande viabilité et entretenu grande capacité proliférative après injection pendant 5 jours de culture (Figure 3 H).
Le modèle d’ischémie limb souris a été choisi pour évaluer l’efficacité thérapeutique de l’injectable microtissues hMSC-chargé. L’état physiologique des membres ischémiques a été examiné à 28 jours après la chirurgie (Figure 4 a). Aucune récupération de membre a été observée dans le groupe fictif ou le groupe de contrôle de GMs. Dans le groupe de traitement cellulaire gratuit5 10, amputation de l’orteil total 50 %, amputation partielle orteil 25 % et 25 % amputation d’un membre partielle ont été observés dans les 7 jours, résultant en perdu 80 % et l’amputation d’orteil total 20 % après 28 jours. En revanche, un traitement microtissues avec 105 CSM atteint améliorée de branche de récupération (75 %) avec seulement 25 % souris ont montré amputation de l’orteil spontanée après 28 jours. 106 CSM, le nombre de cellules effectif minimal utilisé dans la plupart des études, a été choisi comme le contrôle positif de21. Seulement 2 des 4 souris a montré la récupération de la branche, mais tous eu nécrose secondaire.
La perfusion sanguine a été surveillée et évaluée à l’aide de vert d’indocyanine (ICG), un agent de contraste angiographique approuvés par la FDA. Le résultat a montré que les signaux de fluorescence est apparu chez les souris traitées micro-culture en 106 gratuit CSM souris traitées à la. Il n’y a aucun signal de fluorescence évidente dans les postérieurs ischémiques dans l’imposture ou le groupe GM jusqu’au jour 28 (Figure 4 b).
Ces résultats confirment que 3D assistée par micro-culture CSM thérapie atteint supérieures effets thérapeutiques pour le traitement de CLI qui représente la dose minimale pour la thérapie axée sur la cellule dans le modèle murin jusque.
Criblage de cytotoxicité de haut débit MEDICAMENTS sur puce tableau micro-culture 3D
Un tableau de microcryogel 3D prêts à l’emploi pour la culture cellulaire sur puce pourrait être facilement fabriqué en conservant microcryogels sur la puce PMMA après lyophilisation et en combinant avec la puce correspondante de puits-tableau avec bandes adhésives biocompatibles (Figure 1 et Figure 5 a). Dans ce tableau de culture cellulaire de deux parties, la puce de puits-tableau haut servait de réservoirs pour le milieu de culture, des drogues en solutions et des réactifs de dosage, tandis que les cellules sont cultivées dans la 3D microcryogel immobilisé sur la puce de tableau de fond. Les rubans adhésifs entre la puce haut et en bas de tableau permis génération de 384 puits individuels pour la culture cellulaire 3D haut débit (Figure 5 b), offrant ainsi un outil pratique pour la découverte de médicaments.
Comme décrit dans le protocole, tableau micro-culture 3D a été formé par semis directement les cellules en microcryogels avant d’ajouter le support pour les réservoirs. À l’aide de cellules marquées DP NIH-3 t 3, nous avons démontré que les cellules ont été uniformément distribués avec des couches multiples au sein de l’architecture 3D de microcryogels (Figure 5, D). Images de SEM a montré que les cellules adhère fermement aux parois des pores et présentaient même des filopodes étendues le long ou à travers les murs adjacents des macropores dans la microcryogels (Figure 5E).
Ensuite, nous avons montré la faisabilité de l’application de ce tableau micro-culture 3D haut débit dépistage des drogues à l’aide de deux lignées de cellules cancéreuses et des deux composés. Cellules de carcinome hépatocellulaire (HepG2) ont été traités avec la doxorubicine, tandis que les cellules de cancer du poumon non à petites cellules (NCI-H460) ont été traitées avec IMMLG-8439, un nouvel inhibiteur de la tumeur. Cinq à neuf concentrations discrètes de chaque médicament ont été administrées à six puits adjacents comme réplique, avec 0,1 % DMSO en milieu de culture comme contrôle négatif. Une cytotoxicité a été réalisée de la même façon pour les cellules cultivées en plaques multipuits 2D traditionnelles. Après 24 h d’incubation, l’analyse de viabilité de cellules a été utilisé pour évaluer les réactions de drogue de cellules en 2D ou en 3D. Les courbes de réponse de drogue ont été tracées en utilisant des taux de viabilité de cellules normalisées à des concentrations différentes, et la CI50 a été ensuite interpolées à partir de ces courbes. Une plus grande valeur de la CI50 indiquerait que les cellules sont plus résistantes aux médicaments. De Figure 5F et 5I, nous avons observé une augmentation significative de la résistance aux médicaments lorsque les cellules étaient cultivées sur tableau micro-culture 3D qu’en 2D. La CI50 de doxorubicine contre les cellules HepG2 atteint 165.959 µM, par rapport à 18.239 nM sur 2D ; la CI50 de IMMLG-8439 sur cellules de NCI-H460 fut élevé de même à 331.894 nM en 3D tout en exigeant seulement 1.294 nM ou en 2D. Cette observation prit fin en concordance avec les rapports de la pharmacorésistance accrue en 3D culture culture 2D par d’autres chercheurs22,23.
Nous avons attribué cette augmentation dans la résistance à la complexité du microenvironnement 3D par rapport à laconfiguration plane de culture 2D. Images de SEM a révélé que les cellules HepG2 recueilli des sphéroïdes décorer les surfaces des macropores dans le microcryogel. Ces cellules sont étroitement regroupées et cette interaction cellule-cellule renforcée pourrait être une source de résistance aux antituberculeux au HepG222. Il est également intéressant de noter que ces amas de cellules n’étaient pas des sphéroïdes librement suspendus, car ils ont toujours maintenu une adhérence à la matrice (Figure 5, H). À l’inverse, épithéliale-mésenchymateuse-transition (EMT) a émis l’hypothèse survenus lorsque les cellules de cancer du poumon non à petites, NCI-H460, ont été cultivées sur microcryogels 3D. CJN-H460 cellules étalées comme les fibroblastes (Figure 5 j, K) au lieu de regroupement comme HepG2. Par conséquent, nous avons émis l’hypothèse que l’augmentation de la résistance aux médicaments pourrait être le résultat d’une transition des cellules épithéliales de NCI-H460 à un plus malin état18,19,20,21,22 ,,23.
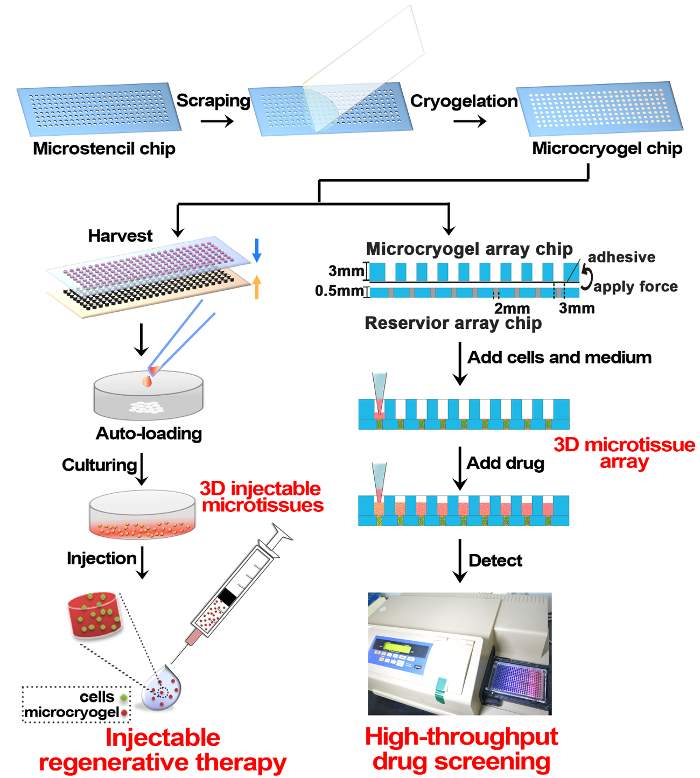
Figure 1 : Schématique de micro-culture 3D Fabrication et Application en thérapie régénératrice et de dépistage des drogues. Brièvement, taille et forme contrôlable microcryogel puce a été fabriqué sur une puce PMMA de tableau par cryogelation de la gélatine. Les puces de microcryogel peuvent être récolté hors puce comme microcryogels individuels et microcryogels en outre, individuelle peut être chargé automatiquement avec les cellules et d’élevage pour former microtissues 3D pour la thérapie régénérative injectable. Une autre application de microcryogel jetons est à assembler avec une puce de tableau de réservoir, puis plus loin, charger les cellules et la culture dans les tableaux de micro-culture 3D pour le dépistage de drogue de haut débit. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
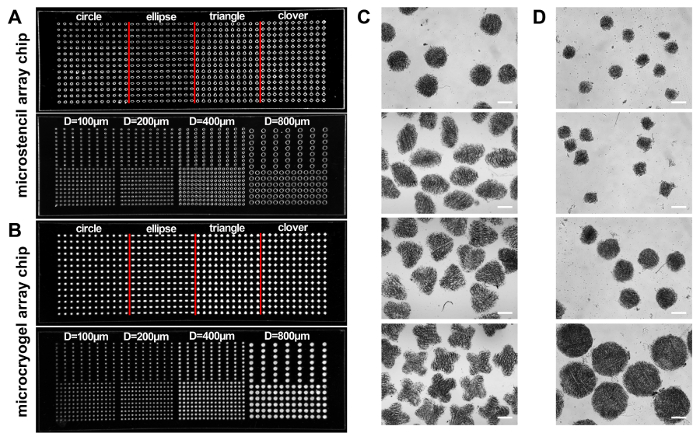
Figure 2:Microstencil tableau puces. (A, B) Photographies de deux puces de microstencil PMMA contenant arrayed micropuits avec différentes formes (c.-à-d., cercle, ellipse, triangle et trèfle) et de forme circulaire avec différentes tailles (diamètre : 100, 200, 400 et 800 µm), respectivement (A), et deux jetons correspondants du tableau microcryogel (B). (C, D) Images microscopiques de la microcryogels individuelle récoltées sur les puces de tableau de deux microcryogels. Echelle = 500 µm. Ce chiffre a été modifié avec la permission de référence14. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Caractérisation de 3D Injectable Microtissues. (A) photographies de microcryogels récoltés. (B) à balayage électronique à balayage (SEM) images de microcryogels montrant interconnectés et structures macroporeuses. (C, D) Fluorescence microscopique et 3D reconstruit des images confocales de CSM-chargé microtissues teinté de vivre/morts et la rhodamine phalloïdine. (E) Quantification des CSM chargement automatique et la prolifération en GMs avec des densités de chargement initial différent. Injection en temps réel (F) forcer les courbes de mesure pour les injections triples de 1 000 GMs dans 1 mL de solution de gélatine 15 % (wt/vol) à 1 mL/min débit d’injection (1 000-1-15 %). (G) Live/dead cell analyse de viabilité de CSM-chargé microtissues injection avant et après l’injection. (H) la prolifération des CSM chargée en post-injection GMs après 1, 3 et 5 jours de culture (n = 3). * p < ANOVA à 0,05, par rapport au jour 1. Les données sont présentées en moyenne ± SEM Ce chiffre a été modifié avec la permission de référence11. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
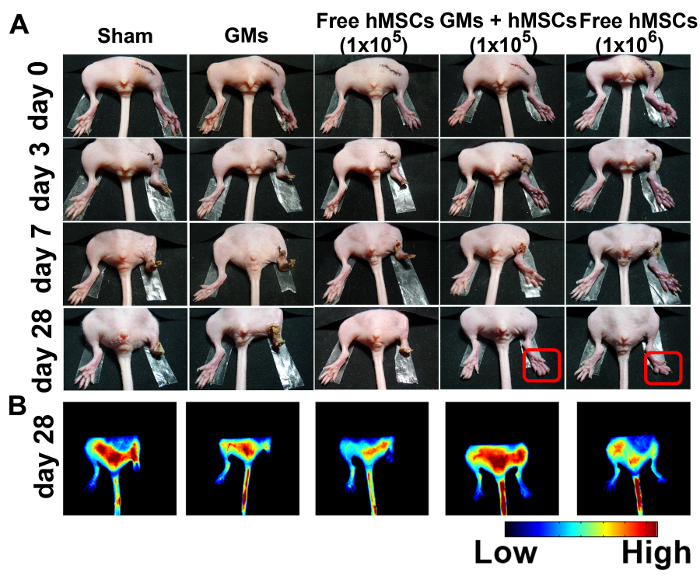
Figure 4:amélioré de récupération et amélioré l’angiogenèse dans ischémique membres postérieurs traités avec 3D Microtissues Injectable. (A) photographies représentatives de sham (n = 4), vierges microcryogels (n = 4), gratuit CSM (105) (n = 8), CSM (105)-chargé de microtissues (n = 8) et sans CSM (106) (n = 4) à 0, 3, 7 et 28 jours après le traitement. Images de Fluorescence (B) obtenu 100 s après l’injection d’ICG sur 28 jours. Ce chiffre a été modifié avec la permission de référence11. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : 3D micro-culture Array for Drug High-throughput Screening. (A) photographie du tableau micro-culture 3D au format multi-384 puits après l’Assemblée et (B) analyse de viabilité de cellules résazurine effectuées sur le tableau. (C) DP-3 t 3 cellules microcryogel après ensemencement (barre d’échelle = 200 µm). (D) la reconstruction 3D des noyaux coloration dépeignant une répartition homogène de cellules en couches multiples dans microcryogel. (E) balayage Micrographie électronique image de DP-3 t 3 cellules s’étend longuement sur macroporeux murs en microcryogels (barre d’échelle = 20 µm). Tests de cytotoxicité de la doxorubicine (F) sur les cellules HepG2 et (je) IMMLG-8439 sur NCI-H460 cellules 3D micro-culture tableau montrant augmenté IC50 comparant à leurs homologues 2D. Les données apparaissent comme moyenne ± sphéroïdes petit SD. (G) des cellules HepG2 dans microcryogel (barre d’échelle = 100 µm), avec adhérence partielle (astérisques dans H) sur le mur de microcryogel (barre d’échelle = 20 µm). (J) NCI-H460 cellules adhérentes et la propagation au sein de la microcryogel (barre d’échelle = 100 µm). (K) NCI-H460 cellules exposante fibrla morphologie oblastic (barre d’échelle = 20 µm). Ce chiffre a été modifié avec la permission de référence9. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Modèles de médecine et in vitro régénératrices pour le dépistage des drogues sont deux applications importantes pour les tissus techniques5,6,7,8,9. Alors que ces deux applications ont des besoins très différents, un terrain d’entente entre les deux réside dans la nécessité d’une plus biomimétique condition de culture afin d’améliorer les fonctions de cellule19. Uniquement avec les fonctions des cellules améliorées dans la recherche, nous pouvons traiter les maladies mieux20,21, et si les cellules cultivées les réponses de drogue mieux reflètent nous pouvons accélérer la drogue découverte6,7. La survie des cellules après greffe in vivo est une condition essentielle de la médecine régénérative, tandis que le débit est important pour le dépistage des drogues à traiter des milliers de composés à la fois. Ces deux exigences sont spécifiques à leurs demandes respectives, et rarement une technologie peut répondre à ces deux exigences. Ainsi, nous avons intégré unique de technologie de microfabrication avec cryogel préparation pour produire microcryogels macroporeux, qui pourrait être récoltée hors puce comme transporteurs de chargés en cellule individuelles pour thérapie régénérative, ou conservé sur puce pour plus montage en tableau pour le dépistage de drogue de haut débit. La micro-échelle et macroporosité de ces nouveaux microcryogels permettent homogène de cellules de chargement par absorption simple et automatique. À l’aide de roman microstencil fabrication de puces de tableau de microcryogel, des centaines et des milliers de criogels de micro-échelle avec uniformes et reproductibles des caractéristiques géométriques pourraient être facilement et efficacement générés. Les microcryogels pouvaient être préparés et entreposés sous vide emballage comme un produit standard, prêt à l’emploi pour faciliter la préparation de microtissues 3D en commun laboratoires pour les demandes ultérieures. Grâce à cette technique de fabrication, nous avons été en mesure de répondre à des exigences spécifiques pour les deux applications différentes tant un terrain d’entente (condition de culture 3D pour mieux "biomimétisme") (élasticité pour protéger des cellules pendant l’injection pour la médecine régénérative et haut-débit dans un format de tableau pour le dépistage des drogues).
La thérapie cellulaire est très prometteur pour la réparation de divers tissus endommagés ou organes24. Cependant, cellule de rétention, la survie des cellules et la reproductibilité du traitement sont encore médiocre en raison de dommages mécaniques pendant l’injection de fuite élevé aux tissus environnants et l’ischémie et l’inflammation de l’environnement in vivo dans la lésion 25de tissus. Certains chercheurs ont utilisé des agrégats cellulaires préformés pour améliorer l’injection de cellules libres. Cependant, elle nécessite une grande quantité de cellules pour former des agrégats cellulaires, ce qui conduit à coût élevé, la taille non uniforme et des quantités globales incontrôlables26. En outre, une lésion mécanique et mort cellulaire sont toujours inévitables pendant l’injection. Alternativement, la thérapie cellulaire biomatériaux assistée a été développée dans lequel biomatériaux sensibles (p. ex., hydrogel thermique ou sensibles au pH) peut être mélangé avec les cellules et gélification sur place pour se rendre compte de la cellule de rétention27. Toutefois, in situ réticulé biomatériaux ne permettre pas d’amorçage de cellules in vitro et résultat immédiat exposition des cellules à un microenvironnement ischémique et inflammatoire sur le site de la lésion. Il est urgent de résoudre ces problèmes afin d’améliorer l’efficacité thérapeutique. Un avantage majeur de microcryogels fabriqués en utilisant ce protocole est leur injectabilité désirée en raison de leur taille miniaturisé et une élasticité exceptionnelle, faciliter leur application dans la livraison de la cellule. L’injectabilité de microcryogels permet la protection des cellules lors de l’accouchement de la cellule, d'où ils pouvaient constituer en 3D microtissues injectable après l’amorçage de in vitro des cellules dans le microcryogel afin d’améliorer les deux protéines de la matrice extracellulaire (ECM) les dépôts ainsi que les interactions cellule-cellule. Les 3D microtissues injectables aboutir à micro-échelle tissu ensembles ce qui représente une stratégie de prestation optimale pour faciliter la protection des cellules, de greffe, de survie et donc améliorer les effets thérapeutiques ultimes sur le site de la lésion.
En plus des effets thérapeutiques pour la thérapie cellulaire, nos résultats indiquaient également l’impact complexe du microenvironnement 3D sur les réponses cellulaires de drogue. Utilisant les conditions de culture de biomimicking, il serait possible d’obtenir in vitro les réponses de la drogue cellulaire plus représentatifs des réponses en vivo , donc accélérer la drogue découverte6,7, 28. Sphéroïdes sont un choix populaire de configuration de la culture cellulaire 3D et de nombreuses techniques ont été développées pour aider les chercheurs génèrent des sphéroïdes. Culture tissulaire faible-adhésif plaques29 ou plaque des surfaces qui sont modifiés avec nano-empreintes8 servaient aussi pour forcer les cellules à s’agréger en empêchant l’adhérence cellule-matrice. Alors que ces techniques sont relativement simples à utiliser, des problèmes tels que la perte des sphéroïdes au cours de change moyen et d’autres opérations ainsi que la variabilité de taille des sphéroïdes sont des problèmes qui entravent l’adoption à grande échelle de cette technologie6. Sphéroïdes plus homogènes pourraient être formées à l’aide de suspension drop30,31,32,33, toutefois, c’est beaucoup de travail si ne pas à l’aide spécialisée de plaques. À l’aide spécialisée suspendus goutte plaques multipuits et l’intégration avec automatisé liquid handling systems6,31, criblage à haut débit pourrait être réalisé. Le plus grand inconvénient de la culture de l’ellipsoïde est l’absence d’ECM, qui a été identifié à jouer un rôle vital dans tous les tissus pathologiques et physiologiques développements34. Une étude de modèle de cerveau a révélé que sphéroïdes cultivées à l’intérieur d’un échafaudage de l’ECM, en comparaison des sphéroïdes pures, augmente la résistance aux médicaments, amélioré l’acidose due à la production de lactate supérieure et amélioré l’angiogenèse avec l’expression de connexes 34de facteurs. D’autres études ont également montré que la présence de matrice pouvait fournir mécano-signalisation nécessaire pour promouvoir la réexposition EMT et supports des caractéristiques tumorales comme invasion et métastase3,35,36 , 37.
Avec l’augmentation de l’importance de l’ECM en développement pathologique, il n’y a aucun doute que l’intégration ECM dans les méthodes de culture 3D pourrait aider à reproduire in vivo des situations mieux6. Hydrogels de matériaux naturels ou synthétiques ont été appliquées pour produire plusieurs in vitro des modèles 3D de tumeur d’évaluation des agents chimiothérapeutiques en raison de leur souplesse et de la contrôlabilité des propriétés biophysiques (tels que la rigidité)38 , 39 , 40 , 41 , 42. même si hydrogels avec propriétés biophysiques accordables avait en effet modelé importantes caractéristiques biologiques des cellules tumorales afin de faciliter le dépistage des drogues plus précise, plusieurs inconvénients de cette méthode ont entravé son utilisation répandue au médicament le dépistage. Réticulation de polymères en présence de cellules est nécessaire pour encapsuler des cellules au sein de la matrice hydrogel, qui pourrait endommager les cellules. Non seulement cela, hydrogels de différentes propriétés biophysiques présentent des défis différents à encapsulés au sein des cellules. En douces hydrogels, forte teneur en eau pourrait soutenir la croissance des cellules mais des hydrogels se dégrade rapidement, en accordant une aide à court terme pour la culture cellulaire 3D. En revanche, hydrogels plus rigides avec haute réticulation pourraient ralentir la dégradation mais faible humidité ne peut pas appuyer la croissance des cellules et RETICULATION haute concentration induit généralement haute cytotoxicity43,44. Non seulement alors, préparer la culture cellulaire 3D avec hydrogels est beaucoup de travail et n’est pas compatible avec la plupart haut débit liquide, systèmes de manutention, contrôle de la température de la solution de précurseur d’hydrogel est important et de brouillage des conseils de distribution fines pourrait entraîner de la gélification de l’hydrogel dans les conseils. Ces inconvénients ont donc incité la recherche d’alternatives ECM surrogates, c'est-à-direaxée sur l’échafaud ECM34.
À l’aide d’échafaudages préformés, cellules pourraient être exemptés du processus de fabrication de biomatériaux et donc prévoient la possibilité pour plus de contrôle sur la fabrication de l’échafaudage car des conditions plus rudes peuvent être utilisées sans crainte d’endommager les cellules. Plusieurs enquêtes ont montré que les cellules tumorales cultivées dans les échafaudages 3D affichent pharmacorésistance plus élevée comparée aux cellules cultivées en 2D en raison de la malignité accrue et améliorée de cell-ECM interaction45,46, 47. ces observations concordent avec les résultats présentés ici. Dans nos autres ouvrages, nous avons encore démontré la polyvalence du tableau 3D micro-culture et ses avantages par rapport aux autres techniques mentionnées ci-dessus. Dans un récent ouvrage, nous avons pu améliorer la fonction hépatique en promouvant le phénotype épithélial des cellules HepaRG en cultivant sur un tableau 3D micro-culture et tel tableau a été appliquée aux médicaments hépatotoxicité évaluation47. En raison de l’uniformité de la taille des pores dans les échafaudages macroporeux 3D, nous étions en mesure de contrôler la taille des sphéroïdes de cellules hépatiques relevant de 50 à 80 µm, quelle que soit la densité de semis cellule initiale. Ceci fournit un avantage significatif sur la formation gratuite sphéroïdes avec tailles non uniforme. Non seulement sphéroïdes poussent uniformément au sein de chaque échafaudage, entre les puits, les cellules sont ensemencées aussi uniformément, donnant le Coefficient de Variation (CV) comparable aux cellules ensemencement en 2D (c'est-à-dire, CV = 0,09 en tableau 3D micro-culture et CV = 0,05 en 2D plaquette commerciale ; données non présentées). Dans un autre ouvrage, nous avons démontré que nous étions en mesure de former microtumor hépatique sur micro-culture 3D tableau pour récapituler des interactions tumeur-stroma pour le dépistage de thérapie combinatoire stroma-reprogrammé48. Microtumors du foie ont été générés par co-culture de longue durée (5 jours) de fibroblastes avec des cellules tumorales à haute densité. Nous avons observé des obstacles vers la diffusion de la drogue en raison de la cellule compacte et la structure de ECM formée dans le foie microtumor, qui a été observé de la même façon en vivo32. À l’aide de cellules cancéreuses luciférase-étiquetés et mécaniquement-amorcé des cellules stromales, combinées à la luminescence de la luciférine comme l’affichage spécifique des cellules cancéreuses, haut-débit, présélection de nouveaux agents thérapeutiques ou d’associations contre les tumeurs stromales interaction est rendue possible.
Malgré les nombreux avantages de notre technique uniques, l’inconvénient de microcryogels actuel est la non-transparence, entravant l’observation optique détaillée des cellules en microcryogels. D’autres améliorations pour ces microcryogels comprendrait à affiner leurs propriétés optiques pour améliorer l’imagerie des cellules en microcryogels pour l’observation. En outre, les propriétés biophysiques importantes comme la rigidité n’ont pas été explorées dans notre technique, qui devrait être traitées si l'on veut mieux imiter les tissus physiologiques et pathologiques des différentes propriétés biophysiques.
Alors que notre technique permet la génération simple de microtissues 3D, certaines précautions doivent être prises pour les expériences réussies. Lorsque la fabrication 3D microcryogels sur puce de tableau de microstencil, il est important de veiller à ce que les microcryogels restent gelés, lorsqu’il est placé dans le lyophilisateur. Il est donc essentiel de refroidir préalablement le lyophilisateur et de transférer les microcryogels du congélateur-20 ° C pour le lyophilisateur rapidement. La fonte des microcryogels avant la lyophilisation ou pendant la lyophilisation provoque pores de s’effondrer et donc affecter la porosité des microcryogels fabriqués. Lorsque la culture microtissues 3D dans le format de tableau, attention est requise pour assurer que l’adhérence entre les deux tableaux est suffisante pour prévenir la contamination croisée entre les puits. Aussi, tandis que la miniaturisation de culture cellulaire a son avantage en augmentant le débit et la réduction de la consommation de réactif, son inconvénient est que le volume de culture faible ne peut pas appuyer la culture cellulaire à long terme sans réapprovisionnement fréquents médias. Non seulement, il est essentiel de maintenir l’humidité de l’environnement de culture afin d’éviter l’influence sur la viabilité cellulaire due à l’évaporation de médias, depuis seulement quelques microlitres de suspension cellulaire ou médias est ajouté. Évaporation va aussi affecter la viabilité des cellules dans les puits périphériques, par conséquent, il est vital d’éviter la mise en culture des cellules dans ces puits.
Néanmoins, notre technique robuste fournit une option pour générer des microtissues 3D de manière facile à utiliser, ce qui pourrait potentiellement faire culture 3D une méthode commune de manipulation des cellules pour la plupart des laboratoires, pour accélérer la science fondamentale et translationnelle avancements.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu financièrement par la Fondation nationale des sciences naturelles de Chine (subventions : 81522022, 51461165302). Les auteurs tiennent à remercier tous les membres Du laboratoire d’aide générale.
matériels
| Name | Company | Catalog Number | Comments |
| Gelatin | sigma | G7041 | All other reagents were purchased from Sigma-Aldrich (St. Louis, MO) unless otherwise indicated. |
| Glutaraldehyde | J&K | 902042 | Used as crosslinker in preparation of material. |
| Glass cover slip (24 x 50 mm) | CITOGLASS, China | 10212450C | To scrape prcursor solution onto microstencils array chips. |
| Sodium borohydride, NaBH4 | Beijing Chemical Works | 116-8 | To wash remaining glutaraldehyde away after gelation. |
| Vacuum jar | asperts, China | VC8130 | To preserve microgels under vacuum. |
| Polymethylmethacrylate (PMMA) sheets | Sunjin Electronics Co., Ltd, China | Ordinary PMMA sheets. | |
| Rayjet laser system | Rayjet, Australia | Rayjet 50 C30 | To engrave PMMA sheets to form wells. |
| Plasma Cleaner | Mycro Technologies, USA | PDC-32G | To make PMMA hyphophilic. |
| Lyophilizer | Boyikang, China | SC21CL | To lyophilize materials. |
| Trypan Blue solution (0.4%) | Zhongkekeao, China | DA0065 | To dye microgels. |
| Doxorubicin hydrochloride | ENERGY CHEMICAL, China | A01E0801360010 | To test drug resistance of cells in 2D or 3D microgel. |
| Live/dead assay | Dojindo Molecular Technologies (Kumamoto, Japan) | CS01-10 | To distinguish alive and dead cells. |
| Cell Titer-Blue | Promega (Wisconsin, USA). | G8080 | To test cell viability. |
| Cell strainer | BD Biosciences, USA | 352360 | To collect microgels. |
| D-Luciferin | SYNCHEM (Germany) | s039 | To tack cells. |
| Scanning electron microscope | FEI, USA | Quanta 200 | To characterize microgel morphology. |
| Mechanical testing machine | Bose, USA | 3230 | To measure mechanical features. |
| Programmable syringe pump | World Precision Instruments, USA | ALADINI 1000 | To test injactabiliy. |
| Digital force gauge | HBO, Yueqing Haibao Instrument Co., Ltd., China | H-50 | To test injactabiliy. |
| Ethylene oxide sterilization system | Anprolene, Anderson Sterilization, Inc., Haw River, NC | AN74i | To sterilize microgels with ethylene oxide gas. |
| Microplate reader | Molecular Devices,USA | M5 | To measure fluorescence intensity in micro-array. |
| Confocal microscope | Nikon, Japan | A1Rsi | To observe cell distribution in 3D. |
| Xenogen Lumina II imaging system | Caliper Life Sciences, USA | IVIS | To track cell in animals. |
| Liquid work stataion | Apricot design,USA | S-pipette | To load medium or cell suspension high-throuputly. |
Références
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking cell-matrix adhesions to the third dimension. Science. 294 (5547), 1708-1712 (2001).
- Abbott, A. Cell culture: biology's new dimension. Nature. 424 (6951), 870-872 (2003).
- Loessner, D., et al. Bioengineered 3D platform to explore cell-ECM interactions and drug resistance of epithelial ovarian cancer cells. Biomaterials. 31 (32), 8494-8506 (2010).
- Fischbach, M. A., Bluestone, J. A., Lim, W. A. Cell-based therapeutics: the next pillar of medicine. Sci Transl Med. 5 (179), 179(2013).
- Kuraitis, D., Giordano, C., Ruel, M., Musaro, A., Suuronen, E. J. Exploiting extracellular matrix-stem cell interactions: a review of natural materials for therapeutic muscle regeneration. Biomaterials. 33 (2), 428-443 (2012).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discov Today. 18 (5-6), 240-249 (2013).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Miniaturized three-dimensional cancer model for drug evaluation. Assay Drug Dev Technol. 11 (7), 435-448 (2013).
- Yoshii, Y., et al. High-throughput screening with nanoimprinting 3D culture for efficient drug development by mimicking the tumor environment. Biomaterials. 51, 278-289 (2015).
- Li, X., et al. Micro-scaffold array chip for upgrading cell-based high-throughput drug testing to 3D using benchtop equipment. Lab Chip. 14 (3), 471-481 (2014).
- Qi, C., Yan, X., Huang, C., Melerzanov, A., Du, Y. Biomaterials as carrier, barrier and reactor for cell-based regenerative medicine. Protein Cell. 6 (9), 638-653 (2015).
- Li, Y., et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia. Proc Natl Acad Sci U S A. 111 (37), 13511-13516 (2014).
- Liu, W., et al. Magnetically controllable 3D microtissues based on magnetic microcryogels. Lab Chip. 14 (15), 2614-2625 (2014).
- Zhao, S., Zhao, H., Zhang, X., Li, Y., Du, Y. Off-the-shelf microsponge arrays for facile and efficient construction of miniaturized 3D cellular microenvironments for versatile cell-based assays. Lab Chip. 13 (12), 2350-2358 (2013).
- Liu, W., et al. Microcryogels as injectable 3-D cellular microniches for site-directed and augmented cell delivery. Acta Biomater. 10 (5), 1864-1875 (2014).
- Hakanson, M., et al. Controlled breast cancer microarrays for the deconvolution of cellular multilayering and density effects upon drug responses. PLoS One. 7 (6), e40141(2012).
- Du, Y., et al. Rapid generation of spatially and temporally controllable long-range concentration gradients in a microfluidic device. Lab Chip. 9 (6), 761-767 (2009).
- He, J., et al. Microfluidic synthesis of composite cross-gradient materials for investigating cell-biomaterial interactions. Biotechnol Bioeng. 108 (1), 175-185 (2011).
- Zeng, Y., et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing. Acta Biomater. 25, 291-303 (2015).
- Yang, F., et al. Genetic engineering of human stem cells for enhanced angiogenesis using biodegradable polymeric nanoparticles. Proc Natl Acad Sci U S A. 107 (8), 3317-3322 (2010).
- Zhang, L., et al. Delayed administration of human umbilical tissue-derived cells improved neurological functional recovery in a rodent model of focal ischemia. Stroke. 42 (5), 1437-1444 (2011).
- Kinnaird, T., et al. Local delivery of marrow-derived stromal cells augments collateral perfusion through paracrine mechanisms. Circulation. 109 (12), 1543-1549 (2004).
- Fischbach, C., et al. Engineering tumors with 3D scaffolds. Nat Methods. 4 (10), 855-860 (2007).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Gimble, J. M., Guilak, F., Bunnell, B. A. Clinical and preclinical translation of cell-based therapies using adipose tissue-derived cells. Stem Cell Res Ther. 1 (2), (2010).
- Thai, H. M., et al. Implantation of a three-dimensional fibroblast matrix improves left ventricular function and blood flow after acute myocardial infarction. Cell Transplant. 18 (3), 283-295 (2009).
- Moreira Teixeira, L. S., et al. High throughput generated micro-aggregates of chondrocytes stimulate cartilage formation in vitro and in vivo. Eur Cell Mater. 23, 387-399 (2012).
- Ifkovits, J. L., et al. Injectable hydrogel properties influence infarct expansion and extent of postinfarction left ventricular remodeling in an ovine model. Proc Natl Acad Sci U S A. 107 (25), 11507-11512 (2010).
- Murphy, A. R., Laslett, A., O'Brien, C. M., Cameron, N. R. Scaffolds for 3D in vitro culture of neural lineage cells. Acta Biomater. , (2017).
- Cheng, V., et al. High-content analysis of tumour cell invasion in three-dimensional spheroid assays. Oncoscience. 2 (6), 596-606 (2015).
- Huber, J. M., et al. Evaluation of assays for drug efficacy in a three-dimensional model of the lung. J Cancer Res Clin Oncol. 142 (9), 1955-1966 (2016).
- Lamichhane, S. P., et al. Recapitulating epithelial tumor microenvironment in vitro using three dimensional tri-culture of human epithelial, endothelial, and mesenchymal cells. BMC Cancer. 16, 581(2016).
- Ware, M. J., et al. Generation of an in vitro 3D PDAC stroma rich spheroid model. Biomaterials. 108, 129-142 (2016).
- Monjaret, F., et al. Fully Automated One-Step Production of Functional 3D Tumor Spheroids for High-Content Screening. J Lab Autom. 21 (2), 268-280 (2016).
- Shologu, N., et al. Recreating complex pathophysiologies in vitro with extracellular matrix surrogates for anticancer therapeutics screening. Drug Discov Today. 21 (9), 1521-1531 (2016).
- Ho, W. J., et al. Incorporation of multicellular spheroids into 3-D polymeric scaffolds provides an improved tumor model for screening anticancer drugs. Cancer Sci. 101 (12), 2637-2643 (2010).
- Pathak, A., Kumar, S. Independent regulation of tumor cell migration by matrix stiffness and confinement. Proc Natl Acad Sci U S A. 109 (26), 10334-10339 (2012).
- Wei, S. C., et al. Matrix stiffness drives epithelial-mesenchymal transition and tumour metastasis through a TWIST1-G3BP2 mechanotransduction pathway. Nat Cell Biol. 17 (5), 678-688 (2015).
- Romero-Lopez, M., et al. Recapitulating the human tumor microenvironment: Colon tumor-derived extracellular matrix promotes angiogenesis and tumor cell growth. Biomaterials. 116, 118-129 (2017).
- Xu, X., Sabanayagam, C. R., Harrington, D. A., Farach-Carson, M. C., Jia, X. A hydrogel-based tumor model for the evaluation of nanoparticle-based cancer therapeutics. Biomaterials. 35 (10), 3319-3330 (2014).
- Xu, X., et al. Recreating the tumor microenvironment in a bilayer, hyaluronic acid hydrogel construct for the growth of prostate cancer spheroids. Biomaterials. 33 (35), 9049-9060 (2012).
- Nyga, A., Loizidou, M., Emberton, M., Cheema, U. A novel tissue engineered three-dimensional in vitro colorectal cancer model. Acta Biomater. 9 (8), 7917-7926 (2013).
- Yip, D., Cho, C. H. A multicellular 3D heterospheroid model of liver tumor and stromal cells in collagen gel for anti-cancer drug testing. Biochem Biophys Res Commun. 433 (3), 327-332 (2013).
- Hoare, T. R., Kohane, D. S. Hydrogels in drug delivery: Progress and challenges. Polymer. 49 (8), 1993-2007 (2008).
- Delgado, L. M., Bayon, Y., Pandit, A., Zeugolis, D. I. To cross-link or not to cross-link? Cross-linking associated foreign body response of collagen-based devices. Tissue Eng Part B Rev. 21 (3), 298-313 (2015).
- Florczyk, S. J., et al. Porous chitosan-hyaluronic acid scaffolds as a mimic of glioblastoma microenvironment ECM. Biomaterials. 34 (38), 10143-10150 (2013).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In vitro three-dimensional (3D) models in cancer research: an update. Mol Carcinog. 52 (3), 167-182 (2013).
- Zhang, M., Boughton, P., Rose, B., Lee, C. S., Hong, A. M. The use of porous scaffold as a tumor model. Int J Biomater. 2013, 396056(2013).
- Wang, J., et al. Engineering EMT using 3D micro-scaffold to promote hepatic functions for drug hepatotoxicity evaluation. Biomaterials. 91, 11-22 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon