Method Article
Visualização de interação proteína-proteína em Citoplasmáticas frações nucleares e por co-imunoprecipitação e
Neste Artigo
Resumo
Protein-protein interactions can occur in both the nucleus and the cytoplasm of a cell. To investigate these interactions, traditional co-immunoprecipitation and modern proximity ligation assay are applied. In this study, we compare these two methods to visualize the distribution of NF90-RBM3 interactions in the nucleus and the cytoplasm.
Resumo
Protein-protein interactions are involved in thousands of cellular processes and occur in distinct spatial context. Traditionally, co-immunoprecipitation is a popular technique to detect protein-protein interactions. Subsequent Western blot analysis is the most common method to visualize co-immunoprecipitated proteins. Recently, the proximity ligation assay has become a powerful tool to visualize protein-protein interactions in situ and provides the possibility to quantify protein-protein interactions by this method. Similar to conventional immunocytochemistry, the proximity ligation assay technique is also based on the accessibility of primary antibodies to the antigens, but in contrast, proximity ligation assay detects protein-protein interactions with a unique technique involving rolling-circle PCR, while conventional immunocytochemistry only shows co-localization of proteins.
Nuclear factor 90 (NF90) and RNA-binding motif protein 3 (RBM3) have been previously demonstrated as interacting partners. They are predominantly localized in the nucleus, but also migrate into the cytoplasm and regulate signaling pathways in the cytoplasmic compartment. Here, we compared NF90-RBM3 interaction in both the nucleus and the cytoplasm by co-immunoprecipitation and proximity ligation assay. In addition, we discussed the advantages and limitations of these two techniques in visualizing protein-protein interactions in respect to spatial distribution and the properties of protein-protein interactions.
Introdução
Fator nuclear 90 (NF90) é uma proteína multi-isoforma com inúmeras funções, incluindo a resposta à infecção viral, a regulação de interleucina-2 pós-transcrição e regulação do miRNA biogênese 1-3. RBM3 é uma proteína de ligação a ARN, envolvidos na tradução e miARN biogénese e pode ser induzida por vários factores de stress incluindo a hipoxia e hipotermia 4-6. Recentemente, encontramos NF90 e RBM3 em um complexo de proteínas 7. A interacção de NF90 e RBM3 é essencial para modular a actividade de proteína quinase-ARN como retículo endoplasmático quinase (PERK) em resposta proteína desdobrada 7. Ambos NF90 e RBM3 estão localizados predominantemente no núcleo, mas uma pequena proporção de NF90 e de transporte RBM3 para o citoplasma e se ligam uns aos outros para lá para funções específicas, por exemplo, para regular a actividade de vantagem. Portanto, é importante para visualizar a distribuição de interacções NF90-RBM3 no compartimento subcelular, que pode indicarseus vários papéis no respectivo compartimento.
Décadas atrás, dois híbridos de levedura (Y2H) foi desenvolvido para detectar a interacção entre duas proteínas 8. No entanto, devido à construção artificial de proteínas fundidas, falsos resultados positivos têm restringido a aplicação deste método. Durante muito tempo, a co-imunoprecipitação foi a principal técnica para analisar interacções proteína-proteína, especialmente em condições endógenas 9. Para analisar o complexo de proteína de co-imunoprecipitada, Western blot é a técnica mais conveniente, enquanto a espectrometria de massa é usada quando super-sensibilidade e precisão são desejados. Nos últimos anos, ensaio de proximidade de ligação foi desenvolvida como um método novo para a detecção de interacções proteína-proteína em ambas as células e tecidos in situ 10,11.
Aqui, nós comparamos o método de co-imunoprecipitação mais popular e método de ensaio de proximidade de ligação relativamente nova na captura NF9interacção 0-RBM3 em fracções subcelulares. Também discutimos as vantagens e limitações de ambas as técnicas.
Protocolo
1. Co-imunoprecipitação
- Semente HEK293 células a 2 x 10 5 células por cavidade em uma placa de 6 cavidades em 2 ml de modificação Médio suplemento (DMEM) de Eagle da Dulbecco com 10% de soro fetal de bovino (FBS) e 100 U / ml de penicilina-estreptomicina (Pen-Strep) .
- Crescer as células durante 48 h a 37 ° C com 5% de CO 2.
- Lavar as células com soro fisiológico tamponado com fosfato frio (PBS) três vezes. Células colheita por centrifugação a 500 xg durante 5 min a 4 ° C.
- A preparação das fracções nuclear e citoplasmática usando reagentes de extracção nuclear e citoplasmática comerciais. Siga as instruções do fabricante, com algumas modificações.
- Use 3 X 10 6 células para uma experiência de co-imunoprecipitação (aproximadamente com 90% de confluência de 3 poços de uma placa de 6 poços). Adicionar 300 ul solução fria citoplasmática de extração (CER I) e vortex por 15 segundos na velocidade mais alta.
- Incubar durante 30 min em gelo. Durante a incubação, vorteX 5 s por cada 10 min.
- Adicionar 16,5 ul extracção a frio citoplasmática solução II (CER II), vortex durante 5 segundos e incubar por 5 min em gelo.
- Vortex durante 5 segundos e centrifugar a 16000 xg durante 5 min a 4 ° C.
- Transferir o sobrenadante (extracto citoplásmico) para um novo tubo de pré-gelada, e manter em gelo até ser utilizada.
- Lavar peletes insolúveis (núcleos) que contêm três vezes com PBS frio 1 ml de cada vez por pipetagem para cima e para baixo cinco vezes. Remover PBS após lavagem.
- Adicionar 150 mL solução de extracção a frio nuclear (NER), vortex durante 15 seg e incubar 1 hora em gelo. Durante a incubação, vortex durante 15 seg e pipeta de 10 vezes com uma ponta de 200 ul a cada 10 min.
- Vortex durante 15 segundos e centrifugar a 16000 xg durante 10 min a 4 ° C.
- Transferir o sobrenadante (extracto nuclear) para um novo tubo de pré-gelada, manter em gelo até à sua utilização.
- Retire 10% do volume de extractos nucleares e citoplasmáticos como entradas cada.
- UMAdd PBS frio para os restantes extractos para um volume final de 1 ml. Manter em gelo até à sua utilização.
NOTA: Pré-compensação não é essencial quando se utiliza a proteína G conjugada esferas magnéticas. No entanto, se o fundo é alta, realizar pré-limpeza por incubação de 40 ul de esferas de proteína G-conjugados magnéticos (pasta a 50%) e 1 ml de lisado diluído a partir deste passo, a 4 ° C durante 30 min num agitador rotativo. sobrenadante separado (lisado pré-limpo) de grânulos com cremalheira magnética. Descarte as contas. - Para o anticorpo primário par com esferas magnéticas Proteína G-conjugados, incubar 40 ul de proteína esferas magnéticas L-conjugados (pasta a 50%) com o anticorpo 4 ug policlonal de coelho anti-RBM3 ou IgG de coelho (controlo negativo) em 200 ul de PBS mais Tween 20 (PBST, 0,02% de Tween 20) à temperatura ambiente (TA) durante 40 min num agitador rotativo.
- grânulos e sobrenadante separado anticorpo acoplado com uma cremalheira magnética, e desprezar o sobrenadante. Lavam-se as esferas uma vez com 200 uL de PBST (0,02%).
- Adicione 1ml diluída lisados (ou, se necessário, os lisados pré-limpo) para os grânulos, e incubar num agitador rotativo a 4 ° C durante a noite.
- No dia seguinte, separar as esferas e o sobrenadante por uma cremalheira magnética, e desprezar o sobrenadante. Lavar 3 x 10 min, com 0,5 ml de PBST (0,02%) para cada tubo a 4 ° C num agitador rotativo com uma velocidade fixa de 20 rpm.
- Eluir proteínas a partir dos grânulos através da adição de tampão de amostra de 40 ul (tampão de amostra comercial 1x e 1,4 mM de ditiotreitol-50 (DTT)). Aquece-se a 70 ° C durante 10 min. Spin down e líquidos de transferência para um novo tubo de 1,5 ml.
- Dilui-se lisados de entrada em tampão de amostra (concentração final: tampão de amostra comercial 1x e DTT 50 mM) e aquece-se a 70 ° C durante 10 min. entradas de carga e as proteínas imunoprecipitadas a partir do último passo de um gel pré-moldado de 4-12% Bis-Tris. O volume de carga de cada cavidade não deve exceder 20 ul. Efectuar a electroforese em tampão de corrida 1x comercial em gelo durante 35 min.
NOTA: Carga nuclear e extrato citoplasmáticos numa proporção de 1: 2 (V / V), o que reflecte a mesma quantidade inicial de células. - Transferência de proteínas para uma membrana de PVDF em tampão de transferência comercial 1x a 30 V durante 2 horas a 4 ° C.
- Bloco de membrana com 5% de leite desnatado em PBST (0,1% de Tween 20) à temperatura ambiente durante 40 minutos num agitador.
- Incubar membrana com anticorpos primários (ambos diluídos em 1: 1000) em PBST (0,1%) a 4 ° C durante a noite.
- Lavar 3 x 10 min com PBST (0,1%) à temperatura ambiente num agitador.
- Incubar membrana com peroxidase de rábano (HRP) -conjugated anticorpos secundários anti-murganho ou anti-coelho (ambos diluídos em 1: 5000) em PBST (0,1%) à temperatura ambiente durante 1 h.
- Lavar 3 x 10 min com PBST (0,1%) à temperatura ambiente num agitador.
- Use 0,2 ml quimioluminescência aumentada (ECL) de uma mistura de substrato por membrana cm 2, incubar à TA durante 5 min. Evite toda a luz a partir desta etapa em diante, exceto luzes vermelhas.
- Descartar líquido e expor a um filme de raios-X em uma cassete de película. Desenvolver filme usando uma pr filme automáticamáquina ocessing.
2. Imunocitoqu�ica e proximidade Ligadura Assay
- Semente células HEK293 em 1.5 x 10 4 culas por câmara em uma câmara de 8-poli-D-lisina lâmina revestida em 0,4 ml de DMEM suplementado com FBS a 10% e 100 U / ml de Pen-Strep.
- Crescer as células durante 48 h a 37 ° C com 5% de CO 2.
- Aspirar o meio, e fixar as células com paraformaldeído a 4% (PFA) durante 10 min à TA.
- Aspirar PFA, e lavagem de 3 x 10 min com 0,5 ml de PBS por câmara.
- Permeabilizar as células e de bloco com 0,5% de Triton X-100 e 5% de soro de cabra normal (NGS) em PBS à temperatura ambiente durante 1 h.
- Incubar com anticorpos primários em 0,1% de Triton X-100 e 5% em PBS, NGS num agitador a 4 ° C durante a noite. Diluir monoclonal de ratinho anti-NF90 e anticorpo policlonal de coelho anti-anticorpo RBM3 1: 100 em PBS durante dupla coloração. Para controlo negativo, omitir independentemente, qualquer um dos dois anticorpos primários, e omitir ambos os anticorpos em um terceiro controlo.
NOTA: Não utilize o bloqueio comercial e reagentes de diluição. - Lavar 3 x 10 min, com 0,5 ml de PBS por câmara.
- Sujeito a imunocitoquímica ou de proximidade protocolos de ensaio ligadura
- imunocitoquímica
- Incubar com 1: 500 diluído fluorescente acoplado-corante verde anti-ratinho e de anticorpos acoplados à corantes fluorescentes vermelhas anti-coelho secundário à TA durante 1 h. Evite luz a partir desta etapa em diante.
- contracoloração núcleos com 4 ', 6-diamidin-2-fenilindol (DAPI) diluído 1: 5000 em PBS à temperatura ambiente durante 10 min.
- Lavar 3 x 10 min, com 0,5 ml de PBS por câmara.
- Retirar as câmaras da lâmina de vidro e seco. Monte com 250 μ, médio por lâmina de montagem.
- ensaio de ligação de proximidade
- Prepare proximidade sondas de ensaio de ligação. Misture e diluir sondas de ensaio ligadura dois proximidade (anticorpos secundários anti-ratinho e anti-coelho ligados com diferentes oligonucleotídeos que pode ligar tháspera a adição de dois outros oligonucleótidos em solução de ligação) ambos 1: 5 em 0,1% de Triton X-100 e 5% de NGS em PBS, com um volume total de 320 ul de uma lâmina de 8 câmaras (aproximadamente 40 ul por cm 2) . Incubar à temperatura ambiente durante 20 min.
- Retirar as câmaras da lâmina de vidro e adicionar as sondas diluído. Incubar numa incubadora de humidade a 37 ° C durante 1 h.
- Preparar a solução de ligação. Misture 8 ul ligase, 64 ul da ligadura 5 x e 248 mL de H 2 O.
- Toque o líquido a partir do slide, e lava-se 2 x 5 minutos em 1x tampão de lavagem A (fornecido com o kit).
- Adicionar a solução de ligação, e incubar numa incubadora de humidade a 37 ° C durante 30 min.
- Preparar a solução de amplificação. Misture 4 ul polimerase, da ampliação de 5x 64 ul e 252 ul H 2 O. Evite luz a partir desta etapa em diante.
- Toque off líquido a partir do slide, e lave 2 x 2 min em 1x tampão de lavagem A.
- Adicione o amplification solução e incubar numa incubadora de humidade escuro a 37 ° C durante 100 min.
- Toque o líquido a partir do slide, e lava-se 2 x 10 minutos em 1x tampão de lavagem B (fornecido com o kit). Lavar durante 1 min em 0.01x Wash Buffer B.
- Seque o slide e montagem com 250 mL de um meio de montagem comercial (com DAPI) por slide.
- imunocitoquímica
- Examine sinais fluorescentes sob um microscópio utilizando uma lente ocular 10X e 20X lente objetiva. Aquisição de imagens por uma câmera CCD.
Resultados
A Figura 1 demonstra que NF90 e RBM3 são ambos proteínas nucleares e apenas uma pequena fracção está presente no citoplasma. Notavelmente, existem três diferentes bandas coradas positivas para RBM3. O menor logo abaixo de 20 kDa reflecte o tamanho correcto de RBM3 (o peso molecular previsto de 17 kDa é RBM3). A origem das duas outras bandas continua a ser investigado. experiências de co-imunoprecipitação com RBM3 como a proteína isca revelou que as interações NF90-RBM3 são predominantemente presente no núcleo e uma minoria no citoplasma. dados dos co-imunoprecipitação suporta a localização de cada única proteína.
Como mostrado na Figura 2A, e NF90 RBM3 estão localizados principalmente no núcleo, mas também no citoplasma in situ. Ambas as proteínas mostram a co-localização perfeita em ambos os compartimentos. ensaio de ligação de proximidade revelou o modelode interacções NF90-RBM3, que é muito semelhante a imunocitoquímica convencional, com a maioria das interacções no núcleo na maioria das células. Apenas uma pequena proporção de células demonstrou distribuição predominantemente citoplasmática de interações NF90-RBM3.
Tomados em conjunto, co-imunoprecipitação e de ligação de proximidade técnicas de ensaio reflectem essencialmente o mesmo padrão de distribuição de interacções proteína-proteína em compartimentos nucleares e citoplasmáticos.
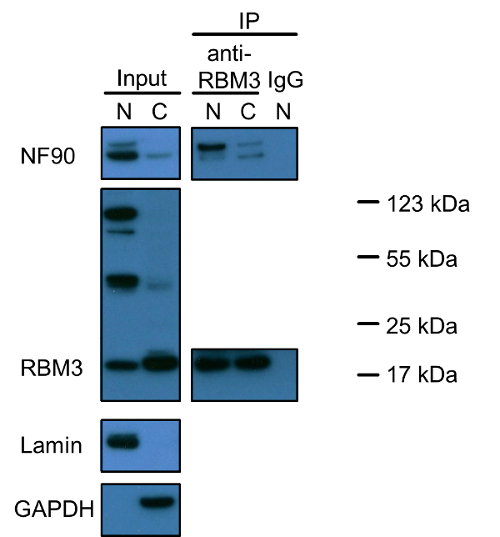
Figura 1: Western Blot Análise do NF90 e RBM3 e suas interações em nuclear e citoplasmática fracções de células HEK293. Os extractos nucleares e citoplasmáticos foram carregadas para SDS-PAGE em gel em uma proporção de 1: 2 (v / v), reflectindo a mesma quantidade de células, como indicado no protocolo de extracção. Lamina e GAPDH foram utilizados como nucleare marcadores citoplasmáticos, respectivamente. Co-imunoprecipitação foi realizada com anticorpo anti-RBM3, ou IgG de coelho como controlo negativo. Os extractos nucleares e citoplasmáticos foram também incubadas com anticorpo anti-RBM3 numa proporção de 1: 2 (v / v), respectivamente. banda superior em blot NF90 indica 110 kDa isoforma longa NF110. N: extracto nuclear; C: extrato citoplasmático, IP: imunoprecipitação. marcadores de proteínas foram marcadas durante bandas positivas RBM3. Por favor clique aqui para ver uma versão maior desta figura.
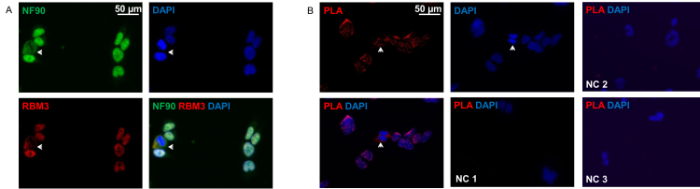
Figura 2: Imunocitoqu�ica e proximidade Ligadura Ensaio de células HEK293. (A) duas vezes coloração de células HEK293 com anticorpos anti-RBM3 (vermelho) anti-NF90 (verde) e. Arrow células show com clara co-localização citoplasmática de NF90 e RBM3. Os núcleos foram contrastadas com DAPI (azul). (B) Ensaio de Proximidade de ligação com os anticorpos anti-RBM3 em células HEK293 anti-NF90 e. manchas fluorescentes vermelhas indicam interações NF90-RBM3. As setas mostram interações NF90-RBM3 em citoplasma. Os núcleos foram contrastadas com DAPI (azul). controle negativo 1 (NC 1): ambos os anticorpos primários foram omitidos. controle negativo 2 (NC 2): anticorpo primário RBM3 única. controle negativo 3 (NC 3): somente NF90 único anticorpo primário. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Há vários benefícios, bem como deficiências para ambos os métodos. Como uma técnica relativamente nova, uma vantagem óbvia de ensaio de proximidade de ligação é a viabilidade para elucidar as interacções proteína-proteína ao nível de uma única célula em vez de um lote de células heterogéneas. Imagens com alta magnitude e resolução (por exemplo, através de microscópio confocal) prever a possibilidade de quantificação contando manchas fluorescentes individuais. Em contraste, a combinação convencional de técnica de co-imunoprecipitação com Western blot pode apenas semi-quantificar as bandas de proteína, principalmente porque um controlo de carga adequado é difícil de determinar, para as amostras IP. Além disso, quando a interacção proteína-proteína é fraco ou transitória, uma grande quantidade de material biológico, por exemplo, células ou tecidos, é necessário para a co-imunoprecipitação ou um sistema de sobre-expressam artificial com tag fundido é aplicado para melhorar a possibilidade para detectar as interacções . Alternativamente, a detecção de techniques com alta sensibilidade, tais como espectrometria de massa pode melhorar a qualidade da experiência. No entanto, no que diz respeito à quantidade de material de partida, o método de ensaio de ligação de proximidade tem vantagens claras. Apenas algumas células são necessários, desde que uma alta qualidade de anticorpos é dada. Além disso, em amostras de tecido, na visualização in situ de interacções proteína-proteína em diferentes estruturas de tecidos e tipos de células pode ser conseguida por ensaio de proximidade de ligação, num padrão semelhante à imunohistoquímica normal. Em contraste, a co-imunoprecipitação é, pela sua natureza, se não para exibir a distribuição espacial das interacções proteína-proteína.
Em células com núcleos grandes, mas pequenos compartimentos citoplasmáticos, o método de ensaio de ligação de proximidade é limitada na análise de distribuições nucleares-citoplasmática e co-imunoprecipitação tradicional tem a sua própria superioridade. Por exemplo, em linhas de células de linfócitos T, de Jurkat, por exemplo, células, DISTRI nuclear-citoplasmáticacontri- de interacção NF90-RBM3 pela técnica de ensaio de ligação de proximidade é restrita, porque o núcleo ocupa praticamente todo o espaço dentro da célula, e é difícil identificar o limite do compartimento citoplasmático. Isto pode ser um problema comum para imunocitoquímica, em geral, quando a proporção de núcleo-citoplasma é extremamente desigual. No entanto, a co-imunoprecipitação, nesta situação não é sujeita a esta limitação.
Uma preocupação especial em relação ensaio de proximidade ligadura é se os sinais do ensaio de proximidade ligadura representam interações proteína-proteína directas ou indirectas. Ambos NF90 e RBM3 têm propriedades de ligação a ARN e a sua interacção é dependente de ARN, como descrito no nosso estudo anterior 7. Assim, o pré-tratamento de lisados de células com RNase dissolve interacção entre NF90 e RBM3 e nada é detectável pelo método de co-imunoprecipitação 7. No entanto, o sinal de ensaio de proximidade de ligação não é afectadamesmo que uma interacção proteína-proteína dependente de ARN perde as espécies de ARN, uma vez que é gerado quando a distância entre as duas proteínas é menos do que 40 nm, o que é geralmente considerado como uma interacção directa. Esta propriedade do ensaio de ligação de proximidade pode superar os problemas técnicos de co-imunoprecipitação, tal como libertação de RNase no ligado celular que pode suprimir as interacções que requerem mediação ARN. No entanto, por outro lado, o método de ensaio de proximidade de ligação pode também gerar sinais de falsos positivos, se a interacção proteína-proteína dependente de ARN, na verdade, não existir, devido à falta de ARN específico em condições fisiológicas.
Outra questão que merece atenção especial é a especificidade dos anticorpos primários ea possibilidade de isoformas da proteína, precursores e agregados de proteínas. Observou-se por Western blot que a isoforma longa NF90, NF110, é muito menos abundante no núcleo e no citoplasma tanto em células HEK293, em comparação com NF90 (Fifigura 1). No entanto, a co-imunoprecipitação desvendados uma afinidade de ligação mais elevada de NF110 para RBM3 particularmente no núcleo. Três bandas principais foram descobertos em borrões RBM3 no núcleo, mas apenas a banda RBM3 normal de 20 kDa foi observada principalmente no citoplasma. Se os outros dois 50 kDa e 100 kDa reflectir isoformas RBM3, precursores, agregados de proteínas com RBM3 ligado ou deveram-se a fundo inespecífica continuam a ser elucidado. Em vez disso, uma vez que o ensaio de proximidade de ligação é baseado em imunocoloração, o ensaio de proximidade de ligação não pode distinguir a diferença entre os diferentes isoformas da proteína, precursores, agregados ou coloração inespecífica, enquanto co-imunoprecipitação pode fornecer mais informações sobre anticorpos de especificidade ou proteína isoformas e precursores do que o ensaio de ligação de proximidade na investigação de interações proteína-proteína. Em relação RBM3, quando se considera todas as faixas de três RBM3 observados no núcleo, o resultado Western blot é consistente com um núcleos predominantes localizatina de RBM3 observado por imunocoloração.
Em conclusão, as técnicas de ensaio de co-imunoprecipitação e de ligação de proximidade tem vantagens intrínsecas e as restrições. Em muitos casos, eles produzem resultados consistentes mas é benéfico usar as duas técnicas quando se investiga sistematicamente determinada interacção proteína-proteína. No entanto, em casos especiais, ou com um determinado fim, pode-se mostrar a superioridade do que o outro. Recentemente, ensaio de proximidade de ligação foi usada para interacções proteína-proteína de tela para desenvolver novos marcadores de prognóstico 12. interacção proteína-proteína é considerada como um biomarcador mais confiável do que uma única proteína. No futuro, o ensaio de proximidade de ligadura pode potencialmente se tornar uma maneira rápida e confiável para analisar as interações proteína-proteína como biomarcadores de diagnóstico e prognóstico em clínicas, embora a identificação e caracterização desses biomarcadores ainda requer a co-immuoprecipication convencional meTHOD.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This study was supported by the Swiss National Science Foundation (SNSF, 31003A_163305).
Materiais
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle’s Medium (DMEM) | Sigma | D6429 | High glucose 4,500 mg/L |
| Fetal bovine serum (FBS) | Gibco, Thermo Fisher Scientific | 10270106 | |
| Penicillin-Streptomycin (PenStrep) | BioConcept | 4-01F00-H | |
| NE-PER Nuclear and Cytoplasmic Extraction Reagents | Thermo Fisher Scientific | 78833 | |
| 1,4-Dithiothreitol (DTT) | Carl Roth | 6908.3 | |
| Dynabeads Protein G | Novex, Thermo Fisher Scientific | 10003D | |
| DRBP76 (NF90/NF110) antibody | BD Transduction Laboratories | 612154 | use 1:1,000 for WB and 1:100 for ICC/PLA |
| RBM3 antibody | ProteinTech | 14363-1-AP | use 1:1,000 for WB and 1:100 for ICC/PLA |
| Lamin A/C antibody | Cell Signaling Technology | #2032 | use 1:1,000 for WB |
| anti-GAPDH antibody | Abcam | ab8245 | use 1:1,000 for WB |
| normal rabbit IgG | Santa Cruz | sc-2027 | |
| anti-rabbit IgG, HRP-linked secondary antibody | Cell Signaling Technology | #7074 | use 1:5,000 for WB |
| anti-mouse HRP secondary antibody | Carl Roth | 4759.1 | use 1:5,000 for WB |
| Clarity Western ECL Blotting Substrate | Bio-Rad | #1705060 | |
| NuPAGE Novex 4-12% Bis-Tris Gel | Novex, Thermo Fisher Scientific | NP0321BOX | |
| NuPAGE LDS Sample Buffer (4x) | Novex, Thermo Fisher Scientific | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Novex, Thermo Fisher Scientific | NP0002 | |
| NuPAGE Transfer Buffer (20x) | Novex, Thermo Fisher Scientific | NP00061 | |
| Amersham Hypond P 0.2 PVDF membrane | GE Healthcare Life Sciences | 10600021 | |
| Poly-D-Lysine 8 Well Culture Slide | Corning BioCoat | 354632 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Normal goat serum (NGS) | Gibco, Thermo Fisher Scientific | PCN5000 | |
| Goat anti-mouse IgG (H+L Antibody), Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11001 | |
| Goat anti-rabbit IgG (H+L Antibody), Alexa Fluor 568 conjugate | Thermo Fisher Scientific | A-11011 | |
| 4′, 6-Diamidin-2-phenylindol (DAPI) | Sigma | D9542 | |
| Duolink PLA probe Anti-mouse PLUS | Sigma | DUO92001 | |
| Duolink PLA probe Anti-rabbit MINUS | Sigma | DUO92005 | |
| Duolink Detection Reagents Red | Sigma | DUO92008 | |
| Duolink Wash Buffers Fluorescence | Sigma | DUO82049 | |
| Duolink Mounting Medium with DAPI | Sigma | DUO82040 | |
| Mowiol 4-88 | Sigma | 81381 | |
| Microscope | Olympus | AX-70 | |
| CCD camera | SPOT | Insight 2MP Firewire | |
| X-ray film | Fujifilm | Super RX | |
| Film processing machine | Fujifilm | FPM-100A |
Referências
- Patiño, C., Haenni, A. L., Urcuqui-Inchima, S. NF90 isoforms, a new family of cellular proteins involved in viral replication? Biochimie. 108, 20-24 (2015).
- Shim, J., Lim, H., R Yates, J., Karin, M. Nuclear export of NF90 is required for interleukin-2 mRNA stabilization. Mol Cell. 10 (6), 1331-1344 (2002).
- Sakamoto, S., et al. The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway. Mol Cell Biol. 29 (13), 3754-3769 (2009).
- Dresios, J., et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters microRNA levels, and enhances global protein synthesis. Proc Natl Acad Sci. 102 (6), 1865-1870 (2005).
- Danno, S., Itoh, K., Matsuda, T., Fujita, J. Decreased expression of mouse Rbm3, a cold-shock protein, in Sertoli cells of cryptorchid testis. Am J Pathol. 156 (5), 1685-1692 (2000).
- Wellmann, S., et al. Oxygen-regulated expression of the RNA-binding proteins RBM3 and CIRP by a HIF-1-independent mechanism. J Cell Sci. 117 (Pt 9), 1785-1794 (2004).
- Zhu, X., Zelmer, A., Kapfhammer, J. P., Wellmann, S. Cold-inducible RBM3 inhibits PERK phosphorylation through cooperation with NF90 to protect cells from endoplasmic reticulum stress. FASEB J. 30 (2), 624-634 (2016).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340 (6230), 245-246 (1989).
- Verhelst, J., De Vlieger, D., Saelens, X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp. (98), (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2007).
- Jarvius, M., et al. In situ detection of phosphorylated platelet-derived growth factor receptor beta using a generalized proximity ligation method. Mol Cell Proteomics. 6 (9), 1500-1509 (2007).
- Liu, C. H., et al. Analysis of protein-protein interactions in cross-talk pathways reveals CRKL protein as a novel prognostic marker in hepatocellular carcinoma. Mol Cell Proteomics. 12 (5), 1335-1349 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados