Method Article
Visualisierung von Protein-Protein-Wechselwirkung in Kern- und Cytoplasma-Fraktionen durch Co-Immunpräzipitation und
In diesem Artikel
Zusammenfassung
Protein-protein interactions can occur in both the nucleus and the cytoplasm of a cell. To investigate these interactions, traditional co-immunoprecipitation and modern proximity ligation assay are applied. In this study, we compare these two methods to visualize the distribution of NF90-RBM3 interactions in the nucleus and the cytoplasm.
Zusammenfassung
Protein-protein interactions are involved in thousands of cellular processes and occur in distinct spatial context. Traditionally, co-immunoprecipitation is a popular technique to detect protein-protein interactions. Subsequent Western blot analysis is the most common method to visualize co-immunoprecipitated proteins. Recently, the proximity ligation assay has become a powerful tool to visualize protein-protein interactions in situ and provides the possibility to quantify protein-protein interactions by this method. Similar to conventional immunocytochemistry, the proximity ligation assay technique is also based on the accessibility of primary antibodies to the antigens, but in contrast, proximity ligation assay detects protein-protein interactions with a unique technique involving rolling-circle PCR, while conventional immunocytochemistry only shows co-localization of proteins.
Nuclear factor 90 (NF90) and RNA-binding motif protein 3 (RBM3) have been previously demonstrated as interacting partners. They are predominantly localized in the nucleus, but also migrate into the cytoplasm and regulate signaling pathways in the cytoplasmic compartment. Here, we compared NF90-RBM3 interaction in both the nucleus and the cytoplasm by co-immunoprecipitation and proximity ligation assay. In addition, we discussed the advantages and limitations of these two techniques in visualizing protein-protein interactions in respect to spatial distribution and the properties of protein-protein interactions.
Einleitung
Nuclear factor 90 (NF90) ist ein Multi-Isoform - Proteins mit zahlreichen Funktionen , einschließlich der Reaktion auf eine virale Infektion, die Regulierung von Interleukin-2 post-Transkription und Regulierung der miRNA Biogenese 1-3. RBM3 ist ein RNA-bindendes Protein, involviert in Translation und miRNA Biogenese und kann durch verschiedene Stressoren einschließlich Hypothermie und Hypoxie 4-6 induziert werden. Vor kurzem fanden wir NF90 und RBM3 in einem Proteinkomplex 7. Das Zusammenspiel von NF90 und RBM3 ist essentielles Protein - Kinase - RNA-ähnliche Endoplasmatischen Retikulum - Kinase (PERK) Aktivität in ungefalteten Protein - Reaktion 7 zu modulieren. Sowohl NF90 und RBM3 befinden sich überwiegend im Kern aber einem geringen Anteil an NF90 und RBM3 Shuttle in das Zytoplasma und binden dort miteinander für bestimmte Funktionen, beispielsweise PERK Aktivität zu regulieren. Daher ist es wichtig, die Verteilung von NF90-RBM3 Wechselwirkungen in dem subzellulären Kompartiment zu visualisieren, die anzeigen kannihre verschiedenen Rollen in den jeweiligen Fach.
Vor Jahrzehnten, Hefe - Zwei - Hybrid (Y2H) wurde die Wechselwirkung zwischen zwei Proteinen 8 zu erkennen , entwickelt. Aufgrund künstliche Konstruktion von Fusionsproteinen, falsch-positive Ergebnisse haben die Anwendung dieses Verfahrens beschränkt. Für eine lange Zeit, Co-Immunpräzipitation war das Haupt Technik Protein-Protein - Wechselwirkungen, insbesondere in endogener Bedingungen 9 zu analysieren. Um die Co-immunpräzipitiert Proteinkomplex zu analysieren, Western-Blot ist die bequemste Methode, während der Massenspektrometrie verwendet wird, wenn Super Empfindlichkeit und Genauigkeit erwünscht sind. In den letzten Jahren Proximity Ligation Assay wurde als ein neues Verfahren entwickelt worden , Protein-Protein - Wechselwirkungen in beiden Zellen und Gewebe in situ 10,11 zu erkennen.
Hier verglichen wir die beliebtesten Coimmunpräzipitation Verfahren und relativ neuartige Nähe Ligatur Testverfahren in NF9 Erfassung0-RBM3 Interaktion in subzellulären Fraktionen. Wir diskutierten auch die Vorteile und Grenzen beider Techniken.
Protokoll
1. Coimmunpräzipitation
- Seed HEK293 Zellen bei 2 × 10 5 Zellen pro Vertiefung in eine 6-Well - Platte in 2 ml nach Dulbecco modifiziertem Eagle-Medium (DMEM) Nahrungsergänzungsmittel mit 10% fetalem Rinderserum (FBS) und 100 U / ml Penicillin-Streptomycin (Pen-Strep) .
- Wachsen Zellen für 48 Stunden bei 37 ° C mit 5% CO 2.
- Wasche die Zellen mit kalter Phosphat-gepufferter Salzlösung (PBS) dreimal. Ernte die Zellen durch Zentrifugation bei 500 xg für 5 min bei 4 ° C.
- Bereiten Sie Kern- und Cytoplasma-Fraktionen kommerziellen Kern und Cytoplasma-Extraktion unter Verwendung von Reagenzien. Folgen Sie Anweisungen des Herstellers mit einigen Modifikationen.
- Verwenden 3 x 10 6 Zellen für einen Co-Immunpräzipitation Experiment (ungefähr 90% Konfluenz von 3 Vertiefungen einer Platte mit 6 Vertiefungen). In 300 ul kalten Cytoplasma-Extraktionslösung (CER I) und Vortex 15 Sekunden lang mit der höchsten Geschwindigkeit.
- Inkubieren für 30 Minuten auf Eis. Während der Inkubation Vortex für 5 s alle 10 min.
- In 16,5 ul kalt zytoplasmatischen Extraktionslösung II (CER II), Vortex für 5 Sekunden und Inkubation für 5 min auf Eis.
- Rührers 5 sec und Zentrifuge bei 16.000 × g für 5 min bei 4 ° C.
- Den Überstand (Zytoplasmaextrakt) in eine neue vorgekühlte Rohr und auf Eis halten, bis sie verwendet.
- Waschen Sie unlöslichen Pellets (mit Kernen) dreimal mit 1 ml kaltem PBS jedes Mal durch Auf- und Abpipettieren fünfmal. Entfernen PBS nach dem Waschen.
- In 150 ul kalten Kernextraktionslösung (NER), Vortex für 15 Sekunden und Inkubation 1 Stunde auf Eis. Während der Inkubation Vortex für 15 Sekunden und Pipette 10 mal mit einer 200 ul Spitze alle 10 min.
- Vortex für 15 s und Zentrifuge bei 16.000 xg für 10 min bei 4 ° C.
- Den Überstand (Kernextrakt) in eine neue vorgekühlte Röhrchen, auf Eis halten bis zur Verwendung.
- Nehmen Sie 10% des Volumens der Kern- und Zytoplasmaextrakte jeweils als Eingänge.
- EINdd kaltem PBS auf die verbleibenden Extrakte auf ein Endvolumen von 1 ml. Halten Sie sich auf Eis bis zum Gebrauch.
HINWEIS: Pre-Clearing nicht wesentlich ist, wenn Protein G-konjugierten magnetischen Kügelchen verwendet wird. Wenn jedoch der Hintergrund hoch ist, führen Pre-Clearing von 40 & mgr; l Protein G-konjugierten magnetischen Kügelchen inkubiert (50% Slurry) und 1 ml für 30 min auf einem Rotator Lysat aus diesem Schritt bei 4 ° C verdünnt. Separate Überstand (bereits geklärten Lysat) von Perlen mit Magnethalter. Entsorgen Sie die Perlen. - Zu kuppeln primäre Antikörper mit Protein G-konjugierten magnetischen Kügelchen, inkubiere 40 & mgr; l Protein G-konjugierten magnetischen Kügelchen (50% ige Aufschlämmung) mit 4 & mgr; g Kaninchen-polyklonalen Anti-RBM3 Antikörper oder Kaninchen-IgG (negative Kontrolle) in 200 & mgr; l PBS plus Tween 20 Puffer (PBST, 0,02% Tween 20) bei Raumtemperatur (RT) für 40 min auf einem Rotator.
- Separate Antikörper-gekoppelten Kügelchen und der Überstand mit einem Magnetträger, und den Überstand verwerfen. Waschen Sie die Perlen einmal mit 200 ul PBST (0,02%).
- 1ml verdünnt Lysaten (oder, falls erforderlich, bereits geklärten Lysate) an die Kügelchen, und über Nacht bei 4 ° C auf einem Rotator inkubiert.
- Am nächsten Tag, trennen Sie die Perlen und Überstand durch einen Magnetträger, und den Überstand verwerfen. Waschen 3 x 10 min mit 0,5 ml PBST (0,02%) für jedes Röhrchen bei 4 ° C auf einem Rotator mit einer festen Drehzahl von 20 Umdrehungen pro Minute.
- Eluieren von Proteinen aus den Perlen durch 40 & mgr; l Probenpuffer Zugabe (1x Handelsprobenpuffer und 50 mM 1,4-Dithiothreitol (DTT)). Hitze bei 70 ° C für 10 min. Spin down und Übertragungsflüssigkeiten in ein neues 1,5-ml-Röhrchen.
- Verdünnte Eingangs Lysate in Probenpuffer (Endkonzentration: 1x Handelsprobenpuffer und 50 mM DTT) und Wärme bei 70 ° C für 10 min. Lasteingänge und immunpräzipitiert Proteine aus dem letzten Schritt zu einer vorgegossenen 4-12% Bis-Tris-Gel. Das Ladevolumen von jeder Vertiefung sollte nicht mehr als 20 & mgr; l nicht überschreiten. Führen Elektrophorese in 1x kommerziellen Laufpuffer auf Eis für 35 min.
HINWEIS: Legen Sie nuklearen und Zytoplasmaextrakts in einem Verhältnis von 1: 2 (V / V), die den gleichen Anfangsmenge an Zellen widerspiegelt. - Transfer-Proteine auf PVDF-Membran in 1x Handelstransferpuffer bei 30 V für 2 h bei 4 ° C.
- Block-Membran mit 5% Magermilch in PBST (0,1% Tween 20) bei RT für 40 min auf einem Schüttler.
- Inkubieren Membran mit primärem Antikörper (beide in einer Verdünnung von 1: 1000) in PBST (0,1%) bei 4 ° C über Nacht.
- Waschen 3 x 10 min mit PBST (0,1%) bei RT auf einem Schüttler.
- Inkubieren Membran mit Meerrettich-Peroxidase (HRP) -konjugiertem Anti-Maus oder Anti-Kaninchen-Sekundärantikörper (beide in einer Verdünnung von 1: 5000) in PBST (0,1%) bei RT für 1 Std.
- Waschen 3 x 10 min mit PBST (0,1%) bei RT auf einem Schüttler.
- Verwenden 0,2 ml verstärkte Chemilumineszenz (ECL) Substratmischung pro cm 2 Membran, inkubiere 5 min bei RT. Vermeiden Sie alles Licht von diesem Schritt ab, außer roten Ampeln.
- Verwerfen Flüssigkeit und belichten zu einem Röntgenfilm in einer Filmkassette. Entwickeln Film einen automatischen Film pr mitHOLZBEARBEITUNGS- Maschine.
2. Immunzytochemie und Proximity Ligation Assay
- Seed HEK293 - Zellen mit 1,5 × 10 4 Zellen pro Kammer in einem 8-Kammer poly-D-Lysin beschichteten Objektträger in 0,4 ml DMEM mit 10% FBS ergänzt und 100 U / ml Pen-Strep.
- Wachsen Zellen für 48 Stunden bei 37 ° C mit 5% CO 2.
- Absaugen Medium und fixieren Zellen mit 4% Paraformaldehyd (PFA) für 10 min bei RT.
- Absaugen PFA und waschen 3 x 10 min mit 0,5 ml PBS pro Kammer.
- Permeabilisieren und Block-Zellen mit 0,5% Triton X-100 und 5% normalem Ziegenserum (NGS) in PBS bei RT für 1 Std.
- Inkubieren mit primärem Antikörper in 0,1% Triton X-100 und 5% NGS in PBS auf einem Schüttler bei 4 ° C über Nacht. Verdünnte Maus monoklonaler anti-NF90 Antikörper und polyklonalem Kaninchen-anti-RBM3 Antikörper 1: 100 in PBS für Doppelfärbung. Für negative Kontrolle wegzulassen unabhängig eine der beiden primären Antikörper und wegzulassen beide Antikörper in einem dritten Steuer.
HINWEIS: Verwenden Sie kommerzielle Blockierung und Verdünnungs Reagenzien verwenden nicht. - Waschen Sie 3 x 10 min mit 0,5 ml PBS pro Kammer.
- Vorbehaltlich Immunzytochemie oder Nähe Ligatur Assay - Protokolle
- Immunzytochemie
- Inkubieren mit 1: 500 verdünnt grün fluoreszierender Farbstoff-gekoppelten anti-Maus und roten Fluoreszenzfarbstoff-gekoppelte Anti-Kaninchen-Sekundärantikörper bei RT für 1 Std. Vermeiden Sie Licht, das von diesem Schritt ab.
- Gegenfärbung Kerne mit 4 ', 6-diamidin-2-phenylindol (DAPI), verdünnt 1: 5.000 in PBS bei RT für 10 min.
- Waschen Sie 3 x 10 min mit 0,5 ml PBS pro Kammer.
- Entfernen Sie die Kammern aus dem Glasträger und trocken. Montieren Sie mit 250 μ, Eindeckmedium pro Folie.
- Proximity-Ligation-Assay
- Bereiten Nähe Ligatur Assay-Sonden. Mischen und Verdünnen zwei Proximity Ligation Assay-Sonden (anti-Maus und Anti-Kaninchen-Sekundär mit verschiedenen Oligonukleotiden gebunden Antikörper, die th ligieren kannrough die Zugabe von zwei weiteren Oligonukleotiden in Ligationslösung) beide 1: 5 in 0,1% Triton X-100 und 5% NGS in PBS, mit einem Gesamtvolumen von 320 & mgr; l für eine 8-Kammerobjektträger (etwa 40 & mgr; l pro cm 2) . 20 min bei RT inkubiert.
- Entfernen Sie die Kammern aus dem Objektträger aus Glas und fügen Sie die verdünnten Sonden. Inkubieren in einer feuchten Inkubator bei 37 ° C für 1 Stunde.
- Bereiten Sie Ligierungslösung. Mischen Sie 8 ul - Ligase, 64 ul 5 x Ligatur Lager und 248 & mgr; l H 2 O.
- Abklopfen die Flüssigkeit aus der Folie, und waschen 2 x 5 min in 1x Waschpuffer A (versehen mit dem Kit).
- Hinzufügen Ligationslösung und Inkubieren in einer feuchten Inkubator bei 37 ° C für 30 min.
- Bereiten Sie Amplifikationslösung. Mix 4 ul - Polymerase, 64 & mgr; l 5x Verstärkung Lager und 252 & mgr; l H 2 O Vermeiden Sie Licht von diesem Schritt ab.
- Abklopfen Flüssigkeit aus dem Schlitten und waschen 2 x 2 min in 1x Wash Buffer A.
- Fügen Sie den Verstärkerlification Lösung und für 100 min bei 37 ° C in einer dunklen Feuchte Inkubator inkubiert.
- Abklopfen die Flüssigkeit aus der Folie, und waschen 2 x 10 min in 1x Waschpuffer B (im Lieferumfang des Kits). Waschen Sie für 1 min in 0,01x Waschpuffer B.
- Trocknen Sie die Rutsche und Halterung mit 250 & mgr; l eines handelsüblichen Montagemedium (mit DAPI) pro Folie.
- Immunzytochemie
- Untersuchen Sie Fluoreszenzsignale unter einem Mikroskop mit einem 10x Okular Objektiv und 20X Objektiv verwendet wird. Erwerben Sie Bilder von einer CCD-Kamera.
Ergebnisse
Abbildung 1 zeigt , dass NF90 und RBM3 sind beide Kernproteine und nur ein kleiner Teil ist in das Zytoplasma. Bemerkenswert ist, gibt es drei verschiedene Bands für RBM3 positiv gefärbt. Die kleinste knapp unter 20 kDa die richtige Größe der RBM3 reflektiert (das vorhergesagte Molekulargewicht von RBM3 ist 17 kDa). Der Ursprung der beiden anderen Bänder noch untersucht werden. Co-Immunpräzipitationsexperimenten mit RBM3 als Köder-Protein ergab, dass NF90-RBM3 Wechselwirkungen sind überwiegend in den Zellkern und einer Minderheit im Zytoplasma. Co-Immunpräzipitation Daten unterstützt die Lokalisierung jedes einzelnen Proteins.
Wie in 2A gezeigt, sind NF90 und RBM3 hauptsächlich im Kern befindet , sondern auch im Zytoplasma in situ. Beide Proteine zeigen perfekte Co-Lokalisation in beiden Fächern. Proximity-Ligation-Assay zeigte das Mustervon NF90-RBM3 Wechselwirkungen, die zu herkömmlichen Immunzytochemie sehr ähnlich ist, wobei die meisten Interaktionen in Nukleus in der Mehrzahl der Zellen. Nur ein kleiner Anteil der Zellen zeigten überwiegend Cytoplasma-Verteilung von NF90-RBM3 Wechselwirkungen.
Zusammen, Co-Immunpräzipitation und Proximity Ligation Assay Techniken reflektieren im Prinzip das gleiche Verteilungsmuster von Protein-Protein-Wechselwirkungen in nuklearen und zytoplasmatischen Kompartimente.
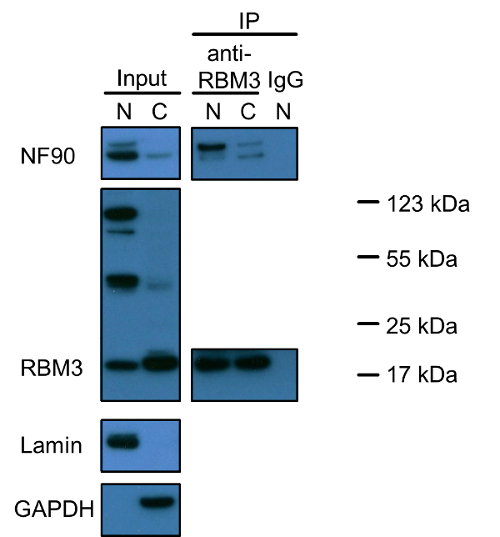
Abbildung 1: Western - Blot - Analyse von NF90 und RBM3 und deren Wechselwirkungen in Kern- und Cytoplasma - Fraktionen von HEK293 - Zellen. 2 (V / V), die gleiche Menge an Zellen widerspiegelt, wie im Extraktionsprotokoll angegeben: Kern- und cytoplasmatische Extrakte wurden einer SDS-PAGE-Gel in einem Verhältnis von 1 geladen. Lamin und GAPDH wurden als Kern verwendetund zytoplasmatische Marker, respectively. Co-Immunpräzipitation mit anti-RBM3 Antikörper oder Kaninchen-IgG als Negativkontrolle durchgeführt. 2 (v / v), jeweils: Kern- und cytoplasmatische Extrakte wurden auch mit anti-RBM3 Antikörper in einem Verhältnis von 1 inkubiert. Oberes Band in NF90-Blot zeigt 110 kDa lange Isoform NF110. N: Kernextrakt; C: Zytoplasmaextrakt, IP: Immunpräzipitation. Protein-Marker wurden für RBM3 positive Banden markiert. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
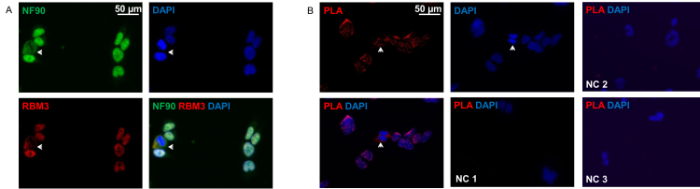
Abbildung 2: Immunzytochemie und Proximity Ligation Assay von HEK293 - Zellen. (A) Doppel-Anfärbung von HEK293 - Zellen mit anti-NF90 (grün) und anti-RBM3 (rot) Antikörper. Pfeil zeigen Zellen mit klaren Zytoplasma-Co-Lokalisation von NF90 und RBM3. Die Kerne wurden mit DAPI (blau) gegengefärbt. (B) Proximity - Ligation - Assay mit anti-NF90 und anti-RBM3 Antikörper in HEK293 - Zellen. Rot fluoreszierende Flecken zeigen NF90-RBM3 Wechselwirkungen. Die Pfeile zeigen NF90-RBM3 Wechselwirkungen im Zytoplasma. Die Kerne wurden mit DAPI (blau) gegengefärbt. Negative Kontrolle 1 (NC 1): beide primäre Antikörper weggelassen wurden. Negative Kontrolle 2 (NC 2): RBM3 einzigen primären Antikörper nur. Negativkontrolle 3 (NC 3): NF90 einzigen primären Antikörper nur. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Es gibt mehrere Vorteile sowie Nachteile für beide Methoden. Als eine relativ neue Technik, ein offensichtlicher Vorteil Proximity Ligation Assay ist die Durchführbarkeit Protein-Protein-Wechselwirkungen auf Einzelzellebene statt einer Charge von heterogenen Zellen aufzuklären. Bilder mit hoher Auflösung und Größe (zB durch konfokale Mikroskop) bieten die Möglichkeit zur Quantifizierung von einzelnen fluoreszierenden Flecken zu zählen. Im Gegensatz dazu kann die herkömmliche Kombination von Co-Immunpräzipitation mit Western-Blot-Technik nur Proteinbanden semi-quantitativ, vor allem, weil eine geeignete Ladesteuerung schwierig ist, für IP-Proben zu bestimmen. Zusätzlich wird , wenn Protein-Protein - Wechselwirkung ist schwach oder transient, eine große Menge von biologischem Material, beispielsweise Zellen oder Gewebe, für die Co-Immunpräzipitation oder einem künstlichen überexprimierenden System mit Fused - Tag angewendet wird benötigt, um die Chance zu erhöhen , die Wechselwirkungen zu detektieren . Alternativ Erkennung techniques mit hoher Empfindlichkeit wie Massenspektrometrie kann das Experiment Qualität zu verbessern. in Bezug auf die Menge an Ausgangsmaterial weist jedoch das Proximity Ligation Assay-Verfahren klare Vorteile. Nur wenige Zellen benötigt werden, vorgesehen, um eine hohe Qualität der Antikörper gegeben. Weiterhin kann in Gewebeproben, in situ Darstellung von Protein-Protein - Wechselwirkungen in verschiedenen Gewebestrukturen und Zelltypen durch Proximity Ligation Assay erreicht werden, in einem ähnlichen Muster wie normale Immunhistochemie. Im Gegensatz dazu Co-Immunpräzipitation ist naturgemäß nicht geeignet, die räumliche Verteilung von Protein-Protein-Wechselwirkungen anzuzeigen.
In Zellen mit großen Kernen, aber kleine cytoplasmatischen Kompartimenten, ist die Nähe Ligatur Testverfahren beschränkt bei der Analyse von Kern zytoplasmatischen Verteilungen und traditionelle Coimmunpräzipitation hat seine eigene Überlegenheit. Beispielsweise in T - Lymphozyten - Zelllinien, beispielsweise Jurkat - Zellen, kern zytoplasmatischen distriträge von NF90-RBM3 Wechselwirkung durch Ligation Assay-Technik Nähe eingeschränkt ist, weil der Kern fast den ganzen Raum im Inneren der Zelle einnimmt, und es ist schwierig, die Grenze der cytoplasmatischen Kompartiment zu identifizieren. Dies kann ein häufiges Problem für Immunzytochemie im Allgemeinen sein, wenn der Kern-Zytoplasma-Verhältnis extrem unausgewogen ist. Jedoch ist Co-Immunpräzipitation in dieser Situation zu dieser Begrenzung unterliegt.
Ein besonderes Anliegen in Bezug auf die Nähe Ligatur-Test ist, ob die Signale von der Nähe Ligatur Test repräsentieren direkte oder indirekte Protein-Protein-Wechselwirkungen. Sowohl NF90 und RBM3 haben RNA-Bindungseigenschaften und ihre Wechselwirkung hängt von RNA, wie in unserer früheren Studie 7 berichtet. Somit Vorbehandlung von Zelllysaten mit RNase löst Wechselwirkung zwischen NF90 und RBM3 und nichts nachweisbar ist durch Coimmunpräzipitation Methode 7. Jedoch ist die Proximity Ligation Assay Signal nicht beeinflusstselbst wenn eine RNA-abhängige Protein-Protein-Wechselwirkung verliert der RNA-Spezies, wie sie erzeugt wird, wenn der Abstand zwischen zwei Proteinen weniger als 40 nm, die üblicherweise als eine direkte Interaktion betrachtet wird. Diese Eigenschaft des Proximity Ligation Assay kann technische Probleme von Co-Immunpräzipitation, wie RNase Freisetzung in Zelllysat zu überwinden, die die Wechselwirkungen erfordern RNA Vermittlungs abschaffen kann. Jedoch auf der anderen Seite kann die Proximity Ligation Assay-Verfahren auch falsche positive Signale zu erzeugen, wenn die RNA-abhängige Protein-Protein-Wechselwirkung nicht tatsächlich aufgrund des Fehlens spezifischer RNA in physiologischen Bedingungen existieren.
Ein weiteres Thema besondere Aufmerksamkeit verdient ist die Spezifität der primären Antikörper und die Möglichkeit der Proteinisoformen, Vorprodukte und Proteinaggregate. Wir beobachteten , durch Western - Blot , dass die lange NF90 Isoform, NF110, ist viel weniger reichlich in beiden Zellkern und Zytoplasma in HEK293 - Zellen im Vergleich zu NF90 (FiAbbildung 1). Jedoch Co-Immunpräzipitation entwirrt eine höhere Bindungsaffinität zu NF110 RBM3 besonders in Kern. Drei Hauptbanden wurden in RBM3 Blots in Nucleus entdeckt, sondern nur die 20 kDa-Bande wurde normales RBM3 hauptsächlich in Zytoplasma beobachtet. Ob die beiden anderen 50 kDa und 100 kDa-Banden RBM3 Isoformen reflektieren, Vorläufer, Proteinaggregate mit gebundenen RBM3 oder waren aufgrund unspezifischer Hintergrund bleiben aufgeklärt werden. Stattdessen, da Assay der Annäherungs Ligierung auf Immunofärbung basiert, können die Proximity Ligation Assay unterscheidet nicht den Unterschied zwischen verschiedenen Protein-Isoformen, Vorläufern, Aggregate oder unspezifische Färbung, während Co-Immunpräzipitation weitere Informationen über die Antikörperspezifität oder Protein-Isoformen und Vorläufern als das zur Verfügung stellen kann Proximity Ligation Assay von Protein-Protein-Wechselwirkungen in zu untersuchen. RBM3 Bezug, wenn alle drei RBM3 Bands in Nukleus beobachtet Berücksichtigung der Western-Blot-Ergebnis steht im Einklang mit überwiegendem Kerne localizatiauf der RBM3 durch Immunfärbung beobachtet.
Abschließend beide Coimmunpräzipitation und Proximity-Ligation-Assay-Techniken haben wesentliche Vorteile und Einschränkungen. In vielen Fällen produzieren sie konsistente Ergebnisse, aber es ist vorteilhaft, beide Techniken zu verwenden, wenn systematisch bestimmte Protein-Protein-Wechselwirkung zu untersuchen. Doch in besonderen Fällen oder mit bestimmten Zweck könnte man Überlegenheit als die anderen zeigen. Vor kurzem Proximity Ligation Assay wurde zum Screenen von Protein-Protein - Wechselwirkungen verwendet worden 12 neuartige prognostische Marker zu entwickeln. Protein-Protein-Wechselwirkung wird als zuverlässiger Biomarker als ein einziges Protein angesehen. In Zukunft können die Proximity Ligation Assay werden potentiell eine schnelle und zuverlässige Möglichkeit, Protein-Protein-Wechselwirkungen als diagnostische und prognostische Biomarker in Kliniken zu analysieren, wobei die Identifizierung und Charakterisierung dieser Biomarker noch die üblichen Co-immuoprecipication me erfordertthode.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This study was supported by the Swiss National Science Foundation (SNSF, 31003A_163305).
Materialien
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle’s Medium (DMEM) | Sigma | D6429 | High glucose 4,500 mg/L |
| Fetal bovine serum (FBS) | Gibco, Thermo Fisher Scientific | 10270106 | |
| Penicillin-Streptomycin (PenStrep) | BioConcept | 4-01F00-H | |
| NE-PER Nuclear and Cytoplasmic Extraction Reagents | Thermo Fisher Scientific | 78833 | |
| 1,4-Dithiothreitol (DTT) | Carl Roth | 6908.3 | |
| Dynabeads Protein G | Novex, Thermo Fisher Scientific | 10003D | |
| DRBP76 (NF90/NF110) antibody | BD Transduction Laboratories | 612154 | use 1:1,000 for WB and 1:100 for ICC/PLA |
| RBM3 antibody | ProteinTech | 14363-1-AP | use 1:1,000 for WB and 1:100 for ICC/PLA |
| Lamin A/C antibody | Cell Signaling Technology | #2032 | use 1:1,000 for WB |
| anti-GAPDH antibody | Abcam | ab8245 | use 1:1,000 for WB |
| normal rabbit IgG | Santa Cruz | sc-2027 | |
| anti-rabbit IgG, HRP-linked secondary antibody | Cell Signaling Technology | #7074 | use 1:5,000 for WB |
| anti-mouse HRP secondary antibody | Carl Roth | 4759.1 | use 1:5,000 for WB |
| Clarity Western ECL Blotting Substrate | Bio-Rad | #1705060 | |
| NuPAGE Novex 4-12% Bis-Tris Gel | Novex, Thermo Fisher Scientific | NP0321BOX | |
| NuPAGE LDS Sample Buffer (4x) | Novex, Thermo Fisher Scientific | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Novex, Thermo Fisher Scientific | NP0002 | |
| NuPAGE Transfer Buffer (20x) | Novex, Thermo Fisher Scientific | NP00061 | |
| Amersham Hypond P 0.2 PVDF membrane | GE Healthcare Life Sciences | 10600021 | |
| Poly-D-Lysine 8 Well Culture Slide | Corning BioCoat | 354632 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Normal goat serum (NGS) | Gibco, Thermo Fisher Scientific | PCN5000 | |
| Goat anti-mouse IgG (H+L Antibody), Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11001 | |
| Goat anti-rabbit IgG (H+L Antibody), Alexa Fluor 568 conjugate | Thermo Fisher Scientific | A-11011 | |
| 4′, 6-Diamidin-2-phenylindol (DAPI) | Sigma | D9542 | |
| Duolink PLA probe Anti-mouse PLUS | Sigma | DUO92001 | |
| Duolink PLA probe Anti-rabbit MINUS | Sigma | DUO92005 | |
| Duolink Detection Reagents Red | Sigma | DUO92008 | |
| Duolink Wash Buffers Fluorescence | Sigma | DUO82049 | |
| Duolink Mounting Medium with DAPI | Sigma | DUO82040 | |
| Mowiol 4-88 | Sigma | 81381 | |
| Microscope | Olympus | AX-70 | |
| CCD camera | SPOT | Insight 2MP Firewire | |
| X-ray film | Fujifilm | Super RX | |
| Film processing machine | Fujifilm | FPM-100A |
Referenzen
- Patiño, C., Haenni, A. L., Urcuqui-Inchima, S. NF90 isoforms, a new family of cellular proteins involved in viral replication? Biochimie. 108, 20-24 (2015).
- Shim, J., Lim, H., R Yates, J., Karin, M. Nuclear export of NF90 is required for interleukin-2 mRNA stabilization. Mol Cell. 10 (6), 1331-1344 (2002).
- Sakamoto, S., et al. The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway. Mol Cell Biol. 29 (13), 3754-3769 (2009).
- Dresios, J., et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters microRNA levels, and enhances global protein synthesis. Proc Natl Acad Sci. 102 (6), 1865-1870 (2005).
- Danno, S., Itoh, K., Matsuda, T., Fujita, J. Decreased expression of mouse Rbm3, a cold-shock protein, in Sertoli cells of cryptorchid testis. Am J Pathol. 156 (5), 1685-1692 (2000).
- Wellmann, S., et al. Oxygen-regulated expression of the RNA-binding proteins RBM3 and CIRP by a HIF-1-independent mechanism. J Cell Sci. 117 (Pt 9), 1785-1794 (2004).
- Zhu, X., Zelmer, A., Kapfhammer, J. P., Wellmann, S. Cold-inducible RBM3 inhibits PERK phosphorylation through cooperation with NF90 to protect cells from endoplasmic reticulum stress. FASEB J. 30 (2), 624-634 (2016).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340 (6230), 245-246 (1989).
- Verhelst, J., De Vlieger, D., Saelens, X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp. (98), (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2007).
- Jarvius, M., et al. In situ detection of phosphorylated platelet-derived growth factor receptor beta using a generalized proximity ligation method. Mol Cell Proteomics. 6 (9), 1500-1509 (2007).
- Liu, C. H., et al. Analysis of protein-protein interactions in cross-talk pathways reveals CRKL protein as a novel prognostic marker in hepatocellular carcinoma. Mol Cell Proteomics. 12 (5), 1335-1349 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten