Method Article
共免疫沈降により核および細胞質画分中のタンパク質間相互作用の可視化と
要約
Protein-protein interactions can occur in both the nucleus and the cytoplasm of a cell. To investigate these interactions, traditional co-immunoprecipitation and modern proximity ligation assay are applied. In this study, we compare these two methods to visualize the distribution of NF90-RBM3 interactions in the nucleus and the cytoplasm.
要約
Protein-protein interactions are involved in thousands of cellular processes and occur in distinct spatial context. Traditionally, co-immunoprecipitation is a popular technique to detect protein-protein interactions. Subsequent Western blot analysis is the most common method to visualize co-immunoprecipitated proteins. Recently, the proximity ligation assay has become a powerful tool to visualize protein-protein interactions in situ and provides the possibility to quantify protein-protein interactions by this method. Similar to conventional immunocytochemistry, the proximity ligation assay technique is also based on the accessibility of primary antibodies to the antigens, but in contrast, proximity ligation assay detects protein-protein interactions with a unique technique involving rolling-circle PCR, while conventional immunocytochemistry only shows co-localization of proteins.
Nuclear factor 90 (NF90) and RNA-binding motif protein 3 (RBM3) have been previously demonstrated as interacting partners. They are predominantly localized in the nucleus, but also migrate into the cytoplasm and regulate signaling pathways in the cytoplasmic compartment. Here, we compared NF90-RBM3 interaction in both the nucleus and the cytoplasm by co-immunoprecipitation and proximity ligation assay. In addition, we discussed the advantages and limitations of these two techniques in visualizing protein-protein interactions in respect to spatial distribution and the properties of protein-protein interactions.
概要
核因子90(NF90)は、ウイルス感染に応答して、miRNAの生合成1-3のインターロイキン2転写後規制の規制を含む多数の機能を備えたマルチアイソフォームタンパク質です。 RBM3は、RNA結合タンパク質、翻訳およびmiRNA生合成に関与し、低体温症および低酸素4-6を含む様々なストレスによって誘導することができるです。最近、我々は、タンパク質複合体7にNF90とRBM3を発見しました。 NF90とRBM3の相互作用は、小胞体ストレス応答7にプロテインキナーゼRNA様小胞体キナーゼ(PERK)活性を調節することが不可欠です。 NF90とRBM3の両方がPERK活性を調節するために、例えば 、核内に主に位置するが、NF90とRBM3シャトル少量の細胞質へと特定の機能のためにお互いにそこにバインドされています。したがって、を示すことができる、細胞内区画にNF90-RBM3相互作用の分布を可視化することが重要ですそれぞれの区画での様々な役割。
数十年前、酵母2ハイブリッド(Y2H)は、2つのタンパク質8の間の相互作用を検出するために開発されました。しかし、融合タンパク質の人工的な構造のため、偽陽性の結果は、この方法の適用が制限されています。長い間、免疫共沈降は、特に内因性条件9に、タンパク質-タンパク質相互作用を分析するための主な手法でした。超感度および精度が所望される場合、質量分析法を用いているが、共免疫沈降したタンパク質複合体を分析するために、ウェスタンブロットは、最も便利な技術です。近年では、近接ライゲーションアッセイは、in situ 10,11 の両方の細胞および組織におけるタンパク質-タンパク質相互作用を検出するための新規な方法として開発されました。
ここでは、最も人気の共免疫沈降法とNF9を取り込むには比較的小説近接ライゲーションアッセイ法を比較しました細胞内画分中の0-RBM3相互作用。また、両方の技術の利点と限界を議論しました。
プロトコル
1.共免疫沈降
- 2の1つの6ウェルプレートにウェル当たり2×10 5細胞でHEK293細胞を播種mlのダルベッコ変法イーグル10%ウシ胎児血清(FBS)を有する培地(DMEM)サプリメントおよび100 U / mlのペニシリン-ストレプトマイシン(ペニシリン-ストレプトマイシン) 。
- 5%CO 2、37℃で48時間、細胞を増殖させます。
- 冷リン酸緩衝生理食塩水(PBS)で3回細胞を洗浄します。 4℃で5分間、500×gで遠心分離によって細胞を回収します。
- 商業核および細胞質抽出試薬を用いて、核および細胞質画分を準備します。いくつかの変更を加えて、製造元の指示に従ってください。
- 1共免疫沈降実験(1 6ウェルプレートの3ウェルから約90%の密集度)のために3×10 6個の細胞を使用してください。最高速度で15秒間300μlの冷たい細胞質抽出液(CERのI)と渦を追加します。
- 氷上で30分間インキュベートします。インキュベーションの間、vorte5秒ごとに10分間のx。
- 5秒間16.5μlの冷たい細胞質抽出溶液II(CER II)、渦を加え、氷上で5分間インキュベートします。
- 4℃で5分間、16,000×gで5秒、遠心分離機のための渦。
- 新しいあらかじめ冷却チューブに上清(細胞質抽出物)を移し、使用するまで氷上に保ちます。
- ピペッティングによって、および5回上下するたびに1ミリリットル冷PBSで(核を含む)、不溶性ペレットを3回洗浄します。洗浄後にPBSを削除してください。
- 15秒間150μlの常温核抽出液(NER)、渦を加え、氷上で1時間インキュベートします。インキュベーションの間、15秒、ピペット200μlのチップで10回毎に10分間の渦。
- 4℃で10分間、16,000×gで15秒間ボルテックスし、遠心分離機。
- 使用するまで氷上に維持し、新しいあらかじめ冷却チューブに上清(核抽出物)を転送します。
- 各入力として、核と細胞質抽出物の体積の10%を取ります。
- A1ミリリットルの最終容量に残った抽出物に冷PBSをddを。使用するまで氷上で保管してください。
注:プロテインG結合磁性ビーズを使用する場合に事前クリアが必須ではありません。バックグラウンドが高い場合には、40μlのプロテインG結合磁性ビーズ(50%スラリー)と回転子上で30分間、4℃で、このステップからの溶解物を希釈した1ミリリットルをインキュベートすることにより、事前決済を行います。磁気ラックでビーズから分離した上清(前清澄化ライセート)。ビーズを捨てます。 - プロテインG結合磁性ビーズと結合一次抗体に、200μlのPBSを加えたトゥイーン20緩衝液中に4μgのウサギポリクローナル抗RBM3抗体またはウサギIgG(陰性対照)と40μlのプロテインG結合磁性ビーズ(50%スラリー)をインキュベートローテーター上で40分間、室温(RT)で(PBST、0.02%のTween 20)。
- 磁気ラックを有する抗体結合ビーズと上清を分離し、上清を捨てます。 200μlのPBST(0.02%)で1回ビーズを洗浄します。
- 1を追加します。mlのビーズに溶解物(または必要に応じて、事前にクリアされた溶解物)で希釈し、そして4℃で一晩回転子にインキュベートします。
- 翌日、磁気ラックによってビーズと上清を分離し、上清を捨てます。 20 rpmで一定の速度で回転体に4℃で各チューブのための0.5ミリリットルPBST(0.02%)で3×10分を洗ってください。
- 40μlの試料緩衝液(1×市販サンプル緩衝液および50mMの1,4-ジチオスレイトール(DTT))を添加することによってビーズからタンパク質を溶出させます。 10分間70℃で加熱。新しい1.5 mlチューブにスピンダウンし、転送用液体。
- 70℃で10分間熱:(1×市販サンプルバッファーと50mMのDTTの最終濃度)をサンプルバッファ内の入力溶解物を希釈します。プレキャスト4-12%Bis-Trisゲルへの最後のステップからの負荷入力および免疫沈降タンパク質。各ウェルの積載量は20μLを超えてはなりません。 35分間氷上で1×商業ランニングバッファーで電気泳動を行います。
注:ロード核と細胞質抽出物細胞の同じ初期量を反映2(V / V):1の比率でのS。 - 4℃で2時間、30 Vで1×商業転送バッファにおけるPVDF膜に転写タンパク質。
- 5%のブロック膜は、シェーカー上で40分間室温にてPBST中の乳(0.1%のTween 20)脱脂しました。
- 一晩4℃でPBST(0.1%)において、一次抗体で膜(千の両方が1で希釈)インキュベートします。
- シェーカー上で室温でPBST(0.1%)で3×10分を洗ってください。
- 西洋ワサビペルオキシダーゼ(HRP)で膜をインキュベートする(両方とも1で希釈した:5,000)、抗マウスまたは抗ウサギ二次抗体を抱合PBST(0.1%)中で、室温で1時間。
- シェーカー上で室温でPBST(0.1%)で3×10分を洗ってください。
- cm 2の膜当たり0.2ミリリットル増強化学発光(ECL)基質混合物を使用し、室温で5分間インキュベートします。赤信号を除く以降、このステップからの全ての光を避けてください。
- 液体捨て、フィルムカセットにX線フィルムにさらします。自動膜PRを用いてフィルムを開発ocessingマシン。
2.免疫細胞化学および近接ライゲーションアッセイ
- シード0.4ミリリットルDMEM中の1つの8室のポリ-D-リジンコートスライドで室あたり1.5×10 4細胞でのHEK293細胞を、10%FBSおよび100U / mlのペニシリン-ストレプトマイシンを補充しました。
- 5%CO 2、37℃で48時間、細胞を増殖させます。
- 吸引中、室温で10分間、4%パラホルムアルデヒド(PFA)で細胞を固定します。
- 吸引しPFA、および室あたり0.5mlのPBSで3×10分を洗います。
- 透過処理し、室温で1時間PBS中の0.5%トリトンX-100および5%正常ヤギ血清(NGS)を有するブロック細胞。
- 一晩4℃でシェーカー上でPBS中0.1%トリトンX-100および5%NGS中で一次抗体と共にインキュベートします。二重染色のためにPBS中に100:マウスモノクローナル抗NF90抗体およびウサギポリクローナル抗RBM3抗体1を希釈します。ネガティブコントロールのために、独立して2次抗体のいずれかを省略し、第三の制御の両方の抗体を省略します。
注:商業ブロッキングと希釈試薬を使用しないでください。 - 室あたり0.5mlのPBSで3×10分を洗ってください。
- 免疫細胞化学または近接ライゲーションアッセイプロトコールに従うことを条件
- 免疫細胞化学
- 500希釈された緑色蛍光色素結合抗マウスおよび赤色蛍光色素結合抗ウサギ二次抗体を室温で1時間:1でインキュベートします。以降、このステップからの光を避けてください。
- 室温で10分間PBSで5,000:4 '、6-diamidin-2-phenylindol(DAPI)で対比染色核は1に希釈しました。
- 室あたり0.5mlのPBSで3×10分を洗ってください。
- ガラススライド、乾燥からチャンバを削除します。スライドごとにメディアをマウント、250μでマウントします。
- 近接ライゲーションアッセイ
- 近接ライゲーションアッセイプローブを準備します。混合と番目を連結することができる別のオリゴヌクレオチドと結合した2つの近接ライゲーションアッセイプローブ(抗マウス及び抗ウサギ二次抗体を希釈ラフライゲーション溶液中の2つの他のオリゴヌクレオチドの付加)1両方:0.1%トリトンX-100で5、PBS中5%NGS、1つの8チャンバースライド(1cm 2当たり約40μl)を320μlの総体積を持ちます。 RTで20分間インキュベートします。
- ガラススライドから室を削除し、希釈したプローブを追加します。 1時間37℃で加湿インキュベーター中でインキュベートします。
- ライゲーション溶液を準備します。 8μlのリガーゼを混ぜ、64μlの5×ライゲーション株式と248μlのH 2 O
- スライドから液体をオフにタップし、1×洗浄バッファーA(キットに付属)で2×5分間洗浄します。
- ライゲーション溶液を加え、30分間、37℃で加湿インキュベーター中でインキュベートします。
- 増幅溶液を準備します。以降、このステップからの光を避けて4μlのポリメラーゼ、64μlの5倍の増幅ストックと252μlのH 2 Oを混ぜます。
- スライドから液体をオフにタップし、1×洗浄緩衝液Aで2×2分の洗浄
- アンプを追加lification溶液および100分間、37℃で暗所湿度インキュベーター中でインキュベートします。
- スライドから液体をオフにタップし、1×洗浄緩衝液B(キットに付属)で2×10分を洗います。 0.01x洗浄緩衝液Bで1分間洗浄します
- スライドを乾燥させ、スライドあたり(DAPI付き)商業マウンティング培地250μlのマウント。
- 免疫細胞化学
- 10X接眼レンズおよび20X対物レンズを使用して、顕微鏡下で蛍光シグナルを調べます。 CCDカメラで画像を取得します。
結果
図1は、NF90およびRBM3の両方の核タンパク質であり、ごく一部が細胞質内に存在することを示しています。特に、RBM3のために陽性に染色された三つの異なるバンドがあります。わずか20キロダルトン以下の最小はRBM3の正しいサイズを反映(RBM3の推定分子量は17kDaのです)。他の二つのバンドの起源は調査されていません。ベイトタンパク質としてRBM3との共免疫沈降実験は、NF90-RBM3相互作用は核と細胞質の少数に主に存在していることを明らかにしました。共免疫沈降データは、各単一のタンパク質の局在化をサポートしています。
図2(a)に示すように 、NF90およびRBM3は、主に核内にもその場で細胞質内に位置しています。両タンパク質は、両方の区画で完璧な共局在を示しています。近接ライゲーションアッセイパターンを明らかにしました大部分の細胞で核の中で最も相互作用して、従来の免疫細胞化学に非常に類似しているNF90-RBM3相互作用、の。細胞のわずかな割合は、NF90-RBM3相互作用の大部分は細胞質分布を示しました。
まとめると、共免疫沈降及び近接ライゲーションアッセイ技術は、基本的には核および細胞質区画におけるタンパク質 - タンパク質相互作用の同じ分布パターンを反映します。
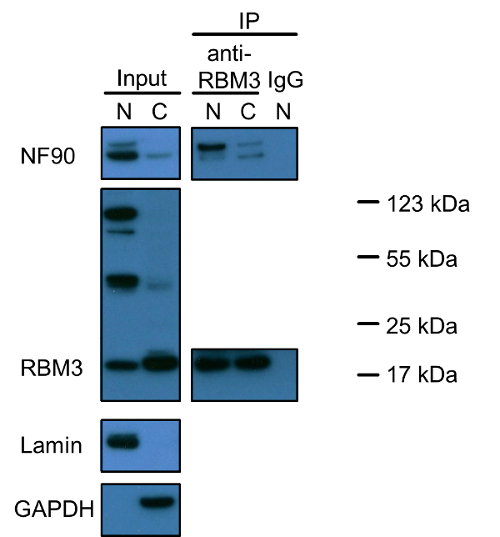
図1:NF90とRBM3およびHEK293細胞の核および細胞質画分中のそれらの相互作用のウェスタンブロット分析。核および細胞質抽出物の比でSDS-PAGEゲルにロードした1:2(V / V)、抽出プロトコールに記載の細胞の同量を反映します。ラミンおよびGAPDHを核としましたそれぞれの細胞質マーカー。共免疫沈降は、陰性対照としての抗RBM3抗体、またはウサギIgGを用いて行きました。核および細胞質抽出物はまた、1の比率で抗RBM3抗体と共にインキュベートした:2(v / v)で、それぞれ。 NF90ブロットでの上方のバンドは、110 kDaの長いアイソフォームNF110を示しています。 N:核抽出物; C:細胞質抽出物、IP:免疫沈降。タンパク質マーカーはRBM3陽性バンドのために標識しました。 この図の拡大版をご覧になるにはこちらをクリックしてください。
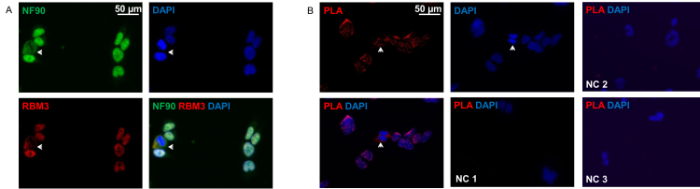
図2:HEK293細胞の免疫細胞化学および近接ライゲーションアッセイ。 (A)抗NF90(緑)および抗RBM3(赤)抗体によるHEK293細胞の二重染色。 NF9の明確な細胞質共局在してshow細胞を矢印0とRBM3。核はDAPI(青)で対比染色しました。 (B)抗NF90及びHEK293細胞における抗RBM3抗体を用いた近接ライゲーションアッセイ。赤色蛍光スポットはNF90-RBM3相互作用を示しています。矢印は細胞質中のNF90-RBM3相互作用を示しています。核はDAPI(青)で対比染色しました。ネガティブコントロール1(NC 1):両方の一次抗体を省略しました。ネガティブコントロール2(NC 2):RBM3単一の一次抗体のみ。陰性コントロール3(NC 3):NF90、単一の一次抗体のみ。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
両方の方法にはいくつかの利点だけでなく、欠点があります。比較的新しい技術として、近接ライゲーションアッセイの明らかな利点は、単一細胞レベルの代わりに、異種の細胞のバッチでのタンパク質 - タンパク質相互作用を解明する可能性があります。高い大きさと(共焦点顕微鏡によって)解像度の画像は、単一の蛍光スポットを計数することによって定量化のための可能性を提供します。対照的に、ウエスタンブロットと免疫共沈降技術の従来の組み合わせは、適切な負荷制御がIPサンプルについて決定することは困難である主な理由は、タンパク質のバンドを半定量することができます。加えて、タンパク質-タンパク質相互作用は、生物学的物質の大量弱いまたは一時的である場合、 例えば 、細胞または組織融合タグとの共免疫沈降又は人工の過剰発現システムは、相互作用を検出するための機会を増強するために適用されるため、必要とされます。代替的に、検出さt例えば、質量分析法のような高感度のechniques実験の質を向上させることができます。しかしながら、近接ライゲーションアッセイ法の出発材料の量に関して明確な利点を有します。ごく少数の細胞が必要とされる、抗体の高品質が与えられている提供。さらに、組織サンプルにおいて、異なる組織構造中のタンパク質-タンパク質相互作用および細胞型のその場での可視化に通常の免疫組織化学と同様のパターンで、近接ライゲーションアッセイすることによって達成することができます。対照的に、免疫共沈降は、タンパク質 - タンパク質相互作用の空間的な分布を表示することが適さない性質によるものです。
大規模な核小細胞質区画を有する細胞では、近接ライゲーションアッセイ法は、核 - 細胞質分布の分析に限定され、従来の共免疫沈降は、独自の優位性を持っています。例えば、Tリンパ球細胞株における、 例えば Jurkat細胞、核-細胞質distri核は細胞の内側のほぼ全空間を占有するので、近接ライゲーションアッセイ法によりNF90-RBM3相互作用のbutionsは、制限され、細胞質の区画の境界を特定することは困難です。核細胞質比が非常にアンバランスである場合、これは、一般的には免疫細胞化学のための共通の問題になる可能性があります。しかし、この状況では、共免疫沈降は、この制限を受けません。
近接ライゲーションアッセイについての特別の関心は、近接連結アッセイからの信号は、直接または間接的タンパク質 - タンパク質相互作用を表しているかどうかです。 NF90とRBM3の両方がRNA結合特性を有し、我々の以前の研究7で報告されているように、それらの相互作用は、RNAに依存しています。したがって、RNアーゼでの細胞溶解物の前処理はNF90とRBM3と何の間の相互作用は、共免疫沈降法7によって検出可能である溶解します。しかし、近接ライゲーションアッセイ信号は影響を受けませんRNA依存性タンパク質 - タンパク質相互作用は、2つのタンパク質間の距離は、通常、直接の相互作用と考えられている40nm未満である場合、それが生成されるように、RNA種を失った場合でも。近接連結アッセイのこの特性は、このようなRNAの仲介を必要とする相互作用を廃止することがあり、細胞溶解液中のRNaseリリースと同時免疫沈降からの技術的問題を克服することができます。 RNA依存性タンパク質 - タンパク質相互作用は、実際に、生理学的条件下で特定のRNAの欠如のために存在しない場合は、一方で、近接ライゲーションアッセイ法はまた、偽陽性シグナルを生成することができます。
特別な注意を値するもう一つの問題は、一次抗体の特異性及びタンパク質アイソフォーム、前駆体およびタンパク質凝集体の可能性です。私たちは、NF90に比べて長いNF90アイソフォーム、NF110は、(Fiがはるかに少ない豊富なHEK293細胞の両方の核と細胞質であることウェスタンブロットによって観察しましたグレ1)。しかし、共免疫沈降は、特に核内でRBM3にNF110のより高い結合親和性を解明しました。三つの主要なバンドが核内でRBM3ブロットで発見されたが、唯一の20 kDaの通常のRBM3バンドは主に細胞質で観察されました。他の二つの50kDaおよび100kDaのバンドがバウンドRBM3とRBM3アイソフォーム、前駆体、タンパク質凝集体を反映してか、非特異的バックグラウンドに起因したかどうかは、まだ解明されていません。近接連結アッセイは免疫染色に基づいているため、共免疫沈降がより抗体特異性又はタンパク質アイソフォームおよび前駆体に関する詳細な情報を提供することができながら、その代わりに、近接ライゲーションアッセイは、異なるタンパク質アイソフォーム、前駆体、凝集体または非特異的染色の違いを区別することはできませんタンパク質 - タンパク質相互作用を調査における近接連結アッセイ。核内に観察されたすべての3つのRBM3バンドを考慮した場合RBM3に関しては、ウエスタンブロット結果が優勢な核と一致しているlocalizatiRBM3の上の免疫染色によって観察しました。
結論として、両方共免疫沈降と近接連結アッセイ技術は、固有の利点と制限があります。多くの場合、これらは、一貫性のある結果を生成するが、体系的に特定のタンパク質 - タンパク質相互作用を調査する際には、両方の技術を使用することが有益です。しかし、特殊なケースで、または特定の目的で、一方が他方よりも優位性を示すことができました。近年、近接ライゲーションアッセイは、新規の予後マーカー12を開発するために、画面のタンパク質-タンパク質相互作用に使用されてきました。タンパク質 - タンパク質相互作用は、単一のタンパク質よりも、より信頼性の高いバイオマーカーであると考えられます。これらのバイオマーカーの同定および特徴付けはまだ私従来の共同immuoprecipicationを必要とするが、将来的に、近接ライゲーションアッセイは、潜在的に、診療所での診断および予後バイオマーカーとしてのタンパク質 - タンパク質相互作用を分析するための迅速かつ信頼性の高い方法になることができますTHOD。
開示事項
The authors have nothing to disclose.
謝辞
This study was supported by the Swiss National Science Foundation (SNSF, 31003A_163305).
資料
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle’s Medium (DMEM) | Sigma | D6429 | High glucose 4,500 mg/L |
| Fetal bovine serum (FBS) | Gibco, Thermo Fisher Scientific | 10270106 | |
| Penicillin-Streptomycin (PenStrep) | BioConcept | 4-01F00-H | |
| NE-PER Nuclear and Cytoplasmic Extraction Reagents | Thermo Fisher Scientific | 78833 | |
| 1,4-Dithiothreitol (DTT) | Carl Roth | 6908.3 | |
| Dynabeads Protein G | Novex, Thermo Fisher Scientific | 10003D | |
| DRBP76 (NF90/NF110) antibody | BD Transduction Laboratories | 612154 | use 1:1,000 for WB and 1:100 for ICC/PLA |
| RBM3 antibody | ProteinTech | 14363-1-AP | use 1:1,000 for WB and 1:100 for ICC/PLA |
| Lamin A/C antibody | Cell Signaling Technology | #2032 | use 1:1,000 for WB |
| anti-GAPDH antibody | Abcam | ab8245 | use 1:1,000 for WB |
| normal rabbit IgG | Santa Cruz | sc-2027 | |
| anti-rabbit IgG, HRP-linked secondary antibody | Cell Signaling Technology | #7074 | use 1:5,000 for WB |
| anti-mouse HRP secondary antibody | Carl Roth | 4759.1 | use 1:5,000 for WB |
| Clarity Western ECL Blotting Substrate | Bio-Rad | #1705060 | |
| NuPAGE Novex 4-12% Bis-Tris Gel | Novex, Thermo Fisher Scientific | NP0321BOX | |
| NuPAGE LDS Sample Buffer (4x) | Novex, Thermo Fisher Scientific | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Novex, Thermo Fisher Scientific | NP0002 | |
| NuPAGE Transfer Buffer (20x) | Novex, Thermo Fisher Scientific | NP00061 | |
| Amersham Hypond P 0.2 PVDF membrane | GE Healthcare Life Sciences | 10600021 | |
| Poly-D-Lysine 8 Well Culture Slide | Corning BioCoat | 354632 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Normal goat serum (NGS) | Gibco, Thermo Fisher Scientific | PCN5000 | |
| Goat anti-mouse IgG (H+L Antibody), Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11001 | |
| Goat anti-rabbit IgG (H+L Antibody), Alexa Fluor 568 conjugate | Thermo Fisher Scientific | A-11011 | |
| 4′, 6-Diamidin-2-phenylindol (DAPI) | Sigma | D9542 | |
| Duolink PLA probe Anti-mouse PLUS | Sigma | DUO92001 | |
| Duolink PLA probe Anti-rabbit MINUS | Sigma | DUO92005 | |
| Duolink Detection Reagents Red | Sigma | DUO92008 | |
| Duolink Wash Buffers Fluorescence | Sigma | DUO82049 | |
| Duolink Mounting Medium with DAPI | Sigma | DUO82040 | |
| Mowiol 4-88 | Sigma | 81381 | |
| Microscope | Olympus | AX-70 | |
| CCD camera | SPOT | Insight 2MP Firewire | |
| X-ray film | Fujifilm | Super RX | |
| Film processing machine | Fujifilm | FPM-100A |
参考文献
- Patiño, C., Haenni, A. L., Urcuqui-Inchima, S. NF90 isoforms, a new family of cellular proteins involved in viral replication? Biochimie. 108, 20-24 (2015).
- Shim, J., Lim, H., R Yates, J., Karin, M. Nuclear export of NF90 is required for interleukin-2 mRNA stabilization. Mol Cell. 10 (6), 1331-1344 (2002).
- Sakamoto, S., et al. The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway. Mol Cell Biol. 29 (13), 3754-3769 (2009).
- Dresios, J., et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters microRNA levels, and enhances global protein synthesis. Proc Natl Acad Sci. 102 (6), 1865-1870 (2005).
- Danno, S., Itoh, K., Matsuda, T., Fujita, J. Decreased expression of mouse Rbm3, a cold-shock protein, in Sertoli cells of cryptorchid testis. Am J Pathol. 156 (5), 1685-1692 (2000).
- Wellmann, S., et al. Oxygen-regulated expression of the RNA-binding proteins RBM3 and CIRP by a HIF-1-independent mechanism. J Cell Sci. 117 (Pt 9), 1785-1794 (2004).
- Zhu, X., Zelmer, A., Kapfhammer, J. P., Wellmann, S. Cold-inducible RBM3 inhibits PERK phosphorylation through cooperation with NF90 to protect cells from endoplasmic reticulum stress. FASEB J. 30 (2), 624-634 (2016).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340 (6230), 245-246 (1989).
- Verhelst, J., De Vlieger, D., Saelens, X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp. (98), (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2007).
- Jarvius, M., et al. In situ detection of phosphorylated platelet-derived growth factor receptor beta using a generalized proximity ligation method. Mol Cell Proteomics. 6 (9), 1500-1509 (2007).
- Liu, C. H., et al. Analysis of protein-protein interactions in cross-talk pathways reveals CRKL protein as a novel prognostic marker in hepatocellular carcinoma. Mol Cell Proteomics. 12 (5), 1335-1349 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved