Method Article
تصور التفاعل البروتين البروتين في هيولي النووية والكسور بواسطة شركة مناعي و
In This Article
Summary
Protein-protein interactions can occur in both the nucleus and the cytoplasm of a cell. To investigate these interactions, traditional co-immunoprecipitation and modern proximity ligation assay are applied. In this study, we compare these two methods to visualize the distribution of NF90-RBM3 interactions in the nucleus and the cytoplasm.
Abstract
Protein-protein interactions are involved in thousands of cellular processes and occur in distinct spatial context. Traditionally, co-immunoprecipitation is a popular technique to detect protein-protein interactions. Subsequent Western blot analysis is the most common method to visualize co-immunoprecipitated proteins. Recently, the proximity ligation assay has become a powerful tool to visualize protein-protein interactions in situ and provides the possibility to quantify protein-protein interactions by this method. Similar to conventional immunocytochemistry, the proximity ligation assay technique is also based on the accessibility of primary antibodies to the antigens, but in contrast, proximity ligation assay detects protein-protein interactions with a unique technique involving rolling-circle PCR, while conventional immunocytochemistry only shows co-localization of proteins.
Nuclear factor 90 (NF90) and RNA-binding motif protein 3 (RBM3) have been previously demonstrated as interacting partners. They are predominantly localized in the nucleus, but also migrate into the cytoplasm and regulate signaling pathways in the cytoplasmic compartment. Here, we compared NF90-RBM3 interaction in both the nucleus and the cytoplasm by co-immunoprecipitation and proximity ligation assay. In addition, we discussed the advantages and limitations of these two techniques in visualizing protein-protein interactions in respect to spatial distribution and the properties of protein-protein interactions.
Introduction
العامل النووي 90 (NF90) هو بروتين متعددة ISOFORM مع وظائف عديدة بما في ذلك الاستجابة للعدوى الفيروسية، وتنظيم انترلوكين 2 بعد النسخ وتنظيم ميرنا نشوء حيوي 1-3. RBM3 هو بروتين ملزمة RNA، والمشاركة في الترجمة وميرنا نشوء حيوي ويمكن الناجمة عن الضغوطات المختلفة بما في ذلك انخفاض حرارة الجسم ونقص الأكسجة 4-6. مؤخرا، وجدنا NF90 وRBM3 في مجمع بروتين 7. تفاعل NF90 وRBM3 ضروري لتعديل بروتين كيناز مثل RNA اندوبلازمية شبكية كيناز (بيرك) النشاط في استجابة البروتين تكشفت 7. وتقع كل من NF90 وRBM3 في الغالب في النواة ولكن نسبة صغيرة من NF90 ومكوك RBM3 إلى السيتوبلازم وربط هناك لبعضها البعض من أجل وظائف محددة، على سبيل المثال لتنظيم النشاط ورفع معنوياته. وبالتالي، فمن المهم أن تصور توزيع التفاعلات NF90-RBM3 في مقصورة التحت خلوية، والتي قد تشير إلىأدوارهم المختلفة في مقصورة منها.
منذ عقود، وقد وضعت الخميرة اثنين الهجين (Y2H) للكشف عن التفاعل بين اثنين من البروتينات 8. ومع ذلك، بسبب البناء الاصطناعي للبروتينات تنصهر، قيدت نتائج إيجابية كاذبة تطبيق هذا الأسلوب. لفترة طويلة، وكان شارك في مناعي التقنية الرئيسية لتحليل تفاعلات البروتين البروتين، خصوصا في ظروف endogeneous 9. لتحليل بروتين معقد immunoprecipitated المشترك، لطخة الغربية هي الأسلوب الأكثر ملاءمة، في حين يتم استخدام مطياف الكتلة عندما يتم المطلوب حساسية فائقة ودقة. في السنوات الأخيرة، وقد وضعت قرب ربط الفحص باعتبارها طريقة جديدة للكشف عن البروتين البروتين التفاعلات في كل من الخلايا والأنسجة في الموقع 10،11.
هنا، قارنا طريقة شارك في مناعي الأكثر شعبية ورواية نسبيا قرب ربط طريقة الفحص في التقاط NF9التفاعل 0-RBM3 في الكسور التحت خلوية. ناقشنا أيضا مزايا والقيود المفروضة على كل من التقنيات.
Protocol
1. شركة مناعي
- البذور HEK293 الخلايا في 2 × 10 5 خلايا لكل بئر في واحدة لوحة 6 جيدا في 2 مل معدلة المتوسطة (DMEM) ملحق النسر Dulbecco ومع 10٪ مصل بقري جنيني (FBS) و 100 U / مل البنسلين، الستربتوميسين (القلم بكتيريا) .
- تنمو الخلايا لمدة 48 ساعة على 37 درجة مئوية مع 5٪ CO 2.
- غسل الخلايا مع الباردة الفوسفات مخزنة المالحة (PBS) ثلاث مرات. حصاد الخلايا بواسطة الطرد المركزي في 500 x ج لمدة 5 دقائق في 4 درجات مئوية.
- إعداد كسور النووية وهيولي باستخدام الكواشف استخراج النووية وهيولي التجارية. اتبع تعليمات الشركة الصانعة مع بعض التعديلات.
- استخدام 3 × 10 6 خلايا لتجربة واحدة شارك في مناعي (ما يقرب من 90٪ confluency من 3 آبار واحدة لوحة 6 جيدا). إضافة 300 حل الباردة ميكرولتر حشوية استخراج (CER الأول) ودوامة لمدة 15 ثانية على أعلى سرعة.
- احتضان لمدة 30 دقيقة على الجليد. أثناء الحضانة، vorteس لمدة 5 ق كل 10 دقيقة.
- إضافة 16.5 الباردة ميكرولتر استخراج حشوية الحل الثاني (CER الثاني)، دوامة لمدة 5 ثوان، واحتضان لمدة 5 دقائق على الجليد.
- دوامة لمدة 5 ثوان وأجهزة الطرد المركزي في 16000 x ج لمدة 5 دقائق في 4 درجات مئوية.
- نقل طاف (استخراج حشوية) في أنبوب جديد قبل المبردة، والحفاظ على الجليد حتى استخدامها.
- غسل الكريات غير قابلة للذوبان (التي تحتوي على نوى) ثلاث مرات مع برنامج تلفزيوني 1 مل البارد في كل مرة من قبل pipetting صعودا وهبوطا خمس مرات. إزالة برنامج تلفزيوني بعد غسل.
- إضافة 150 ميكرولتر الباردة حل استخراج النووي (معدل الالتحاق الصافي)، دوامة لمدة 15 ثانية، واحتضان 1 ساعة على الجليد. أثناء الحضانة، ودوامة لمدة 15 ثانية وماصة 10 مرات مع تلميح 200 ميكرولتر كل 10 دقيقة.
- دوامة لمدة 15 ثانية وأجهزة الطرد المركزي في 16000 x ج لمدة 10 دقيقة على 4 درجات مئوية.
- نقل طاف (استخراج النووي) في أنبوب جديد قبل المبردة، والحفاظ على الجليد حتى الاستخدام.
- إخراج 10٪ من حجم مقتطفات النووية وهيولي كل كمدخلات.
- ادد برنامج تلفزيوني الباردة إلى مقتطفات المتبقية إلى الحجم النهائي من 1 مل. الحفاظ على الجليد حتى الاستخدام.
ملاحظة: قبل إزالة ليست ضرورية عند استخدام البروتين حبات مغناطيسية-G مترافق. ومع ذلك، إذا كانت الخلفية عالية، نفذ ما قبل المقاصة التي يحتضنها 40 البروتين ميكرولتر الخرز G-مترافق المغناطيسي (50٪ الطين) و 1 مل مخففة المحللة من هذه الخطوة في 4 درجة مئوية لمدة 30 دقيقة على محور دوار. طاف منفصل (مسح قبل المحللة) من الخرز مع حامل المغناطيسي. تجاهل الخرز. - إلى الأجسام المضادة الأولية زوجين مع حبات مغناطيسية البروتين G-مترافق، واحتضان 40 ميكرولتر البروتين حبات مغناطيسية G-مترافق (50٪ الطين) مع الأجسام المضادة 4 ميكروغرام الأرنب بولكلونل مكافحة RBM3 أو مفتش أرنب (المراقبة السلبية) في 200 ميكرولتر PBS بالإضافة توين 20 عازلة (PBST، توين 20 0.02٪) في درجة حرارة الغرفة (RT) لمدة 40 دقيقة على محور دوار.
- منفصل الخرز وطاف الأجسام المضادة يقترن مع رف المغناطيسي، وتجاهل طاف. تغسل حبات مرة واحدة مع 200 PBST ميكرولتر (0.02٪).
- إضافة 1المخفف مل لست] (أو إذا لزم الأمر، لست] مسح مسبقا) إلى الخرز، واحتضان على محور دوار عند 4 درجات مئوية خلال الليل.
- في اليوم التالي، فصل الخرز وطاف بواسطة رف المغناطيسي، وتجاهل طاف. غسل 3 × 10 دقيقة مع 0.5 مل PBST (0.02٪) لكل أنبوب في 4 درجات مئوية على محور دوار مع سرعة ثابتة من 20 دورة في الدقيقة.
- أزل البروتينات من الخرز بإضافة عازلة عينة 40 ميكرولتر (عينة العازلة التجاري 1X و 50 ملم 1،4-dithiothreitol (DTT)). الحرارة على 70 درجة مئوية لمدة 10 دقيقة. تدور باستمرار والسوائل نقل إلى أنبوب 1.5 مل جديد.
- تمييع لست] مساهمة في عينة العازلة (تركيز النهائي: عينة العازلة التجاري 1X و 50 ملي DTT) والحرارة على 70 درجة مئوية لمدة 10 دقيقة. المدخلات تحميل والبروتينات immunoprecipitated من الخطوة الأخيرة لالجاهزة 4-12٪ مكرر تريس هلام. يجب أن لا يتجاوز حجم التحميل من كل بئر 20 ميكرولتر. أداء الكهربائي في المخزن تشغيل التجاري 1X على الجليد لمدة 35 دقيقة.
ملاحظة: تحميل النووية واستخراج حشويةالصورة في نسبة 1: 2 (V / V)، وهو ما يعكس نفس المبلغ الأولي من الخلايا. - نقل البروتينات إلى غشاء PVDF في المخزن نقل التجاري 1X في 30 V لمدة 2 ساعة في 4 درجات مئوية.
- غشاء كتلة مع 5٪ الحليب الخالي من الدسم في PBST (0.1٪ توين 20) في RT لمدة 40 دقيقة على شاكر.
- احتضان الغشاء مع الأجسام المضادة الأولية (سواء المخفف في 1: 1000) في PBST (0.1٪) في 4 درجات مئوية خلال الليل.
- غسل 3 × 10 دقيقة مع PBST (0.1٪) في RT على شاكر.
- احتضان الغشاء مع الفجل البيروكسيداز (HRP) -conjugated الأجسام المضادة الثانوية المضادة للماوس أو المضادة للأرنب (سواء المخفف في 1: 5000) في PBST (0.1٪) في RT لمدة 1 ساعة.
- غسل 3 × 10 دقيقة مع PBST (0.1٪) في RT على شاكر.
- استخدام 0.2 مل تعزيز التوهج (ECL) الركيزة خليط لكل سم 2 غشاء، في احتضان RT لمدة 5 دقائق. تجنب كل ضوء من هذه الخطوة فصاعدا إلا أضواء حمراء.
- تجاهل السائل وفضح إلى فيلم الأشعة السينية في شريط الفيلم. تطوير الفيلم باستخدام العلاقات العامة الفيلم التلقائيآلة ocessing.
2. سيتولوجية مناعية والقرب من ربط الفحص
- البذور HEK293 الخلايا في 1.5 × 10 4 خلايا في غرفة واحدة 8-غرفة بولي-D-يسين الشرائح المغلفة في 0.4 مل DMEM تستكمل مع FBS 10٪ و 100 U / مل القلم بكتيريا.
- تنمو الخلايا لمدة 48 ساعة على 37 درجة مئوية مع 5٪ CO 2.
- نضح المتوسطة وإصلاح الخلايا مع بارافورمالدهيد 4٪ (PFA) لمدة 10 دقيقة في RT.
- نضح PFA، وغسل 3 × 10 دقيقة مع 0.5 مل برنامج تلفزيوني في الغرفة.
- Permeabilize والخلايا كتلة مع 0.5٪ تريتون X-100 و 5٪ الماعز العادي المصل (خ ع) في برنامج تلفزيوني على RT لمدة 1 ساعة.
- احتضان مع الأجسام المضادة الأولية في 0.1٪ تريتون X-100 و 5٪ خ ع في برنامج تلفزيوني على شاكر في 4 درجات مئوية خلال الليل. تمييع الماوس وحيدة النسيلة المضادة للNF90 الأجسام المضادة وبولكلونل الأرنب مكافحة RBM3 الضد 1: 100 في برنامج تلفزيوني لالمزدوج تلطيخ. من أجل السيطرة السلبية، حذف بشكل مستقل إما من الأجسام المضادة الأولية اثنين، وحذف كل من الأجسام المضادة في عنصر تحكم الثالثة.
ملاحظة: لا تستخدم حجب التجاري والكواشف تمييع. - غسل 3 × 10 دقيقة مع 0.5 مل برنامج تلفزيوني في الغرفة.
- مع مراعاة مناعية أو القرب بروتوكولات ربط الفحص
- مناعية
- احتضان مع 1: 500 المخفف الأخضر الفلورسنت جانب صبغ مكافحة فأر والأجسام المضادة بالإضافة صبغة الفلورسنت الحمراء المضادة للأرنب الثانوية في RT لمدة 1 ساعة. تجنب ضوء من هذه الخطوة فصاعدا.
- نوى مباين مع 4 "، 6 diamidin-2-phenylindol (دابي) المخفف 1: 5000 في برنامج تلفزيوني على RT لمدة 10 دقيقة.
- غسل 3 × 10 دقيقة مع 0.5 مل برنامج تلفزيوني في الغرفة.
- إزالة غرف من شريحة زجاجية وجافة. جبل مع 250 μ والمتوسطة لكل شريحة متزايدة.
- القرب فحص الربط
- إعداد القرب تحقيقات ربط الفحص. خلط وتمييع اثنين قرب تحقيقات ربط فحص (المضادة للماوس والمضادة للأرنب الأجسام المضادة الثانوية المرفقة مع أليغنوكليوتيد المختلفة التي يمكن أن ligate عشرالخام إضافة اثنين من أليغنوكليوتيد أخرى في حل الربط) على حد سواء 1: 5 في 0.1٪ تريتون X-100 و 5٪ خ ع في برنامج تلفزيوني، بإجمالي 320 ميكرولتر لشريحة واحدة 8-غرفة (حوالي 40 ميكرولتر لكل سم 2) . في احتضان RT لمدة 20 دقيقة.
- إزالة غرف من شريحة زجاجية وإضافة تحقيقات المخفف. احتضان في حاضنة الرطوبة عند 37 درجة مئوية لمدة 1 ساعة.
- يعد حل الربط. مزيج 8 ميكرولتر يغاز، 64 ميكرولتر 5 × الأسهم ربط و 248 ميكرولتر H 2 O.
- الاستفادة من السائل من الشرائح، وغسل 2 × 5 دقائق في 1X الاحتياطي اغسل ألف (المقدمة مع عدة).
- إضافة الحل ربط واحتضان في حاضنة الرطوبة عند 37 درجة مئوية لمدة 30 دقيقة.
- يعد حل التضخيم. خلط 4 ميكرولتر البلمرة، 64 ميكرولتر الأسهم التضخيم 5X و 252 ميكرولتر H 2 O. تجنب ضوء من هذه الخطوة فصاعدا.
- الاستفادة من السائل من الشرائح، وغسل 2 × 2 دقيقة في 1X الاحتياطي اغسل A.
- إضافة أمبيرحل lification واحتضان في حاضنة الرطوبة السوداء عند 37 درجة مئوية لمدة 100 دقيقة.
- الاستفادة من السائل من الشرائح، وغسل 2 × 10 دقيقة في 1X الاحتياطي اغسل ب (المقدمة مع عدة). يغسل لمدة 1 دقيقة في 0.01x الاحتياطي اغسل B.
- تجف الشريحة وجبل مع 250 ميكرولتر من المتوسطة المتزايدة التجاري (مع دابي) لكل شريحة.
- مناعية
- دراسة الإشارات الفلورية تحت المجهر باستخدام عدسة العدسة 10X 20X والعدسة الشيئية. الحصول على صور بواسطة كاميرا CCD.
النتائج
يوضح الشكل (1) التي NF90 وRBM3 كلاهما البروتينات النووية وفقط جزء صغير موجود في السيتوبلازم. والجدير بالذكر أن هناك ثلاثة نطاقات مختلفة ملطخة إيجابية لRBM3. أصغر أقل بقليل من 20 كيلو دالتون يعكس حجم الصحيح من RBM3 (وتنبأ الوزن الجزيئي للRBM3 هو 17 كيلو دالتون). يبقى أصل اثنين من فرق أخرى للتحقيق معهم. وكشفت التجارب المشتركة مناعي مع RBM3 كما البروتين الطعم أن التفاعلات NF90-RBM3 موجودة في الغالب في نواة وأقلية في السيتوبلازم. يدعم بيانات المشترك مناعي توطين كل بروتين واحد.
كما هو مبين في الشكل 2A، NF90 وRBM3 تقع أساسا في النواة ولكن أيضا في السيتوبلازم في الموقع. وتشير كل من البروتينات الكمال شارك في التعريب في كل من المقصورات. كشفت القرب ربط فحص نمطالتفاعلات NF90-RBM3، والتي هي مشابهة جدا لمناعية التقليدية، مع معظم التفاعلات في النواة في معظم الخلايا. فقط أظهرت نسبة صغيرة من الخلايا التوزيع في الغالب حشوية من التفاعلات NF90-RBM3.
معا، وشارك في مناعي وربط القرب تقنيات فحص تعكس أساسا نمط التوزيع نفسه من تفاعلات البروتين البروتين في المقصورات النووية وهيولية.
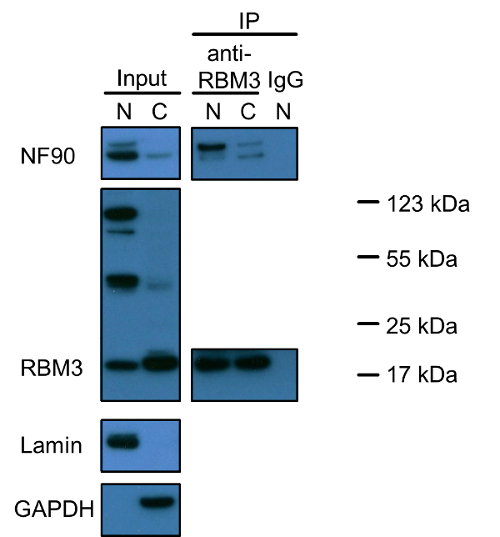
الشكل 1: ويسترن تحليل وصمة عار من NF90 وRBM3 وتفاعلاتها في الكسور النووية وهيولي من خلايا HEK293. تم تحميل مقتطفات النووية وحشوية إلى هلام SDS-PAGE في نسبة 1: 2 (V / V)، مما يعكس نفس الكمية من الخلايا كما جاء في بروتوكول الاستخراج. استخدمت امين وGAPDH كما النوويةوعلامات هيولية، على التوالي. وقد أجريت شارك في مناعي مع الأجسام المضادة لمكافحة RBM3، أو مفتش أرنب كما المراقبة السلبية. وحضنت مقتطفات النووية وهيولي أيضا مع الأجسام المضادة لمكافحة RBM3 في نسبة 1: 2 (ت / ت)، على التوالي. الشريط العلوي في لطخة NF90 تشير 110 كيلو دالتون الإسوي طويلة NF110. N: استخراج النووي؛ C: استخراج حشوية، IP: مناعي. وصفت علامات البروتين لفرق الإيجابية RBM3. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
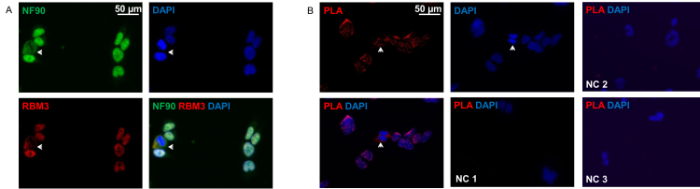
الشكل 2: سيتولوجية مناعية والقرب من ربط الفحص من HEK293 الخلايا. (A) انقر نقرا مزدوجا تلطيخ الخلايا HEK293 مع anti-NF90 (الخضراء) ومكافحة RBM3 (الحمراء) الأجسام المضادة. السهم خلايا عرض واضح مع حشوية شارك في توطين NF90 وRBM3. تم counterstained نوى مع دابي (الأزرق). (ب) فحص القرب ربط مع anti-NF90 وأضداد RBM3 في الخلايا HEK293. وتشير البقع الحمراء الفلورسنت التفاعلات NF90-RBM3. الأسهم تظهر التفاعلات NF90-RBM3 في السيتوبلازم. تم counterstained نوى مع دابي (الأزرق). حذفت كل من الأجسام المضادة الأولية: السيطرة السلبية 1 (NC 1). السيطرة السلبية 2 (NC 2): RBM3 احد الأجسام المضادة الأولية فقط. السيطرة السلبية 3 (NC 3): NF90 الأجسام المضادة الأولية واحد فقط. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هناك العديد من الفوائد، وكذلك أوجه القصور لكلتا الطريقتين. كما تقنية جديدة نسبيا، وهي ميزة واضحة لفحص القرب ربط هي جدوى لتوضيح البروتين البروتين التفاعلات على مستوى خلية واحدة بدلا من مجموعة من الخلايا غير المتجانسة. الصور مع فائق الضخامة والقرار (مثلا عن طريق المجهر متحد البؤر) توفر إمكانية القياس الكمي عن طريق عد البقع الفلورسنت واحدة. في المقابل، فإن الجمع التقليدي للتقنية شارك في مناعي مع لطخة غربية لا يمكن إلا أن شبه الكمي العصابات البروتين، وذلك بسبب تحكم التحميل المناسبة ومن الصعب تحديد لعينات IP. وبالإضافة إلى ذلك، عندما تفاعل البروتين البروتين ضعيف أو عابرة، وكمية كبيرة من المواد البيولوجية، على سبيل المثال، الخلايا أو الأنسجة، مطلوب للمشاركة في مناعي أو نظام overexpressing الاصطناعي مع العلامة تنصهر يتم تطبيقها على تعزيز فرصة للكشف عن التفاعلات . بدلا من ذلك، كشف رechniques مع حساسية عالية مثل قياس الطيف الكتلي يمكن تحسين نوعية التجربة. ومع ذلك، في احترام لكمية من المواد ابتداء من القرب طريقة ربط الفحص لديها مزايا واضحة. فقط مطلوبة عدد قليل من الخلايا، شريطة تقديم نوعية عالية من الأجسام المضادة. وعلاوة على ذلك، في عينات الأنسجة، في التصور الموقع من البروتين البروتين التفاعلات في هياكل الأنسجة وأنواع مختلفة من الخلايا ويمكن تحقيق ذلك عن طريق فحص القرب ربط، في نمط مماثل المناعية الطبيعية. في المقابل، شارك في مناعي بطبيعته غير ملائمة لعرض التوزيع المكاني للتفاعلات البروتين البروتين.
في الخلايا مع نواة كبيرة ولكن المقصورات حشوية صغيرة، ويقتصر على مقربة طريقة ربط الفحص في تحليل التوزيعات النووية حشوية والتقليدي شارك في مناعي لديها تفوقها الخاصة. على سبيل المثال، في تي خطوط الخلايا اللمفاوية، على سبيل المثال Jurkat الخلايا، وزعته-حشوية النوويةbutions التفاعل NF90-RBM3 القرب تقنية ربط فحص يقتصر، لأن نواة تحتل تقريبا الفضاء كله داخل الخلية، وأنه من الصعب تحديد حدود حجرة هيولية. هذا يمكن أن يكون مشكلة مشتركة للمناعية في عام، عندما تكون نسبة النواة السيتوبلازم غير متوازنة للغاية. ومع ذلك، وشارك في مناعي في هذه الحالة لا يخضع لهذا القيد.
واحد قلق خاص بشأن فحص القرب ربط هو ما إذا كانت إشارات من فحص القرب ربط تمثل تفاعلات البروتين البروتين مباشرة أو غير مباشرة. كلا NF90 وRBM3 لها خصائص ملزم RNA وتفاعلها يعتمد على الحمض النووي الريبي، كما ورد في دراسة سابقة لدينا 7. وهكذا، المعالجة من الخلية لست] مع ريبونوكلياز يذوب التفاعل بين NF90 وRBM3 وليس هناك ما هو كشفها بواسطة طريقة شارك في مناعي 7. ومع ذلك، لا يتأثر إشارة فحص القرب ربطحتى لو تفاعل البروتين البروتين التي تعتمد على الحمض النووي الريبي يفقد الأنواع RNA، كما يتم إنشاؤه عند المسافة بين اثنين من البروتينات أقل من 40 نانومتر، الذي يعتبر عادة التفاعل المباشر. هذه الخاصية للربط الفحص القرب يمكن التغلب على المشاكل التقنية من شارك في مناعي، مثل الإفراج ريبونوكلياز في المحللة الخلية التي قد تلغي التفاعلات التي تتطلب وساطة الحمض النووي الريبي. ومع ذلك، من ناحية أخرى، فإن طريقة الفحص القرب ربط ويمكن أيضا توليد اشارات ايجابية كاذبة، إذا لا وجود تفاعل البروتين البروتين التي تعتمد على الحمض النووي الريبي في الواقع نتيجة لعدم وجود الحمض النووي الريبي محددة في الظروف الفسيولوجية.
وثمة مسألة أخرى تستحق اهتماما خاصا هي خصوصية الأجسام المضادة الأولية وإمكانية الإسوية البروتين، والسلائف والمجاميع البروتين. لاحظنا من قبل لطخة غربية أن الإسوي NF90 طويلة، NF110، أقل توافرا في كل نواة والسيتوبلازم في الخلايا HEK293 بالمقارنة مع NF90 (فايجوري 1). ومع ذلك، تداعى شارك في مناعي تقارب ملزم أعلى من NF110 إلى RBM3 ولا سيما في النواة. تم اكتشاف ثلاثة نطاقات رئيسية في البقع RBM3 في النواة، ولكن لوحظ فقط الفرقة RBM3 العادي 20 كيلو دالتون أساسا في السيتوبلازم. سواء تعكس الآخران 50 كيلو دالتون و 100 كيلو دالتون العصابات الإسوية RBM3 والسلائف، وحدات البروتين مع RBM3 ملزمة أو كانت بسبب الخلفية غير محددة تظل إلى توضيح. بدلا من ذلك، منذ يستند فحص القرب ربط على المناعية، وفحص القرب ربط لا يمكن تمييز الفرق بين مختلف الأشكال الإسوية البروتين، والسلائف، وحدات أو تلطيخ غير محددة، في حين شارك في مناعي يمكن أن توفر مزيد من المعلومات عن الأجسام المضادة خصوصية أو البروتين الإسوية والسلائف من فحص ربط القرب في التحقيق في تفاعلات البروتين البروتين. وفيما يتعلق RBM3، عند النظر في جميع النطاقات الثلاثة RBM3 لوحظ في النواة، ونتيجة لطخة غربية تتفق مع نوى السائدة localizatiعلى من RBM3 التي لاحظها المناعية.
في الختام، كلا تقنيات فحص شارك في مناعي وربط القرب لها مزايا الجوهرية والقيود. في كثير من الحالات، فإنها تنتج نتائج متسقة ولكن من المفيد استخدام كل التقنيات عند التحقيق بشكل منهجي معين تفاعل البروتين البروتين. ومع ذلك، في حالات خاصة أو مع غرض معين، يمكن للمرء أن تظهر التفوق من جهة أخرى. في الآونة الأخيرة، وقد استخدمت قرب ربط الفحص إلى الشاشة تفاعلات البروتين البروتين لتطوير رواية علامات النذير 12. ويعتبر تفاعل البروتين البروتين والعلامات البيولوجية أكثر موثوقية من بروتين واحد. في المستقبل، يمكن الفحص عن قرب ربط يحتمل أن تصبح وسيلة سريعة وموثوق بها لتحليل التفاعلات البروتين البروتين والمؤشرات الحيوية التشخيصية والتنبؤية في العيادات، على الرغم من أن تحديد وتوصيف هذه المؤشرات الحيوية لا يزال يتطلب التقليدية المشارك immuoprecipication ليثود.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This study was supported by the Swiss National Science Foundation (SNSF, 31003A_163305).
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle’s Medium (DMEM) | Sigma | D6429 | High glucose 4,500 mg/L |
| Fetal bovine serum (FBS) | Gibco, Thermo Fisher Scientific | 10270106 | |
| Penicillin-Streptomycin (PenStrep) | BioConcept | 4-01F00-H | |
| NE-PER Nuclear and Cytoplasmic Extraction Reagents | Thermo Fisher Scientific | 78833 | |
| 1,4-Dithiothreitol (DTT) | Carl Roth | 6908.3 | |
| Dynabeads Protein G | Novex, Thermo Fisher Scientific | 10003D | |
| DRBP76 (NF90/NF110) antibody | BD Transduction Laboratories | 612154 | use 1:1,000 for WB and 1:100 for ICC/PLA |
| RBM3 antibody | ProteinTech | 14363-1-AP | use 1:1,000 for WB and 1:100 for ICC/PLA |
| Lamin A/C antibody | Cell Signaling Technology | #2032 | use 1:1,000 for WB |
| anti-GAPDH antibody | Abcam | ab8245 | use 1:1,000 for WB |
| normal rabbit IgG | Santa Cruz | sc-2027 | |
| anti-rabbit IgG, HRP-linked secondary antibody | Cell Signaling Technology | #7074 | use 1:5,000 for WB |
| anti-mouse HRP secondary antibody | Carl Roth | 4759.1 | use 1:5,000 for WB |
| Clarity Western ECL Blotting Substrate | Bio-Rad | #1705060 | |
| NuPAGE Novex 4-12% Bis-Tris Gel | Novex, Thermo Fisher Scientific | NP0321BOX | |
| NuPAGE LDS Sample Buffer (4x) | Novex, Thermo Fisher Scientific | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Novex, Thermo Fisher Scientific | NP0002 | |
| NuPAGE Transfer Buffer (20x) | Novex, Thermo Fisher Scientific | NP00061 | |
| Amersham Hypond P 0.2 PVDF membrane | GE Healthcare Life Sciences | 10600021 | |
| Poly-D-Lysine 8 Well Culture Slide | Corning BioCoat | 354632 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Normal goat serum (NGS) | Gibco, Thermo Fisher Scientific | PCN5000 | |
| Goat anti-mouse IgG (H+L Antibody), Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11001 | |
| Goat anti-rabbit IgG (H+L Antibody), Alexa Fluor 568 conjugate | Thermo Fisher Scientific | A-11011 | |
| 4′, 6-Diamidin-2-phenylindol (DAPI) | Sigma | D9542 | |
| Duolink PLA probe Anti-mouse PLUS | Sigma | DUO92001 | |
| Duolink PLA probe Anti-rabbit MINUS | Sigma | DUO92005 | |
| Duolink Detection Reagents Red | Sigma | DUO92008 | |
| Duolink Wash Buffers Fluorescence | Sigma | DUO82049 | |
| Duolink Mounting Medium with DAPI | Sigma | DUO82040 | |
| Mowiol 4-88 | Sigma | 81381 | |
| Microscope | Olympus | AX-70 | |
| CCD camera | SPOT | Insight 2MP Firewire | |
| X-ray film | Fujifilm | Super RX | |
| Film processing machine | Fujifilm | FPM-100A |
References
- Patiño, C., Haenni, A. L., Urcuqui-Inchima, S. NF90 isoforms, a new family of cellular proteins involved in viral replication? Biochimie. 108, 20-24 (2015).
- Shim, J., Lim, H., R Yates, J., Karin, M. Nuclear export of NF90 is required for interleukin-2 mRNA stabilization. Mol Cell. 10 (6), 1331-1344 (2002).
- Sakamoto, S., et al. The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway. Mol Cell Biol. 29 (13), 3754-3769 (2009).
- Dresios, J., et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters microRNA levels, and enhances global protein synthesis. Proc Natl Acad Sci. 102 (6), 1865-1870 (2005).
- Danno, S., Itoh, K., Matsuda, T., Fujita, J. Decreased expression of mouse Rbm3, a cold-shock protein, in Sertoli cells of cryptorchid testis. Am J Pathol. 156 (5), 1685-1692 (2000).
- Wellmann, S., et al. Oxygen-regulated expression of the RNA-binding proteins RBM3 and CIRP by a HIF-1-independent mechanism. J Cell Sci. 117 (Pt 9), 1785-1794 (2004).
- Zhu, X., Zelmer, A., Kapfhammer, J. P., Wellmann, S. Cold-inducible RBM3 inhibits PERK phosphorylation through cooperation with NF90 to protect cells from endoplasmic reticulum stress. FASEB J. 30 (2), 624-634 (2016).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340 (6230), 245-246 (1989).
- Verhelst, J., De Vlieger, D., Saelens, X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp. (98), (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2007).
- Jarvius, M., et al. In situ detection of phosphorylated platelet-derived growth factor receptor beta using a generalized proximity ligation method. Mol Cell Proteomics. 6 (9), 1500-1509 (2007).
- Liu, C. H., et al. Analysis of protein-protein interactions in cross-talk pathways reveals CRKL protein as a novel prognostic marker in hepatocellular carcinoma. Mol Cell Proteomics. 12 (5), 1335-1349 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved