Method Article
Visualisation des interaction protéine-protéine en nucléaire et cytoplasmique Fractions par Co-immunoprécipitation et
Dans cet article
Résumé
Protein-protein interactions can occur in both the nucleus and the cytoplasm of a cell. To investigate these interactions, traditional co-immunoprecipitation and modern proximity ligation assay are applied. In this study, we compare these two methods to visualize the distribution of NF90-RBM3 interactions in the nucleus and the cytoplasm.
Résumé
Protein-protein interactions are involved in thousands of cellular processes and occur in distinct spatial context. Traditionally, co-immunoprecipitation is a popular technique to detect protein-protein interactions. Subsequent Western blot analysis is the most common method to visualize co-immunoprecipitated proteins. Recently, the proximity ligation assay has become a powerful tool to visualize protein-protein interactions in situ and provides the possibility to quantify protein-protein interactions by this method. Similar to conventional immunocytochemistry, the proximity ligation assay technique is also based on the accessibility of primary antibodies to the antigens, but in contrast, proximity ligation assay detects protein-protein interactions with a unique technique involving rolling-circle PCR, while conventional immunocytochemistry only shows co-localization of proteins.
Nuclear factor 90 (NF90) and RNA-binding motif protein 3 (RBM3) have been previously demonstrated as interacting partners. They are predominantly localized in the nucleus, but also migrate into the cytoplasm and regulate signaling pathways in the cytoplasmic compartment. Here, we compared NF90-RBM3 interaction in both the nucleus and the cytoplasm by co-immunoprecipitation and proximity ligation assay. In addition, we discussed the advantages and limitations of these two techniques in visualizing protein-protein interactions in respect to spatial distribution and the properties of protein-protein interactions.
Introduction
Facteur nucléaire 90 (NF90) est une protéine multi-isoforme avec de nombreuses fonctions , y compris la réponse à l' infection virale, la régulation de l' interleukine-2 post-transcription et la régulation de la biogenèse des miARN 1-3. RBM3 est une protéine de liaison à l' ARN, impliqués dans la traduction et la biogenèse des miARN et peut être induite par divers facteurs de stress , y compris l' hypothermie et l' hypoxie 4-6. Récemment, nous avons trouvé NF90 et RBM3 dans un complexe protéique 7. L'interaction de NF90 et RBM3 est essentiel pour moduler la protéine kinase réticulum endoplasmique kinase (PERK) l' activité de l' ARN comme en réponse de la protéine dépliée 7. Deux NF90 et RBM3 sont situés principalement dans le noyau , mais une faible proportion de NF90 et une navette RBM3 dans le cytoplasme et il se lient les unes aux autres pour des fonctions spécifiques, par exemple pour réguler l' activité PERK. Par conséquent, il est important de visualiser la répartition des interactions NF90-RBM3 dans le compartiment sous-cellulaire, ce qui peut indiquerleurs différents rôles dans le compartiment respectif.
Il y a des décennies, deux hybrides de levure (Y2H) a été développé pour détecter l'interaction entre les deux protéines 8. Cependant, en raison de la construction artificielle de protéines fusionnées, des résultats faussement positifs ont restreint l'application de cette méthode. Pendant longtemps, la co-immunoprécipitation a été la principale technique pour analyser les interactions protéine-protéine, en particulier dans des conditions endogènes 9. D'analyser le complexe protéique de co-immunoprécipitation, Western Blot est la technique la plus commode, tandis que la spectrométrie de masse est utilisée lorsque super-sensibilité et la précision sont souhaitées. Au cours des dernières années, un essai de ligature de proximité a été développé comme un nouveau procédé pour détecter des interactions protéine-protéine dans les cellules et les tissus in situ 10,11.
Ici, nous avons comparé la méthode de co-immunoprécipitation le plus populaire et relativement nouvelle méthode d'essai de ligature de proximité dans la capture NF9l'interaction 0-RBM3 dans les fractions subcellulaires. Nous avons également discuté les avantages et les limites des deux techniques.
Protocole
1. Co-immunoprécipitation
- Seed HEK293 cellules à 2 x 10 5 cellules par puits dans une plaque à 6 puits dans 2 ml Eagle modifié (DMEM) le supplément de Dulbecco avec 10% de sérum fœtal bovin (FBS) et 100 U / ml de pénicilline-streptomycine (Pen-Strep) .
- Cultiver les cellules pendant 48 heures à 37 ° C avec 5% de CO 2.
- Laver les cellules avec une solution saline tamponnée au phosphate froide (PBS) à trois reprises. cellules de récolte par centrifugation à 500 g pendant 5 min à 4 ° C.
- Préparer des fractions nucléaires et cytoplasmiques en utilisant des réactifs commerciaux d'extraction nucléaire et cytoplasmique. Suivez les instructions du fabricant, avec quelques modifications.
- En utilisant 3 x 10 6 cellules pour une expérience de co-immunoprécipitation (avec environ 90% de confluence de 3 puits d'une plaque à 6 puits). Ajouter 300 ul solution froide cytoplasmique d'extraction (CER I) et vortex pendant 15 secondes à la vitesse maximale.
- Incuber pendant 30 min sur la glace. Pendant l'incubation, Vortex pour toutes les 10 min 5.
- Ajouter 16,5 ul froid extraction cytoplasmique solution II (CER II), vortex pendant 5 secondes et incuber pendant 5 min sur la glace.
- Vortex pendant 5 secondes et centrifuger à 16 000 xg pendant 5 min à 4 ° C.
- Transférer le surnageant (extrait cytoplasmique) dans un nouveau tube pré-réfrigéré, et garder sur la glace jusqu'à utilisation.
- Laver culots insolubles (contenant des noyaux) trois fois avec PBS 1 ml à froid à chaque fois par pipetage de haut en bas cinq fois. Retirer PBS après lavage.
- Ajouter 150 ul solution d'extraction à froid nucléaire (NER), vortex pendant 15 secondes et incuber 1 h sur la glace. Pendant l'incubation, vortex pendant 15 secondes et la pipette 10 fois avec une pointe de 200 pi toutes les 10 min.
- Vortex pendant 15 s et centrifuger à 16 000 xg pendant 10 min à 4 ° C.
- Transférer le surnageant (extrait nucléaire) dans un nouveau tube pré-réfrigéré, garder sur la glace jusqu'à utilisation.
- Sortir 10% du volume des extraits nucléaires et cytoplasmiques chacun comme entrées.
- UNEdd PBS froid aux extraits qui restent à un volume final de 1 ml. Gardez sur la glace jusqu'à utilisation.
NOTE: Pré-compensation est pas indispensable lors de l'utilisation de protéines des billes magnétiques G-conjugué. Cependant, si le fond est élevé, effectuer le pré-compensation en incubant 40 pi de billes de protéine G-conjugués magnétiques (50% en suspension) et 1 ml dilué lysat provenant de cette étape à 4 ° C pendant 30 min sur un rotateur. surnageant séparée (lysat pré-autorisé) à partir de perles avec support magnétique. Jeter les perles. - À l'anticorps primaire couple avec des perles magnétiques de protéine G-conjugués, incuber 40 ul de billes de protéine magnétiques G-conjugués (50% en suspension) avec un anticorps 4 ug polyclonal de lapin anti-RBM3 ou de lapin IgG (témoin négatif) dans 200 ul de PBS plus Tween 20 (PBST 0,02% de Tween 20) à température ambiante (TA) pendant 40 min sur un rotateur.
- perles et surnageant séparé anticorps couplé à un support magnétique, et jeter le surnageant. Laver les billes une fois avec 200 ul de PBST (0,02%).
- Ajouter 1ml dilué lysats (ou si nécessaire, des lysats pré-autorisé) aux billes, et incuber sur un agitateur à 4 ° C jusqu'au lendemain.
- Le lendemain, séparer les billes et le surnageant par une grille magnétique, et jeter le surnageant. Laver 3 x 10 minutes avec 0,5 ml de PBST (0,02%) pour chaque tube à 4 ° C sur un agitateur avec une vitesse fixe de 20 tours par minute.
- Éluer des protéines à partir des billes par l'ajout d'un tampon d'échantillon de 40 pi (tampon échantillon commercial 1x et 50 mM de 1,4-dithiothréitol (DTT)). On chauffe à 70 ° C pendant 10 min. Isoler et les liquides de transfert à un nouveau tube de 1,5 ml.
- Diluer les lysats d'entrée dans un tampon d'échantillon (concentration finale: 1 x tampon d'échantillon commercial et DTT 50 mM) et on chauffe à 70 ° C pendant 10 min. entrées de charge et protéines immunoprécipitées de la dernière étape à un 4-12% de gel bis-Tris préfabriqué. Le volume de chargement de chaque puits ne doit pas dépasser 20 pi. Effectuer l'électrophorèse dans un tampon 1x exploitation commerciale sur la glace pendant 35 min.
NOTE: Charge nucléaire et extrait cytoplasmiques dans un rapport de 1: 2 (V / V), ce qui reflète la même quantité initiale de cellules. - Transfert des protéines à membrane PVDF dans un tampon 1x transfert commercial à 30 V pendant 2 h à 4 ° C.
- Membrane de bloc avec 5% de lait écrémé dans du PBST (0,1% de Tween 20) à température ambiante pendant 40 minutes sur un agitateur.
- Incuber la membrane avec des anticorps primaires (tous deux dilués à 1: 1000) dans du PBST (0,1%) à 4 ° C pendant une nuit.
- Laver 3 x 10 min avec du PBST (0,1%) à température ambiante sur un agitateur.
- Incuber la membrane avec la peroxydase de raifort (HRP) conjuguée à des anticorps secondaires anti-souris ou anti-lapin (à la fois dilué dans 1: 5000) dans du PBST (0,1%) à température ambiante pendant 1 h.
- Laver 3 x 10 min avec du PBST (0,1%) à température ambiante sur un agitateur.
- Utiliser 0,2 ml chimioluminescence amplifiée (ECL) du mélange de substrat par cm2 de membrane, incuber à température ambiante pendant 5 min. Evitez toute la lumière à partir de cette étape, sauf à compter les feux rouges.
- Jeter liquide et exposer à un film X-ray dans une cassette de film. Développer film à l'aide d'un pr automatique du filmMachine ocessing.
2. Immunocytochimie et Proximité Ligation Assay
- Semence des cellules HEK293 à 1,5 x 10 4 cellules par chambre dans une chambre 8 de poly-D-lysine lame enduite dans 0,4 ml de DMEM supplémenté avec 10% de FBS et 100 U / ml de Pen-Strep.
- Cultiver les cellules pendant 48 heures à 37 ° C avec 5% de CO 2.
- Aspirer le milieu, et fixer les cellules avec 4% de paraformaldehyde (PFA) pendant 10 min à température ambiante.
- Aspirer PFA, et lavage 3 x 10 min avec 0,5 ml de PBS par chambre.
- Et perméabiliser les cellules de bloc avec 0,5% de Triton X-100 et 5% de sérum de chèvre normal (NGS) dans du PBS à température ambiante pendant 1 h.
- Incuber avec des anticorps primaires de 0,1% de Triton X-100 et 5% de NGS dans du PBS sur un agitateur à 4 ° C pendant la nuit. Diluer monoclonal de souris anti-anticorps et NF90 polyclonal de lapin anti-anticorps RBM3 1: 100 dans du PBS pendant deux taches. Pour le contrôle négatif, omettre indépendamment l'une des deux anticorps primaires, et omettre les deux anticorps dans un troisième contrôle.
REMARQUE: Ne pas utiliser le blocage commercial et des réactifs de dilution. - Laver 3 x 10 min avec 0,5 ml de PBS par chambre.
- Sous réserve des protocoles d'essai de ligature immunocytochimie ou de proximité
- Immunocytochimie
- Incuber à 1: 500 fluorescent anti-souris couplé au colorant vert dilué et d'anticorps fluorescents rouges de colorant couplé anti-lapin secondaire à température ambiante pendant 1 h. Evitez la lumière de cette étape en avant.
- Counterstain avec des noyaux 4 ', 6-diamidin-2-phénylindole (DAPI) dilué 1: 5000 dans du PBS à température ambiante pendant 10 min.
- Laver 3 x 10 min avec 0,5 ml de PBS par chambre.
- Enlever les chambres de la lame de verre et sec. Monter avec 250 μ, moyenne par diapositive de montage.
- essai de ligature de proximité
- Préparer proximité sondes de dosage de ligature. Mélanger et diluer deux proximité sondes de dosage de ligature (anticorps secondaires anti-souris et anti-lapin attachés avec différents oligonucléotides qui peut ligaturer through l'ajout de deux autres oligonucléotides en solution de ligature) les deux 1: 5 à 0,1% de Triton X-100 et 5% NGS dans PBS, avec un volume total de 320 pl pour une diapositive 8 chambre (environ 40 pi par cm 2) . Incubation à température ambiante pendant 20 min.
- Enlever les chambres de la lame de verre et ajouter les sondes diluées. Incuber dans un incubateur humide à 37 ° C pendant 1 heure.
- Préparer la solution de ligature. Mélanger 8 pi ligase, 64 pi x 5 ligature stock et 248 ul H 2 O.
- Appuyez sur le liquide de la diapositive, et laver 2 x 5 min dans 1x Wash Buffer A (fourni avec le kit).
- Ajouter la solution de ligature et on incube dans un incubateur humide à 37 ° C pendant 30 min.
- Préparer une solution d'amplification. Mélanger 4 pl polymerase, 64 pl amplification 5x stock et 252 ul H 2 O. Évitez la lumière de cette étape en avant.
- Appuyez sur le liquide de la diapositive, et laver 2 x 2 min 1x Wash Buffer A.
- Ajouter l'amplisolution lification et incuber dans un incubateur d'humidité obscurité à 37 ° C pendant 100 minutes.
- Appuyez sur le liquide de la diapositive, et laver 2 x 10 min dans du 1x Wash Buffer B (fourni avec le kit). Laver pendant 1 min dans 0,01x Wash Buffer B.
- Sécher la lame et monter avec 250 pi d'un milieu de montage commercial (avec DAPI) par diapositive.
- Immunocytochimie
- Examiner les signaux fluorescents sous un microscope en utilisant une lentille d'oculaire 10X et 20X objectif. L'acquisition d'images par une caméra CCD.
Résultats
La figure 1 montre que NF90 et RBM3 sont tous deux des protéines nucléaires et seulement une petite fraction est présente dans le cytoplasme. Notamment, il y a trois bandes différentes colorées positives pour RBM3. Le plus petit peu moins de 20 kDa reflète la taille correcte de RBM3 (le poids moléculaire prédit de RBM3 est de 17 kDa). L'origine des deux autres groupes reste à étudier. Des expériences de co-immunoprécipitation avec RBM3 que la protéine appât a révélé que les interactions NF90-RBM3 sont principalement présents dans le noyau et une minorité dans le cytoplasme. données Co-immunoprécipitation prend en charge la localisation de chaque protéine unique.
Comme on le voit sur la figure 2A, NF90 et RBM3 sont principalement localisées dans le noyau , mais aussi dans le cytoplasme in situ. Les deux protéines montrent la co-localisation parfaite dans les deux compartiments. essai de ligature de proximité a révélé le motifdes interactions NF90-RBM3, ce qui est très similaire à immunocytochimie classique, avec la plupart des interactions dans le noyau dans la majorité des cellules. Seule une petite proportion de cellules a démontré distribution principalement cytoplasmique des interactions NF90-RBM3.
Pris ensemble, les techniques d'analyse de co-immunoprécipitation et la proximité de ligature reflète essentiellement le même schéma d'interactions protéine-protéine dans des compartiments de distribution nucléaires et cytoplasmiques.
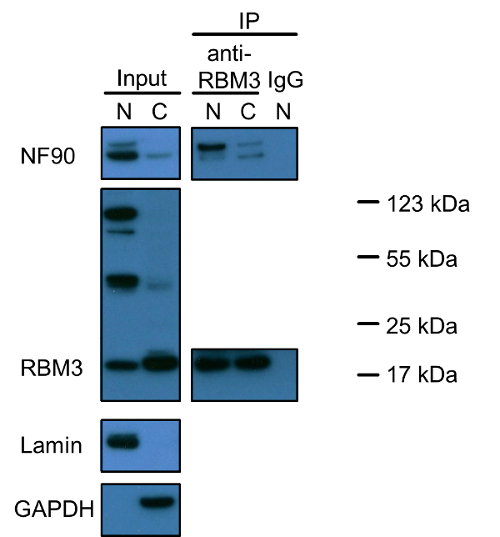
Figure 1: Western Blot Analyse des NF90 et RBM3 et leurs interactions dans nucléaires et cytoplasmiques Fractions de cellules HEK293. Des extraits nucléaires et cytoplasmiques ont été chargés sur un gel SDS-PAGE dans un rapport de 1: 2 (V / V), ce qui reflète la même quantité de cellules comme indiqué dans le protocole d'extraction. Lamin et GAPDH ont été utilisés comme nucléaireet des marqueurs cytoplasmiques, respectivement. Co-immunoprécipitation a été effectuée avec un anticorps anti-RBM3 ou IgG de lapin comme témoin négatif. Des extraits nucléaires et cytoplasmiques ont également été mises en incubation avec un anticorps anti-RBM3 dans un rapport de 1: 2 (v / v), respectivement. bande supérieure en NF90 blot indique 110 kDa isoforme longue NF110. N: extrait nucléaire; C: extrait cytoplasmique, IP: immunoprécipitation. Les marqueurs protéiques ont été marqués pour les bandes positives RBM3. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
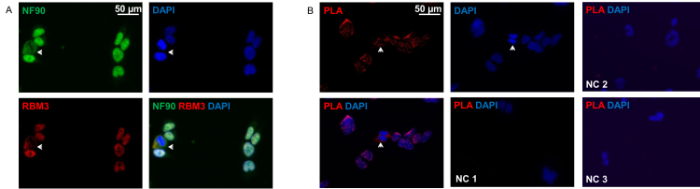
Figure 2: Immunocytochimie et Proximité Ligation Dosage de cellules HEK293. (A) Double-coloration des cellules HEK293 avec anti-NF90 (vert) et anti-RBM3 (rouge) des anticorps. Flèche cellules montrent avec la co-localisation cytoplasmique claire de NF90 et RBM3. Les noyaux ont été DAPI (bleu). (B) Essai de proximité de ligature avec des anticorps anti-RBM3 dans des cellules HEK293 et anti NF90. taches fluorescentes rouges indiquent les interactions NF90-RBM3. Les flèches indiquent les interactions NF90-RBM3 dans le cytoplasme. Les noyaux ont été DAPI (bleu). Contrôle négatif 1 (NC 1): les deux anticorps primaires ont été omis. Contrôle négatif 2 (NC 2): RBM3 seul anticorps primaire seulement. Contrôle négatif 3 (NC 3): NF90 anticorps primaire unique. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Il y a plusieurs avantages ainsi que des lacunes pour les deux méthodes. En tant que technique relativement nouvelle, un avantage évident d'essai de ligature de proximité est la possibilité d'élucider les interactions protéine-protéine au niveau d'une seule cellule au lieu d'un lot de cellules hétérogènes. Images à haute intensité et de la résolution (par exemple par microscope confocal) offrent la possibilité pour la quantification par comptage des taches fluorescentes simples. En revanche, la combinaison de la technique classique de co-immunoprécipitation avec Western Blot peut seulement semi-quantifie des bandes de protéines, principalement du fait d'une commande de chargement approprié est difficile de déterminer des échantillons IP. En outre, lorsque l' interaction protéine-protéine est faible ou transitoire, une grande quantité de matériel biologique, par exemple des cellules ou des tissus, est nécessaire pour la co-immunoprécipitation ou d' un système de surexpression artificielle avec étiquette fondue est appliquée afin d' améliorer la possibilité de détecter les interactions . Alternativement, la détection techniques avec une sensibilité élevée, tels que la spectrométrie de masse peuvent améliorer la qualité de l'expérience. Toutefois, en ce qui concerne la quantité de matériau de départ du procédé d'essai de ligature de proximité présente des avantages évidents. Seules quelques cellules sont nécessaires, ont fourni une grande qualité d'anticorps est donné. En outre, dans des échantillons de tissus, la visualisation in situ des interactions protéine-protéine dans différentes structures de tissus et types de cellules dans peut être obtenue par dosage de ligature de proximité, dans un motif similaire à celui immunohistochimie normal. En revanche, la co-immunoprécipitation est par nature inadaptée pour afficher la distribution spatiale des interactions protéine-protéine.
Dans les cellules avec de grands noyaux, mais de petits compartiments cytoplasmiques, le procédé d'essai de ligature de proximité est limitée à l'analyse de la distribution nucléaire et cytoplasmique co-immunoprécipitation traditionnel possède sa propre supériorité. Par exemple, dans des lignées cellulaires de lymphocytes T, des cellules Jurkat , par exemple, distribu nucléo-butions de NF90-RBM3 interaction par la proximité technique d'essai de ligature est limitée, parce que le noyau occupe presque tout l'espace intérieur de la cellule, et il est difficile d'identifier la limite du compartiment cytoplasmique. Cela peut être un problème commun pour immunocytochimie en général, lorsque le rapport de noyau-cytoplasme est très déséquilibrée. Cependant, la co-immunoprécipitation dans cette situation ne sont pas soumis à cette limitation.
Une préoccupation particulière concernant dosage proximité de ligature est de savoir si les signaux provenant de l'essai proximité de ligature représentent les interactions protéine-protéine directe ou indirecte. Les deux NF90 et RBM3 ont des propriétés liant l'ARN et leur interaction est dépendante de l' ARN, comme indiqué dans notre précédente étude 7. Ainsi, le prétraitement des lysats cellulaires avec de la RNase dissout l' interaction entre NF90 et RBM3 et rien ne peut être détectée par un procédé de co-immunoprécipitation 7. Cependant, le signal d'essai de ligature de proximité ne soit pas affectéemême si une interaction protéine-protéine dépendante de l'ARN perd de l'espèce d'ARN, telle qu'elle est générée lorsque la distance entre les deux protéines est inférieure à 40 nm, ce qui est généralement considéré comme une interaction directe. Cette propriété de l'essai de ligature de proximité peut surmonter les problèmes techniques de co-immunoprécipitation, telles que la RNase libération dans un lysat de cellules qui peuvent supprimer les interactions nécessitant la médiation de l'ARN. Cependant, d'autre part, le procédé d'essai de ligature de proximité peut également générer des signaux faux positifs, si l'interaction protéine-protéine dépendante de l'ARN ne pas réellement exister en raison de l'absence d'ARN spécifique dans des conditions physiologiques.
Une autre question qui mérite une attention particulière est la spécificité des anticorps primaires et la possibilité d'isoformes de protéines, des précurseurs et des agrégats de protéines. Nous avons observé par Western Blot que l'isoforme long NF90, NF110, est beaucoup moins abondant dans le noyau et le cytoplasme à la fois dans des cellules HEK293 par rapport à NF90 (Figurer 1). Cependant, la co-immunoprécipitation démêlé une affinité de liaison supérieure de NF110 à RBM3 particulièrement dans le noyau. Trois bandes principales ont été découverts dans blots RBM3 dans le noyau, mais seulement la bande de 20 kDa RBM3 normale a été observée principalement dans le cytoplasme. Que les deux autres 50 kDa et 100 kDa bandes reflètent isoformes RBM3, des précurseurs, des agrégats de protéines avec RBM3 lié ou étaient dus à fond non spécifique reste à élucider. Au lieu de cela, étant donné que l'essai de proximité de ligature est basée sur l'immunocoloration, le dosage de proximité de ligature ne peut pas distinguer la différence entre les différentes isoformes de la protéine, des précurseurs, des agrégats ou une coloration non spécifique, tandis que la co-immunoprécipitation peut fournir plus d'informations sur spécificité d'anticorps ou de protéines isoformes et des précurseurs que l' essai de ligature de proximité à étudier les interactions protéine-protéine. En ce qui concerne RBM3, lorsque l'on considère tous les trois bandes de RBM3 observées dans le noyau, le résultat de transfert Western est compatible avec un noyau prédominants localizatisur des RBM3 observée par immunocoloration.
En conclusion, les deux techniques de dosage de co-immunoprécipitation et la proximité ligature ont des avantages intrinsèques et les restrictions. Dans de nombreux cas, ils produisent des résultats cohérents, mais il est avantageux d'utiliser les deux techniques lorsqu'ils enquêtent systématiquement certaine interaction protéine-protéine. Toutefois, dans des cas particuliers ou avec un but particulier, on pourrait montrer la supériorité que l'autre. Récemment, un essai de proximité de ligature a été utilisé pour les interactions protéine-protéine écran pour développer de nouveaux marqueurs pronostiques 12. l'interaction protéine-protéine est considérée comme un marqueur biologique plus fiable qu'une seule protéine. Dans l'avenir, le dosage de proximité de ligature peut potentiellement devenir un moyen rapide et fiable pour analyser les interactions protéine-protéine comme biomarqueurs diagnostiques et pronostiques dans les cliniques, bien que l'identification et la caractérisation de ces biomarqueurs nécessite encore le co-immuoprecipication classique methode.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This study was supported by the Swiss National Science Foundation (SNSF, 31003A_163305).
matériels
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle’s Medium (DMEM) | Sigma | D6429 | High glucose 4,500 mg/L |
| Fetal bovine serum (FBS) | Gibco, Thermo Fisher Scientific | 10270106 | |
| Penicillin-Streptomycin (PenStrep) | BioConcept | 4-01F00-H | |
| NE-PER Nuclear and Cytoplasmic Extraction Reagents | Thermo Fisher Scientific | 78833 | |
| 1,4-Dithiothreitol (DTT) | Carl Roth | 6908.3 | |
| Dynabeads Protein G | Novex, Thermo Fisher Scientific | 10003D | |
| DRBP76 (NF90/NF110) antibody | BD Transduction Laboratories | 612154 | use 1:1,000 for WB and 1:100 for ICC/PLA |
| RBM3 antibody | ProteinTech | 14363-1-AP | use 1:1,000 for WB and 1:100 for ICC/PLA |
| Lamin A/C antibody | Cell Signaling Technology | #2032 | use 1:1,000 for WB |
| anti-GAPDH antibody | Abcam | ab8245 | use 1:1,000 for WB |
| normal rabbit IgG | Santa Cruz | sc-2027 | |
| anti-rabbit IgG, HRP-linked secondary antibody | Cell Signaling Technology | #7074 | use 1:5,000 for WB |
| anti-mouse HRP secondary antibody | Carl Roth | 4759.1 | use 1:5,000 for WB |
| Clarity Western ECL Blotting Substrate | Bio-Rad | #1705060 | |
| NuPAGE Novex 4-12% Bis-Tris Gel | Novex, Thermo Fisher Scientific | NP0321BOX | |
| NuPAGE LDS Sample Buffer (4x) | Novex, Thermo Fisher Scientific | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Novex, Thermo Fisher Scientific | NP0002 | |
| NuPAGE Transfer Buffer (20x) | Novex, Thermo Fisher Scientific | NP00061 | |
| Amersham Hypond P 0.2 PVDF membrane | GE Healthcare Life Sciences | 10600021 | |
| Poly-D-Lysine 8 Well Culture Slide | Corning BioCoat | 354632 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Normal goat serum (NGS) | Gibco, Thermo Fisher Scientific | PCN5000 | |
| Goat anti-mouse IgG (H+L Antibody), Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11001 | |
| Goat anti-rabbit IgG (H+L Antibody), Alexa Fluor 568 conjugate | Thermo Fisher Scientific | A-11011 | |
| 4′, 6-Diamidin-2-phenylindol (DAPI) | Sigma | D9542 | |
| Duolink PLA probe Anti-mouse PLUS | Sigma | DUO92001 | |
| Duolink PLA probe Anti-rabbit MINUS | Sigma | DUO92005 | |
| Duolink Detection Reagents Red | Sigma | DUO92008 | |
| Duolink Wash Buffers Fluorescence | Sigma | DUO82049 | |
| Duolink Mounting Medium with DAPI | Sigma | DUO82040 | |
| Mowiol 4-88 | Sigma | 81381 | |
| Microscope | Olympus | AX-70 | |
| CCD camera | SPOT | Insight 2MP Firewire | |
| X-ray film | Fujifilm | Super RX | |
| Film processing machine | Fujifilm | FPM-100A |
Références
- Patiño, C., Haenni, A. L., Urcuqui-Inchima, S. NF90 isoforms, a new family of cellular proteins involved in viral replication? Biochimie. 108, 20-24 (2015).
- Shim, J., Lim, H., R Yates, J., Karin, M. Nuclear export of NF90 is required for interleukin-2 mRNA stabilization. Mol Cell. 10 (6), 1331-1344 (2002).
- Sakamoto, S., et al. The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway. Mol Cell Biol. 29 (13), 3754-3769 (2009).
- Dresios, J., et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters microRNA levels, and enhances global protein synthesis. Proc Natl Acad Sci. 102 (6), 1865-1870 (2005).
- Danno, S., Itoh, K., Matsuda, T., Fujita, J. Decreased expression of mouse Rbm3, a cold-shock protein, in Sertoli cells of cryptorchid testis. Am J Pathol. 156 (5), 1685-1692 (2000).
- Wellmann, S., et al. Oxygen-regulated expression of the RNA-binding proteins RBM3 and CIRP by a HIF-1-independent mechanism. J Cell Sci. 117 (Pt 9), 1785-1794 (2004).
- Zhu, X., Zelmer, A., Kapfhammer, J. P., Wellmann, S. Cold-inducible RBM3 inhibits PERK phosphorylation through cooperation with NF90 to protect cells from endoplasmic reticulum stress. FASEB J. 30 (2), 624-634 (2016).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340 (6230), 245-246 (1989).
- Verhelst, J., De Vlieger, D., Saelens, X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp. (98), (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2007).
- Jarvius, M., et al. In situ detection of phosphorylated platelet-derived growth factor receptor beta using a generalized proximity ligation method. Mol Cell Proteomics. 6 (9), 1500-1509 (2007).
- Liu, C. H., et al. Analysis of protein-protein interactions in cross-talk pathways reveals CRKL protein as a novel prognostic marker in hepatocellular carcinoma. Mol Cell Proteomics. 12 (5), 1335-1349 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon