Method Article
ויזואליזציה של אינטראקציה בין חלבונים ב גרעיני cytoplasmic שברים על ידי Co-immunoprecipitation ו
In This Article
Summary
Protein-protein interactions can occur in both the nucleus and the cytoplasm of a cell. To investigate these interactions, traditional co-immunoprecipitation and modern proximity ligation assay are applied. In this study, we compare these two methods to visualize the distribution of NF90-RBM3 interactions in the nucleus and the cytoplasm.
Abstract
Protein-protein interactions are involved in thousands of cellular processes and occur in distinct spatial context. Traditionally, co-immunoprecipitation is a popular technique to detect protein-protein interactions. Subsequent Western blot analysis is the most common method to visualize co-immunoprecipitated proteins. Recently, the proximity ligation assay has become a powerful tool to visualize protein-protein interactions in situ and provides the possibility to quantify protein-protein interactions by this method. Similar to conventional immunocytochemistry, the proximity ligation assay technique is also based on the accessibility of primary antibodies to the antigens, but in contrast, proximity ligation assay detects protein-protein interactions with a unique technique involving rolling-circle PCR, while conventional immunocytochemistry only shows co-localization of proteins.
Nuclear factor 90 (NF90) and RNA-binding motif protein 3 (RBM3) have been previously demonstrated as interacting partners. They are predominantly localized in the nucleus, but also migrate into the cytoplasm and regulate signaling pathways in the cytoplasmic compartment. Here, we compared NF90-RBM3 interaction in both the nucleus and the cytoplasm by co-immunoprecipitation and proximity ligation assay. In addition, we discussed the advantages and limitations of these two techniques in visualizing protein-protein interactions in respect to spatial distribution and the properties of protein-protein interactions.
Introduction
גורם גרעיני 90 (NF90) הוא חלבון רב-איזופורם עם פונקציות רבות כולל בתגובה לזיהום ויראלי, הסדרת אינטרלויקין -2 שלאחר תעתיק ורגולציה של מירנה biogenesis 1-3. RBM3 הוא חלבון קושר RNA, מעורב biogenesis תרגום מירנה יכול להיגרם על ידי גורמי לחץ שונים כולל היפותרמיה היפוקסיה 4-6. לאחרונה, מצאנו NF90 ו RBM3 בתוך חלבון מורכב 7. האינטראקציה של NF90 ו RBM3 חיוני לווסת קינאז חלבון-RNA כמו קינאז reticulum endoplasmic ("הערכה") פעילות בתגובה חלבון פרש 7. שניהם NF90 ו RBM3 ממוקמים בעיקר בגרעין אלא חלק קטן NF90 ושירות הסעות RBM3 לתוך הציטופלסמה לאגד יש לזה עבור פונקציות ספציפיות, למשל להסדיר את הפעילות "הערכה". לכן, חשוב כדי להמחיש את ההפצה של אינטראקציות NF90-RBM3 בתא subcellular, אשר עשוי להצביעתפקידיהם השונים בתא בהתאמה.
לפני עשרות שנים, היברידית שמרים שני (Y2H) פותחה כדי לזהות את האינטראקציה בין שני חלבונים 8. עם זאת, בשל בנייה מלאכותית של חלבונים התמזגו, תוצאות חיוביות כוזבות הגבילו את היישום של שיטה זו. במשך זמן רב, שיתוף immunoprecipitation היה הטכניקה העיקרית לנתח אינטראקציות בין חלבונים, במיוחד בתנאי endogeneous 9. כדי לנתח את מורכבות חלבון-immunoprecipitated שיתוף, כתם מערבי הוא הטכניקה הנוחה ביותר, תוך ספקטרומטריית מסה משמשת כאשר רגישות ודיוק סופר הם רצויות. בשנים האחרונות, assay קשירת הקרבה פותח שיטה חדשה לאיתור אינטראקציות חלבון-חלבון בשני התאים והרקמות באתרו 10,11.
הנה, השווינו את שיטת שיתוף immunoprecipitation הפופולרית ביותר ושיטת assay רומן יחסית קרב קשירה בלכידת NF9האינטראקציה 0-RBM3 שברים subcellular. דנו גם את היתרונות והמגבלות של שתי הטכניקות.
Protocol
1. Co-immunoprecipitation
- זרע HEK293 תאים ב 2 x 10 5 תאים לכל היטב צלחת אחת 6-היטב 2 מיליליטר הבינוני של הנשר השונה של Dulbecco (DMEM) תוספת עם 10% בסרום שור עוברי (FBS) ו 100 U / mL פניצילין, סטרפטומיצין (עט סטרפטוקוקוס) .
- לגדל תאים עבור 48 שעות ב 37 מעלות צלזיוס עם 5% CO 2.
- שטוף תאים עם פוספט שנאגר מלוחים קרים (PBS) שלוש פעמים. קציר תאים על ידי צנטריפוגה XG ב 500 במשך 5 דקות ב 4 ° C.
- כן שברים גרעיניים cytoplasmic באמצעות ריאגנטים הפקה מסחריים גרעיניים cytoplasmic. בצע הוראה של היצרן עם כמה שינויים.
- השתמש 3 x 10 6 תאים לניסוי שיתוף immunoprecipitation אחד (כ 90% confluency מ 3 בארות של צלחת 6-גם אחד). הוספת 300 פתרון מיצוי ציטופלסמית μl קר (אני CER) ו מערבולת למשך 15 שניות במהירות הגבוהה ביותר.
- דגירה במשך 30 דקות על קרח. במהלך הדגירה, vortex עבור 5 ימים כל 10 דקות.
- להוסיף 16.5 פתרון מיצוי ציטופלסמית קר μl השנייה (CER II), מערבולת למשך 5 שניות ו דגירה במשך 5 דקות על הקרח.
- וורטקס למשך 5 שניות ו צנטריפוגות ב XG 16,000 במשך 5 דקות ב 4 ° C.
- העברת supernatant (תמצית cytoplasmic) לתוך צינור מראש צונן חדש, ולשמור על הקרח עד בשימוש.
- לשטוף כדורי מסיסים (גרעינים המכיל) שלוש פעמים עם 1 מ"ל קר PBS בכל פעם על ידי pipetting למעלה ולמטה חמש פעמים. הסר PBS לאחר לשטוף.
- להוסיף 150 פתרון מיצוי גרעיני μl קר (NER), מערבולת עבור 15 שניות ו דגירה שעה 1 על הקרח. במהלך הדגירה, מערבולת עבור 15 שניות ו פיפטה 10 פעמים עם טיפ 200 μl כל 10 דקות.
- וורטקס למשך 15 שניות ו צנטריפוגות ב XG 16,000 במשך 10 דקות ב 4 °.
- העברת supernatant (תמצית גרעינית) לתוך צינור מראש צונן חדש, ולשמור על קרח עד לשימוש.
- להוציא 10% מנפח של תמציות גרעיני cytoplasmic כל כתשומות.
- אdd קר PBS על תמציות הנותרים לנפח סופי של 1 מ"ל. שמור על הקרח עד לשימוש.
הערה: Pre-הסליקה אינה הכרחית בעת שימוש חלבון G-מצומדות חרוזים מגנטיים. עם זאת, אם הרקע הוא גבוה, לבצע מראש סליקה על ידי דוגרים 40 חרוזים מגנטיים μl חלבון G-מצומדות (50% תרחיף) ו 1 מ"ל מדולל lysate משלב זה על 4 מעלות צלזיוס למשך 30 דקות על הכתף. supernatant הנפרד (lysate מראש פינה) עשויים חרוזים עם מתלה מגנטית. מחק את החרוזים. - כדי נוגדן ראשוני זוג עם חלבון G-מצומדות חרוזים מגנטיים, דגירה 40 μl חלבון G-מצומדות חרוזים מגנטיים (50% תרחיף) עם נוגדנים או IgG ארנב נגד RBM3 ארנב polyclonal 4 מיקרוגרם (שליטה שלילי) ב 200 μl PBS בתוספת חיץ Tween 20 (PBST, 0.02% Tween 20) בטמפרטורת החדר (RT) במשך 40 דקות על הכתף.
- נפרדים נוגדן מצמידים חרוזים supernatant עם מתלה מגנטי, וזורקים supernatant. שטפו את החרוזים פעם עם 200 PBST μl (0.02%).
- הוסף 1מ"ל מדולל lysates (או אם lysates הצורך, מראש פינה) על חרוזים, דגירה על הכתף ב 4 מעלות צלזיוס למשך הלילה.
- ביום למחרת, להפריד את החרוזים supernatant ידי מתלה מגנטי, וזורקים supernatant. לשטוף 3 x 10 דקות עם 0.5 מ"ל PBST (0.02%) עבור כל צינור ב 4 ° C על הכתף עם מהירות קבועה של 20 סל"ד.
- Elute החלבונים מן החרוזים ידי הוספת מאגר מדגם 40 μl (חיץ מדגם מסחרי 1x ו -50 מ"מ 1,4-dithiothreitol (DTT)). מחממים על 70 מעלות צלזיוס למשך 10 דקות. ספין למטה ונוזלים והעברת צינור 1.5 מ"ל חדש.
- לדלל lysates קלט במאגר מדגם (ריכוז סופי: חיץ מדגם מסחרי 1x ו -50 מ"מ DTT) וחום ב 70 מעלות צלזיוס למשך 10 דקות. תשומות טענו וחלבוני immunoprecipitated מהשלב האחרון ג'ל טרומי 4-12% bis-טריס. היקף הטעינה של כל טוב לא יעלה על 20 μl. בצע אלקטרופורזה במאגר ריצה מסחרי 1x על קרח למשך 35 דקות.
הערה: גרעיני טען ותמצית cytoplasmicים על יחס של 1: 2 (V / V), אשר משקף את הסכום הראשוני הזהה של תאים. - העברת חלבוני קרום PVDF חיץ העברת מסחרי 1x 30 V עבור שעה 2 ב 4 ° C.
- קרום בלוק עם 5% חלב רזה ב PBST (0.1% Tween 20) ב RT במשך 40 דקות על שייקר.
- דגירה הממברנה עם נוגדנים ראשוניים (הן מדולל 1: 1,000) ב PBST (0.1%) ב 4 מעלות צלזיוס למשך הלילה.
- לשטוף 3 x 10 דקות עם PBST (0.1%) ב RT על שייקר.
- דגירה הממברנה עם peroxidase חזרת (HRP), מצומדות אנטי עכבר או נוגדנים משני ארנבת אנטי (הן מדולל 1: 5,000) ב PBST (0.1%) ב RT עבור שעה 1.
- לשטוף 3 x 10 דקות עם PBST (0.1%) ב RT על שייקר.
- השתמש 0.2 מ"ל chemiluminescence משופרת (ECL) תערובת המצע לכל קרום 2 ס"מ, לדגור על RT במשך 5 דקות. הימנעו מכל אור משלב זה ואילך למעט אורות אדומים.
- בטל נוזלי ולחשוף את סרט רנטגן קלטת סרט. לפתח את הסרט באמצעות יחסי ציבור סרט אוטומטימכונת ocessing.
2. Immunocytochemistry ו Assay קשירת הסמיכות
- זרע HEK293 התאים ב 1.5 x 10 4 תאים לכל קאמרית השקופית מצופה אחד 8-תא פולי- D- ליזין ב 0.4 מ"ל DMEM בתוספת 10% FBS ו 100 U / ml עט סטרפטוקוקוס.
- לגדל תאים עבור 48 שעות ב 37 מעלות צלזיוס עם 5% CO 2.
- לשאוב בינוני, ולתקן תאים עם paraformaldehyde 4% (PFA) במשך 10 דקות ב RT.
- לשאוב PFA, לשטוף 3 x 10 דקות עם 0.5 מ"ל PBS לכל תא.
- Permeabilize ותאי לחסום עם 0.5% Triton X-100 ו בסרום עז נורמלי 5% (NGS) ב- PBS ב RT עבור שעה 1.
- דגירה עם נוגדנים עיקריים 0.1% Triton X-100 ו -5% NGS ב PBS על שייקר ב 4 מעלות צלזיוס למשך הלילה. לדלל נוגדן אנטי NF90 חד שבטי עכבר הארנב polyclonal אנטי RBM3 נוגדן 1: 100 ב PBS עבור צביעה כפולה. לקבלת שליטה שלילית, להשמיט באופן עצמאי אחד משני הנוגדנים הראשוניים, ולהשמיט הוא נוגדני שליטה שלישית.
הערה: אל תשתמשו חסימה מסחרית ריאגנטים דילול. - לשטוף 3 x 10 דקות עם 0.5 מ"ל PBS לכל תא.
- בכפוף פרוטוקולי assay קשירת immunocytochemistry או קרבה
- immunocytochemistry
- דגירה עם 1: 500 נוגדנים משני אנטי עכבר לצבוע מצמידים פלואורסצנטי ירוק מדולל ואדום ניאון לצבוע מצמידים נגד ארנב ב RT עבור שעה 1. הימנע אור משלב זה ואילך.
- גרעינים Counterstain עם 4 ', 6-diamidin-2-phenylindol (DAPI) מדולל 1: 5,000 PBS ב RT במשך 10 דקות.
- לשטוף 3 x 10 דקות עם 0.5 מ"ל PBS לכל תא.
- סור לתאי משקופית הזכוכית ויבשה. הר עם 250 μ, הרכבה בינונית לכל שקופית.
- assay קשירת סמיכות
- הכן בדיקות assay קשירת הקרבה. מערבב לדלל שתי חלליות assay קרבת הקשירה (אנטי עכבר נוגדנים משני נגד ארנב מצורפים עם oligonucleotides שונה אשר יכול ולקשור ההתוספת הגסה של שני oligonucleotides אחרים בתמיסת קשירה) הוא 1: 5 ב 0.1% Triton X-100 ו -5% NGS ב PBS, בהיקף כולל של 320 μl עבור שקופית 8-תא אחד (כ 40 μl לסנטימטר 2) . לדגור על RT במשך 20 דקות.
- סור לתאי משקופית הזכוכית ולהוסיף החלליות המדוללות. דגירה באינקובטור לחות על 37 מעלות צלזיוס למשך 1 שעה.
- כן פתרון קשירה. מיקס 8 μl אנזים, 64 μl 5 x מניות קשירה ו -248 μl H 2 O.
- הקש את הנוזל משקופית, ולשטוף 2 x 5 דקות 1x לשטוף הצפה (מצורף לערכה).
- הוסף פתרון קשירת דגירת חממת לחות על 37 מעלות צלזיוס למשך 30 דקות.
- כן פתרון הגברה. מערבבים 4 פולימראז μl, 64 μl המניות 5x הגברה 252 μl H 2 O. הימנע אור משלב זה ואילך.
- הקש את נוזלי משקופית, ולשטוף 2 x 2 דקות בתוך א 1x הצפת לשטוף
- מוסיפים את המגברפתרון lification דגירת חממת לחות כהה ב 37 מעלות צלזיוס למשך 100 דקות.
- הקש את הנוזל משקופית, ולשטוף 2 x 10 דקות ב 1x הצפה לשטוף B (מצורף לערכה). לשטוף דקות 1 ב 0.01x לשטוף הצפת B.
- ייבש את שקופית הר עם 250 μl של מדיום גובר מסחרי (עם DAPI) לכל שקופית.
- immunocytochemistry
- בדוק אותות ניאון תחת מיקרוסקופ באמצעות עדשה עינית 10X ו 20X עדשה אובייקטיבית. לרכוש תמונות באמצעות מצלמת CCD.
תוצאות
איור 1 מדגים כי NF90 ו RBM3 הוא חלבונים גרעיניים רק חלק קטן נוכח בציטופלסמה. יש לציין, יש שלוש להקות שונות מוכתמות חיובי RBM3. הקטן רק מתחת ל -20 kDa משקף את הגודל הנכון של RBM3 (המשקל המולקולרי החזה של RBM3 הוא 17 KDA). מקורו של שתי הלהקות האחרות נשאר להיחקר. ניסויי Co-immunoprecipitation עם RBM3 כמו חלבון הפיתיון גילו כי אינטראקציות NF90-RBM3 נוכחות בעיקר בגרעין ומיעוט בציטופלסמה. נתונים Co-immunoprecipitation תומך בלוקליזציה של כל חלבון יחיד.
כפי שניתן לראות בתרשים 2A, NF90 ו RBM3 ממוקמים בעיקר בגרעין אלא גם בציטופלסמה באתרו. חלבוני שניהם להראות שיתוף לוקליזציה מושלמת בשני התאים. assay קשירת הסמיכות חשף את התבניתאינטראקציות NF90-RBM3, אשר דומה מאוד immunocytochemistry קונבנציונלי, עם רוב אינטראקציות גרעין רוב התאים. רק אחוז קטן של תאים הפגין הפצת cytoplasmic בעיקר של אינטראקציות NF90-RBM3.
יחדיו, טכניקות assay שיתוף immunoprecipitation וקרבת קשירה משקפות בעצם אותו הדפוס וההפצה של אינטראקציות בין חלבונים בתאים גרעיניים cytoplasmic.
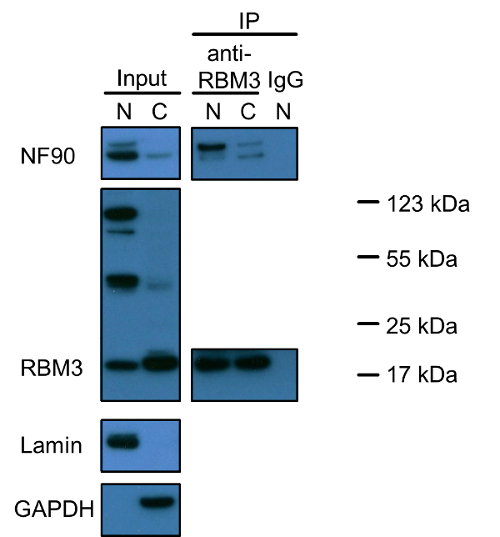
איור 1: ניתוח כתם המערבי של NF90 ו RBM3 ויחסי הגומלין שלהם ב גרעיני cytoplasmic שברים של תאי HEK293. תמציות גרעיני cytoplasmic הועמסו על ג'ל SDS-PAGE על יחס של 1: 2 (V / V), המשקף את אותה כמות של תאים כאמור בפרוטוקול החילוץ. Lamin ו GAPDH שימשו גרעיניוסמני cytoplasmic, בהתאמה. Co-immunoprecipitation בוצע עם נוגדן אנטי RBM3, או IgG ארנב כפי בקרה שלילית. תמציות גרעיניות cytoplasmic גם הודגרו עם נוגדן אנטי RBM3 על יחס של 1: 2 (v / v), בהתאמה. להקה עליונה ב כתם NF90 מציינת NF110 איזופורם ארוך 110 kDa. N: תמצית גרעינית; C: תמצית cytoplasmic, IP: immunoprecipitation. סמני חלבון תויגו ללהקות חיוביות RBM3. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
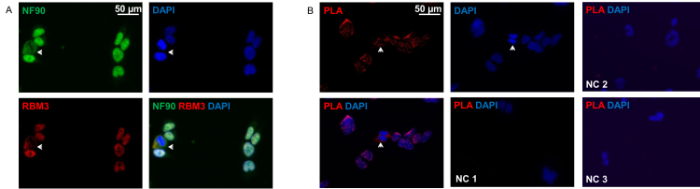
איור 2: Immunocytochemistry והקרבה קשירת Assay של HEK293 תאים. (א) מכתים זוגי של HEK293 תאים עם אנטי NF90 (ירוק) ואנטי-RBM3 (אדום) נוגדנים. חץ תאי הצגה עם cytoplasmic ברור שיתוף לוקליזציה של NF90 ו RBM3. גרעינים היו counterstained עם DAPI (כחול). (ב) assay קשירת הסמיכות עם אנטי NF90 ונוגדנים אנטי RBM3 בתאים HEK293. כתמי ניאון אדומים עולים אינטראקציות NF90-RBM3. חצים מראים אינטראקציות RBM3 NF90 בציטופלסמה. גרעינים היו counterstained עם DAPI (כחול). בקרת 1 שלילית (NC 1): הוא נוגדנים ראשוניים הושמטו. שליטה 2 שלילי (NC 2): נוגדן ראשוני יחיד RBM3 בלבד. שליטה 3 שלילי (NC 3): נוגדן ראשוני יחיד NF90 בלבד. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
Discussion
ישנם מספר יתרונות כמו גם חסרונות עבור שתי השיטות. כתוצאת שיטה חדשנית יחסית, יתרון ברור של assay קשירת הקרב הוא כדאי להבהיר אינטראקציות בין חלבונים ברמה מתא בודד במקום קבוצה של תאים הטרוגנית. תמונות עם גודל ורזולוציה גבוהים (למשל על ידי מיקרוסקופ confocal) לספק את אפשרות כימות על ידי ספירת כתמי פלורסנט בודדים. לעומת זאת, שילוב הקונבנציונלי של טכניקת שיתוף immunoprecipitation עם כתם מערבי יכול רק למחצה לכמת להקות חלבון, בעיקר בגלל טעינה מלאה מתאימה קשה לקבוע עבור דגימות IP. בנוסף, כאשר האינטראקציה בין חלבונים חלשה או חולף, כמות גדולה של חומר ביולוגי, למשל, תאים או רקמות, נדרש שיתוף immunoprecipitation או מערכת overexpressing מלאכותית עם תג התמזג ליישם כדי לשפר את הסיכוי לזהות את האינטראקציות . לחלופין, איתור techniques עם רגישות גבוהה כגון ספקטרומטריית מסה יכול לשפר את איכות הניסוי. עם זאת, ביחס לכמות חומר החל שיטת assay קרבת הקשירה יש יתרונות ברורים. רק כמה תאים נדרשים, ספק באיכות גבוהה של נוגדנים היא נתונה. יתר על כן, בדגימות רקמה, להדמיה באתרו של אינטראקציות חלבון-חלבון שונה מבני רקמות תאים מסוגים יכולים להיות מושגת על ידי assay קשירת קרבה, עם דפוס דומה כמו אימונוהיסטוכימיה נורמלי. לעומת זאת, שיתוף immunoprecipitation היא מטבעה המתאים כדי להציג את הפריסה המרחבית של אינטראקציות בין חלבונים.
בתאים עם גרעינים גדולים מדי אך תאי ציטופלסמית קטנים, שיטת assay קשירת הקרבה מוגבלת בניתוח הפצות גרעיניות cytoplasmic ושיתוף immunoprecipitation המסורתית יש עליונות משלו. לדוגמה, בשורות תאי T לימפוציטים, למשל Jurkat תאים, גרעיני cytoplasmic distributions אינטראקצית NF90-RBM3 ידי טכניקת assay קשירת קרבה מוגבל, כי הגרעין תופס כמעט את החלל כולו בתוך התא, וקשה לזהות את הגבול של תא cytoplasmic. זו יכולה להיות בעיה נפוצה עבור immunocytochemistry בכלל, כאשר היחס-הציטופלסמה לגרעין אינו מאוזן מאוד. עם זאת, שיתוף immunoprecipitation במצב זה אינו כפוף למגבלה זו.
אחת דאגה מיוחדת לגבי assay קשירת קרבה היא האם את האותות המגיעים מן assay קשירת הקרבה מייצגים אינטראקציות ישירות או עקיפות בין חלבונים. לשניהם NF90 ו RBM3 נכסים קושרי RNA ואת האינטראקציה שלהם תלויה RNA, כפי שדווח במחקר הקודם שלנו 7. לפיכך, המקדים של lysates תא עם RNase מתמוסס האינטראקציה בין NF90 ו RBM3 ושום דבר ניתן לזהות על ידי שיטת שיתוף immunoprecipitation 7. עם זאת, את אות assay קרבת הקשירה אינה מושפעתגם אם אינטראקציה בין חלבוני RNA תלוי מאבדת את מיני RNA, כפי שהוא נוצר כאשר המרחק בין שני חלבונים הוא פחות מ -40 ננומטר, אשר נחשב בדרך כלל אינטראקציה ישירה. מאפיין זה של assay קשירת הקרב יכול להתגבר על בעיות טכניות שיתוף immunoprecipitation, כגון שחרור RNase ב lysate תא שעשוי לבטל את האינטראקציות מחייבות גישור RNA. עם זאת, מצד השני, שיטת assay קשירת הקרב יכולה גם ליצור אותות חיוביים כוזבים, אם האינטראקציה בין החלבונים תלויים RNA לא מקיימת בפועל בשל חוסר RNA הספציפי בתנאים פיסיולוגיים.
סוגיה נוספת ראויה לתשומת לב מיוחדת היא ספציפי של נוגדנים ראשוניים אפשרות isoforms חלבון, מבשרי אגרגטים חלבון. צפינו על ידי כתם מערבי כי איזופורם NF90 הארוך, NF110, הוא הרבה פחות בשפע הוא בגרעין הציטופלסמה בתאי HEK293 לעומת NF90 (אלחוטיאיור 1). עם זאת, שיתוף immunoprecipitation נפרם יש זיקה מחייבת גבוהה של NF110 כדי RBM3 במיוחד גרעין. שלוש להקות עיקריות התגלו כתמי RBM3 בגרעין, אך רק 20 להקת RBM3 הנורמלי kDa נצפתה בעיקר בציטופלסמה. אם שני אחרים 50 kDa ו -100 להקות kDa לשקף isoforms RBM3, מבשרים, אגרגטים חלבון עם RBM3 הכבול או נובעים רקע נוקב להישאר להיות הובהר. במקום זאת, מאז assay קשירת הקרב מבוסס על immunostaining, assay קשירת הקרבה לא יכול להבחין בהבדל בין שונה isoforms חלבון, מבשרים, אגרגטים או מכתים נוקב, תוך שיתוף immunoprecipitation יכול לספק מידע נוסף על סגוליות נוגדנים או חלבון isoforms ומבשר מאשר assay קשירת הקרבה בחקירת אינטראקציות חלבון-חלבון. לגבי RBM3, כאשר בוחנים את כל שלוש להקות RBM3 שנצפו גרעין, תוצאת הכתם המערבית עולה בקנה אחד עם גרעינים שולטים localizatiעל של RBM3 שנצפו על ידי immunostaining.
לסיכום, שתי טכניקות assay שיתוף immunoprecipitation וקרבת קשירה יש יתרונות ומגבלות מהותיים. במקרים רבים, הם מייצרים תוצאות עקביות אבל זה מועיל להשתמש בשתי הטכניקות כאשר שיטתי חוקרת אינטראקציה בין חלבונים מסוימים. עם זאת, במקרים מיוחדים או עם מטרה מסוימת, אפשר להראות עליון יותר מהשנייה. לאחרונה, assay קשירת הקרבה נעשה שימוש כדי אינטראקציות חלבון-חלבון מסך לפתח סמנים פרוגנוסטיים רומן 12. אינטראקציה בין חלבונים נחשבת סמן ביולוגי אמין יותר מאשר חלבון אחת. בעתיד, assay קרבת הקשירה יכולה להיות פוטנציאלית דרך מהירה ואמינה לנתח אינטראקציות בין חלבונים כסמנים ביולוגיים אבחון פרוגנוסטיים במרפאות, למרות זיהוי והאפיון של סמנים אלה עדיין המחייב הקונבנציונלי שיתוף immuoprecipication ליthod.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This study was supported by the Swiss National Science Foundation (SNSF, 31003A_163305).
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle’s Medium (DMEM) | Sigma | D6429 | High glucose 4,500 mg/L |
| Fetal bovine serum (FBS) | Gibco, Thermo Fisher Scientific | 10270106 | |
| Penicillin-Streptomycin (PenStrep) | BioConcept | 4-01F00-H | |
| NE-PER Nuclear and Cytoplasmic Extraction Reagents | Thermo Fisher Scientific | 78833 | |
| 1,4-Dithiothreitol (DTT) | Carl Roth | 6908.3 | |
| Dynabeads Protein G | Novex, Thermo Fisher Scientific | 10003D | |
| DRBP76 (NF90/NF110) antibody | BD Transduction Laboratories | 612154 | use 1:1,000 for WB and 1:100 for ICC/PLA |
| RBM3 antibody | ProteinTech | 14363-1-AP | use 1:1,000 for WB and 1:100 for ICC/PLA |
| Lamin A/C antibody | Cell Signaling Technology | #2032 | use 1:1,000 for WB |
| anti-GAPDH antibody | Abcam | ab8245 | use 1:1,000 for WB |
| normal rabbit IgG | Santa Cruz | sc-2027 | |
| anti-rabbit IgG, HRP-linked secondary antibody | Cell Signaling Technology | #7074 | use 1:5,000 for WB |
| anti-mouse HRP secondary antibody | Carl Roth | 4759.1 | use 1:5,000 for WB |
| Clarity Western ECL Blotting Substrate | Bio-Rad | #1705060 | |
| NuPAGE Novex 4-12% Bis-Tris Gel | Novex, Thermo Fisher Scientific | NP0321BOX | |
| NuPAGE LDS Sample Buffer (4x) | Novex, Thermo Fisher Scientific | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Novex, Thermo Fisher Scientific | NP0002 | |
| NuPAGE Transfer Buffer (20x) | Novex, Thermo Fisher Scientific | NP00061 | |
| Amersham Hypond P 0.2 PVDF membrane | GE Healthcare Life Sciences | 10600021 | |
| Poly-D-Lysine 8 Well Culture Slide | Corning BioCoat | 354632 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Normal goat serum (NGS) | Gibco, Thermo Fisher Scientific | PCN5000 | |
| Goat anti-mouse IgG (H+L Antibody), Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11001 | |
| Goat anti-rabbit IgG (H+L Antibody), Alexa Fluor 568 conjugate | Thermo Fisher Scientific | A-11011 | |
| 4′, 6-Diamidin-2-phenylindol (DAPI) | Sigma | D9542 | |
| Duolink PLA probe Anti-mouse PLUS | Sigma | DUO92001 | |
| Duolink PLA probe Anti-rabbit MINUS | Sigma | DUO92005 | |
| Duolink Detection Reagents Red | Sigma | DUO92008 | |
| Duolink Wash Buffers Fluorescence | Sigma | DUO82049 | |
| Duolink Mounting Medium with DAPI | Sigma | DUO82040 | |
| Mowiol 4-88 | Sigma | 81381 | |
| Microscope | Olympus | AX-70 | |
| CCD camera | SPOT | Insight 2MP Firewire | |
| X-ray film | Fujifilm | Super RX | |
| Film processing machine | Fujifilm | FPM-100A |
References
- Patiño, C., Haenni, A. L., Urcuqui-Inchima, S. NF90 isoforms, a new family of cellular proteins involved in viral replication? Biochimie. 108, 20-24 (2015).
- Shim, J., Lim, H., R Yates, J., Karin, M. Nuclear export of NF90 is required for interleukin-2 mRNA stabilization. Mol Cell. 10 (6), 1331-1344 (2002).
- Sakamoto, S., et al. The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway. Mol Cell Biol. 29 (13), 3754-3769 (2009).
- Dresios, J., et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters microRNA levels, and enhances global protein synthesis. Proc Natl Acad Sci. 102 (6), 1865-1870 (2005).
- Danno, S., Itoh, K., Matsuda, T., Fujita, J. Decreased expression of mouse Rbm3, a cold-shock protein, in Sertoli cells of cryptorchid testis. Am J Pathol. 156 (5), 1685-1692 (2000).
- Wellmann, S., et al. Oxygen-regulated expression of the RNA-binding proteins RBM3 and CIRP by a HIF-1-independent mechanism. J Cell Sci. 117 (Pt 9), 1785-1794 (2004).
- Zhu, X., Zelmer, A., Kapfhammer, J. P., Wellmann, S. Cold-inducible RBM3 inhibits PERK phosphorylation through cooperation with NF90 to protect cells from endoplasmic reticulum stress. FASEB J. 30 (2), 624-634 (2016).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340 (6230), 245-246 (1989).
- Verhelst, J., De Vlieger, D., Saelens, X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp. (98), (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2007).
- Jarvius, M., et al. In situ detection of phosphorylated platelet-derived growth factor receptor beta using a generalized proximity ligation method. Mol Cell Proteomics. 6 (9), 1500-1509 (2007).
- Liu, C. H., et al. Analysis of protein-protein interactions in cross-talk pathways reveals CRKL protein as a novel prognostic marker in hepatocellular carcinoma. Mol Cell Proteomics. 12 (5), 1335-1349 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved