Method Article
공동 면역 침전에 의한 핵 및 세포질 분수에서 단백질 - 단백질 상호 작용의 시각화 및
요약
Protein-protein interactions can occur in both the nucleus and the cytoplasm of a cell. To investigate these interactions, traditional co-immunoprecipitation and modern proximity ligation assay are applied. In this study, we compare these two methods to visualize the distribution of NF90-RBM3 interactions in the nucleus and the cytoplasm.
초록
Protein-protein interactions are involved in thousands of cellular processes and occur in distinct spatial context. Traditionally, co-immunoprecipitation is a popular technique to detect protein-protein interactions. Subsequent Western blot analysis is the most common method to visualize co-immunoprecipitated proteins. Recently, the proximity ligation assay has become a powerful tool to visualize protein-protein interactions in situ and provides the possibility to quantify protein-protein interactions by this method. Similar to conventional immunocytochemistry, the proximity ligation assay technique is also based on the accessibility of primary antibodies to the antigens, but in contrast, proximity ligation assay detects protein-protein interactions with a unique technique involving rolling-circle PCR, while conventional immunocytochemistry only shows co-localization of proteins.
Nuclear factor 90 (NF90) and RNA-binding motif protein 3 (RBM3) have been previously demonstrated as interacting partners. They are predominantly localized in the nucleus, but also migrate into the cytoplasm and regulate signaling pathways in the cytoplasmic compartment. Here, we compared NF90-RBM3 interaction in both the nucleus and the cytoplasm by co-immunoprecipitation and proximity ligation assay. In addition, we discussed the advantages and limitations of these two techniques in visualizing protein-protein interactions in respect to spatial distribution and the properties of protein-protein interactions.
서문
핵 인자 90 (NF90)은 인터루킨 -2 후 전사 및 miRNA의 생합성 1-3의 규제의 바이러스 감염에 대한 반응 조절 등 다양한 기능을 가진 멀티 이소 단백질이다. RBM3는 RNA 결합 단백질 번역 및 miRNA의 생합성에 관여 저체온증 저산소증 4-6을 포함하는 다양한 스트레스에 의해 유도 될 수있다. 최근에, 우리는 단백질 복합체 7 NF90 및 RBM3를 발견했다. NF90 RBM3과의 상호 작용은 단백질 펼친 응답 7 단백질 키나제 RNA 같은 소포체 키나제 (PERK) 활성을 조절하는 것이 필수적이다. NF90 및 RBM3 모두 핵하지만 세포질에 작은 NF90의 비율과 RBM3 셔틀에 주로 위치하며, PERK 활동을 조절하는 특정 기능을 위해 서로가 예를 결합한다. 따라서, 어느 것을 나타낼 수 있고, 세포 내 구획에서-NF90 RBM3 상호 작용의 분포를 시각화하는 것이 중요각각의 구획에서의 다양한 역할.
수십 년 전에, 효모 두 하이브리드 (Y2H)는 두 단백질 (8) 사이의 상호 작용을 검출하기 위해 개발되었다. 그러나, 융합 단백질의 인공 건설, 거짓 양성 결과는이 방법의 적용을 제한하고있다. 오랫동안, 공동 면역 침전 특히 내인성 조건 9, 단백질 - 단백질 상호 작용을 분석하는 주요 기술이다. 최고 감도 및 정밀도가 요구되는 경우, 질량 스펙트럼에서 사용되는 동안에 공동 면역 침전 된 단백질 복합체를 분석, 웨스턴 블롯, 가장 편리한 기술이다. 최근, 근접 결찰 분석은 동일계 10,11 모두에서 세포 및 조직에서의 단백질 - 단백질 상호 작용을 검출하는 신규 한 방법으로 개발되었다.
여기서는 NF9 캡처에서 가장 인기있는 공동 면역 침전 법 및 비교적 신규 근접 결찰 분석 방법에 비해세포 내 분수에 0 RBM3 상호 작용. 우리는 또한 장점과 두 가지 기술의 한계를 논의했다.
프로토콜
1. 공동 면역 침전
- 씨앗 하나 6 웰 플레이트에 웰 당 2 × 10 5 세포에서 HEK293 세포 2 ㎖의 10 % 소 태아 혈청 (FBS)와 함께 둘 베코의 수정 이글의 중간 (DMEM) 보충 100 U / mL의 페니실린 - 스트렙토 마이신 (펜 연쇄상 구균) .
- 5 % CO 2, 37 ℃에서 48 시간 동안 세포를 성장.
- 차가운 인산 완충 식염수 (PBS)로 3 회 세포를 씻으십시오. 4 ° C에서 5 분 500 XG에 원심 분리하여 수확 세포.
- 상업 핵 및 세포질 추출 시약을 사용하여 핵 및 세포질 분수를 준비합니다. 일부 수정과 제조업체의 지시 사항을 따르십시오.
- 하나의 공동 면역 실험 (한 6 웰 플레이트의 3 우물에서 약 90 %의 컨 플루)에 대한 3 × 10 6 세포를 사용합니다. 최고 속도로 15 초 동안 300 μl의 차가운 세포질 추출 용액 (CER의 I)와 소용돌이를 추가합니다.
- 얼음에 30 분 동안 품어. 배양, vorte 중5 초마다 10 분 동안 X.
- 5 초 동안 16.5 μl의 차가운 세포질 추출 용액 II (CER II), 소용돌이를 추가하고 얼음에 5 분 동안 품어.
- 4 ° C에서 5 분 동안 16,000 XG에 5 초 원심 분리기를위한 소용돌이.
- 새로운 사전 냉각 튜브에 뜨는 (세포질 추출물)를 전송하고, 사용까지 얼음에 보관하십시오.
- 때마다 최대 피펫 팅에 의해 5 배 아래로 1 ml의 차가운 PBS와 불용성 펠렛 (포함하는 핵)을 세 번 씻으십시오. 세척 후 PBS를 제거합니다.
- 15 초 동안 150 μl의 차가운 핵 추출 용액 (NER), 소용돌이를 추가하고 얼음에 1 시간을 품어. 배양하는 동안, 15 초 및 피펫 200 μl의 팁 10 시간마다 10 분 동안 소용돌이.
- 4 ℃에서 10 분 동안 16,000 XG에 15 초 동안 소용돌이와 원심 분리기.
- 새로운 사전 냉각 튜브에 뜨는 (핵 추출물)로 이동시켜 사용할 때까지 얼음에 보관하십시오.
- 각각의 입력으로 핵 및 세포질 추출물의 볼륨의 10 %를 가져 가라.
- 에이1 ml의 최종 용적에 남아있는 추출물을 차가운 PBS를 위해 dd. 얼음에 사용할 때까지 보관하십시오.
주 : 단백질 G 공역 자성 비드를 사용하는 경우 사전 클리어링이 필수적인 것은 아니다. 백그라운드가 높은 경우에는, 40 ㎕의 단백질 G 공역 자성 비드 (50 % 슬러리)와 회 전자에서 30 분 동안 4 ℃에서이 단계에서 해물 희석 한 용액을 배양하여 전 소거를 수행한다. 자기 랙 구슬에서 분리 된 상층 액 (사전 허가 해물). 구슬을 폐기하십시오. - 단백질 G-복합 자석 구슬 몇 차 항체로, 4 μg의 토끼 다 클론 항 RBM3 항체 또는 토끼의 IgG (음성 대조군) 200 ㎕의 PBS에 플러스 트윈 20 버퍼와 단백질 G - 복합 자석 구슬 (50 % 슬러리) μL (40)을 품어 (PBST, 0.02 % 트윈 20)가 회 40 분 동안 실온 (RT)에서.
- 별도의 자기 랙 구슬과 뜨는 항체를 결합하고, 상층 액을 버린다. 200 μL PBST (0.02 %) 한 번 구슬을 씻으십시오.
- 1 추가용액은 비드 해물을 (또는 필요한 사전 허가 해물 경우)로 희석하고, 밤새 4 ℃에서 회전에 배양한다.
- 다음 날, 자기 랙에 의해 구슬과 상층 액을 분리하고, 상층 액을 버린다. 20 rpm의 고정 된 속도로 회 전자에 4 ° C에서 각각의 튜브 0.5 ml의 PBST (0.02 %)와 3 × 10 분을 씻으십시오.
- 40 ㎕의 시료 완충액 (1X 상업용 샘플 버퍼의 50 mM 1,4- 디티 오 트레이 톨 (DTT))를 첨가하여 비드로부터 단백질을 용출. 10 분 동안 70 ℃에서 가열한다. 새로운 1.5 ML 튜브에 스핀 다운 및 전송 액체.
- 10 분 동안 70 ℃에서 가열 (1X 상업용 샘플 완충액 50 mM의 DTT, 최종 농도)을 샘플 버퍼에 입력 해물을 희석. 프리 캐스트 4-12% 비스 - 트리스 젤 마지막 단계에서로드 입력과 면역 단백질. 각 웰의 적재 부피는 20 μl를 초과 할 수 없습니다. 35 분 동안 얼음에 1 배 상업 운전 버퍼에 전기 영동을 수행합니다.
참고 :로드 핵 및 세포질 추출물셀의 동일한 초기 량을 반영 (2) (V / V를) : 1의 비율로 S. - 4 ° C에서 2 시간 동안 30 V에서 1 배 상업 전송 버퍼에서 PVDF 막에 전달 단백질.
- 5 % 차단 막을 진탕 기에서 40 분 동안 RT에서 우유 PBST (0.1 % 트윈 20)를 미끄러 져.
- 밤새 4 ° C에서 PBST (0.1 %)에서 : 일차 항체와 멤브레인 (1,000 두 1에 희석) 품어.
- 쉐이커에 RT에서 PBST (0.1 %)와 3 × 10 분을 씻으십시오.
- 1 시간 동안 RT에서 PBST (0.1 %)에서, (5000 모두 1로 희석) 양 고추 냉이 퍼 옥시 다제 (HRP)와 함께 막을 인큐베이션 항 - 마우스 또는 항 - 토끼 이차 항체를 π 공역.
- 쉐이커에 RT에서 PBST (0.1 %)와 3 × 10 분을 씻으십시오.
- cm 2 막 당 0.2 ml의 강화 된 화학 발광 (ECL) 기판 혼합물을 사용하여, 5 분 동안 실온에서 품어. 빨간 불빛을 제외하고 이후이 단계에서 모든 빛을 피하십시오.
- 액체 버리고 필름 카세트에 X 선 필름에 노출. 자동 필름 홍보를 사용하여 필름 개발ocessing 기계.
2. 면역 세포 화학 및 근접 내고 분석
- 시드 0.4 ㎖의 DMEM 한 8 실, 폴리 D 라이신 코팅 된 슬라이드 챔버 당 1.5 × 104 세포의 HEK293 세포는 10 % FBS, 100 U / ㎖ 펜 연쇄상 보충.
- 5 % CO 2, 37 ℃에서 48 시간 동안 세포를 성장.
- 대기음 매체 및 RT에서 10 분 동안 4 % 파라 포름 알데히드 (PFA)로 세포를 고정한다.
- 대기음 PFA, 챔버 당 0.5 ml의 PBS로 세척 3 × 10 분.
- Permeabilize 하시려면 1 시간 동안 실온에서 PBS에서 0.5 % 트리톤 X-100, 5 % 정상 염소 혈청 (NGS)와 블록 셀.
- 밤새 4 ° C에서 통에 PBS에서 0.1 % 트리톤 X-100 및 5 % NGS의 일차 항체와 함께 품어. 마우스 단일 클론 항 NF90 항체 토끼 다 클론 항 RBM3 항체 1을 희석 : PBS 100을 두 번 염색을 위해. 음성 대조군의 경우, 독립적으로 두 일차 항체 중 어느 하나를 생략하고, 제 3 제어 모두 항체 생략.
참고 : 광고 차단 및 희석 시약을 사용하지 마십시오. - 챔버 당 0.5 ml의 PBS로 3 × 10 분을 씻으십시오.
- 면역 세포 또는 근접 내고 분석 프로토콜에 따라
- 면역 세포 화학
- 부화 1 : 500 희석 된 녹색 형광 염료가 결합 된 항 - 마우스 및 적색 형광성 염료 결합 항 - 토끼 이차 항체를 실온에서 1 시간 동안. 이후이 단계에서 빛을 피하십시오.
- 10 분 동안 실온에서 PBS로 5,000 : 4 ', 6-diamidin -2- phenylindol (DAPI)로 Counterstain과 핵 (1) 희석 하였다.
- 챔버 당 0.5 ml의 PBS로 3 × 10 분을 씻으십시오.
- 유리 슬라이드 건조에서 챔버를 제거합니다. 슬라이드 당 매체를 장착, 250 μ으로 마운트합니다.
- 근접 내고 분석
- 근접 내고 분석 프로브를 준비합니다. 믹스와 일을 결찰 수있는 다른 올리고 뉴클레오티드로 연결된 두 개의 근접 내고 분석 프로브 (항 - 마우스 및 안티 - 토끼 보조 항체를 희석하나 8 챔버 슬라이드 (cm 2 당 약 40 ㎕를 320 ㎕의 총 부피로 PBS에서 0.1 % 트리톤 X-100 5 5 % NGS) 다른 두 연결 용액의 올리고 뉴클레오티드)을 모두 한 거친 첨가 . 실온에서 20 분 동안 인큐베이션.
- 유리 슬라이드에서 챔버를 제거하고 희석 프로브를 추가 할 수 있습니다. 1 시간 동안 37 ℃에서 습도 인큐베이터에서 인큐베이션.
- 연결 용액을 준비합니다. 8 리가 ㎕를 혼합 64 μl를 5 × 결찰 재고 및 248 μL의 H 2 O
- 슬라이드에서 액체를 누른 1X 세척 버퍼 (A)에 2 × 5 분을 씻어 (키트와 함께 제공).
- 라이 게이션 용액을 첨가하고 30 분 동안 37 ℃에서 습도 인큐베이터에서 배양한다.
- 증폭 솔루션을 준비합니다. 이후이 단계에서 빛을 피 4 μL 중합 효소, 64 ㎕의 5 배 증폭 재고 및 252 μL의 H 2 O를 섞는다.
- 슬라이드에서 액체를 누른 1X 세척 버퍼 A에 2 × 2 분을 씻어
- 앰프 추가lification 용액을 100 분 동안 37 ℃에서 어두운 습도 인큐베이터에서 배양한다.
- 슬라이드에서 액체를 누른 1X 세척 버퍼 B에 2 × 10 분을 씻어 (키트와 함께 제공). 0.01x 세척 버퍼 B.에서 1 분 동안 세척
- 슬라이드를 건조 및 슬라이드 당 (DAPI)와 상업 장착 매체의 250 μl를 마운트.
- 면역 세포 화학
- 10 배의 접안 렌즈와 20 배 대물 렌즈를 사용하여 현미경 형광 신호를 검사합니다. CCD 카메라에 의해 화상을 취득.
결과
도 1 및 NF90 RBM3 모두 핵 단백질과 작은 부분이 세포질에 존재하는 것을 보여준다. 특히, RBM3에 대한 긍정적 인 스테인드 세 가지 밴드가 있습니다. 20 kDa의 아래 작은이 RBM3의 정확한 크기를 반영 (RBM3의 예측 분자량이 17 kDa의)입니다. 다른 두 밴드의 기원은 조사가 남아있다. 미끼 단백질로 RBM3와 공동 면역 침전 실험 NF90-RBM3 상호 작용은 핵 및 세포질에서 소수 민족에 주로 존재하는 것으로 나타났습니다. 공동 면역 침전 데이터는 각각의 단일 단백질의 현지화를 지원합니다.
도 2a에 도시 된 바와 같이, NF90 및 RBM3 주로 핵하지만 시튜 세포질에 위치한다. 두 단백질 모두 구획에 완벽한 공동 현지화을 보여줍니다. 근접 내고 분석은 패턴을 밝혀세포의 대부분의 핵에있는 대부분의 상호 작용으로, 기존의 면역 세포와 매우 유사하다 NF90-RBM3 상호 작용의. 만 세포의 작은 비율은 NF90-RBM3 상호 작용의 주로 세포질 분포를 보여 주었다.
종합적으로, 공동 면역 침전 법 및 근접 내고 분석 기술은 기본적 핵과 세포질 구획에 단백질 - 단백질 상호 작용의 동일한 배광 패턴을 반영한다.
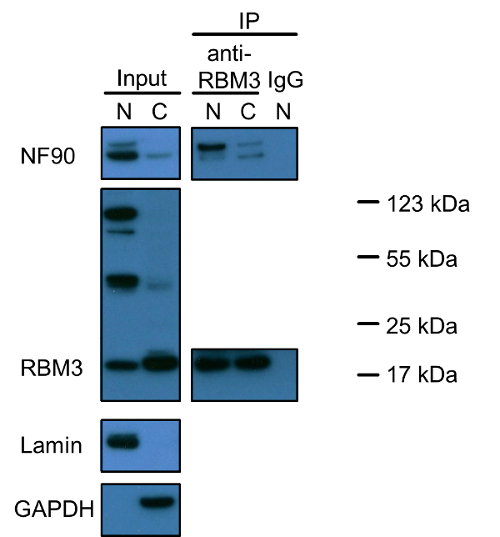
그림 1 : NF90 및 RBM3 및 HEK293 세포의 핵 및 세포질 분수에서 그들의 상호 작용의 웨스턴 블롯 분석. 핵과 세포질 추출물의 비율로 SDS-PAGE 겔에 로딩하고 1 : 2 (V / V), 추출 프로토콜에서 명시된 바와 같이 셀의 동일한 양을 반영. 라민 및 GAPDH 핵으로 사용했다각각과 세포질 마커. 공동 면역 침전은 음성 대조군으로서 항 - RBM3 항체 또는 토끼 IgG를 사용하여 수행 하였다. 핵과 세포질 추출물도 1의 비율로 안티 RBM3 항체로 인큐베이션 하였다 : 2 (V / V)를 각각. NF90 오의 상위 대역은 110 kDa의 긴 이성체 NF110를 나타냅니다. N : 핵 추출물; C : 세포질 추출물, IP : 면역. 단백질 마커는 RBM3 긍정적 밴드 표지 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
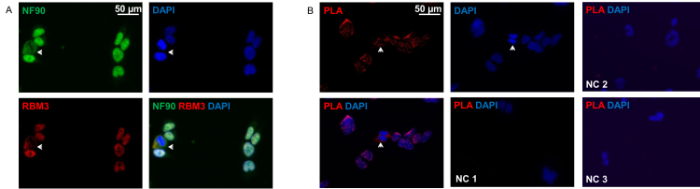
그림 2 : 면역 세포 화학 및 HEK293 세포의 근접 내고 분석. (A) 항 NF90 (녹색) 및 항 RBM3 (적색) 항체 HEK293 세포의 이중 염색. NF9의 명확한 세포질 공동 현지화와 쇼 세포 화살표0 RBM3. 핵은 DAPI (파란색)으로 대조 하였다. 안티 NF90 및 HEK293 세포에서 항 RBM3 항체와 (B)의 근접 결찰 분석법. 적색 형광 반점은 NF90-RBM3 상호 작용을 나타냅니다. 화살표는 세포질에서 NF90-RBM3 상호 작용을 보여줍니다. 핵은 DAPI (파란색)으로 대조 하였다. 음성 대조군 1 (NC 1) : 두 일차 항체를 생략 하였다. 음성 대조군 2 (NC 2) : RBM3 단일 차 항체 만. 음성 대조군 3 (NC 3) : NF90 단일 차 항체 만. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
두 방법에 대한 몇 가지 장점뿐만 아니라 단점이있다. 비교적 새로운 기술로서, 인접 결찰 분석법의 명백한 이점은 단일 세포 수준 대신 이기종 셀 배치의 단백질 - 단백질 상호 작용을 규명 할 수있는 가능성이다. 높은 크기 및 (공 초점 현미경으로 예) 해상도의 이미지는 하나의 형광 반점을 계산하여 정량화에 대한 가능성을 제공합니다. 대조적으로, 웨스턴 블랏과 공동 면역 침전 기술의 통상적 인 조합은 단지 적절한 로딩 컨트롤 IP 샘플에 대해 결정하기 곤란하기 때문에, 주로 단백질 밴드를 반 정량 할 수있다. 또한, 단백질 - 단백질 상호 작용은 공 면역 침전 또는 융합 태그 인공 과발현 시스템에 필요한 생체 물질, 예를 들어, 세포 또는 조직, 다량의 상호 작용을 검출 할 수있는 기회를 향상시키기 위해 적용되며, 약하거나 과도 때 . 또한, 검출 t이러한 질량 분석법 등의 고감도 echniques 실험의 품질을 향상시킬 수있다. 그러나, 원료의 양에 대하여 근접 결찰 정량법 명확한 이점을 갖는다. 단지 몇 개의 세포가 필요한 항체의 높은 품질이 제공 제공된다. 또한, 조직 샘플에서, 조직 구조 및 세포 유형에서 다른 단백질 - 단백질 상호 작용의 동일계 시각화 정상적인 면역과 동일한 패턴에 근접 결찰 분석법에 의해 달성 될 수있다. 대조적으로, 공동 면역 침전은 단백질 - 단백질 상호 작용의 공간 분포를 표시 부적당 그 성질이다.
대형 핵 작지만 세포질 구획 셀, 인접 결찰 분석 방법은 핵 세포질 분포 전통적인 공동 면역 침전 분석 자체 우월성을 갖는다 제한된다. 예를 들어 T 림프구 세포주의 예는 Jurkat 세포의 핵 - 세포질 DISTRI핵이 세포 내부의 거의 전체 공간을 차지하기 때문에 인접 결찰 분석 기술에 의해-NF90 RBM3 상호 작용 butions은 제한되고, 세포질 구획의 경계를 확인하기 어렵다. 핵과 세포질의 비율이 매우 불균형 때, 일반적으로 면역 세포에 대한 일반적인 문제가 될 수있다. 그러나,이 상황에서 공동 면역 이러한 제한을받지 않는다.
근접 결찰 분석법에 관한 하나의 특별한 관심은 근접 결찰 분석법에서 신호가 직접 또는 간접적으로 단백질 - 단백질 상호 작용을 나타내는 것인지이다. NF90 및 RBM3 모두 RNA 결합 특성을 가지고 우리의 이전 연구 (7)에보고 된 상호 작용은 RNA에 따라 달라집니다. 따라서,의 RNase와 세포 용 해물의 전처리 NF90 및 RBM3 아무것도 사이의 상호 작용이 공동 면역 침전 법 (7)에 의해 검출 될 수 녹는다. 그러나, 근접 내고 분석 신호는 영향을받지 않습니다RNA 의존성 단백질 - 단백질 상호 작용은 두 단백질 사이의 거리가 일반적으로 직접적인 상호 작용으로 간주 이하가 40nm 인 경우는 생성되는 바와 같이, RNA 종을 잃을지라도. 근접 내고 분석의이 속성은 RNA 중재를 필요로하는 상호 작용을 폐지 할 수있다 세포 용 해물에서의 RNase 자료 등의 공동 면역에서 기술적 인 문제를 극복 할 수 있습니다. RNA의 의존성 단백질 - 단백질 상호 작용이 실제로 생리적 조건에서 특정 RNA의 부족으로 인해 존재하지 않는 경우, 다른 한편으로는, 근접 결찰 분석 방법은 또한 위양성 신호를 생성 할 수있다.
특별한주의가 가치가있는 또 다른 문제는 일차 항체의 특이성 단백질 이성체, 전구체 단백질 응집체의 가능성이다. 우리 NF90에 비해 긴 NF90 이성체, NF110은 (FI 훨씬 덜 풍부 HEK293 세포에서 모두 핵과 세포질하다 웨스턴 블롯에 의해 관찰gure 1). 그러나, 공동 면역 침전은 NF110 높은 결합력 특히 핵 RBM3 위해 풀린다. 세 가지 주요 밴드는 핵에 RBM3의 말에 발견 된, 만 20 kDa의 정상 RBM3 밴드는 주로 세포질에서 관찰되었다. 다른 두 50 kDa의 100 kDa의 밴드가 결합 된 RBM3와 RBM3 이성체, 전구 물질, 단백질 응집체를 반영하거나 인해 불특정 배경에되었는지 밝혀지지 남아있다. 근접 결찰 분석법이 면역에 기초하고 있기 때문에 동시 면역은보다 항체 특이성 또는 단백질 이성체 및 전구체에 대한 추가 정보를 제공 할 수 있지만, 대신, 근접 결찰 분석법, 단백질 이성체, 전구체 응집체 또는 비특이적 염색 상이한 간의 차이를 구별 할 수있다 단백질 - 단백질 상호 작용을 조사하는 근접 결찰 분석법. 핵에서 관찰 세 RBM3 대역을 고려할 때 RBM3에 관해서는, 웨스턴 블롯 결과는 지배적 인 핵와 일치 localizatiRBM3의에 면역 염색으로 관찰.
결론적으로, 모두 공동 면역과 근접 내고 분석 기술은 고유의 장점과 제한이 있습니다. 많은 경우에, 그들은 일관성있는 결과를 생성하지만, 체계적 특정한 단백질 - 단백질 상호 작용을 조사 할 때 두 가지 기술을 사용하는 것이 유리하다. 그러나 특별한 경우 또는 특정 목적으로, 하나는 다른 것보다 우월를 표시 할 수 있습니다. 최근 근접 결찰 분석법 신규 예후 마커 (12)을 개발하는 화면의 단백질 - 단백질 상호 작용에 사용되어왔다. 단백질 - 단백질 상호 작용은 하나의 단백질보다 더 신뢰할 수있는 바이오 마커로 간주됩니다. 이러한 바이오 마커의 동정 및 특성은 여전히 저 종래 공동 immuoprecipication 필요하지만 향후에는 근접 결찰 분석은 잠재적으로, 병원에서의 진단 및 예후 바이오 마커로서 단백질 - 단백질 상호 작용 분석을 위해 신속하고 신뢰할 수있는 방법이 될 수있다THOD.
공개
The authors have nothing to disclose.
감사의 말
This study was supported by the Swiss National Science Foundation (SNSF, 31003A_163305).
자료
| Name | Company | Catalog Number | Comments |
| Dulbecco's Modified Eagle’s Medium (DMEM) | Sigma | D6429 | High glucose 4,500 mg/L |
| Fetal bovine serum (FBS) | Gibco, Thermo Fisher Scientific | 10270106 | |
| Penicillin-Streptomycin (PenStrep) | BioConcept | 4-01F00-H | |
| NE-PER Nuclear and Cytoplasmic Extraction Reagents | Thermo Fisher Scientific | 78833 | |
| 1,4-Dithiothreitol (DTT) | Carl Roth | 6908.3 | |
| Dynabeads Protein G | Novex, Thermo Fisher Scientific | 10003D | |
| DRBP76 (NF90/NF110) antibody | BD Transduction Laboratories | 612154 | use 1:1,000 for WB and 1:100 for ICC/PLA |
| RBM3 antibody | ProteinTech | 14363-1-AP | use 1:1,000 for WB and 1:100 for ICC/PLA |
| Lamin A/C antibody | Cell Signaling Technology | #2032 | use 1:1,000 for WB |
| anti-GAPDH antibody | Abcam | ab8245 | use 1:1,000 for WB |
| normal rabbit IgG | Santa Cruz | sc-2027 | |
| anti-rabbit IgG, HRP-linked secondary antibody | Cell Signaling Technology | #7074 | use 1:5,000 for WB |
| anti-mouse HRP secondary antibody | Carl Roth | 4759.1 | use 1:5,000 for WB |
| Clarity Western ECL Blotting Substrate | Bio-Rad | #1705060 | |
| NuPAGE Novex 4-12% Bis-Tris Gel | Novex, Thermo Fisher Scientific | NP0321BOX | |
| NuPAGE LDS Sample Buffer (4x) | Novex, Thermo Fisher Scientific | NP0007 | |
| NuPAGE MES SDS Running Buffer (20x) | Novex, Thermo Fisher Scientific | NP0002 | |
| NuPAGE Transfer Buffer (20x) | Novex, Thermo Fisher Scientific | NP00061 | |
| Amersham Hypond P 0.2 PVDF membrane | GE Healthcare Life Sciences | 10600021 | |
| Poly-D-Lysine 8 Well Culture Slide | Corning BioCoat | 354632 | |
| Paraformaldehyde (PFA) | Sigma | P6148 | |
| Normal goat serum (NGS) | Gibco, Thermo Fisher Scientific | PCN5000 | |
| Goat anti-mouse IgG (H+L Antibody), Alexa Fluor 488 conjugate | Thermo Fisher Scientific | A-11001 | |
| Goat anti-rabbit IgG (H+L Antibody), Alexa Fluor 568 conjugate | Thermo Fisher Scientific | A-11011 | |
| 4′, 6-Diamidin-2-phenylindol (DAPI) | Sigma | D9542 | |
| Duolink PLA probe Anti-mouse PLUS | Sigma | DUO92001 | |
| Duolink PLA probe Anti-rabbit MINUS | Sigma | DUO92005 | |
| Duolink Detection Reagents Red | Sigma | DUO92008 | |
| Duolink Wash Buffers Fluorescence | Sigma | DUO82049 | |
| Duolink Mounting Medium with DAPI | Sigma | DUO82040 | |
| Mowiol 4-88 | Sigma | 81381 | |
| Microscope | Olympus | AX-70 | |
| CCD camera | SPOT | Insight 2MP Firewire | |
| X-ray film | Fujifilm | Super RX | |
| Film processing machine | Fujifilm | FPM-100A |
참고문헌
- Patiño, C., Haenni, A. L., Urcuqui-Inchima, S. NF90 isoforms, a new family of cellular proteins involved in viral replication? Biochimie. 108, 20-24 (2015).
- Shim, J., Lim, H., R Yates, J., Karin, M. Nuclear export of NF90 is required for interleukin-2 mRNA stabilization. Mol Cell. 10 (6), 1331-1344 (2002).
- Sakamoto, S., et al. The NF90-NF45 complex functions as a negative regulator in the microRNA processing pathway. Mol Cell Biol. 29 (13), 3754-3769 (2009).
- Dresios, J., et al. Cold stress-induced protein Rbm3 binds 60S ribosomal subunits, alters microRNA levels, and enhances global protein synthesis. Proc Natl Acad Sci. 102 (6), 1865-1870 (2005).
- Danno, S., Itoh, K., Matsuda, T., Fujita, J. Decreased expression of mouse Rbm3, a cold-shock protein, in Sertoli cells of cryptorchid testis. Am J Pathol. 156 (5), 1685-1692 (2000).
- Wellmann, S., et al. Oxygen-regulated expression of the RNA-binding proteins RBM3 and CIRP by a HIF-1-independent mechanism. J Cell Sci. 117 (Pt 9), 1785-1794 (2004).
- Zhu, X., Zelmer, A., Kapfhammer, J. P., Wellmann, S. Cold-inducible RBM3 inhibits PERK phosphorylation through cooperation with NF90 to protect cells from endoplasmic reticulum stress. FASEB J. 30 (2), 624-634 (2016).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340 (6230), 245-246 (1989).
- Verhelst, J., De Vlieger, D., Saelens, X. Co-immunoprecipitation of the Mouse Mx1 Protein with the Influenza A Virus Nucleoprotein. J Vis Exp. (98), (2015).
- Söderberg, O., et al. Direct observation of individual endogenous protein complexes in situ by proximity ligation. Nat Methods. 3 (12), 995-1000 (2007).
- Jarvius, M., et al. In situ detection of phosphorylated platelet-derived growth factor receptor beta using a generalized proximity ligation method. Mol Cell Proteomics. 6 (9), 1500-1509 (2007).
- Liu, C. H., et al. Analysis of protein-protein interactions in cross-talk pathways reveals CRKL protein as a novel prognostic marker in hepatocellular carcinoma. Mol Cell Proteomics. 12 (5), 1335-1349 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유