Method Article
Avaliação do dopado com boro Diamante Eletrodo de Qualidade e Aplicação de
Neste Artigo
Resumo
Um protocolo é descrito para a caracterização dos parâmetros eletroquímicos-chave de um diamante dopado com boro (BDD) eletrodo e posterior aplicação em experimentos para geração de pH situ.
Resumo
Diamante dopado com boro (BDD) eletrodos mostraram a promessa considerável como um material de eletrodo, onde muitas de suas propriedades relatadas, tais como janela estendido solvente, baixas correntes de fundo, resistência à corrosão, etc., surgem da natureza cataliticamente inerte da superfície. No entanto, se durante o processo de crescimento, não-diamante-carbono (NDC) fica incorporado na matriz do eléctrodo, as propriedades electroquímicas irá mudar como a superfície torna-se mais cataliticamente activo. Como tal, é importante que o Electroche tem conhecimento da qualidade e resultando propriedades electroquímicas chave do eléctrodo BDD antes da utilização. Este artigo descreve uma série de etapas de caracterização, incluindo microscopia Raman, capacitância, janela solvente e redox eletroquímica, para verificar se o eletrodo de BDD contém insignificante NDC ou seja insignificante sp 2 carbono. Uma aplicação é realçado, que tira proveito da cataliticamente inertee natureza resistente à corrosão de uma superfície NDC-livre, ou seja, de protões locais estável e quantificável e produção de hidróxido devido a eletrólise da água em um eletrodo de BDD. Uma abordagem para medir a alteração local do pH induzida por electrólise da água usando óxido de irídio revestidos eléctrodos de BDD também é descrita em detalhe.
Introdução
Escolha do material de eletrodo é de grande importância na realização de qualquer estudo eletroanalítico. Nos últimos anos, sp 3 carbono (diamante) dopado com boro suficiente para tornar o material "metal-like" tornou-se uma escolha popular para uma ampla gama de aplicações eletroanalíticas devido à sua excelente eletroquímica (e térmicas e mecânicas) propriedades 1,2 , 3. Estes incluem a resistência à corrosão sob extremas solução, temperatura e pressão condições 4 Windows solventes ultra-largas, baixas correntes de fundo, e reduziu a incrustação, em comparação com outros materiais de eletrodo comumente usados 5-7,3. Entretanto, o aumento não-diamante-carbono (NDC: sp 2) resulta de conteúdo em uma janela solvente diminuindo, aumentando 7,8 correntes de fundo, mudanças tanto na integridade estrutural e sensibilidade para diferentes espécies esfera redox internas, por exemplo. oxigénio 9-12.
Nota para assimme aplicações, presença NDC é visto como vantajoso 13. Além disso, se o material não contém boro suficiente irá comportar-se como um semi-condutores do tipo p e mostram uma reduzida sensibilidade a espécie redox na janela potencial redutora, onde o material é mais empobrecido de portadores de carga 7. Finalmente, a química da superfície de diamante dopado com boro (BDD) pode também desempenhar um papel na resposta observada electroquímica. Isto é especialmente verdade para as espécies esfera interna que são sensíveis à superfície química e diminuir diamante dopado em que um átomo de hidrogénio (H -) - superfície terminada pode fazer um eletrodo semicondutor BDD aparecer "metal-like" 7.
Para aproveitar as propriedades superiores de BDD, é frequentemente essencial que o material é suficientemente dopado e contém tão pouco quanto possível NDC. Dependendo do método adotado para crescer o BDD, as propriedades podem variar 14,15. Este artigo sugere um primeiro-primas e um eleitoguia protocolo caracterização rochemical para avaliar BDD eletrodo adequação antes do uso (ou seja, de boro suficiente, minimal NDC) e, em seguida, descreve um aplicativo baseado em localmente mudando pH electroquimicamente usando o eletrodo verificou-protocolo. Este processo aproveita a capacidade de resistência da superfície da NDC-livre BDD à corrosão ou dissolução sob aplicação de extremos aplicado potenciais (ou correntes) por longos períodos de tempo. Em particular, a utilização de um eléctrodo de BDD para gerar protões estável (H +) ou hidróxido (OH -) fundentes devido à electrólise (oxidação ou redução, respectivamente) de água na proximidade de um segundo (sensor) 16,17 é aqui descrito.
Deste modo é possível controlar o ambiente do sensor de pH de uma maneira sistemática, por exemplo, para experiências de titulação de pH, ou para corrigir o pH a um valor em que o processo electroquímico é mais sensível. Este último é especialmente útil paraaplicações em que o sensor é colocado na fonte, por exemplo, rio, lago, o mar e o pH do sistema não é óptimo para a medição electroquímica de interesse. Dois exemplos recentes incluem: (i) a geração de um baixo pH localizado, numa solução de pH neutro, para a electrodeposição de mercúrio e de extracção 17; Observação O BDD é um material preferido para a electrodeposição de metais devido à janela catódica estendida 9,18,19. (ii) Quantificação de forma detectável electroquimicamente de sulfureto de hidrogénio, presente a um pH elevado, aumentando localmente o pH de neutro a fortemente alcalina 16.
Protocolo
NOTA: eléctrodos de BDD são mais cultivados usando técnicas de deposição de vapor químico, ligados a um substrato de crescimento. Eles deixam a câmara de H-terminado (hidrofóbico) crescimento. Se crescido suficientemente espesso o BDD pode ser removido a partir do substrato e é denominado autoportante. A superfície de crescimento BDD independente é muitas vezes polido para reduzir significativamente a rugosidade da superfície. Limpar o BDD no resultado de ácido em um de oxigênio (O) terminadas em superfície.
1. Limpeza Ácida BDD
- Coloque um copo de ácido sulfúrico concentrado (H 2 SO 4; ~ 2 ml ou a uma profundidade suficiente para cobrir o diamante) sobre uma placa quente a temperatura ambiente e inserir o BDD.
- Adicionar o nitrato de potássio (KNO3) até que se dissolva sem mais longos (~ 0,5 g em 2 ml), depois cobrir com um vidro de relógio e de calor para ~ 300 ° C, a solução torna-se castanho enquanto se aquece e o nitrato de potássio irá dissolver.
CUIDADO Cuidados devem ser tomados ao manusear ácido quente!; luvas de borracha, segurança graparigas e jaleco deve ser usado e este processo deve ser conduzido em um exaustor. - Deixar aquecer durante pelo menos 30 minutos ou até que já não há qualquer cor castanha para a solução, depois desligar a placa de aquecimento e deixar a solução arrefecer até à TA.
- Elimine cuidadosamente a ácido por diluição em água a temperatura ambiente e lavar com água destilada BDD.
- Medir o ângulo de contacto com a superfície, ver secção 1.2. Hidrofóbica (terminada-H) 20,21 eléctrodos têm relatado ângulos de contacto na gama de 60-90 ° 3, o que reduz significativamente a que a superfície é tornada hidrófila por meio de O-terminação.
- (método alternativo opcional) Para eléctrodos película muito fina (ligado ao substrato de crescimento e para evitar a delaminação filme usando o tratamento acima), lavar uma vez com 2-propanol e duas vezes com água desionizada num banho de ultra-sons. Em seguida, adotar uma das três seguintes procedimentos de limpeza (1) anodicamente polarizar o diamante durante 30 minutos a 10 mA cm -2 Em 1 M de ácido perclórico a 40 ° C, 22; ou (2) anodicamente polarizar o diamante durante 20 min a 10 mA cm-2 em 1 M de ácido nítrico, seguida posteriormente catodicamente polarizar a 10 mA cm2 durante mais 20 minutos na mesma solução ou 23; (3) ciclo de diamante entre 2 0,1 V em H 2 SO 4, até que um sinal electroquimico estável é conseguido 7. Siga este com o passo 1.4.
Medição 2. Ângulo de Contato
- Coloque o diamante no palco amostra de um analisador de ângulo de contato, garantindo que é plana. Coloque uma seringa de 1 ml no posicionador acima da plataforma da amostra, fixar uma agulha na ponta. Encha a seringa com água deionizada.
- Utilizar o controlador Z para baixar a seringa com a amostra, use o X - e Y - controladores e a câmara / iluminador para alinhar a seringa acima do centro do diamante.
- Usando o software analisador de dispensa repetição 1 ul volumes de água para fora da seringa até se formar uma gota na ponta da agulha, visível na imagem da câmara (nunca superior a 10 ul) em. Diminuir a agulha para depositar a gota sobre a superfície e ajustar a iluminação para contraste máximo.
- Recolha uma imagem e aplicar gota software de análise de forma, utilizando o método de secção cónica. Clique em "encontrar baseline" no software e clique em "computação", seguido de "tangente".
NOTA: Este procedimento detecta a linha de base e se encaixa uma equação cónica para o (elíptica) cair forma; um ângulo de contato, θ, é traçada entre a linha de base e a tangente no ponto de contato de três fases.
3. BDD Caracterização de Materiais
- Análise Raman para sp 2/3 sp conteúdo
- Realizar Raman (ver referência 14 para um guia prático para Espectroscopia Raman) em diversas áreas do eletrodo BDD, 24 utilização de um ou 514,5 nm532 nm do laser, que enfatiza sp 2 conteúdo, é defendida.
- Ligue o espectrômetro micro-Raman e permitir ~ 30 min para o CCD Detector de arrefecer. Verifique a lente apropriada, e os filtros de rede de difracção estão no lugar para utilização com o laser de escolha.
- Calibra-se o sistema utilizando um silício (Si) de uma amostra de calibração. Colocar o substrato de Si na câmara de instrumento e concentrar opticamente sobre a amostra com o microscópio. Feche a porta para a câmara. Mude para vista de laser e verificar o ponto de laser é bem definido e circular. Calibrar usando o software, clique em "Ferramentas" seguido de "calibração" "calibração rápida", em seguida, em seguida, em "OK".
- Remover o substrato de Si a partir da câmara e substituir com o eléctrodo de BDD. Opticamente concentrar o microscópio sobre a área de interesse, mudar para a vista do laser e abrir o obturador para verificar se o laser é focalizada. Feche o obturador.
- Tome uma medição Raman usando o software; click "medição" e depois "novo" e depois "aquisição espectral." definir o intervalo de medição do número de onda para cobrir as características de interesse, para o BDD isto é 200 - de 1.800 cm-1; definir o tempo de aquisição de digitalização (<10 seg); ajustar a potência de laser de 100% (para o BDD) e; definir o número de acumulações (scans de repetição) a cinco (para BDD). Se o espectro resultante é muito ruidoso pode ser necessário mais acumulações. Pressione corrida e salvar o espectro resultante para análise. Tire uma foto da área Raman foi realizada em usar o vídeo ao vivo. Salve a imagem como uma referência.
- Observe os picos de ~ 1.332 cm -1 no espectro que indica sp 3 diamante (Figura 1); o mais amplo o pico mais os defeitos presentes 3,25.
- Observar qualquer NDC - indicado por um pico largo centrado em 1,575 L cm-1 26, nos espectros (Figura 1A e 1B), com origem no alongamento de SP emparelhado 2 locais; quanto maior for a intensidade do pico mais NDC presente.
NOTA: as ligações n formadas por sp 2 C são mais polarizável do que sp 3 σ títulos e são ressonantemente reforçada por lasers visíveis, levando a mais ampla, mais dominante, G 25 picos. Note-se que o método exato usado para realizar análises podem variar entre diferentes instrumentos e software.
4. Caracterização eletroquímica
- Preparando contatos ôhmicas
- Freestanding BDD
- Usando técnicas padrão descarga eléctrica (ou evapora-se) a parte traseira da BDD com titânio (Ti) / ouro (Au) de 10 nm / 300 nm, utilizando um sputterer / evaporador a pressões abaixo de 1 x 10 ~ 5 mbar. Se uma fonte de três destino está disponível, mais idealmente é Ti 10 nm / platina (Pt) de 10 nm / Au 300 nm para evitar a difusão de Ti para o Au.
- Hibridar durante 5 h a 400 ° C (pressão atmosférica), que permite o Ti para formar carboneto de titânio, CrucIAL para a formação de um contato ôhmico 27.
NOTA: se a superfície traseira do BDD é altamente polido (~ nm rugosidade), então é preferencialmente para encrespar a superfície antes da deposição por pulverização catódica para garantir um revestimento mais robusto. Isto pode ser conseguido, por exemplo, laser de baixa potência Micromachining a superfície (remoção de <30 uM de material).
- Diamante fina película cultivadas num substrato condutor
- Sputter / evaporar como acima, mas com a face superior, utilizando uma máscara de sombra coloque delicadamente sobre a superfície superior para evitar entrar em contato com todo o topo do eletrodo.
OU - Raspe a parte de trás do substrato condutor utilizando uma caneta de ponta de diamante. Então, cubra a área riscada com a realização de Ag colar ou uma tinta condutora semelhante pintando em uma camada fina com um pincel pequeno. Finalmente, conectar eletricamente, anexando os fios de cobre com epóxi condutor.
Nota: Há uma variedade de maneiras de preparar o BDD depois de eleitosRical contacto, tal como descrito na Referência 4, por exemplo, se o BDD pode ser maquinada em estruturas mais pequenas, no selo de vidro ou epóxi, ou se ainda ligado ao grampo de bolacha / anexar uma célula electroquímica para a superfície superior.
- Sputter / evaporar como acima, mas com a face superior, utilizando uma máscara de sombra coloque delicadamente sobre a superfície superior para evitar entrar em contato com todo o topo do eletrodo.
- Freestanding BDD
- Medidas de capacitância
- Preparar uma solução de 20 ml de 0,1 M KNO 3, pesando 0,20 g em água bidestilada (esta qualidade de água ao longo é recomendado, resistividade 18,2 M cm). Limpe o eletrodo antes do uso, quer por polimento alumina ou por via electroquímica ciclismo em ácido diluído (ver secção 1 NOTA) 16,23,28.
- Usando um potenciostato executar voltamogramas cíclicos (CV) de 0,1 V seg -1 entre -0,1 V e 0,1 V, a partir de 0 V, com o BDD como o eléctrodo de trabalho em comparação com um eléctrodo de referência comum, por exemplo, prata / cloreto de prata (Ag / AgCl ) ou um eléctrodo de calomelanos saturado (SCE), e um contra-eléctrodo de Pt. Analisar o segundo CV.
NOTA: A Figura 2A Mostra uma curva típica capacitância gravado com um metálico autoportante dopado eletrodo BDD. - Medir a magnitude total atual a 0 V a partir da curva capacitância gravado e dividir por dois, este valor é "i". Determine a capacitância, C, usando o valor para i, com a equação 1, normalizar em relação ao eléctrodo de área (representando rugosidade da superfície, se for o caso) e citação em iF cm -2. Alta qualidade, "metal-like" BDD tem uma capacitância << 10 iF cm -2. Use todos os dados de plotagem software para apresentar e analisar os dados.
i = C (Vt-1) (1 eq.);
onde i é a corrente (A) e (V -1 t) é a taxa de varrimento potencial.
- Janela solvente
- Limpe o eletrodo como no passo 4.2.1. Usando um potenciostato executar um CV de 0,1 M KNO 3 a 0,1 V s-1 a partir de 0 V para V -2 -2 então entre V e V 2 umnd de volta para 0 V com o BDD como o eletrodo de trabalho versus um eléctrodo de referência comum e contra-eletrodo Pt. Repetir. Analisar o segundo CV, um exemplo CV é mostrado na Figura 2B.
- Converter a atual densidade de corrente (mA cm -2), tendo em conta a rugosidade da superfície, e citar a janela solvente como a janela potencial definido por limites atuais de ± 0,4 mA cm-2 em ambas as direções. 7,29 Use todos os dados de plotagem software apresentar e analisar os dados.
- Observar a evidência da NDC (sp 2 carbono) na janela de solvente; a reação de redução de oxigênio é favorecido em NDC que é claramente evidente na janela redutora. Oxidação de SP 2 contendo grupos também resulta em picos característicos pouco antes da electrólise da água na janela anódica (Figura 2B).
NOTA: alta qualidade "metálicos" eletrodos de BDD têm janelas de solventes >> 3 V, não suportam a reac redução de oxigêniomento (TRG) em 0,1 M KNO 3 (ou TRG é fortemente retardado cineticamente) e mostram insignificantes assinaturas de oxidação do NDC.
- Redox Eletroquímica
- Limpe o eletrodo como no passo 4.2.1.
- Usando um recorde potencióstato CVs em 1 mM de rutênio hexaamine (Ru (NH3) 6 3+) e 0,1 M KNO 3 entre 0,2 V e -0,8 V versus SCE, por taxas de varredura na faixa de 0,05 V sec -1 - 0,2 V seg -1.
NOTA: Este casal mostra a transferência de elétrons rápido e é eletroativo em uma região que desafia p-tipo semicondutor BDD. sp 2 contendo o BDD também irá mostrar ORR nesta região, o sinal para o último é mais evidente à medida que a concentração de Ru (NH3) 6 3+ é diminuída. - Medir a separação entre a voltagem anódica e catódica de corrente de pico (Δ E P) do CV gravada, e a temperatura, tal como descrito 20.Para "metal-like" ohmically contactado BDD terminada com oxigênio a 298 K, E Δ p <70 mV 30,31. Maiores valores de p Δ E são sintomáticas de um contacto óhmico pobre ou um teor de boro inferior, como mostrado na Figura 2C para eléctrodos de BDD densidades de contaminantes na gama de 9,2 x 10 16 a 3 x 10 20 cm -3 B átomos.
- Medir a corrente de pico da varredura para a frente, i p, e correlacionar com o esperado a partir da equação Randles Sevcik 2 (cotado a 298 K) 3,30, assumindo o eletrodo está em geometria e grande o suficiente em forma de disco (1 mm de diâmetro) que a difusão linear domina. Use todos os dados de plotagem software para apresentar e analisar os dados.
i p = 2,69 × 10 5 n 3/2 AD 1/2 1/2 cv (eq 2)
onde né o número de electrões transferidos, A é a área (cm2), D é o coeficiente de difusão (cm2 s @ 1), c é a concentração (mol cm -3) e v é a taxa de varrimento (V seg -1).
5. pH Generation: Preparação de pH Eletrodo sensível e pH Geração
- Oxide Iridium (pH sensível) Solução Preparação
- Prepare uma solução de KNO 3 20 ml de 0,1 M como no ponto 5.4.1. Adicione 5 gotas de solução indicadora de fenolftaleína, utilizando uma pipeta Pasteur e mexa (isto é suficiente para ver uma resposta por olho, mas para uma cor mais intensa, adicionar mais gotas). Coloque o eletrodo de trabalho BDD e contra eletrodo de Pt em solução.
- Ajustar o pH da solução a 10,5 pela adição de sal de cloreto de potássio anidro, agitando continuamente. Deixar coberto e agitação durante 48 horas à temperatura ambiente para estabilizar, nesta fase, a solução irá, gradualmente, vai de amarelo para verde-azul-violeta. Conservar no frigorífico a 3 ° C.
- pH sensível Óxido Iridium Film Deposição
- Usando um potenciostato executar um CV na solução de óxido de irídio e entre 0 V 1 V versus SCE para determinar o potencial a que a corrente máxima é gravado. Este é o potencial de deposição, E dep como mostrado na Figura 3A, tipicamente situada entre + 0,6 V ~ - 0,85 V; ela pode variar dependendo de um número de factores tais como a temperatura, o material do eléctrodo, etc. 32, 33
- Usando cronoamperometria com um potenciostato, o passo do potencial de 0 V ("E inicial" e "baixa E" no software), onde não electrólise ocorre a E dep ("High E" no software), por um período de tempo de 0,2 s por passo, repita 100x.
- Executar um CV entre 0 V e 1 V em 0,1 MH 2 SO 4 para o IrO x depositado eletrodo. O personagemforma istic CV é mostrado na Figura 3B. Uma densidade de corrente no intervalo de ~ 0,6 mA cm-2 - 0,7 mA cm2 para o primeiro pico anódica (correspondendo a uma espessura de película média de ~ 8 nm para 0,7 mA cm-2), indica uma película sensível ao pH estável 34, 35.
- Se a densidade de corrente é menor do que 0,6 mA cm2 repetir os passos 5.2.2 - 5.2.4 até esse valor seja atingido. Deixar o eléctrodo em solução tampão de pH 7, durante 24 horas para hidratar como a resposta do filme é IrO x 33 dependente de hidratação.
- IrO x Film pH Caracterização
- Prepara-se uma série de soluções tampão, que cobrem a gama de pH de interesse (pH 2 - pH 12), estes elementos podem ser feitos em casa (por exemplo, Carmody 36) ou adquiridos comercialmente.
- Lave o eletrodo com água destilada. Colocar o eléctrodo IrO x e eléctrodo de referência na solução tampão de pH mais baixo. Usando um potenciostatoregistrar o potencial de circuito aberto (OCP) ao longo de 30 segundos, com três repetições. Retire o eletrodo da solução, enxaguar e lugar no próximo buffer.
- Repita o passo 5.3.2 para cada buffer, em seguida, repita a série, pelo menos, duas vezes. Plot pH vs. OCP, a curva de calibração para a resposta filme. Um filme IrO x apresenta uma inclinação com um gradiente entre 59 - 80 mV por década 37.
NOTA: A Figura 3C mostra uma trama exemplo calibração de um sensor de pH IrO x sucesso no BDD.
- Utilizando um gerador de pH e medição do sistema
NOTA: esta assume a utilização de um sistema de eléctrodo duplo onde um eléctrodo é revestido com a película IrO x (por exemplo, disco) e o segundo (por exemplo, anel de BDD) vai gerar H + ou OH - galvanostaticamente da electrólise da água.- Prepara-se uma solução de KNO 3 20 ml de 0,1 M por adição de água desionizada para o sal. Conecte o IrO x revestidoeléctrodo como o eléctrodo de trabalho num sistema de dois eléctrodos, com o segundo eléctrodo estável um eléctrodo de referência SCE, por exemplo. Medir a OCP usando um potenciostato, para estabelecer o pH de partida.
- Conecte o eletrodo gerador a um sistema galvanostático dois eletrodos adequado com um eléctrodo contador, por exemplo folha de Pt, e repita o passo 5.4.1, mas depois de um período de tempo definido aplicar uma corrente ao eletrodo gerador.
NOTA: encontramos correntes na faixa de 0 a ± 50 mA são adequados com os nossos eletrodos de BDD; correntes maiores resultam numa libertação de gás apreciáveis. A magnitude e direção da corrente depende do resultado desejado; uma corrente positiva irá resultar num desvio de pH mais ácido e uma corrente negativa a pH mais alcalino, quanto maior for a corrente maior será a mudança do pH. - Usando o potenciostato, gravar a mudança de OCP em resposta à atual galvanostático, espere até que a resposta se estabiliza. Em seguida, coloque o IrO x eléctrodo em tampão de pH 7, durante 10 minutos para re-equilibrar a IrO x filme.
- Repita os passos 5.4.2 a 5.4.3 com diferentes correntes aplicadas, até que todos os dados necessários foram coletados. Traçar os dados usando a curva de calibração obtida no ponto 5.3 para converter OCP para um pH de, um conjunto de dados de exemplo é mostrado na Figura 4A. Retire a película IrO x usando polimento alumina ou pulsando em 0,1 MH 2 SO 4 a partir de 2 V para -2 V para 0,2 seg, × 100. Aplicar ao sistema de medição de interesse.
- Avaliação visual da geração de pH local
- Prepare uma solução de KNO 3 20 ml de 0,1 M como no ponto 5.4.1. Adicione 5 gotas de solução indicadora de fenolftaleína, utilizando uma pipeta Pasteur e mexa (isto é suficiente para ver uma resposta por olho, mas para uma cor mais intensa, adicionar mais gotas). Coloque o eletrodo de trabalho BDD e contra eletrodo de Pt em solução.
- Aplicar uma corrente de negativo para o eléctrodo de trabalho usandoum galvanostato que no passo 5.4.2 (por exemplo, ~ -0,6 mA cm-2) de modo a que a solução muda de cor de incolor para cor de rosa. Esta localmente gera agora uma solução que é a pH ≥ 10,5.
- Repita o passo 5.5.1 com 5 gotas de solução de vermelho de metilo em vez de fenolftaleína e mexa. Aplicar uma corrente (por exemplo, ~ 6,6 mA cm-2) suficientemente positivo tal que a solução muda de cor de amarelo para vermelho. Isto gera localmente agora uma solução que é a pH 4,2 ≤ 38.
Resultados
Espectros e eletroquímicos características Raman foram obtidos para representativos eletrodos macrodisc BDD com diferentes densidades dopantes, e ambos os níveis significativos e insignificantes de NDC, Figuras 1 e 2. As figuras 1A e B mostram os dados típicos Raman para NDC contendo microcristalina película fina BDD e maiores de grãos autoportante BDD, dopado acima do limiar metálico, respectivamente. A presença de NDC é identificável pelas grandes picos marcados entre 1400 e 1600 centímetros -1; não existe tal pico visível na Figura 1C, que mostra a assinatura típica de Raman NDC-livre, autônomo BDD. Em todas as três espectros na Figura 1 é possível observar um pico acentuado em 1.332 cm-1, isso é o pico de assinatura de carbono sp 3 (diamante); assimetria da linha de base em torno deste pico é conhecido como uma "ressonância Fano"E, se presente indica que a amostra é adequadamente dopados (10 20 cm -3 átomos de B) para utilização em estudos electroquímicos. Este é o caso para todos os três eléctrodos apresentados aqui.
Na Figura 2 dados de exemplo para os estudos eletroquímicos (capacitância, janela solvente e currículos registrados no mediador redox Ru (NH3) 6 3+) são apresentados tanto para NDC contendo e NDC-livre BDD, dopado acima do limiar metálico. As curvas de capacitância na figura 2a indicam claramente que a NDC contendo BDD apresenta uma corrente capacitiva maior do que a NDC-livre BDD. As capacitâncias para cada foi calculado conforme descrito no texto e são cotados na Figura 2A como 10,8 iF cm -2 (NDC-contendo) e 6,3 cm -2 iF (NDC-free) do BDD. Alta qualidade, baixo NDC-content, eletrodos de BDD são esperados para ter uma capacitância << 10 iF cm -2. Da mesma forma, a figura 2B compara as janelas de solventes exemplar NDC contendo eletrodos e NDC-livres BDD. Pode ser visto que para um eléctrodo NDC contendo o aparecimento de H2O oxidação e redução foi apresentado em forma significativa, diminuindo a janela solvente. Também digno de nota é o aparecimento de picos anódicos devido à oxidação da NDC e um pico devido a ORR catódica que é catalisada no NDC mas não na de carbono sp 3. Para um eléctrodo de alta qualidade com o BDD negligenciável NDC se espera que a janela de solvente a ser >> 3 V em solução aquosa de KNO 3. Na Figura 2C a resposta CV de eléctrodos BDD com uma variedade de níveis de dopagem são investigados utilizando o mediador redox Ru (NH3) 6 3+. Para eléctrodos BDD dopado metálico acima do limiar, a separação entre a tensão anódica e catódica picos de corrente deverá ser de cerca de 59 mV, de acordo com a equação de Nernst; HoweVer, como o nível dopante diminui o material torna-se esvaziada de portadores de carga que resulte num aumento na separação entre picos.
A macrodisc BDD, revestidos em IrO x, foi usado para gravar os dados na Figura 3, enquanto todos diamante (BDD isolados no diamante) 39 eletrodos duplos e um epóxi selado BDD eletrodo disco anel foram utilizados para os experimentos de geração de pH na Figura 4A. Os dados na Figura 3 ilustra o processo de deposição e caracterização para um pH sensível IrO x filme sobre o BDD. Na Figura 3A um CV típico gravado na solução x IrO deposição é mostrado. O potencial empregue para subsequente IrO x deposição pode ser identificada a partir da posição do pico de corrente de oxidante, como aqui ilustrado. A Figura 3B é uma CV exemplar em ácido sulfúrico de um IRO x filme electrodepósitoed no BDD. A forma do CV é característica de uma película depositada com sucesso com a densidade de corrente de pico do fornecimento de informações sobre espessura da película. Uma densidade de corrente mais elevada indica uma película mais espessa. A estabilidade da película depende da espessura; muito fina ea resposta pH vai nos levar, muito grosso eo tempo de resposta filme vai ser lento e que o filme pode descamar. Um valor de pico de densidade de corrente de 0,7 mA cm ~ -2 foi mostrado para indicar uma película estável com uma excelente resposta de pH. A resposta OCP da camada IrO x sobre um eléctrodo de BDD para diferentes tampões de pH é mostrado na Figura 3C. O desvio entre as medições é pequeno, tal como evidenciado pela dimensão das barras de erro e a inclinação é super-Nernstiana (> 59 mV) tal como esperado para este tipo de película.
Finalmente, a Figura 4 ilustra a utilização de um eléctrodo para o BDD geração de pH. Na Figura 4A do pH me mudareléctrodo BDD asured numa IrO x revestidos é apresentada para uma gama de correntes aplicadas ao eléctrodo BDD geração pH colocado nas proximidades, quer no anel ou formato de banda, tal como ilustrado na Figura 4. Para diferentes correntes aplicadas, o pH pode ser alterada localmente e quantificável de um valor de partida (quase neutro) a ácido ou alcalino. Este processo pode ser observada visualmente como ilustrado na Figura 4B, em que uma densidade de corrente apropriada é aplicada a um eléctrodo de BDD para alterar o pH de próximo do neutro até> 10,5. Na presença de fenolftaleína (indicador de pH), isso resulta na solução vai de incolor para cor de rosa, na vizinhança do eléctrodo.
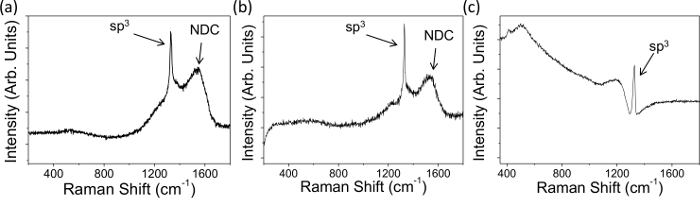
Figura 1. Os dados típicos de Raman gravados com um laser de 514 nm (A) contendo NDC fina BDD microcristalina filme ligado ao substrato de crescimento (DOPdensidade formiga 1,9 × 10 20 átomos de boro cm -3) e (B, C) maior de grãos autônomo BDD, média densidade dopante 1,9 × 10 20 e 3 × 10 20 átomos B cm -3, respectivamente. NDC é evidente em (A) e (B), devido à presença dos picos marcados NDC entre 1.400 e 1.600 cm-1, (C) contém negligenciável NDC. Todos os três eléctrodos mostram uma "ressonância Fano" e, assim, são apropriadamente dopado com boro para estudos electroquímicos 7. Reproduzido em parte de referência [4c] com permissão. Por favor clique aqui para ver uma versão maior desta figura.
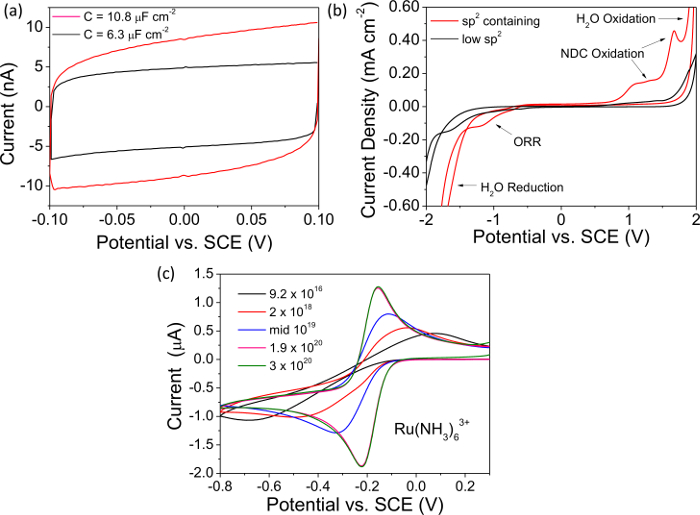
Figura 2. Caracterização eletroquímica. Todos os dados representativos em ( A, B) foi gravada em isolamento de diamante envolto rescindido-O eletrodos de BDD dopados acima do limiar metálico ou seja, 10 20 B átomos cm -3 39. (A) curvas de capacitância para NDC-livre BDD onde C = 6.3 uF cm-2 (preto), e para NDC contendo BDD onde C = 10,8 iF cm-2 (vermelho). (B) janelas de solventes representativos para NDC-livre BDD, a janela solvente> 3,95 V (preto) e para NDC contendo BDD, a janela solvente = 3,22 V (vermelho). (C) CV registada em 1 mM Ru (NH3) 6 3+ a 0,1 V s-1 para selado autoportante BDD macrodisc eléctrodos de diferentes densidades de boro contaminantes na gama de vidro de 9,2 x 10 16 - 10 3 × 20 cm átomos B - 3. Reproduzido em parte de referência [4c] com permissão. Clique aqui para ver uma versão maior desta figura.

Figura 3. Caracterização de IrO deposição x filme sobre BDD e resposta pH. (A) CV em IrO x solução antes da deposição. A corrente máxima de oxidação proporciona um valor para o potencial de deposição, E dep, onde a formação da película é encontrada para ser mais eficiente. Usando potenciais> E dep, resulta em um filme depositado instável. (B) CV característica para um IrO x filme electrodepositada em 0,1 MH 2 SO 4 gravado em 0.1 V s-1; i p, a é tipicamente ~ 0,7 mA cm -2. (C) Calibrag pH Representantecurva n (R 2 = 0,997) para electrodepositada IrO x em um eletrodo de BDD autônomo. O declive mostra uma resposta de super-Nernstiana (65,4 mV) ao pH. As pequenas barras de erro (n = 3) indicam estabilidade do filme e reprodutibilidade nas medições. Por favor clique aqui para ver uma versão maior desta figura.
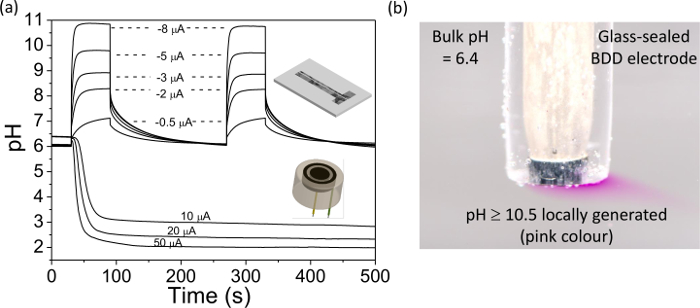
Figura 4. Uso de um disco anel BDD independente e eletrodos de banda dupla no controle de pH situ BDD eletrodo disco anel, diâmetro do disco = 0,922 milímetros, separação = 0,262 milímetros e largura do anel = 0,150 milímetros.; BDD gerador eletrodo banda = 0,460 × 3 mm, detector = 0,09 × 3 mm, e separação = 0,2 mm. (A) pH medido experimentalmente contra o perfil de tempo ao longo dos eletrodos detectores como uma functiem aplicados de galvanostáticas correntes (10 a 50 mA no eletrodo disco anel e -0,5 a -8 mA para o eletrodo de banda dupla). Note-se a pH estável gerado durante longos períodos de tempo. Reprodução de modificação de referências [9º-A] e [9b]. (B) a visualização simples de geração em pH situ utilizando solução de indicador fenolftaleína; uma corrente de -4.55 -0.58 (uA mA cm2) foi aplicada a um vidro de 1 mm de diâmetro selado BDD macroelectrode. A cor rosa indica pH≥10.5, solução incolor indica pH≤8.4 38. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Começando com uma superfície terminada-O é defendida porque a superfície de terminada-H é electroquimicamente instável, especialmente em altas potenciais anódicos 7,40,41. Alterando terminação superfície pode afectar a cinética de transferência de electrões de casais esfera interna, tais como a electrólise da água (aqui utilizados para mudar a solução de pH local). Além disso, se o BDD contém NDC significativa nos contornos de grão é também possível que, após a aplicação do extremo anódico / catódico potenciais defendido neste artigo para geração de pH, decapagem podia ocorrer nesses pontos mais fracos. Isso faria com que o filme para corroer e de filmes finos, eventualmente, delaminate, manifestando-se em um perfil instável geração pH, como visto com película fina de Au e Pt eletrodos 17. Assim, um protocolo rigorosa para avaliar a qualidade do eléctrodo antes de utilização é adoptada para avaliar o conteúdo de NDC como discutido nas Figuras 1 (Raman) e 2 (capacitance e janela solvente).
Também de importância é o teor de boro. Se o material é dopado abaixo do limiar metálico (<10 B 20 átomos cm -3), será carga esvaziada, a potenciais negativos do potencial flatband, resultando num decréscimo no desempenho electroquímico 7,42. A maneira mais fácil de avaliar qualitativamente os níveis de dopagem metálico é olhar para a presença de uma assinatura Fano que provoca assimetria no pico sp 3, no espectro de Raman, como mostrado na Figura 1 (AC). Isto é devido à interferência entre o estado phonon discreto eo contínuo eletrônico e é visto em níveis de boro doping> 10 20 B átomos cm -3 43. Espectrometria de massa de íons secundários (SIMS), em última análise quantifica teor de boro, mas é destrutivo e mais intensivo de usar. Observe como SIMS fornece conteúdo total de boro que não leva em conta eventuais reduções no número de livremente availabltransportadoras e de carga devido à compensação ou passivation de boro aceitantes com doadores compatíveis, tais como nitrogênio ou hidrogênio 45 44, respectivamente.
Electroquimicamente, diferenças de densidade dopantes pode ser visualizado por emprego de uma esfera exterior de electrões rápida transferência par redox cujo potencial formal reside dentro do intervalo de banda de O-terminado semicondutor BDD, tal como Ru (NH3) 6 3 + / 2 + 46. Por exemplo, como mostrado na Figura 2C, pois os níveis de dopagem de aumento do eléctrodo BDD, e o material se move a partir de semi-condutores metálicos para a corrente aumenta e o pico a pico de separação diminui à medida que a transferência de electrões torna-se mais fácil. Em níveis dopantes metálicos do eléctrodo deve mostrar um comportamento semelhante a um eletrodo clássico onde, por um mediador, como Ru (NH3) 6 3+, difusão reversível CVs limitados são gravados a uma macroelectrode em solutio estacionárian. Note-se, em níveis de dopante boro ~ 10 19 perto de comportamento reversível foi gravado, mas apenas para superfícies H-terminados. Isto é devido a uma particularidade interessante desta superfície onde H terminada faz com que os níveis de energia das bandas de condução e de valência em diamante para ser levantada. Isto significa transferência de elétrons da banda de valência para H 3 O + é agora possível, resultando na transferência de superfície doping e uma condutividade de superfície mensurável. No entanto, devido à instabilidade electroquímico da superfície de terminada-H, especialmente em altos potenciais anódicos, trabalhando com H-terminados eléctrodos de densidade inferior dopantes não é uma abordagem viável a longo prazo 7,40,41.
A capacidade de modificar o pH local do eléctrodo de medição tem muitas aplicações diferentes, por exemplo experiências de titulação de pH locais agora se tornaram possíveis em que o pH pode ser sistematicamente modificado e o impacto sobre o sistema electroquimicamente avaliadas in situ . Íons metálicos ligados pode ser libertado por diminuição do pH permitindo o eletrodo sensor para avaliar tanto o conteúdo de metal gratuitamente no pH natural e teor total de metal, diminuindo localmente valores para muito ácidas, in situ 47-50. Isto é muito útil para as medições de origem. Além disso, as espécies podem ser comutados de não ser detectável electroquimicamente para detectável em virtude da alteração do pH local, por exemplo, sulfureto de hidrogénio dissolvido converte completamente à forma sulfureto detectável electroquimicamente a valores de pH> 9 16. No exemplo dado, para as geometrias dos eléctrodos empregue , mudanças de pH mais de 4 unidades (de 6,4 para 2,0 e 6,0 para 10,8) foram demonstrados. Aumentos maiores são possíveis através do aumento da corrente galvanostática e alterando as geometrias dos eléctrodos. Por exemplo, diminuindo a distância entre o gerador e os eléctrodos detectores e reduzindo o tamanho relativo do detector irá permitir que os valores de pH menor / maior a ser atingido. A façanhaure tamanho do eléctrodo BDD será limitada pela resolução da técnica de fabrico empregue. Note-se, também existe um limite superior para o tamanho da corrente capaz de ser passada para a geração de pH estável. Este é ditada pela corrente em que é observada a libertação de gás e a formação de bolhas significativa no eléctrodo gerador.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
Gostaríamos de agradecer ao Dr. Jonathan Newland para a fotografia na Figura 4B e para o processamento de imagens de microscópio óptico para o vídeo, Senhorita Jennifer Webb para o conselho e visuais sobre medidas de ângulo de contato, senhorita Sze-yin tan para a janela solvente dados da figura 2B , o Dr. Joseph Maxim para aconselhamento sobre espectroscopia Raman, e também membros da Warwick Eletroquímica e Interfaces Grupo que ajudaram a desenvolver os protocolos aqui descritos. Gostaríamos também de agradecer Max Joseph, Lingcong Meng, Zoe Ayres e Roy Meyler por sua parte em filmar o protocolo.
Materiais
| Name | Company | Catalog Number | Comments |
| Pt Wire | Counter Electrode | ||
| Saturated Calomel Electrode | IJ Cambria Scientific Ltd. | 2056 | Reference Electrode (alternatively use Ag|AgCl) |
| BDD Electrode | Working Electrode | ||
| Iridium Tetrachloride | VWR International Ltd | 12184.01 | |
| Hydrogen Peroxide | Sigma-Aldrich | H1009 | (30% w/w) Corrosive |
| Oxalic Acid | Sigma-Aldrich | 241172 | Harmful, Irritant |
| Anhydrous Potassium Chloride | Sigma-Aldrich | 451029 | |
| Sulphuric Acid | VWR International Ltd | 102765G | (98%) Corrosive |
| Potassium Nitrate | Sigma-Aldrich | 221295 | |
| Hexaamine Ruthenium Chloride | Strem Chemicals Inc. | 44-0620 | Irritant |
| Perchloric Acid | Sigma-Aldrich | 311421 | Oxidising, Corrosive |
| 2-Propanol | Sigma-Aldrich | 24137 | Flammable |
| Nitric Acid | Sigma-Aldrich | 695033 | Oxidising, Corrosive |
| Sputter/ Evapourator | With Ti & Au targets | ||
| Raman | 514.5 nm laser | ||
| Annealing Oven | Capable of 400 °C | ||
| Ag paste | Sigma-Aldrich | 735825 | or other conductive paint |
| Potentiostat | |||
| pH Buffer solutions | Sigma-Aldrich | 38740-38752 | Fixanal buffer concentrates |
| Phenolphthalein Indicator | VWR International Ltd | 210893Q | |
| Methyl Red Indicator | Sigma-Aldrich | 32654 |
Referências
- Angus, J. C., Brillas, E., Huitle, C. A. M. Ch. 1, Synthetic Diamond Films: Preparation, Electrochemistry, Characterization and Applications. Electrochemistry on diamond: History and current status. , (2011).
- Fujishima, A. . Diamond Electrochemistry. , (2005).
- Macpherson, J. V. A practical guide to using boron doped diamond in electrochemical research. Physical Chemistry Chemical Physics. 17 (5), 2935-2949 (2015).
- Balmer, R. S., et al. Chemical vapour deposition synthetic diamond: materials, technology and applications. Journal of Physics: Condensed Matter. 21 (36), 364221 (2009).
- Swain, G. M., Ramesham, R. The electrochemical activity of boron-doped polycrystalline diamond thin film electrodes. Analytical Chemistry. 65 (4), 345-351 (1993).
- Luong, J. H. T., Male, K. B., Glennon, J. D. Boron-doped diamond electrode: synthesis, characterization, functionalization and analytical applications. Analyst. 134 (10), 1965-1979 (2009).
- Hutton, L. A., et al. Examination of the Factors Affecting the Electrochemical Performance of Oxygen-Terminated Polycrystalline Boron-Doped Diamond Electrodes. Analytical Chemistry. 85 (15), 7230-7240 (2013).
- Bennett, J. A., Wang, J., Show, Y., Swain, G. M. Effect of sp2-Bonded Nondiamond Carbon Impurity on the Response of Boron-Doped Polycrystalline Diamond Thin-Film Electrodes. Journal of The Electrochemical Society. 151 (9), E306-E313 (2004).
- Martin, H. B., Argoitia, A., Landau, U., Anderson, A. B., Angus, J. C. Hydrogen and Oxygen Evolution on Boron-Doped Diamond Electrodes. Journal of The Electrochemical Society. 143 (6), L133-L136 (1996).
- Panizza, M., Cerisola, G. Application of diamond electrodes to electrochemical processes. Electrochimica Acta. 51 (2), 191-199 (2005).
- Williams, O. A. Nanocrystalline diamond. Diamond and Related Materials. 20 (5-6), 5-6 (2011).
- Patel, A. N., Tan, S. -. y., Miller, T. S., Macpherson, J. V., Unwin, P. R. Comparison and Reappraisal of Carbon Electrodes for the Voltammetric Detection of Dopamine. Analytical Chemistry. 85 (24), 11755-11764 (2013).
- Watanabe, T., Honda, Y., Kanda, K., Einaga, Y. Tailored design of boron-doped diamond electrodes for various electrochemical applications with boron-doping level and sp2-bonded carbon impurities. physica status solidi (a). 211 (12), 2709-2717 (2014).
- Poferl, D. J., Gardner, N. C., Angus, J. C. Growth of boron-doped diamond seed crystals by vapor deposition. Journal of Applied Physics. 44 (4), 1428-1434 (1973).
- Spitsyn, B. V., Bouilov, L. L., Derjaguin, B. V. Vapor growth of diamond on diamond and other surfaces. Journal of Crystal Growth. 52 (Pt 1), 219-226 (1981).
- Bitziou, E., et al. In Situ Optimization of pH for Parts-Per-Billion Electrochemical Detection of Dissolved Hydrogen Sulfide Using Boron Doped Diamond Flow Electrodes. Analytical Chemistry. 86 (21), 10834-10840 (2014).
- Read, T. L., Bitziou, E., Joseph, M. B., Macpherson, J. V. In Situ Control of Local pH Using a Boron Doped Diamond Ring Disk Electrode: Optimizing Heavy Metal (Mercury) Detection. Analytical Chemistry. 86 (1), 367-371 (2014).
- Manivannan, A., Tryk, D., Fujishima, A. Detection of Trace Lead at Boron-Doped Diamond Electrodes by Anodic Stripping Analysis. Electrochemical and solid-state letters. 2 (9), 455-456 (1999).
- Manivannan, A., Seehra, M. S., Tryk, D. A., Fujishima, A. Electrochemical detection of ionic mercury at boron-doped diamond electrodes. Analytical Letters. 35 (2), 355-368 (2002).
- Boukherroub, R., et al. Photochemical oxidation of hydrogenated boron-doped diamond surfaces. Electrochemistry Communications. 7 (9), 937-940 (2005).
- Yagi, I., Notsu, H., Kondo, T., Tryk, D. A., Fujishima, A. Electrochemical selectivity for redox systems at oxygen-terminated diamond electrodes. Journal of Electroanalytical Chemistry. 473 (1), 173-178 (1999).
- Duo, I., Levy-Clement, C., Fujishima, A., Comninellis, C. Electron Transfer Kinetics on Boron-Doped Diamond Part I: Influence of Anodic Treatment. Journal of Applied Electrochemistry. 34 (9), 935-943 (2004).
- Mahé, E., Devilliers, D., Comninellis, C. Electrochemical reactivity at graphitic micro-domains on polycrystalline boron doped diamond thin-films electrodes. Electrochimica Acta. 50 (11), 2263-2277 (2005).
- Vandenabeele, P. . Practical Raman spectroscopy: an introduction. , (2013).
- Filik, J. Raman spectroscopy: a simple, non-destructive way to characterise diamond and diamond-like materials. Spectroscopy Europe. 17 (5), 10 (2005).
- Tuinstra, F., Koenig, J. L. Raman Spectrum of Graphite. The Journal of Chemical Physics. 53 (3), 1126-1130 (1970).
- Tachibana, T., Williams, B., Glass, J. Correlation of the electrical properties of metal contacts on diamond films with the chemical nature of the metal-diamond interface. II. Titanium contacts: A carbide-forming metal. Physical Review B. 45 (20), 11975 (1992).
- Zivcova, Z. V., et al. Electrochemistry and in situ Raman spectroelectrochemistry of low and high quality boron doped diamond layers in aqueous electrolyte solution. Electrochimica Acta. 87, 518-525 (2013).
- Granger, M. C., et al. Standard Electrochemical Behavior of High-Quality, Boron-Doped Polycrystalline Diamond Thin-Film Electrodes. Analytical Chemistry. 72 (16), 3793-3804 (2000).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods. Fundamentals and Applications. , (2001).
- Simonov, A. N., et al. Inappropriate Use of the Quasi-Reversible Electrode Kinetic Model in Simulation-Experiment Comparisons of Voltammetric Processes That Approach the Reversible Limit. Analytical Chemistry. 86 (16), 8408-8417 (2014).
- Terashima, C., Rao, T. N., Sarada, B. V., Spataru, N., Fujishima, A. Electrodeposition of hydrous iridium oxide on conductive diamond electrodes for catalytic sensor applications. Journal of Electroanalytical Chemistry. 544, 65-74 (2003).
- Bitziou, E., O'Hare, D., Patel, B. A. Simultaneous Detection of pH Changes and Histamine Release from Oxyntic Glands in Isolated Stomach. Analytical Chemistry. 80 (22), 8733-8740 (2008).
- Pickup, P. G., Birss, V. I. The kinetics of charging and discharging of iridium oxide films in aqueous and non-aqueous media. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 240 (1-2), 185-199 (1988).
- Baur, J. E., Spaine, T. W. Electrochemical deposition of iridium (IV) oxide from alkaline solutions of iridium(III) oxide. Journal of Electroanalytical Chemistry. 443 (2), 208-216 (1998).
- Carmody, W. R. Easily prepared wide range buffer series. Journal of Chemical Education. 38 (11), 559 (1961).
- Glab, S., Hulanicki, A., Edwall, G., Ingman, F. Metal-Metal Oxide and Metal Oxide Electrodes as pH Sensors. Critical Reviews in Analytical Chemistry. 21 (1), 29-47 (1989).
- Burgot, J. -. L. . Ionic equilibria in analytical chemistry. , (2012).
- Joseph, M. B., et al. Fabrication Route for the Production of Coplanar Diamond Insulated, Boron Doped Diamond Macro- and Microelectrodes of any Geometry. Analytical Chemistry. 86 (11), 5238-5244 (2014).
- Vanhove, E., et al. Stability of H-terminated BDD electrodes: an insight into the influence of the surface preparation. physica status solidi (a). 204 (9), 2931-2939 (2007).
- Salazar-Banda, G. R., et al. On the changing electrochemical behaviour of boron-doped diamond surfaces with time after cathodic pre-treatments. Electrochimica Acta. 51 (22), 4612-4619 (2006).
- Gelderman, K., Lee, L., Donne, S. W. Flat-Band Potential of a Semiconductor: Using the Mott-Schottky Equation. Journal of Chemical Education. 84 (4), 685 (2007).
- Ushizawa, K., et al. Boron concentration dependence of Raman spectra on {100} and {111} facets of B-doped CVD diamond. Diamond and Related Materials. 7 (11-12), 1719-1722 (1998).
- Chrenko, R. Boron, the dominant acceptor in semiconducting diamond. Physical Review B. 7 (10), 4560 (1973).
- Uzan-Saguy, C., et al. Hydrogen diffusion in B-ion-implanted and B-doped homo-epitaxial diamond: passivation of defects vs passivation of B acceptors. Diamond and Related Materials. 10 (3-7), 453-458 (2001).
- Hammerich, O., Speiser, B. . Organic Electrochemistry. , (2015).
- Juang, R. -. S., Wang, S. -. W. Electrolytic recovery of binary metals and EDTA from strong complexed solutions. Water Research. 34 (12), 3179-3185 (2000).
- Byrne, R. H., Kump, L. R., Cantrell, K. J. The influence of temperature and pH on trace metal speciation in seawater. Marine Chemistry. 25 (2), 163-181 (1988).
- Schonberger, E., Pickering, W. The influence of pH and complex formation on the ASV peaks of Pb, Cu and Cd. Talanta. 27 (1), 11-18 (1980).
- Chau, Y., Lum-Shue-Chan, K. Determination of labile and strongly bound metals in lake water. Water Research. 8 (6), 383-388 (1974).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados