Method Article
Beurteilung der bordotierten Diamantelektrode Qualität und Anwendung auf
In diesem Artikel
Zusammenfassung
Ein Protokoll ist für die Charakterisierung der wichtigsten elektrochemischen Parameter einer mit Bor dotierten Diamant (BDD) Elektrode und anschließende Anwendung für die in situ Erzeugung pH Versuchen beschrieben.
Zusammenfassung
Bor dotiertem Diamant (BDD) Elektroden haben ein beträchtliches Potential als Elektrodenmaterial in dem viele ihrer gemeldeten Eigenschaften wie erweiterte Lösungsmittel Fenster geringe Hintergrundströme, Korrosionsbeständigkeit, usw., ergeben sich aus der katalytisch inerten Natur der Oberfläche dargestellt. Wenn jedoch während des Wachstumsprozesses, wird Nicht-Diamant-Kohlenstoff (NDC) in der Elektrodenmatrix eingearbeitet, werden die elektrochemischen Eigenschaften zu ändern, wenn die Oberfläche katalytisch aktiv wird. Als solches ist es wichtig, dass der Elektrochemiker bekannt ist für die Qualität und die resultierenden Schlüsselelektrochemischen Eigenschaften des BDD Elektrode vor der Verwendung. Diese Veröffentlichung beschreibt eine Reihe von Charakterisierungsschritte einschließlich Raman-Mikroskopie, Kapazität, Lösungsmittel Fenster und Redox Elektrochemie, um festzustellen, ob die BDD-Elektrode enthält vernachlässigbare NDC also vernachlässigbar sp 2 -Kohlenstoff. Eine Anwendung markiert ist, welche Vorteile der katalytisch inerten stattund korrosionsbeständige Natur eines NDC freie Oberfläche, dh stabilen und quantifizierbaren lokalen Protonen und Hydroxid-Produktion durch Wasserelektrolyse an einer BDD-Elektrode. Ein Ansatz zur Messung des lokalen pH-Änderung durch Elektrolyse von Wasser unter Verwendung von Iridiumoxid beschichtet BDD Elektroden induziert wird ebenfalls im Detail beschrieben.
Einleitung
Wahl des Elektrodenmaterials ist von großer Bedeutung bei der Durchführung jeder elektroanalytische Studie. In den letzten Jahren sp 3 Kohlenstoff (Diamant) mit genügend Bor, das Material zu rendern dotierten "metallartigen" hat sich zu einer beliebten Wahl für eine breite Palette von elektroanalytische Anwendungen aufgrund ihrer hervorragenden elektrochemischen (und thermischen und mechanischen) Eigenschaften 1,2 , 3. Dazu gehören Korrosionsbeständigkeit unter extremen Lösung, Temperatur- und Druckbedingungen 4 Ultra-Weit Lösungsmittel Fenster, niedrige Hintergrundströme und reduziert Fouling, im Vergleich zu anderen gängigen Elektrodenmaterialien 5-7,3. Die Erhöhung Nicht-Diamant-Kohlenstoff (NDC: sp 2) Gehalt führt zu einer Abnahme der Lösungsmittelfenster, steigende Hintergrundströme 7,8, Änderungen sowohl strukturelle Integrität und die Sensibilität gegenüber unterschiedlichen inneren Kugel Redoxspezies, zB. Sauerstoff 9-12.
Hinweis für some Anwendungen wird NDC Präsenz als vorteilhaft, 13 zu sehen. Außerdem, wenn das Material nicht ausreichend Bor enthalten, werden sie als Halbleiter-p-Verhalten und zeigen eine verminderte Empfindlichkeit gegen Redoxspezies in der reduktiven Potentialfenster, wo das Material die meisten Ladungsträger 7 aufgebraucht ist. Schließlich kann die Oberflächenchemie von Bor dotiertem Diamant (BDD) spielen auch eine Rolle bei der beschriebenen elektrochemischen Antwort. Dies gilt insbesondere für die innere Kugel Arten, die Oberflächenchemie und niedriger dotierten Diamanten in dem ein Wasserstoff (H -) - empfindlich sind beendet Oberfläche bilden eine halbleitende BDD Elektrode erscheinen "metallartig" 7.
Um die Vorteile der überlegenen Eigenschaften der BDD zu nehmen, ist es oft unerlässlich das Material ausreichend dotiert und enthält so wenig NDC wie möglich. Abhängig von der angenommen, um die BDD wachsen Verfahren können die Eigenschaften 14,15 variieren. Dieses Papier schlägt vor, zunächst ein Material und einen Auserwähltenchemischen Charakterisierung Protokoll Leitfaden für die Bewertung der BDD-Elektrode Eignung vor der Anwendung (dh ausreichend Bor, minimal NDC) und beschreibt dann eine Anwendung auf Basis von lokal wechselnden pH elektrochemisch unter Verwendung des Protokolls-Elektrode überprüft. Dieses Verfahren nutzt den Vorteil des Oberflächenwiderstandsfähigkeit von NDC freien BDD zu Korrosion oder Auflösung unter Anwendung extremer angelegten Potentiale (oder Ströme) für lange Zeiträume. Insbesondere die Verwendung eines BDD Elektrode stabile Proton (H +) oder Hydroxid zu erzeugen (OH -) Flüsse durch Elektrolyse (Oxidation oder Reduktion jeweils) Wasser in unmittelbarer Nähe zu einer zweiten (Sensor) 16,17 wird hier beschrieben.
Auf diese Weise ist es möglich, den pH-Umgebung des Sensors in einer systematischen Weise zu steuern, beispielsweise für pH-Titration, oder um den pH auf einen Wert in dem der elektrochemische Prozess ist am empfindlichsten zu fixieren. Letzteres ist besonders nützlich,Anwendungen, bei denen der Sensor an der Quelle, zum Beispiel Fluß, See, Meer und dem pH des Systems platziert ist nicht optimal für die elektrochemische Messung von Interesse. Zwei neuere Beispiele schließen ein: (i) die Erzeugung eines lokalisierten niedrigen pH in einem pH-neutralen Lösung für die Elektroabscheidung und Strippen von Quecksilber 17; beachten Sie BDD ist ein beliebtes Material für die elektrochemische Abscheidung von Metallen aufgrund der erweiterten kathodischen Fenster 9,18,19. (ii) Quantifizierung des elektrochemisch detektierbare Form von Schwefelwasserstoff, bei hohem pH Derzeit indem der pH lokalen Erhöhung von neutral bis stark alkalisch 16.
Protokoll
HINWEIS: BDD Elektroden werden am häufigsten unter Verwendung von chemischen Dampfabscheidungstechniken auf einem Wachstumssubstrat angebracht gezüchtet. Sie verlassen die Wachstumskammer H-terminierten (hydrophoben). Wenn gewachsen dick genug, die BDD kann von dem Substrat entfernt werden und ist freistehend bezeichnet. Die freistehende BDD Wachstumsoberfläche wird oft poliert, um die Oberflächenrauhigkeit deutlich zu reduzieren. Reinigung des BDD in Säure führt in einer Sauerstoff (O) -terminierten Oberfläche.
1. Säurereinigung BDD
- Stellen Sie ein Becherglas mit konzentrierter Schwefelsäure (H 2 SO 4; ~ 2 ml oder tief genug, um den Diamanten zu decken) auf einer heißen Platte bei RT und legen Sie die BDD.
- In Kaliumnitrat (KNO 3), bis es nicht mehr auflöst (~ 0,5 g in 2 ml), dann mit einem Uhrglas und Wärme auf ~ 300 ° C abdecken, wird die Lösung braun, wie es heizt und das Kaliumnitrat wird sich auflösen.
VORSICHT Vorsicht beim Umgang mit heißer Säure genommen werden!; Gummihandschuhe, Sicherheits gMädels und Laborkittel tragen werden, und dieser Prozess sollte in einem Abzug durchgeführt werden. - Lassen Sie für mindestens 30 Minuten oder bis es nicht mehr die braune Farbe der Lösung zu erwärmen, dann schalten Sie die Kochplatte und lassen Sie die Lösung auf RT abkühlen.
- Sorgfältig der Säure zu entsorgen durch Verdünnen in RT Wasser und spülen Sie die BDD mit destilliertem Wasser.
- Messen Sie die Oberflächenkontaktwinkel, siehe Abschnitt 1.2. Hydrophobe (H-terminiert) 20,21 Elektroden-Kontaktwinkel im Bereich von 60-90 ° 3 erheblich reduziert, wenn die Oberfläche hydrophil durch O-Beendigung gerendert gemeldet.
- (optional Alternativverfahren) Bei sehr dünnen Filmelektroden (auf das Wachstumssubstrat und zur Vermeidung Filmaufblättern Verwendung der obigen Behandlung angebracht ist), einmal zu waschen mit 2-Propanol und zweimal mit deionisiertem Wasser in einem Ultraschallbad. Dann gibt, die ein aus den folgenden drei Reinigungsverfahren (1) anodisch polarisieren Diamant für 30 min bei 10 mA cm -2 In 1 M Perchlorsäure bei 40 ° C 22; oder (2) anodisch polarisieren Diamant für 20 min bei 10 mA cm -2 in 1 M Salpetersäure, anschließend kathodisch polarisiert bei 10 mA cm -2 für weitere 20 min in der gleichen Lösung 23 oder; (3) Zyklus der Diamant zwischen 2 V in 0,1 MH 2 SO 4, bis eine stabile elektrochemische Signal erreicht 7. Folgen Sie dieser Schritt 1.4.
2. Kontaktwinkelmessung
- Legen Sie die Diamanten auf dem Probentisch eines Kontaktwinkel-Analysator, sicherstellen, dass er flach ist. Legen Sie eine 1-ml-Spritze in den Stellungsregler über dem Probentisch, sichern eine Nadel am Ende. Füllen Sie die Spritze mit entsalztem Wasser.
- Verwenden die z-Steuerung, um die Spritze zu der Probe zu verringern, verwenden die x - und y - Controller und die Kamera / Beleuchtungseinrichtung, um die Spritze über der Mitte der Diamant auszurichten.
- Unter Verwendung der Analysesoftware Spende Repeat 1 ul volumes Wasser aus der Spritze, bis ein Tröpfchen bildet sich an der Spitze der Nadel, auf dem Kamerabild (nie mehr als 10 ul) sichtbar. Senken Sie die Nadel, um die Tröpfchen auf die Oberfläche abzuscheiden und stellen Sie die Beleuchtung für maximalen Kontrast.
- Sammeln Sie ein Bild und gelten Tropfenform-Analyse-Software, mit der Kegelschnitt-Methode. Klicken Sie auf "finden Sie Basislinie" in der Software, und klicken Sie dann auf "Berechnung", gefolgt von "Tangente".
Hinweis: Dieses Verfahren erfasst die Grundlinie und passt eine konische Gleichung auf die (elliptisch) Tropfenform; ein Kontaktwinkel θ, ist zwischen der Grundlinie und der Tangente an die Dreiphasen-Kontaktpunkt gezogen.
3. BDD Materialcharakterisierung
- Raman-Analyse für sp 2 / sp 3 Inhalt
- Führen Sie Raman (siehe Referenz 14 für eine Anleitung zur praktischen Raman-Spektroskopie) in verschiedenen Bereichen des BDD-Elektrode, 24 Verwendung eines 514,5 nm oder532 nm-Laser, der sp 2 -Gehalt betont, wird befürwortet.
- Schalten Sie den Mikro-Raman-Spektrometer und lassen ~ 30 min für die CCD-Detektor abkühlen. Überprüfen Sie die entsprechende Objektiv, Beugungsgitter und Filter vorhanden sind, für die Verwendung mit dem Laser der Wahl.
- Kalibrierung des Systems unter Verwendung eines Silizium (Si) Kalibrierprobe. Platzieren des Si-Substrats in der Instrumentenkammer und konzentrieren optisch auf die Probe mit dem Mikroskop. Schließen Sie die Tür zu der Kammer. Wechseln Sie zu Laserblick und überprüfen der Laserpunkt ist gut definiert und kreisförmig. Kalibrieren Sie mit Hilfe der Software, klicken Sie auf "Werkzeuge", gefolgt von "Kalibrierung", dann "schnelle Kalibrierung" und dann "OK".
- Entfernen Sie das Si-Substrat aus der Kammer und ersetzen Sie mit der BDD-Elektrode. Optisch fokussieren Sie das Mikroskop auf dem Gebiet von Interesse, wechseln Sie zu Lasersicht und öffnen Sie den Auslöser, um zu überprüfen, dass der Laser fokussiert ist. Schließen Sie den Auslöser.
- Werfen Sie einen Raman-Messung mit der Software; click "Messung", dann "neue" und dann "spektraler Akquisition." stellen Sie den Messwellenzahlbereich, um die Eigenschaften von Interesse abzudecken, für die BDD ist 200 - 1800 cm -1; setzen Sie den Scan-Erfassungszeit (<10 sec); stellen Sie die Laserleistung auf 100% (für BDD) und; die Anzahl der Akkumulationen (Wiederholung Scans) bis fünf (BDD). Wenn das resultierende Spektrum ist sehr laut mehr Ansammlungen kann notwendig sein. Drücken Lauf und speichern Sie das resultierende Spektrum für die Analyse. Nehmen Sie ein Bild von der Umgebung Raman wurde unter Verwendung des Live-Videos durchgeführt. Speichern Sie das Bild als Referenz.
- Beachten Sie die Peak ~ 1.332 cm -1 in dem Spektrum, sp 3 Diamanten (1) anzeigen; Je breiter die Spitzen desto mehr Mängel vorliegen 3,25.
- Die ggf. NDC - von einem breiten Peak bei 1.575 G cm -1 26 zentriert angegeben ist, in den Spektren (1A und 1B), die aus der Dehnung der gepaarten sp 2 Websites; desto größer ist die Spitzenintensität umso NDC vorhanden.
HINWEIS: die π-Bindungen durch sp 2 C gebildet sind polarisierbar als sp 3 σ-Bindungen und resonant durch sichtbare Laser verbessert, was zu einer breiteren, dominant, G 25 Gipfel. Beachten Sie, dass die genaue Methode, um Analysen durchführen kann zwischen verschiedenen Instrumenten und Software variieren.
4. elektrochemische Charakterisierung
- Vorbereiten ohmsche Kontakte
- Freistehende BDD
- Verwendung von Standardtechniken durch Sputtern (oder verdampft) die Rückseite des BDD mit Titan (Ti) / Gold (Au) 10 nm / 300 nm, unter Verwendung einer Sputtervorrichtung / Verdampfer bei Drücken unterhalb von 1 × 10 -5 mBar. Wenn ein drei Zielquelle verfügbar ist, mehr ideal ist Ti 10 nm / Platin (Pt) 10 nm / Au 300 nm für die Diffusion von Ti in die Au vermeiden.
- Glühen 5 h bei 400 ° C (Atmosphärendruck) ermöglicht die Ti, um Titankarbid zu bilden, Crucial zur Bildung eines ohmschen Kontakts 27.
Hinweis: Wenn die Rückfläche des BDD hochglanzpoliert ist (~ nm Rauheit), dann ist es bevorzugt, die Oberfläche vor aufrauen, um die Abscheidung durch Sputtern, um eine robustere Beschichtung zu gewährleisten. Dies kann erreicht werden, zum Beispiel, einen niedrigen Stromlasermikrobearbeitung der Oberfläche (Entfernung von <30 um Material).
- Dünnfilm-Diamant auf einem leitenden Substrat aufgewachsen
- Sputter / verdunsten wie oben, aber mit der Oberseite, mit einer Lochmaske platzieren sanft auf der oberen Fläche nach oben Kontaktieren der gesamten Elektrode zu vermeiden.
ODER - Rubbeln Sie an der Rückseite des leitenden Substrats mit einem Diamant spitzen Stift. Dann beschichten die verkratzten Stellen mit der Durchführung von Ag-Paste oder einem ähnlichen leitfähigen Farbe durch die Malerei auf einer dünnen Schicht mit einem kleinen Pinsel. Schließlich elektrischen Verbindung durch Anbringen Kupferdrähte mit leitfähigem Epoxidharz.
Hinweis: Es gibt eine Vielzahl von Möglichkeiten, um die BDD nach elect vorzubereitentrischen Kontakt nach Referenz 4 beschrieben, beispielsweise wenn das BDD in kleinere Strukturen Dichtung in Glas oder Epoxy bearbeitet werden oder wenn noch an der Waferklemme befestigt / befestigen eine elektrochemische Zelle zu der oberen Fläche.
- Sputter / verdunsten wie oben, aber mit der Oberseite, mit einer Lochmaske platzieren sanft auf der oberen Fläche nach oben Kontaktieren der gesamten Elektrode zu vermeiden.
- Freistehende BDD
- Kapazitätsmessungen
- Bereiten Sie eine 20 ml 0,1 M KNO 3 -Lösung durch Wiegen 0,20 g in bidestilliertem Wasser (diese Wasserqualität ist im gesamten empfohlen, Widerstand 18,2 M cm). Die Elektrode vor der entweder durch Aluminiumoxid Polieren oder durch elektrochemisches Radfahren in verdünnter Säure Gebrauch zu reinigen (siehe Abschnitt 1 HINWEIS) 16,23,28.
- Verwendung eines Potentiostat ausgeführt Cyclovoltammogramme (CV) bei 0,1 V sec -1 zwischen -0.1 V und 0,1 V, beginnend bei 0 V, wobei die BDD als Arbeitselektrode gegenüber einer gemeinsamen Bezugselektrode, beispielsweise aus Silber / Silberchlorid (Ag / AgCl ) oder eine gesättigte Kalomelelektrode (SCE) und eine Pt-Gegenelektrode. Analysieren Sie den zweiten CV.
HINWEIS: 2A Zeigt einen typischen Kapazitätsverlauf mit einer freistehenden metallischen aufgezeichnet dotierten BDD-Elektrode. - Messung der Gesamtstromstärke auf 0 V aus dem aufgezeichneten Kapazitätskurve und Division durch 2, ist dieser Wert "i". Bestimmen Sie die Kapazität C mit dem Wert für i, mit der Gleichung 1, Normalisierung in Bezug auf Fläche Elektrode (Anteil von Oberflächenrauheit falls) und Zitat in uF cm -2. Hohe Qualität, "metallartigen" BDD eine Kapazität << 10 uF cm -2. Verwenden Sie keine grafischen Darstellung von Daten zu präsentieren und die Daten zu analysieren.
i = C (Vt-1) (Gl. 1);
wobei i Strom (A) und (V t -1) ist die potentielle Scanrate.
- Solvent-Fenster
- Reinigen Sie die Elektrode wie in Schritt 4.2.1. Mit Hilfe eines Potentiostaten betreiben ein CV in 0,1 M KNO 3 bei 0.1 V s -1 von 0 V bis -2 V dann zwischen -2 V und +2 V and wieder auf 0 V mit der BDD als Arbeitselektrode gegenüber einer gemeinsamen Bezugselektrode und die Gegenelektrode Pt. Wiederholen. Analyse der zweiten CV, ein Beispiel CV ist in 2B gezeigt.
- Konvertieren Sie Strom an Stromdichte (mA cm -2), wobei die Oberflächenrauhigkeit in Betracht, und zitieren das Lösungsmittel Fenster wie der Potentialfenster von aktuellen Grenzen von ± 0,4 mA cm -2 in beide Richtungen definiert. 7,29 Verwenden Sie keine grafischen Darstellung von Daten zu präsentieren und die Daten zu analysieren.
- Beachten Sie die Hinweise auf NDC (sp 2 Kohlenstoff) in dem Lösungsmittel-Fenster; die Sauerstoffreduktionsreaktion an NDC, das bei der reduktiven Fenster klar ersichtlich ist, begünstigt. Oxidation von sp 2 enthaltenden Gruppen führt auch charakteristische Peaks kurz vor der Wasserelektrolyse im anodischen Fensters (2B).
HINWEIS: hohe Qualität "metallisch" BDD-Elektroden haben Lösungsmittel Fenster >> 3 V, nicht die Sauerstoffreduktion reac unterstützennung (ORR) in 0,1 M KNO 3 (oder ORR stark kinetisch verzögert) und zeigen vernachlässigbar NDC Oxidations Signaturen.
- Redox Elektrochemie
- Reinigen Sie die Elektrode wie in Schritt 4.2.1.
- Mit Hilfe eines Potentiostaten Rekord Lebensläufe in 1 mM Ruthenium Hexaamin (Ru (NH 3) 6 3+) und 0,1 M KNO 3 zwischen +0,2 V und -0,8 V gegen SCE, für Scanraten im Bereich von 0,05 V s -1 - 0,2 V sec -1.
HINWEIS: Dieses Paar zeigt schnelle Elektronentransfer und elektro in einer Region, die p-Typ-Halbleiter BDD herausfordert. sp 2 enthält BDD wird auch zeigen ORR in diesem Bereich, ist das Signal für die letztere noch deutlicher, wenn die Konzentration von Ru (NH 3) 6 3+ verringert wird. - Die Spannung Trennung zwischen dem anodischen und kathodischen Peakstrom (Δ E p) von der aufgezeichneten CV, und der Temperatur, wie beschrieben 20.Für "metallartigen" ohmisch kontaktiert Sauerstoff-terminierten BDD bei 298 K, Δ E p <70 mV 30,31. Größer Δ E p Werte sind symptomatisch für einen schlechten ohmschen Kontakt oder einer niedrigeren Gehalt an Bor, wie in 2C für die BDD-Elektroden von Dotierungsdichten im Bereich 9,2 × 10 16 bis 3 x 10 20 B-Atome cm -3 dargestellt.
- Die Peakstrom der Vorwärtsabtastung, i p, und korrelieren mit der aus dem Randles Sevcik Gleichung 2 3,30 (bei 298 K angegeben) erwartet wird, unter der Annahme, die Elektrode scheibenförmig in der Geometrie und groß genug ist (Durchmesser 1 mm) überragt, dass lineare Diffusion. Verwenden Sie keine grafischen Darstellung von Daten zu präsentieren und die Daten zu analysieren.
i p = 2,69 x 10 5 n 3/2 AD 1/2 cv 1/2 (Gleichung 2)
wobei nist die Anzahl der übertragenen Elektronen ist, A Fläche (cm 2) ist, D Diffusionskoeffizient (cm 2 s -1) ist, ist C-Konzentration (mol cm -3) und v Abtastgeschwindigkeit (V sec -1).
5. pH-Generation: Herstellung von pH-sensitive Elektrode und pH-Generation
- Iridiumoxid (pH-empfindliche) Herstellung der Lösung
- Bereiten Sie eine 20 ml 0,1 M KNO3-Lösung, wie in Abschnitt 5.4.1. 5 Tropfen Phenolphthalein-Lösung mit einer Pasteurpipette und umrühren (dies ist ausreichend, um eine Reaktion mit dem Auge zu sehen, aber für eine intensivere Farbe, fügen Sie mehr Tropfen). Legen Sie die BDD Arbeitselektrode und Pt-Gegenelektrode in Lösung.
- Einstellen des pH der Lösung auf 10,5 durch Zugabe von wasserfreiem Kaliumchlorid-Salz unter ständigem Rühren. Lassen bedeckt und unter Rühren für 48 Stunden bei Raumtemperatur zu stabilisieren, in dieser Phase die Lösung wird nach und nach von gelb-grün zu gehenblau-violett. Im Kühlschrank lagern bei 3 ° C.
- pH-empfindliche Iridium-Oxid-Film Deposition
- Verwendung eines Potentiostaten führen eine CV im Iridiumoxid Lösung zwischen 0 V und +1 V gegen SCE, das Potential, bei dem der Maximalstrom erfasst bestimmen. Dies ist das Abscheidungspotential, E dep, wie in 3A gezeigt, in der Regel liegen zwischen ~ + 0,6 V - 0,85 V; es kann in Abhängigkeit von einer Reihe von Faktoren, wie Temperatur, Elektrodenmaterial usw. 32, 33 unterschiedlich
- Verwendung Chronoamperometrie mit einem Potentiostaten Schritt das Potential von 0 V ("initial E" und "Low-E" in der Software), in denen keine Elektrolyse auftritt, um E dep ("High E" in der Software), für eine Zeitdauer von 0,2 s pro Schritt wiederholen, 100x.
- Führen Sie einen CV zwischen 0 V und +1 V in 0,1 MH 2 SO 4 für die IrOx hinterlegt Elektrode. Der Charakteristic CV Form ist in 3B gezeigt. Eine Stromdichte im Bereich von ~ 0,6 mA cm -2 - 0,7 mA cm -2 für die erste Anodenpeak (entsprechend einer mittleren Filmdicke von 8 nm ~ 0,7 mA cm -2) zeigt einen stabilen pH-empfindlichen Schicht 34, 35.
- Wenn die Stromdichte weniger als 0,6 mA cm -2 die Schritte 5.2.2 - 5.2.4, bis dieser Wert erreicht ist. Verlassen die Elektrode in pH 7-Pufferlösung für 24 h auf als die Reaktion der IrOx Dünnschicht hydratisieren Hydratation abhängige 33.
- IrOx Dünnschicht pH Charakterisierung
- Bereiten Sie eine Reihe von Pufferlösungen, die den pH-Bereich von Interesse abdecken (pH 2 - pH 12), so können diese im Haus gemacht werden (zB Carmody 36) oder im Handel erworben.
- Spülen Sie die Elektrode mit destilliertem Wasser. Legen Sie die IrO x und Referenzelektrode in die Pufferlösung der niedrigste pH-Wert. Verwendung eines Potentiostatennotieren Sie die Ruhepotential (OCP) mehr als 30 sec, mit drei Wiederholungen. Entfernen Sie die Elektrode aus der Lösung, spülen und in den nächsten Puffer.
- Wiederholen Sie Schritt 5.3.2 für jeden Puffer, dann mindestens zweimal wiederholen Sie die Serie. Plot pH vs. OCP, die Eichkurve für den Film Antwort. Ein IrOx Folie eine Steigung mit einem Gradienten zwischen 59 bis 80 mV pro Dekade 37.
HINWEIS: 3C zeigt ein Beispiel Eichkurve für eine erfolgreiche IrOx pH-Sensor auf BDD.
- Mit Hilfe eines pH-Generator und Messsystem
HINWEIS: Diese übernimmt Verwendung eines Zweielektrodensystem, bei dem eine Elektrode mit dem IrOx Dünnschicht (zB Disk) und dem zweiten (zB BDD Ring) beschichtet wird H + oder OH zu erzeugen - galvanostatisch von Wasserelektrolyse.- Vorbereitung einer 20 ml 0,1 M KNO & sub3; -Lösung durch Zugabe von entionisiertem Wasser, um das Salz. Verbinden Sie die IrOx beschichtetenElektrode als Arbeitselektrode in einem Zweielektrodensystem, wobei die zweite Elektrode ein stabiles Referenzelektrode z SCE. Messen Sie die OCP Verwendung eines Potentiostaten, um die Ausgangs-pH zu etablieren.
- Schließen Sie die Generatorelektrode an eine geeignete zwei Elektroden galvanostatischen System mit einer Gegenelektrode, zB Pt-Folie, und wiederholen Sie Schritt 5.4.1, aber nach einem festgelegten Zeitraum gelten einen Strom an der Generatorelektrode.
HINWEIS: wir finden, Ströme im Bereich 0 bis ± 50 & mgr; A sind geeignet mit unseren BDD-Elektroden; größere Ströme führen zu nennenswerten Gasentwicklung. Der Betrag und die Richtung des Stroms hängt von der gewünschten Ergebnisses; ein positiver Strom wird zu einer Verlagerung in stärker sauren pH-Wert und einem negativen Strom zu alkalischer pH-Wert, desto größer der Strom desto größer ist die pH-Wertänderung führen. - Unter Verwendung des Potentiostaten, notieren Sie die Änderung in der OCP in Reaktion auf die galvanostatische aktuelle, warten Sie, bis die Antwort stabilisiert. Dann legen Sie die IrO x Elektrode in pH-7-Puffer für 10 Minuten wieder ins Gleichgewicht des IrOx Dünnschicht.
- Die Schritte 5.4.2 mit verschiedenen angelegten Ströme 5.4.3 bis alle erforderlichen Daten gesammelt worden sind. Zeichnen Sie die Daten mit Hilfe der Eichkurve in Abschnitt 5.3 erhalten, um OCP auf pH umzuwandeln, ist ein Beispiel für Datensatz in 4A gezeigt. Entfernen Sie die IrOx Dünnschicht unter Verwendung von Aluminiumoxid Polieren oder Pulsieren in 0,1 MH 2 SO 4 von +2 V bis V für 0,2 s -2 × 100. Übernehmen, um das Messsystem von Interesse.
- Visuelle Beurteilung der lokale pH-Generation
- Bereiten Sie eine 20 ml 0,1 M KNO3-Lösung, wie in Abschnitt 5.4.1. 5 Tropfen Phenolphthalein-Lösung mit einer Pasteurpipette und umrühren (dies ist ausreichend, um eine Reaktion mit dem Auge zu sehen, aber für eine intensivere Farbe, fügen Sie mehr Tropfen). Legen Sie die BDD Arbeitselektrode und Pt-Gegenelektrode in Lösung.
- Anwenden einer negativen Strom an die Arbeitselektrode mitein Galvanostat wie in Schritt 5.4.2 (zB ~ -0,6 mA cm -2), so dass die Farbe der Lösung von farblos nach rosa ändert. Diese nun lokal erzeugt eine Lösung, die bei pH ≥ 10,5 ist.
- Wiederholen Sie Schritt 5.5.1 mit 5 Tropfen Methylrot-Lösung anstelle von Phenolphthalein und umrühren. Tragen Sie einen ausreichend positiven Strom (zB ~ 6,6 mA cm -2), so dass die Lösung die Farbe wechselt von gelb nach rot. Diese nun lokal erzeugt eine Lösung, die bei pH ≤ 4.2 38 ist.
Ergebnisse
Raman-Spektren und die elektrochemischen Charakteristika wurden für repräsentative BDD macrodisc Elektroden mit verschiedenen Dotierungsmitteldichten für NDC haltigen Dünnschicht mikro BDD und größerer Korn erhalten, und beide signifikant und vernachlässigbare Niveaus von NDC, Figuren 1 und 2. 1A und B zeigen typische Raman-Daten freistehenden BDD über der metallischen Schwellen dotiert sind. Die Anwesenheit von NDC ist erkennbar an den markierten breite Peaks zwischen 1400 und 1600 cm -1; es keinen solchen Peak in 1C, die die typische Raman-Signatur des NDC freien zeigt freistehende BDD sichtbar. In allen drei Spektren in Figur 1 ist es möglich, einen scharfen Peak bei 1.332 cm -1 zu beobachten, ist dies die Signatur Peak von sp 3 Kohlenstoff (Diamant); Asymmetrie des Baseline um diesen Peak wird als "Fano Resonanz bekannt"Und wenn vorhanden zeigt an, dass die Probe in geeigneter Weise für den Einsatz in elektrochemischen Untersuchungen dotiert (10 20 B-Atome cm -3). Dies ist der Fall für alle drei hier gezeigten Elektroden.
In Figur 2 beispielsweise Daten für die elektrochemische Untersuchungen (Kapazität Lösungsmittel Fenster und CVs in Redoxvermittlers Ru aufgezeichnet (NH 3) 6 3+) sind sowohl für NDC haltigen und NDC freien BDD dargestellt, oberhalb der metallischen Schwellen dotiert. Die Kapazitätskennlinien in 2A zeigen deutlich, dass NDC haltigen BDD weist eine größere kapazitive Strom als NDC freie BDD. Die Kapazitäten der einzelnen wurde wie im Text beschrieben und in Figur 2A als 10,8 uF cm -2 (NDC haltigen) und 6,3 uF cm -2 (NDC frei) BDD zitiert berechnet. Hohe Qualität, niedriger NDC-Inhalte, BDD-Elektroden werden voraussichtlich eine Kapazität aufweisen << 10 & mgr; F cm -2. In ähnlicher Weise vergleicht 2B die Lösungsmittel Fenster Exemplar NDC haltigen und NDC freie BDD-Elektroden. Es kann gesehen werden, dass für eine NDC haltigen Elektroden das Einsetzen von H 2 O Oxidation und Reduktion wurde in deutlich gebracht, Verengung des Lösungs Fenster. Bemerkenswert ist auch das Aussehen des anodischen Peaks aufgrund der Oxidation von NDC und kathodische Spitze aufgrund ORR die auf NDC aber nicht auf sp 3 Kohlenstoff katalysiert wird. Für eine hohe Qualität BDD-Elektrode mit vernachlässigbarer NDC wird erwartet, dass das Lösungsmittel Fenster zu sein >> 3 V in wässrigen KNO 3 -Lösung. In 2C die CV Antwort BDD-Elektroden mit einer Vielzahl von Dotierungspegeln unter Verwendung des Redox-Mediator Ru (NH 3) 6 3+ sucht. BDD Elektroden über der metallischen Schwellen dotiert wird die Spannungstrennung zwischen dem anodischen und kathodischen Stromspitzen erwartet nahe 59 mV, in Übereinstimmung mit der Nernst-Gleichung zu sein; however, da das Dotierungsniveau abnimmt, wird das Material von Ladungsträgern, was zu einer Erhöhung der Spitzentrennung Peak verarmt.
Ein BDD macrodisc, in IrO x beschichtet, wurde verwendet, um die Daten in Abbildung 3 aufzuzeichnen, während alle Diamant (BDD in Diamanten isoliert) 39 Dual-Elektroden und ein Epoxidharz versiegelt BDD Ringscheibenelektrode wurden für die pH-Generation Experimente in 4A verwendet. Die Daten in Abbildung 3 veranschaulicht die Abscheidung und Charakterisierungsverfahren für eine pH-empfindliche IrOx Dünnschicht auf BDD. In 3A ein typisches CV im IrOx Abscheidungslösung erfasst wird angezeigt. Die für die anschließende IrO x Abscheidung eingesetzt Potential kann aus der Position der Oxidationsspitzenstrom identifiziert werden, wie hier dargestellt. 3B ist eine beispielhafte CV in Schwefelsäure eines IrOx Dünnschicht Galvanoed auf BDD. Die Form des CV ist charakteristisch für eine erfolgreich abgeschiedenen Films mit der Spitzenstromdichte, die Informationen über Filmdicke. Eine höhere Stromdichte zeigt eine dickere Folie. Die Stabilität des Films ist dickenabhängig; zu dünn, und der pH-Antwort wird zu treiben, zu dick ist und der Film Ansprechzeit langsam ist und die Folie kann abblättern. Ein Wert für die Spitzenstromdichte ~ 0,7 mA cm -2 ist gezeigt worden, um einen stabilen Film mit einer ausgezeichneten pH-Antwort anzuzeigen. Der OCP-Antwort des IrO x Schicht auf einem BDD Elektrode gegenüber verschiedenen pH-Puffer ist in 3C gezeigt. Die Drift zwischen den Messungen klein ist, wie durch die Größe der Fehlerbalken nachweisbar und die Steigung super Nernst (> 59 mV) als für diese Art von Film zu erwarten.
Schließlich zeigt 4 die Verwendung eines BDD Elektrode zur pH-Generation. In 4A der pH-Wert zu ändern michbei einer IrO asured X beschichtete BDD Elektrode für einen Bereich von Strömen auf den pH-Erzeugungs BDD-Elektrode in der Nähe aufge aufgebracht entweder in Ring oder ein Band-Format präsentiert, wie in Figur 4 dargestellt. Bei verschiedenen angelegten Strömen kann der pH-Wert lokal geändert und quantifizierbar von einem Startwert (nahe Null), entweder sauer oder alkalisch ist. Dieser Prozess kann visuell beobachtet, wie in 4B, wobei eine geeignete Stromdichte auf einem BDD Elektrode angelegt, um den pH-Wert nahe dem Neutralpunkt zu> 10,5 verändern erläutert. In Gegenwart von Phenolphthalein (pH-Indikator) resultiert in der Lösung geht von farblos nach rosa, in der Nähe der Elektrode.
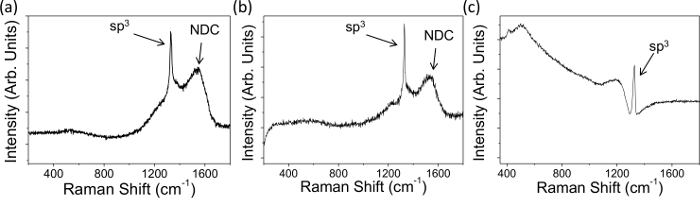
Abbildung 1. Typische Raman-Daten mit einem 514-nm-Laser auf (A) NDC enthaltende Dünnschicht mikro BDD auf das Wachstumssubstrat befestigt (dop zeichnetenant Dichte 1,9 x 10 20 Boratomen cm -3) und (B, C) freistehende größere Korn BDD durchschnittliche Dotierungsmitteldichte 1,9 × 10 20 und 3 × 10 20 B-Atome cm -3 auf. NDC ist evident (A) und (B) aufgrund der Anwesenheit der markierten Peaks NDC 1400 bis 1600 cm -1, (C) enthält vernachlässigbare NDC. Alle drei Elektroden zeigen eine "Fano Resonanz" und damit in geeigneter Weise Bor für elektrochemische Untersuchungen 7 dotiert. Teilweise aus Lit. [4c] Wiedergabe mit Genehmigung. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
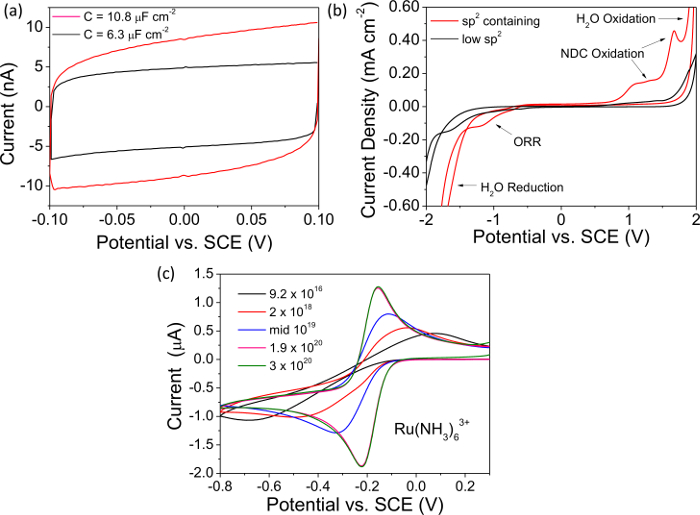
Abbildung 2. Elektrochemische Charakterisierung. Alle repräsentative Daten in ( A, B) auf isolierenden Diamant ummantelt O-termini BDD-Elektroden über der metallischen Schwellen dh 10 20 B-Atome cm -3 dotiert 39 registriert worden. (A) Kapazitanz Kurven für NDC freien BDD wobei C = 6,3 uF cm -2 (schwarz) und für die NDC-enthaltenden BDD wobei C = 10,8 uF cm -2 (rot). (B) Repräsentative Lösungsmittel Fenster für NDC freie BDD, Lösungsmittel Fenster> 3,95 V (schwarz) und für NDC haltigen BDD, Lösungsmittel Fenster = 3,22 V (rot). (C) CVs in 1 mM Ru (NH 3) 6 3+ 0,1 V sec aufgezeichnet -1 für Glas versiegelt freistehende BDD macrodisc Elektroden unterschiedlicher Bor-Dotierungsdichten im Bereich 9,2 × 10 16 - 3 x 10 20 Atomen cm B - 3. Teilweise aus Lit. [4c] mit Genehmigung wiedergegeben. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abbildung 3. Charakterisierung IrOx Filmabscheidung auf BDD und pH-Antwort. (A) CV in IrOx Lösung vor der Abscheidung. Die maximale Oxidationsstrom liefert einen Wert für das Abscheidungspotential, E dep, wo die Filmbildung festgestellt wird, als am wirksamsten. Verwendung Potentialen> E dep, ergibt eine instabile abgeschiedenen Films. (B) Kenn CV für eine galvanisch abgeschiedene IrOx Dünnschicht in 0,1 MH 2 bei 0,1 V s -1 SO 4 aufgenommen; i p, ist eine in der Regel ~ 0.7 mA cm -2. (C) Repräsentative pH Kalibrierungn-Kurve (R 2 = 0,997) für galvanisch abgeschiedene IrOx auf einem freistehenden BDD-Elektrode. Die Steigung ist eine super-Nernst-Reaktion (65,4 mV) auf pH. Die kleinen Fehlerbalken (n = 3) zeigen Filmstabilität und Reproduzierbarkeit der Messungen. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
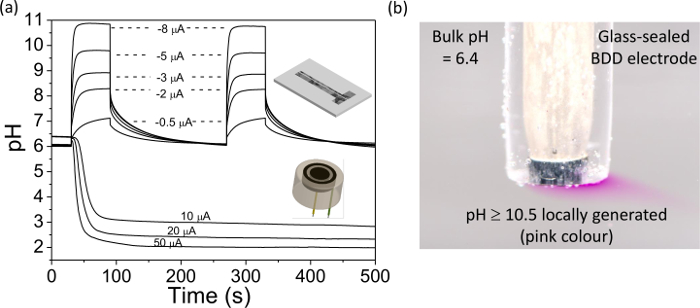
Abbildung 4. Verwendung eines freistehenden BDD Ringscheibe und Dual-Band-Elektroden für die In-situ-pH-Kontrolle BDD Ringscheibenelektrode, Scheibendurchmesser = 0,922 mm, Abstand = 0,262 mm und Ringbreite = 0,150 mm. BDD Bandelektrode Generator = 0,460 × 3 mm, Detektor = 0,09 × 3 mm, und Abstand = 0,2 mm. (A) Experimentell gemessene pH-Zeit-Profil in den Detektorelektroden als Funktiauf Hoch galvanostatischen Strom (10 bis 50 & mgr; A an der Ringscheibenelektrode und -0,5 bis -8 & mgr; A für die Dual-Band-Elektrode). Beachten Sie den stabilen pH über lange Zeitdauer erzeugt. Modifizierte Wiedergabe von Lit. [9a] und [9b]. (B) Einfache Visualisierung von in situ pH Generation unter Verwendung von Phenolphthalein-Indikatorlösung; ein Strom von uA -4.55 (-0.58 mA cm -2) wurde zu einer 1 mm Durchmesser Glas aufgebracht abgedichtet BDD Makroelektrode. Die rosa Farbe zeigt pH≥10.5, farblose Lösung zeigt pH≤8.4 38. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Diskussion
Beginnend mit einem O-terminierte Oberfläche befürwortet wird, weil die H-terminierten Oberfläche elektrochemisch instabil ist, insbesondere bei hohen anodischen Potentialen 7,40,41 ist. Ändern Oberflächenterminierung können die Elektronen-Transfer Kinetik der inneren Kugel Paare, wie beispielsweise die Wasserelektrolyse (hier verwendet, um den pH-Wert lokale Lösung zu ändern) zu beeinflussen. Wenn darüber hinaus die BDD enthält signifikante NDC an den Korngrenzen ist es auch möglich, dass bei Anwendung der extreme anodischen / kathodischen Potentialen befürwortet in diesem Artikel für pH Generation, Ätzen könnte an diesen Schwachpunkte auf. Dies würde dazu führen, dass der Film korrodieren und für dünne Filme, schließlich delaminieren, manifestiert sich in einem instabilen pH-Generation-Profil, wie mit Dünnschicht Au und Pt-Elektroden 17 zu sehen. Somit eine strenge Protokoll zur Bewertung der Qualität der Elektrode vor der Verwendung wird angenommen, um NDC Gehalt zu bewerten, da die in den 1 (Raman) und 2 (capacit diskutiertance und Lösungsmittel Fenster).
Von Bedeutung ist auch der Gehalt an Bor. Wenn das Material unter dem metallischen Schwelle (<10 20 B-Atome cm -3) dotiert ist, wird es möglicherweise erschöpft, bei Potentialen Negativ des Flachbandpotential, was zu einer Verringerung der elektrochemische Leistung 7,42. Der einfachste Weg zur qualitativen Beurteilung metallischen Dotierungspegel ist, um das Vorhandensein eines Fano Signatur, die Asymmetrie verursacht, in der sp 3 Peaks im Raman-Spektrum, wie in Figur 1 (AC) gezeigt aussehen. Dies ist aufgrund der Interferenz zwischen den diskreten Phonon Zustand und dem elektronischen Kontinuum und ist an Bor-Dotierungspegel> 10 20 B-Atome cm -3 43 gesehen. Sekundärionen-Massenspektrometrie (SIMS) schließlich quantifiziert Bor-Gehalt, sondern ist destruktiv und intensiver zu bedienen. Beachten Sie, wie SIMS bietet insgesamt Borgehalt es nicht für Kürzungen der Anzahl der frei availabl Kontoe Ladungsträger aufgrund der Kompensation oder Passivierung von Bor-Akzeptoren mit geeigneten Spendern, wie Stickstoff oder Wasserstoff 45 44 sind.
Elektrochemisch kann Dotiermitteldichte Schiede durch Einsatz einer äußeren Kugel schnelle Elektronentransfer Redoxpaar deren formale Potenzial liegt innerhalb der Bandlücke visualisiert werden O-termini halbleitendem BDD, wie Ru (NH 3) 6 3 + / 2 + 46. Zum Beispiel, wie in 2C gezeigt ist, da der Dotierungspegel der Elektrode BDD Anstieg und das Material bewegt sich von halbleitenden, um die Stromerhöhungen sowie die Spitze-Spitze-Abstand abnimmt, wie Elektronentransfer wird leichtere metallisch. Bei metallischen Dotierungsniveaus sollte die Elektrode Verhalten ähnlich einem klassischen Elektrode, wo für einen Vermittler, wie Ru (NH 3) 6 3+, reversible Diffusion begrenzt Lebensläufe werden bei einer Makroelektrode in stationären solutio aufgezeichnet zeigenn. Hinweis an Bor-Dotierungsniveaus ~ 10 19 in der Nähe von Wendeverhalten wurde gespeichert, sondern nur für H-terminierten Oberflächen. Dies ist auf eine interessante Besonderheit dieser Oberfläche, wo H-termini bewirkt, daß die Energieniveaus der Valenz- und Leitungsband in Diamant zu erheben. Dies bedeutet einen Elektronentransfer vom Valenzband in H 3 O + ist nun möglich, was zu Oberflächenüberdotierung und eine messbare Oberflächenleitfähigkeit. Aufgrund der elektrochemischen Instabilität des H-terminierten Oberfläche, insbesondere bei hohen anodischen Potentialen, die Arbeit mit H-termini niedrigeren Dotierungsmitteldichte Elektroden ist jedoch keine langfristige brauchbarer Ansatz 7,40,41.
Die Fähigkeit, den lokalen pH-Wert der Messelektrode zu ändern hat viele verschiedene Anwendungen, zum Beispiel lokale pH-Titration nunmehr möglich geworden, wo der pH-Wert kann systematisch verändert und die Auswirkung auf das System elektrochemisch in situ beurteilt . Gebundenen Metallionen können durch eine Verringerung der pH ermöglicht die Sensorelektrode sowohl befreit werden beurteilen freien Metallgehalt beim natürlichen pH und Gesamtmetallgehalt durch lokales Verringern sehr saure Werte, in situ 47-50. Dies ist sehr nützlich für die an den Source-Messungen. Zusätzlich kann Spezies aus nicht in der elektrochemisch durch die Änderung der lokalen pH nachweisbaren nachweisbare schaltet werden, vollständig konvertiert zB gelösten Schwefelwasserstoff in das elektrochemisch detektierbare Sulfidform bei pH-Werten> 9 16. In dem gegebenen Beispiel für die Elektrodengeometrien verwendet , pH-Änderungen über 4 Einheiten (6,4 bis 2,0 und 6,0 bis 10,8) wurden demonstriert. Größere Veränderungen sind durch die Erhöhung der galvanostatischen aktuelle und die Änderung der Elektrodengeometrien möglich. B. Verringern des Abstands zwischen dem Generator und dem Detektor-Elektroden und eine Verringerung der relativen Größe des Detektors ermöglicht niedrigeren / höheren pH-Werten erreicht werden. Das Kunststückure Größe des BDD-Elektrode wird durch die Auflösung des Herstellungstechnik eingesetzt beschränkt werden. Beachten, gibt es auch eine obere Grenze für die Größe des Stromes in der Lage, für einen stabilen pH Generation weitergegeben werden. Dies wird durch den Strom bei dem der Gasentwicklung und die Blasenbildung an der Erzeugungselektrode beobachtet diktiert.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
Wir möchten Dr. Jonathan Newland für das Foto in 4B und für die Verarbeitung von optischen Mikroskop Bilder für das Video, Miss Jennifer Webb für Beratung und Visuals auf Kontaktwinkelmessungen danken, Miss Sze-yin Tan für das Lösungsmittel Fensterdaten in 2B Dr. Maxim Joseph für die Beratung über die Raman-Spektroskopie, aber auch Mitglieder der Warwick Elektrochemie und Grenzflächengruppe, die geholfen haben, die hier beschriebenen Protokolle zu entwickeln. Wir möchten auch Max Joseph, Lingcong Meng, Zoe Ayres und Roy Meyler ihrerseits in Dreharbeiten zu dem Protokoll zu danken.
Materialien
| Name | Company | Catalog Number | Comments |
| Pt Wire | Counter Electrode | ||
| Saturated Calomel Electrode | IJ Cambria Scientific Ltd. | 2056 | Reference Electrode (alternatively use Ag|AgCl) |
| BDD Electrode | Working Electrode | ||
| Iridium Tetrachloride | VWR International Ltd | 12184.01 | |
| Hydrogen Peroxide | Sigma-Aldrich | H1009 | (30% w/w) Corrosive |
| Oxalic Acid | Sigma-Aldrich | 241172 | Harmful, Irritant |
| Anhydrous Potassium Chloride | Sigma-Aldrich | 451029 | |
| Sulphuric Acid | VWR International Ltd | 102765G | (98%) Corrosive |
| Potassium Nitrate | Sigma-Aldrich | 221295 | |
| Hexaamine Ruthenium Chloride | Strem Chemicals Inc. | 44-0620 | Irritant |
| Perchloric Acid | Sigma-Aldrich | 311421 | Oxidising, Corrosive |
| 2-Propanol | Sigma-Aldrich | 24137 | Flammable |
| Nitric Acid | Sigma-Aldrich | 695033 | Oxidising, Corrosive |
| Sputter/ Evapourator | With Ti & Au targets | ||
| Raman | 514.5 nm laser | ||
| Annealing Oven | Capable of 400 °C | ||
| Ag paste | Sigma-Aldrich | 735825 | or other conductive paint |
| Potentiostat | |||
| pH Buffer solutions | Sigma-Aldrich | 38740-38752 | Fixanal buffer concentrates |
| Phenolphthalein Indicator | VWR International Ltd | 210893Q | |
| Methyl Red Indicator | Sigma-Aldrich | 32654 |
Referenzen
- Angus, J. C., Brillas, E., Huitle, C. A. M. Ch. 1, Synthetic Diamond Films: Preparation, Electrochemistry, Characterization and Applications. Electrochemistry on diamond: History and current status. , (2011).
- Fujishima, A. . Diamond Electrochemistry. , (2005).
- Macpherson, J. V. A practical guide to using boron doped diamond in electrochemical research. Physical Chemistry Chemical Physics. 17 (5), 2935-2949 (2015).
- Balmer, R. S., et al. Chemical vapour deposition synthetic diamond: materials, technology and applications. Journal of Physics: Condensed Matter. 21 (36), 364221 (2009).
- Swain, G. M., Ramesham, R. The electrochemical activity of boron-doped polycrystalline diamond thin film electrodes. Analytical Chemistry. 65 (4), 345-351 (1993).
- Luong, J. H. T., Male, K. B., Glennon, J. D. Boron-doped diamond electrode: synthesis, characterization, functionalization and analytical applications. Analyst. 134 (10), 1965-1979 (2009).
- Hutton, L. A., et al. Examination of the Factors Affecting the Electrochemical Performance of Oxygen-Terminated Polycrystalline Boron-Doped Diamond Electrodes. Analytical Chemistry. 85 (15), 7230-7240 (2013).
- Bennett, J. A., Wang, J., Show, Y., Swain, G. M. Effect of sp2-Bonded Nondiamond Carbon Impurity on the Response of Boron-Doped Polycrystalline Diamond Thin-Film Electrodes. Journal of The Electrochemical Society. 151 (9), E306-E313 (2004).
- Martin, H. B., Argoitia, A., Landau, U., Anderson, A. B., Angus, J. C. Hydrogen and Oxygen Evolution on Boron-Doped Diamond Electrodes. Journal of The Electrochemical Society. 143 (6), L133-L136 (1996).
- Panizza, M., Cerisola, G. Application of diamond electrodes to electrochemical processes. Electrochimica Acta. 51 (2), 191-199 (2005).
- Williams, O. A. Nanocrystalline diamond. Diamond and Related Materials. 20 (5-6), 5-6 (2011).
- Patel, A. N., Tan, S. -. y., Miller, T. S., Macpherson, J. V., Unwin, P. R. Comparison and Reappraisal of Carbon Electrodes for the Voltammetric Detection of Dopamine. Analytical Chemistry. 85 (24), 11755-11764 (2013).
- Watanabe, T., Honda, Y., Kanda, K., Einaga, Y. Tailored design of boron-doped diamond electrodes for various electrochemical applications with boron-doping level and sp2-bonded carbon impurities. physica status solidi (a). 211 (12), 2709-2717 (2014).
- Poferl, D. J., Gardner, N. C., Angus, J. C. Growth of boron-doped diamond seed crystals by vapor deposition. Journal of Applied Physics. 44 (4), 1428-1434 (1973).
- Spitsyn, B. V., Bouilov, L. L., Derjaguin, B. V. Vapor growth of diamond on diamond and other surfaces. Journal of Crystal Growth. 52 (Pt 1), 219-226 (1981).
- Bitziou, E., et al. In Situ Optimization of pH for Parts-Per-Billion Electrochemical Detection of Dissolved Hydrogen Sulfide Using Boron Doped Diamond Flow Electrodes. Analytical Chemistry. 86 (21), 10834-10840 (2014).
- Read, T. L., Bitziou, E., Joseph, M. B., Macpherson, J. V. In Situ Control of Local pH Using a Boron Doped Diamond Ring Disk Electrode: Optimizing Heavy Metal (Mercury) Detection. Analytical Chemistry. 86 (1), 367-371 (2014).
- Manivannan, A., Tryk, D., Fujishima, A. Detection of Trace Lead at Boron-Doped Diamond Electrodes by Anodic Stripping Analysis. Electrochemical and solid-state letters. 2 (9), 455-456 (1999).
- Manivannan, A., Seehra, M. S., Tryk, D. A., Fujishima, A. Electrochemical detection of ionic mercury at boron-doped diamond electrodes. Analytical Letters. 35 (2), 355-368 (2002).
- Boukherroub, R., et al. Photochemical oxidation of hydrogenated boron-doped diamond surfaces. Electrochemistry Communications. 7 (9), 937-940 (2005).
- Yagi, I., Notsu, H., Kondo, T., Tryk, D. A., Fujishima, A. Electrochemical selectivity for redox systems at oxygen-terminated diamond electrodes. Journal of Electroanalytical Chemistry. 473 (1), 173-178 (1999).
- Duo, I., Levy-Clement, C., Fujishima, A., Comninellis, C. Electron Transfer Kinetics on Boron-Doped Diamond Part I: Influence of Anodic Treatment. Journal of Applied Electrochemistry. 34 (9), 935-943 (2004).
- Mahé, E., Devilliers, D., Comninellis, C. Electrochemical reactivity at graphitic micro-domains on polycrystalline boron doped diamond thin-films electrodes. Electrochimica Acta. 50 (11), 2263-2277 (2005).
- Vandenabeele, P. . Practical Raman spectroscopy: an introduction. , (2013).
- Filik, J. Raman spectroscopy: a simple, non-destructive way to characterise diamond and diamond-like materials. Spectroscopy Europe. 17 (5), 10 (2005).
- Tuinstra, F., Koenig, J. L. Raman Spectrum of Graphite. The Journal of Chemical Physics. 53 (3), 1126-1130 (1970).
- Tachibana, T., Williams, B., Glass, J. Correlation of the electrical properties of metal contacts on diamond films with the chemical nature of the metal-diamond interface. II. Titanium contacts: A carbide-forming metal. Physical Review B. 45 (20), 11975 (1992).
- Zivcova, Z. V., et al. Electrochemistry and in situ Raman spectroelectrochemistry of low and high quality boron doped diamond layers in aqueous electrolyte solution. Electrochimica Acta. 87, 518-525 (2013).
- Granger, M. C., et al. Standard Electrochemical Behavior of High-Quality, Boron-Doped Polycrystalline Diamond Thin-Film Electrodes. Analytical Chemistry. 72 (16), 3793-3804 (2000).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods. Fundamentals and Applications. , (2001).
- Simonov, A. N., et al. Inappropriate Use of the Quasi-Reversible Electrode Kinetic Model in Simulation-Experiment Comparisons of Voltammetric Processes That Approach the Reversible Limit. Analytical Chemistry. 86 (16), 8408-8417 (2014).
- Terashima, C., Rao, T. N., Sarada, B. V., Spataru, N., Fujishima, A. Electrodeposition of hydrous iridium oxide on conductive diamond electrodes for catalytic sensor applications. Journal of Electroanalytical Chemistry. 544, 65-74 (2003).
- Bitziou, E., O'Hare, D., Patel, B. A. Simultaneous Detection of pH Changes and Histamine Release from Oxyntic Glands in Isolated Stomach. Analytical Chemistry. 80 (22), 8733-8740 (2008).
- Pickup, P. G., Birss, V. I. The kinetics of charging and discharging of iridium oxide films in aqueous and non-aqueous media. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 240 (1-2), 185-199 (1988).
- Baur, J. E., Spaine, T. W. Electrochemical deposition of iridium (IV) oxide from alkaline solutions of iridium(III) oxide. Journal of Electroanalytical Chemistry. 443 (2), 208-216 (1998).
- Carmody, W. R. Easily prepared wide range buffer series. Journal of Chemical Education. 38 (11), 559 (1961).
- Glab, S., Hulanicki, A., Edwall, G., Ingman, F. Metal-Metal Oxide and Metal Oxide Electrodes as pH Sensors. Critical Reviews in Analytical Chemistry. 21 (1), 29-47 (1989).
- Burgot, J. -. L. . Ionic equilibria in analytical chemistry. , (2012).
- Joseph, M. B., et al. Fabrication Route for the Production of Coplanar Diamond Insulated, Boron Doped Diamond Macro- and Microelectrodes of any Geometry. Analytical Chemistry. 86 (11), 5238-5244 (2014).
- Vanhove, E., et al. Stability of H-terminated BDD electrodes: an insight into the influence of the surface preparation. physica status solidi (a). 204 (9), 2931-2939 (2007).
- Salazar-Banda, G. R., et al. On the changing electrochemical behaviour of boron-doped diamond surfaces with time after cathodic pre-treatments. Electrochimica Acta. 51 (22), 4612-4619 (2006).
- Gelderman, K., Lee, L., Donne, S. W. Flat-Band Potential of a Semiconductor: Using the Mott-Schottky Equation. Journal of Chemical Education. 84 (4), 685 (2007).
- Ushizawa, K., et al. Boron concentration dependence of Raman spectra on {100} and {111} facets of B-doped CVD diamond. Diamond and Related Materials. 7 (11-12), 1719-1722 (1998).
- Chrenko, R. Boron, the dominant acceptor in semiconducting diamond. Physical Review B. 7 (10), 4560 (1973).
- Uzan-Saguy, C., et al. Hydrogen diffusion in B-ion-implanted and B-doped homo-epitaxial diamond: passivation of defects vs passivation of B acceptors. Diamond and Related Materials. 10 (3-7), 453-458 (2001).
- Hammerich, O., Speiser, B. . Organic Electrochemistry. , (2015).
- Juang, R. -. S., Wang, S. -. W. Electrolytic recovery of binary metals and EDTA from strong complexed solutions. Water Research. 34 (12), 3179-3185 (2000).
- Byrne, R. H., Kump, L. R., Cantrell, K. J. The influence of temperature and pH on trace metal speciation in seawater. Marine Chemistry. 25 (2), 163-181 (1988).
- Schonberger, E., Pickering, W. The influence of pH and complex formation on the ASV peaks of Pb, Cu and Cd. Talanta. 27 (1), 11-18 (1980).
- Chau, Y., Lum-Shue-Chan, K. Determination of labile and strongly bound metals in lake water. Water Research. 8 (6), 383-388 (1974).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten