Method Article
Usando o Eletrorretinograma na Avaliação da Função na Roedor Retina e os efeitos protetores do remoto Limb Pré-Condicionamento Isquêmico
Neste Artigo
Resumo
The electroretinogram (ERG) is an electrical potential generated by the retina in response to light. This paper describes how to use the ERG to assess retinal function, in dark-adapted rats, and how it can be can be used to assess a neuroprotective intervention, in the present case remote ischemic preconditioning.
Resumo
The ERG is the sum of all retinal activity. The ERG is usually recorded from the cornea, which acts as an antenna that collects and sums signals from the retina. The ERG is a sensitive measure of changes in retinal function that are pan-retinal, but is less effective for detecting damage confined to a small area of retina. In the present work we describe how to record the ‘flash’ ERG, which is the potential generated when the retina is exposed to a brief light flash. We describe methods of anaesthesia, mydriasis and corneal management during recording; how to keep the retina dark adapted; electrode materials and placement; the range and calibration of stimulus energy; recording parameters and the extraction of data. We also describe a method of inducing ischemia in one limb, and how to use the ERG to assess the effects of this remote-from-the-retina ischemia on retinal function after light damage. A two-flash protocol is described which allows isolation of the cone-driven component of the dark-adapted ERG, and thereby the separation of the rod and cone components. Because it can be recorded with techniques that are minimally invasive, the ERG has been widely used in studies of the physiology, pharmacology and toxicology of the retina. We describe one example of this usefulness, in which the ERG is used to assess the function of the light-damaged retina, with and without a neuroprotective intervention; preconditioning by remote ischemia.
Introdução
O ERG é um potencial eléctrico gerado pela retina em resposta a luz, e gravado a partir da superfície da córnea do olho. Quando as condições de gravação são geridos com cuidado, o ERG pode ser usada em uma variedade de maneiras de avaliar a função da retina. Aqui descrevemos como para gravar o 'flash ERG', o potencial gerado quando a retina é exposto a um breve flash, brilhante apresentada em um fundo Ganzfeld. O Ganzfeld dispersa a luz homogeneamente eo flash de luz atinge toda a retina aproximadamente uniformemente. Se a retina está adaptado escuro antes de gravar, e o de adaptação ao escuro é mantida como o animal é preparado para a gravação, o ERG obtido é gerado por ambos os bastonetes e cones fotorreceptores.
O flash ERG adaptação ao escuro tem uma forma de onda característica, que foi analisada em duas maneiras. Em primeiro lugar, precoce e tardio componentes da forma de onda do ERG foram distinguidos, e relacionados com a sequência de neurónioactivação ai na retina. O primeiro componente é um de curta latência negativo ido potencial, a uma onda (Figura 1). Isto é seguido por um potencial positivo Ir, chamado a onda b. A fase ascendente da onda b mostra oscilações, que são considerados um componente separado (potenciais oscilatórios ou PO). A onda um é considerado ser gerado por fotorreceptores, o b-ondas por células da camada nuclear interna, e as células PO por amacrine 1.
Com base na força do estímulo, as respostas a pisca muito fraca denominado o limiar de resposta escotópica são possíveis. O limiar de resposta escotópica é entendida para ser gerada a partir das células ganglionares da retina 2-4. Em segundo lugar, o flash ERG podem ser separados por adaptação à luz, ou por um protocolo de dois flashes descrito abaixo, em componentes rod- e orientada para o cone. Sob condições fotópicas, a uma onda não é detectável em ratazanas, pois a população cone é baixo, mas PO e uma onda b são5 claro. Nos primatas, cujas retinas têm populações superiores cone, tanto rod- e vias cone- gerar um detectável uma onda 6.
Duas medidas úteis muitas vezes extraídos do flash ERG são as amplitudes de a- e b-ondas, medidos como na Figura 1, com as respostas de flash típicos mostrados na Figura 2. Quando a população de fotorreceptores é reduzido, por exemplo por exposição a prejudicialmente brilhante luz, todos os componentes do ERG são reduzidos. Intervenções neuroprotetores, como remota pré-condicionamento isquêmico (RIP), pode ser validado pela preservação das amplitudes do a- e b-ondas (Figura 3). Em resumo, a análise do ERG permite comparações entre saudável, luz e da retina danificado neuroprotected.
Protocolo
Este protocolo segue as diretrizes de cuidados de animais de University of Sydney.
1. Os eléctrodos Factura
- Construir o eléctrodo positivo (o qual entrará em contacto com a córnea) a partir de uma (5 cm) de comprimento curto de fio de platina de 1-2 mm de diâmetro. Moldá-lo em um loop de alguns mm de diâmetro. Conecte-se este ciclo com uma vantagem convencional, o tempo suficiente para chegar à fase de entrada do seu amplificador (ver Figura 4).
- Construir o eléctrodo negativo (o que vai na boca do animal), utilizando um de Ag / AgCl sedimentar 1-2 mm de diâmetro, também ligada a uma guia convenção (ver Figura 4).
- Como um eletrodo de referência (que entrará em garupa do animal), use uma agulha hipodérmica limpo (23 G), também ligado a uma vantagem de comprimento adequado (consulte a Figura 4).
- O ideal é usar cabos de três chumbo fornecidos por fabricantes de instrumentos, para conectar os três eletrodos (U positivo94; córnea, negativo → boca, referência → traseiro) para o amplificador.
2. Conexão e Calibração do estímulo luminoso e ERG Set-up
- Criar (ou localizar) um pequeno laboratório de gravação, o que pode ser feito escuro. Equipar com uma ou ambas de uma luz sobre-o-banco de vermelho ou uma cabeça-lâmpada vermelha.
- Use um luxímetro para confirmar que a luz vermelha iluminância atingir os olhos do rato durante a instalação não exceda 1 lux.
Nota: Um filtro de densidade neutro pode ser usado para reduzir o brilho da lâmpada e a fonte de luz da lâmpada deve especificamente emitem luz vermelha. Adaptação das Trevas vai ser comprometida se fontes de luz emitem comprimentos de onda (visíveis) mais baixos. - Lacrar todos a luz difusa que entra no laboratório de gravação (isso muitas vezes exige persistência com fita opaco) e preparar um filtro de densidade neutra (este pode ser comprado em folhas) grande o suficiente para caber mais, e assim fraca, qualquer tela de computador que você terá na laboratório.
Nota: luz e Strayà luz de uma tela são suficientes para prejudicar a adaptação ao escuro do olho de rato. - Ligue o amplificador para hardware de aquisição de dados. Conecte-se, leads negativos e positivos de referência para o amplificador. Verifique se o computador ea unidade de alimentação Ganzfeld LED estão bem conectados a uma fonte de terra.
Nota: Alguns laboratórios têm-se especializado pontos de aterramento, conectado a um terreno de construção; uma tubulação de água é uma alternativa eficaz. - Calibrar a fonte de luz LED com um radiómetro de investigação de qualidade. Corrigir o sensor do medidor na posição em que o olho do animal será localizado durante uma experiência.
- Programe os LEDs Ganzfeld para executar um protocolo de campo total ERG com aumentos passo a passo em energia flash, duração do flash, flash e repetição tempo entre flashes, denominado intervalo interstimuls (ISI), configurações. Por exemplo um protocolo de campo total ver Tabela 1.
Nota: O ERG de campo total flashes aumentará de flashes ofuscantes repetitivas para bdireito pisca em uma forma sábia passo. O programa de flash duplo surge na sequência do protocolo de campo total e permite o isolamento dos bastonetes e cones respostas.
3. Dia Antes do ERG Experimentação
- Escuro adaptar ratos Sprague-Dawley, durante 12 h antes da gravação. É conveniente fazer isso no laboratório de gravação, uma vez que a luz difusa foi eliminada.
4. Dia do ERG Experimentação
- Organizar para que o animal delicadamente ser aquecido durante a gravação. Nós usamos uma plataforma de metal leve construído de modo que a cabeça do animal pode descansar no ponto correto no momento da entrada para o Ganzfeld. A plataforma tem embutido tubagem através da qual se bombeia a água pré-aquecida a 40 ° C num banho de água.
Nota: A experiência mostra que este mantém a temperatura do núcleo do animal a 37 ° C. - Pesar o rato sob condições de pouca luz. Peso recorde e make up cetamina correta (60 mg / kg) e xilazina (5 mg / kg) dose. Contenha o rato gently e injetar anestésico por via intraperitoneal.
- Nota momento da injecção. Uma vez que o animal está inconsciente (geralmente dentro de 5 min) verificar profundidade da anestesia levemente beliscar uma almofada do pé, para ver se uma resposta reflexa está presente. É melhor esperar até que esse reflexo é ausente ou fraco, antes de prosseguir.
- Aplicar uma única gota de atropina e outro de proxmethacaine a córnea.
- Corte um comprimento de 10 centímetros da linha preta. Faça um laço com um nó simples e deslizar o laço sobre o equador do olho. Aperte-o ligeiramente; o efeito é chamar o globo ocular ligeiramente para a frente, com o mínimo de pressão. Isso mantém a córnea resulta das pálpebras.
- Aplicar olho carbómero gotas à superfície da córnea. Certifique-se de carbómero permanece sobre a superfície da córnea e não derramar sobre as pálpebras ou o rosto.
- Coloque roupas de cama absorvente em cima da plataforma aquecida.
- Posição rato na cama, com a cabeça no lugar recomendado na abertura do Ganzfeld.
- Inserir intErnal sonda de temperatura no recto. Sonda de temperatura segura na posição gravando cabo de sonda para a cauda.
- Insira o eletrodo de referência (a agulha 23 G) por via subcutânea na perna de trás, e se conectar ao amplificador.
- Inserir o eléctrodo negativo (o sedimento de Ag / AgCl) de forma segura na boca. Para evitar que isso escorregar para fora da boca, apor o cabo de ligação a uma superfície estável.
- Posicionar o eléctrodo positivo ao longo do centro da córnea. Usando um micromanipulador, garantir que o eletrodo toca a córnea suavemente.
- Verifique a temperatura do corpo é a 37,0-37,5 ° C.
- Uma vez que o animal está devidamente posicionado e eletrodos estão no lugar, armar toda a configuração (Ganzfeld e animal) com um material opaco (para preservar a adaptação ao escuro). Nós usamos um pano preto macio.
- No software de aquisição fixado em uma taxa de amostragem de 2 KHz com um tempo de coleta de 100-1000 ms com 5 ms de amostragem pré-coleção. Defina os filtros passa banda para 1-1,000Hz e garantir que a amostragem é acionado para provar o período de ~ 250 ms após um flash.
- Verifique a linha de base a gravação. Deve ser livre de ruídos estranhos, mas mostrar algum ruído amplificador e uma oscilação respiratória.
- Se a linha de base mostra ruídos estranhos, começar solução de problemas. A maioria dos problemas são relacionados a derrapagem na posição do eletrodo, ou aterramento. Use uma gaiola de Faraday para garantir gravações são livres de ruídos estranhos.
- Executar um flash de teste, 0,4 log scot cd.sm -2. Uma forma de onda ERG semelhante à Figura 2A deve aparecer. Em nossas respostas típicas de laboratório para um flash cd.sm scot 0,4 log -2 são (a onda: -474 ± 39 mV e b-ondas: 1512 ± 160 mV, n = 11).
- Permitir animal escuro re-adaptar para 10 min. É conveniente utilizar estes 10 min para verificar novamente a linha de base.
- Após a confirmação do sinal estável começar a gravar.
- No fim da sessão de gravação, que vá corpo temperature foi mantida. Remover eletrodos. Reaplicar carb�ero polímero de córneas. Permitir que o animal se recuperar em uma almofada de calor até que esteja totalmente móvel e ativo, antes de retornar à habitação animal.
5. A isquemia remoto
- Execute isquemia remoto em ambos os roedores acordado ou anestesiados.
- Se o animal é anestesiado, colocá-lo em uma plataforma aquecida (acima) e coloque o manguito do esfigmomanômetro sobre a parte superior da traseira-membro, claro do joelho.
- Se os animais estão acostumados a serem tratadas, é possível executar esse procedimento sem anestesia; isto requer duas pessoas. Uma pessoa restringe o animal delicadamente eo segundo aplica-se o manguito do esfigmomanômetro e opera o esfigmomanômetro.
- Para animais acordados, use um pedaço de toalha de ~ 15 centímetros x 30-50 cm para embrulhar cuidadosamente o animal, com um hindlimb livre. Coloque o animal em sua parte traseira em (digamos) o antebraço esquerdo, com a cabeça enfiada entre o braço do suporte e torso, e lugara braçadeira como acabado de descrever.
- Esvaziar a manga e assegurar a válvula de pressão de ar é fechada. Bombear o manguito até 160 mmHg em animais anestesiados, e 180 mmHg em animais acordados. Isso excede a pressão sistólica (geralmente 140 mmHg e 160 mmHg, respectivamente).
- Manter essas pressões, conforme necessário, usando a bomba de mão.
- Após o tempo previsto para a isquemia (nós usamos dois períodos de 5 min separados por 5 min de reperfusão), esvazie a pressão do balonete, desapertando a válvula de pressão de ar.
- Confirmar o efeito de isquemia remoto com uma sonda de temperatura ligada a pele da pata. A temperatura da pele cai tipicamente 32-30 ° C, durante 5 minutos e recupera por reperfusão.
6. Danos Luz
- Certifique-se de que os ratos estão em uma noite de adaptação ao escuro, antes do procedimento danos leves.
- No momento adequado seguinte isquemia (em nossos experimentos sem atraso), cada animal é colocado isoladamente em um caixas de acrílico, with água e alimentos em recipientes à base de chão.
Nota: O dano induzido por luz só pode ser realizado em animais albinos. - Ligue uma luz branca pré-calibrado 1.000 lux em um horário padrão (geralmente 09:00) e manter esta condição durante 24 horas.
7. ERG Extração de Dados e Análise
- Adquirir formas de onda médios do ERG. Se necessário, corrigir para uma linha de base diferente de zero, por subtracção.
- Medir a amplitude da onda-um (apresentada em meados de altas intensidades de estímulo), como a diferença de tensão entre a linha de base e a primeira (<30 ms latência) da calha (Figura 1).
- Medir a amplitude da onda b como a diferença de tensão entre o pico da onda e um-a positiva da onda seguinte, que ocorre tipicamente a uma latência de 80-100 mseg (Figura 1).
- Isolar potenciais oscilatórios usando uma transformada de Fourier para filtrar dados 60-235 Hz, com uma banda de transição 90 Hz 7. Se necessário, o sinal de potencial oscilatório isolado pode então ser subtraída da forma de onda não filtrada para confirmar a identidade da calha de uma onda.
- O tempo implícita (latência) dos a- e b-picos de onda também pode ser uma medida útil (Figura 1). Use os flashes individuais para isolar a resposta rod. Subtrair a resposta de cones (flash 2) a partir da resposta mista (flash 1) para isolar a resposta da haste (Figura 2).
- Normalizar a intensidade da luz indivíduo uma onda e amplitudes da onda-b (pós-tratamento / pós-tratamento-base) ou a média para os grupos de tratamento. Curvas intensidade-resposta traçar as amplitudes de grupo e erro contra energia flash.
Resultados
O protocolo pode ser utilizado para medir a função visual da retina de roedores in vivo. A uma onda, uma medida da função de fotorreceptores, e da onda b, uma medida da função retina interna, são anotados na Figura 1.
Os dominados-rod ERG sinal aumenta com o aumento do estímulo de luz, como mostrado na Figura 2A. A onda de um torna-se aparente a ~ 0,4 log Scot cd.sm -2 e a amplitude de um dos aumentos de onda até à saturação a 2,5 log Scot cd.sm -2 (não mostrado). O paradigma de flash duplo tem sido utilizado para separar o sinal misturado ERG em cone e da haste isolado de resposta, como na Figura 2B.
Esta técnica de gravação ERG pode ser usado para verificar as intervenções neuroprotectores. A avaliação basal completou uma semana antes de danos provocados pela luz são vistos na Figura 3A. Danos provocados pela luz reduzida tanto uma onda e amplitudes da onda b, demonstrado na Fig3B ure. Pré-condicionamento isquémico remoto foi capaz de reduzir a perda de amplitude do ERG, como pode ser visto na Figura 3C. A técnica isquemia remoto depende da correcta aplicação do torniquete acima do "joelho". Incorrecta aplicação do torniquete não evitar danos luz para a retina, como visto na Figura 3D.

Figura 1: Medição do um-ondas e b-ondas a partir de uma adaptação ao escuro ERG O traço mostrado é gravado a partir da córnea de um olho adaptado ao escuro para um flash de luz brilhante dado no momento t0 mostrado.. A amplitude da onda é uma medida da linha de base para a primeira calha (seta vermelha). A amplitude da onda b é medido a partir da calha de uma onda para o seguinte pico positivo (seta azul). Implícita tempo (latência) é medido a partir do estímuloartefacto (t0) até o ponto de interesse no traçado, tal como a calha do a-onda (colchete). Por favor clique aqui para ver uma versão maior desta figura.
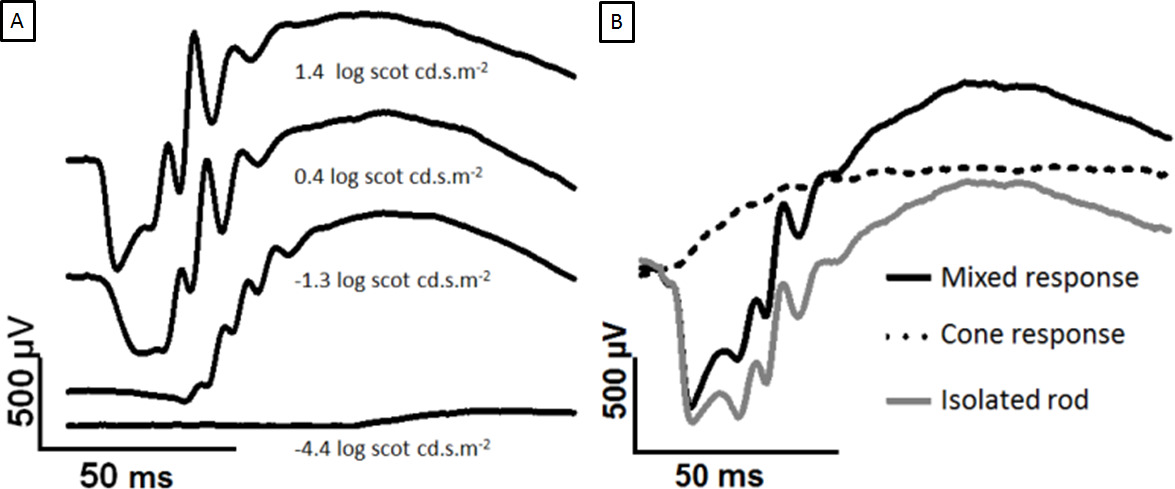
Figura 2: Desenvolvimento de adaptação ao escuro ERG com o aumento da força de flash e separação de bastonetes e cones respostas Os traços mostrados são constituídas a partir da córnea de um olho adaptado ao escuro para aumentar flashes de luz.. A onda parece um em intensidades mais brilhantes. (A) Comparando 1,4-0,4 log Scot cd.sm -2, o pico da onda b saturou mas a uma onda continua a crescer. Em (B), os flashes individuais são sobrepostas. Os dois log 2,0 scot cd.sm -2 flashes são separados por um 500 ms ISI. O primeiro flash gera um mistoresposta (preto), e o segundo flash gera uma resposta apenas de cone (linha pontilhada). Subtraindo a resposta cone produz a haste isolado resposta (cinza). Por favor clique aqui para ver uma versão maior desta figura.
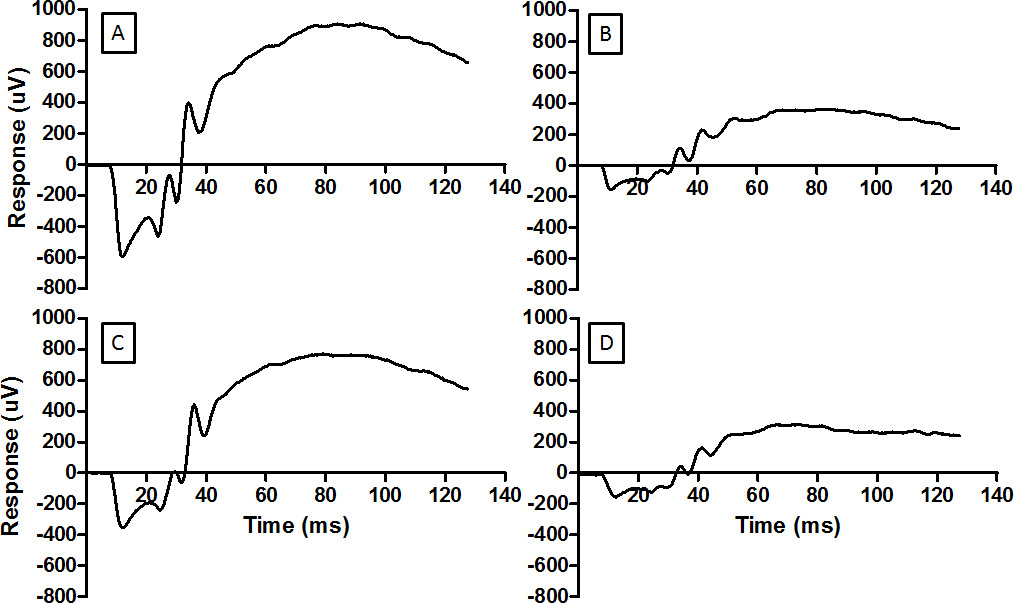
Figura 3: O ERG fornece uma medida da função da retina formas de onda representativos são mostrados aqui como (A) retina normal, (B) da retina danificado pela luz, (C) retina condicionado por RIP antes de ser exposto à luz prejudicial, e. (D) retina ineficaz condicionada por RIP e, em seguida, expostos a luz prejudicial. A mesma energia flash foi usado para cada registro (log 2,0 cd.sm -2). Para o registro em D o manguito de pressãono membro posterior foi colocado incorretamente e isquemia não foi estabelecida. Danos luz reduz a amplitude do ERG (B) e RIP atenua a redução. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4:. Feche acima do ERG eletrodos Os eletrodos a serem construídas são mostrados, esquerda para a direita; o eléctrodo positivo para contactar a córnea, o eléctrodo negativo para ser colocado na boca e o eléctrodo de referência, que é composto de uma pinça ligada a uma agulha que é então inserida na garupa subcutaneamente. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
O flash método ERG de adaptação ao escuro descrito acima é um método confiável para avaliar a função da retina em ratos. Tanto a uma onda e onda-b foram reduzidas em danos leves. Remoto pré-condicionamento isquêmico mitigado reduções de luz induzida por danos no um-ondas e b-ondas. Esta preservação da função da retina sugere que o pré-condicionamento isquêmico remoto tem induzido neuroproteção, assemelhando-se outras formas de pré-condicionamento de proteção, tais como hipóxia, isquemia e exercício 8-10. O sinal ERG gravado é determinada por três conjuntos de fatores - a configuração de gravação, parâmetros do estímulo luminoso, eo estado do animal.
Configuração de gravação
O ERG é reduzido em amplitude quando os eletrodos são colocados incorretamente ou a preparação não é completamente aterrada 11. Aterramento correto do equipamento eléctrico nas proximidades, é importante, para reduzir o ruído na gravação; se o ruído persiste uma significativa faraday gaiola deve ser usado. O eléctrodo positivo deve ser firmemente posicionada no centro da córnea com a confirmação da posição verificados antes do início do protocolo de campo total ERG e na conclusão. É importante que esta contatos dos eletrodos somente a córnea; entre em contato com a pálpebra ou mesmo bigodes pode reduzir a amplitude do sinal. Um fio de algodão solto foi usado neste protocolo para evitar que as pálpebras de tocar o eletrodo positivo. Alguns pesquisadores desenvolveram lentes de contato com o eletrodo positivo incorporado para assegurar um contato confiável e de prevenção da pálpebra comovente 12.
O estímulo de luz configurado
O estimulador temos usado fornece amplo espectro de luz branca, a partir de fontes de LED. Outras fontes de luz são adequados como estímulos luminosos, tais como iluminação xenon estroboscópicas e iluminação de halogéneo, consulte Weymouth e Vingrys para comparações entre estímulos de luz 11. A vantagem de luz LED, no entanto, is que a duração de cada emissão de luz e a sua energia são facilmente programável e repor rapidamente sobre uma vasta gama de intensidades de luz. Temos desenvolvido um conjunto de flashes de energia graduada, que no intervalo roedor de adaptação ao escuro de limiar (produzindo uma resposta apenas detectável) para saturar (produzindo uma resposta máxima).
Por tentativa e erro, nós estabelecemos interstimulus intervalos (ISIS) que garantem que a amplitude da resposta a um flash é independente de um flash anterior da mesma intensidade. Quanto mais brilhante o flash, quanto mais tempo o ISI necessário para esta independência.
Também por tentativa e erro, nós estabelecemos um número mínimo de respostas necessárias em cada energia para fornecer um sinal limpo. Uma média de mais respostas serão sempre fornecer um sinal mais limpo. Nós usamos os mínimos para que a série de energia pode ser concluída rapidamente (em nosso protocolo 11 min); conclusão rápida reduz a variação devido a mudanças no estado anestésico e allows tempo para outras variáveis a ser estudado, se necessário.
Estado do animal
Vários parâmetros da fisiologia do animal são importantes para otimizar e padronizar os registos de ERG obtidos.
Temperatura
O sinal de uma onda é gerada a partir da activação induzida pela luz de um G acoplado a uma proteína de fototransdução cascata no segmento externo; a dinâmica desta cascata são, como todas as reacções enzimáticas, 13,14 dependente da temperatura. Roedores sob anestesia são propensos a hipotermia e requerer aquecimento externo para manter uma temperatura interna de 37,5 ° C durante a gravação. Se a temperatura do corpo cai mais de 1-2 ° C, a onda A e b-onda amplitudes diminuir e aumentar suas latências 15.
Anestesia
Registos de ERG estáveis requerem o animal a estar imóvel. Os bloqueadores neuromusculares e anaesthetic agentes são utilizados em experimentação ERG para alcançar um estado inconsciente e imóvel. Houve somente cinco relatórios de gravações ERG acordado em ratos 16-20. Nestes estudos, os eléctrodos foram pré-cirurgicamente implantados no crânio e dois destes estudos testou o efeito de anestesia no ERG 17,20.
O anestésico mais comum usado para registos de ERG foi uma combinação de cetamina e xilazina (nas nossas experiências a 60 mg / kg de cetamina e 5 mg / kg de xilazina é usado). Isto afecta o ERG inferior a anestesia gasosa de isoflurano e tais halotano, e mostrou ser relativamente não-tóxico, com altas taxas de recuperação 17,21,22. Esta abordagem mantém a imobilidade dos animais durante ~ 40 min; meia dose pode ser usado para estender condições de gravação por um período similar. O estudo realizado por Chang diretamente comparou o ERG com e sem anestesia e mostraram que a cetamina-xilazina não mensurável perturbar a amplitude e as latências de a- e b-17 ondas. A maioria dos pesquisadores padronizar condições anestésicas e, em seguida, testar parâmetros experimentais; algum efeito de anestésicos não pode ser totalmente descontada.
Ambiente ocular
A fisiologia do olho requer manutenção, para otimizar e padronizar a gravação ERG. Os alunos devem ter um tamanho padrão; Isto é conseguido com um midriático, aplicado como gotas para os olhos, para alcançar a dilatação máxima. Em roedores, a atropina ou fenilefrina é usada 23. A hidratação da córnea é mantida através da aplicação de um polímero de carbómero antes da gravação; este também estabiliza condutância eléctrica entre o eléctrodo positivo e córnea. Se a córnea torna-se desidratado, formação de cicatrizes e catarata corneal pode ocorrer 24. Formação de catarata é mais comum em ratinhos 25, e vários métodos para manter a hidratação da córnea foram empregues no rato registos de ERG, incluindo um fluxo constante de fluido aquoso oucontato eletrodos estilo feitos sob medida que a hidratação armadilha na superfície da córnea 12.
Adaptive estado de retina
Esta é uma variável importante. O protocolo fornecido acima destina-se a assegurar que a retina é adaptado ao escuro, ao seu estado mais sensível. Idealmente, ratos com pigmento necessário 3 horas de habitação escuro para ser totalmente enquanto os animais não-pigmentados, como ratos Sprague Dawley de adaptação ao escuro, exigem um mínimo de 5 h 26. É uma prática padrão para gravações ERG escotópicas para adaptar os animais durante a noite durante 12 horas. Adaptação parcial ou total à luz pode ser facilmente e rapidamente alcançado por acender uma luz padrão fundo intensidade no estimulador Ganzfeld. Depois de adaptação à luz, no entanto, a adaptação ao escuro completo leva horas para conseguir; daí a sugestão de extremo cuidado para assegurar que os olhos não são expostos à luz acidentalmente antes da gravação.
A técnica de gravação ERG é limitada pelaacima fatores determinantes (ou seja, ERG e estímulo set-up) ea proficiência do investigador no teste ERG. Pesquisadores inexperientes são susceptíveis de ter registos de ERG variáveis. Variância pode ser reduzido através da criação de tamanhos de amostra grande o suficiente para comparar os resultados, tais como reduções ou ganhos na função visual. Alternativamente, as gravações ERG pode ser normalizada entre as gravações de linha de base e gravações de pós-tratamento. Os dados normalizados pode então ser agrupados e analisados. Ao apresentar dados ERG, é prática padrão para mostrar os dados de grupos e formas de onda representativos.
Quando todos os acima são cuidadosamente controladas, a amplitude do ERG é uma medida do estado funcional da retina. O ERG é consistentemente reduzida em amplitude por esgotamento da camada de fotorreceptores causada por dano ou degeneração luz geneticamente induzida 27,28. Por outro lado, o efeito protector de uma intervenção, tais como RIP pode ser detectado no amplitude do ERG 29. O ERG também tem sido usado para demonstrar os efeitos protetores do pré-condicionamento isquêmico, hipóxico pré-condicionamento, exercício, dieta e açafrão na retina 8-10,30.
Crescente conhecimento da dinâmica da cascata de fototransdução da rodopsina, e das conexões sinápticas da retina, tem incentivado o desenvolvimento de modelos de geração de ERG e sofisticada análise de forma de onda ERG é possível que a modelagem cinética com base em eventos fisiológicos conhecidos de fototransdução em fotorreceptores e nossa compreensão dos circuitos da retina interna 31. Por exemplo, a onda A modelos cinéticos baseiam-se nas etapas bioquímicas que ocorrem durante a fototransdução e ajuste do modelo permite a comparação de parâmetros do modelo, tais como as respostas de pico, atrasos temporais e sensibilidade 14.
A desvantagem de modelagem é que ele se baseia em suposições sobre circuitr retinaly, e só pode ser tão informativa quanto as premissas permitem. À luz dessa desvantagem, o modelo cinético de uma onda foi recentemente criticado por simplificar demais uma onda dinâmica 32. Em estudos de degeneração dos fotorreceptores, análise de forma de onda ERG normalmente não é realizada por uma razão diferente. Degeneração de fotorreceptores é muitas vezes graves, resultando em perdas dramáticas na função visual e, consequentemente, uma análise mais aprofundada dos parâmetros b-onda uma onda e não se justifica 8,9,27,30. Independentemente disso, a modelagem do ERG uma onda e b-ondas tem sido adotada como prática padrão em muitos estudos com roedores e informações detalhadas sobre a modelagem ERG, por uma onda, b-ondas e dos PO podem ser encontrados nos estudos de Hood, e avaliação artigos de Weymouth e Vingrys, Frishman, e Wachtmeister 11,32-34.
Em resumo, o método ERG de adaptação ao escuro apresentado pode gravar diferenças mensuráveis entre degeneração da retina com e sem intervenções neuroprotetores sdominam vários como pré-condicionamento isquêmico remoto. Os elementos essenciais para gravações ERG confiáveis têm sido descritas. As medições ERG de fotorreceptores e função retina interna são úteis para pesquisadores que estudam degenerações da retina, e os efeitos de várias intervenções genéticas, biofarmacêuticas e farmacológicas sobre a função visual.
Divulgações
Jonathan Stone é o diretor do CSCM Pty Ltd
Agradecimentos
Os autores agradecem o apoio da Sra Sharon Spana no monitoramento roedor, manipulação e experimentação. PhD apoio financeiro foi fornecido pela Universidade de Sydney e do Centro Australiano de Investigação de Excelência em Vision.
Materiais
| Name | Company | Catalog Number | Comments |
| PC computer | |||
| Powerlab, 4 channel acquistion hardware | AD Instruments | PL 35044 | Acquistion of ERG |
| Animal Bio Amp | AD Instruments | FE 136 | Amplifier for ERG |
| Lab chart | AD Instruments | Signal collection software | |
| Ganzfield | Photometric solutions | FS-250A | Light stimulus |
| Ganzfield operating system | Photometric solutions | ||
| Research Radiometer | International light technologies | ILT-1700 | calibrate light series |
| Lux meter | LX-1010B | check red light illumanation | |
| Excel | Microsoft | ||
| Lead wires | AD Instruments | Connect postive, negative ground electrodes to amplifier | |
| Lead wires - alligator | AD Instruments | ground ganzfield and acquistion hardware to computer | |
| Platinum wire 95% | A&E metals | postive electrode | |
| Mouth electrode Ag/AgCl Pellet | SDR | E205 | negative electode |
| 26 G needle | BD | ground electode | |
| Water pump | |||
| Water bath | |||
| Tubing | |||
| Homeothermic blanket system with flexible probe | Harvard Appartus | 507222F | |
| Atropine 1% w/v | Bausch & Lomb | topical mydriasis | |
| Proxmethycaine 0.5% w/v | Bausch & Lomb | topical anaesthetic | |
| Visco tears eye drops | Novartis | carbomer polymer | |
| Thread | retract eye lid | ||
| Tweezers | |||
| Reusable adhesive | Blu tac | Dim red headlamp. Affix electrodes | |
| Absorbent bedding | |||
| Ketamil - ketamine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | dissociative | |
| Xylium - Xylazine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | muscle relaxant | |
| Scale |
Referências
- Arden, G. B., Heckenlively, J. . Principles and practice of clinical electrophysiology of vision. , 139-183 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. Journal of Physiology-London. 555 (1), 153-173 (2004).
- Fortune, B., et al. Selective ganglion cell functional loss in rats with experimental glaucoma. Investigative Ophthalmology & Visual Science. 45 (6), 1854-1862 (2004).
- Alarcon-Martinez, L., et al. Short and long term axotomy-induced ERG changes in albino and pigmented rats. Molecular Vision. 15 (254-255), 2373-2383 (2009).
- Lyubarsky, A. L., et al. Functionally rodless mice: transgenic models for the investigation of cone function in retinal disease and therapy. Vision Research. 42 (4), 401-415 (2002).
- Bush, R. A., Sieving, P. A. . A PROXIMAL RETINAL COMPONENT IN THE PRIMATE PHOTOPIC ERG A-WAVE. Investigative Ophthalmology & Visual Science. 35 (2), 635-645 (1994).
- Liu, K., et al. Development of the electroretinographic oscillatory potentials in normal and ROP rats. Investigative Ophthalmology & Visual Science. 47 (12), 5447-5452 (2006).
- Casson, R. J., Wood, J. P. M., Melena, J., Chidlow, G., Osborne, N. N. The effect of ischemic preconditioning on light-induced photoreceptor injury. Investigative Ophthalmology & Visual Science. 44 (3), 1348-1354 (2003).
- Lawson, E. C., et al. Aerobic Exercise Protects Retinal Function and Structure from Light-Induced Retinal Degeneration. Journal of Neuroscience. 34 (7), 2406-2412 (2014).
- Grimm, C., et al. HIF-1-induced erythropoietin in the hypoxic retina protects against light-induced retinal degeneration. Nature Medicine. 8 (7), 718-724 (2002).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: Methods for extraction and interpretation of rod and cone responses. Progress in Retinal and Eye Research. 27 (1), 1-44 (2008).
- Bayer, A. U., Cook, P., Brodie, S. E., Maag, K. P., Mittag, T. Evaluation of different recording parameters to establish a standard for flash electroretinography in rodents. Vision Research. 41 (17), 2173-2185 (2001).
- Pugh, E. N., Lamb, T. D. AMPLIFICATION AND KINETICS OF THE ACTIVATION STEPS IN PHOTOTRANSDUCTION. Biochimica Et Biophysica Acta. 1141 (2-3), 111-149 (1993).
- Breton, M. E., Schueller, A. W., Lamb, T. D., Pugh, E. N. ANALYSIS OF ERG A-WAVE AMPLIFICATION AND KINETICS IN TERMS OF THE G-PROTEIN CASCADE OF PHOTOTRANSDUCTION. Investigative Ophthalmology & Visual Science. 35 (1), 295-309 (1994).
- Mizota, A., Adachi-Usami, E. Effect of body temperature on electroretinogram of mice. Investigative Ophthalmology & Visual Science. 43 (12), 3754-3757 (2002).
- Szabo-Salfay, O., et al. The electroretinogram and visual evoked potential of freely moving rats. Brain Research Bulletin. 56 (1), 7-14 (2001).
- Charng, J., et al. Conscious Wireless Electroretinogram and Visual Evoked Potentials in Rats. Plos One. 8 (9), (2013).
- Galambos, R., Juhasz, G., Kekesi, A. K., Nyitrai, G., Szilagyi, N. NATURAL SLEEP MODIFIES THE RAT ELECTRORETINOGRAM. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5153-5157 (1994).
- Galambos, R., Szabo-Salfay, O., Szatmar, E., Szilagyi, N., Juhasz, G. Sleep modifies retinal ganglion cell responses in the normal rat. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 2083-2088 (2001).
- Guarino, I., Loizzo, S., Lopez, L., Fadda, A., Loizzo, A. A chronic implant to record electroretinogram, visual evoked potentials and oscillatory potentials in awake, freely moving rats for pharmacological studies. Neural Plasticity. 11 (3-4), 241-250 (2004).
- Huang, J. C., Salt, T. E., Voaden, M. J., Marshall, J. NON-COMPETITIVE NMDA-RECEPTOR ANTAGONISTS AND ANOXIC DEGENERATION OF THE ERG B-WAVE IN-VITRO. Eye (London). 5 (4), 476-480 (1991).
- Sasovetz, D. . KETAMINE HYDROCHLORIDE - EFFECTIVE GENERAL ANESTHETIC FOR USE IN ELECTRORETINOGRAPHY. Annals of Ophthalmology. 10 (11), 1510-1514 (1978).
- Mojumder, D. K., Wensel, T. G. Topical Mydriatics Affect Light-Evoked Retinal Responses in Anesthetized Mice). Investigative Ophthalmology & Visual Science. 51 (1), 567-576 (2010).
- Fraunfel, F. t., Burns, R. P. ACUTE REVERSIBLE LENS OPACITY - CAUSED BY DRUGS, COLD, ANOXIA, ASPHYXIA, STRESS, DEATH AND DEHYDRATION. Experimental Eye Research. 10 (1), 19 (1970).
- Calderone, L., Grimes, P., Shalev, M. ACUTE REVERSIBLE CATARACT INDUCED BY XYLAZINE AND BY KETAMINE-XYLAZINE ANESTHESIA IN RATS AND MICE. Experimental Eye Research. 42 (4), 331-337 (1986).
- Behn, D., et al. Dark adaptation is faster in pigmented than albino rats. Documenta Ophthalmologica. 106 (2), 153-159 (2003).
- Sugawara, T., Sieving, P. A., Bush, R. A. Quantitative relationship of the scotopic and photopic ERG to photoreceptor cell loss in light damaged rats. Experimental Eye Research. 70 (5), 693-705 (2000).
- Machida, S., et al. P23H rhodopsin transgenic rat: Correlation of retinal function with histopathology. Investigative Ophthalmology & Visual Science. 41 (10), 3200-3209 (2000).
- Brandli, A., Stone, J. Remote Ischemia Influences the Responsiveness of the Retina. Observations in the Rat. Investigative Ophthalmology & Visual Science. 55 (4), 2088-2096 (2014).
- Maccarone, R., Di Marco, S., Bisti, S. Saffron supplement maintains morphology and function after exposure to damaging light in mammalian retina. Investigative Ophthalmology & Visual Science. 49 (3), 1254-1261 (2008).
- Hood, D. C., Birch, D. G. Assessing abnormal rod photoreceptor activity with the a-wave of the electroretinogram: Applications and methods. Documenta Ophthalmologica. 92 (4), 253-267 (1996).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Progress in Retinal and Eye Research. 39, 1-22 (2014).
- Hood, D. C., Birch, D. G. A COMPUTATIONAL MODEL OF THE AMPLITUDE AND IMPLICIT TIME OF THE B-WAVE OF THE HUMAN ERG. Visual Neuroscience. 8 (2), 107-126 (1992).
- Wachtmeister, L. Oscillatory potentials in the retina: what do they reveal. Progress in Retinal and Eye Research. 17 (4), 485-521 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados