Method Article
Utilizando el Electrorretinograma para evaluar la función en el Roedor Retina y los efectos protectores de distancia Limb Preacondicionamiento Isquémico
En este artículo
Resumen
The electroretinogram (ERG) is an electrical potential generated by the retina in response to light. This paper describes how to use the ERG to assess retinal function, in dark-adapted rats, and how it can be can be used to assess a neuroprotective intervention, in the present case remote ischemic preconditioning.
Resumen
The ERG is the sum of all retinal activity. The ERG is usually recorded from the cornea, which acts as an antenna that collects and sums signals from the retina. The ERG is a sensitive measure of changes in retinal function that are pan-retinal, but is less effective for detecting damage confined to a small area of retina. In the present work we describe how to record the ‘flash’ ERG, which is the potential generated when the retina is exposed to a brief light flash. We describe methods of anaesthesia, mydriasis and corneal management during recording; how to keep the retina dark adapted; electrode materials and placement; the range and calibration of stimulus energy; recording parameters and the extraction of data. We also describe a method of inducing ischemia in one limb, and how to use the ERG to assess the effects of this remote-from-the-retina ischemia on retinal function after light damage. A two-flash protocol is described which allows isolation of the cone-driven component of the dark-adapted ERG, and thereby the separation of the rod and cone components. Because it can be recorded with techniques that are minimally invasive, the ERG has been widely used in studies of the physiology, pharmacology and toxicology of the retina. We describe one example of this usefulness, in which the ERG is used to assess the function of the light-damaged retina, with and without a neuroprotective intervention; preconditioning by remote ischemia.
Introducción
El ERG es un potencial eléctrico generado por la retina en respuesta a la luz, y grabado de la superficie corneal del ojo. Cuando las condiciones de grabación se manejan con cuidado, el ERG se puede utilizar en una variedad de maneras para evaluar la función de la retina. Aquí describimos cómo grabar el 'Flash ERG', el potencial generado cuando la retina se expone a un breve, flash brillante presentado en un fondo Ganzfeld. El Ganzfeld dispersa la luz de forma homogénea y el flash de la luz alcanza toda la retina aproximadamente uniforme. Si la retina está oscuro adaptado antes de grabar, y la oscuridad, la adaptación se mantiene como el animal se prepara para la grabación, el ERG obtenido se genera por ambas fotorreceptores conos y bastones.
El oscuro-adaptado de flash ERG tiene una forma de onda característica, que ha sido analizada de dos maneras. En primer lugar, principios y finales de los componentes de la forma de onda ERG se han distinguido, y en relación con la secuencia de la neuronaal activación en la retina. El primer componente es una latencia corta en sentido negativo potencial, la onda a (Figura 1). Esto es seguido por un potencial positivo va, llamada la onda b. La fase ascendente de la onda b muestra oscilaciones, que se consideran un componente separado (potenciales oscilatorios o PO). La onda a se considera que está generada por fotorreceptores, la onda b por las células de la capa nuclear interna, y los PO por las células amacrinas 1.
Sobre la base de la fuerza del estímulo, las respuestas a destellos muy tenues denominan el umbral de respuesta escotópica son posibles. El umbral de respuesta escotópica se entiende que ser generado a partir de las células ganglionares de la retina 2-4. En segundo lugar, el flash ERG se puede separar por adaptación a la luz, o por un protocolo de dos flash descritos a continuación, en componentes de bastón y cono impulsada. En condiciones fotópicas, la onda a es no detectable en ratas, porque la población de cono es baja, pero PO y una onda b sonclaro 5. En los primates, cuyas retinas tienen poblaciones cono superior, tanto de varilla y las vías de cono generan una detectable una onda 6.
Dos medidas útiles a menudo extraídos de la ERG flash son las amplitudes de la a- y b-ondas, medidos como en la Figura 1, con respuestas de flash típicos mostrados en la Figura 2. Cuando la población fotorreceptor se reduce, por ejemplo por la exposición a damagingly brillante luz, se reducen todos los componentes del ERG. Intervenciones neuroprotectoras, como a distancia precondicionamiento isquémico (RIP), pueden ser validados por la preservación de las amplitudes de la a- y b-ondas (Figura 3). En resumen, el análisis de la ERG permite comparaciones entre sana, ligera y de la retina dañada neuroprotected.
Protocolo
Este protocolo sigue las directrices de cuidado de animales de la Universidad de Sydney.
1. Electrodos Fabricadores
- Construir el electrodo positivo (el que se pondrá en contacto la córnea) a partir de un corto (5 cm) longitud de alambre de platino 1-2 mm de diámetro. Moda en un bucle de unos pocos milímetros de diámetro. Conecte este lazo a una ventaja convencional, el tiempo suficiente para llegar a la etapa de entrada del amplificador (ver Figura 4).
- Construir el electrodo negativo (que irá en la boca del animal) utilizando un Ag / AgCl pellet 1-2 mm de diámetro, también conectado a una ventaja de convención (véase la Figura 4).
- Como electrodo de referencia (que entrará en la grupa del animal), utilice una aguja hipodérmica limpia (23 G), también conectado a un cable de longitud adecuada (ver Figura 4).
- Lo ideal es usar cables de tres líderes proporcionadas por los fabricantes de instrumentos, para conectar los tres electrodos (U positivo94; córnea, negativo → boca, la referencia → grupa) al amplificador.
2. Conexión y calibración del estímulo de luz y ERG Set-up
- Crear (o localizar a) un laboratorio de grabación pequeño, que puede hacerse oscuro. Equipar con uno o ambos de una luz sobre-el-banco hecho de color rojo o una cabeza con lámpara roja.
- Use un medidor de luz para confirmar que la iluminación de luz roja alcanzando el ojo de la rata durante la instalación no exceda de 1 lux.
Nota: un filtro de densidad neutra se puede utilizar para reducir el brillo de la lámpara y la fuente de luz de la lámpara debe emitir específicamente luz roja. Adaptación oscuro se verá comprometida si las fuentes de luz emiten bajas (longitudes de onda visibles). - Sellar toda la luz parásita que entra en el laboratorio de grabación (esto a menudo requiere persistencia con cinta opaca) y preparar un filtro de densidad neutra (esto se puede comprar en las hojas) lo suficientemente grande como para caber en, y tan tenue, cualquier pantalla de ordenador que tendrá en el laboratorio.
Nota: La luz parásita yla luz de una pantalla son suficientes para perjudicar adaptación a la oscuridad de los ojos de rata. - Conecte el amplificador al hardware de adquisición de datos. Conecte cables positivo, negativo y de referencia para el amplificador. Asegúrese de que el ordenador y la fuente de alimentación Ganzfeld LED estén bien conectados a una fuente de tierra.
Nota: Algunos laboratorios han especializado puntos de puesta a tierra, conectado a una tierra del edificio; una pipa de agua es una alternativa eficaz. - Calibrar la fuente de luz LED con un radiómetro-calidad de la investigación. Fije el sensor del medidor en la posición en la que los ojos del animal se encuentra durante un experimento.
- Programa de los LED Ganzfeld para ejecutar un protocolo ERG de campo completo con aumentos graduales en la energía flash, duración del flash, flash de repetición y el tiempo entre destellos, denominado intervalo interstimuls (ISI), los ajustes. Por ejemplo, un protocolo de campo completo véase el cuadro 1.
Nota: El campo completo ERG destellos aumentan de destellos tenues repetitivas abderecha parpadea de una manera sabia paso. El programa de flash doble continuación del protocolo de campo completo y permite el aislamiento de las respuestas de conos y bastones.
3. Día Antes de ERG Experimentación
- Oscuro adaptarse ratas Sprague-Dawley de 12 hr antes de la grabación. Es conveniente hacer esto en el laboratorio de grabación, una vez que la luz externa se ha eliminado.
4. Día de ERG Experimentación
- Haga arreglos para que el animal sea calienta suavemente durante la grabación. Utilizamos una plataforma de metal ligero construido de manera que la cabeza del animal puede descansar en el punto correcto en la entrada a la Ganzfeld. La plataforma tiene tubo incorporado a través del cual bombeamos agua precalentada a 40 ° C en un baño de agua.
Nota: La experiencia demuestra que esto mantiene la temperatura central del animal a 37 ° C. - Pesar la rata en condiciones de oscuridad. Apunte el peso y compensar ketamina correcta (60 mg / kg) y xilazina (5 mg / kg) dosis. Restringir la rata gently e inyectar anestesia por vía intraperitoneal.
- Nota momento de la inyección. Una vez que el animal está inconsciente (generalmente dentro de 5 min) comprobar la profundidad de la anestesia ligeramente pellizcar una almohadilla del pie, para ver si una respuesta refleja está presente. Lo mejor es esperar hasta que este reflejo está ausente o débil, antes de proceder.
- Aplique una gota de atropina y otro de proxmethacaine a la córnea.
- Cortar una longitud de 10 cm de hilo negro. Haga un lazo con un nudo simple y deslice el aro sobre el ecuador del ojo. Apriete ligeramente; el efecto es dibujar el globo ocular ligeramente hacia adelante, con una presión mínima. Esto mantiene la córnea clara de los párpados.
- Aplicar ojo carbómero cae a la superficie de la córnea. Asegurar carbómero permanece en la superficie de la córnea y no se derrame en los párpados o la cara.
- Coloque la ropa de cama absorbente en la parte superior de la plataforma climatizada.
- Posición de la rata en la ropa de cama, con la cabeza en el lugar recomendado en la apertura de la Ganzfeld.
- Insertar intsonda de temperatura ernal en el recto. Sonda de temperatura segura en posición con cinta adhesiva el cable de la sonda a la cola.
- Inserte el electrodo de referencia (la aguja 23 G) por vía subcutánea en la pata trasera, y conectarse a un amplificador.
- Coloque el electrodo negativo (el sedimento de Ag / AgCl) de forma segura en la boca. Para evitar que esto se salga de la boca, colocar el cable de conexión a una superficie estable.
- Coloque el electrodo positivo sobre el centro de la córnea. El uso de un micromanipulador, asegúrese de que el electrodo toca la córnea con suavidad.
- Revise la temperatura del cuerpo está en 37,0 a 37,5 ° C.
- Una vez que el animal esté correctamente colocado y electrodos están en su lugar, cubrir toda la configuración (Ganzfeld y animal) con un material opaco (para preservar la adaptación a la oscuridad). Utilizamos un paño negro suave.
- En el software de adquisición ajustado a una frecuencia de muestreo de 2 KHz con un tiempo de colección de 100 a 1000 ms con 5 ms de muestreo pre-colección. Establezca los filtros de paso de banda para 1-1.000Hz y asegurar que el muestreo se activa para probar el periodo de ~ 250 ms después de un flash.
- Compruebe la línea de base de la grabación. Debe estar libre de ruidos extraños, pero muestran un poco de ruido del amplificador y una oscilación respiratoria.
- Si la línea de base muestra ruidos extraños, comenzará la solución de problemas. La mayoría de los problemas están relacionados con el deslizamiento en la posición del electrodo, o de puesta a tierra. Utilice una jaula de Faraday para garantizar grabaciones están libres de ruidos extraños.
- Ejecute un destello de prueba, 0,4 log scot cd.sm -2. Una forma de onda ERG similar a la figura debería aparecer 2A. En nuestras respuestas típicas de laboratorio para un 0,4 log scot cd.sm -2 Flash son (una onda: -474 ± 39 mV y la onda b: 1.512 ± 160 mV, n = 11).
- Deje que los animales a oscuro re-adaptarse durante 10 min. Es conveniente utilizar estos 10 min para volver a comprobar la línea de base.
- Tras la confirmación de señal estable comenzar la grabación.
- Al final de la sesión de grabación, compruebe que temperat cuerpose mantuvo ure. Retire los electrodos. Vuelva a aplicar polímero carbómero de córneas. Deje que el animal se recupere en una almohadilla de calor hasta que es completamente móvil y activo, antes de regresar a la vivienda de los animales.
5. La isquemia a distancia
- Realizar isquemia a distancia, ya sea en roedores despiertos o anestesiados.
- Si se anestesia el animal, lo pondré sobre una plataforma climatizada (arriba) y deslice el manguito del esfigmomanómetro sobre la parte superior de la extremidad posterior, clara de la rodilla.
- Si los animales están acostumbrados a ser manejado, es posible llevar a cabo este procedimiento sin anestesia; esto requiere dos personas. A una persona le restringe el animal suavemente, y la segunda se aplica el manguito del esfigmomanómetro y opera el esfigmomanómetro.
- Para los animales despiertos, use un pedazo de toalla de ~ 15 cm x 30 a 50 cm para envolver suavemente el animal, con un solo miembro posterior libre. Colocar el animal en la espalda a (por ejemplo) el antebrazo izquierdo, con la cabeza metida entre el brazo y el torso del titular, y el lugarel brazalete como se acaba de describir.
- Desinflar el manguito y asegurar la válvula de presión de aire se cierra. Bombee el manguito a 160 mmHg en animales anestesiados, y 180 mmHg en animales despiertos. Esto supera la presión sistólica (generalmente 140 mmHg y 160 mmHg respectivamente).
- Mantener estas presiones, según sea necesario, utilizando la bomba de mano.
- Después de la hora prevista para la isquemia (usamos 2 períodos de 5 min separadas por 5 min de reperfusión), desinflar la presión del manguito aflojando la válvula de presión de aire.
- Confirmar el efecto de la isquemia a distancia con una sonda de temperatura de la piel unida a la almohadilla de la pata. Temperatura de la piel por lo general cae 32-30 ° C, durante 5 min y se recupera en la reperfusión.
6. Daño Luz
- Asegúrese de que las ratas están en un oscuro adaptado durante la noche, antes de que el procedimiento de daño de la luz.
- En el momento apropiado después de isquemia de las extremidades (en nuestros experimentos sin demora), cada animal se coloca en solitario en una cajas de plexiglás, wiª de agua y alimentos en recipientes con base de suelo.
Nota: El daño inducido por la luz sólo puede llevarse a cabo en animales albinos. - Encender una luz blanca pre-calibrado 1.000 lux a un tiempo estándar (normalmente 09 a.m.) y mantener esta condición durante 24 horas.
7. ERG extracción de datos y análisis
- Adquirir formas de onda promediados del ERG. Si es necesario, correcto para una línea de base distinto de cero, por sustracción.
- Medir la amplitud de la onda a (presentado en mediados a altas intensidades de estímulo), como la diferencia de voltaje entre la línea de base y la primera (<30 mseg latencia) canal (Figura 1).
- Mida la amplitud de la onda b como la diferencia de voltaje entre el pico de la onda A y el positivo de la siguiente ola, que se producen normalmente en una latencia de 80 a 100 ms (Figura 1).
- Aislar potenciales oscilatorios mediante el uso de una transformada de Fourier para filtrar los datos 60 a 235 Hz, con una banda de transición 90 Hz 7. Si se requiere la señal potencial oscilatorio aislado puede entonces ser restada de la forma de onda sin filtrar para confirmar la identidad de la vaguada de onda a.
- El tiempo implícito (latencia) de los picos A y B de onda también puede ser una medida útil (Figura 1). Utilice los destellos individuales para aislar la respuesta varilla. Restar la respuesta de los conos (flash 2) de la respuesta mixta (flash 1) para aislar la respuesta de varilla (Figura 2).
- Normalizar la intensidad de luz individual una onda y amplitudes de onda b (post-tratamiento / post-tratamiento-base) o un promedio de grupos de tratamiento. Curvas Intensidad-respuesta trazar las amplitudes de grupo y de error contra la energía flash.
Resultados
El protocolo se puede utilizar para medir la función visual de la retina de roedores in vivo. La onda a, una medida de la función de los fotorreceptores, y la onda b, una medida de la función de la retina interna, se anotan en la Figura 1.
Las señales ERG aumentos de barra dominadas con el creciente estímulo de luz, como se muestra en la Figura 2A. La onda se convierte en un aparente en ~ 0,4 log scot cd.sm -2 y la amplitud de la onda aumenta hasta una saturación en 2,5 log scot cd.sm -2 (no mostrado). El paradigma twin flash ha sido utilizado para separar señal mixta ERG en cono y el aislado de varilla de respuesta, como en la Figura 2B.
Esta técnica de grabación de ERG se puede utilizar para comprobar las intervenciones neuroprotectores. Grabaciones basales completaron una semana antes de daño de la luz se ven en la figura 3A. Daño de la luz reducida tanto una onda y amplitudes de onda b, demostrado en la figura3B Ure. Precondicionamiento isquémico remoto fue capaz de reducir la pérdida de ERG amplitud, como se ve en la Figura 3C. La técnica de isquemia a distancia depende de la aplicación correcta de la torniquete por encima de la "rodilla". Aplicación incorrecta del torniquete no previene daño de la luz a la retina, como se ve en la figura 3D.

Figura 1: Medición de la onda a y b-ondas desde una adaptada a la oscuridad ERG La traza mostrada se registra de la córnea de un ojo adaptado a la oscuridad a un brillante destello de luz dada en el momento se muestra t0.. La amplitud de la onda a se mide desde la línea base hasta la primera artesa (flecha roja). La amplitud de la onda b se mide desde el punto más bajo de la onda a la siguiente pico positivo (flecha azul). Implícito tiempo (latencia) se mide desde el estímuloartefacto (t0) hasta el punto de interés en la traza, como el canal de la una onda (corchetes). Haga clic aquí para ver una versión más grande de esta figura.
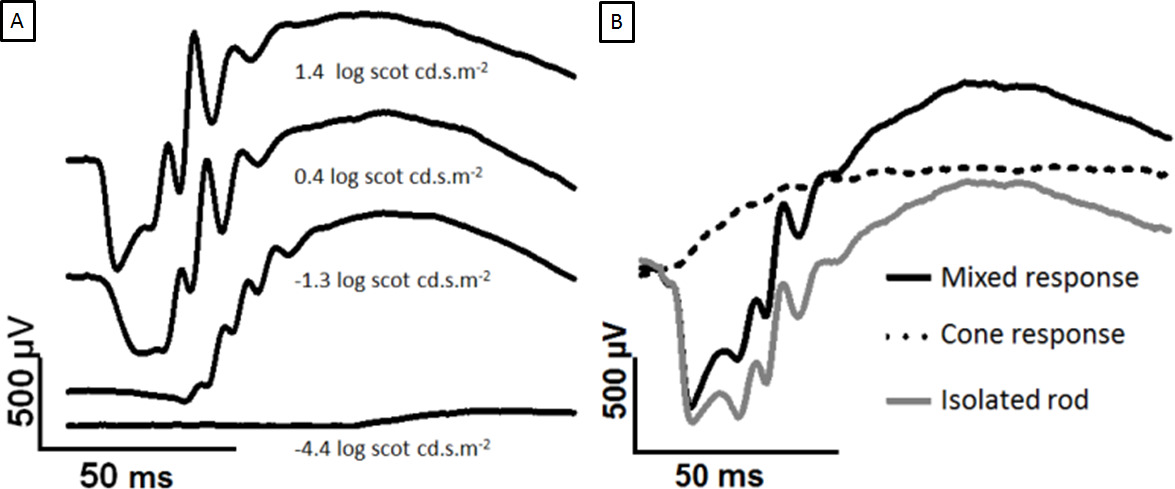
Figura 2: Desarrollo de adaptado a la oscuridad ERG con el aumento de la fuerza del flash y la separación de las respuestas de conos y bastones Las huellas muestran se registran desde la córnea de un ojo adaptado a la oscuridad a la creciente destellos de luz.. La onda a aparece a intensidades más brillantes. (A) La comparación de 1,4-0,4 log scot cd.sm -2, la onda b pico ha saturado pero la onda a sigue creciendo. En (B), los destellos individuales se superponen. Los dos log 2,0 scot cd.sm -2 flashes están separados por un 500 ISI ms. El primer flash genera una mixtarespuesta (negro), y el segundo flash genera una respuesta de cono solamente (línea de puntos). Restando la respuesta cono produce la respuesta varilla aislada (gris). Haga clic aquí para ver una versión más grande de esta figura.
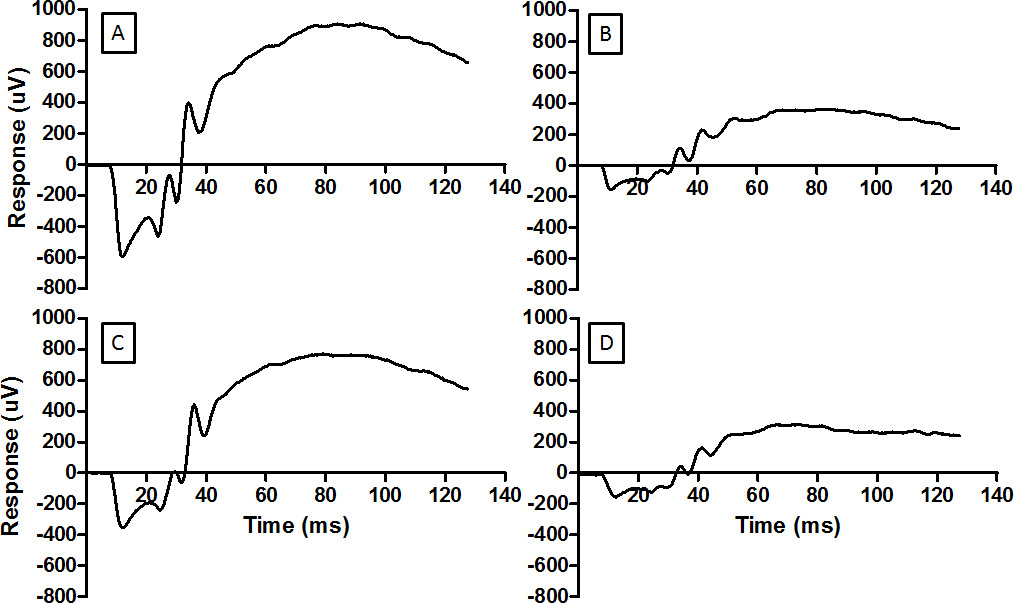
Figura 3: El ERG proporciona una medida de la función de la retina formas de onda representativos se muestran aquí por (A) retina normal, (B) retina dañada por la luz, (C) retina condicionada por RIP antes de ser expuestos a la luz dañina, y. (D) retina ineficazmente condicionada por RIP y luego expuesto a la luz dañina. La misma energía del flash se utiliza para cada registro (log 2,0 cd.sm -2). Para el registro en D el manguito de presiónen la extremidad posterior se colocó incorrectamente y la isquemia no se estableció. Daño de la luz reduce la amplitud de la ERG (B) y RIP mitiga la reducción. Por favor, haga clic aquí para ver una versión más grande de esta figura.

Figura 4:. Cierre de electrodos ERG Los electrodos que se construyan se muestran, de izquierda a derecha; el electrodo positivo al contacto con la córnea, el electrodo negativo que se coloca en la boca y el electrodo de referencia, que se compone de una pinza conectada a una aguja que se inserta en la vía subcutánea grupa. Haga clic aquí para ver una versión más grande de esta cifra.
Discusión
El método ERG flash adaptada a la oscuridad descrito anteriormente es un método fiable para evaluar la función de la retina en ratas. Tanto la onda ay la onda b se redujeron en un daño de la luz. Remoto precondicionamiento isquémico mitigado reducciones inducidas daños-luz en la onda ay la onda b. Esta preservación de la función retiniana sugiere que el precondicionamiento isquémico remoto ha inducido neuroprotección, asemejándose a otras formas de acondicionamiento previo de protección, tales como hipoxia, isquemia y ejercicio 8-10. La señal ERG registrada está determinada por tres conjuntos de factores - la configuración de la grabación, los parámetros del estímulo de luz, y el estado del animal.
Configuración de grabación
El ERG se reduce en amplitud cuando los electrodos se colocan de forma incorrecta o la preparación se forma incompleta a tierra 11. Conexión a tierra correcta de los equipos eléctricos cercanos es importante, para reducir el ruido en la grabación; si el ruido persiste una significativa faradioay jaula debe ser utilizado. El electrodo positivo se debe colocar de forma segura en el centro de la córnea con la confirmación de la posición marcada antes de iniciar el protocolo de campo completo ERG y en la terminación. Es importante que este electrodo contactos solamente la córnea; en contacto con el párpado o incluso los bigotes pueden reducir la amplitud de la señal. Un hilo de algodón suelta se ha utilizado en este protocolo para evitar que los párpados de tocar el electrodo positivo. Algunos investigadores han desarrollado lentes de contacto con el electrodo positivo incrustado para asegurar un contacto fiable y la prevención de párpado tocar 12.
El estímulo de luz creó
El estimulador hemos utilizado proporciona luz blanca de amplio espectro, de fuentes LED. Otras fuentes de luz son adecuados como estímulos de luz, como la iluminación estroboscópica de xenón e iluminación halógena, consulte Weymouth y Vingrys para las comparaciones entre los estímulos de luz 11. La ventaja de la luz LED, sin embargo, ies que la duración de cada destello y su energía son fácilmente programable y restablece rápidamente en un amplio intervalo de intensidades de luz. Hemos desarrollado una serie de destellos de energía graduada, que en el rango de roedores adaptada a la oscuridad del umbral (que producen una respuesta justa detectable) para saturar (que produce una respuesta máxima).
Por ensayo y error, hemos establecido interstimulus intervalos (ISIS) que aseguran que la amplitud de la respuesta a un flash es independiente de un flash precedente de la misma intensidad. Cuanto más brillante el flash, el más largo es el ISI requerido para esta independencia.
También por ensayo y error hemos establecido un número mínimo de respuestas requeridas en cada energía para proporcionar una señal limpia. Un promedio de más respuestas siempre proporcionarán una señal más limpia. Utilizamos los mínimos por lo que la serie de energía puede completarse rápidamente (en el protocolo 11 min); finalización rápida reduce la variación debido a cambios en el estado anestésico y allows tiempo para otras variables a estudiar, si es necesario.
Estado del animal
Varios parámetros de la fisiología del animal son importantes para optimizar y estandarizar las grabaciones ERG obtenidos.
Temperatura
La señal de onda a se genera a partir de la activación inducida por la luz de un acoplado a proteína G cascada de fototransducción en el segmento externo; la dinámica de esta cascada son, como todas las reacciones enzimáticas, dependiente de la temperatura 13,14. Roedores bajo anestesia son propensos a la hipotermia y requieren calentamiento externo para mantener una temperatura interna de 37,5 ° C a lo largo de la grabación. Si la temperatura corporal cae más de 1.2 ° C, las amplitudes de una onda y b-onda disminuyen y sus latencias aumentan 15.
Anestesia
Grabaciones ERG estables requieren el animal a ser inmóvil. Bloqueantes neuromusculares y anaesthetagentes ic se utilizan en ERG experimentación para lograr un estado inconsciente e inmóvil. Sólo ha habido cinco reportes de grabaciones ERG despierto en ratas 16-20. En estos estudios, los electrodos fueron quirúrgicamente pre-implantado en el cráneo y dos de estos estudios probaron el efecto de la anestesia en el ERG 17,20.
El anestésico más común utilizado para grabaciones ERG ha sido una combinación de ketamina y xilazina (en nuestros experimentos 60 mg / kg de ketamina y 5 mg se utiliza / kg de xilazina). Esto afecta a la ERG menos de anestesia gaseosos tales isoflurano y halotano, y ha demostrado ser relativamente no tóxico, con altas tasas de recuperación 17,21,22. Este enfoque mantiene inmóvil el animal durante ~ 40 min; una dosis media puede ser utilizado para extender las condiciones de grabación por un período similar. El estudio realizado por Chang comparó directamente el ERG con y sin anestesia y demostró que la ketamina-xilazina no perturbar sensiblemente la amplitud y latencias de a- y b-17 olas. La mayoría de los investigadores estandarizar las condiciones anestésicas y luego probar parámetros experimentales; algún efecto de los anestésicos no puede ser completamente descartada.
Entorno ocular
La fisiología del ojo requiere mantenimiento, para optimizar y estandarizar la grabación ERG. Los alumnos deben tener un tamaño estándar; esto se consigue con un midriático, aplica como gotas para los ojos, para lograr la dilatación máxima. En roedores, la atropina o fenilefrina se usa 23. La hidratación de la córnea se mantiene mediante la aplicación de un polímero carbómero antes de grabaciones; esto también estabiliza la conductancia eléctrica entre el electrodo positivo y la córnea. Si la córnea se deshidrata, la formación de cicatrices y de cataratas corneal puede ocurrir 24. La formación de cataratas es más común en los ratones 25, y diversos métodos de mantenimiento de la hidratación corneal se han empleado en ratón grabaciones ERG, incluyendo un flujo constante de fluido acuoso ocontacto electrodos de estilo a medida que la trampa de hidratación en la superficie de la córnea 12.
Estado Adaptativo de la retina
Esta es una variable importante. El protocolo proporcionado anteriormente está diseñado para asegurar que la retina es adaptada a la oscuridad, a su estado más sensible. Idealmente, las ratas pigmentadas requieren 3 horas de la vivienda oscura para ser totalmente oscuro adaptado mientras que los animales no pigmentadas, como ratas Sprague Dawley, requieren un mínimo de 5 horas 26. Es una práctica estándar para grabaciones ERG escotópicas para adaptar los animales durante la noche durante 12 horas. Adaptación parcial o total a la luz se puede conseguir fácilmente y rápidamente encendiendo una luz de fondo intensidad estándar en el estimulador Ganzfeld. Después de adaptación a la luz, sin embargo, adaptación a la oscuridad completa tarda horas para lograr; de ahí la sugerencia de extremo cuidado para asegurarse de que los ojos no están expuestos accidentalmente a la luz antes de grabar.
La técnica de grabación ERG está limitado por lapor encima de los factores determinantes (es decir, ERG y estímulo set-up) y el nivel de competencia del investigador en las pruebas de ERG. Investigadores sin experiencia es probable que tengan grabaciones ERG variables. Varianza puede reducirse mediante la creación de grandes tamaños de muestra suficientes para comparar los resultados, tales como reducciones o aumentos en la función visual. Alternativamente, grabaciones ERG pueden normalizarse entre las grabaciones de referencia y grabaciones posteriores al tratamiento. Los datos normalizados se pueden entonces ser agrupados y analizados. En la presentación de los datos de ERG, es una práctica estándar para mostrar los datos del grupo y formas de onda representativas.
Cuando todo lo anterior se controlan cuidadosamente, la amplitud de la ERG es una medida del estado funcional de la retina. El ERG se reduce constantemente en amplitud por el agotamiento de la capa de fotorreceptores causada por daño de la luz o la degeneración inducida genéticamente 27,28. Por el contrario, el efecto protector de una intervención como RIP se puede detectar en la amplitude del ERG 29. El ERG también se ha utilizado en la demostración de los efectos protectores de preacondicionamiento isquémico, preacondicionamiento hipóxica, ejercicio, dieta y azafrán en la retina 8-10,30.
La creciente conocimiento de la dinámica de la cascada de fototransducción de la rodopsina, y de las conexiones sinápticas de la retina, se ha fomentado el desarrollo de modelos de generación de ERG, y sofisticado análisis de ondas ERG es posible aunque el modelado cinético basado en eventos fisiológicos conocidos de fototransducción en fotorreceptores , y nuestra comprensión de los circuitos de la retina interior 31. Por ejemplo, los modelos cinéticos de onda de una se basan en los pasos bioquímicos que ocurren durante la fototransducción y ajustar el modelo permite la comparación de los parámetros del modelo tales como respuestas de los picos, los retrasos de temporización y sensibilidad 14.
La desventaja de los modelos es que se basa en supuestos sobre circuitr retinay, y sólo puede ser tan informativo como los supuestos permiten. A la luz de esta desventaja, el modelo cinético una onda ha sido recientemente criticado por simplificar demasiado una onda dinámica 32. En los estudios de degeneración de los fotorreceptores, análisis de ondas ERG es típicamente no realiza por una razón diferente. Degeneración de los fotorreceptores es a menudo severo, resultando en pérdidas dramáticas en la función visual y en consecuencia, un mayor análisis de una onda y los parámetros b-onda no se justifica 8,9,27,30. Independientemente, ERG modelado de la onda ay la onda b se ha adoptado como práctica habitual en muchos estudios de roedores e información detallada sobre el modelado ERG, por una onda, la onda b y PO se pueden encontrar en los estudios de la capilla, y la revisión artículos de Weymouth y Vingrys, Frishman y Wachtmeister 11,32-34.
En resumen, el método ERG adaptada a la oscuridad presenta puede registrar diferencias medibles entre la degeneración de la retina con y sin intervenciones neuroprotectoras sUCH como precondicionamiento isquémico remoto. Los elementos esenciales para grabaciones ERG confiables han descrito. Las mediciones ERG de los fotorreceptores y función retina interna son útiles para los investigadores que estudian las degeneraciones de la retina, y los efectos de diversas intervenciones genéticas, biofarmacéuticas y farmacológicos sobre la función visual.
Divulgaciones
Jonathan Stone es el director de CSCM Pty Ltd
Agradecimientos
Los autores agradecen la asistencia de la señora Sharon Spana en el monitoreo de roedores, la manipulación y la experimentación. Apoyo financiero de doctorado ha sido proporcionada por la Universidad de Sydney y el Centro Australiano de Investigación de Excelencia en la visión.
Materiales
| Name | Company | Catalog Number | Comments |
| PC computer | |||
| Powerlab, 4 channel acquistion hardware | AD Instruments | PL 35044 | Acquistion of ERG |
| Animal Bio Amp | AD Instruments | FE 136 | Amplifier for ERG |
| Lab chart | AD Instruments | Signal collection software | |
| Ganzfield | Photometric solutions | FS-250A | Light stimulus |
| Ganzfield operating system | Photometric solutions | ||
| Research Radiometer | International light technologies | ILT-1700 | calibrate light series |
| Lux meter | LX-1010B | check red light illumanation | |
| Excel | Microsoft | ||
| Lead wires | AD Instruments | Connect postive, negative ground electrodes to amplifier | |
| Lead wires - alligator | AD Instruments | ground ganzfield and acquistion hardware to computer | |
| Platinum wire 95% | A&E metals | postive electrode | |
| Mouth electrode Ag/AgCl Pellet | SDR | E205 | negative electode |
| 26 G needle | BD | ground electode | |
| Water pump | |||
| Water bath | |||
| Tubing | |||
| Homeothermic blanket system with flexible probe | Harvard Appartus | 507222F | |
| Atropine 1% w/v | Bausch & Lomb | topical mydriasis | |
| Proxmethycaine 0.5% w/v | Bausch & Lomb | topical anaesthetic | |
| Visco tears eye drops | Novartis | carbomer polymer | |
| Thread | retract eye lid | ||
| Tweezers | |||
| Reusable adhesive | Blu tac | Dim red headlamp. Affix electrodes | |
| Absorbent bedding | |||
| Ketamil - ketamine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | dissociative | |
| Xylium - Xylazine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | muscle relaxant | |
| Scale |
Referencias
- Arden, G. B., Heckenlively, J. . Principles and practice of clinical electrophysiology of vision. , 139-183 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. Journal of Physiology-London. 555 (1), 153-173 (2004).
- Fortune, B., et al. Selective ganglion cell functional loss in rats with experimental glaucoma. Investigative Ophthalmology & Visual Science. 45 (6), 1854-1862 (2004).
- Alarcon-Martinez, L., et al. Short and long term axotomy-induced ERG changes in albino and pigmented rats. Molecular Vision. 15 (254-255), 2373-2383 (2009).
- Lyubarsky, A. L., et al. Functionally rodless mice: transgenic models for the investigation of cone function in retinal disease and therapy. Vision Research. 42 (4), 401-415 (2002).
- Bush, R. A., Sieving, P. A. . A PROXIMAL RETINAL COMPONENT IN THE PRIMATE PHOTOPIC ERG A-WAVE. Investigative Ophthalmology & Visual Science. 35 (2), 635-645 (1994).
- Liu, K., et al. Development of the electroretinographic oscillatory potentials in normal and ROP rats. Investigative Ophthalmology & Visual Science. 47 (12), 5447-5452 (2006).
- Casson, R. J., Wood, J. P. M., Melena, J., Chidlow, G., Osborne, N. N. The effect of ischemic preconditioning on light-induced photoreceptor injury. Investigative Ophthalmology & Visual Science. 44 (3), 1348-1354 (2003).
- Lawson, E. C., et al. Aerobic Exercise Protects Retinal Function and Structure from Light-Induced Retinal Degeneration. Journal of Neuroscience. 34 (7), 2406-2412 (2014).
- Grimm, C., et al. HIF-1-induced erythropoietin in the hypoxic retina protects against light-induced retinal degeneration. Nature Medicine. 8 (7), 718-724 (2002).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: Methods for extraction and interpretation of rod and cone responses. Progress in Retinal and Eye Research. 27 (1), 1-44 (2008).
- Bayer, A. U., Cook, P., Brodie, S. E., Maag, K. P., Mittag, T. Evaluation of different recording parameters to establish a standard for flash electroretinography in rodents. Vision Research. 41 (17), 2173-2185 (2001).
- Pugh, E. N., Lamb, T. D. AMPLIFICATION AND KINETICS OF THE ACTIVATION STEPS IN PHOTOTRANSDUCTION. Biochimica Et Biophysica Acta. 1141 (2-3), 111-149 (1993).
- Breton, M. E., Schueller, A. W., Lamb, T. D., Pugh, E. N. ANALYSIS OF ERG A-WAVE AMPLIFICATION AND KINETICS IN TERMS OF THE G-PROTEIN CASCADE OF PHOTOTRANSDUCTION. Investigative Ophthalmology & Visual Science. 35 (1), 295-309 (1994).
- Mizota, A., Adachi-Usami, E. Effect of body temperature on electroretinogram of mice. Investigative Ophthalmology & Visual Science. 43 (12), 3754-3757 (2002).
- Szabo-Salfay, O., et al. The electroretinogram and visual evoked potential of freely moving rats. Brain Research Bulletin. 56 (1), 7-14 (2001).
- Charng, J., et al. Conscious Wireless Electroretinogram and Visual Evoked Potentials in Rats. Plos One. 8 (9), (2013).
- Galambos, R., Juhasz, G., Kekesi, A. K., Nyitrai, G., Szilagyi, N. NATURAL SLEEP MODIFIES THE RAT ELECTRORETINOGRAM. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5153-5157 (1994).
- Galambos, R., Szabo-Salfay, O., Szatmar, E., Szilagyi, N., Juhasz, G. Sleep modifies retinal ganglion cell responses in the normal rat. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 2083-2088 (2001).
- Guarino, I., Loizzo, S., Lopez, L., Fadda, A., Loizzo, A. A chronic implant to record electroretinogram, visual evoked potentials and oscillatory potentials in awake, freely moving rats for pharmacological studies. Neural Plasticity. 11 (3-4), 241-250 (2004).
- Huang, J. C., Salt, T. E., Voaden, M. J., Marshall, J. NON-COMPETITIVE NMDA-RECEPTOR ANTAGONISTS AND ANOXIC DEGENERATION OF THE ERG B-WAVE IN-VITRO. Eye (London). 5 (4), 476-480 (1991).
- Sasovetz, D. . KETAMINE HYDROCHLORIDE - EFFECTIVE GENERAL ANESTHETIC FOR USE IN ELECTRORETINOGRAPHY. Annals of Ophthalmology. 10 (11), 1510-1514 (1978).
- Mojumder, D. K., Wensel, T. G. Topical Mydriatics Affect Light-Evoked Retinal Responses in Anesthetized Mice). Investigative Ophthalmology & Visual Science. 51 (1), 567-576 (2010).
- Fraunfel, F. t., Burns, R. P. ACUTE REVERSIBLE LENS OPACITY - CAUSED BY DRUGS, COLD, ANOXIA, ASPHYXIA, STRESS, DEATH AND DEHYDRATION. Experimental Eye Research. 10 (1), 19 (1970).
- Calderone, L., Grimes, P., Shalev, M. ACUTE REVERSIBLE CATARACT INDUCED BY XYLAZINE AND BY KETAMINE-XYLAZINE ANESTHESIA IN RATS AND MICE. Experimental Eye Research. 42 (4), 331-337 (1986).
- Behn, D., et al. Dark adaptation is faster in pigmented than albino rats. Documenta Ophthalmologica. 106 (2), 153-159 (2003).
- Sugawara, T., Sieving, P. A., Bush, R. A. Quantitative relationship of the scotopic and photopic ERG to photoreceptor cell loss in light damaged rats. Experimental Eye Research. 70 (5), 693-705 (2000).
- Machida, S., et al. P23H rhodopsin transgenic rat: Correlation of retinal function with histopathology. Investigative Ophthalmology & Visual Science. 41 (10), 3200-3209 (2000).
- Brandli, A., Stone, J. Remote Ischemia Influences the Responsiveness of the Retina. Observations in the Rat. Investigative Ophthalmology & Visual Science. 55 (4), 2088-2096 (2014).
- Maccarone, R., Di Marco, S., Bisti, S. Saffron supplement maintains morphology and function after exposure to damaging light in mammalian retina. Investigative Ophthalmology & Visual Science. 49 (3), 1254-1261 (2008).
- Hood, D. C., Birch, D. G. Assessing abnormal rod photoreceptor activity with the a-wave of the electroretinogram: Applications and methods. Documenta Ophthalmologica. 92 (4), 253-267 (1996).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Progress in Retinal and Eye Research. 39, 1-22 (2014).
- Hood, D. C., Birch, D. G. A COMPUTATIONAL MODEL OF THE AMPLITUDE AND IMPLICIT TIME OF THE B-WAVE OF THE HUMAN ERG. Visual Neuroscience. 8 (2), 107-126 (1992).
- Wachtmeister, L. Oscillatory potentials in the retina: what do they reveal. Progress in Retinal and Eye Research. 17 (4), 485-521 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados