Method Article
باستخدام مخطط كهربية لتقييم وظيفة في القوارض الشبكية وتأثيرات واقية من بعيد الاطراف الدماغية شروط مسبقة
In This Article
Summary
The electroretinogram (ERG) is an electrical potential generated by the retina in response to light. This paper describes how to use the ERG to assess retinal function, in dark-adapted rats, and how it can be can be used to assess a neuroprotective intervention, in the present case remote ischemic preconditioning.
Abstract
The ERG is the sum of all retinal activity. The ERG is usually recorded from the cornea, which acts as an antenna that collects and sums signals from the retina. The ERG is a sensitive measure of changes in retinal function that are pan-retinal, but is less effective for detecting damage confined to a small area of retina. In the present work we describe how to record the ‘flash’ ERG, which is the potential generated when the retina is exposed to a brief light flash. We describe methods of anaesthesia, mydriasis and corneal management during recording; how to keep the retina dark adapted; electrode materials and placement; the range and calibration of stimulus energy; recording parameters and the extraction of data. We also describe a method of inducing ischemia in one limb, and how to use the ERG to assess the effects of this remote-from-the-retina ischemia on retinal function after light damage. A two-flash protocol is described which allows isolation of the cone-driven component of the dark-adapted ERG, and thereby the separation of the rod and cone components. Because it can be recorded with techniques that are minimally invasive, the ERG has been widely used in studies of the physiology, pharmacology and toxicology of the retina. We describe one example of this usefulness, in which the ERG is used to assess the function of the light-damaged retina, with and without a neuroprotective intervention; preconditioning by remote ischemia.
Introduction
وأرج هو إمكانية الكهربائية المولدة عن طريق القرنية في الاستجابة للضوء، والمسجلة من سطح القرنية من العين. عندما تدار شروط تسجيل بعناية، وأرج يمكن استخدامها في مجموعة متنوعة من الطرق لتقييم وظيفة الشبكية. نحن هنا وصف كيفية تسجيل "فلاش أرج"، واحتمال ولدت عندما يتعرض الشبكية إلى وجيزة، ومضة مشرقة المعروضة في خلفية فريق Ganzfeld. وفريق Ganzfeld يشتت ضوء متجانس ومضة من الضوء تصل إلى شبكية العين كلها تقريبا بشكل موحد. إذا شبكية العين ويتم تكييف الظلام قبل التسجيل، ويتم الحفاظ على التكيف مع الظلام، كما يتم إعداد الحيوان للتسجيل، حصل على أرج يتم إنشاؤها من قبل كل من قضيب والمخروط خلايا مستقبلة للضوء.
فلاش أرج تتكيف مع الظلام لديه الموجي مميزة، والتي تم تحليلها بطريقتين. أولا، تم تمييزها المبكرة والمتأخرة مكونات الموجي أرج، وترتبط إلى سلسلة من الخلايا العصبيةتفعيل القاعدة في شبكية العين. أقرب العنصر هو الكمون القصير إمكانية الذهاب سلبيا، وعلى بعد موجة (الشكل 1). ويتبع ذلك عن طريق إمكانية الذهاب إيجابية، ودعا ب الموجة. المرحلة طلوع ب الموجة تظهر التذبذبات، التي تعتبر عنصرا منفصلا (إمكانات متذبذبة أو المكتب). يعتبر من الموجة إلى أن تولدها خلايا مستقبلة للضوء، وب الموجة من قبل خلايا الطبقة النووية الداخلية، والبروتوكولات الاختيارية من قبل خلايا عديم الاستطالات 1.
استنادا إلى قوة التحفيز، وصفته الردود على ومضات خافتة جدا الاستجابة عتبة ظلامية ممكنة. ومن المفهوم الاستجابة عتبة ظلامية أن تتولد من خلايا الشبكية العقدة 2-4. ثانيا، فلاش أرج يمكن فصلها عن طريق التكيف مع الضوء، أو عن طريق بروتوكول اثنين فلاش هو موضح أدناه، إلى مكونات rod- ويحركها مخروط. في ظل ظروف فوتوبيك، وعلى بعد موجة ليست قابلة للكشف في الفئران، لأن السكان مخروط منخفض، ولكن مكتب خدمات المشاريع وأ ب الموجة هيواضح 5. في المقدمات، التي لديها السكان مخروط أعلى شبكية العين، سواء rod- ومسارات cone- توليد للكشف على الموجة 6.
اثنين من التدابير المفيدة في كثير من الأحيان المستخرجة من فلاش أرج هي سعة من A و B موجات يقاس في الشكل 1، مع الردود فلاش النموذجية هو مبين في الشكل (2). وعندما يتم خفض السكان مبصرة، على سبيل المثال من خلال التعرض لدمارا مشرق ضوء، يتم تخفيض جميع مكونات أرج. التدخلات اعصاب، مثل البعيد شروط مسبقة الدماغية (RIP)، ويمكن التصديق عليها من قبل المحافظة على سعة من A و B موجات (الشكل 3). وباختصار، فإن تحليل ERG يتيح مقارنات بين الأصحاء، وعلى ضوء تلف شبكية العين وneuroprotected.
Protocol
هذا البروتوكول يتبع المبادئ التوجيهية رعاية الحيوان من جامعة سيدني.
1. صنع أقطاب
- بناء القطب الموجب (واحد والتي سوف نتصل القرنية) من مسافة قصيرة (5 سم) طول سلك البلاتين 1-2 مم في القطر. أزياء قبل أن تتحول إلى حلقة بضعة ملليمترات. ربط هذه الحلقة إلى رصاص التقليدي، طويلة بما فيه الكفاية للوصول إلى مرحلة الإدخال من مكبر للصوت (انظر الشكل 4).
- بناء القطب السالب (والتي سوف تذهب في فم الحيوان) باستخدام حج / أجكل بيليه 1-2 مم في القطر، وأيضا على صلة الرصاص اتفاقية (انظر الشكل 4).
- كما القطب المرجعية (التي سوف تذهب إلى الردف الحيوان)، واستخدام إبرة تحت الجلد نظيفة (23 G)، مرتبطة أيضا بفارق طول المناسب (انظر الشكل 4).
- من الناحية المثالية، استخدام الكابلات الثلاثة الرصاص المقدمة من قبل الشركات المصنعة أداة، لتوصيل الأقطاب الثلاثة (إيجابية U94؛ القرنية، سلبي → الفم، إشارة → الكفل) لمكبر للصوت.
2. اتصال ومعايرة ضوء التحفيز وأرج مجموعة المتابعة
- إنشاء (أو موقع) مختبر تسجيل صغير، والتي يمكن أن تكون مصنوعة الظلام. تجهيز مع أي من الإفراط في مقاعد البدلاء ضوء مصنوعة أحمر أو أحمر الرأس مصباح أو كليهما.
- استخدام متر لوكس للتأكد من أن الضوء الأحمر مضوائية الوصول إلى عين فأر أثناء الإعداد لا تتجاوز 1 لوكس.
ملاحظة: يمكن استخدام فلتر الكثافة محايدة للحد من سطوع المصباح ومصدر ضوء مصباح يجب أن تنبعث منها على وجه التحديد الضوء الأحمر. وسوف يتأثر التكيف الظلام إذا مصادر الضوء ينبعث الدنيا (مرئية) الأطوال الموجية. - اغلاق كافة الضوء الشارد دخول المختبر تسجيل (هذا غالبا ما يتطلب استمرار مع الشريط مبهمة) وإعداد فلتر الكثافة المحايدة (يمكن شراؤها في ورقة) كبيرة بما يكفي لتناسب أكثر، وخافت جدا، أي شاشة الكمبيوتر سوف يكون في المختبر.
ملاحظة: ضوء شارد وضوء شاشة تكفي ليمس التكيف مع الظلام من العين الفئران. - توصيل مكبر للصوت الأجهزة الحصول على البيانات. ربط الإيجابية، ويؤدي سلبية وإشارة إلى مكبر للصوت. تأكد من توصيل الكمبيوتر وفريق Ganzfeld الصمام وحدة إمدادات الطاقة بشكل آمن إلى مصدر الأرض.
ملاحظة: بعض المعامل المتخصصة ونقاط التأريض، متصلة الأرض بناء. النرجيلة هو بديل فعال. - معايرة مصدر ضوء LED مع الاشعاع البحوث ذات الجودة. إصلاح أجهزة الاستشعار المقياس في الموضع الذي سيقع العين الحيوان أثناء التجربة.
- برنامج المصابيح فريق Ganzfeld لتشغيل بروتوكول أرج كامل الحقل مع زيادات تدريجية في الطاقة فلاش، مدة فلاش، فلاش التكرار والوقت بين ومضات، ووصف interstimuls الفاصلة (ISI)، إعدادات. لوضع بروتوكول سبيل المثال كامل الحقل أنظر الجدول 1.
ملاحظة: حقل كامل زيادة ومضات أرج من ومضات خافتة المتكررة لبومضات الصحيحة بطريقة حكيمة الخطوة. يتبع برنامج فلاش مزدوج على من بروتوكول كامل الحقل ويمكن عزل قضيب ومخروط الردود.
3. يوم قبل أرج التجريب
- الظلام التكيف مع الفئران سبراغ داولي لمدة 12 ساعة قبل التسجيل. أنه لأمر مريح للقيام بذلك في المختبر التسجيل، مرة واحدة وقد تم القضاء على ضوء شارد.
4. يوم أرج التجريب
- ترتيب للحيوان أن تكون ساخنة بلطف أثناء التسجيل. نستخدم منصة المعادن الخفيفة بنيت بحيث رأس الحيوان يمكن أن تبقى عند نقطة الصحيحة عند مدخل إلى فريق Ganzfeld. على منصة لديه أنابيب يحمل في ثناياه عوامل نستطيع من خلالها ضخ المياه مسخن الى 40 درجة مئوية في حمام مائي.
ملاحظة: تبين التجربة أن هذا يبقي درجة الحرارة الأساسية الحيوان عند 37 درجة مئوية. - وزن الفئران في ظل الظروف المظلمة. سجل الوزن والماكياج الكيتامين الصحيح (60 ملغ / كلغ) وزيلازين (5 ملغ / كلغ) جرعة. كبح جماح الفئران جنرالTLY وحقن مخدر داخل الصفاق.
- ملاحظة وقت الحقن. مرة واحدة الحيوان فاقد الوعي (عادة في غضون 5 دقائق) تحقق عمق التخدير بواسطة معسر برفق وسادة قدم واحدة، لمعرفة ما إذا كان رد الفعل المنعكس موجودة. فمن الأفضل أن ننتظر حتى هذا لا ارادي غير موجود أو ضعيف، قبل المتابعة.
- تطبيق قطرة واحدة من الأتروبين وآخر من proxmethacaine إلى القرنية.
- قطع بطول 10 سم من الخيط الأسود. جعل حلقة مع عقدة بسيطة وزلة حلقة فوق خط الاستواء للعين. تشديد عليه قليلا؛ وأثر هو رسم مقلة العين إلى الأمام قليلا، مع الحد الأدنى من الضغط. هذا يحافظ على القرنية واضحة من الجفون.
- قطرات العين تطبيق كربومير على سطح القرنية. تبقى ضمان كربومير على سطح القرنية ولا تسرب على الجفون أو وجهه.
- وضع الفراش ماصة على قمة منصة ساخنة.
- موقف الفئران على الفراش، مع الرأس في مكان الموصى بها في الجلسة الافتتاحية للفريق Ganzfeld.
- إدراج الباحثالتحقيق في درجة الحرارة ernal في المستقيم. التحقيق في درجة الحرارة آمن في الموقف عن طريق تسجيل الحبل التحقيق الى الذيل.
- إدراج القطب المرجعية (إبرة 23 G) تحت الجلد في الساق الخلفية، والاتصال مكبر للصوت.
- وضع القطب السالب (بيليه حج / أجكل) بشكل آمن في الفم. لمنع هذا الانزلاق خارج الفم، ويضعوا زمام المبادرة بالاتصال على سطح ثابت.
- وضع القطب الموجب على مركز للقرنية. باستخدام micromanipulator، تأكد من أن القطب يلمس القرنية بلطف.
- تحقق من درجة حرارة الجسم في 37،0-37،5 درجة مئوية.
- مرة واحدة يتم وضع الحيوان بشكل صحيح والأقطاب في مكانها الصحيح، ثنى الإعداد كله (فريق Ganzfeld والحيوان) مع مادة مبهمة (للحفاظ على التكيف مع الظلام). نستخدم قطعة قماش سوداء لينة.
- في برنامج الحصول على تعيين في معدل أخذ العينات 2 كيلو هيرتز مع الوقت مجموعة من 100-1000 ميللي ثانية مع 5 ميللي ثانية لأخذ العينات قبل المجموعة. تعيين مرشحات تمرير الفرقة 1-1،000يتم تشغيل هرتز والتأكد من أخذ العينات لأخذ عينات من فترة ~ 250 مللي ثانية بعد ومضة.
- تحقق من الأساس التسجيل. يجب أن تكون خالية من الضوضاء الدخيلة، ولكن تظهر بعض الضوضاء مكبر للصوت والتذبذب في الجهاز التنفسي.
- إذا تبين الأساس الضوضاء الدخيلة، تبدأ المشاكل. ترتبط معظم مشاكل لإنزلاق في موقف القطب، أو التأريض. استخدام قفص فاراداي لضمان التسجيلات خالية من الضوضاء الدخيلة.
- تشغيل فلاش اختبار، 0.4 سجل الاسكتلندي cd.sm -2. الموجي أرج على غرار الشكل يجب أن تظهر 2A. في مختبرنا ردود نموذجية ل0.4 سجل الاسكتلندي cd.sm -2 فلاش هي: (أ الموجة: -474 ± 39 μV وب الموجة: 1512 ± 160 μV، ن = 11).
- السماح الحيوان مظلمة إعادة التكيف لمدة 10 دقيقة. أنها مريحة لاستخدام هذه 10 دقيقة لإعادة فحص خط الأساس.
- بعد تأكيد إشارة مستقرة تبدأ تسجيل.
- في نهاية الدورة تسجيل، تأكد من أن temperat الجسمواستمر لدى عودتهم. إزالة الأقطاب. تطبيق البوليمر كربومير لقرنية العين. السماح للحيوان للتعافي على وسادة الحرارة حتى يصبح المحمول بشكل كامل وفعال، قبل أن يعود إلى حظائر الحيوانات.
5. نقص التروية عن بعد
- أداء نقص التروية عن بعد في أي من القوارض مستيقظا أو anesthetised.
- إذا تم تخدير الحيوان، وضعه على منصة ساخنة (أعلاه)، وتنزلق الكفة مقياس ضغط الدم على الجزء العلوي من أطرافه الخلفية، واضحة في الركبة.
- إذا تم استخدام الحيوانات ليجري التعامل معها، فمن الممكن لتنفيذ هذا الإجراء دون تخدير. هذا يتطلب شخصين. شخص واحد يقيد الحيوان برفق والثانية تنطبق الكفة مقياس ضغط الدم ويعمل على مقياس ضغط الدم.
- للحيوانات مستيقظا، استخدم قطعة من منشفة ~ 15 سم × 30-50 سم إلى التفاف بلطف الحيوان، مع hindlimb واحد مجانا. وضع الحيوان على ظهرها (ويقول) الساعد الأيسر، مع رئيسها مدسوس بين ذراع حامل والجذع، ومكانصفعة وصفها بأنها مجرد.
- فرغ الكفة والتأكد من إغلاق صمام ضغط الهواء. ضخ الكفة إلى 160 مم زئبق في الحيوانات anesthetised، وإلى 180 مم زئبق في الحيوانات مستيقظا. هذا يتجاوز الضغط الانقباضي (عادة 140 مم زئبق و 160 مم زئبق على التوالي).
- الحفاظ على هذه الضغوط على النحو المطلوب، وذلك باستخدام مضخة يدوية.
- بعد الوقت المخطط له لنقص التروية (نستخدم 2 فترات 5 دقائق مفصولة 5 دقائق ضخه)، فرغ ضغط الكفة عن طريق فك صمام ضغط الهواء.
- تأكيد تأثير نقص التروية عن بعد مع تحقيق درجة حرارة الجلد تعلق على قاطع الطريق. درجة حرارة الجلد وعادة ما تقع 32-30 ° C، أكثر من 5 دقائق ويتعافى على ضخه.
6. ضوء الأضرار
- تأكد من أن الفئران هي في ليلة وضحاها تكييفها الظلام، قبل إجراء اضرار طفيفة.
- في الوقت المناسب بعد نقص تروية الأطراف (في تجاربنا دون تأخير)، يتم وضع كل حيوان منفردة إلى صناديق شبكي، وايالمياه التاسع والمواد الغذائية في حاويات القائم على الأرض.
ملاحظة: لا يمكن إلا أن يضطلع الضرر الناجم عن الضوء في الحيوانات البيضاء. - التبديل على 1000 لوكس الضوء الأبيض معايرة قبل في وقت قياسي (عادة 9:00) والحفاظ على هذه الحالة لمدة 24 ساعة.
7. أرج استخراج وتحليل البيانات
- اكتساب أشكال موجة متوسط من أرج. إذا لزم الأمر، صحيح لخط الأساس غير صفرية، من خلال الطرح.
- قياس السعة من على بعد موجة (قدمت في منتصف لشدة التحفيز عالية)، حيث أن فرق الجهد بين خط الأساس والأولى (<30 مللي ثانية الكمون) حوض (الشكل 1).
- قياس السعة ب الموجة بالفرق بين الجهد ذروة في الموجة والموجب من الموجة التالية، والتي تحدث عادة في الكمون من 80-100 ميللي ثانية (الشكل 1).
- عزل إمكانات متذبذبة باستخدام تحويل فورييه لتصفية البيانات 60-235 هرتز، مع فرقة الانتقال 90 هرتز 7. إذا يمكن بعد ذلك طرح المطلوبة معزولة إشارة محتملة متذبذبة من الموجي فلتر لتأكيد هوية الحوض الصغير على بعد الموجة.
- الوقت الضمني (الكمون) من A و B موجة القمم يمكن أيضا أن تكون مقياسا مفيدا (الشكل 1). استخدام مضات التوأم لعزل استجابة قضيب. طرح استجابة مخروط (فلاش 2) من ردود فعل متباينة (فلاش 1) لعزل استجابة قضيب (الشكل 2).
- تطبيع شدة الضوء الفردية على الموجة وسعة ب الموجة (بعد العلاج / بعد المعاملة الأساس) أو متوسط لمجموعات العلاج. منحنيات شدة الاستجابة مؤامرة سعة مجموعة والخطأ ضد الطاقة فلاش.
النتائج
بروتوكول يمكن استخدامها لقياس وظيفة البصرية من القوارض شبكية العين في الجسم الحي. وعلى بعد موجة، وهو مقياس لوظيفة مبصرة، وب الموجة، وهو مقياس لوظيفة شبكية العين الداخلية، ومشروحة في الشكل 1.
وأرج زيادات إشارة التي يهيمن عليها قضيب مع التحفيز ضوء زيادة، كما هو مبين في الشكل 2A. يصبح على بعد موجة واضحة في ~ 0.4 سجل الاسكتلندي cd.sm -2 والسعة من الزيادات في الموجة حتى التشبع بنسبة 2.5 سجل الاسكتلندي cd.sm -2 (لا يظهر). وقد استخدم نموذج فلاش التوأم لفصل مختلطة إشارة أرج في مخروط وقضيب عزل ردا على ذلك، كما في الشكل 2B.
هذا الأسلوب تسجيل أرج يمكن استخدامها للتحقق من التدخلات اعصاب. أكملت التسجيلات الأساسية أسبوع وينظر قبل وقوع اضرار طفيفة في الشكل 3A. خفضت كل من الموجة وسعة ب الموجة اضرار طفيفة، أظهرت في الشكللدى عودتهم 3B. كان شروط مسبقة الدماغية عن بعد قادرة على الحد من فقدان ERG السعة، كما رأينا في الشكل 3C. تقنية نقص التروية عن بعد يعتمد على التطبيق الصحيح لوقف النزف فوق "الركبة". التطبيق غير الصحيح لوقف النزف لا يمنع وقوع اضرار طفيفة لشبكية العين، كما رأينا في الشكل 3D.

الشكل 1: قياس من على بعد موجة وب موجات من الظلام تكييفها أرج تتبع يظهر يتم تسجيلها من قرنية العين الظلام تكييفها لومضة من الضوء الساطع معينة في الوقت يظهر T0. يتم قياس السعة من على بعد موجة من خط الأساس إلى القاع الأول (السهم الأحمر). يتم قياس السعة للب موجة من مستوى القاع من على بعد موجة من ذروة الإيجابية التالية (السهم الأزرق). يتم قياس الوقت الضمني (الكمون) من التحفيزالحرفية (T0) إلى نقطة اهتمام على أثر، مثل الحوض الصغير من على بعد موجة (قوس مربع). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
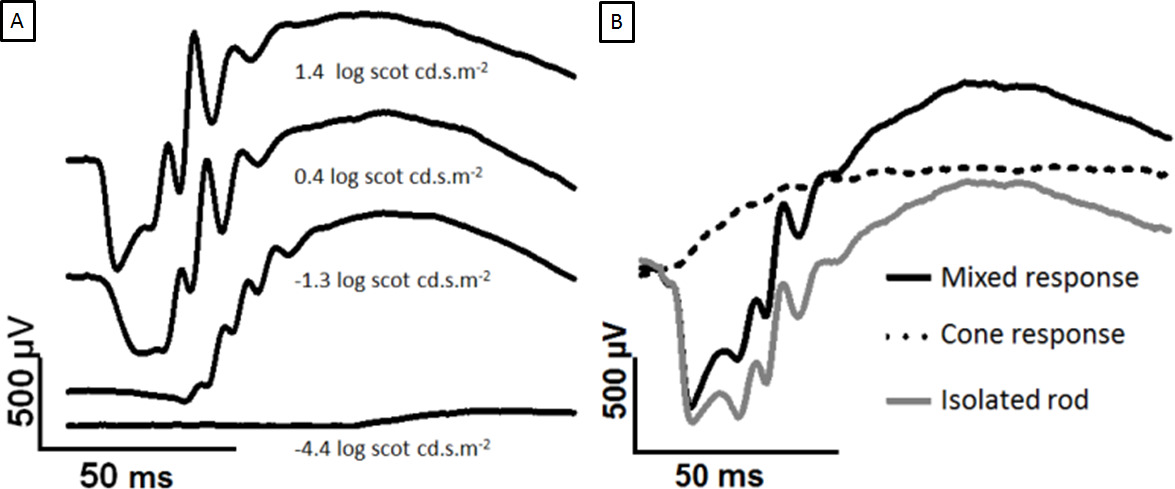
الشكل 2: تطوير الظلام تكييفها أرج مع زيادة قوة الفلاش والفصل بين قضيب ومخروط استجابات آثار معروضة تسجل من قرنية العين الظلام تكييفها لزيادة ومضات من الضوء. تظهر على الموجة في شدة أكثر إشراقا. (A) مقارنة 1،4-0،4 سجل الاسكتلندي cd.sm -2، والمشبعة الذروة ب الموجة ولكن على بعد موجة ما زال ينمو. في (B)، ومضافين ومضات التوأم. يتم فصل اثنين من 2.0 سجل الاسكتلندي cd.sm -2 ومضات من 500 مللي ثانية ISI. الفلاش الأول يولد مختلطةاستجابة (أسود)، وفلاش الثاني يولد استجابة مخروط الوحيد (الخط المنقط). طرح استجابة مخروط تعطي ردا قضيب معزولة (الرمادي). الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
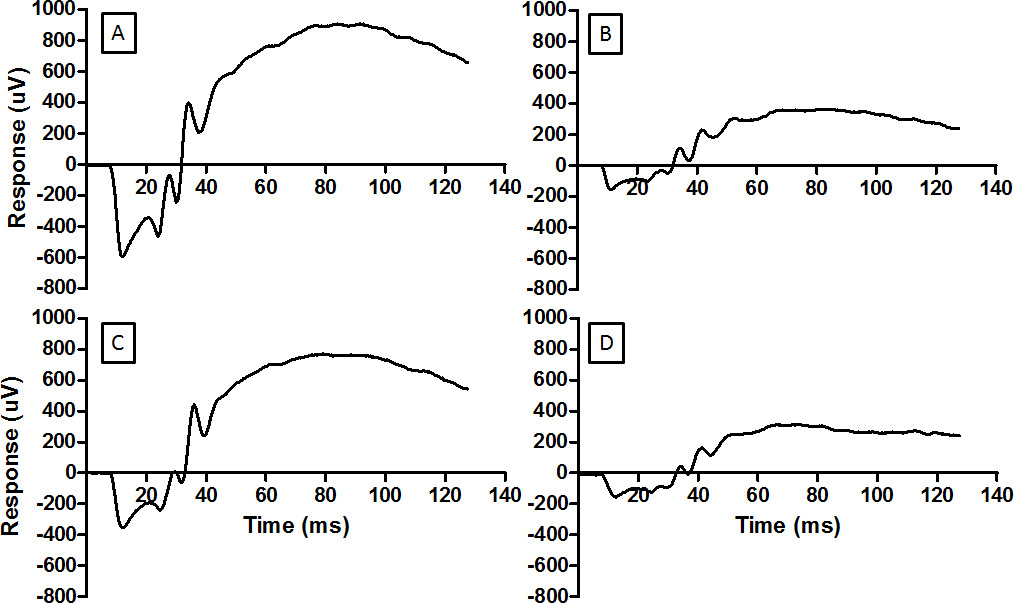
الرقم 3: أرج يوفر قدرا من وظيفة شبكية العين ترد الطول الموجي التمثيلية هنا ل(A) شبكية العين العادية، (B) شبكية العين المتضررة من الضوء، (C) شبكية العين مشروطة RIP قبل التعرض للضوء ضارة، و. (D) شبكية العين مكيفة غير فعال من قبل RIP ثم تعرضها للضوء ضارة. تم استخدام نفس الطاقة فلاش لكل سجل (2.0 سجل cd.sm -2). للسجل في D الكفة الضغطعلى الطرف الخلفية وضعت بشكل غير صحيح ولم تنشأ نقص التروية. اضرار طفيفة يقلل من اتساع أرج (B) وRIP يخفف من التخفيض. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.

الرقم 4: عن قرب الأقطاب أرج الأقطاب سيتم بناؤها ترد، من اليسار إلى اليمين؛ القطب الموجب للاتصال القرنية، القطب السالب لتوضع في الفم والقطب المرجعية التي تتكون من مقطع التمساح متصلة إبرة ثم يتم إدخالها تحت الجلد الفدرالية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
Discussion
فلاش طريقة أرج الظلام تكييفها المذكورة أعلاه هو طريقة يمكن الاعتماد عليها لتقييم وظيفة شبكية العين في الفئران. خفضت كل من على بعد موجة وب الموجة التي كتبها اضرار طفيفة. جهاز التحكم عن بعد شروط مسبقة الدماغية التخفيف التخفيضات الناجمة عن الأضرار الخفيفة في لالموجة والموجة ب. هذا الحفاظ على وظيفة الشبكية تشير إلى أن شروط مسبقة الدماغية البعيد قد يسببها العصبية، تشبه الأشكال الأخرى من شروط مسبقة واقية مثل نقص الأكسجين، ونقص التروية وممارسة 10/08. يتم تحديد إشارة أرج التي سجلتها ثلاث مجموعات من العوامل - الإعداد التسجيل، المعلمات من التحفيز الخفيفة، وحالة الحيوان.
تسجيل الإعداد
يتم تقليل أرج في السعة عندما توضع الأقطاب بشكل غير صحيح أو إعداد يرتكز بشكل غير كامل (11). أسس صحيحة من المعدات الكهربائية القريبة مهم، للحد من الضوضاء في التسجيل. إذا استمر ضجيج كبير على فارادعبد المنعم يوسف قفص ينبغي استخدامها. وينبغي وضع القطب الموجب بشكل آمن في مركز القرنية مع تأكيد موقف فحص قبل البدء في بروتوكول كامل الحقل أرج وعند الانتهاء. ومن المهم أن هذا القطب الاتصالات فقط القرنية. الاتصال مع جفن أو يمكن حتى شعيرات تقليل إشارة السعة. وقد تم استخدام خيط القطن فضفاضة في هذا البروتوكول لمنع الجفون من لمس القطب الموجب. وقد وضعت بعض المحققين العدسات اللاصقة مع القطب الموجب جزءا لا يتجزأ من ضمان اتصال موثوق بها ومنع لمس جفن 12.
تعيين التحفيز تضيء
منشط وقد استخدمنا توفر الضوء الأبيض واسعة الطيف، من مصادر LED. مصادر الضوء الأخرى هي مناسبة كما المنبهات الخفيفة مثل إضاءة الزينون القوية وإضاءة الهالوجين، انظر يماوث وVingrys لإجراء مقارنات بين المنبهات الخفيفة 11. ميزة LED ضوء، إلا أننيق أن مدة كل فلاش وطاقتها للبرمجة بسهولة وبسرعة إعادة تعيين أكثر من مجموعة واسعة من شدة الضوء. قمنا بتطوير مجموعة من ومضات من الطاقة متدرجة، والتي في نطاق القوارض تكييفها داكنة من العتبة (المنتجة للاستجابة فقط للكشف) لتشبع (إنتاج الاستجابة القصوى).
عن طريق التجربة والخطأ، وأنشأنا interstimulus فترات (إيزيس) التي تضمن أن اتساع ردا على فلاش مستقلة عن ومضة السابق من نفس كثافة. وأكثر إشراقا ومضة، ويعد ISI المطلوبة لهذا الاستقلال.
أيضا عن طريق التجربة والخطأ وضعنا الحد الأدنى لعدد الاستجابات المطلوبة في كل الطاقة لتوفير إشارة نظيفة. وبلغ متوسط مزيد من الردود توفر دائما إشارة أنظف. نستخدم الدنيا بحيث سلسلة الطاقة يمكن أن تكتمل بسرعة (في لدينا بروتوكول 11 دقيقة)؛ الانتهاء السريع يقلل الاختلاف نتيجة للتغيرات في حالة التخدير وألوالوقت WS عن المتغيرات الأخرى التي يتعين دراستها، إذا لزم الأمر.
حالة الحيوان
العديد من المعلمات من علم وظائف الأعضاء الحيوان مهمة لتحسين وتوحيد تسجيلات أرج الحصول عليها.
درجة الحرارة
يتم إنشاء إشارة إلى موجة من تفعيل يسببها الخفيف لG البروتين يقترن phototransduction شلال في الجزء الخارجي؛ ديناميات هذا الشلال هي، مثل كل التفاعلات الإنزيمية، 13،14 تعتمد على درجة الحرارة. القوارض تحت التخدير عرضة لانخفاض حرارة الجسم وتتطلب التدفئة الخارجية للحفاظ على درجة الحرارة الأساسية من 37.5 درجة مئوية في جميع أنحاء تسجيل. إذا كانت درجة حرارة الجسم تنخفض أكثر من 1-2 درجة مئوية، وعلى بعد موجة وب الموجة سعة انخفاض والإختفاء من زيادة 15.
خدر
تسجيلات أرج مستقرة وتتطلب الحيوان أن يكون بلا حراك. حاصرات العصبية والعضلية وanaesthetوتستخدم وكلاء جيم في أرج التجريب لتحقيق حالة اللاوعي وبلا حراك. لم يكن هناك سوى خمسة تقارير من التسجيلات ERG مستيقظا في الفئران 16-20. في هذه الدراسات، وأقطاب جراحيا قبل زرعها في الجمجمة واثنان من هذه الدراسات اختبرت تأثير التخدير على أرج 17،20.
كان مخدر الأكثر شيوعا للتسجيلات أرج مزيج من الكيتامين وزيلازين (في تجاربنا 60 ملغم / كغم من الكيتامين و 5 ملغ / كغ يستخدم من زيلازين). هذا يؤثر على أرج أقل من التخدير الغازية مثل هذا الأيزوفلورين والهالوثين، وأثبت نسبيا غير سامة، مع ارتفاع معدلات استرداد الكلفة 17،21،22. هذا النهج يبقي متحرك حيوان ل~ 40 دقيقة. جرعة نصف يمكن استخدامها لتوسيع ظروف التسجيل لمدة مماثلة. الدراسة التي تشانغ مقارنة مباشرة أرج مع وبدون تخدير، وأظهرت أن الكيتامين-زيلازين لا التشويش ملموس السعة والإختفاء من أ وبموجات 17. معظم الباحثين توحيد شروط التخدير ومن ثم اختبار المعلمات التجريبية. بعض تأثير التخدير أمر لا يمكن تجاهله تماما.
البيئة العين
فسيولوجيا العين يتطلب صيانة، لتحسين وتوحيد تسجيل أرج. يجب أن يكون التلاميذ حجم قياسي. ويتحقق هذا مع موسع للحدقة، كما هو مطبق قطرات العين، لتحقيق أقصى تمدد. في القوارض، يتم استخدام الأتروبين أو فينيليفرين 23. يتم الحفاظ على ترطيب القرنية عن طريق تطبيق بوليمر كربومير قبل التسجيلات. هذا استقرار أيضا تصرف الكهربائي بين القطب الموجب والقرنية. إذا أصبحت القرنية المجففة، قد تحدث ندبات وإعتام عدسة العين تشكيل القرنية 24. تشكيل الساد هو أكثر شيوعا في الفئران 25، وقد تم استخدام الأساليب المختلفة للحفاظ على ترطيب القرنية في الماوس أرج التسجيلات، بما في ذلك تدفق مستمر من السائل المائي أوحسب الطلب الاتصال أقطاب النمط الذي فخ الماء على سطح القرنية 12.
الدولة التكيفية للشبكية العين
هذا هو متغير رئيسي. تم تصميم بروتوكول الواردة أعلاه للتأكد من أن شبكية العين هي الظلام تكييفها، إلى حالته الأكثر حساسية. من الناحية المثالية، تتطلب الفئران مصطبغة 3 ساعة السكن الظلام لتكون داكنة تكييفها بشكل كامل بينما الحيوانات غير الصباغية، مثل الفئران سبراغ داولي، تتطلب ما لا يقل عن 5 ساعة 26. ومن الممارسات القياسية للتسجيلات أرج ظلامية للتكيف الحيوانات بين عشية وضحاها لمدة 12 ساعة. التكيف الكامل أو الجزئي للضوء يمكن بسهولة وسرعة حققت من خلال تحويل على ضوء خلفية كثافة القياسي في مشجعا فريق Ganzfeld. بعد التكيف مع الضوء، ولكن التكيف مع الظلام الكامل يستغرق ساعات لتحقيقه؛ ومن هنا جاء اقتراح من الحذر الشديد لضمان أن أعين لا يتعرض للضوء عن طريق الخطأ قبل التسجيل.
هي تقنية تسجيل أرج محدودة من قبلفوق العوامل المحددة (أي أرج والتحفيز مجموعة متابعة) وإتقان الباحث في اختبار أرج. من المحتمل أن يكون التسجيلات ERG متغير الباحثين عديم الخبرة. ويمكن تخفيض التباين من خلال خلق الأحجام الكبيرة عينة كافية لمقارنة النتائج، مثل تخفيض أو المكاسب التي تحققت في وظيفة البصرية. بدلا من ذلك، تسجيلات أرج يمكن تطبيع بين التسجيلات الأساسية والتسجيلات بعد العلاج. ويمكن بعد ذلك البيانات تطبيع تصنيفها وتحليلها. وعند تقديم البيانات أرج، فمن الممارسة القياسية لعرض البيانات المجموعة والطول الموجي التمثيلية.
عندما يتم التحكم كل ما سبق بعناية، واتساع أرج هي مقياس للحالة وظيفية للشبكية. يتم تقليل أرج باستمرار في السعة التي كتبها استنفاد طبقة مبصرة الناجمة عن وقوع اضرار طفيفة أو انحطاط الناجم عن وراثيا 27،28. وفي المقابل، يمكن الكشف عن تأثير وقائي للتدخل مثل RIP في AMPLitude من أرج 29. كما تم استخدام أرج في إثبات التأثيرات الواقية من شروط مسبقة الدماغية، شروط مسبقة ميتة، وممارسة، والزعفران الغذائية على شبكية العين 8-10،30.
تزايد المعرفة لديناميات شلال phototransduction من رودوبسين، والاتصالات المشبكية في شبكية العين، وقد شجع تطوير نماذج من الجيل أرج، ومتطورة التحليل الموجي أرج غير ممكنة على الرغم من النمذجة الحركية استنادا إلى الأحداث الفسيولوجية المعروفة phototransduction في المستقبلات الضوئية وفهمنا من الدوائر الداخلية للشبكية 31. على سبيل المثال، تستند النماذج الحركية على الموجة على الخطوات البيوكيميائية التي تحدث أثناء phototransduction وتركيب نموذج يتيح مقارنات بين المعلمات نموذج مثل ردود الذروة، والتأخير توقيت والحساسية 14.
العيب النمذجة هو أنه يعتمد على افتراضات حول circuitr الشبكيةص، ويمكن أن يكون إلا بالمعلومات كما تسمح الافتراضات. في ضوء هذا العيب، تم النموذج الحركي لموجة انتقادات مؤخرا لتبسيط والموجة ديناميات 32. في الدراسات انحطاط مبصرة، وعادة ما يتم تنفيذ أرج التحليل الموجي لسبب مختلف. انحطاط مستقبلة للضوء في كثير من الأحيان شديدة، مما أدى إلى خسائر كبيرة في وظيفة البصرية، وبالتالي، ليس له ما يبرره مزيد من التحليل لموجة والمعلمات ب الموجة 8،9،27،30. بغض النظر، اعتمد أرج نمذجة والموجة والموجة ب كممارسة قياسية في العديد من الدراسات القوارض ومعلومات مفصلة عن أرج النمذجة، لالموجة، ب الموجة والبروتوكولات الاختيارية يمكن العثور عليها في الدراسات التي هود، ومراجعة مقالات ويماوث وVingrys، Frishman، وWachtmeister 11،32-34.
وباختصار، قدم طريقة أرج تكييفها داكنة يمكن أن تسجل الاختلافات قابلة للقياس بين تنكس الشبكية مع وبدون تدخلات اعصاب الصورةاوك وشروط مسبقة الدماغية بعيد. وقد وصفت العناصر الأساسية لتسجيلات أرج يمكن الاعتماد عليها. القياسات أرج من مستقبلة للضوء وظيفة شبكية العين الداخلية هي مفيدة للباحثين الذين يدرسون الإنحطاط من شبكية العين، وآثار مختلف التدخلات الوراثية، الصيدلانية البيولوجية والدوائية على وظيفة البصرية.
Disclosures
جوناثان ستون هو مدير شركة خاصة محدودة الأبيض المتوسط
Acknowledgements
المؤلفون ممتنون للمساعدة السيدة شارون سبانا في رصد القوارض والمناولة والتجريب. تم توفير الدعم المالي الدكتوراه من جامعة سيدني ومركز الأبحاث الأسترالية للتميز في الرؤية.
Materials
| Name | Company | Catalog Number | Comments |
| PC computer | |||
| Powerlab, 4 channel acquistion hardware | AD Instruments | PL 35044 | Acquistion of ERG |
| Animal Bio Amp | AD Instruments | FE 136 | Amplifier for ERG |
| Lab chart | AD Instruments | Signal collection software | |
| Ganzfield | Photometric solutions | FS-250A | Light stimulus |
| Ganzfield operating system | Photometric solutions | ||
| Research Radiometer | International light technologies | ILT-1700 | calibrate light series |
| Lux meter | LX-1010B | check red light illumanation | |
| Excel | Microsoft | ||
| Lead wires | AD Instruments | Connect postive, negative ground electrodes to amplifier | |
| Lead wires - alligator | AD Instruments | ground ganzfield and acquistion hardware to computer | |
| Platinum wire 95% | A&E metals | postive electrode | |
| Mouth electrode Ag/AgCl Pellet | SDR | E205 | negative electode |
| 26 G needle | BD | ground electode | |
| Water pump | |||
| Water bath | |||
| Tubing | |||
| Homeothermic blanket system with flexible probe | Harvard Appartus | 507222F | |
| Atropine 1% w/v | Bausch & Lomb | topical mydriasis | |
| Proxmethycaine 0.5% w/v | Bausch & Lomb | topical anaesthetic | |
| Visco tears eye drops | Novartis | carbomer polymer | |
| Thread | retract eye lid | ||
| Tweezers | |||
| Reusable adhesive | Blu tac | Dim red headlamp. Affix electrodes | |
| Absorbent bedding | |||
| Ketamil - ketamine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | dissociative | |
| Xylium - Xylazine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | muscle relaxant | |
| Scale |
References
- Arden, G. B., Heckenlively, J. Principles and practice of clinical electrophysiology of vision. , MIT Press. 139-183 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. Journal of Physiology-London. 555 (1), 153-173 (2004).
- Fortune, B., et al. Selective ganglion cell functional loss in rats with experimental glaucoma. Investigative Ophthalmology & Visual Science. 45 (6), 1854-1862 (2004).
- Alarcon-Martinez, L., et al. Short and long term axotomy-induced ERG changes in albino and pigmented rats. Molecular Vision. 15 (254-255), 2373-2383 (2009).
- Lyubarsky, A. L., et al. Functionally rodless mice: transgenic models for the investigation of cone function in retinal disease and therapy. Vision Research. 42 (4), 401-415 (2002).
- Bush, R. A., Sieving, P. A. A PROXIMAL RETINAL COMPONENT IN THE PRIMATE PHOTOPIC ERG A-WAVE. Investigative Ophthalmology & Visual Science. 35 (2), 635-645 (1994).
- Liu, K., et al. Development of the electroretinographic oscillatory potentials in normal and ROP rats. Investigative Ophthalmology & Visual Science. 47 (12), 5447-5452 (2006).
- Casson, R. J., Wood, J. P. M., Melena, J., Chidlow, G., Osborne, N. N. The effect of ischemic preconditioning on light-induced photoreceptor injury. Investigative Ophthalmology & Visual Science. 44 (3), 1348-1354 (2003).
- Lawson, E. C., et al. Aerobic Exercise Protects Retinal Function and Structure from Light-Induced Retinal Degeneration. Journal of Neuroscience. 34 (7), 2406-2412 (2014).
- Grimm, C., et al. HIF-1-induced erythropoietin in the hypoxic retina protects against light-induced retinal degeneration. Nature Medicine. 8 (7), 718-724 (2002).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: Methods for extraction and interpretation of rod and cone responses. Progress in Retinal and Eye Research. 27 (1), 1-44 (2008).
- Bayer, A. U., Cook, P., Brodie, S. E., Maag, K. P., Mittag, T. Evaluation of different recording parameters to establish a standard for flash electroretinography in rodents. Vision Research. 41 (17), 2173-2185 (2001).
- Pugh, E. N., Lamb, T. D. AMPLIFICATION AND KINETICS OF THE ACTIVATION STEPS IN PHOTOTRANSDUCTION. Biochimica Et Biophysica Acta. 1141 (2-3), 111-149 (1993).
- Breton, M. E., Schueller, A. W., Lamb, T. D., Pugh, E. N. ANALYSIS OF ERG A-WAVE AMPLIFICATION AND KINETICS IN TERMS OF THE G-PROTEIN CASCADE OF PHOTOTRANSDUCTION. Investigative Ophthalmology & Visual Science. 35 (1), 295-309 (1994).
- Mizota, A., Adachi-Usami, E. Effect of body temperature on electroretinogram of mice. Investigative Ophthalmology & Visual Science. 43 (12), 3754-3757 (2002).
- Szabo-Salfay, O., et al. The electroretinogram and visual evoked potential of freely moving rats. Brain Research Bulletin. 56 (1), 7-14 (2001).
- Charng, J., et al. Conscious Wireless Electroretinogram and Visual Evoked Potentials in Rats. Plos One. 8 (9), (2013).
- Galambos, R., Juhasz, G., Kekesi, A. K., Nyitrai, G., Szilagyi, N. NATURAL SLEEP MODIFIES THE RAT ELECTRORETINOGRAM. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5153-5157 (1994).
- Galambos, R., Szabo-Salfay, O., Szatmar, E., Szilagyi, N., Juhasz, G. Sleep modifies retinal ganglion cell responses in the normal rat. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 2083-2088 (2001).
- Guarino, I., Loizzo, S., Lopez, L., Fadda, A., Loizzo, A. A chronic implant to record electroretinogram, visual evoked potentials and oscillatory potentials in awake, freely moving rats for pharmacological studies. Neural Plasticity. 11 (3-4), 241-250 (2004).
- Huang, J. C., Salt, T. E., Voaden, M. J., Marshall, J. NON-COMPETITIVE NMDA-RECEPTOR ANTAGONISTS AND ANOXIC DEGENERATION OF THE ERG B-WAVE IN-VITRO. Eye (London). 5 (4), 476-480 (1991).
- Sasovetz, D. KETAMINE HYDROCHLORIDE - EFFECTIVE GENERAL ANESTHETIC FOR USE IN ELECTRORETINOGRAPHY. Annals of Ophthalmology. 10 (11), 1510-1514 (1978).
- Mojumder, D. K., Wensel, T. G. Topical Mydriatics Affect Light-Evoked Retinal Responses in Anesthetized Mice). Investigative Ophthalmology & Visual Science. 51 (1), 567-576 (2010).
- Fraunfel, F. t, Burns, R. P. ACUTE REVERSIBLE LENS OPACITY - CAUSED BY DRUGS, COLD, ANOXIA, ASPHYXIA, STRESS, DEATH AND DEHYDRATION. Experimental Eye Research. 10 (1), 19(1970).
- Calderone, L., Grimes, P., Shalev, M. ACUTE REVERSIBLE CATARACT INDUCED BY XYLAZINE AND BY KETAMINE-XYLAZINE ANESTHESIA IN RATS AND MICE. Experimental Eye Research. 42 (4), 331-337 (1986).
- Behn, D., et al. Dark adaptation is faster in pigmented than albino rats. Documenta Ophthalmologica. 106 (2), 153-159 (2003).
- Sugawara, T., Sieving, P. A., Bush, R. A. Quantitative relationship of the scotopic and photopic ERG to photoreceptor cell loss in light damaged rats. Experimental Eye Research. 70 (5), 693-705 (2000).
- Machida, S., et al. P23H rhodopsin transgenic rat: Correlation of retinal function with histopathology. Investigative Ophthalmology & Visual Science. 41 (10), 3200-3209 (2000).
- Brandli, A., Stone, J. Remote Ischemia Influences the Responsiveness of the Retina. Observations in the Rat. Investigative Ophthalmology & Visual Science. 55 (4), 2088-2096 (2014).
- Maccarone, R., Di Marco, S., Bisti, S. Saffron supplement maintains morphology and function after exposure to damaging light in mammalian retina. Investigative Ophthalmology & Visual Science. 49 (3), 1254-1261 (2008).
- Hood, D. C., Birch, D. G. Assessing abnormal rod photoreceptor activity with the a-wave of the electroretinogram: Applications and methods. Documenta Ophthalmologica. 92 (4), 253-267 (1996).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Progress in Retinal and Eye Research. 39, 1-22 (2014).
- Hood, D. C., Birch, D. G. A COMPUTATIONAL MODEL OF THE AMPLITUDE AND IMPLICIT TIME OF THE B-WAVE OF THE HUMAN ERG. Visual Neuroscience. 8 (2), 107-126 (1992).
- Wachtmeister, L. Oscillatory potentials in the retina: what do they reveal. Progress in Retinal and Eye Research. 17 (4), 485-521 (1998).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved