Method Article
Verwenden der Funktion zur Elektroretinogramm im Nager Retina und die schützende Wirkung des Fern Limb ischämischen Präkonditionierung bewerten
In diesem Artikel
Zusammenfassung
The electroretinogram (ERG) is an electrical potential generated by the retina in response to light. This paper describes how to use the ERG to assess retinal function, in dark-adapted rats, and how it can be can be used to assess a neuroprotective intervention, in the present case remote ischemic preconditioning.
Zusammenfassung
The ERG is the sum of all retinal activity. The ERG is usually recorded from the cornea, which acts as an antenna that collects and sums signals from the retina. The ERG is a sensitive measure of changes in retinal function that are pan-retinal, but is less effective for detecting damage confined to a small area of retina. In the present work we describe how to record the ‘flash’ ERG, which is the potential generated when the retina is exposed to a brief light flash. We describe methods of anaesthesia, mydriasis and corneal management during recording; how to keep the retina dark adapted; electrode materials and placement; the range and calibration of stimulus energy; recording parameters and the extraction of data. We also describe a method of inducing ischemia in one limb, and how to use the ERG to assess the effects of this remote-from-the-retina ischemia on retinal function after light damage. A two-flash protocol is described which allows isolation of the cone-driven component of the dark-adapted ERG, and thereby the separation of the rod and cone components. Because it can be recorded with techniques that are minimally invasive, the ERG has been widely used in studies of the physiology, pharmacology and toxicology of the retina. We describe one example of this usefulness, in which the ERG is used to assess the function of the light-damaged retina, with and without a neuroprotective intervention; preconditioning by remote ischemia.
Einleitung
Die ERG ist ein elektrisches Potential von der Netzhaut als Reaktion auf Licht erzeugt und von der Hornhautoberfläche des Auges aufgezeichnet. Wenn die Bedingungen der Aufnahme wird sorgfältig gesteuert, kann die ERG in einer Vielzahl von Möglichkeiten, um die Funktion der Retina zu bewerten verwendet werden. Hier haben wir beschrieben, wie man die "Flash-ERG, die erzeugt werden, wenn die Netzhaut zu einer kurzen, hellen Blitz in einem Ganzfeld Hintergrund präsentiert ausgesetzt Potenzial aufzuzeichnen. Die Ganzfeld streut das Licht homogen und der Lichtblitz erreicht die gesamte Netzhaut etwa gleichmäßig. Wenn die Netzhaut vor der Aufnahme angepasst dunkel, und die dunkel Anpassung beibehalten wird, wie das Tier wird für die Aufnahme bereit, erhalten die ERG wird sowohl von Stäbchen und Zapfen-Photorezeptoren erzeugt.
Die dunkeladaptierten Flash ERG eine charakteristische Wellenform, die in zwei Arten analysiert wurde. Erste, frühe und späte Komponenten des ERG-Wellenform werden unterschieden, und mit der Sequenz des Neurons bezogenenal Aktivierung in der Netzhaut. Die früheste Komponente ein kurzer Latenz negativ werdenden Potentials der a-Welle (1). Dies wird durch einen positiv verlaufenden Potential gefolgt, die so genannte b-Welle. Die steigende Phase der b-Welle zeigt Schwingungen, die als eine separate Komponente (Schwingungspotentiale oder OP) werden. Die a-Welle wird als von Photorezeptoren erzeugt werden, die b-Welle durch Zellen der inneren Körnerschicht und der OP durch Amakrinzellen 1.
Auf der Grundlage der Reizstärke, Antworten auf sehr dunkel blinkt bezeichnet die skotopischen Schwellenreaktion möglich. Skotopischen Schwellenreaktion versteht man aus den retinalen Ganglienzellen 2-4 erzeugt werden. Zweitens kann der Flash-ERG durch Lichtanpassung zu trennen, oder durch eine zwei Flash-Protokoll weiter unten beschrieben, in Stab- und kegel angetriebenen Bestandteile. Unter photopischen Bedingungen ist der a-Welle nicht bei der Ratte nachweisbar sind, da der Konus Bevölkerung ist gering, aber OP und eine b-Welle sindklar 5. In Primaten, deren Netzhaut eine höhere Konus Populationen sowohl Stab- und kegelWege ein nachweisbares eine Wellen 6.
Zwei nützliche Maßnahmen oft aus dem Flash-ERG extrahiert sind die Amplituden der A- und B-Wellen gemessen, wie in Figur 1, mit typischen Flash-Antworten in 2 gezeigt. Wenn die Fotorezeptorpopulation verringert wird, beispielsweise durch Einwirkung von schädigend hellen Licht, sind alle Komponenten des ERG reduziert. Neuroprotektive Eingriffe, wie Fern ischämischen Präkonditionierung (RIP), kann durch den Erhalt der Amplituden der A- und B-Wellen (3) überprüft werden. Zusammenfassend ist die Analyse der ERG ermöglicht Vergleiche zwischen gesund, leicht beschädigt und neuroprotected Netzhaut.
Protokoll
Dieses Protokoll folgt den Richtlinien der Tierpflege University of Sydney.
1. Herstellung Elektroden
- Konstruieren Sie die positive Elektrode (die eine, die die Hornhaut treten wird) von einem kurzen (5 cm) Länge der Platindraht 1-2 mm im Durchmesser. FaShion sie in einer Schleife wenige mm im Durchmesser. Verbinden Sie diese Schleife zu einer herkömmlichen Blei, lange genug, um die Eingangsstufe des Verstärkers zu erreichen (siehe Abbildung 4).
- Konstruieren Sie die negative Elektrode mit einer Ag / AgCl-Pellet 1-2 mm Durchmesser, auch mit einem Kongress Leitung verbunden (die in das Maul des Tieres gehen wird) (siehe Abbildung 4).
- Als eine Referenzelektrode (die in das Tier Rumpf gehen), mit einem sauberen Injektionsnadel (23 G), auch mit einer Leitung von geeigneter Länge verbunden (siehe Abbildung 4).
- Idealerweise verwenden Drei-Blei-Kabel vom Gerätehersteller zur Verfügung gestellt, um die drei Elektroden anschließen (positive U94; Hornhaut, negativ → Mund, Referenz → Hinterteil) an den Verstärker.
2. Anschluss und Kalibrierung der Lichtreiz und ERG Set-up
- Erstellen (oder suchen) einen kleinen Aufnahme Labor, das dunkel gemacht werden können. Rüsten Sie sich mit einer oder beiden der Over-the-Bank hellrot gemacht oder einem roten Kopf-Lampe.
- Verwenden Sie ein Luxmeter zu bestätigen, dass rotes Licht Beleuchtungsstärke erreicht Auge der Ratte während der Installation ist 1 Lux nicht übersteigen.
Hinweis: Ein Neutraldichtefilter verwendet werden, um die Helligkeit der Lampe zu verringern und die Quelle der Lampenlicht müssen ausdrücklich rotes Licht emittieren. Dunkeladaption wird gefährdet, wenn Lichtquellen strahlen unteren (sichtbaren) Wellenlängen. - Abdichtung alle Streulicht in das Aufnahmelabor (dies oft erfordert Ausdauer mit Deckband) und erstellt einen Neutraldichtefilter (dies kann in Platten gekauft werden) groß genug, um zu passen, und so dunkel, jeder Computer-Bildschirm finden Sie in der haben Labor.
Hinweis: Streulicht unddas Licht eines Bildschirms ausreichend sind, um Dunkeladaption des Auges der Ratte zu beeinträchtigen. - Schließen Sie den Verstärker an Datenerfassungshardware. Schließen Sie positive, negative und Referenzleitungen an den Verstärker. Sicherstellen, dass der Computer und die LED-Ganzfeld-Netzteil fest mit einer Massequelle verbunden ist.
Hinweis: Einige Labors haben Erdungspunkten spezialisiert, zu einem Gebäude Masse verbunden ist; eine Wasserleitung ist eine effektive Alternative. - Kalibrieren Sie die LED-Lichtquelle mit einer Forschungs hochwertige Radiometer. Fix-Sensor des Messgeräts in der Position, an der das Auge des Tieres wird während eines Experiments befinden.
- Programmieren Sie die Ganzfeld-LEDs, um eine Vollfeld-ERG-Protokoll mit stufenweisen Anstieg der Blitzenergie, Blitzdauer, Flash-Wiederholung und die Zeit zwischen den Blitzen führen, bezeichnet interstimuls Intervall (ISI), Einstellungen. Ein Beispiel für Vollfeld-Protokoll finden Sie in Tabelle 1.
Hinweis: Die Vollfeld-ERG blinkt erhöhen aus sich wiederholenden dim Wallungen zu brechts blinkt in einer schrittweisen Art und Weise. Das Doppel Flash-Programm folgt auf die Vollfeld-Protokoll und ermöglicht Isolierung von Stäbchen und Zapfen Antworten.
3. Tag vor der ERG Experimentation
- Dunkle Sprague-Dawley Ratten anpassen 12 Stunden vor der Aufnahme. Es ist zweckmäßig, diese in der Aufzeichnung Labor tun, einmal Streulicht eliminiert wurde.
4. Tag der ERG Experimentation
- Vereinbaren Sie für das Tier sanft während der Aufnahme erwärmt werden. Wir verwenden eine Leichtmetall-Plattform gebaut, damit Kopf des Tieres kann an der richtigen Stelle an der Einreise in das Ganzfeld ruhen. Die Plattform verfügt über eingebaute Schläuche, durch die wir die Pumpe Wasser auf 40 ° C vorgewärmt in einem Wasserbad.
Anmerkung: Die Erfahrung zeigt, dass dies hält die Kerntemperatur des Tieres auf 37 ° C. - Wiegen Sie die Ratte bei schlechten Lichtverhältnissen. Nehmen Sie Gewicht und machen richtig Ketamin (60 mg / kg) und Xylazin (5 mg / kg) Dosis. Restrain die Ratte gently und injizieren Narkose intraperitoneal.
- Hinweis Zeitpunkt der Injektion. Sobald das Tier bewusstlos ist (in der Regel innerhalb von 5 min) zu überprüfen Narkosetiefe durch leichtes Kneifen einem Fuß-Pad, um zu sehen, wenn ein Reflexantwort vorhanden ist. Es ist am besten zu warten, bis dieser Reflex nicht vorhanden oder schwach ist, bevor Sie fortfahren.
- Tragen Sie einen Tropfen Atropin und andere der proxmethacaine zu Hornhaut.
- Schneiden Sie ein 10 cm Länge der schwarzen Faden. Machen Sie eine Schleife mit einem einfachen Knoten und schieben Sie die Schleife über dem Äquator des Auges. Leicht anziehen; Der Effekt wird auf den Augapfel leicht nach vorne zu ziehen, mit minimalem Druck. Dies hält die Hornhaut von den Augenlidern klar.
- Bewerben Carbomer Augentropfen auf die Hornhautoberfläche. Stellen Sie sicher, Carbomer bleibt auf Hornhautoberfläche und nicht auf den Augenlidern oder das Gesicht zu verschütten.
- Zeigen saugfähigen Einstreu auf der Oberseite des beheizten Plattform.
- Position Ratte auf dem Bettzeug, mit dem Kopf in der empfohlene Ort in der Öffnung des Ganzfeld.
- Int Inserternal Temperatursonde in das Rektum. Sichere Temperaturfühler in Position durch Abkleben Sondenkabel mit dem Schwanz.
- Legen Sie die Referenzelektrode (die 23 G-Nadel) subkutan in die hintere Bein, und eine Verbindung zum Verstärker.
- Zeigen die negative Elektrode (die Ag / AgCl-Pellet) sicher in den Mund. Um dies zu verhindern ein Herausrutschen des Mundes, befestigen Sie die Anschlussleitung auf eine stabile Oberfläche.
- Positionieren Sie die positive Elektrode über der Mitte der Hornhaut. Mit einem Mikromanipulator, sicherzustellen, dass die Elektrode die Hornhaut sanft berührt.
- Überprüfen Sie die Körpertemperatur bei 37,0 bis 37,5 ° C.
- Sobald das Tier richtig positioniert ist und Elektroden in aufgeführt sind, drapieren den gesamten Setup (Ganzfeld und Tier) mit einem undurchsichtigen Material (zur Dunkeladaptation zu erhalten). Wir verwenden Sie ein weiches schwarzes Tuch.
- In der Erfassungssoftware bei einer 2 kHz Abtastrate mit einer Erfassungszeit von 100-1000 ms mit 5 msec der Pre-Kollektion Probenahme eingestellt. Stellen Sie die Bandpassfilter, um 1-1000Hz und sicher, dass Probenahme ausgelöst wird, um den Zeitraum von ~ 250 ms nach einer Flash-kosten.
- Überprüfen Sie die Aufnahme Grundlinie. Es sollte frei von Fremdgeräusche, aber zeigen einige Verstärkerrauschen und eine Atmungsschwingung.
- Wenn die Grundlinie zeigt Nebengeräusche, beginnen die Fehlersuche. Die meisten Probleme sind ähnlich wie in Elektrodenposition oder Erdungs Schlupf. Verwenden Sie einen Faraday-Käfig, um sicherzustellen, Aufnahmen sind frei von Nebengeräuschen.
- Führen Sie einen Testblitz, 0,4 log scot cd.sm -2. Eine ERG Wellenform ähnlich zu 2A erscheinen soll. In unserem Labor typische Antworten für eine 0,4 log scot cd.sm -2 Blitz sind (a-Welle: -474 ± 39 & mgr; V und b-Welle: 1512 ± 160 & mgr; V, n = 11).
- Erlauben Tier zu dunkel wieder Anpassung für 10 min. Es ist zweckmäßig, diese 10 Minuten zu verwenden, um die Basislinie erneut prüfen.
- Nach der Bestätigung der stabilen Signal Aufzeichnung starten.
- Am Ende der Aufnahme-Session, überprüfen Sie, dass Körper temperature wurde beibehalten. Elektroden entfernen. Wenden Carbomer Polymers an Hornhäuten. Lassen Sie das Tier auf einem Heizkissen erholen, bis er vollständig mobil und aktiv, vor der Rückkehr in Stallungen.
5. Fern Ischämie
- Führen Sie Fern Ischämie entweder wach oder anästhesiert Nagetiere.
- Wird das Tier narkotisiert, legen Sie es auf eine beheizte Plattform (oben) und schieben Sie die Blutdruckmanschette über den oberen Teil der Hintergliedmaße, klare des Knies.
- Wenn die Tiere auf der Handhabung verwendet wird, ist es möglich, dieses Verfahren ohne Betäubung durchzuführen; dies sind zwei Personen erforderlich. Eine Person hält den Tier sanft und die zweite gilt die Blutdruckmanschette und betreibt das Blutdruckmessgerät.
- Für wach Tiere, verwenden Sie ein Stück Tuch ~ 15 cm x 30-50 cm vorsichtig wickeln Sie das Tier, mit einem Hinterlauf frei. Legen Sie das Tier auf den Rücken (sagen wir) den linken Unterarm, mit seinem Kopf zwischen dem Halter Arm und Oberkörper, und Ort verstecktdie Manschette wie gerade beschrieben.
- Lassen Sie die Luft der Manschette und sicherzustellen, dass die Luftdruckventil geschlossen ist. Pumpen Sie die Manschette auf 160 mmHg in anästhesierten Tieren und bis 180 mmHg in wach Tiere. Dies übersteigt systolische Druck (in der Regel 140 mmHg und 160 mmHg beziehungsweise).
- Pflegen Sie diesen Druck nach Bedarf, mit der Handpumpe.
- Nach der geplanten Zeit für Ischämie (wir verwenden 2 Perioden von 5 Minuten mit dem 5 min Reperfusion getrennt), die Luft aus dem Manschettendruck durch Lösen der Druckluftventil.
- Bestätigen Sie die Wirkung des Fern Ischämie mit einer Hauttemperatursonde in die Pfotenballen befestigt. Hauttemperatur fällt in der Regel 32 bis 30 ° C, während 5 min und stellt auf der Reperfusion.
6. Lichtschaden
- Stellen Sie sicher, dass Ratten in einem dunkeladaptierten über Nacht, bevor die Lichtschäden Verfahren.
- Zum geeigneten Zeitpunkt folgenden Extremitäten-Ischämie (in unseren Versuchen ohne Verzögerung), wird jedes Tier einzeln in eine Plexiglas-Boxen, wi platziertth Wasser und Nahrung in Boden-basierten Container.
Hinweis: Lichtschäden können nur in Albino-Tieren durchgeführt werden. - Anschalten einer vorkalibrierten 1.000 Lux weißes Licht bei einer Standardzeit (in der Regel 9.00), und dieser Zustand für 24 h aufrechtzuerhalten.
7. ERG Datenextraktion und -analyse
- Erwerben gemittelten Wellenformen der ERG. Falls erforderlich, für ein Nicht-Null-Grundlinie korrekt ist, durch Subtraktion.
- Messen der Amplitude der A-Welle (in mittleren bis hohen Reizstärken dargestellt), da die Spannungsdifferenz zwischen der Basislinie und der ersten (<30 ms Latenz) Wanne (Abbildung 1).
- Messung der b-Wellenamplitude als die Spannungsdifferenz zwischen der Spitze des a-Welle und der positiven der folgenden Welle, typischerweise bei einer Latenzzeit von 80-100 ms (Figur 1) auftritt.
- Isolieren oszillierenden Potentiale unter Verwendung einer Fourier-Transformation, um Daten von 60 bis 235 Hz zu filtern, mit einer 90 Hz Gangsband 7. Bei Bedarf kann der isolierte Schwingungspotentialsignal kann dann von der ungefilterten Wellenform subtrahiert werden, um die Identität des a-Wellental zu bestätigen.
- Die implizite Zeit (Latenz) der a- und b-Wellenberge können auch eine sinnvolle Maßnahme (Abbildung 1) ist. Verwenden Sie die Zwillings blinkt, um den Stab Reaktion zu isolieren. Subtrahieren Sie die Konus-Antwort (Flash-2) aus dem Mischantwort (Flash-1), um den Stab Reaktion zu isolieren (Abbildung 2).
- Normalisieren einzelnen Lichtintensität einen Wellen und b-Wellenamplituden (Nachbehandlung / Nachbehandlung-Basislinie) oder gemittelt für den Behandlungsgruppen. Intensity-Wirkungs-Kurven zeichnen die Gruppe Amplituden und Fehler gegen Blitzenergie.
Ergebnisse
Das Protokoll kann verwendet werden, um die Sehfunktion von Nagetier Retina in vivo zu messen. Die a-Welle, ein Maß für Photorezeptor-Funktion und die b-Welle, ein Maß für innere Retina-Funktion werden in 1 gekennzeichnet.
Die stab dominiert ERG-Signal mit zunehmendem Lichtreiz, wie in 2A gezeigt. Die a-Welle wird bei ~ 0,4 log Scot cd.sm -2 und die Amplitude der A-Welle zu, bis Sättigung bei 2,5 log Scot cd.sm -2 (nicht dargestellt) erkennbar. Das Doppelblitz Paradigma wurde genutzt, um gemischte ERG Signal in Zapfen und Stäbchen Isolat Reaktion trennen, wie in 2B.
Das ERG Aufnahmetechnik kann zur neuroprotektiven Interventionen zu überprüfen. Baseline-Aufnahmen haben eine Woche vor Lichtschäden sind in 3A zu sehen. Lichtschäden reduziert sowohl eine Wellen und b-Wellenamplituden, in Fig nachgewiesenure 3B. Fern ischämischen Präkonditionierung konnte den Verlust der ERG Amplitude zu reduzieren, wie in 3C gesehen. Der Remote-Ischämie-Technik hängt von der korrekten Anwendung der Blutsperre über dem "Knie". Falsche Anwendung der Blutsperre nicht Lichtschäden zu vermeiden, um die Netzhaut, wie in 3D zu sehen.

Abbildung 1: Die Messung der a-Welle und b-Wellen von einem dunkeladaptierten ERG der dargestellten von der Hornhaut eines dunkeladaptierten Auge auf einen hellen Lichtblitz an der gezeigten Zeitpunkt t0 gegeben zeichneten Spur.. Die Amplitude der A-Welle wird von der Grundlinie zu der ersten Mulde (roter Pfeil) gemessen. Die Amplitude der B-Welle von der Mulde der a-Welle auf die folgende positive Spitze (blauer Pfeil) gemessen. Implizite Zeit (Latenz) wird aus dem Stimulus gemessenArtefakt (t0) bis zu dem Punkt von Interesse auf der Spur, wie der Tiefpunkt der a-Welle (eckige Klammer). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
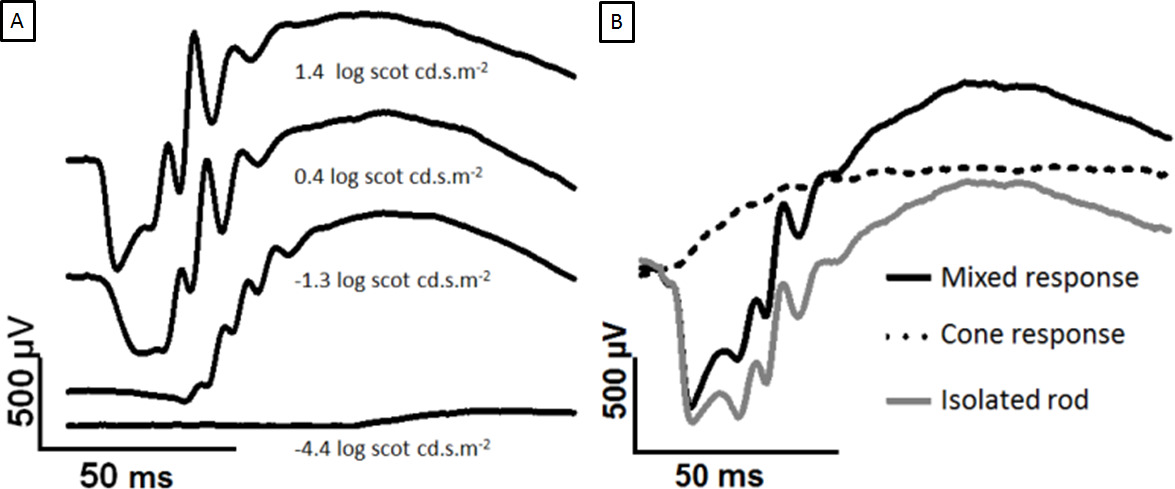
Abbildung 2: Entwicklung der dunkeladaptierten ERG mit zunehmender Blitzstärke und die Trennung der Stäbchen und Zapfen Die gezeigten Reaktionen sind von der Hornhaut eines dunkeladaptierten Auge zur Steigerung Lichtblitze aufgezeichneten Spuren.. Die a-Welle erscheint heller Intensitäten. (A) Vergleich von 1,4 bis 0,4 log Scot cd.sm -2 der Peak b-Welle gesättigt ist, aber die A-Welle weiter zu. In (B) werden die Doppelblitze überlagert. Die beiden 2,0 log scot cd.sm -2 Blitze werden durch einen 500 ms ISI getrennt. Der erste Blitz erzeugt ein gemischtesReaktion (schwarz) und der zweite Blitz erzeugt ein kegel einzige Antwort (gepunktete Linie). Subtrahieren des Kegels Reaktion ergibt die isolierten Stange Antwort (grau). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
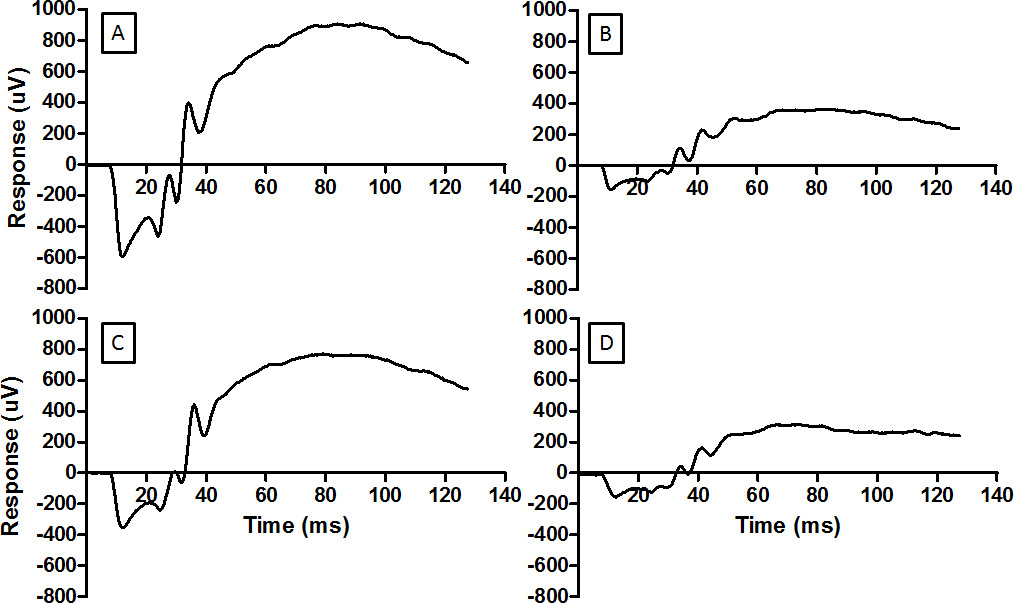
Abbildung 3: Die ERG ist ein Maß für die Funktion der Netzhaut Repräsentative Wellenformen werden hier für die (A) normalen Netzhaut, (B) Netzhaut durch Licht beschädigt ist, (C) Netzhaut bedingt durch RIP, bevor sie dem schädlichen Licht ausgesetzt gezeigt, und. (D) Netzhaut ineffektiv durch RIP konditioniert und dann zu schädlichen Licht ausgesetzt ist. Das gleiche Blitzenergie wurde für jeden Datensatz (2,0 log cd.sm -2) verwendet. Für das Protokoll in D die Druckmanschetteauf der Hintergliedmaße wurde falsch platziert und Ischämie wurde nicht festgelegt. Lichtschäden reduziert die Amplitude der ERG (B) und RIP mildert die Reduktion. Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

Abb. 4: Schließen Sie oben ERG Elektroden Die Elektroden aufgebaut angezeigt, links nach rechts; die positive Elektrode, die Hornhaut zu kontaktieren, die negative Elektrode, in den Mund und der Referenzelektrode, die aus einer Krokodilklemme auf eine Nadel, die dann in das Hinterteil subkutan eingelegt verbunden sind platziert werden. , um eine größere Version zu sehen Bitte klicken Sie hier von dieser Figur.
Diskussion
Die oben beschriebene dunkeladaptierten Flash ERG Verfahren ist eine zuverlässige Methode zur Beurteilung Retinafunktion bei Ratten. Sowohl die A-Welle und b-Welle wurden durch Lichtschäden reduziert. Remote ischämischen Präkonditionierung gemildert Lichtschäden induzierte Reduktionen in der a-Welle und b-Welle. Diese Erhaltung der Netzhautfunktion legt nahe, dass Remote-ischämischen Präkonditionierung induziert hat Neuroprotektion, ähnlich andere Formen der Schutz Präkonditionierung wie Hypoxie, Ischämie und Bewegung 8-10. Die Aufnahme-Setup, Parameter der Lichtreiz, und der Zustand des Tieres - Die ERG-Signal aufgezeichnet wird von drei Gruppen von Faktoren bestimmt.
Aufnahme-Setup
Die ERG ist in der Amplitude reduziert, wenn Elektroden sind falsch platziert oder die Zubereitung unvollständig geerdet 11. Korrekte Erdung der elektrischen Anlagen in der Nähe ist wichtig, um Rauschen in der Aufnahme zu reduzieren; Wenn größere Lärm besteht ein Faraday sollte Käfig verwendet werden. Die positive Elektrode soll sicher und in der Mitte der Hornhaut mit der Bestätigung der Position vor dem Starten des ERG Vollfeld-Protokoll und bei Beendigung geprüft positioniert werden. Es ist wichtig, daß diese Elektrodenkontakte nur die Hornhaut; mit dem Augenlid zu kontaktieren oder sogar Whisker Signalamplitude zu reduzieren. Eine lockere Baumwollfaden hat in diesem Protokoll verwendet worden, um die Augenlider vom Berühren der positiven Elektrode zu verhindern. Einige Forscher haben Kontaktlinsen mit der positiven Elektrode eingebettet ist, um einen zuverlässigen Kontakt und die Vermeidung von Augenlid berühren 12 sicherzustellen, entwickelt.
Die Lichtreiz einrichten
Der Stimulator wir verwendet haben, bietet Breitspektrum-weißes Licht aus LED-Quellen. Andere Lichtquellen sind als Lichtreize wie Xenon-Blitzlicht-und Halogen-Beleuchtung, sehen Weymouth und Vingrys für Vergleiche zwischen den Lichtreize 11 geeignet. Der Vorteil von LED-Licht, aber is, dass die Dauer jedes einzelnen Leucht und seine Energie sind einfach zu programmieren und eine breite Palette von Lichtintensitäten schnell zurückgesetzt über. Wir haben eine Reihe von Blitzen abgestufter Energie, die in der dunkeladaptierten Nagetier Bereich von Schwellen (Herstellung einer just-nachweisbare Reaktion) zu sättigen (Herstellung einer maximalen Reaktion) entwickelt.
Durch Versuch und Irrtum, haben wir Interstimulus (ISIS), die sicherstellen, dass die Amplitude der Antwort auf einen Blitz ist unabhängig von einem vorhergehenden Flash gleicher Stärke hergestellt. Je heller das flash, je länger die ISI für diese Unabhängigkeit erforderlich.
Auch durch Versuch und Irrtum haben wir eine Mindestanzahl von Antworten bei jeder Energie benötigt, um ein sauberes Signal bereitzustellen etabliert. Durchschnittlich mehr Antworten werden immer ein klareres Signal. Wir nutzen die Minima, so dass der Energie Serie schnell abgeschlossen werden (in unserem Protokoll 11 min); rasche Fertigstellung reduziert Variation aufgrund von Änderungen der Narkosezustand und allows Zeit für andere Variablen untersucht werden, falls erforderlich.
Zustand des Tieres
Verschiedene Parameter des Tierphysiologie sind wichtig zur Optimierung und Standardisierung der ERG-Aufnahmen erhalten.
Temperatur
Die a-Wellensignal wird von dem lichtinduzierte Aktivierung eines G-Protein-gekoppelten Phototransduktionskaskade im äußeren Segment erzeugt wird; Die Dynamik dieser Kaskade sind wie alle enzymatischen Reaktionen temperaturabhängige 13,14. Nagetieren unter Anästhesie sind anfällig für Hypothermie und benötigen externe Erwärmen auf eine Kerntemperatur von 37,5 ° C während des gesamten Aufzeichnungs aufrechtzuerhalten. Wenn die Körpertemperatur fällt mehr als 1-2 ° C, die a-Welle und b-Wellenamplituden verringern und deren Latenzzeiten zu erhöhen 15.
Anästhesie
Stabile ERG Aufnahmen erfordern das Tier unbeweglich zu sein. Neuromuskuläre Blocker und anaesthetic Mittel sind in ERG Experimente verwendet werden, um eine unbewusste und regungslos Zustand zu erreichen. Es gibt nur fünf Berichte über wach ERG Aufnahmen bei Ratten 16-20. In diesen Studien wurden Elektroden chirurgisch in den Schädelvorge implantiert und zwei dieser Studien getestet die Wirkung der Anästhesie auf der ERG 17,20.
Die häufigste Narkose ERG Aufnahmen verwendet hat eine Kombination von Ketamin und Xylazin (in unseren Experimenten 60 mg / kg Ketamin und 5 mg / kg Xylazin verwendet wird). Dies wirkt sich auf die ERG weniger als gasförmigen Narkose wie Isofluran und Halothan und hat relativ nicht-toxisch erwiesen, mit einem hohen Rückgewinnungsraten 17,21,22. Dieser Ansatz hält das Tier unbeweglich für ~ 40 min; eine halbe Dosis kann verwendet werden, um die Aufzeichnungsbedingungen für einen ähnlichen Zeitraum zu verlängern. Die Studie von Chang direkt verglichen die ERG mit und ohne Anästhesie und zeigte, dass Ketamin-Xylazin ist messbar stören die Amplitude und die Latenzzeiten von A- und B-Wellen 17. Die meisten Forscher standardisieren Narkosebedingungen und testen Versuchsparameter; einige Wirkung von Anästhetika nicht gänzlich ausgeschlossen werden.
Okularumgebung
Die Physiologie des Auges erfordert Wartung, zu optimieren und zu standardisieren ERG Aufzeichnung. Die Schüler sollen eine Standard-Größe sein; Dieses ist mit einer mydriatischen erreicht, aufgebracht, wie Augentropfen, um die maximale Ausdehnung erreichen. Bei Nagetieren wird Atropin oder Phenylephrin verwendet 23. Die Hydratation der Hornhaut wird durch Anwendung eines Carbomer Polymer vor der Aufnahmen gehalten wird; Dies stabilisiert auch die elektrische Leitfähigkeit zwischen der positiven Elektrode und der Hornhaut. Wenn die Hornhaut wird entwässert, können Hornhautnarben und Kataraktbildung 24 auftreten. Katarakt-Bildung in Mäusen 25 häufiger und verschiedene Methoden zur Erhaltung Hydration der Horn wurden in Maus-ERG Aufnahmen eingesetzt worden, einschließlich eines konstanten Fluss der wässrigen Flüssigkeit odermaßgeschneiderte Kontakt Stil Elektroden dass Falle Flüssigkeitszufuhr an der Hornhautoberfläche 12.
Adaptive Zustand der Netzhaut
Dies ist ein Hauptvariable. Die oben angegebenen Protokoll ist so ausgelegt, um sicherzustellen, dass die Netzhaut ist dunkeladaptierten, um am empfindlichsten Zustand. Idealerweise erforderlich pigmentierten Ratten 3 Stunden von dunklen Gehäuse vollständig dunkeladaptierten während unpigmentierten Tieren wie Sprague Dawley Ratten zu sein, erfordern ein Minimum von 5 Stunden 26. Es ist gängige Praxis für skotopischen ERG Aufzeichnungen zu den Tieren über Nacht 12 Stunden anzupassen. Teilweise oder vollständige Anpassung an Licht kann einfach und schnell durch Drehen auf einer Standard-Intensität Hintergrundbeleuchtung in der Ganzfeld-Stimulator erreicht werden. Nach leichten Anpassung jedoch übernimmt die volle Dunkeladaptation Stunden zu erreichen; daher der Vorschlag von äußerster Vorsicht, um sicherzustellen, dass die Augen nicht versehentlich Licht vor der Aufnahme ausgesetzt.
Die ERG Aufnahmetechnik ist durch die begrenzteüber Bestimmungsfaktoren (dh ERG & Stimulus Set-up) und der Kenntnisse der Forscher an ERG-Tests. Unerfahrene Forscher dürften Variablen ERG Aufnahmen haben. Varianz kann durch die Schaffung von groß genug Stichprobengrößen, die Ergebnisse, wie zum Beispiel Ermäßigungen oder Gewinne in der Sehfunktion vergleichen reduziert werden. Alternativ können ERG Aufnahmen zwischen Baseline-Aufnahmen und Nachbehandlung Aufnahmen normalisiert werden. Die normalisierten Daten können dann gruppiert und analysiert werden. Bei der Vorlage ERG Daten ist es gängige Praxis, Gruppendaten und repräsentative Wellenformen zeigen.
Wenn alle der oben genannten sorgfältig gesteuert werden, wird die Amplitude des ERG ist ein Maß für den Funktionszustand der Netzhaut. Die ERG konsistent in der Amplitude durch Verarmung der Photorezeptorschicht durch Lichtschäden oder genetisch induzierte Degeneration 27,28 verursacht wird, reduziert. Umgekehrt ist die schützende Wirkung einer Intervention wie RIP in der ampl erkannt werdenitude der ERG 29. Die ERG hat sich auch beim Nachweis der schützenden Wirkungen von ischämischen Präkonditionierung, hypoxische Präkonditionierung, Bewegung und Ernährung Safran auf der Netzhaut 8-10,30 verwendet.
Wachsenden Wissen über die Dynamik des Phototransduktionskaskade von Rhodopsin und der synaptischen Verbindungen von der Netzhaut, hat die Entwicklung von Modellen der ERG Generation, und anspruchsvolle ERG Wellenformanalyse angeregt ist möglich, wenn die kinetische Modellierung auf bekannte physiologische Ereignisse Phototransduktion in Photorezeptoren auf der Basis und unser Verständnis der inneren Netzhautschaltung 31. Zum Beispiel sind die A-Welle kinetischen Modelle auf die biochemischen Schritte, die während Phototransduktion auftreten und Anpassung des Modells ermöglicht Vergleiche von Modellparametern wie Peakantworten, Zeitverzögerungen und Empfindlichkeit 14 basierend.
Der Nachteil der Modellierung ist, dass es auf Annahmen über Netzhaut circuitr stützty, und kann nur so informativ wie die Annahmen zu ermöglichen. Angesichts dieser Nachteile, die eine Wellen kinetisches Modell wurde vor kurzem für ein vereinWellenDynamik 32 kritisiert. In Photorezeptordegeneration Studien ERG Wellenform-Analyse wird in der Regel nicht aus einem anderen Grund durchgeführt. Photorezeptordegeneration ist oft schwerer, was zu dramatischen Verlusten in Sehfunktion und folglich wird die weitere Analyse eines Wellen und b-Wellenparameter nicht gerechtfertigt 8,9,27,30. Unabhängig davon hat ERG Modellierung der a-Welle und b-Welle als gängige Praxis in vielen Studien an Nagetieren und detaillierte Informationen über ERG Modellierung angenommen wurde, für einen Wellen, b-Welle und OPs können in Studien von Hood und Überprüfung gefunden werden Artikel von Weymouth und Vingrys, Frishman und Wachtmeister 11,32-34.
Zusammenfassend hat die dunkeladaptierten ERG Methode kann messbare Unterschiede zwischen Netzhautdegeneration mit und ohne neuroprotektiven Interventionen s aufzeichnenuch als Fern ischämischen Präkonditionierung. Die wesentlichen Elemente, um eine zuverlässige ERG Aufnahmen wurden beschrieben. Die ERG-Messungen der Photorezeptor und inneren Netzhaut-Funktion sind für die Forscher untersuchen Degenerationen der Netzhaut, und die Auswirkungen der verschiedenen genetischen, biopharmazeutischen und pharmakologische Interventionen auf die Sehfunktion.
Offenlegungen
Jonathan Stone ist der Direktor der CSCM Pty Ltd
Danksagungen
Die Autoren sind dankbar für die Unterstützung von Frau Sharon Spana in Nagetier-Überwachung, Handhabung und Experimentieren. PhD finanzielle Unterstützung wurde von University of Sydney und Australian Research Centre for Excellence in Sicht zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| PC computer | |||
| Powerlab, 4 channel acquistion hardware | AD Instruments | PL 35044 | Acquistion of ERG |
| Animal Bio Amp | AD Instruments | FE 136 | Amplifier for ERG |
| Lab chart | AD Instruments | Signal collection software | |
| Ganzfield | Photometric solutions | FS-250A | Light stimulus |
| Ganzfield operating system | Photometric solutions | ||
| Research Radiometer | International light technologies | ILT-1700 | calibrate light series |
| Lux meter | LX-1010B | check red light illumanation | |
| Excel | Microsoft | ||
| Lead wires | AD Instruments | Connect postive, negative ground electrodes to amplifier | |
| Lead wires - alligator | AD Instruments | ground ganzfield and acquistion hardware to computer | |
| Platinum wire 95% | A&E metals | postive electrode | |
| Mouth electrode Ag/AgCl Pellet | SDR | E205 | negative electode |
| 26 G needle | BD | ground electode | |
| Water pump | |||
| Water bath | |||
| Tubing | |||
| Homeothermic blanket system with flexible probe | Harvard Appartus | 507222F | |
| Atropine 1% w/v | Bausch & Lomb | topical mydriasis | |
| Proxmethycaine 0.5% w/v | Bausch & Lomb | topical anaesthetic | |
| Visco tears eye drops | Novartis | carbomer polymer | |
| Thread | retract eye lid | ||
| Tweezers | |||
| Reusable adhesive | Blu tac | Dim red headlamp. Affix electrodes | |
| Absorbent bedding | |||
| Ketamil - ketamine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | dissociative | |
| Xylium - Xylazine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | muscle relaxant | |
| Scale |
Referenzen
- Arden, G. B., Heckenlively, J. . Principles and practice of clinical electrophysiology of vision. , 139-183 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. Journal of Physiology-London. 555 (1), 153-173 (2004).
- Fortune, B., et al. Selective ganglion cell functional loss in rats with experimental glaucoma. Investigative Ophthalmology & Visual Science. 45 (6), 1854-1862 (2004).
- Alarcon-Martinez, L., et al. Short and long term axotomy-induced ERG changes in albino and pigmented rats. Molecular Vision. 15 (254-255), 2373-2383 (2009).
- Lyubarsky, A. L., et al. Functionally rodless mice: transgenic models for the investigation of cone function in retinal disease and therapy. Vision Research. 42 (4), 401-415 (2002).
- Bush, R. A., Sieving, P. A. . A PROXIMAL RETINAL COMPONENT IN THE PRIMATE PHOTOPIC ERG A-WAVE. Investigative Ophthalmology & Visual Science. 35 (2), 635-645 (1994).
- Liu, K., et al. Development of the electroretinographic oscillatory potentials in normal and ROP rats. Investigative Ophthalmology & Visual Science. 47 (12), 5447-5452 (2006).
- Casson, R. J., Wood, J. P. M., Melena, J., Chidlow, G., Osborne, N. N. The effect of ischemic preconditioning on light-induced photoreceptor injury. Investigative Ophthalmology & Visual Science. 44 (3), 1348-1354 (2003).
- Lawson, E. C., et al. Aerobic Exercise Protects Retinal Function and Structure from Light-Induced Retinal Degeneration. Journal of Neuroscience. 34 (7), 2406-2412 (2014).
- Grimm, C., et al. HIF-1-induced erythropoietin in the hypoxic retina protects against light-induced retinal degeneration. Nature Medicine. 8 (7), 718-724 (2002).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: Methods for extraction and interpretation of rod and cone responses. Progress in Retinal and Eye Research. 27 (1), 1-44 (2008).
- Bayer, A. U., Cook, P., Brodie, S. E., Maag, K. P., Mittag, T. Evaluation of different recording parameters to establish a standard for flash electroretinography in rodents. Vision Research. 41 (17), 2173-2185 (2001).
- Pugh, E. N., Lamb, T. D. AMPLIFICATION AND KINETICS OF THE ACTIVATION STEPS IN PHOTOTRANSDUCTION. Biochimica Et Biophysica Acta. 1141 (2-3), 111-149 (1993).
- Breton, M. E., Schueller, A. W., Lamb, T. D., Pugh, E. N. ANALYSIS OF ERG A-WAVE AMPLIFICATION AND KINETICS IN TERMS OF THE G-PROTEIN CASCADE OF PHOTOTRANSDUCTION. Investigative Ophthalmology & Visual Science. 35 (1), 295-309 (1994).
- Mizota, A., Adachi-Usami, E. Effect of body temperature on electroretinogram of mice. Investigative Ophthalmology & Visual Science. 43 (12), 3754-3757 (2002).
- Szabo-Salfay, O., et al. The electroretinogram and visual evoked potential of freely moving rats. Brain Research Bulletin. 56 (1), 7-14 (2001).
- Charng, J., et al. Conscious Wireless Electroretinogram and Visual Evoked Potentials in Rats. Plos One. 8 (9), (2013).
- Galambos, R., Juhasz, G., Kekesi, A. K., Nyitrai, G., Szilagyi, N. NATURAL SLEEP MODIFIES THE RAT ELECTRORETINOGRAM. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5153-5157 (1994).
- Galambos, R., Szabo-Salfay, O., Szatmar, E., Szilagyi, N., Juhasz, G. Sleep modifies retinal ganglion cell responses in the normal rat. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 2083-2088 (2001).
- Guarino, I., Loizzo, S., Lopez, L., Fadda, A., Loizzo, A. A chronic implant to record electroretinogram, visual evoked potentials and oscillatory potentials in awake, freely moving rats for pharmacological studies. Neural Plasticity. 11 (3-4), 241-250 (2004).
- Huang, J. C., Salt, T. E., Voaden, M. J., Marshall, J. NON-COMPETITIVE NMDA-RECEPTOR ANTAGONISTS AND ANOXIC DEGENERATION OF THE ERG B-WAVE IN-VITRO. Eye (London). 5 (4), 476-480 (1991).
- Sasovetz, D. . KETAMINE HYDROCHLORIDE - EFFECTIVE GENERAL ANESTHETIC FOR USE IN ELECTRORETINOGRAPHY. Annals of Ophthalmology. 10 (11), 1510-1514 (1978).
- Mojumder, D. K., Wensel, T. G. Topical Mydriatics Affect Light-Evoked Retinal Responses in Anesthetized Mice). Investigative Ophthalmology & Visual Science. 51 (1), 567-576 (2010).
- Fraunfel, F. t., Burns, R. P. ACUTE REVERSIBLE LENS OPACITY - CAUSED BY DRUGS, COLD, ANOXIA, ASPHYXIA, STRESS, DEATH AND DEHYDRATION. Experimental Eye Research. 10 (1), 19 (1970).
- Calderone, L., Grimes, P., Shalev, M. ACUTE REVERSIBLE CATARACT INDUCED BY XYLAZINE AND BY KETAMINE-XYLAZINE ANESTHESIA IN RATS AND MICE. Experimental Eye Research. 42 (4), 331-337 (1986).
- Behn, D., et al. Dark adaptation is faster in pigmented than albino rats. Documenta Ophthalmologica. 106 (2), 153-159 (2003).
- Sugawara, T., Sieving, P. A., Bush, R. A. Quantitative relationship of the scotopic and photopic ERG to photoreceptor cell loss in light damaged rats. Experimental Eye Research. 70 (5), 693-705 (2000).
- Machida, S., et al. P23H rhodopsin transgenic rat: Correlation of retinal function with histopathology. Investigative Ophthalmology & Visual Science. 41 (10), 3200-3209 (2000).
- Brandli, A., Stone, J. Remote Ischemia Influences the Responsiveness of the Retina. Observations in the Rat. Investigative Ophthalmology & Visual Science. 55 (4), 2088-2096 (2014).
- Maccarone, R., Di Marco, S., Bisti, S. Saffron supplement maintains morphology and function after exposure to damaging light in mammalian retina. Investigative Ophthalmology & Visual Science. 49 (3), 1254-1261 (2008).
- Hood, D. C., Birch, D. G. Assessing abnormal rod photoreceptor activity with the a-wave of the electroretinogram: Applications and methods. Documenta Ophthalmologica. 92 (4), 253-267 (1996).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Progress in Retinal and Eye Research. 39, 1-22 (2014).
- Hood, D. C., Birch, D. G. A COMPUTATIONAL MODEL OF THE AMPLITUDE AND IMPLICIT TIME OF THE B-WAVE OF THE HUMAN ERG. Visual Neuroscience. 8 (2), 107-126 (1992).
- Wachtmeister, L. Oscillatory potentials in the retina: what do they reveal. Progress in Retinal and Eye Research. 17 (4), 485-521 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten