Method Article
Utilizzando il Elettroretinogramma per valutare la funzione in roditori Retina e gli effetti protettivi del Remote Limb ischemico precondizionamento
In questo articolo
Riepilogo
The electroretinogram (ERG) is an electrical potential generated by the retina in response to light. This paper describes how to use the ERG to assess retinal function, in dark-adapted rats, and how it can be can be used to assess a neuroprotective intervention, in the present case remote ischemic preconditioning.
Abstract
The ERG is the sum of all retinal activity. The ERG is usually recorded from the cornea, which acts as an antenna that collects and sums signals from the retina. The ERG is a sensitive measure of changes in retinal function that are pan-retinal, but is less effective for detecting damage confined to a small area of retina. In the present work we describe how to record the ‘flash’ ERG, which is the potential generated when the retina is exposed to a brief light flash. We describe methods of anaesthesia, mydriasis and corneal management during recording; how to keep the retina dark adapted; electrode materials and placement; the range and calibration of stimulus energy; recording parameters and the extraction of data. We also describe a method of inducing ischemia in one limb, and how to use the ERG to assess the effects of this remote-from-the-retina ischemia on retinal function after light damage. A two-flash protocol is described which allows isolation of the cone-driven component of the dark-adapted ERG, and thereby the separation of the rod and cone components. Because it can be recorded with techniques that are minimally invasive, the ERG has been widely used in studies of the physiology, pharmacology and toxicology of the retina. We describe one example of this usefulness, in which the ERG is used to assess the function of the light-damaged retina, with and without a neuroprotective intervention; preconditioning by remote ischemia.
Introduzione
L'ERG è un potenziale elettrico generato dalla retina in risposta alla luce, e registrato dalla superficie corneale dell'occhio. Quando le condizioni di registrazione vengono gestite accuratamente, l'ERG può essere utilizzato in una varietà di modi per valutare la funzione retinica. Qui abbiamo descritto come registrare il 'Flash ERG', il potenziale generato quando la retina è esposto a un breve lampo, luminoso presentato in uno sfondo Ganzfeld. Il Ganzfeld disperde la luce in modo omogeneo e il lampo di luce raggiunge tutta la retina di circa uniforme. Se la retina è scuro adattato prima della registrazione, e il buio-adattamento è mantenuto come l'animale è preparato per la registrazione, l'ERG ha ottenuto è generato da due bastoncelli e coni.
Il-scuro adattato Flash ERG ha una forma d'onda caratteristica, che è stato analizzato in due modi. Innanzitutto, precoci e tardive componenti della forma d'onda ERG sono stati distinti, e relativi alla sequenza di neuroneal attivazione nella retina. Il primo componente è una breve latenza andamento negativo potenziale, l'a-onda (Figura 1). Questo è seguito da un potenziale positivo continuo, chiamato b-wave. La fase di salita del b-wave mostra oscillazioni, che sono considerate un componente separato (potenziali oscillatori o PO). L'a-onda è considerato essere generato da fotorecettori, il b-wave dalle cellule dello strato nucleare interno e dei PO dalle cellule amacrine 1.
Sulla base della forza dello stimolo, risposte a molto fioche lampeggia definito la risposta di soglia scotopica sono possibili. La risposta di soglia scotopica è inteso essere generato dalle cellule gangliari retiniche 2-4. In secondo luogo, il flash ERG può essere separata da adattamento alla luce, o da un protocollo due Flash descritto di seguito, in componenti di noccioli e cono guidato. In condizioni fotopiche, l'a-onda non è rilevabile nei ratti, perché la popolazione cono è basso, ma PO e un b-wave sonochiaro 5. Nei primati, le cui retine avere popolazioni cono più elevati, sia Rod- e percorsi di cono generano un rilevabile un onda 6.
Due misure utili spesso estratte dal flash ERG sono le ampiezze dei a- e b-onde, misurate come nella figura 1, con risposte in flash tipici mostrati in Figura 2. Quando la popolazione fotorecettore è ridotto, per esempio mediante esposizione a pericolosamente luminoso luce, tutti i componenti del ERG sono ridotti. Interventi neuroprotettivi, come ad esempio a distanza precondizionamento ischemico (RIP), possono essere convalidati dalla conservazione delle ampiezze delle a- e b-onde (Figura 3). In sintesi, l'analisi della ERG consente confronti tra sano, leggero e della retina danneggiate neuroprotected.
Protocollo
Questo protocollo segue le linee guida per la cura degli animali di Università di Sydney.
1. Realizzazione di elettrodi
- Costruire l'elettrodo positivo (quello che contattare la cornea) da un breve (5 cm) lunghezza del filo di platino 1-2 mm di diametro. Adatti in un loop di pochi mm di diametro. Collegare questo circuito ad un cavo tradizionale, abbastanza a lungo per raggiungere la fase di ingresso dell'amplificatore (vedi Figura 4).
- Costruire l'elettrodo negativo (che andrà in bocca all'animale) utilizzando un Ag / AgCl pellet 1-2 mm di diametro, anche collegata ad un cavo convenzione (vedi Figura 4).
- Come un elettrodo di riferimento (che entrerà in groppa dell'animale), utilizzare un ago ipodermico pulita (23 G), anche collegata ad un cavo di lunghezza appropriata (vedere Figura 4).
- Idealmente, utilizzare cavi a tre lead forniti dai produttori di strumenti, per collegare i tre elettrodi (positiva U94; cornea, negativo → bocca, riferimento → groppa) all'amplificatore.
2. Connessione e calibrazione di stimolo luminoso e ERG Set-up
- Creare (o individuare) un piccolo laboratorio di registrazione, che può essere fatta scuro. Dotare con uno o entrambi di una luce over-the-banco fatto rosso o una testa-spia rossa.
- Utilizzare un metro lux per confermare che l'illuminamento a luci rosse raggiungere l'occhio del ratto durante l'installazione non supera 1 lux.
Nota: un filtro a densità neutra può essere utilizzato per ridurre la luminosità della lampada e la sorgente di luce della lampada deve specificamente emettere luce rossa. Adattamento scuro sarà compromessa se fonti di luce emettono inferiori (visibili) lunghezze d'onda. - Sigillare tutta la luce parassita di entrare nel laboratorio di registrazione (questo spesso richiede la persistenza con nastro opaco) e preparare un filtro a densità neutra (questo può essere acquistato in fogli) grande abbastanza da contenere oltre, e così debole, qualsiasi schermo del computer si avrà nel laboratorio.
Nota: luce diffusa ela luce di uno schermo sono sufficienti a pregiudicare adattamento scuro dell'occhio ratto. - Collegare l'amplificatore di hardware di acquisizione dati. Collegare i cavi, negativi e positivi di riferimento per l'amplificatore. Assicurarsi che il computer e l'unità di alimentazione Ganzfeld LED siano collegati a una presa di terra.
Nota: Alcuni laboratori sono specializzati punti di terra, collegato ad una terra dell'edificio; un tubo di acqua è un'alternativa efficace. - Calibrare la sorgente luminosa a LED con un radiometro di ricerca di qualità. Fissare sensore dello strumento nella posizione in cui l'occhio dell'animale sarà situato durante un esperimento.
- Programmare i LED Ganzfeld per eseguire un protocollo di ERG a tutto campo con aumenti passo-saggio in energia flash, durata del flash, flash ripetizione e tempo tra lampi, chiamato intervallo interstimuls (ISI), le impostazioni. Ad esempio, un protocollo a tutto campo si veda la tabella 1.
Nota: Il full-campo ERG lampi passano da ripetitivi dim lampeggia per Blampeggia a destra in modo saggio passo. Il programma Twin Flash fa seguito al protocollo a tutto campo e consente l'isolamento di coni e bastoncelli risposte.
3. Giorno Prima di ERG Sperimentazione
- Scuro adattare ratti Sprague-Dawley di 12 ore prima della registrazione. È conveniente fare questo in laboratorio di registrazione, una volta che la luce esterna è stata eliminata.
4. Giorno di ERG Sperimentazione
- Disporre per l'animale sia dolcemente riscaldata durante la registrazione. Usiamo una piattaforma di metallo leggero costruito in modo che la testa dell'animale può riposare al giusto punto all'entrata al Ganzfeld. La piattaforma ha integrato tubo attraverso cui si pompa acqua preriscaldata a 40 ° C in un bagno d'acqua.
Nota: L'esperienza dimostra che questo mantiene la temperatura interna dell'animale a 37 ° C. - Pesare il ratto in condizioni di oscurità. Peso record e portare corretto ketamina (60 mg / kg) e xilazina (5 mg / kg) dose. Trattenere il ratto gently e iniettare anestetico per via intraperitoneale.
- Nota momento dell'iniezione. Una volta che l'animale è incosciente (di solito entro 5 min) verificare la profondità dell'anestesia pizzicando leggermente un rilievo del piede, per vedere se una risposta riflessa è presente. E 'meglio aspettare fino a quando questo riflesso è assente o debole, prima di procedere.
- Applicare una sola goccia di atropina e un altro di proxmethacaine alla cornea.
- Tagliare una lunghezza 10 centimetri di filo nero. Fare un cappio con un nodo semplice e scivolare l'anello sopra l'equatore dell'occhio. Stringere leggermente; l'effetto è quello di disegnare il bulbo oculare leggermente in avanti, con pressione minima. Ciò mantiene la cornea risulta dalle palpebre.
- Applicare occhio carbomer scende verso la superficie della cornea. Garantire carbomer rimane sulla superficie corneale e non fuoriesca sulle palpebre o la faccia.
- Posizionare assestamento assorbente in cima piattaforma riscaldato.
- Posizionare topo sulla biancheria da letto, con la testa nel posto consigliato nell'apertura del Ganzfeld.
- Inserisci intsonda di temperatura ernal nel retto. Sonda di temperatura sicuro in posizione con nastro adesivo il cavo della sonda fino alla coda.
- Inserire l'elettrodo di riferimento (l'ago 23 G) per via sottocutanea nella gamba posteriore, e la connessione all'amplificatore.
- Inserire l'elettrodo negativo (il pellet Ag / AgCl) saldamente in bocca. Per evitare che questo scivolare fuori dalla bocca, apporre il cavo di collegamento di una superficie stabile.
- Posizionare l'elettrodo positivo sul centro della cornea. Utilizzando un micromanipolatore, assicurarsi che l'elettrodo tocca la cornea delicatamente.
- Controllare la temperatura del corpo è al 37,0-37,5 ° C.
- Una volta che l'animale è posizionato correttamente e gli elettrodi sono in atto, copre l'intero setup (Ganzfeld e animale) con un materiale opaco (per preservare adattamento al buio). Usiamo un panno morbido nera.
- Nel software di acquisizione fissato a una frequenza di campionamento 2 KHz con un tempo di raccolta di 100-1000 msec con 5 msec di prelevamento dei campioni pre-collezione. Impostare i filtri passa banda a 1-1,000Hz e assicura che il campionamento viene attivato per assaggiare il periodo di ~ 250 msec dopo un lampo.
- Controllare la linea di base della registrazione. Dovrebbe essere esente da disturbi esterni, ma mostrare un po 'di rumore amplificatore e una oscillazione respiratoria.
- Se la linea di base mostra rumori estranei, iniziare la risoluzione dei problemi. La maggior parte dei problemi sono legati allo scivolamento in posizione degli elettrodi, o incaglio. Utilizzare una gabbia di Faraday per garantire registrazioni siano privi di rumore estraneo.
- Eseguire un lampo di prova, 0,4 log scot cd.sm -2. Una forma d'onda ERG simile alla figura dovrebbe apparire 2A. Nelle nostre risposte tipiche di laboratorio per un 0,4 log scot cd.sm -2 Flash sono (a-wave: -474 ± 39 mV e b-wave: 1.512 ± 160 mV, n = 11).
- Lasciare animale scuro riadattare per 10 min. E 'conveniente usare questi 10 minuti di ricontrollare la linea di base.
- A seguito della conferma del segnale stabile avviare la registrazione.
- Alla fine della sessione di registrazione, controllare che il corpo temperature è stata mantenuta. Rimuovere gli elettrodi. Riapplicare carbomer polimero cornee. Permettere agli animali di recuperare su un blocco di calore finché non è completamente mobile e attivo, prima di tornare a stabulazione degli animali.
5. Ischemia Remote
- Eseguire ischemia a distanza sia in roditori svegli o anestetizzati.
- Se l'animale è anestetizzato, adagiarlo su una piattaforma riscaldata (sopra) e infilare il bracciale sfigmomanometro sulla parte superiore della arti posteriori, chiara del ginocchio.
- Se gli animali sono abituati ad essere manipolati, è possibile eseguire questa procedura senza anestesia; questo richiede due persone. Una persona trattiene l'animale delicatamente e il secondo si applica il bracciale sfigmomanometro e gestisce il misuratore di pressione.
- Per gli animali svegli, utilizzare un pezzo di asciugamano ~ 15 centimetri x 30-50 cm per avvolgere delicatamente l'animale, con uno degli arti posteriori gratuito. Posare l'animale sul dorso su (ad esempio) l'avambraccio sinistro, con la testa infilata tra il braccio del titolare e il tronco, e luogoil bracciale come appena descritto.
- Sgonfiare il bracciale e garantire la valvola dell'aria viene chiusa. Pompare il bracciale a 160 mmHg in animali anestetizzati, e a 180 mmHg negli animali svegli. Ciò supera la pressione sistolica (di solito 140 mmHg e 160 mmHg, rispettivamente).
- Mantenere queste pressioni, come richiesto, utilizzando la pompa a mano.
- Trascorso il tempo previsto per ischemia (usiamo 2 periodi di 5 minuti separati da 5 min riperfusione), sgonfiare la pressione del bracciale svitando la valvola dell'aria.
- Confermare l'effetto di ischemia remota con una sonda di temperatura della pelle attaccata alla zampa. La temperatura cutanea scende tipicamente 32-30 ° C, più di 5 minuti e recupera su riperfusione.
6. Danni Luce
- Assicurarsi che i ratti sono in un buio adattato durante la notte, prima che la procedura di danno chiaro.
- Al momento opportuno a seguito di ischemia degli arti (nei nostri esperimenti senza indugio), ogni animale viene posto singolarmente in scatole di plexiglass, with acqua e cibo in contenitori di pavimento-based.
Nota: il danno indotto dalla luce può essere intrapresa solo in animali albini. - Accendere una luce bianca pre-calibrato 1.000 lux a un tempo standard (di solito 09:00) e mantenere questa condizione per 24 ore.
7. ERG Estrazione dei dati e analisi
- Acquisire forme d'onda medio della ERG. Se necessario, corretto per una linea di base non-zero, per sottrazione.
- Misurare l'ampiezza della a-onda (presentato a metà a intensità elevate stimolo), come la differenza di tensione tra la linea di base e la prima (<30 msec latenza) trogolo (Figura 1).
- Misurare l'ampiezza dell'onda b come la differenza di tensione tra il picco di una onda e il positivo delle seguenti onda, tipicamente si verificano in una latenza di 80-100 msec (Figura 1).
- Isolare potenziali oscillatorie utilizzando una trasformata di Fourier per filtrare i dati 60-235 Hz, con una banda di transizione 90 Hz 7. Se necessario il isolato potenziale segnale oscillatorio può essere sottratta dalla forma d'onda non filtrato per confermare l'identità di un trogolo onda.
- Il tempo implicito (latenza) del tipo A e B onda picchi può anche essere una misura utile (Figura 1). Utilizzare i gemelli lampeggia per isolare la risposta canna. Sottrarre la risposta cono (flash 2) dalla risposta mista (flash 1) per isolare la risposta asta (Figura 2).
- Normalizzare l'intensità della luce individuale un onda e ampiezze b-onda (post-trattamento / post-trattamento-base) o media per i gruppi di trattamento. Curve Intensity-risposta tracciare le ampiezze di gruppo e l'errore contro l'energia del flash.
Risultati
Il protocollo può essere utilizzato per misurare la funzione visiva di roditore retina in vivo. L'a-onda, una misura della funzione fotorecettori, e b-wave, una misura della funzione retina interna, vengono annotati in Figura 1.
I asta dominato ERG segnale aumenta con la crescente stimolo luminoso, come mostrato nella figura 2A. L'a-onda diventa chiaro a ~ 0,4 log scot cd.sm -2 e l'ampiezza delle onde un aumenta fino a saturazione 2,5 log Scot cd.sm -2 (non mostrato). Il paradigma del flash gemello è stato utilizzato per separare segnale misto ERG in cono e l'asta isolare la risposta, come in Figura 2B.
Questa tecnica di registrazione ERG può essere usata per controllare gli interventi neuroprotettivi. Registrazioni di base completato una settimana prima al danno luce sono visti nella Figura 3A. Danno luce ridotto sia un onda e ampiezze b-onda, ha dimostrato in figUre 3B. Remote precondizionamento ischemico era in grado di ridurre la perdita di ERG ampiezza, come illustrato nella Figura 3C. La tecnica ischemia remota dipende dalla corretta applicazione del laccio sopra il "ginocchio". Errata applicazione del laccio emostatico non impedisce danni lievi alla retina, come si vede in figura 3D.

Figura 1: Misura del un-wave e b-onde da un dark-adattato ERG Il tracciato mostrato è registrato dalla cornea di un occhio adattato all'oscurità per un lampo di luce dato al momento indicato t0.. L'ampiezza della a-onda viene misurata dalla linea di base alla prima scanalatura (freccia rossa). L'ampiezza del b-onda è misurata dal trogolo di un onda al seguente picco positivo (freccia blu). Tempo implicito (latenza) è misurata dallo stimolomanufatto (t0) fino al punto di interesse sulla traccia, come ad esempio la depressione del un-onda (parentesi quadra). Cliccate qui per vedere una versione più grande di questa figura.
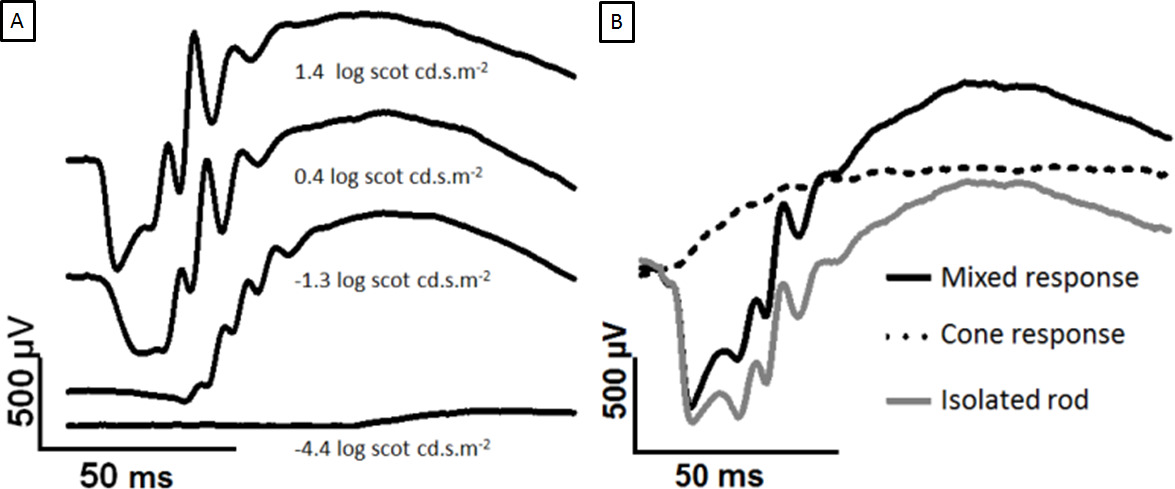
Figura 2: Sviluppo di dark-adattato ERG con forza crescente il flash e la separazione di coni e bastoncelli risposte Le tracce riportate sono registrati dalla cornea di un occhio adattato all'oscurità ad aumentare lampi di luce.. L'a-onda appare in intensità luminose. (A) Confronto tra 1,4-0,4 log scot cd.sm -2, il picco b-wave ha saturato ma l'a onda continua a crescere. In (B), i gemelli flash sono sovrapposti. I due log 2.0 scot cd.sm -2 flash sono separati da 500 msec ISI. Il primo flash genera un mistorisposta (nero), e il secondo flash genera una risposta solo cono (linea tratteggiata). Sottraendo la risposta cono produce la risposta verga isolato (grigio). Cliccate qui per vedere una versione più grande di questa figura.
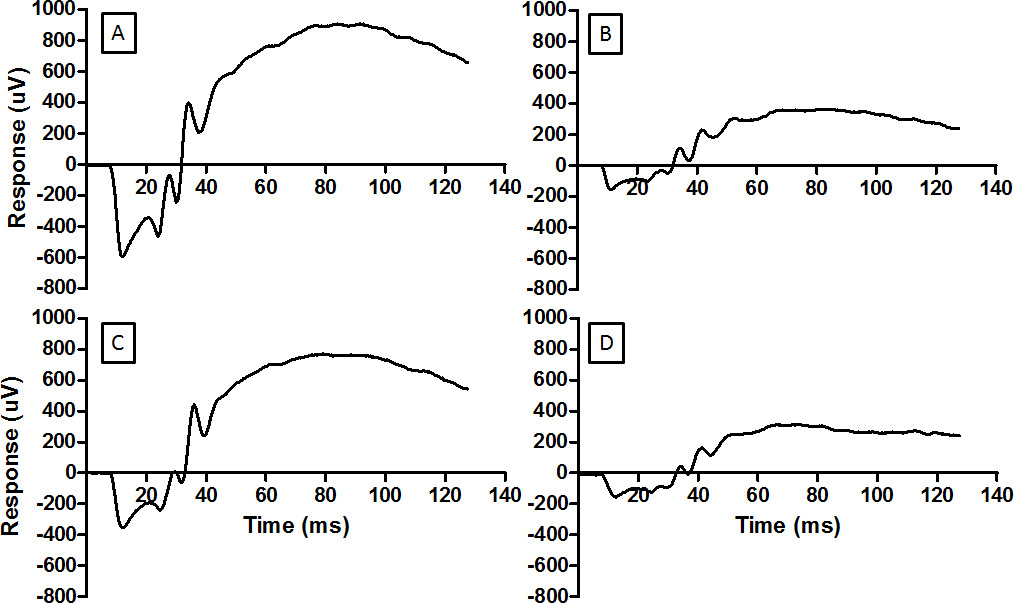
Figura 3: Il ERG fornisce una misura della funzione della retina forme d'onda rappresentativi sono riportati qui per (A) della retina normale, (B) retina danneggiata dalla luce, (C) retina condizionato da RIP prima di essere esposto alla luce dannosa, e. (D) retina inefficace condizionato da RIP e quindi esposto a luce dannosa. La stessa energia del flash è stato utilizzato per ogni record (log 2.0 cd.sm -2). Per la cronaca in D il bracciale della pressionesul arto posteriore è stato correttamente posizionato e ischemia non è stato stabilito. Danni luce riduce l'ampiezza del ERG (B) e RIP mitiga la riduzione. Clicca qui per vedere una versione più grande di questa figura.

Figura 4:. Primo piano elettrodi ERG Gli elettrodi di costruire sono indicati, da sinistra a destra; l'elettrodo positivo per contattare la cornea, l'elettrodo negativo ad essere messi in bocca e l'elettrodo di riferimento che si compone di un coccodrillo collegato ad un ago che viene quindi inserito nel sottocute groppa. Cliccate qui per una versione ingrandita di questa figura.
Discussione
Il flash metodo di ERG adattata al buio sopra descritto è un metodo affidabile per valutare la funzione della retina nei ratti. Sia l'una-wave e b-wave sono stati ridotti del danno chiaro. Remote precondizionamento ischemico mitigata riduzioni danni indotti luce del un-wave e b-wave. Questa conservazione della funzione retinica suggerisce che a distanza precondizionamento ischemico ha indotto neuroprotezione, simile ad altre forme di precondizionamento protettivi quali ipossia, ischemia e l'esercizio 8-10. Il segnale ERG registrata è determinata da tre serie di fattori - l'impostazione di registrazione, i parametri dello stimolo della luce, e lo stato dell'animale.
Messa a punto di registrazione
L'ERG è ridotto in ampiezza quando gli elettrodi sono posizionati in modo non corretto o la preparazione non è completamente a terra 11. La corretta messa a terra di impianti elettrici nelle vicinanze è importante, per ridurre il rumore nella registrazione; se il rumore significativa persista un faraday gabbia dovrebbe essere usato. L'elettrodo positivo deve essere posizionata correttamente al centro della cornea con la conferma della posizione controllata prima di iniziare il protocollo completo campo ERG e al completamento. È importante che questo elettrodo contatti solo la cornea; il contatto con la palpebra o anche baffi in grado di ridurre l'ampiezza del segnale. Un filo di cotone sciolto è stato utilizzato in questo protocollo per prevenire le palpebre di toccare l'elettrodo positivo. Alcuni ricercatori hanno messo a punto le lenti a contatto con l'elettrodo positivo incorporato per assicurare un contatto affidabile e la prevenzione della palpebra toccare 12.
Lo stimolo luce istituito
Lo stimolatore abbiamo usato a luce bianca ad ampio spettro, da sorgenti LED. Altre fonti di luce sono adatti come stimoli luminosi, come l'illuminazione stroboscopica xeno e lampade alogene, vedere Weymouth e Vingrys per i confronti tra stimoli luce 11. Il vantaggio di luce LED, tuttavia, is che la durata di ciascun lampo e la sua energia sono facilmente programmabili e rapidamente azzerare in un ampio intervallo di intensità di luce. Abbiamo sviluppato una serie di lampi di energia graduale, che nella gamma roditore dark-adattato da soglia (che producono una risposta appena rilevabile) per saturare (produrre una risposta massima).
Per tentativi ed errori, abbiamo stabilito interstimulus intervalli (ISIS) che garantiscono che l'ampiezza di risposta ad una flash è indipendente da un lampo precedente della stessa intensità. Il più brillante il flash, il più a lungo l'ISI richiesto per questa indipendenza.
Anche per tentativi ed errori abbiamo stabilito un numero minimo di risposte richieste ad ogni energia per fornire un segnale pulito. Una media di risposte saranno sempre fornire un segnale più pulito. Usiamo i minimi in modo che la serie di energia può essere completato rapidamente (nel nostro protocollo 11 min); rapido completamento riduce la variazione a causa di cambiamenti di stato anestetico e allows tempo per altre variabili da studiare, se necessario.
Stato dell'animale
Diversi parametri della fisiologia dell'animale sono importanti per ottimizzare e standardizzare le registrazioni ERG ottenuti.
Temperatura
Il segnale a onda è generata da attivazione indotta dalla luce di un accoppiato alla proteina G phototransduction cascata nel segmento esterno; la dinamica di questa cascata sono, come tutte le reazioni enzimatiche, dipendente dalla temperatura 13,14. Roditori sotto anestesia sono inclini a ipotermia e richiedono riscaldamento esterno per mantenere una temperatura interna di 37,5 ° C per tutta la registrazione. Se la temperatura corporea scende più di 1-2 ° C, le ampiezze a-onde e b-wave diminuiscono e loro latenze aumentano 15.
Anestesia
Stabili le registrazioni ERG richiedono l'animale ad essere immobile. Bloccanti neuromuscolari e anaesthetagenti ic sono utilizzati in ERG sperimentazione per raggiungere uno stato di incoscienza e immobile. Ci sono stati solo cinque casi di sveglio registrazioni ERG in ratti 16-20. In questi studi, gli elettrodi sono stati chirurgicamente pre-impiantati nel cranio e due di questi studi hanno testato l'effetto dell'anestesia sul ERG 17,20.
L'anestetico più comune utilizzato per le registrazioni ERG è una combinazione di ketamina e xilazina (nei nostri esperimenti 60 mg / kg di ketamina e 5 mg / kg di xilazina è utilizzato). Ciò influisce sul ERG meno anestesia gassosi come isoflurano e alotano, e si è dimostrato relativamente non tossico, con alti tassi di recupero 17,21,22. Questo approccio mantiene l'immobile animale per ~ 40 min; metà dose può essere utilizzato per estendere condizioni di registrazione per un periodo simile. Lo studio di Chang direttamente confrontato la ERG con e senza anestesia e ha dimostrato che la ketamina-xylazina non misurabile perturba l'ampiezza e latenze di a- e b-Onde 17. La maggior parte dei ricercatori standardizzare le condizioni di anestetici e quindi testare parametri sperimentali; qualche effetto di anestetici non può essere del tutto scontato.
Ambiente oculare
La fisiologia dell'occhio richiede manutenzione, per ottimizzare e standardizzare la registrazione ERG. Gli alunni dovrebbero essere un formato standard; ciò si ottiene con un midriatico, applicato come collirio, per ottenere la massima dilatazione. Nei roditori, atropina o fenilefrina viene utilizzato 23. L'idratazione della cornea viene mantenuta mediante l'applicazione di un polimero carbomer prima registrazioni; Questo stabilizza anche conduttanza elettrica tra l'elettrodo positivo e cornea. Se la cornea diventa disidratato, corneale cicatrici e la cataratta formazione può avvenire 24. Formazione di cataratta è più comune nei topi 25, e vari metodi di mantenere l'idratazione corneale sono state impiegate in topo ERG registrazioni, tra cui un flusso costante di liquido acquoso ocontatto elettrodi stile su misura che idratazione trappola sulla superficie corneale 12.
Stato Adaptive di retina
Questa è una variabile importante. Il protocollo fornito sopra è progettato per garantire che la retina è adattato al buio, al suo stato più sensibile. Idealmente, i ratti pigmentati richiesto 3 ore di alloggi scuro per essere completamente adattata al buio, mentre gli animali non pigmentate, come i ratti Sprague Dawley, richiedono un minimo di 5 ore 26. E 'una pratica standard per scotopiche registrazioni ERG per adattare gli animali durante la notte per 12 ore. Adattamento totale o parziale alla luce può essere raggiunto facilmente e rapidamente accendendo una luce di sfondo intensità standard nel stimolatore Ganzfeld. Dopo adattamento alla luce, però, pieno adattamento al buio vogliono ore per raggiungere; da qui il suggerimento di estrema cautela al fine di garantire che gli occhi non siano esposti accidentalmente alla luce prima della registrazione.
La tecnica di registrazione ERG è limitata dallasopra fattori determinanti (per esempio, ERG e stimolo set-up) e la competenza del ricercatore a test ERG. Ricercatori inesperti possono avere registrazioni variabili ERG. Varianza può essere ridotto attraverso la creazione di dimensioni del campione abbastanza grande per confrontare i risultati, come riduzioni o aumenti di funzione visiva. In alternativa, le registrazioni ERG possono essere normalizzati tra le registrazioni di base e registrazioni post-trattamento. I dati normalizzati possono essere raggruppati e analizzati. Nel presentare i dati ERG, è prassi normale per visualizzare i dati di gruppo e forme d'onda rappresentative.
Quando tutto quanto sopra sono attentamente controllati, l'ampiezza della ERG è una misura dello stato funzionale della retina. L'ERG è costantemente ridotto in ampiezza dalla riduzione dello strato di fotorecettori causata da danno chiaro o degenerazione geneticamente indotta 27,28. Al contrario, l'effetto protettivo di un intervento quale RIP può essere rilevato in AMPLitude dell'ERG 29. L'ERG è stato utilizzato anche a dimostrare gli effetti protettivi del precondizionamento ischemico, precondizionamento ipossico, l'esercizio fisico, e lo zafferano dietetico sulla retina 8-10,30.
Crescente conoscenza delle dinamiche della cascata fototrasduzione della rodopsina, e delle connessioni sinaptiche della retina, ha favorito lo sviluppo di modelli di generazione ERG e sofisticata analisi della forma d'onda ERG è possibile anche se la modellazione cinetica sulla base di noti eventi fisiologici di fototrasduzione a fotorecettori , e la nostra comprensione di interiore circuiteria retinica 31. Ad esempio, i modelli cinetici a-onda si basano sui gradini biochimici che si verificano durante fototrasduzione e adattamento del modello consente confronti di parametri del modello come il picco di risposta, ritardi di temporizzazione e sensibilità 14.
Lo svantaggio di modellazione è che si basa su ipotesi relative circuitr retinay, e può essere così informativo ipotesi permettono solo. Alla luce di questo inconveniente, il modello cinetico un onda è stato recentemente criticato per banalizzando un onda dinamica 32. Negli studi degenerazione dei fotorecettori, analisi della forma d'onda ERG non è in genere eseguita per un motivo diverso. Fotorecettore degenerazione è spesso grave, con conseguenti perdite drammatiche funzione visiva e, di conseguenza, ulteriori analisi di un onda e parametri di b-wave non è giustificata 8,9,27,30. Indipendentemente da ciò, ERG modellizzazione del un-wave e b-wave è stato adottato come prassi standard in molti studi su roditori e informazioni dettagliate su ERG modellazione, per un onda, b-wave e PO possono essere trovati negli studi da Hood, e revisione articoli di Weymouth e Vingrys, Frishman, e Wachtmeister 11,32-34.
In sintesi, il metodo ERG adattato al buio presentato può registrare differenze misurabili tra degenerazione retinica con e senza interventi neuroprotettivi sale come remote precondizionamento ischemico. Sono stati descritti gli elementi essenziali per registrazioni affidabili ERG. Le misure ERG di fotorecettori e la funzione della retina interna sono utili per i ricercatori che studiano degenerazioni della retina, e gli effetti dei vari interventi genetici, biofarmaceutiche e farmacologici sulla funzione visiva.
Divulgazioni
Jonathan Stone è il direttore del CSCM Pty Ltd
Riconoscimenti
Gli autori sono grati per l'assistenza della signora Sharon Spana nel monitoraggio dei roditori, il trattamento e la sperimentazione. Sostegno finanziario PhD è stato fornito da Università di Sydney e centro di ricerca australiano per l'eccellenza in Vision.
Materiali
| Name | Company | Catalog Number | Comments |
| PC computer | |||
| Powerlab, 4 channel acquistion hardware | AD Instruments | PL 35044 | Acquistion of ERG |
| Animal Bio Amp | AD Instruments | FE 136 | Amplifier for ERG |
| Lab chart | AD Instruments | Signal collection software | |
| Ganzfield | Photometric solutions | FS-250A | Light stimulus |
| Ganzfield operating system | Photometric solutions | ||
| Research Radiometer | International light technologies | ILT-1700 | calibrate light series |
| Lux meter | LX-1010B | check red light illumanation | |
| Excel | Microsoft | ||
| Lead wires | AD Instruments | Connect postive, negative ground electrodes to amplifier | |
| Lead wires - alligator | AD Instruments | ground ganzfield and acquistion hardware to computer | |
| Platinum wire 95% | A&E metals | postive electrode | |
| Mouth electrode Ag/AgCl Pellet | SDR | E205 | negative electode |
| 26 G needle | BD | ground electode | |
| Water pump | |||
| Water bath | |||
| Tubing | |||
| Homeothermic blanket system with flexible probe | Harvard Appartus | 507222F | |
| Atropine 1% w/v | Bausch & Lomb | topical mydriasis | |
| Proxmethycaine 0.5% w/v | Bausch & Lomb | topical anaesthetic | |
| Visco tears eye drops | Novartis | carbomer polymer | |
| Thread | retract eye lid | ||
| Tweezers | |||
| Reusable adhesive | Blu tac | Dim red headlamp. Affix electrodes | |
| Absorbent bedding | |||
| Ketamil - ketamine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | dissociative | |
| Xylium - Xylazine 100 mg/ml - 50 ml | Troy Laboratories Pty Ltd | muscle relaxant | |
| Scale |
Riferimenti
- Arden, G. B., Heckenlively, J. . Principles and practice of clinical electrophysiology of vision. , 139-183 (2006).
- Bui, B. V., Fortune, B. Ganglion cell contributions to the rat full-field electroretinogram. Journal of Physiology-London. 555 (1), 153-173 (2004).
- Fortune, B., et al. Selective ganglion cell functional loss in rats with experimental glaucoma. Investigative Ophthalmology & Visual Science. 45 (6), 1854-1862 (2004).
- Alarcon-Martinez, L., et al. Short and long term axotomy-induced ERG changes in albino and pigmented rats. Molecular Vision. 15 (254-255), 2373-2383 (2009).
- Lyubarsky, A. L., et al. Functionally rodless mice: transgenic models for the investigation of cone function in retinal disease and therapy. Vision Research. 42 (4), 401-415 (2002).
- Bush, R. A., Sieving, P. A. . A PROXIMAL RETINAL COMPONENT IN THE PRIMATE PHOTOPIC ERG A-WAVE. Investigative Ophthalmology & Visual Science. 35 (2), 635-645 (1994).
- Liu, K., et al. Development of the electroretinographic oscillatory potentials in normal and ROP rats. Investigative Ophthalmology & Visual Science. 47 (12), 5447-5452 (2006).
- Casson, R. J., Wood, J. P. M., Melena, J., Chidlow, G., Osborne, N. N. The effect of ischemic preconditioning on light-induced photoreceptor injury. Investigative Ophthalmology & Visual Science. 44 (3), 1348-1354 (2003).
- Lawson, E. C., et al. Aerobic Exercise Protects Retinal Function and Structure from Light-Induced Retinal Degeneration. Journal of Neuroscience. 34 (7), 2406-2412 (2014).
- Grimm, C., et al. HIF-1-induced erythropoietin in the hypoxic retina protects against light-induced retinal degeneration. Nature Medicine. 8 (7), 718-724 (2002).
- Weymouth, A. E., Vingrys, A. J. Rodent electroretinography: Methods for extraction and interpretation of rod and cone responses. Progress in Retinal and Eye Research. 27 (1), 1-44 (2008).
- Bayer, A. U., Cook, P., Brodie, S. E., Maag, K. P., Mittag, T. Evaluation of different recording parameters to establish a standard for flash electroretinography in rodents. Vision Research. 41 (17), 2173-2185 (2001).
- Pugh, E. N., Lamb, T. D. AMPLIFICATION AND KINETICS OF THE ACTIVATION STEPS IN PHOTOTRANSDUCTION. Biochimica Et Biophysica Acta. 1141 (2-3), 111-149 (1993).
- Breton, M. E., Schueller, A. W., Lamb, T. D., Pugh, E. N. ANALYSIS OF ERG A-WAVE AMPLIFICATION AND KINETICS IN TERMS OF THE G-PROTEIN CASCADE OF PHOTOTRANSDUCTION. Investigative Ophthalmology & Visual Science. 35 (1), 295-309 (1994).
- Mizota, A., Adachi-Usami, E. Effect of body temperature on electroretinogram of mice. Investigative Ophthalmology & Visual Science. 43 (12), 3754-3757 (2002).
- Szabo-Salfay, O., et al. The electroretinogram and visual evoked potential of freely moving rats. Brain Research Bulletin. 56 (1), 7-14 (2001).
- Charng, J., et al. Conscious Wireless Electroretinogram and Visual Evoked Potentials in Rats. Plos One. 8 (9), (2013).
- Galambos, R., Juhasz, G., Kekesi, A. K., Nyitrai, G., Szilagyi, N. NATURAL SLEEP MODIFIES THE RAT ELECTRORETINOGRAM. Proceedings of the National Academy of Sciences of the United States of America. 91 (11), 5153-5157 (1994).
- Galambos, R., Szabo-Salfay, O., Szatmar, E., Szilagyi, N., Juhasz, G. Sleep modifies retinal ganglion cell responses in the normal rat. Proceedings of the National Academy of Sciences of the United States of America. 98 (4), 2083-2088 (2001).
- Guarino, I., Loizzo, S., Lopez, L., Fadda, A., Loizzo, A. A chronic implant to record electroretinogram, visual evoked potentials and oscillatory potentials in awake, freely moving rats for pharmacological studies. Neural Plasticity. 11 (3-4), 241-250 (2004).
- Huang, J. C., Salt, T. E., Voaden, M. J., Marshall, J. NON-COMPETITIVE NMDA-RECEPTOR ANTAGONISTS AND ANOXIC DEGENERATION OF THE ERG B-WAVE IN-VITRO. Eye (London). 5 (4), 476-480 (1991).
- Sasovetz, D. . KETAMINE HYDROCHLORIDE - EFFECTIVE GENERAL ANESTHETIC FOR USE IN ELECTRORETINOGRAPHY. Annals of Ophthalmology. 10 (11), 1510-1514 (1978).
- Mojumder, D. K., Wensel, T. G. Topical Mydriatics Affect Light-Evoked Retinal Responses in Anesthetized Mice). Investigative Ophthalmology & Visual Science. 51 (1), 567-576 (2010).
- Fraunfel, F. t., Burns, R. P. ACUTE REVERSIBLE LENS OPACITY - CAUSED BY DRUGS, COLD, ANOXIA, ASPHYXIA, STRESS, DEATH AND DEHYDRATION. Experimental Eye Research. 10 (1), 19 (1970).
- Calderone, L., Grimes, P., Shalev, M. ACUTE REVERSIBLE CATARACT INDUCED BY XYLAZINE AND BY KETAMINE-XYLAZINE ANESTHESIA IN RATS AND MICE. Experimental Eye Research. 42 (4), 331-337 (1986).
- Behn, D., et al. Dark adaptation is faster in pigmented than albino rats. Documenta Ophthalmologica. 106 (2), 153-159 (2003).
- Sugawara, T., Sieving, P. A., Bush, R. A. Quantitative relationship of the scotopic and photopic ERG to photoreceptor cell loss in light damaged rats. Experimental Eye Research. 70 (5), 693-705 (2000).
- Machida, S., et al. P23H rhodopsin transgenic rat: Correlation of retinal function with histopathology. Investigative Ophthalmology & Visual Science. 41 (10), 3200-3209 (2000).
- Brandli, A., Stone, J. Remote Ischemia Influences the Responsiveness of the Retina. Observations in the Rat. Investigative Ophthalmology & Visual Science. 55 (4), 2088-2096 (2014).
- Maccarone, R., Di Marco, S., Bisti, S. Saffron supplement maintains morphology and function after exposure to damaging light in mammalian retina. Investigative Ophthalmology & Visual Science. 49 (3), 1254-1261 (2008).
- Hood, D. C., Birch, D. G. Assessing abnormal rod photoreceptor activity with the a-wave of the electroretinogram: Applications and methods. Documenta Ophthalmologica. 92 (4), 253-267 (1996).
- Robson, J. G., Frishman, L. J. The rod-driven a-wave of the dark-adapted mammalian electroretinogram. Progress in Retinal and Eye Research. 39, 1-22 (2014).
- Hood, D. C., Birch, D. G. A COMPUTATIONAL MODEL OF THE AMPLITUDE AND IMPLICIT TIME OF THE B-WAVE OF THE HUMAN ERG. Visual Neuroscience. 8 (2), 107-126 (1992).
- Wachtmeister, L. Oscillatory potentials in the retina: what do they reveal. Progress in Retinal and Eye Research. 17 (4), 485-521 (1998).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon