Method Article
Ordenando células individuais e único embriões em 3D Confinamento: Um novo dispositivo de alta Screening conteúdo
Neste Artigo
Resumo
Nós relatamos um dispositivo e um novo método para estudar células e embriões. células individuais são precisamente ordenados em matrizes microcavidade. Seu confinamento 3D é um passo para ambientes 3D encontrados em condições fisiológicas e permite a orientação organela. Ao controlar a forma da célula, esta configuração minimiza variabilidade relatados em ensaios convencionais.
Resumo
As células biológicas são geralmente observados em superfícies planas (2D). Esta condição não é fisiológica, e fenótipos e formas são altamente variáveis. A triagem com base em células em tais ambientes têm limitações, portanto, graves: organelas celulares mostram fenótipos extremos, morfologias celulares e tamanhos são organelos celulares heterogêneos e / ou específicos não pode ser correctamente visualizado. Além disso, as células in vivo situam-se num ambiente 3D; Nesta situação, as células mostram diferentes fenótipos principalmente por causa da sua interacção com a matriz extracelular em torno do tecido. A fim de padronizar e gerar fim de células individuais em um ambiente 3D fisiologicamente relevantes para ensaios baseados em células, relatamos aqui a microfabricação e aplicações de um dispositivo para o cultivo in vitro de células 3D. Este dispositivo é composto por uma matriz 2D de microcavidades (tipicamente 10 cavidades 5 / cm2), cada um cheio com células individuais ou embriões. posi celularção, a forma, a polaridade e organização celular interna tornar-se então normalizados mostrando uma arquitetura 3D. Usamos moldagem réplica de padrão de uma matriz de microporos, (PDMS) camada 'eggcups', em um polidimetilsiloxano fina aderiu em uma lamela. Cavidades foram cobertas com fibronectina para facilitar a aderência. As células foram inseridos por centrifugação. A porcentagem de preenchimento foi otimizado para cada sistema que permite até 80%. As células e os embriões viabilidade foi confirmada. Esta metodologia foi utilizada para a visualização dos organelos celulares, tais como aparelhos de Golgi e núcleo, e para estudar processos activos, tais como o encerramento do anel cytokinetic durante a mitose celular. Este dispositivo permitiu a identificação de novas funcionalidades, tais como acumulações periódicas e heterogeneidades de miosina e actina durante o encerramento do anel cytokinetic e fenótipos compactadas para Golgi e alinhamento núcleo. Caracterizamos o método de células de mamíferos, levedura de fissão, brotação de levedura, C. elegans wom adaptação específica em cada caso. Finalmente, as características deste dispositivo torná-lo particularmente interessante para ensaios de rastreio de drogas e medicina personalizada.
Introdução
Actual em ensaios baseados em células in vitro são bidimensional (2D). Esta configuração não é natural para células de mamíferos e, por conseguinte, não é fisiologicamente relevante 1; células mostram uma diversidade de formas, tamanhos e fenótipos heterogêneos. Eles apresentam sérias limitações adicionais quando aplicado para aplicações de rastreio, tais como uma distribuição desordenada dentro do plano e fenótipos extremos de organelos celulares (fibras de stress, em particular). Isto é particularmente importante em ensaios clínicos para o teste de drogas, onde os altos orçamentos são gastos a cada ano. A maioria destas drogas que falham quando aplicados a modelos animais por causa da condição de cultura 2D artificial nas fases iniciais de rastreio de drogas. Além disso, ao utilizar esta abordagem, organelos celulares específicos podem não ser correctamente visualizado, tal como o anel de actomiosina cytokinetic durante a mitose celular, e, geralmente, estruturas que estão a evoluir no plano perpendicular ao plano de observação. Algunsnovos ensaios 2D têm sido propostos a fim de ultrapassar os inconvenientes acima mencionados e conhecimentos importantes sobre a organização do citoesqueleto foram observados 2,3. No entanto, estes ensaios ainda apresentam uma séria limitação: células apresentam um fenótipo muito propagação em contraste com o que se observa in vivo, em que as células apresentam uma arquitectura 3D. Estes artefactos associados com o método de cultura pode desencadear características não-fisiológicos, tais como fibras de stress 1,4,5 melhoradas.
Tridimensionais ensaios de cultura celular fornecer várias vantagens quando comparados com os ambientes 2D 6,7. Eles são fisiologicamente mais relevante, e os resultados são, portanto, significativa. Como um exemplo, as células embebidas em hidrogéis mostram estruturas 3D-like, mas as suas morfologias diferem de uma célula para outra 8,9. No entanto, as suas morfologias diferem de uma célula para outra, o que complica as aplicações de rastreio. Uma estratégia alternativa é incorporar únicacélulas em cavidades microfabricados 10,11. posição da célula, forma, polaridade e organização célula interna pode, então, tornar-se normalizada. Além de fornecer a arquitetura 3D-like para as células, microcavidades também permite estudos de triagem de alto conteúdo 10,12-14; As células individuais podem ser ordenadas em microarrays e organelos celulares e suas evoluções pode ser observada em paralelo. Essa regularidade fornece boas estatísticas com baixo número de células e melhores resoluções temporais / espaciais. Os compostos úteis são mais fáceis de identificar com segurança.
Neste estudo, nós mostramos a fabricação e aplicação de um novo sistema de células única cultura 3D-like de alto conteúdo de triagem aplicações 10,12,13. O dispositivo consiste de uma matriz de microcavidades elastoméricos (10 5 cavidades / cm 2), cunhada 'eggcups »(CE). Dimensões e volume total de CE neste trabalho são otimizados para o volume típico de células NIH3T3 e HeLa individuaisdurante a divisão celular. Morfologia das cavidades cilíndricas - - é seleccionado a forma da célula orientar correctamente para a visualização de processos activos. Moldagem réplica é usado para padrão de um conjunto de CE para um (PDMS) camada fina polidimetilsiloxano aderiu em um vidro lamela 15,16. As células são introduzidas na CE por centrifugação. Relatamos aqui a observação e normalização das organelas celulares (fibras de stress de actina, aparelho de Golgi e núcleo) em 3D (CE), em comparação com as mesmas células em 2D (plana) superfícies. Nós também relatam a observação de processos dinâmicos ativos, tais como o fechamento do anel actomiosina cytokinetic durante a mitose de células 17. Por fim, mostramos resultados desta metodologia em outros sistemas com paredes rígidas, como a levedura de brotamento, levedura e C. embriões elegans, o que confirma a aplicabilidade da nossa metodologia para uma ampla gama de sistemas modelo.
A seguir, apresentamos um p detalhada e exaustivarotocolo, a fim de fabricar e aplicar as 'eggcups' para microfabricação 3D. Nossa abordagem é simples e não precisa de um quarto limpo. Nós antecipamos que essa nova metodologia será particularmente interessante para testes de rastreio de drogas e medicina personalizada, em substituição de placas de Petri. Finalmente, o nosso dispositivo irá ser útil para estudar a distribuição de respostas de células a estímulos externos, por exemplo no cancro ou 18 em pesquisa básica 19.
Protocolo
1. Microfabricação de 'Eggcups'
- Fabricação do Mestre: microcavidades matriz
- Aqueça uma bolacha de 3 '' de silício de até 200 ° C para evaporar qualquer presença de umidade.
- Spin-coat uma fina camada de SU-8 fotorresiste. Ajustar o volume da resina e velocidade de centrifugação em função do tipo e espessura do material fotosensitivo desejado. Esta espessura vai ditar a profundidade das 'Eggcups »(CE). Para uma camada de espessura de 30 um e SU-8 2025, spin-coat a 2,800 rpm.
- Pré-coze a bolacha a 65 ° C durante 1 min (passo 1 de 2) para uma espessura SU-8 2,025 camada de 30 um. Adaptar o tempo, dependendo do tipo de foto-resistente e de espessura desejada. Verifique o fabricante folha de dados para obter detalhes.
- Pré-coze a bolacha a 95 ° C durante 3 min (passo 2 de 2) para uma espessura SU-8 2,025 camada de 30 um. Adaptar o tempo, dependendo do tipo de foto-resistente e de espessura desejada. Verifique o fabricante folha de dados para obter detalhes.
- carregar owafer no alinhador máscara de exposição aos raios UV. Coloque a máscara de fotolitografia nele. A máscara mostra um padrão de características circulares (discos), de 20 um de diâmetro. Garantir um perfeito contato entre si.
NOTA: Diferentes fabricantes oferecem máscaras de fotolitografia. A resolução espacial irá determinar o custo final. máscaras de acetato de fornecer resolução aceitável (≈10 mm) a baixo custo. máscaras de cromo proporcionar uma melhor resolução, mas são mais caros. Adaptar os diâmetros dos discos (a partir da máscara de fotolitografia) para o volume de células. Dimensões dos discos sobre a máscara irá determinar o diâmetro da cavidade do dispositivo. diâmetros pequenos levarão a um enchimento de baixa; demasiado grande diâmetro não vai limitar as células. Para as células HeLa e NIH3T3, diâmetros de 20 um a 25 um são sugeridos. - Verifique a fonte de exposição antes da lâmpada de UV e optimizar o tempo de exposição de acordo. Irradiar (comprimento de onda = 365 nm) 41,5 seg (ou o tempo de exposição optimizado) a250 mJ / cm 2.
NOTA: SU-8 2025 é um fotorresiste negativo, o que significa que as regiões expostas a UV será curado. Neste caso, as características circulares eram negros e transparente descanso. trabalho fotorresiste positivo no sentido oposto: regiões não expostas são curados. Selecione o fotorresiste em conformidade, dependendo do design e foto-máscara.
NOTA: proteger os olhos da luz UV com óculos de segurança apropriados. - Remover suavemente a máscara da camada foto-resistente.
- Pós-coza a bolacha a 65 ° C durante 1 min (passo 1 de 2) para uma espessura SU-8 2,025 camada de 30 um. Pós-coza a bolacha a 95 ° C durante 3 min (passo 2 de 2) para uma espessura SU-8 2,025 camada de 30 um. Adaptar o tempo, dependendo do tipo de foto-resistente e de espessura desejada. Verifique o fabricante folha de dados para obter detalhes. Depois de pós-cozimento, arrefecer a bolacha à temperatura ambiente no banco por cerca de 1 min.
- Coloque a bolacha no spin-coater e soltar alguns mm de SU-8 desenvolvedor para cobrirtoda a área da bolacha. Desenvolver durante 2 min e, em seguida, spin-revestimento a 1.000 rpm durante 30 segundos. Repita o procedimento três vezes.
- Lavar com 2-propanol para se assegurar a remoção completa de subdesenvolvidos SU-8. Aparecimento de regiões branco é uma indicação de desenvolvimento incompleto. Se assim for, repetir o passo de desenvolvimento de um tempo adicional.
- Duro-coza a bolacha a 200 ° C para assegurar a robustez das microestruturas fabricadas. Este passo é opcional.
- Armazenar o disco de contacto 3 '' com microestruturas dentro de um 94 milímetros x 15 mm numa caixa de Petri de poliestireno.
NOTA: Não há necessidade de tratamento de superfície, em especial, silanização, para as próximas etapas.
- Fabricação do polidimetilsiloxano (PDMS) Réplica: Colunas matriz
- Misturar completamente numa proporção 1:10 (w / w) do agente de reticulação e o pré-polímero de um total de 30 g no interior de um tubo de 50 ml.
NOTA: Usando uma proporção de 1:10 (v / v) também está a trabalhar. - Centrifuga-se o tubo a 1.800 xg durante 5 min pararemover bolhas de ar.
- Gota suavemente o PDMS no topo das microestruturas.
NOTA: Se aparecerem bolhas de ar durante esta etapa, desgaseificar a amostra utilizando uma bomba de vácuo para 15-20 min. - Colocar a amostra num forno a 65 ° C durante 4 h.
NOTA: O tempo de cura varia entre os utilizadores e, em conjunto com o agente de reticulação: proporção de pré-polímero. Desta vez vai ditar a rigidez do PDMS. Recomenda-se a curar mais de 2 horas e se ater a um tempo de cura fixo. - Usar um bisturi para cortar suavemente a área de interesse (stamp) de cerca de 1 cm 2, que inclui cerca de 10 ou 5 'microcavidades Eggcups'.
NOTA: Corte pela primeira vez as PDMS e, em seguida, retire-a suavemente. Para verificar a qualidade da réplica de PDMS com um microscópio óptico.
- Misturar completamente numa proporção 1:10 (w / w) do agente de reticulação e o pré-polímero de um total de 30 g no interior de um tubo de 50 ml.
- Fabricação de 'eggcups' por moldagem réplica. No que se segue, duas estratégias alternativas para a fabricação de '' Eggcups são descritos. Ambos os protocolos são similar e fornecer resultados idênticos:
- estratégia 1
- Ative o selo PDMS fabricada por tratamento com plasma de oxigênio durante 30 segundos. Armazenar temporariamente os selos activados numa placa de Petri fechada para evitar a deposição de pó.
NOTA: Ajuste o tempo de exposição, se forem utilizados outros gases para o plasma. - Coloque o PDMS activados selo de cabeça para cima (o lado com as estruturas) numa placa de Petri ao lado de uma tampa do tubo de 15 ml. Encha a tampa com 200 mL de trimetilclorosilano (TMCS). Feche a placa de Petri e deixar o silanizar selo para 7 min.
NOTA: Alguns deformação temporária no selo e / ou mudança de cor (branco) pode ser observada. O selo irá recuperar a sua forma original em curto período de tempo e as estruturas não irá ser afectada.
NOTA: TMCS produz inalação e dérmica toxicidade aguda, e é altamente inflamável (com recapitular ignição capaz de ocorrer através de distâncias consideráveis). Por conseguinte, ele deve ser usado numa câmara de exaustão para longe da fontes de ignição. - Coloque o selo PDMS sobre o spin-coater com as estruturas de cabeça para cima. Colocar uma pequena gota de alguns microlitros (cerca de 20 uL) de PDMS líquidos (1:10 w / w reticulante: pré-polímero) na parte superior das estruturas. Spin-revestimento a 1.500 rpm durante 30 segundos para depositar uma camada fina de PDMS na parte superior das estruturas.
NOTA: Se o selo não se encaixa no spin-coater chuck lugar do selo no topo de uma tampa placa de Petri com um pequeno furo no seu centro. - Colocar o selo no forno a 65 ° C durante 4 horas para curar a camada de PDMS revestido por centrifugação depositado.
- Ative a camada de PDMS fina, colocando o selo PDMS de cabeça para cima, juntamente com uma lamela de vidro # 0 de 25 mm de diâmetro, usando oxigênio líquido de limpeza de plasma durante 30 segundos. Avançar rapidamente para a próxima etapa.
NOTA: lamelas com outras espessuras, formas, dimensões e podem ser usados também. No entanto, algumas estruturas celulares poderiam ser difíceis de visualizar dependendo da espessura da lamela e seleccionado objectivoampliação e / ou NA e / ou distância de trabalho. Verifique a folha de dados objetivos. - Coloque em contato o selo (o lado com a camada fina revestida de rotação) com a lamela de vidro. Pressione suavemente tudo em torno da superfície do selo com uma pinça para fazer a 'ligação'. Finalmente, manter uma pressão constante no topo do selo para cerca de 10 seg.
- Após 30 min gentilmente 'casca' o selo para fora da lamela, a fim de "libertar" 'eggcups' (veja a Figura 1). Lavar cuidadosamente com etanol e seco. Se PDMS 'eggcups' não são bem aderida à lamela de vidro (ou seja, se destacam durante a etapa 'unpeeling'), considere ajustar as configurações do aspirador de plasma e reiniciar no passo 1.3.1.5.
NOTA: Este passo é delicada. Prestar atenção, a fim de evitar a ruptura da lamela e / ou desprendimento da camada de PDMS fina. - Cole um pedaço pequeno (identificador) de PDMS curado de 1 mm x 1mm x 3 mm de volume na extremidade da lamela com uma pequena gota de PDMS líquidos e curar o PDMS como antes. Isto irá facilitar a manipulação da amostra depois (ver a Figura 1). Este passo é opcional.
- Ative o selo PDMS fabricada por tratamento com plasma de oxigênio durante 30 segundos. Armazenar temporariamente os selos activados numa placa de Petri fechada para evitar a deposição de pó.
- estratégia 2
- Hidrofilizar as PDMS selos fabricados por tratamento com plasma de oxigénio durante 30 seg. Armazenar temporariamente os selos activados numa placa de Petri fechada para evitar a deposição de pó.
NOTA: Ajuste o tempo de exposição, se forem utilizados outros gases para o plasma. - Hidrofilizar a 25 milímetros lamelas de vidro de diâmetro # 0 oxigênio tratamento de plasma de 15 W durante 30 segundos. Avançar rapidamente para a próxima etapa.
NOTA: lamelas com outras espessuras, formas, dimensões e podem ser usados também. No entanto, as estruturas celulares será difícil de visualizar dependendo da espessura lamela seleccionado e as características objectivas (ver nota abaixo). - Spin-revestimento uma pequena gota de PDMS (1:10 w / w reticulante: pré-polYmer) de alguns microlitros para as lamelas de vidro. Girar-revestimento a 1.500 rpm durante 30 segundos para uma espessura final de cerca de 50 um.
- Cole um pequeno pedaço (identificador) de PDMS curados of 1 mm x 1 mm x 3 mm de volume na extremidade da lamela com uma pequena gota de PDMS líquidos e curar o PDMS como antes. Isto irá facilitar a manipulação da amostra depois (ver a Figura 1). Este passo é opcional.
- Armazenar temporariamente as lamelas PDMS-revestidos em um limpa limpe dentro de uma placa de Petri para proteger da deposição de poeira.
- Coloque uma gota de reagente de silanização em cima de cada selo e deixe evaporar em 1-2 min. Em seguida, secá-las sob uma corrente de N 2.
NOTA: Nesta etapa, uma deformação temporária do carimbo pode ser observado durante a evaporação. O selo irá recuperar a sua forma original depois de se secar com N 2, sem qualquer deformação permanente de microestruturas. - Deixe cair muito suavemente o selo silanizada em cima doPDMS-spin-revestido lamela de vidro armazenado na caixa de Petri. Certifique-se de que ambos os lados são completamente paralelo durante o contacto. Evite pressionar ou mover o selo após colocá-lo sobre a lamela PDMS-revestidos.
- Colocar a placa de Petri com amostras no vácuo durante 1-2 h para remover as bolhas de ar.
NOTA: Certifique-se de que as amostras são totalmente horizontal para evitar o deslocamento de selo. Evita também potencialmente vibração causada pela bomba de vácuo. - Coloque as amostras em estufa a 65 ° C durante 4 h.
- Delicadamente, retire o selo para revelar 'eggcups'. Lavar cuidadosamente com etanol e seco.
É necessária prática neste momento: NOTA. Preste atenção em evitar a ruptura da lamela e / ou descolamento da camada de PDMS fina.
- Hidrofilizar as PDMS selos fabricados por tratamento com plasma de oxigénio durante 30 seg. Armazenar temporariamente os selos activados numa placa de Petri fechada para evitar a deposição de pó.
- estratégia 1
2. Introdução de células para o '' Eggcups
A fim de introduzir células de mamíferos dentro "eggcups ', PDMS ne superfícieeds a ser funcionalizado com proteínas de adesão da matriz extracelular. Este exemplo utiliza a fibronectina, mas outras proteínas de interesse, tais como colagénio, pode ser utilizada.
- Hidrofilizar dos eggcups 'no limpador de plasma de oxigênio durante 30 segundos.
NOTA: Otimizar os parâmetros, se necessário. - Prepara-se uma solução em PBS 1x de 20 ug mL-1 de fibronectina a partir de fontes de bovinos.
- Esterilizar dos eggcups 'com UV durante 5 min. Depositar uma pequena gota (cerca de 20-50 mL) de solução de fibronectina para cobrir toda a área 'Eggcups' e incubar durante 1 h à TA. Proteger a amostra de secagem.
- Lavar cuidadosamente as 'eggcups' com PBS 1x. Repita 3 vezes.
NOTA: A amostra está pronta para usar imediatamente ou armazenadas a 4 ° C no escuro durante várias semanas. - Introduzir uma peça de plástico feito por encomenda cilíndrico de 63 mm de altura de 26 mm de raio exterior e 7 mm de dimensões raio interno para um tubo de 50 ml (verFigura 2) 20
CUIDADO: Use itens UV-esterilizado ou esterilizá-los uso anterior.
NOTA: Esta peça pode ser facilmente fabricado no laboratório. ou por qualquer loja de máquina disponível. - Colocar 13 ml de meio de cultura de células no interior do tubo (ver Tabela 1). O meio deve preencher pelo menos 2 cm acima da peça cilíndrica para a sua imersão completa da amostra.
NOTA: Para mais informações sobre tipos específicos de células, e outros sistemas modelo tais como leveduras ou C. elegans embriões, e do meio correspondente utilizado, consulte a secção 5 e Tabela 1. O protocolo descrito foi otimizado para HeLa, células NIH3T3, e outras linhas de células (ver Tabela 1). - Introduzir muito suavemente dos Eggcups 'no interior do tubo e paralela ao lado superior da peça de plástico. Use uma pinça afiada para manter a amostra usando a alça PDMS. Pressione suavemente as lamelas até que ela se encontra em cima do lado superior da peça de plástico, unaté que esteja completamente imerso (ver Figura 2).
NOTA: É recomendado o uso de pinças afiadas e retas. Com pinças curvas, a manipulação da amostra é difícil e pode causar a ruptura. - células de cultura até 80-100% de confluência numa placa de Petri P60 e recolhê-las por tripsinização.
NOTA: As células podem ser de tipo selvagem, transfectadas ou tratadas com qualquer droga de interesse.
NOTA: Evitar a formação de agregados de células, o que evitará células individuais para introduzir os 'eggcups'. Para otimizar esta etapa, pipeta cima e para baixo cuidadosamente após tripsinização. - células em meio de cultura de 5 ml de re-suspender. Pipetar 200 ul de células no topo dos Eggcups ''.
NOTA: Drop células como centrado possível no topo dos eggcups ", mas evitando o contato físico. Isto irá evitar a ruptura e / ou danos da amostra. - Centrifugar a 1.800 g durante 2 min.
NOTA: Após a primeira centrifugação, o check-in de um microfoneroscope a porcentagem de preenchimento dos "eggcups '. - Pipeta novamente 200 uL de células em cima dos Eggcups 'e centrifugar a 1800 xg durante 2 min. Repetir para um total de três vezes, a fim de optimizar a percentagem de enchimento.
NOTA: Após a última centrifugação, verifique com um microscópio a percentagem de enchimento do 'eggcups'. Se necessário, repita os passos de enchimento + centrifugação até atingir a porcentagem de preenchimento desejado. - Retirar a amostra do tubo utilizando as pinças cortantes, segurando a pega de PDMS. Certifique-se de ter cuidado em não as células 'perturbadoras' que são realizadas nos "eggcups '(ver Figura 2).
- Colocar a amostra em uma placa de Petri com meio. Lavar para remover o excesso de células que não estão nas Eggcups '' por pipetagem para cima e para baixo três vezes, com cuidado ao lado de cada lado (no total 4 lados) da matriz microestrutura.
NOTA: Pipetting muito forte pode liberaralgumas células fora dos "eggcups '. - Substituir o meio com meio fresco para remover as células nonattached.
NOTA: Nesta etapa pode ser adicionado um medicamento de interesse. - Fix células ou prepará-los para time-lapse passo imaging.See 4.1.
3. Observação da dinâmica celular activa em "Eggcups ': Cytokinetic anel de fechamento
NOTA: Este exemplo usa células HeLa que são transfectadas com MYH10-GFP e Lifeact-mCherry para miosina e actina, respectivamente, as moléculas activas principais envolvidos no fecho do anel cytokinetic durante a mitose celular. O dispositivo é preparado com microcavidades de 25 um de diâmetro. Por sua observação, foi utilizado um microscópio invertido epifluorescência, equipado com uma objectiva de óleo 60X (1,40 NA, DIC, Plano de Apo) e GFP (miosina) e TxRed (actina) filtros. Alternativamente, foi utilizado um microscópio confocal vertical, equipado com um 25X ou 63X HCX IR APO objectivo L de água (0.95 NA). Para este EXAmple, é altamente recomendável para sincronizar as células usando o bloco timidina dupla, bloco mitótico ou mitótico método shake-off 21-24.
NOTA: A espessura do PDMS utilizado para «Eggcups 'permite o uso de uma variedade de objectivos, tanto em microscópios invertidos e posicionado na posição vertical.
- Lugar "eggcups 'em um suporte de microscópio e preenchê-lo com 1 ml de meio de observação de 10% FCS G-15. Para evitar a evaporação, colocar uma tampa de vidro no topo do suporte ou aplicar uma fina camada de óleo mineral no topo da medium.Select o objectivo óleo de 60X.
NOTA: meio L-15 é adequado para não-CO 2 atmosferas. Note também que alguns compostos de DMEM são auto-fluorescente. Quando se utiliza esta forma, recomenda-se a photobleach os compostos fluorescentes, iluminando-a com uma lâmpada de alta intensidade durante 1-2 horas.
NOTA: Evite a utilização de tampas de plástico quando se trabalha com imagens DIC. - Coloque o suporte com 'eggcups' e obserforma vação ao microscópio. Concentre-se cuidadosamente usando a luz de campo claro até que as Eggcups '', e as células estão no mesmo plano de observação.
- Abra o software e ajustar os parâmetros. Selecione os filtros TxRed e GFP para actina e miosina; ajustar o tempo de exposição para cada canal. Uma taxa de aquisição típico é de 5 segundos para ambos os canais.
NOTA: O tempo de exposição pode ter de ser ajustada dependendo da configuração utilizada, corante ou outros organelos celulares de interesse. - Selecione a região de interesse e buscar um anel cytokinetic usando o GFP ou canal TxRed. Focar com precisão.
NOTA: O anel é mais acentuada na miosina e mais fácil de reconhecer. - Executar a aquisição automática em ambos os canais até que o anel está completamente fechada.
Nota: Alguns fotodegradação podem ser observadas. Ajustar os parâmetros de microscópio, a fim de reduzi-lo.
4. Observação de organelas celulares fixos nas 'Eggcups'
Este passo pode ser realizado antes ou após o passo 3 #. As células podem ser directamente fixo depois do passo de centrifugação e coradas para o organelo de interesse ou após a observação ao microscópio. Este exemplo mostra a coloração das fibras aparelho de Golgi, núcleo e actina em fibroblastos NIH3T3 em Eggcups ''.
- Fixação de células no 'Eggcups'
- Prepare a 3% de paraformaldeído (PFA) e aquecido a 37 ° C. Retirar a amostra 'eggcups' a partir do tubo de 50 ml (ou titular do microscópio) e colocá-lo dentro de um P35 placa de Petri. Lavar uma vez com PBS 1x.
NOTA: Os protocolos para a preparação de paraformaldeído a 3% são amplamente disponíveis em outro lugar.
CUIDADO: Use luvas de borracha nitrílica e óculos de protecção durante a preparação da PFA. - Remover completamente o PBS e soltar 1 ml de 3% PFA e incubar durante 17 min. Remover o PFA e lavar duas vezes com 1 ml de PBS 1X. permeabilizar as células com 1 ml de 0,5% Tritpor 3 min e lavar duas vezes com PBS 1x durante 5 min.
- Prepare a 3% de paraformaldeído (PFA) e aquecido a 37 ° C. Retirar a amostra 'eggcups' a partir do tubo de 50 ml (ou titular do microscópio) e colocá-lo dentro de um P35 placa de Petri. Lavar uma vez com PBS 1x.
- Coloração de células em '' Eggcups
- Incubar as células de coloração de Golgi com o anticorpo primário de coelho policlonal anti-Giantin em uma diluição de 1: 500 em PBS. Colocar uma gota 100 ul de solução de anticorpo para uma folha de película de plástico e incuba-se as células no interior dos Eggcups "de cabeça para baixo durante 45 minutos.
NOTA: Proteger a amostra com uma tampa para evitar a secagem. - Solte cuidadosamente os 'Eggcups' e colocá-los em uma placa de Petri P35. Lavar 3 vezes, 5 min cada, com PBS 1x.
- Prepare um coquetel em PBS com o anti-coelho anticorpo secundário de cabra Cy3 (1: 1.000) e com faloidina Alexa Fluor 488 (1: 200) para a coloração de fibras de actina estresse.
- Incubar as células com uma queda de 100 ul de solução de anticorpo para uma folha de película de plástico e incuba-se as células no interior dos Eggcups "de cabeça para baixo durante 45 minutos.
- Lançamento cuidadosamente o 'eggcups "e colocá-los em uma placa de Petri P35. Lavar 3 vezes, 5 min cada, com PBS 1x.
- Incubar as células de coloração núcleo colocando uma gota 100 uL de 1 ug mL1 DAPI em PBS para uma folha de película de plástico e incuba-se as células no interior dos Eggcups "de cabeça para baixo durante 45 minutos. Este passo pode ser realizado com o passo 4.2.3.
- Solte cuidadosamente os 'eggcups' e colocá-los em uma placa de Petri P35. Lavar 3 vezes, 5 min cada, com PBS 1x.
- células de montagem usando um Glicerol 15 mL: PBS (1: 1 v / v) numa lâmina de microscópio de vidro padrão e selar a amostra com unha polonês para evitar a secagem.
NOTA: Dependendo da espessura 'eggcups', a montagem pode ser difícil. Recomenda-se, em seguida, para armazenar a amostra numa placa de Petri de P35 em PBS, protegido contra a secagem.
- Incubar as células de coloração de Golgi com o anticorpo primário de coelho policlonal anti-Giantin em uma diluição de 1: 500 em PBS. Colocar uma gota 100 ul de solução de anticorpo para uma folha de película de plástico e incuba-se as células no interior dos Eggcups "de cabeça para baixo durante 45 minutos.
- A observação ao microscópio
NOTA: Para este exemplo um microscópio confocal na vertical é usado, equipados com detectores PMT e híbridos. Um ou 25X 63 X HCX IR APO objectivo L de água (0.95 NA) foi seleccionado para fornecer um campo largo da amostra e mostrar a aplicabilidade do aparelho para aplicações de rastreio de alto conteúdo.- Selecione o objetivo 25X ou 63X de água.
NOTA: objetivos diferentes podem ser usadas, dependendo da aplicação e do sinal. Mas o uso de objetivos elevados abertura numérica é recomendada. - Colocar a amostra fixa com os 'eggcups' e se concentrar cuidadosamente usando a luz brightfield (contraste de fase ou DIC) até dos eggcups 'e células estão no plano de observação.
- Abra o software e ajustar os parâmetros. Selecione os filtros GFP, Cy3 e DAPI para actina, de Golgi e de observação núcleo, respectivamente; ajustar o tempo de exposição para todos os canais.
NOTA: O tempo de exposição pode ter de ser ajustada dependendo da configuração. - Selecionar e concentrar a região de interesse; iniciar a captura de imagem (veja a Figura 3).
- Selecione o objetivo 25X ou 63X de água.
- As células de levedura de fissão e de brotamento
NOTA: Este exemplo utiliza células de levedura de fissão que são marcadas com RLC1-mCherry e CHD-GFP para miosina e actina, respectivamente. As células de levedura de germinação não está marcado com fluorescência aqui. Para a observação levedura foi utilizado um giro confocal disco microscópio invertido. Um objectivo óleo 100X HCX PL APO CS (1,4 NA) foi utilizado para todas as aquisições. Alternativamente, as células também foram observadas utilizando um microscópio de contraste de fase invertida equipado com uma objectiva 20X ar contraste de fase LCPlanFl (0,4 NA). Neste exemplo, o protocolo é idêntico para os dois tipos de células.- Preparar a superfície 'Eggcups' como descrito acima. Para fissão e células de levedura de germinação, preparar cavidades de 5 um de diâmetro (ver Tabela 1). Neste caso, a superfície não necessita de ser funcionalizado com proteínas de adesão.
NOTA: O ca de enchimenton ser otimizado usando 'eggcups' cónicos. Esta forma captura e retém as células, evitando libertar durante o passo de enxaguamento após a centrifugação. Encher percentagem é óptima a cerca de 80%. Estes 'eggcups' cónicos podem ser fabricados por meio de Deep Reactive Ion Etching 13. - Cultura de células de levedura no meio de cultura apropriado (ver Tabela 1) até atingir uma densidade óptica (OD) na gama de 0,2 e 0,8. Sonicar a cultura de células de levedura para remover agregados.
- Inserir células de levedura em 'eggcups' por centrifugação. Por centrifugação, 4 ml de células cultivadas em a OD apropriada é adicionada ao tubo com Eggcups ''. Após a primeira centrifugação, agite o tubo com as células que não estão em dos eggcups 're-suspender, enquanto as células nas' eggcups 'não sejam perturbados. Sem abrir o tubo, centrifugar novamente e repita esta etapa duas vezes. Isto assegura a deposiçãodas células a partir da cultura nas microcavidades vazios e irá aumentar a percentagem de enchimento.
Nota: Quando se trabalha com leveduras, recomenda-se pré-aquecer a centrífuga à temperatura de trabalho durante as experiências
NOTA: O protocolo pode ser uma pausa aqui e continuou até 12 horas mais tarde. Neste caso, armazenar a amostra à temperatura de trabalho e cobri-lo para evitar a evaporação. - Coloque 'eggcups' em um suporte de microscópio e preencher o suporte com meio filtrante esterilizada para a imagem latente. Agora lavar as células com o mesmo material até que as células de levedura flutuantes são removidos eficientemente. Tome cuidado para não perturbar as células em 'eggcups' durante o processo de lavagem.
- Selecione o objectivo de óleo 100X e concentrar-se cuidadosamente. Abra o software e ajustar os parâmetros. Para levedura, selecione a GFP filtros e TxRed para actina e miosina e ajustar o tempo de exposição para ambos os canais. A taxa de aquisição típico é de 3 segundos.
NOTA: Dependendoo fluoróforo, tipo de marcação e o set-up, tempo de exposição varia para outros sistemas.
- Preparar a superfície 'Eggcups' como descrito acima. Para fissão e células de levedura de germinação, preparar cavidades de 5 um de diâmetro (ver Tabela 1). Neste caso, a superfície não necessita de ser funcionalizado com proteínas de adesão.
- C. elegans Embrião
NOTA: Este exemplo usa C. elegans embriões de 25-30 uM de largura e de 50-55 ^ m de comprimento. Os embriões foram cultivados, tal como indicado em 25. Um protocolo visual simples de como manipular C. elegans pode ser encontrado em 26. A observação foi realizada utilizando um microscópio de contraste de fase invertida equipado com uma objectiva 40X de ar 0,55 NA.- Preparar a superfície 'Eggcups' como descrito acima, e de 25 um em diâmetro (ver Tabela 1). Neste caso, a superfície não necessita de ser funcionalizado com proteínas de adesão.
- Cultura do C. embriões elegans no meio de cultura adequado (ver Tabela 1).
- Insira embriões em 'eggcups' por centrifugação como descrito acima (ver secção 2,6-2,12) utilizando água ultrapura como meio de cultura.
NOTA: Os embriões foram 'comportando «normalmente em água ultrapura durante a duração da experiência. Como alternativa, use um buffer M9 fisiológica para experimentos de longa duração. - Lavar a amostra como descrito acima (ver secção 2.14). Coloque os 'eggcups' em um suporte de microscópio. Selecione o objetivo de ar 40X e concentrar-se cuidadosamente. Abra o software e ajustar os parâmetros. Selecione uma taxa de aquisição de 3 seg.
Resultados
Dos eggcups »(CE) são uma metodologia de alto teor-triagem romance que permite a visualização de células orientadas e embriões em um ambiente 3D. Além disso, alguns processos celulares, que são difíceis de observar em culturas 2D padrão (planas), pode ser observada por este novo método. A Figura 1a mostra um resumo do processo de microfabricação CE (ver também a secção 1 em o protocolo acima descrito ). O método é simples, rápido, eficiente e sem qualquer exigência de equipamentos especiais. Figura 1B e 1C mostra uma imagem de um microscópio eletrônico de varredura ampliada de 'eggcups', respectivamente imagem em grande escala e. Como pode ser observado, a sua forma e tamanho são muito regulares. Este método é muito flexível; diferentes formas e tamanhos podem ser facilmente fabricado e adaptados para diferentes sistemas modelo. As dimensões de'eggcups' foram seleccionados da seguinte maneira: dimensõesde células que sofrem divisão foram medidos em superfícies 2D: eles têm uma forma esférica e o seu diâmetro foi feita como uma boa indicação para o diâmetro CE. As células em alongado'eggcups' e oriente ao longo do seu eixo longitudinal durante a divisão celular, por exemplo. Esta dimensão depende do sistema - células e embriões - assim que esta dimensão deve ser avaliado em cada caso.
A Figura 2 mostra o material necessário (Figura 2a) e um protocolo passo-a-passo (figura 2b) sobre como utilizar os Eggcups '' (ver também a secção 2 no protocolo acima descrito). O enchimento do CE com células de interesse (ou outros sistemas modelo) é muito simples e rápido. Tipicamente, leva menos de 20-30 minutos, o que também inclui o tempo de tripsinização de células. Após o enchimento, as amostras podem ser usadas para estudar os processos activos (imagens ao vivo) ou podem ser fixadas e coradas para a visualização de organelos de interest (ver também secções 3 e 4 no protocolo descrito acima).
Em superfícies planas, as células apresentam respostas heterogéneas e fenótipos extremos de organelas celulares. De facto, tem sido sugerido que as fibras de stress de actina (e outros organelos celulares) são artefactos de as condições de cultura 1. Para provar esta hipótese, foram cultivadas células NIH3T3 tanto sobre 'Eggcups' 3D e sobre superfícies planas e comparados os fenótipos dos diferentes organelos celulares, ou seja, fibras de stress de actina, aparelho de Golgi e núcleos. A Figura 3 mostra um exemplo de como as células são organizados em ambas as configurações. Em CE, as células são distribuídas numa matriz ordenada que mostra um fenótipo esférico semelhante homogénea (Figura 3a). Em superfícies planas, as células mostram o típico desordenada, propagação e morfologia heterogênea (Figura 3b). Há também diferenças significativas nas estruturas do citoesqueleto. Em particular, as células em R16; Eggcups 'mostram uma redução no número de fibras de stress, em comparação com superfícies planas. Isto é ainda confirmado na imagens 3D reconstruídas onde há fibras de stress claras são visíveis (veja a Figura 3c - d). Isto confirma que algumas estruturas celulares são ampliados em culturas 2D. Esta é também de acordo com observações realizadas in vivo, onde fibras de stress não pode ser identificado.
O aparelho de Golgi, também mostra a variação significativa no seu fenótipo, dependendo das condições de cultura (ver Figura 4). O aparelho de Golgi em culturas 2D normalmente mostra um fenótipo estendido 'abraçando' a periferia núcleo enquanto que em 'eggcups' mostra um fenótipo mais compactado (veja a Figura 4a - b). A fim de simular uma manipulação rastreio de drogas, que também avaliado o efeito da droga sobre as células em cultura em ambos os ambientes. Foram selecionados blebbistatin mainly porque interrompe as fibras de stress de actina e poderia ter um efeito sobre a morfologia Golgi (veja a Figura 3c - d). Uma vez que o Golgi está localizado ao lado do núcleo da célula, esta droga também poderia ter um efeito sobre sua arquitetura. Em primeiro lugar, observou-se que as células tratadas com este medicamento sugerem menor morfologia regular e uniforme em relação ao tipo selvagem células (WT) (veja a Figura 3c - d). Nós, então, comparada e quantificado o fenótipo Golgi observado em 'eggcups' e em superfícies planas (ver Figura 4c). Observou-se que em superfícies 2D células mostraram principalmente um fenótipo estendido Considerando que, em células 'eggcups' mostrou um fenótipo mais compactada. Não observamos que a diferença marcante entre WT e células tratadas com blebbistatin.
Finalmente, em 2D superfícies do núcleo da célula é orientado aleatoriamente ao passo que para as células em CE é ortogonalmente orientada com respeito ao plano XY em ambosWT e blebbistatin células tratadas (ver Figura 5a - c). Isto realça a resistência do dispositivo para orientar organelos celulares, semelhante a uma antiga aplicação do método para orientar o plano de observação do anel cytokinetic em leveduras e células de mamíferos 10,12,13. Finalmente estudada como a esfericidade núcleo (definida como ψ = [π 1/3 6V N 2/3] / A N, em que V o símbolo n representa o volume do núcleo e A n a sua área de superfície) foi afectado, dependendo das condições de cultura e após o tratamento de células com blebbistatin. a Figura 5D mostra as distribuições de ψ correspondentes. Não foi observada diferença para WT plana vs WT CE, o que revela que a CE não estão afetando a esfericidade normal das células. No entanto, observou-se umadiferença quando comparando WT CE para Blebb CE sugerindo que a CE estão revelando um efeito real da droga que é mascarado em 2D.
estudo de células vivas usando 'eggcups' permitem também identificação de novos processos activos que não são visíveis nas culturas convencionais. Nós plaqueadas células em CE e visualizados divisão celular. A Figura 6 mostra uma sequência de imagens do fecho do anel cytokinetic durante a mitose celular. O dispositivo 'eggcups' permite uma visualização completa do anel, enquanto culturas padrão 2D mostra apenas duas áreas que corresponde a um único plano 10. Reconstrução do anel a partir de uma sequência de imagens z-stack usando culturas 2D pode ser feito 27, mas a informação importante está perdido. A qualidade é diminuída devido à baixa resolução z e processos dinâmicos não podem ser resolvidos. Actina e miosina são as proteínas-chave na geração de força de divisão celular. Sua dinâmica não pode be fotografadas e estudadas em 2D cultura (Figura 6a), enquanto que com 'eggcups' é imediatamente revelado. Nós identificamos novas estruturas e processos: em células HeLa encontramos acumulações periódicas de miosina 17. Estas acumulações mover radialmente como o anel está a fechar (Figura 6b). Em levedura também encontramos heterogeneidades em miosina e actina (Figura 6c, direita) 17. Em contraste com o que vemos em células HeLa, eles giram no anel durante o fechamento. A velocidade está na gama de uM min-1 e não seria resolvido pelo z reconstrução com microscópios convencionais. Finalmente, o anel pode ser cytokinetic ainda estudados através de coloração para os seus componentes. Nós descobrimos que há uma acumulação de fosfotirosina na vizinhança do anel (Figura 6d). Nós também podemos mostrar que anillin é colocalizing no anel (Figura 6e). Por coloração das células nesta orientação, We revelam que anillin também mostra uma distribuição não homogênea.
Também foram aplicados dos eggcups 'a diferentes sistemas modelo: nós informamos células de mamíferos, levedura de fissão, mas nós também testou brotamento levedura e C. elegans (veja a Figura 7a - e). Neste caso, o protocolo foi adaptado para cada sistema específico em termos de meios de cultura, as cavidades tamanho e morfologia (ver Tabela 1). Como um exemplo, em forma de V cónica Eggcups '' foram a morfologia óptima para a imobilização de levedura de fissão eficientemente 12, em vez de completamente cilíndrica (ou em forma de U) Forma utilizado para células de mamífero 13. Isto permitiu testar o efeito de diferentes drogas citoesqueleto com potencial aplicação em pesquisa de ciências biológicas. Isto demonstra a flexibilidade e confiabilidade da metodologia desenvolvida.
Além disso, a disposição altamente ordenada de células permite umafácil, automatizada ler-out da fluorescência de células individuais. Nós ilustrar isso através da inserção de células NIH3T3 que expressam GFP em 'eggcups "(Figura 8a). A posição de célula pode ser facilmente reconhecido e o nível de expressão correspondente medido. Figura 8b mostra a distribuição dos sinais de fluorescência. Isto pode ser aplicado a qualquer limite ler (imunofluorescência, repórteres fluorescentes em células, por exemplo).
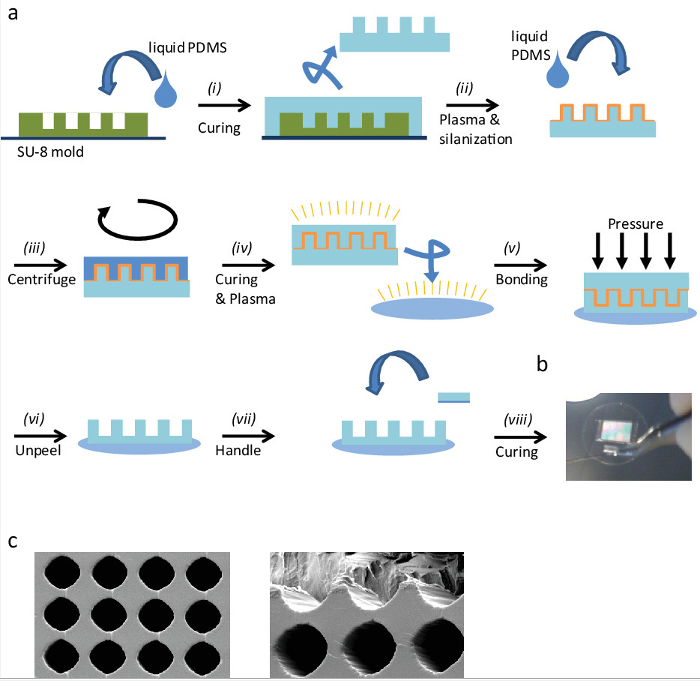
Figura 1: Fabricação de Eggcups '' (a) Representação esquemática do processo de fabricação de Eggcups '' por moldagem réplica:. (I) Verter PDMS líquido sobre o molde SU-8 e curá-lo. (Ii) Recorte o selo e remova-o com cuidado a partir da superfície, em seguida, plasma ativá-lo para silanizar-lo. (Iii) Pour PDMS líquidos no carimbo de silanizadad centrifugar-lo para obter uma camada de PDMS fina. (Iv) Após a cura da camada de PDMS, plasma activar selo ambos, o PDMS coberto e uma lamela de vidro. (V) Plasma ligam tanto pela aplicação de uma pressão suave e homogênea. (Vi) Após a colagem plasma, remova cuidadosamente o selo para descobrir a superfície eggcups '. (Vii) Para simplificar o tratamento nas próximas etapas, adicionar uma pequena parte do punho PDMS. Ligam-se a peça de PDMS para a lamela por colagem com PDMS líquidos e (viii) curá-lo depois no forno. (B) A imagem de uma lamela de 25 mm, com PDMS 'eggcups' e uma alça. Imagens de microscópio (C) Eletrônica de Varredura de 'eggcups' PDMS. A distância entre os centros de 'eggcups' é de 30 mm e seu diâmetro de cerca de 25 mm. (Esquerda) Vista superior. (Direita) 'Eggcups' são cortadas para a imagem da parte interna. Por favor clique aqui para vie wa versão maior desta figura.

Figura 2: (a) elementos necessários para o enchimento CE. (1) tubo de 50 ml; (2) peça cilíndrica (parte superior e lateral); (3) meio de cultura celular; (4) "eggcups '; (5) pinças afiadas. (B) Representação esquemática do processo de enchimento CE. (I) uma peça cilíndrica é primeiro introduzida num tubo de 50 mL e encheu-se com 13 ml de meio de cultura celular. Em seguida, (ii) as '' Eggcups são suavemente depositada no topo da peça cilíndrica usando pinças cortantes para manipular o CE utilizando o pequeno pedaço de PDMS. (III) células na densidade adequada são pipetados em cima do CE. (Iv) As células são introduzidas nas Eggcups '' por centrifugação. (V) Finalmente, a amostra é suavemente lançado para fora do tubo e está pronto para usar. m / files / ftp_upload / 51880 / 51880fig2large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
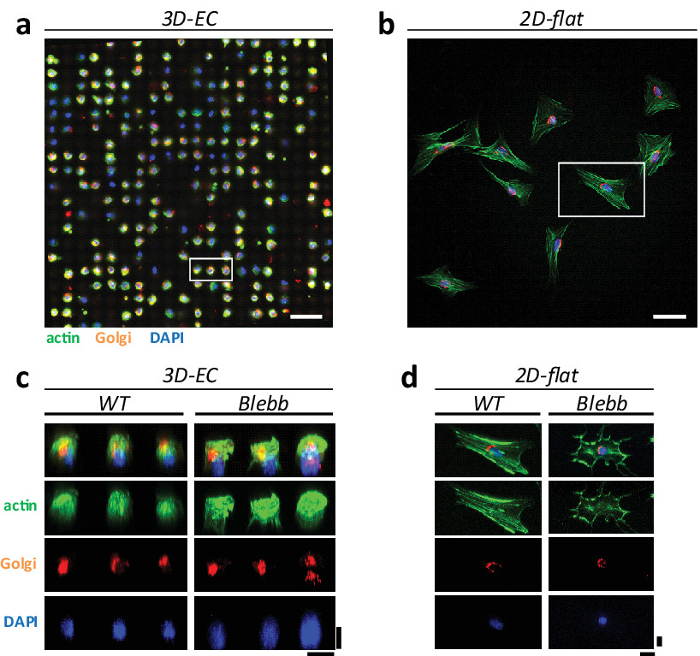
Figura 3: Comparação de fenótipos celulares em 3D "eggcups 'e superfícies planas em 2D. A microscopia confocal (objetiva água 25X, 0,95 NA, Leica) imagem de células NIH3T3 em (a), CE formando um conjunto ordenado, e que mostram um fenótipo esférico homogêneo, e em (b) cultura plana 2D standard, distribuídos aleatoriamente com fenótipos heterogêneos. As células foram coradas para actina (em verde), Golgi (em laranja) e núcleo (em azul). Barras de escala = 100 pm. Reconstrução (c) 3D de células na CE e (d) em superfícies planas para a WT e células tratadas com blebbistatin. Barras de escala = 20 uM.880 / 51880fig3large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 4: Estudo de NIH3T3 Golgi fenótipo aparelho de imagem esquemática e amostra de Golgi classificação fenótipo de células em (a) plano e (b), CE.. As células foram classificadas como compactada, fragmentada alargada ou, dependendo do valor α. (C) Quantificação de fenótipos de Golgi. Barras de escala = 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
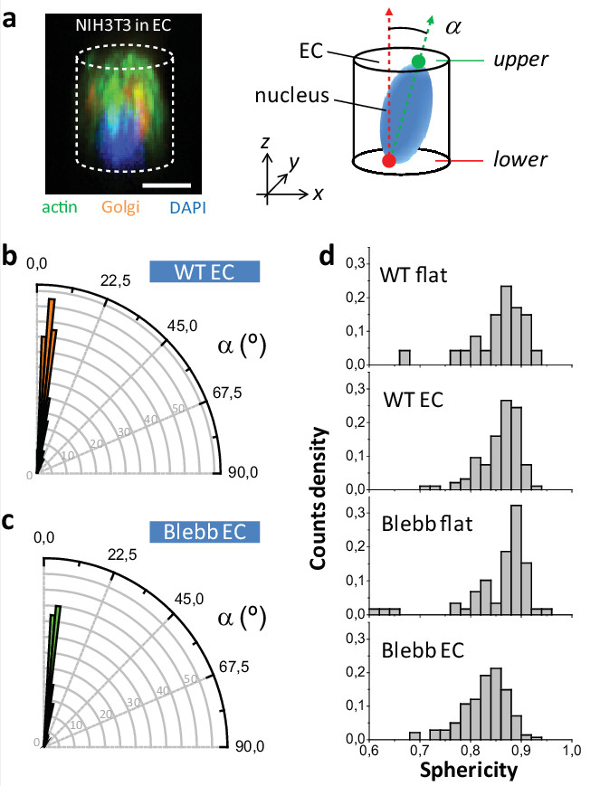
Figura 5: Estudo de NIH3T3 fenótipo núcleo. (a) (Esquerda) imagem microscopia confocal de uma célula NIH3T3 dentro de um CE e coradas para a actina (em verde), Golgi (em laranja) e núcleo (em azul). (Direito) Esquema de orientação núcleos dentro CE. (B) distribuição angular de núcleos no interior CE para WT e (c) células tratadas com blebbistatin. (D) Os valores de esfericidade Núcleo de células WT e blebbistatin-tratados, tanto para CE e superfícies planas (P [WT CE -Blebb CE] <0,001, P [Blebb plana -Blebb CE] <000,1; n WT plana = 47, n WT EC = 94, n plana Blebb = 59, n Blebb EC = 141 células). Barra de escala = 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
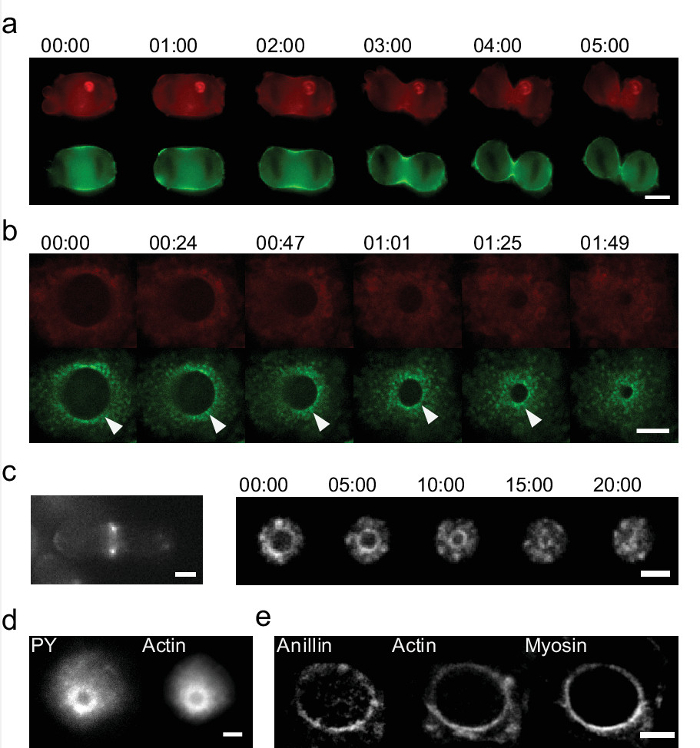
Figura 6: Estudo detalhado do anel cytokinetic em amostras vivas e fixas e em dois sistemas usando 'eggcups' (a) sequência Tempo do anel cytokinetic utilizando a cultura padrão 2D in vitro.. Apenas dois pontos brilhantes em actina (Lifeact-mCherry, vermelho) e miosina (GFP marcadas, verde) são visíveis no sulco de clivagem das células HeLa (Barra de escala = 10 uM). (B) sequência Tempo de encerramento para o anel cytokinetic em células HeLa durante a mitose usando 'eggcups'. As imagens mostram actina (em vermelho) e miosina (verde). 'Eggcups' permitir a identificação de acumulações ainda miosina. Um exemplo é destacada com uma seta. (Barra de escala = 5 uM). (C) O anel cytokinetic também pode ser visualizado na levedura de fissão. (À esquerda) As células encontram-se em uma superfície plana, a cito anel cinética é visível apenas como dois pontos (à direita) Células em 'eggcups':. Todo o encerramento podem ser capturadas. A actina é marcada com DCC-GFP (Barras de escala = 2 uM). Tempo em min: seg. (D - e) Os exemplos de anéis cytokinetic coradas. (D) Actina-GFP expressando células HeLa são coradas para a fosfotirosina (PY), que também mostra o sinal no anel (Barra de escala = 5 uM). Células (e) HeLa expressando GFP marcado miosina e Lifeact-mCherry (actina) estão manchadas para anillin. Anillin é revelada para localizar no anel cytokinetic e menos concentrada no córtex. Ele mostra co-localização com a actina e miosina (Barra de escala = 5 mm). Por favor clique aqui para ver uma versão maior desta figura.
80 / 51880fig7.jpg "/>
Figura 7:. Aplicação das Eggcups '' para outros tipos de células e sistemas modelo (a) U2OS (osteossarcoma humano). A inserção mostra uma célula em divisão. (Barra de escala = 20 mm). (B) as células NIH3T3 que expressam GFP. Diferença nos níveis de expressão pode ser facilmente lido (Barra de escala = 20 mm). (C) As células SW480 (Barra de escala = 20 uM). (D) de fermento de brotamento; o seu tempo de ciclo é alterado. (Barra de escala = 10 uM). (E) C. elegans vermes;. (à esquerda) em uma superfície plana (à direita) em 'eggcups', embrião é visto de uma perspectiva de outra forma ocultos. (Barras de escala = 10 uM). Tempo em min: seg. Por favor clique aqui para ver uma versão maior desta figura.

Figura 8: A organização em uma matriz de 'eggcups' permite uma análise automatizada de população de células (a) células NIH3T3 em CE (Barra de escala = 20 m).. Eles têm diferentes níveis de expressão da GFP. (B) o reconhecimento automatizado da posição da célula permite uma análise individual do nível de expressão. Resume-se o histograma da expressão GFP da população de células. Por favor clique aqui para ver uma versão maior desta figura.
| modelo de Sistema | Digitar | Cultura médium | Observação Médio | '' eggcups diâmetro (μ; M) | Comentários / Descrição |
| As células de mamífero | NIH3T3 | BCS a 10% de DMEM-elevado teor de glucose | BCS a 10% L-15 | 20 | Outras linhas celulares estáveis, tais como MDCK ou REF52, bem como linhas de células primárias, células cancerosas e / ou de células estaminais também pode ser inserido nos Eggcups ''. |
| HeLa | 10% de FCS-DMEM rico em glicose | 10% de FCS G-15 | 25 | Disponível a partir de muitas fontes diferentes. | |
| U2OS | 10% de FCS-DMEM rico em glicose | 10% de FCS G-15 | 20-25 | Disponível a partir de muitas fontes diferentes. | |
| SW480 | 10% de FCS-DMEM rico em glicose | 10% de FCS G-15 | 17-20 | Disponível a partir de muitas fontes diferentes. | |
| Fermento | levedura de fissão | agarplaca (YE5S) e líquidos de mídia (YE5S e EMM5S) | Esterilizado por filtração media EMM (veja a lista de materiais) | 5 | A superfície não necessita de ser funcionalizado com proteínas adesivas. |
| Levedura de brotamento | placa de agar (YPD) e meios de comunicação de líquido (YEPD e SD) | media SD | 5 | A superfície não necessita de ser funcionalizado com proteínas adesivas. | |
| Embrião | C. elegans | placa NGM | água ultrapura | 25 | Alternativamente meio M9 pode ser utilizado para experiências a longo prazo. A receita desta solução com sal pode ser encontrada aqui: http://cshprotocols.cshlp.org/content/2009/5/pdb.rec11798.full?text_only=true |
Tabela 1: Condições de cultura em 'eggcups' para diferentes sistemas modelo. O protocolo anterior relacionada-pode ser facilmente adaptadosubstituindo apenas as condições de cultura descritas e o tamanho de Eggcups ''.
Discussão
moldagem réplica foi utilizado a fim de fabricar os Eggcups ''. O processo de fabricação não precisa de uma sala limpa; é fácil e simples, embora alguns prática pode não ser necessária. Em particular, libertando o selo PDMS é a etapa mais importante, a fim de produzir uma grande área de '' Eggcups alta qualidade. Por esta razão, um cuidado especial tem de ser tomada neste passo. Se essa etapa for repetidamente falhando, considere para otimizar os parâmetros do plasma mais limpos antes da silanização e plasmáticas. silanização insuficiente levará a forte aderência do selo para o filme PDMS. Se este for observado, o tempo de incubação com o reagente de silanização pode ser aumentada. Note-se que outros materiais e técnicas pode ser aplicado para fabricar os Eggcups '', que podem ser funcionalizados com uma grande variedade de ligandos (fibronectina, gelatina, colagénio, etc.). Em particular, em microcavidades de poliestireno podem ser facilmente fabricadas por CUStécnica de estampagem a quente tom-feita. Isto assegura a biocompatibilidade e a comparação directa com os resultados obtidos em placas de cultura padrão. Da mesma forma, cuidados e práticas especiais são necessários, a fim de otimizar a percentagem de enchimento. Em particular, o passo de enxaguamento é crítico a fim de assegurar um enchimento apropriada, sem excesso de células, contribuindo para o ruído de fundo e no sinal. Se as células são removidas facilmente de cavidades, considere para alterar o tamanho ou profundidade das cavidades.
'Eggcups' oferecer uma arquitetura 3D-like de células e testes de rastreio de alto conteúdo usando um protocolo simples. organelas celulares e os processos activos desconhecidos usando ensaios de cultura padrão pode ser facilmente visualizado por meio de inserção de células individuais em microcavidades individuais ( 'eggcups'). Dependendo do sistema de modelo, o tamanho, a forma e as suas dimensões podem ser facilmente adaptadas. Desta forma, as células de mamíferos, levedura de fissão, brotação levedura e C. elegans cum ser manipulados e estudados, bem como quaisquer embriões tais como Drosophila, ratinhos ou embriões humanos para a fertilização in vitro, ou células-tronco, por exemplo.
Nesta configuração células individuais são capturados. Isto está em contraste com os tecidos epiteliais encontradas in vivo. No entanto, neste ambiente podem ser reproduzidas em nossos Eggcups '' por revestimento das paredes laterais com as caderinas imitar os contactos célula-célula usando elastómeros mais flexíveis. contactos focais será promovida pela deposição de fibronectina no fundo dos poços. Estas respectivas distribuições de moléculas de adesão deve permitir em reproduzir os ambientes celulares encontradas in vivo. Por este método seria aproximar as condições fisiológicas.
troca de meio no nosso ensaio é assegurada. As células na CE não mostram qualquer tipo de degradação, quando a realização de experimentos tanto a curto como a longo prazo devido à falta de troca de meio. Note-se também que as células em ca CEn ser cultivadas até confluência embora o interesse principal é quando as células individuais ou embriões são isolados dentro das cavidades.
Orientação de organelas ou organismos inteiros está revelando novas informações. Mostramos diferentes dinâmicas de actina e miosina no anel cytokinetic. Embora o anel cytokinetic em levedura e células de mamíferos é composto de componentes-chave semelhantes, mostramos com esta configuração, que as suas dinâmicas específicas é diferente 17. Este apoio é o resultado, que o mecanismo de fecho em ambos os sistemas é bem diferente. Para desenvolver e pesquisar uma hipótese tal, a orientação da célula é indispensável. Em estudos futuros, este dispositivo pode ser também usado para investigar outros eventos relacionados com a organela organização em células.
Além disso, esta técnica pode ser de grande utilidade na biologia do desenvolvimento. embriões de forma alongada pode ser facilmente orientada, observado ou ainda tratado com uma orientação definida.Provavelmente o nosso ensaio não iria impor a polaridade de embriões, mas a percentagem de enchimento de alta permitiria a extrair A leitura desejada de uma forma fiável. Ao todo 'eggcups' poderia ser um bom dispositivo para projeções de alta de conteúdo.
Outros ensaios de cultura têm sido propostos. Estes métodos variam de dimensões múltiplas células em 2D em placas com múltiplas cavidades, para células individuais depositadas em motivos adesivas micropatterned com forma idêntica. No entanto, nenhum deles é adequado para ultrapassar as limitações descritas acima na observação de organelos celulares e processos dinâmicos 1.
Futuras melhorias para o nosso sistema permitirá que a aplicabilidade da 'eggcups' para fins orientados para a indústria. Como um exemplo, aplicações de rastreio de drogas em empresas farmacêuticas requerem a utilização de placas com múltiplas cavidades 14,28; implementação 'eggcups' em tais plataformas potencialmente melhorar a confiabilidade dotestes e resultados. Como tais ensaios, alto-triagem de conteúdo será realizada utilizando os processos automatizados geralmente usados de empresas farmacêuticas (e laboratórios de pesquisa acadêmica), utilizando robôs. Isso irá garantir a repetibilidade e confiabilidade com baixa variabilidade. Alguns produtos comerciais baseados em ensaios em cultura de células 3D já apareceram no mercado destacando a importância deste tipo de ensaios. Finalmente, estes dispositivos de abrir novas perspectivas para a medicina personalizada: células do doente pudesse ser colocado em Eggcups '', e cocktails de tratamento pode ser testado num ambiente fisiológico; o biomarcador read-out permitirá prever um tratamento ideal para ser administrado ao paciente 29. Ao todo, a forma física das células e embriões estão orientando a arquitetura das cavidades, e esperamos que o dispositivo e este método será amplamente difundido no futuro.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Nós reconhecemos L. Brino (facilidade de Triagem conteúdo IGBMC alta, Illkirch, França) para fornecer-nos com o anticorpo anti-Giantin, M. Labouesse Lab. para C. elegans (IGBMC) e B. Séraphin Lab. para quem gosta de levedura (IGBMC), E. Paluch e A. Hyman para as células HeLa fluorescentes (MPI-CBG, Dresden), J. Moseley (Dartmouth Medical School) e JQ Wu (Ohio State University) para células de levedura de fissão; A. Hoel e F. Evenou para ajudar experimental, C. Rick (IBMC, Estrasburgo, França) para obter ajuda técnica e JC Jeannot (Femto-st, França) para ajudar na microfabricação. Este trabalho foi apoiado por fundos do CNRS, da Universidade de Estrasburgo, Conectus, La Fondation pour la Recherche Médicale ea ci-FRC de Estrasburgo.
Materiais
| Name | Company | Catalog Number | Comments |
| ddH20 (ultrapure) | Millipore | - | Use always fresh water. |
| Parafilm (plastic film) | Bemis | PM-999 | Adhere Parafilm to the lab bench using some water droplets and ensure a perfect surface flatness. |
| Photo-mask | Selba | - | http://www.selba.ch |
| Silicon wafer | Siltronix | - | http://www.siltronix.com/ |
| SU-8 photoresist | MicroChem | 2000 series | http://www.microchem.com/Prod-SU82000.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| SU-8 developer | MicroChem | - | http://microchem.com/Prod-Ancillaries.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information | |||
| 2-propanol | Sigma-Aldrich | 19030 | http://www.sigmaaldrich.com/catalog/product/sial/i9030?lang=en®ion=CA |
| Available from multiple companies. | |||
| Sigmacote (siliconizing reagent ) | Sigma-Aldrich | SL2-25ML | http://www.sigmaaldrich.com/catalog/product/sigma/sl2?lang=fr®ion=FR |
| harmful, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Chlorotrimethylsilane (TMCS) | Sigma-Aldrich | 386529-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/386529?lang=fr®ion=FR |
| TMCS produces acute inhalation and dermal toxicity, and is highly flammable (with ignition flashback able to occur across considerable distances), consequently it should be used in a fume cupboard away from sources of ignition | |||
| Nitrile gloves | Kleenguard | 57372 | http://www.kcprofessional.com/products/ppe/hand-gloves/thin-mil-/57372-kleenguard-g10-blue-nitrile-gloves-m |
| Available from multiple companies. | |||
| Glass coverslips #0 | Knittel glass | KN00010022593 | http://www.knittelglass.com/index_e.htm |
| Very fragile. Manipulate gently. | |||
| Sharp straight tweezers | SPI | 0WSSS-XD | http://www.2spi.com/catalog/tweezers/t/elec7 |
| 50 ml tube | BD Falcon | 352070 | http://www.bdbiosciences.com/cellculture/tubes/features/index.jsp |
| Available from multiple companies. | |||
| PDMS | Dow Corning | Sylgard 184 kit | http://www.dowcorning.com/applications/search/default.aspx?R=131EN |
| The package contains both PDMS base and curing agent. Similar elastomers are available from multiple companies. | |||
| Microscope glass slides | Dutscher | 100001 | http://www.dutscher.com/frontoffice/search |
| Available from multiple companies. | |||
| DMEM high-glucose medium | Fisher Scientific | 41965-039 | http://www.fishersci.com/ecomm/servlet/Search?LBCID=12301479&keyWord=41965-039&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Bovine calf serum | Sigma-Aldrich | C8056-500ML | http://www.sigmaaldrich.com/catalog/product/sigma/c8056?lang=en®ion=CA |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200-072 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=25200-072&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS 1x | Fisher Scientific | 14200-067 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=14200-067&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS is at 10x and should be diluted to 1x using ddH2O | |||
| L-15 medium | Fisher Scientific | 21083-027 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=21083-027&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Medium for atmospheres without CO2 control | |||
| Fibronectin | Sigma-Aldrich | F1141-5MG | http://www.sigmaaldrich.com/catalog/search?interface=All&term=F1141-5MG&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Penicillin & Streptomycin | Fisher Scientific | 15140-122 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=15140-122&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=CHEM |
| Petri dish P35 | Greiner | 627102 | http://www.greinerbioone.com/en/row/articles/catalogue/article/144_11/12885/ |
| Petri dish P60 | Greiner | 628163 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/145_8_bl/24872/ |
| Petri dish P94 | Greiner | 633179 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/146_8_bl/24882/ |
| Paraformaldehyde 3 % | Sigma-Aldrich | P6148-500G | http://www.sigmaaldrich.com/catalog/product/sial/p6148?lang=fr®ion=FR |
| Harmful in-particular for the eyes, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Triton 0.5 % | Sigma-Aldrich | 93443-100ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=93443-100ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Phallodin-Green Fluorescent Alexa Fluor 488 | InVitrogen | A12379 | http://www.lifetechnologies.com/order/catalog/product/A12379?CID=search-a12379 |
| dissolve powder in 1.5 ml methanol | |||
| Alexa Fluor 647 | InVitrogen | A21245 | 1:200 dilution in PBS 1x |
| rabbit polyclonal anti-Giantin | Abcam | ab24586 | 1:500 dilution in PBS 1x |
| http://www.abcam.com/giantin-antibody-ab24586.html | |||
| rabbit anti-anillin | Courtesy of M. Glotzer, Published in Piekny, A. J. & Glotzer, M. Anillin is a scaffold protein that links RhoA, actin, and myosin during cytokinesis. Current biology 18, 30–6 (2008). | 1:500 dilution in PBS 1x | |
| Anti-phosphotyrosine | Transduction Lab | 610000 | http://www.bdbiosciences.com/ptProduct.jsp?ccn=610000 |
| Cy3 goat anti-rabbit | Jackson Immunoresearch | 111-166-047 | http://www.jacksonimmuno.com/catalog/catpages/fab-rab.asp |
| 1:1,000 dilution in PBS 1x | |||
| DAPI | Sigma-Aldrich | D8417 | http://www.sigmaaldrich.com/catalog/product/sigma/d8417?lang=fr®ion=FR |
| 1 mg/ml for 1 min | |||
| Glycerol | Sigma-Aldrich | G2025 | http://www.sigmaaldrich.com/catalog/search?interface=All&term=G2025&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Mineral oil | Sigma-Aldrich | M8410-500ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=M8410-500ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| HeLa cells | - | - | Mammalian cells are available from many companies. See also Table 1 |
| NIH3T3 cells | ATCC | - | Mammalian cells are available from many companies. See also Table 1 |
| Fission yeast | - | - | For details on strains, contact the corresponding author. See also Table 1 |
| C. elegans worms | - | - | For details, contact the corresponding author. See also Table 1 |
| YES (Agar) + 5 Supplements included | MP Biomedicals | 4101-732 | http://www.mpbio.com/search.php?q=4101-732&s=Search |
| For preparation: follow instructions as given on the box | |||
| YES (Media) + 5 Supplements included | MP Biomedicals | 4101-522 | http://www.mpbio.com/search.php?q=4101-522&s=Search |
| For preparation: follow the instructions as given on the box | |||
| EMM (Media) | MP Biomedicals | 4110-012 | http://www.mpbio.com/search.php?q=4110-012&s=Search |
| For preparation: follow instructions as given on the box | |||
| Filter sterilized EMM (Media) - Only for imaging | MP Biomedicals | 4110-012 | For preparation: follow instructions as given on the box. Filter sterilize the media using a 0.22 µm filter instead of autoclaving. This gives transparency to the media and reduces the autofluorescence. |
| Supplements (for EMM) | MP Biomedicals | 4104-012 | http://www.mpbio.com/search.php?q=4104-012&s=Search |
| (Add 225 mg/L into the EMM media before autoclaving or filtering) | |||
| Stericup and Steritop Vaccum driven sterile filters | Millipore | - | http://www.millipore.com/cellbiology/flx4/cellculture_prepare&tab1=2&tab2=1#tab2=1:tab1=2 |
Referências
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294, 1708-1712 (2001).
- Azioune, A., Storch, M., Bornens, M., Thery, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab Chip. 9, 1640-1642 (2009).
- Mandal, K., Balland, M., Bureau, L. Thermoresponsive Micropatterned Substrates for Single Cell Studies. PLoS ONE. 7, e37548(2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nat Rev Mol Cell Biol. 8, 839-845 (2007).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. , (2012).
- Ghibaudo, M., Di Meglio, J. M., Hersen, P., Ladoux, B. Mechanics of cell spreading within 3D-micropatterned environments. Lab Chip. 11, 805-812 (2010).
- Greiner, A. M., Richter, B., Bastmeyer, M. Micro-Engineered 3D Scaffolds for Cell Culture Studies. Macromol Biosci. 12, 1301-1314 (2012).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat Mater. 12, 458-465 (2013).
- Legant, W. R., et al. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat Meth. 7, 969-971 (2010).
- Devices and methods for observing the cell division. , WO/2010/092116 (2010).
- Ochsner, M., et al. Micro-well arrays for 3D shape control and high resolution analysis of single cells. Lab Chip. 7, 1074-1077 (2007).
- Devices and methods for observing cells with cell wall or invertebrate embryos with oblong eggshell . , WO2013144302 (2012).
- Devices and methods for observing eukaryotic cells without cell wall. , WO2013135809 (2012).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends Biotech. 28, 237-245 (2010).
- Wolfe, D., Qin, D., Whitesides, G. Microengineering in Biotechnology, Ch 3. Methods in Molecular Biology. Hughes, M. P., Hoettges, K. F. 583, Humana Press. 81-107 (2010).
- Mehling, M., Tay, S. Microfluidic cell culture. Curr Op Biotech. 25, 95-102 (2014).
- Wollrab, V., Thiagarajan, R., Wald, A., Kruse, K., Riveline, D. Still and rotating myosin clusters determine cytokinetic ring constriction. Nat Commun. 7, 11860-11869 (2016).
- Yao, X., et al. Functional analysis of single cells identifies a rare subset of circulating tumor cells with malignant traits. Integr Biol. 6, 388-398 (2014).
- Eberwine, J., Sul, J. Y., Bartfai, T., Kim, J. The promise of single-cell sequencing. Nat Meth. 11, 25-27 (2014).
- Allen, T. D., et al. Generation of cell-free extracts of Xenopus eggs and demembranated sperm chromatin for the assembly and isolation of in vitro-formed nuclei for Western blotting and scanning electron microscopy (SEM). Nat. Protocols. 2, 1173-1179 (2007).
- Robbins, E., Marcus, P. I. Mitotically Synchronized Mammalian Cells: a Simple Method for Obtaining Large Populations. Science. 144, (1964).
- Whitfield, M. L., et al. Stem-loop binding protein, the protein that binds the 3" end of histone mRNA, is cell cycle regulated by both translational and posttranslational mechanisms. Molecular and Cellular Biology. 20, (2000).
- Straight, A. F., et al. Dissecting Temporal and Spatial Control of Cytokinesis with a Myosin II Inhibitor. Science. 299, 1743-1747 (2003).
- Tang, J., Erikson, R. L., Liu, X. Checkpoint kinase 1 (Chk1) is required for mitotic progression through negative regulation of polo-like kinase 1 (Plk1). Proc Natl Acad Sci. 103, 11964-11969 (2006).
- Zahreddine, H., Zhang, H., Diogon, M., Nagamatsu, Y., Labouesse, M. CRT-1/Calreticulin and the E3 Ligase EEL-1/HUWE1 Control Hemidesmosome Maturation in C. elegans Development. Curr Biol. 20, 322-327 (2010).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans Methods: Synchronization and Observation. JoVE. , e4019(2012).
- Saha, S., Pollard, T. D. Anillin-related protein Mid1p coordinates the assembly of the cytokinetic contractile ring in fission yeast. Mol Biol Cell. 23, 3982-3992 (2012).
- Prestwich, G. D. Evaluating Drug Efficacy and Toxicology in Three Dimensions: Using Synthetic Extracellular Matrices in Drug Discovery. Acc Chem Res. 41, 139-148 (2007).
- Futamura, Y., et al. Morphobase, an Encyclopedic Cell Morphology Database, and Its Use for Drug Target Identification. Chem Biol. 19, 1620-1630 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados