Method Article
Ordenando las células individuales y solo los embriones en 3D Confinamiento: un nuevo dispositivo para la selección de alto contenido
En este artículo
Resumen
Se presenta un dispositivo y un nuevo método para estudiar las células y embriones. Las células individuales se ordenan precisamente en matrices microcavidad. Su confinamiento en 3D es un paso hacia entornos 3D se encuentran en condiciones fisiológicas y permite la orientación orgánulo. Mediante el control de la forma celular, esta configuración reduce al mínimo la variabilidad reportado en ensayos estándar.
Resumen
Las células biológicas se observan generalmente en las superficies planas (2D). Esta condición no es fisiológico y fenotipos y formas son muy variables. Selección basada en células en estos entornos tienen limitaciones, por lo tanto graves: orgánulos celulares muestran fenotipos extremos, morfologías celulares y tamaños son orgánulos celulares heterogéneas y / o específicos no se pueden visualizar correctamente. Además, las células in vivo se encuentran en un entorno 3D; en esta situación, las células muestran diferentes fenotipos principalmente debido a su interacción con la matriz extracelular que rodea el tejido. Con el fin de estandarizar y generar orden de las celdas individuales en un entorno 3D fisiológicamente relevante para los ensayos basados en células, se presenta aquí la microfabricación y las aplicaciones de un dispositivo para el cultivo in vitro de células en 3D. Este dispositivo consiste en una matriz 2D de microcavidades (típicamente 10 5 cavidades / cm 2), cada uno lleno con células individuales o embriones. posición de la célulación, la forma, la polaridad y la organización interna de la celda se convierten entonces normalizado que muestra una arquitectura 3D. Utilizamos moldeo réplica al patrón de una serie de microcavidades, hueveras '', sobre una delgada polidimetilsiloxano (PDMS) capa adherida sobre un cubreobjetos. Las cavidades se cubrieron con fibronectina para facilitar la adhesión. Las células se insertan por centrifugación. porcentaje de llenado se ha optimizado para cada sistema que permite hasta 80%. Las células y los embriones se confirmó la viabilidad. Se aplicó esta metodología para la visualización de orgánulos celulares, tales como aparato de Golgi y el núcleo, y para estudiar los procesos activos, tales como el cierre del anillo cytokinetic durante la mitosis celular. Este dispositivo permitió la identificación de nuevas características, tales como la acumulación y la falta de homogeneidad de la miosina y actina periódicas durante el cierre del anillo cytokinetic y fenotipos compactados de Golgi y la alineación núcleo. Nos caracteriza el método de células de mamífero, levadura de fisión, la levadura en ciernes, C. elegans wITH adaptación específica en cada caso. Por último, las características de este dispositivo lo hacen particularmente interesante para los ensayos de cribado de fármacos y la medicina personalizada.
Introducción
Actual en ensayos basados en células in vitro son de dos dimensiones (2D). Esta configuración no es natural para las células de mamíferos y, por tanto, no es fisiológicamente relevante 1; las células muestran una diversidad de formas, tamaños y fenotipos heterogéneos. Presentan serias limitaciones adicionales cuando se aplica a las aplicaciones de cribado, tales como una distribución desordenada dentro del plano y fenotipos extremos de los orgánulos celulares (fibras de estrés, en particular). Esto es particularmente importante en los ensayos clínicos de las pruebas de drogas, donde los presupuestos altos se gastan cada año. La mayoría de estos fármacos fracasan, aunque cuando se aplica a los modelos animales debido a la condición de cultivo 2D artificial en las primeras etapas de la detección de drogas. Además, mediante el uso de este enfoque, los orgánulos celulares específicos no pueden ser correctamente visualizados, tal como el anillo de actomiosina cytokinetic durante la mitosis celular, y en general estructuras que se están desarrollando en el plano perpendicular al plano de observación. Algunosnuevos ensayos 2D se han propuesto con el fin de superar los inconvenientes antes mencionados y importantes conocimientos sobre la organización del citoesqueleto se han observado 2,3. Sin embargo, estos ensayos todavía presentes una seria limitación: células muestran un fenotipo muy propagación en contraste con lo que se observa in vivo, donde las células presentan una arquitectura 3D. Estos artefactos asociados con el método de cultivo pueden desencadenar características no fisiológicas tales como las fibras de estrés mejoradas 1,4,5.
Ensayos de cultivos celulares tridimensionales proporcionan múltiples ventajas en comparación con los entornos 2D 6,7. Ellos son fisiológicamente más relevantes, y los resultados son por lo tanto significativa. Como un ejemplo, las células embebidas en hidrogeles muestran estructuras 3D-como pero sus morfologías difieren de una célula a otra 8,9. Sin embargo, sus morfologías difieren de una célula a otra, lo que complica las aplicaciones de cribado. Una estrategia alternativa es la de insertar solacélulas en cavidades microfabricados 10,11. posición de la célula, la forma, la polaridad y la organización interna de la pila pueden entonces convertirse normalizado. Además de proporcionar una arquitectura 3D-como a las células, microcavidades cuenta también los estudios de cribado de alto contenido 10,12-14; células individuales pueden ser ordenados en microarrays y orgánulos celulares y sus evoluciones se pueden observar en paralelo. Esta regularidad ofrece buenas estadísticas con bajo número de células y mejores resoluciones temporales / espaciales. Los compuestos útiles son más fáciles de identificar de forma fiable.
En este estudio, mostramos la fabricación y aplicación de un nuevo sistema de células sola cultura 3D-como para aplicaciones de alto contenido de cribado 10,12,13. El dispositivo consiste en una serie de microcavidades elastoméricos (10 5 cavidades / cm2), acuñadas '' hueveras (EC). Las dimensiones y el volumen total de la CE en este trabajo se han optimizado para el volumen típico de las células HeLa y NIH3T3 individualesdurante la división celular. La morfología de las cavidades cilíndricas - - se selecciona de forma de la célula orientar correctamente para la visualización de procesos activos. Moldeo de réplica se utiliza para una variedad de patrones CE sobre una delgada polidimetilsiloxano (PDMS) capa adherida sobre un vidrio cubreobjetos 15,16. Las células se introducen en la CE por centrifugación. Presentamos aquí la observación y la normalización de los orgánulos celulares (fibras de estrés de actina, aparato de Golgi y el núcleo) en 3D (CE) en comparación con las mismas células en 2D (plano) superficies. Nos informan también de la observación de los procesos dinámicos activos, tales como el cierre del anillo de actomiosina cytokinetic durante la mitosis celular 17. Finalmente, se muestran los resultados de esta metodología en otros sistemas con paredes rígidas, como la levadura en ciernes, levadura de fisión y C. embriones elegans que confirma la aplicabilidad de nuestra metodología para una amplia gama de sistemas modelo.
A continuación presentamos una p detallado y exhaustivorotocolo con el fin de fabricar y aplicar las hueveras '' para la microfabricación 3D. Nuestro enfoque es simple y no necesita una habitación limpia. Anticipamos que esta nueva metodología será particularmente interesante para los ensayos de cribado de fármacos y la medicina personalizada, en sustitución de las placas de Petri. Finalmente, nuestro dispositivo será útil para estudiar la distribución de respuestas de las células a los estímulos externos, por ejemplo en el cáncer de 18 o en la investigación básica 19.
Protocolo
1. La microfabricación de Eggcups ''
- La fabricación del Maestro: microcavidades matriz
- Calentar una oblea de 3 '' de silicio de hasta 200 ° C para evaporar cualquier presencia de humedad.
- Spin-abrigo de una fina capa de SU-8 fotoprotector. Ajustar el volumen de resina y de hilado de velocidad en función del espesor y fotoprotector tipo deseado. Este espesor dictará la profundidad de las hueveras '' (EC). Para una capa de espesor de 30 micras y SU-8 2025, spin-capa a 2.800 rpm.
- Pre-hornear la oblea a 65 ° C durante 1 min (paso 1 de 2) para un espesor de SU-8 2025 capa de 30 micras. Adaptar el tiempo, dependiendo del tipo de resina fotosensible y el grosor deseado. Compruebe la hoja de datos del fabricante para más detalles.
- Pre-hornear la oblea a 95 ° C durante 3 min (etapa 2 de 2) para un espesor SU-8 2,025 capa de 30 micras. Adaptar el tiempo, dependiendo del tipo de resina fotosensible y el grosor deseado. Compruebe la hoja de datos del fabricante para más detalles.
- cargar ella oblea en el alineador de máscara para la exposición UV. Coloque la máscara de fotolitografía en él. La máscara muestra un patrón de características circulares (discos) de 20 micras de diámetro. Asegurar un contacto perfecto entre sí.
NOTA: Los distintos fabricantes ofrecen máscaras de fotolitografía. La resolución espacial determinará el coste final. máscaras de acetato proporcionan una resolución aceptable (≈10 micras) a bajo costo. máscaras de cromo proporcionan una mejor resolución, pero son más caros. Adaptar los diámetros de los discos (de la máscara de fotolitografía) y el volumen de las células. Las dimensiones de los discos en la máscara determinarán el diámetro de las cavidades del equipo. Los diámetros pequeños conduzcan a un relleno de baja; diámetro demasiado grande, no se limitará a las células. Para las células HeLa y NIH3T3, se sugieren diámetros de 20 micras a 25 micras. - Comprobar el poder de la memoria antes de lámpara UV y optimizar el tiempo de exposición en consecuencia. Irradiar (longitud de onda = 365 nm) para 41,5 seg (o el tiempo de exposición optimizado) a250 mJ / cm 2.
NOTA: SU-8 2025 es un fotoprotector negativo, lo que significa que las regiones expuestas a los rayos UV se curan. En este caso, las características circulares eran de color negro y el resto transparente. trabajo fotoprotector positivo en el sentido contrario: las regiones no expuestas se curan. Seleccione la resina fotosensible en consecuencia, dependiendo del diseño y foto-máscara.
NOTA: proteger los ojos de la luz UV con gafas de seguridad apropiadas. - Eliminar suavemente la máscara de la capa de resina fotosensible.
- Post-hornear la oblea a 65 ° C durante 1 min (paso 1 de 2) para un espesor de SU-8 2025 capa de 30 micras. Post-hornear la oblea a 95 ° C durante 3 min (etapa 2 de 2) para un espesor de SU-8 2025 capa de 30 micras. Adaptar el tiempo, dependiendo del tipo de resina fotosensible y el grosor deseado. Compruebe la hoja de datos del fabricante para más detalles. Después de post-cocción, enfriar la oblea a la temperatura ambiente en el banco de alrededor de 1 min.
- Colocar la oblea en el spin-revestidor y soltar unos pocos mm de SU-8 desarrollador para cubrirtoda la zona de la oblea. Desarrollar por 2 min y luego girar-capa a 1.000 rpm durante 30 seg. Repetir el procedimiento tres veces.
- Enjuague con 2-propanol para asegurar la eliminación completa de subdesarrollada SU-8. Apariencia de las regiones blanco es una indicación de desarrollo incompleto. Si es así, repetir la etapa de revelado un tiempo adicional.
- Hard-hornear la oblea a 200 ° C para asegurar la solidez de las microestructuras fabricadas. Este paso es opcional.
- Almacenar la oblea 3 '' con microestructuras dentro de una 94 mm x 15 mm de poliestireno placa de Petri.
NOTA: No hay necesidad de tratamiento de superficies, en particular, silanización, para los siguientes pasos.
- La fabricación del polidimetilsiloxano (PDMS) Réplica: Pilares de matriz
- Mezclar bien en una relación 1:10 (w / w) el reticulante y el pre-polímero para un total de 30 g en un tubo de 50 ml.
NOTA: El uso de una relación de 1:10 (v / v) también está trabajando. - Centrifugar el tubo a 1800 xg durante 5 min aeliminar las burbujas de aire.
- Deje caer suavemente el PDMS en la parte superior de las microestructuras.
NOTA: Si aparecen burbujas de aire durante este paso, desgasificar la muestra usando una bomba de vacío durante 15-20 min. - Colocar la muestra en un horno a 65 ° C durante 4 horas.
NOTA: El tiempo de curado varía entre los usuarios y, junto con el reticulante: proporción de pre-polímero. Esta vez dictará la rigidez de los PDMS. Se recomienda para curar más de 2 horas y mantenerse dentro de un tiempo de curado fijo. - Utilizar un bisturí para cortar suavemente el área de interés (sello) de aproximadamente 1 cm 2, que incluye alrededor de 10 microcavidades o 5 '' hueveras.
NOTA: Corte primero el PDMS y, a continuación, la pela apagado suavemente. Comprobar la calidad de la réplica de PDMS con un microscopio óptico.
- Mezclar bien en una relación 1:10 (w / w) el reticulante y el pre-polímero para un total de 30 g en un tubo de 50 ml.
- La fabricación de hueveras '' por moldeo réplica. En lo que sigue, se describen dos estrategias alternativas para la fabricación de 'hueveras. Ambos protocolos son similar y proporcionar resultados idénticos:
- estrategia 1
- Activar el sello PDMS fabricado por tratamiento con plasma de oxígeno durante 30 segundos. Almacenar temporalmente los sellos activadas en una placa de Petri cerrada para evitar la acumulación de polvo.
NOTA: Ajuste el tiempo de exposición si se utilizan otros gases para el plasma. - Coloque los PDMS activados sello boca arriba (el lado con las estructuras) en una placa de Petri lado de un tapón de tubo de 15 ml. Llenar la tapa con 200 l de trimetilclorosilano (TMCS). Cierre la placa de Petri y dejar que el sello silaniza durante 7 minutos.
NOTA: Algunos deformación temporal en el sello y / o cambio de color (blanco) puede ser observada. El sello se recuperará su forma original en poco tiempo y no se verá afectado a las estructuras.
NOTA: TMCS produce toxicidad por inhalación y dérmica aguda, y es altamente inflamable (con retrospectiva de ignición capaz de producirse a través de distancias considerables). En consecuencia, se debe utilizar en una campana de gases lejos de la fuentes de ignición. - Coloque el sello de PDMS en el spin-revestidor con las estructuras boca arriba. Ponga una pequeña gota de pocos microlitros (alrededor de 20 l) de PDMS líquido (1:10 w / w reticulante: pre-polímero) en la parte superior de las estructuras. Spin-capa a 1500 rpm durante 30 seg para depositar una fina capa de PDMS en la parte superior de las estructuras.
NOTA: Si el sello no encaja en el lugar mandril spin-revestidor el sello en la parte superior de una tapa de caja de Petri con un pequeño agujero en su centro. - Coloque el sello en el horno a 65 ° C durante 4 horas para curar la capa de PDMS spin-revestido depositado.
- Activar la capa delgada de PDMS colocando el sello PDMS boca arriba, junto con un cubreobjetos de vidrio # 0 de 25 mm de diámetro, se utiliza el filtro de plasma de oxígeno durante 30 segundos. Proceder rápidamente con el paso siguiente.
NOTA: Cubreobjetos con otros espesores, formas y dimensiones se puede utilizar también. Sin embargo, algunas estructuras celulares podrían ser difíciles de visualizar en función del espesor cubreobjetos seleccionado y objetivoampliación y / o NA y / o la distancia de trabajo. Consultar ficha de objetivo. - Colocar en contacto el sello (el lado con la capa delgada spin-revestido) con el cubreobjetos de vidrio. Presione suavemente todo alrededor de la superficie del sello con pinzas para hacer la 'unión'. Por último, mantener una presión constante en la parte superior del sello por alrededor de 10 segundos.
- Después de 30 minutos suavemente «piel», el sello de la cubreobjetos con el fin de "liberar" '' hueveras (ver Figura 1). Enjuague bien con etanol y se seca. Si PDMS '' hueveras no están bien adheridas en el cubreobjetos de vidrio (es decir, que se desprenden durante la "pelando" paso), tenga en cuenta el ajuste de la configuración del limpiador de plasma y reinicie en el paso 1.3.1.5.
NOTA: Este paso es delicado. Prestar atención a fin de evitar la rotura del cubreobjetos y / o desprendimiento de la capa de PDMS delgada. - Pegar un trozo pequeño (mango) de PDMS curadas de 1 mm x 1mm x 3 mm en el volumen en el borde del cubreobjetos con una pequeña gota de PDMS líquidos y curar el PDMS como antes. Esto facilitará la manipulación de la muestra después (véase la Figura 1). Este paso es opcional.
- Activar el sello PDMS fabricado por tratamiento con plasma de oxígeno durante 30 segundos. Almacenar temporalmente los sellos activadas en una placa de Petri cerrada para evitar la acumulación de polvo.
- estrategia 2
- Hidrofilizar el PDMS sellos fabricados por tratamiento con plasma de oxígeno durante 30 segundos. Almacenar temporalmente los sellos activadas en una placa de Petri cerrada para evitar la acumulación de polvo.
NOTA: Ajuste el tiempo de exposición si se utilizan otros gases para el plasma. - Hidrofilizar el cubreobjetos de vidrio de diámetro # 0 de tratamiento con plasma de oxígeno 25 mm a 15 W durante 30 s. Proceder rápidamente con el paso siguiente.
NOTA: Cubreobjetos con otros espesores, formas y dimensiones se puede utilizar también. Sin embargo, las estructuras celulares serán difíciles de visualizar en función del espesor cubreobjetos seleccionado y características objetivas (ver nota anterior). - Spin-capa una pequeña gota de PDMS (01:10 w / w reticulante: pre-polYmer) de pocos microlitros sobre el cubreobjetos de vidrio. Spin-capa a 1500 rpm durante 30 segundos para un espesor final de alrededor de 50 micras.
- Pegar un trozo pequeño (mango) de PDMS curadas de 1 mm x 1 mm x 3 mm en el volumen en el borde del cubreobjetos con una pequeña gota de PDMS líquidos y curar los PDMS como antes. Esto facilitará la manipulación de la muestra después (véase la Figura 1). Este paso es opcional.
- Almacenar temporalmente los cubreobjetos PDMS recubrimiento sobre un trapo limpio en el interior de una caja de Petri para protegerlo de la deposición de polvo.
- Ponga una gota de reactivo de silanización en la parte superior de cada sello y dejar que se evapore durante 1-2 minutos. A continuación, se seca bajo una corriente de N2.
NOTA: En este paso, una deformación temporal del sello se puede observar durante la evaporación. El sello se recuperará su forma original después de secar con N 2 sin ninguna deformación permanente de las microestructuras. - Caer muy suavemente el sello silanizada en la parte superior de laPDMS-spin recubierto cubreobjetos de vidrio almacenada en la placa de Petri. Asegúrese de que ambas partes están completamente paralelas durante el contacto. Evite presionar o mover el sello después de colocarla en el cubreobjetos recubiertos de PDMS.
- Coloque la placa de Petri con las muestras en el vacío durante 1-2 horas para eliminar las burbujas de aire.
NOTA: Asegurarse de que las muestras son totalmente horizontal para evitar el desplazamiento del sello. También evite la vibración potencialmente causada por la bomba de vacío. - Colocar las muestras en el horno a 65 ° C durante 4 h.
- Con cuidado, retire el sello para revelar '' hueveras. Enjuague bien con etanol y se seca.
la práctica es necesaria en este punto: NOTA. Prestar atención en evitar la rotura del cubreobjetos y / o desprendimiento de la capa de PDMS delgada.
- Hidrofilizar el PDMS sellos fabricados por tratamiento con plasma de oxígeno durante 30 segundos. Almacenar temporalmente los sellos activadas en una placa de Petri cerrada para evitar la acumulación de polvo.
- estrategia 1
2. La introducción de células en el '' Eggcups
Con el fin de introducir dentro de células de mamífero '' hueveras, ne superficie de PDMSeds a ser funcionalizado con proteínas de adhesión de la matriz extracelular. Este ejemplo utiliza la fibronectina pero otras proteínas de interés, como el colágeno, se podría utilizar.
- Hidrofilizar las 'hueveras' en el filtro de plasma de oxígeno durante 30 segundos.
NOTA: Optimizar los parámetros si es necesario. - Preparar una solución en PBS 1x de 20 mg ml-1 de fibronectina de fuentes bovinas.
- Esterilizar las hueveras '' con UV durante 5 minutos. Depositar una pequeña gota (alrededor de 20 a 50 l) de la solución de fibronectina para cubrir toda el área 'hueveras' y se incuba durante 1 hora a RT. Evita que la muestra se seque.
- Enjuague suavemente las hueveras '' con PBS 1x. Repetir 3 veces.
NOTA: La muestra está lista para usar inmediatamente o se almacenaron a 4 ° C en la oscuridad durante varias semanas. - Introducir una pieza de plástico a medida cilíndrica de 63 mm de altura, 26 mm de radio externo y 7 mm de cotas de radio internos en un tubo de 50 ml (véaseLa Figura 2) 20
PRECAUCIÓN: El uso artículos UV-esterilizado o los esterilizar antes de su uso.
NOTA: Esta pieza puede ser fácilmente fabricado en el laboratorio. o por cualquier taller de máquinas disponibles. - Dicho de 13 ml de medio de cultivo celular en el interior del tubo (véase la Tabla 1). El medio debe llenar al menos 2 cm por encima de la pieza cilíndrica para asegurar la inmersión completa de la muestra.
NOTA: Para obtener información detallada de los tipos de células específicas, y otros sistemas modelo como la levadura o C. elegans embriones, y el medio correspondiente, se indican en la sección 5 y la Tabla 1. El protocolo descrito se ha optimizado para HeLa, las células NIH3T3, y otras líneas celulares (véase la Tabla 1). - Introducir suavemente los 'hueveras' en el interior del tubo y paralelo al lado superior de la pieza de plástico. Use pinzas cortantes para contener la muestra usando el mango PDMS. Presione suavemente el cubreobjetos hasta que se encuentra en la parte superior de la cara superior de la pieza de plástico, de las Naciones Unidashasta que esté completamente sumergida (ver Figura 2).
NOTA: Se recomienda utilizar pinzas afiladas y rectas. Con unas pinzas curvas, la manipulación de la muestra es difícil y puede causar la rotura. - células de cultivo hasta 80-100% de confluencia en una placa de Petri P60 y recoger ellos por tripsinización.
NOTA: Las células pueden ser de tipo salvaje, transfectadas o tratados con cualquier fármaco de interés.
NOTA: Evitar la formación de agregados de células que eviten las células individuales para entrar en las hueveras ''. Para optimizar este paso, la pipeta hacia arriba y abajo a fondo después de tripsinización. - células en medio de cultivo de 5 ml volver a suspender. Pipetear 200 l de células en la parte superior de las hueveras ''.
NOTA: Caída de las células lo más centrado posible en la parte superior de las hueveras '', pero evitando el contacto físico. Esto evitará la rotura y / o daño de la muestra. - Se centrifuga a 1.800 g durante 2 min.
NOTA: Después de la primera centrifugación, el registro de un micrófonoROSCOPE el porcentaje de llenado de las hueveras ''. - Pipeta de nuevo 200 l de células en la parte superior de las hueveras '' y se centrifuga a 1.800 g durante 2 min. Repetir para un total de tres veces con el fin de optimizar el porcentaje de llenado.
NOTA: Después de la última centrifugación, consulte con un microscopio el porcentaje de llenado de hueveras ''. Si es necesario, repetir las etapas de llenado + centrifugación hasta alcanzar el porcentaje de llenado deseado. - Retire la muestra del tubo utilizando las pinzas cortantes sostienen la manija PDMS. Asegúrese de tener cuidado en no las células perturbadoras '' que se celebran en las hueveras '' (ver Figura 2).
- Colocar la muestra en una placa de Petri con medio. Enjuague para eliminar el exceso de células que no están en los 'hueveras' pipeteando arriba y abajo tres veces suavemente junto a cada lado (un total de 4 lados) de la matriz de microestructura.
NOTA: El pipeteo con demasiada fuerza puede liberaralgunas células fuera del área de 'hueveras'. - Sustituir el medio con medio fresco para eliminar las células nonattached.
NOTA: En este paso de un fármaco de interés se puede añadir. - Fijar las células o prepararlos para la etapa de lapso de tiempo imaging.See 4.1.
3. Observación de Cellular Dynamics activa en "Eggcups ': cytokinetic cierre del anillo
NOTA: Este ejemplo utiliza células HeLa que se transfectan con MYH10-GFP y Lifeact-mCherry de miosina y actina, respectivamente, moléculas activas clave involucrados en el cierre del anillo cytokinetic durante la mitosis celular. El dispositivo se prepara con microcavidades de 25 micras de diámetro. Por su observación, se utilizó un microscopio invertido de epifluorescencia, equipado con un objetivo de aceite 60X (1,40 NA, DIC, Plan de Apo) y GFP (miosina) y TxRed (actina) filtros. Alternativamente se usó un microscopio confocal en posición vertical, equipado con un 25X o 63X HCX IR APO objetivo L de agua (0,95 NA). Por esta example, es muy recomendable para sincronizar las células utilizando el bloque doble timidina, bloque mitótico o mitótico método de 21-24 sacudida-off.
NOTA: El espesor del PDMS utilizados para las hueveras '' permite el uso de una variedad de objetivos, tanto en microscopios invertidos y en posición vertical posicionado.
- Place '' hueveras en un soporte de microscopio y llenarlo con 1 ml de FCS medio L-15 de observación de 10%. Para evitar la evaporación, colocar una tapa de vidrio en la parte superior del soporte o aplicar una fina capa de aceite mineral en la parte superior de la medium.Select el objetivo aceite de 60X.
NOTA: medio L-15 es adecuado para distintos del CO 2 atmósferas. Tenga en cuenta también que algunos compuestos de DMEM son auto-fluorescente. Al utilizar este medio, se recomienda photobleach los compuestos fluorescentes mediante la iluminación con una lámpara de alta intensidad durante 1-2 horas.
NOTA: Evitar el uso de tapas de plástico cuando se trabaja con imágenes DIC. - Coloque el soporte con hueveras '' y obsermedio vación en el microscopio. Enfoque cuidadosamente el uso de luz de campo claro hasta que las hueveras '', y las células están en el mismo plano de la observación.
- Abra el programa y ajustar los parámetros. Seleccione los filtros TxRed y GFP para actina y la miosina; ajustar el tiempo de exposición para cada canal. Una velocidad de adquisición típico es de 5 seg para ambos canales.
NOTA: El tiempo de exposición puede tener que ajustarse en función de la configuración utilizada, colorantes u otros orgánulos celulares de interés. - Seleccione la región de interés y buscar un anillo cytokinetic utilizando el canal de GFP o TxRed. Enfocar con precisión.
NOTA: El anillo es más agudo en la miosina y más fácil de reconocer. - Ejecutar la adquisición automática en ambos canales hasta que el anillo está completamente cerrada.
NOTA: Algunos photobleaching se puede observar. Ajustar los parámetros del microscopio con el fin de reducirlo.
4. Observación de los orgánulos celulares fijos en las hueveras ''
Este paso puede realizarse antes o después de la etapa # 3. Las células se pueden fijar directamente después de la etapa de centrifugación y se tiñeron para el orgánulo de interés o después de la observación en el microscopio. Este ejemplo muestra la tinción de las fibras aparato de Golgi, núcleo y actina en fibroblastos NIH3T3 en 'hueveras.
- La fijación de las células en el '' Eggcups
- Preparar 3% de paraformaldehído (PFA) y calentar a 37 ° C. Retire la muestra '' hueveras del tubo de 50 ml (o el titular microscopio) y colocarlo dentro de una cápsula de Petri P35. Se lava una vez con PBS 1x.
NOTA: Los protocolos para la preparación de 3% de paraformaldehído están ampliamente disponibles en otros lugares.
PRECAUCIÓN: Use guantes de nitrilo y protección para los ojos durante la preparación de PFA. - Eliminar por completo el PBS y colocar 1 ml de 3% PFA y se incuba durante 17 min. Retire la PFA y enjuague dos veces con 1 ml de PBS 1X. permeabilizar las células utilizando 1 ml de 0,5% Tritpor 3 min y se lava dos veces con PBS 1x para 5 min.
- Preparar 3% de paraformaldehído (PFA) y calentar a 37 ° C. Retire la muestra '' hueveras del tubo de 50 ml (o el titular microscopio) y colocarlo dentro de una cápsula de Petri P35. Se lava una vez con PBS 1x.
- La tinción de las células en las hueveras ''
- Se incuban las células de Golgi tinción aparato con el anticuerpo primario policlonal de conejo anti-Giantin en una dilución 1: 500 en PBS. Coloque una gota de 100 l de solución de anticuerpos en una hoja de película de plástico y se incuban las células dentro de las hueveras '' boca abajo durante 45 minutos.
NOTA: Proteger la muestra con una cubierta para evitar que se seque. - Soltar con cuidado las hueveras '' y colocarlos en una placa de Petri P35. Enjuagar 3 veces, 5 minutos cada uno, con PBS 1x.
- Preparar un cóctel en PBS con el anticuerpo secundario Cy3 de cabra anti-conejo (1: 1000) y con faloidina Alexa Fluor 488 (1: 200) para la tinción de fibras de estrés de actina.
- Se incuban las células con una caída de 100 l de solución de anticuerpo sobre una hoja de película de plástico y se incuban las células en el interior de los '' hueveras boca abajo durante 45 min.
- Lanzamiento cuidadosamente la 'eggcups 'y colocarlos en una placa de Petri P35. Enjuagar 3 veces, 5 minutos cada uno, con PBS 1x.
- Se incuban las células para la tinción del núcleo colocando una gota de 100 l de 1 mg ml -1 DAPI en PBS sobre una lámina de película de plástico y se incuban las células dentro de las hueveras '' boca abajo durante 45 minutos. Este paso se puede realizar con el paso 4.2.3.
- Soltar con cuidado las hueveras '' y colocarlos en una placa de Petri P35. Enjuagar 3 veces, 5 minutos cada uno, con PBS 1x.
- células de montaje utilizando un glicerol 15 l: PBS (1: 1 v / v) en un portaobjetos de microscopio estándar y sellar la muestra con esmalte de uñas para evitar la desecación.
NOTA: Dependiendo del espesor '' hueveras, montaje puede ser difícil. Se recomienda almacenar entonces la muestra en una placa de Petri P35 en PBS, protegido de secado.
- Se incuban las células de Golgi tinción aparato con el anticuerpo primario policlonal de conejo anti-Giantin en una dilución 1: 500 en PBS. Coloque una gota de 100 l de solución de anticuerpos en una hoja de película de plástico y se incuban las células dentro de las hueveras '' boca abajo durante 45 minutos.
- Observación microscopio
NOTA: En este ejemplo se utiliza un microscopio confocal en posición vertical, equipado con detectores PMT y de híbridos. Un 25X o 63 X HCX IR APO objetivo L de agua (0,95 NA) fue seleccionada para proporcionar un amplio campo de la muestra y mostrar la aplicabilidad del dispositivo para aplicaciones de alto contenido de detección.- Seleccione el objetivo 25X o 63X agua.
NOTA: Diferentes objetivos pueden ser utilizados dependiendo de la aplicación y de la señal. Sin embargo, se recomienda el uso de objetivos de gran apertura numérica. - Coloque la muestra fijada con las hueveras '' y centrarse cuidadosamente usando la luz de campo claro (contraste de fases o CID) hasta que las hueveras '' y las células se encuentran en el plano de observación.
- Abra el programa y ajustar los parámetros. Seleccione los filtros GFP, Cy3 y DAPI para actina, Golgi y el núcleo de observación, respectivamente; ajustar el tiempo de exposición para todos los canales.
NOTA: El tiempo de exposición puede tener que ajustarse en función de la configuración. - Seleccionar y enfocar la región de interés; iniciar la captura de imágenes (ver Figura 3).
- Seleccione el objetivo 25X o 63X agua.
- Las células de levadura de fisión y de florecimiento
NOTA: Este ejemplo utiliza células de levadura de fisión, que estén etiquetadas RLC1-mCherry y la EC-GFP de miosina y actina, respectivamente. Las células de levadura en ciernes no están etiquetados con fluorescencia aquí. Para la observación levadura de fisión se utilizó un hilado microscopio confocal de disco invertida. Se utilizó un objetivo de aceite de 100X HCX PL APO CS (1,4 NA) para todas las adquisiciones. Alternativamente, también se observaron las células usando un microscopio de contraste de fases invertido equipado con un objetivo de contraste de aire 20X fase LCPlanFl (0,4 NA). En este ejemplo, el protocolo es idéntico para ambos tipos de células.- Preparar la superficie '' hueveras como se ha descrito anteriormente. Para la fisión y en ciernes células de levadura, preparar cavidades de 5 m de diámetro (véase la Tabla 1). En este caso, la superficie no tiene que ser funcionalizado con proteínas de adhesión.
NOTA: El llenado can ser optimizado mediante el uso de 'hueveras' cónicas. Esta forma capta y retiene las células evitando la liberación durante la etapa de aclarado después de la centrifugación. Llenado porcentaje es óptimo a aproximadamente 80%. Estos '' hueveras cónicas se pueden fabricar por medio de Deep Reactive Ion Etching 13. - Células de levadura Cultura en los medios de cultivo adecuado (véase la Tabla 1) hasta alcanzar una densidad óptica (OD) en el intervalo de 0,2 y 0,8. Sonicar el cultivo de células de levadura para eliminar los agregados.
- Insertar células de levadura en hueveras '' por centrifugación. Por centrifugación, se añadieron 4 ml de células cultivadas en la DO apropiada en el tubo con hueveras ''. Después de la primera centrifugación, agitar suavemente el tubo a las células que no están en las hueveras '' volver a suspender, mientras que las células en las hueveras '' no se vean perturbadas. Sin necesidad de abrir el tubo, se centrifuga de nuevo y repetir este paso dos veces. Esto asegura la deposiciónde células del cultivo en las microcavidades vacías y se incrementará el porcentaje de llenado.
NOTA: Cuando se trabaja con la levadura, se recomienda precalentar la centrífuga a la temperatura de trabajo durante los experimentos
NOTA: El protocolo puede ser una pausa aquí y continuó hasta 12 horas más tarde. En este caso, almacenar la muestra a la temperatura de trabajo y se cubre para evitar la evaporación. - Coloque '' hueveras en un soporte de microscopio y llenar el titular con el medio esterilizado por filtración para obtener imágenes. Ahora enjuagar las células con el mismo medio hasta que las células de levadura flotantes se eliminan de manera eficiente. Tenga cuidado de no molestar a las células en hueveras '' durante el proceso de lavado.
- Seleccione el objetivo aceite de 100X y centrarse cuidadosamente. Abra el programa y ajustar los parámetros. Para la levadura de fisión, seleccione la GFP filtros y TxRed para la actina y la miosina y ajustar el tiempo de exposición para ambos canales. Una velocidad de adquisición normal es de 3 seg.
NOTA: En función deel fluoróforo, el tipo de marcaje y la puesta en marcha, el tiempo de exposición varía para otros sistemas.
- Preparar la superficie '' hueveras como se ha descrito anteriormente. Para la fisión y en ciernes células de levadura, preparar cavidades de 5 m de diámetro (véase la Tabla 1). En este caso, la superficie no tiene que ser funcionalizado con proteínas de adhesión.
- C. elegans embriones
NOTA: En este ejemplo se utiliza C. elegans embriones de 25-30 micras de ancho y 50-55 micras de largo. Los embriones se cultivaron como se indica en 25. Un protocolo simple visual de cómo manipular C. elegans se puede encontrar en 26. La observación se realizó utilizando un microscopio de contraste de fases invertido equipado con un objetivo de 40X de aire 0,55 NA.- Prepare la superficie '' hueveras como se describió anteriormente y 25 micras de diámetro (ver Tabla 1). En este caso, la superficie no tiene que ser funcionalizado con proteínas de adhesión.
- Cultura del C. elegans embriones en el medio de cultivo adecuado (ver Tabla 1).
- Inserte embriones en hueveras '' por centrifugación como se ha descrito anteriormente (ver sección 2.6 a 2.12) utilizando agua ultrapura como medio de cultivo.
NOTA: Los embriones fueron 'comportando' normalmente en agua ultrapura para la duración del experimento. Alternativamente utilizar un tampón M9 fisiológica para los experimentos a largo plazo. - Enjuagar la muestra como se describe anteriormente (véase el apartado 2.14). Coloque las hueveras '' en un soporte de microscopio. Seleccione el objetivo 40X de aire y centrarse cuidadosamente. Abra el programa y ajustar los parámetros. Seleccione una velocidad de adquisición de 3 seg.
Resultados
Las hueveras '' (EC) son una metodología novedosa de alto contenido de cribado que permite la visualización de las células y embriones orientadas en un entorno 3D. Además, algunos procesos celulares, que son difíciles de observar en cultivos estándar 2D (planos), pueden ser observados por este nuevo método. La figura 1a muestra un resumen del procedimiento de la microfabricación CE (ver también la Sección 1 en el protocolo anteriormente descrito ). El método es simple, rápido, eficiente y sin ningún requisito de equipo especial. Figura 1b y 1c muestra una imagen de microscopio electrónico de barrido ampliada de '' hueveras, respectivamente foto a gran escala y. Como se puede observar, su forma y tamaño son muy regular. Este método es muy flexible; diferentes formas y tamaños pueden ser fácilmente fabricados y adaptados para diferentes sistemas modelo. Se seleccionaron las dimensiones de'eggcups' de la siguiente manera: Dimensionesde células que se someten a la división se midieron en superficies 2D: tienen una forma esférica y su diámetro se tomó como una buena indicación para el diámetro de la CE. Las células en'eggcups' alargado y orientar a lo largo de su eje longitudinal durante la división celular, por ejemplo. Esta dimensión depende del sistema - células y embriones - por lo que esta dimensión se debe evaluar en cada caso.
La Figura 2 muestra el material necesario (Figura 2a) y un protocolo paso a paso (Figura 2b) acerca de cómo utilizar las hueveras '' (véase también la sección 2 en el protocolo descrito anteriormente). El llenado de la CE con células de interés (u otros sistemas modelo) es muy simple y rápido. Normalmente, se tarda menos de 20 a 30 min, que también incluye el tiempo de tripsinización de células. Después del llenado, las muestras pueden ser utilizados para estudiar procesos activos (imágenes en vivo) o pueden ser fijadas y teñidas para la visualización de orgánulos de interest (ver también las secciones 3 y 4 en el protocolo descrito anteriormente).
En las superficies planas, las células muestran respuestas heterogéneas y fenotipos extremos de los orgánulos celulares. De hecho, se ha sugerido que las fibras de estrés de actina (y otros orgánulos celulares) son artefactos de las condiciones de cultivo 1. Para probar esta hipótesis, se cultivaron células NIH3T3 tanto en 'hueveras' 3D y en las superficies planas y se compararon los fenotipos de los diferentes orgánulos celulares, es decir, las fibras de estrés de actina, aparato de Golgi y los núcleos. La Figura 3 muestra un ejemplo de cómo se organizan las células en ambas configuraciones. En CE, las células se distribuyen en una matriz ordenada que muestra un fenotipo homogénea esférica similar (Figura 3a). En las superficies planas, las células muestran la típica desordenada, extensión y morfología heterogénea (Figura 3b). También hay diferencias significativas en la estructura del citoesqueleto. En particular, las células en R16; hueveras 'muestran una reducción en el número de fibras de estrés en comparación con superficies planas. Esto se ve confirmado en el 3D reconstruido imágenes en las que no hay fibras de estrés claros son visibles (véase la Figura 3c - d). Esto confirma que algunas estructuras celulares se magnifican en cultivos 2D. Esto también está de acuerdo con las observaciones realizadas in vivo donde no se pueden identificar las fibras de estrés.
El aparato de Golgi también muestra una variación significativa en su fenotipo en función de la condición de cultivo (véase la Figura 4). El aparato de Golgi en cultivos 2D muestra típicamente un fenotipo extendido 'abrazar' la periferia del núcleo mientras que en hueveras '' que muestra un fenotipo más compactado (véase la Figura 4a - b). Con el fin de simular una manipulación de detección de drogas, también se evaluó el efecto de los fármacos sobre las células cultivadas en ambos entornos. Seleccionamos Blebbistatin pppgy porque interrumpe las fibras de estrés de actina y podría tener un efecto sobre la morfología de Golgi (véase la Figura 3c - d). Dado que el aparato de Golgi se encuentra junto al núcleo de la célula, este medicamento también podría tener un efecto en su arquitectura. En primer lugar, se observó que las células tratadas con este fármaco mostraron una morfología menos regular y uniforme en comparación con las células de tipo salvaje (WT) (véase la figura 3c - d). Por último, comparamos y cuantificado el fenotipo observado en Golgi '' hueveras y en superficies planas (véase la Figura 4c). Hemos observado que en las superficies 2D células mostraron en su mayoría un fenotipo extendido, mientras que en las células '' hueveras mostraron un fenotipo más compactado. No se observó a pesar de una notable diferencia entre el TE y las células tratadas con Blebbistatin.
Por último, en las superficies 2D el núcleo de la célula está orientada al azar, mientras que para las células en CE que está orientado ortogonalmente con respecto al plano XY en tantoWT y Blebbistatin células tratadas (ver Figura 5a - c). Esto pone de relieve la resistencia del dispositivo a orgánulos celulares orientar, similar a un ex aplicación del método para orientar el plano de observación del anillo cytokinetic en levaduras y células de mamíferos 10,12,13. Finalmente Estudiamos cómo la esfericidad núcleo (define como ψ = [π 1/3 6V n 2/3] / A n, donde V n es el volumen del núcleo y A n su área de superficie) se vio afectada dependiendo de la condición de cultivo y sobre el tratamiento de células con Blebbistatin. Figura 5D muestra las distribuciones correspondientes de ψ. No se observó una diferencia para WT WT plana vs CE, que revela que la CE no están afectando a la esfericidad normal de las células. Sin embargo, se observó unadiferencia al comparar WT CE a Blebb CE sugiere que la CE están revelando un efecto real del fármaco que está enmascarado en 2D.
estudios de células vivas utilizando hueveras '' permiten también la identificación de nuevos procesos activos que no son visibles en los cultivos convencionales. Hacemos enchapado en células CE y se visualizó la división celular. La figura 6 muestra una secuencia de imágenes del cierre del anillo cytokinetic durante la mitosis celular. El dispositivo 'hueveras' permite una visualización completa del anillo, mientras que los cultivos 2D estándar sólo muestra dos zonas que corresponden a un solo plano 10. Reconstrucción del anillo a partir de una secuencia de imágenes z-pila utilizando cultivos 2D se puede hacer 27, pero la información importante se pierde. La calidad se ve disminuida debido a la baja resolución de z y procesos dinámicos no se pueden resolver. La actina y la miosina son las proteínas clave en la generación de la fuerza de la división celular. Su dinámica no puede be fotografiado y estudiado en 2D de cultivo (Figura 6a), mientras que con hueveras '' se revela inmediatamente. Hemos identificado nuevas estructuras y procesos: en las células HeLa que encontramos acumulaciones periódicas de la miosina 17. Estas acumulaciones se mueven radialmente como el anillo se cierra (Figura 6b). En la levadura de fisión también encontramos la falta de homogeneidad en la miosina y actina (Figura 6c, derecha) 17. En contraste con lo que vemos en las células HeLa, que giran en el anillo durante el cierre. La velocidad está en el rango de micras min -1 y no sería resoluble por z reconstrucción con microscopios estándar. Por último el anillo cytokinetic puede estudiarse aún más por la tinción de sus componentes. Encontramos que hay una acumulación de fosfotirosina en las proximidades del anillo (Figura 6d). También se puede demostrar que se anillin colocalizing en el anillo (Figura 6e). Por tinción de las células en esta orientación, we anillin revelan que también muestra una distribución no homogénea.
También se aplicaron las hueveras '' a diferentes sistemas de modelos: se informó de células de mamífero, levadura de fisión, pero también a prueba levadura en ciernes y C. elegans (véase la Figura 7a - e). En este caso, el protocolo fue adaptado para cada sistema específico en términos de medios de cultivo, cavidades tamaño y morfología (ver Tabla 1). Como ejemplo, en forma de V cónica 'hueveras eran la morfología óptima para la inmovilización de la levadura de fisión de manera eficiente 12, en lugar de completamente cilíndrico (o en forma de U) forma utilizado para las células de mamíferos 13. Esto permitió probar el efecto de diferentes fármacos citoesqueleto con potencial aplicación en la investigación biológica. Esto demuestra la flexibilidad y la fiabilidad de la metodología desarrollada.
Además, la disposición altamente ordenada de las células permite unafácil, automatizado lectura de datos de la fluorescencia de las células individuales. Se ilustra mediante la inserción de células NIH3T3 que expresan GFP en hueveras '' (Figura 8a). La posición de la célula se puede reconocer fácilmente y el nivel de expresión medido correspondiente. La Figura 8b muestra la distribución de las señales de fluorescencia. Esto se puede aplicar a cualquier lectura de salida (inmunofluorescencia, reporteros fluorescentes en las células, por ejemplo).
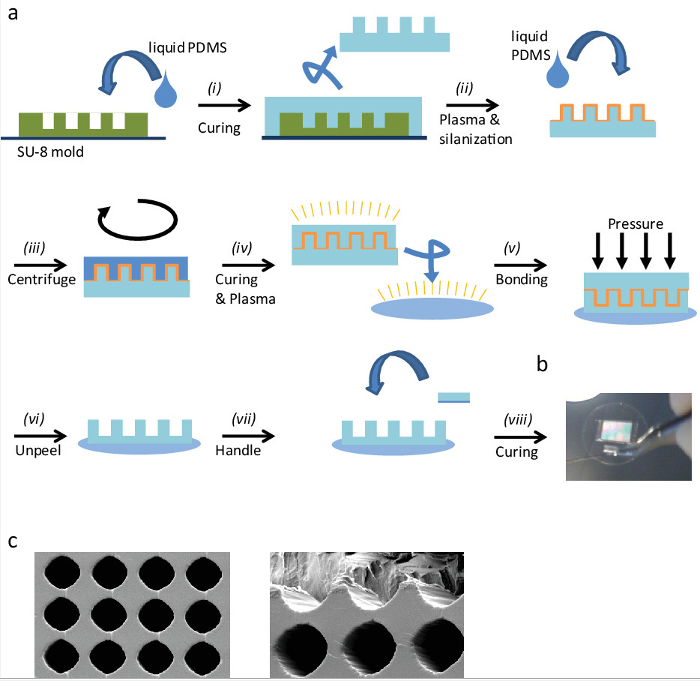
Figura 1: La fabricación de hueveras '' (a) Descripción esquemática del procedimiento de fabricación de hueveras '' por moldeo réplica:. (I) Pour PDMS líquido en el molde SU-8 y la cura. (Ii) Recorte el sello y extraerlo con cuidado de la superficie, entonces el plasma activarlo para que silanizar. (Iii) Verter líquidos en el PDMS un sello silanizadad centrifugar para obtener una capa delgada de PDMS. (Iv) Después del curado de la capa de PDMS, plasma activar sello tanto, los PDMS cubiertos y un cubreobjetos de vidrio. (V) de plasma se une tanto al aplicar una presión suave y homogénea. (Vi) Después de la unión de plasma, retirar con cuidado el sello de descubrir la superficie '' hueveras. (Vii) Para simplificar el manejo en los próximos pasos, añadir una pequeña pieza de mango PDMS. Enlazar la pieza de PDMS para el cubreobjetos por encolado con PDMS líquidos y (viii) la cura entonces en el horno. (B) Imagen de un cubreobjetos de 25 mm con PDMS '' hueveras y un mango. Imágenes de microscopio (c) de barrido de electrones de '' hueveras PDMS. La distancia entre los centros de hueveras '' es de 30 m, y su diámetro de aproximadamente 25 micras. (Izquierda) Vista superior. (Derecha) se cortan 'Eggcups' a la imagen de la parte interior. Por favor, haga clic aquí para competir wa versión más grande de esta figura.

Figura 2: (a) los elementos necesarios para el llenado de la CE. (1) tubo de 50 ml; (2) pieza cilíndrica (vista superior y lateral); (3) medio de cultivo celular; (4) '' hueveras; (5) pinzas cortantes. (B) Esquema del proceso de llenado CE. (I) una pieza cilíndrica se introduce primero en un tubo de 50 ml y se llenó con 13 ml de medio de cultivo celular. A continuación, (ii) las hueveras '' se depositan suavemente en la parte superior de la pieza cilíndrica con unas pinzas cortantes para manipular la CE con el pequeño trozo de PDMS. (Iii) Las células en la densidad apropiada se pipetean en la parte superior de la CE. (Iv) Las células se introducen en las hueveras '' por centrifugación. (V) Finalmente, la muestra se libera suavemente hacia fuera del tubo y que está listo para usar. m / archivos / ftp_upload / 51880 / 51880fig2large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
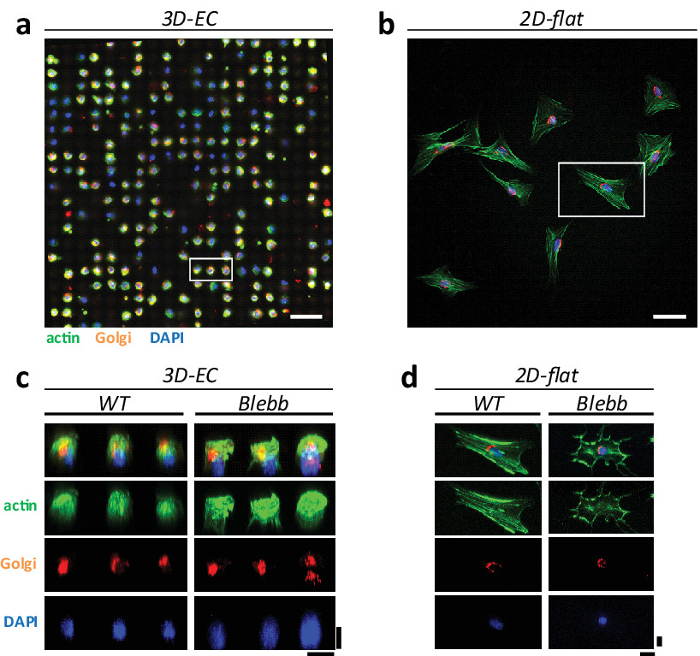
Figura 3: Comparación de los fenotipos de células en 3D '' hueveras y superficies planas 2D. La microscopía confocal (25X objetivo agua, 0,95 NA, Leica) Imagen de las células NIH3T3 en CE (a) formar una matriz ordenada, y que muestran un fenotipo esférica homogénea, y en (b) la cultura plana 2D estándar, distribuidos al azar con fenotipos heterogéneos. Las células se tiñeron para la actina (en verde), aparato de Golgi (de color naranja) y el núcleo (en azul). Barras de escala = 100 m. La reconstrucción (c) 3D de las células en CE y (d) en superficies planas para WT y las células tratadas con Blebbistatin. Barras de escala = 20 m.880 / 51880fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Estudio de Golgi NIH3T3 fenotipo aparato esquemática y muestra la imagen de la clasificación fenotipo de Golgi de las células en (a) plana y (b) CE.. Las células se clasifican como compactado, extendida o fragmentado en función de la α-valor. (C) Cuantificación de los fenotipos de Golgi. Las barras de escala = 10 micras. Por favor, haga clic aquí para ver una versión más grande de esta figura.
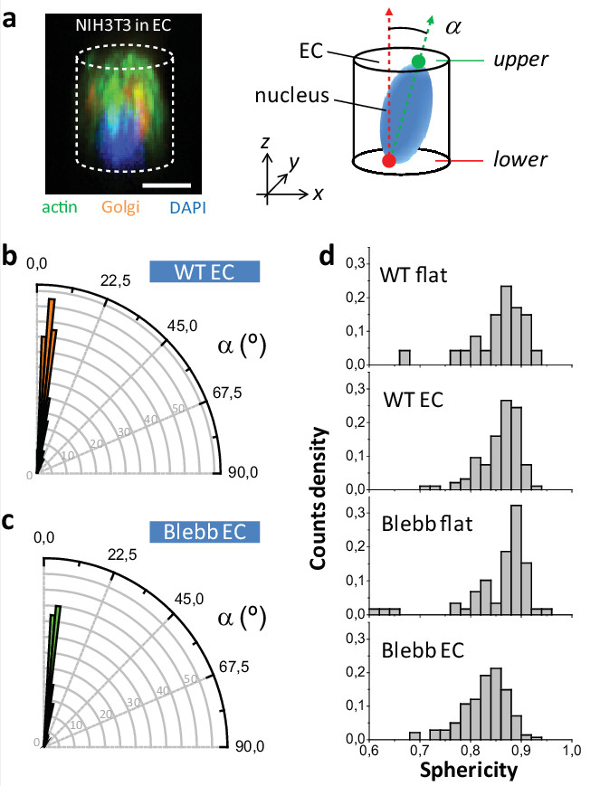
Figura 5: Estudio de NIH3T3 fenotipo núcleo. (a) Imagen de microscopia confocal de una célula NIH3T3 dentro de un CE y manchados por la actina (en verde) (izquierda), aparato de Golgi (de color naranja) y el núcleo (en azul). (Derecha) Esquema de orientación de los núcleos dentro de la CE. (B) la distribución angular de los núcleos dentro de CE para WT y las células tratadas con Blebbistatin (c). (D) los valores de esfericidad núcleo de las células WT y tratados con Blebbistatin tanto para la CE y las superficies planas (P [WT CE -Blebb CE] <0,001, P [Blebb plana -Blebb CE] <000,1; n = 47 WT plana, n WT EC = 94, n = 59 Blebb plana, n Blebb EC = 141 células). Barra de escala = 10 micras. Haga clic aquí para ver una versión más grande de esta figura.
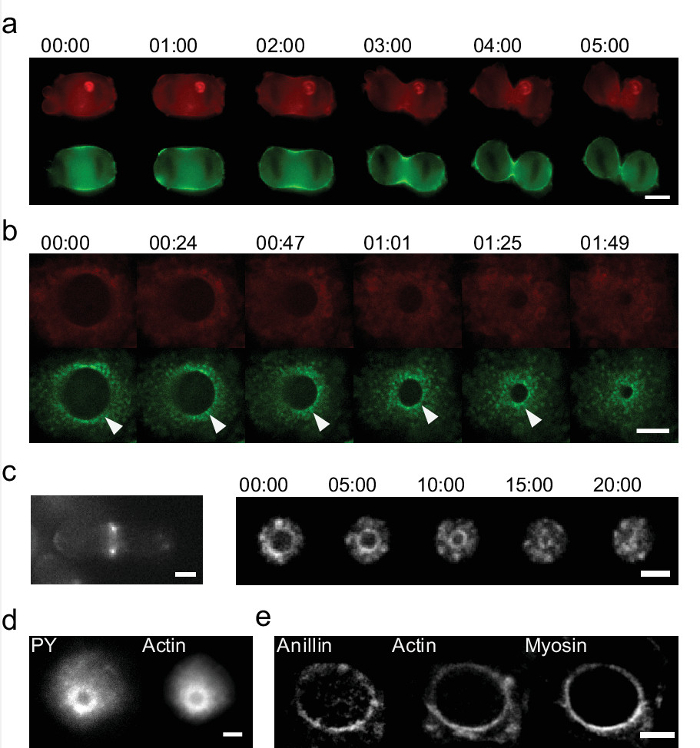
Figura 6: Estudio de detalle del anillo cytokinetic en muestras vivas y fijas y en dos sistemas que utilizan '' hueveras (a) Secuencia temporal del anillo cytokinetic mediante cultivo estándar 2D in vitro.. Sólo dos puntos brillantes en la actina (Lifeact-mCherry, rojo) y la miosina (GFP etiquetados, verde) son visibles en el surco de segmentación de las células HeLa (barra de escala = 10 micras). (B) Secuencia temporal del cierre para el anillo cytokinetic en células HeLa durante la mitosis mediante hueveras ''. Las imágenes muestran la actina (en rojo) y la miosina (verde). 'Eggcups' permiten la identificación de las acumulaciones aún miosina. Un ejemplo se pone de relieve con una punta de flecha. (Barra de escala = 5 micras). (C) El anillo cytokinetic también puede ser visualizado en la levadura de fisión. (Izquierda) Las células se encuentran en una superficie plana, la cito anillo cinética sólo es visible como dos puntos (derecha) Las células en hueveras '':. todo el cierre puede ser capturado. Actina se etiqueta con CC-GFP (Barras de escala = 2 m). Tiempo en min: seg. (D - e) Los ejemplos de anillos cytokinetic manchados. (D) La actina-GFP expresando células HeLa se tiñen para fosfotirosina (PY), que también muestra la señal en el anillo (Barra de escala = 5 micras). Células (e) HeLa que expresan GFP etiquetados miosina y Lifeact-mCherry (actina) se tiñeron para anillin. Anillin se revela a localizarse en el anillo cytokinetic y menos concentrado en la corteza. Muestra co-localización con la actina y la miosina (Barra de escala = 5 micras). Por favor, haga clic aquí para ver una versión más grande de esta figura.
80 / 51880fig7.jpg "/>
Figura 7:. La aplicación de las hueveras '' a otros tipos de células y sistemas modelo (a) U2OS (osteosarcoma humano). El recuadro muestra una célula en división. (Barra de escala = 20 micras). (B) las células NIH3T3 que expresan GFP. La diferencia en los niveles de expresión se puede leer fácilmente (barra de escala = 20 m). (C) las células SW480 (Barra de escala = 20 micras). (D) la levadura en ciernes; su tiempo de ciclo es sin cambios. (Barra de escala = 10 micras). (E) C. elegans gusanos;. (izquierda) en una superficie plana (derecha) '' hueveras, embrión se ve desde una perspectiva oculta lo contrario. (Barras de escala = 10 m). Tiempo en min: Sec. Haga clic aquí para ver una versión más grande de esta figura.

Figura 8: La organización de una serie de '' hueveras permite un análisis automatizado de la población de células (a) en las células NIH3T3 (CE Barra de escala = 20 micras).. Tienen diferentes niveles de expresión de GFP. (B) el reconocimiento automatizado de la posición de la célula permite un análisis individual del nivel de expresión. Se resume en el histograma de la expresión de GFP de la población celular. Por favor, haga clic aquí para ver una versión más grande de esta figura.
| Sistema modelo | Tipo | Medio cultural | observación Medio | '' hueveras de diámetro (μ;metro) | Comentarios / Descripción |
| Células mamíferas | NIH3T3 | 10% BCS DMEM de alta glucosa | 10% BCS L-15 | 20 | Otras líneas estables de células, como REF52 o MDCK, así como líneas de células primarias, células cancerosas y / o células madre también se pueden insertar en los 'hueveras. |
| HeLa | 10% de FCS DMEM de alta glucosa | 10% de FCS L-15 | 25 | Disponible a partir de muchas fuentes diferentes. | |
| U2OS | 10% de FCS DMEM de alta glucosa | 10% de FCS L-15 | 20-25 | Disponible a partir de muchas fuentes diferentes. | |
| SW480 | 10% de FCS DMEM de alta glucosa | 10% de FCS L-15 | 17-20 | Disponible a partir de muchas fuentes diferentes. | |
| Levadura | La levadura de fisión | agarplaca (YE5S) y líquidos medios (YE5S y EMM5S) | Esterilizada por filtración de medios EMM (ver la lista de materiales) | 5 | La superficie no necesita ser funcionalizado con proteínas adhesivas. |
| La levadura en ciernes | placa de agar (YPD) y líquidos medios de comunicación (YEPD y SD) | medios SD | 5 | La superficie no necesita ser funcionalizado con proteínas adhesivas. | |
| Embrión | C. elegans | placa de NGM | agua ultra pura | 25 | Alternativamente medio M9 se puede utilizar para experimentos a largo plazo. La receta de esta solución salada se puede encontrar aquí: http://cshprotocols.cshlp.org/content/2009/5/pdb.rec11798.full?text_only=true |
Tabla 1: Condiciones de cultivo en hueveras '' para diferentes sistemas modelo. El protocolo relacionada anteriormente se puede adaptar fácilmentepor sólo la sustitución de las condiciones de cultivo descritas y el tamaño de las hueveras ''.
Discusión
moldeo de réplica se utilizó con el fin de fabricar las 'hueveras. El proceso de fabricación no necesita una habitación limpia; es fácil y simple, aunque puede ser necesario un poco de práctica. En particular, la liberación de la marca de PDMS es el paso más crítico con el fin de producir una gran área de '' hueveras de alta calidad. Por esta razón, especial cuidado tiene que ser tomado en este paso. Si este paso se abstiene repetidamente, tenga en cuenta para optimizar los parámetros del plasma más limpios antes de la silanización y plasmáticas. silanización insuficiente dará lugar a una fuerte adherencia del sello a la película de PDMS. Si esto se observa, el tiempo de incubación con el reactivo de silanización se puede aumentar. Tenga en cuenta que otras técnicas y materiales se pueden aplicar para fabricar las 'hueveras', que pueden ser funcionalizados con una amplia gama de ligandos (fibronectina, gelatina, colágeno, etc.). En particular, microcavidades en poliestireno pueden ser fácilmente fabricados por custom-hizo-técnica de estampado en caliente. Esto garantiza la biocompatibilidad y la comparación directa con los resultados obtenidos en placas de cultivo estándar. Del mismo modo, se requiere un cuidado especial y la práctica con el fin de optimizar el porcentaje de llenado. En particular, la etapa de aclarado es crítica con el fin de garantizar un relleno apropiado sin exceso de células, lo que contribuye al ruido y el fondo en la señal. Si las células se extraen fácilmente de las cavidades, considere para cambiar el tamaño o la profundidad de las cavidades.
'Eggcups' proporcionan la arquitectura 3D-como a las células y ensayos de cribado de alto contenido utilizando un protocolo simple. orgánulos celulares y procesos activos desconocidos usando ensayos estándar de cultivo pueden ser fácilmente visualizados por medio de la inserción de células individuales en microcavidades individuales ( '') hueveras. Dependiendo del sistema modelo, el tamaño, forma y sus dimensiones se pueden adaptar fácilmente. De esta manera, las células de mamífero, levadura de fisión, la levadura en ciernes y C. c elegansun ser manipulados y estudiados, así como cualquier embriones tales como Drosophila, ratones o embriones humanos para la fertilización in vitro, o células, por ejemplo, del tallo.
En esta configuración se capturan las células individuales. Esto está en contraste con los tejidos epiteliales encontradas in vivo. Sin embargo, este entorno podría ser reproducida en nuestras 'hueveras' mediante el recubrimiento de las paredes laterales con cadherinas para imitar contactos célula-célula utilizando elastómeros más flexibles. contactos focales serán promovidas por la deposición de fibronectina en el fondo de los pozos. Estas distribuciones respectivas de las moléculas de adhesión deben permitir que en la reproducción de los entornos celulares encontrados in vivo. Por este método se podría aproximarse a las condiciones fisiológicas.
el intercambio de soporte en nuestro ensayo está asegurada. Las células en la CE no muestran ningún tipo de degradación cuando se realizan experimentos tanto a corto como a largo plazo debido a la falta de intercambio de soporte. Tenga en cuenta también que las células de la CE can ser cultivadas hasta confluencia aunque el principal interés es cuando se aíslan las células individuales o embriones dentro de las cavidades.
Orientación de los orgánulos u organismos enteros está revelando nueva información. Mostramos diferentes dinámicas de actina y miosina en el anillo cytokinetic. Aunque el anillo cytokinetic en la levadura de fisión y de mamífero se compone de componentes clave similares, demostramos con esta configuración, que su dinámica es diferente específicos 17. Con ello se apoya el resultado, que el mecanismo de cierre en los dos sistemas es diferente también. Para desarrollar e investigar esta hipótesis, la orientación de la célula es indispensable. En estudios futuros, este dispositivo también se puede utilizar para investigar otros eventos relacionados con orgánulos organización en las células.
Más allá de eso, esta técnica puede ser de gran utilidad en la biología del desarrollo. embriones alargados se pueden orientar fácilmente, observados o tratan adicionalmente en una orientación definida.Probablemente nuestro ensayo no impondría polaridad de embriones, pero el porcentaje de llenado de alta permitiría extraer La lectura deseado de una manera confiable. En total 'hueveras' podría ser un buen dispositivo para la detección de alto contenido.
Se han propuesto otros ensayos de cultivo. Estos métodos van desde múltiples células en dimensiones 2D en placas de múltiples pocillos, a células individuales depositados en motivos adhesivas micropatterned con forma idéntica. Sin embargo, ninguna de ellas es adecuada para superar las limitaciones detalladas anteriormente en la observación de los orgánulos celulares y procesos dinámicos 1.
Las futuras mejoras a nuestro sistema permitirá a la aplicabilidad de las hueveras '' a fines orientados a la industria. Como ejemplo, las aplicaciones de selección de fármacos en las compañías farmacéuticas requieren el uso de placas de múltiples pocillos 14,28; la aplicación de las hueveras '' en este tipo de plataformas potencialmente mejorar la fiabilidad depruebas y resultados. Como tales altas ensayos, contenido de detección se realizaron con los procesos automatizados de uso común de las empresas farmacéuticas y laboratorios de investigación (académica) utilizando robots. Esto asegurará repetibilidad y fiabilidad con baja variabilidad. Algunos productos comerciales basados en ensayos de cultivo de células en 3D ya han aparecido en el mercado destacando la importancia de este tipo de ensayos. Por último, estos dispositivos se abren nuevas perspectivas para la medicina personalizada: las células de los pacientes podrían ser colocados en las hueveras '', y los cócteles de tratamiento podrían ser probados en un entorno fisiológico; el biomarcador de lectura permitirá anticipar un tratamiento óptimo que debe darse al paciente 29. En total, la forma física de las células y embriones están guiando la arquitectura de las cavidades, y esperamos que el dispositivo y este método serán ampliamente difundidas en el futuro.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Reconocemos L. Brino (planta de filtrado de contenido de alta IGBMC, Illkirch, Francia) para que nos proporciona el anticuerpo anti-Giantin, M. Labouesse laboratorio. para C. elegans (IGBMC) y B. Séraphin laboratorio. de levadura en ciernes (IGBMC), E. y A. Hyman Paluch para las células HeLa fluorescentes (MPI-CBG, Dresde), J. Moseley (Dartmouth Medical School) y JQ Wu (Universidad del Estado de Ohio) para células de levadura de fisión; A. Hoël y F. Evenou ayuda experimental, C. Rick (IBMC, Estrasburgo, Francia) para la ayuda técnica, y JC Jeannot (Femto-st, Francia) para ayudar en la microfabricación. Este trabajo fue apoyado por fondos del CNRS, la Universidad de Estrasburgo, conectus, La Fundación para la Investigación Médica y el ci-FRC de Estrasburgo.
Materiales
| Name | Company | Catalog Number | Comments |
| ddH20 (ultrapure) | Millipore | - | Use always fresh water. |
| Parafilm (plastic film) | Bemis | PM-999 | Adhere Parafilm to the lab bench using some water droplets and ensure a perfect surface flatness. |
| Photo-mask | Selba | - | http://www.selba.ch |
| Silicon wafer | Siltronix | - | http://www.siltronix.com/ |
| SU-8 photoresist | MicroChem | 2000 series | http://www.microchem.com/Prod-SU82000.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| SU-8 developer | MicroChem | - | http://microchem.com/Prod-Ancillaries.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information | |||
| 2-propanol | Sigma-Aldrich | 19030 | http://www.sigmaaldrich.com/catalog/product/sial/i9030?lang=en®ion=CA |
| Available from multiple companies. | |||
| Sigmacote (siliconizing reagent ) | Sigma-Aldrich | SL2-25ML | http://www.sigmaaldrich.com/catalog/product/sigma/sl2?lang=fr®ion=FR |
| harmful, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Chlorotrimethylsilane (TMCS) | Sigma-Aldrich | 386529-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/386529?lang=fr®ion=FR |
| TMCS produces acute inhalation and dermal toxicity, and is highly flammable (with ignition flashback able to occur across considerable distances), consequently it should be used in a fume cupboard away from sources of ignition | |||
| Nitrile gloves | Kleenguard | 57372 | http://www.kcprofessional.com/products/ppe/hand-gloves/thin-mil-/57372-kleenguard-g10-blue-nitrile-gloves-m |
| Available from multiple companies. | |||
| Glass coverslips #0 | Knittel glass | KN00010022593 | http://www.knittelglass.com/index_e.htm |
| Very fragile. Manipulate gently. | |||
| Sharp straight tweezers | SPI | 0WSSS-XD | http://www.2spi.com/catalog/tweezers/t/elec7 |
| 50 ml tube | BD Falcon | 352070 | http://www.bdbiosciences.com/cellculture/tubes/features/index.jsp |
| Available from multiple companies. | |||
| PDMS | Dow Corning | Sylgard 184 kit | http://www.dowcorning.com/applications/search/default.aspx?R=131EN |
| The package contains both PDMS base and curing agent. Similar elastomers are available from multiple companies. | |||
| Microscope glass slides | Dutscher | 100001 | http://www.dutscher.com/frontoffice/search |
| Available from multiple companies. | |||
| DMEM high-glucose medium | Fisher Scientific | 41965-039 | http://www.fishersci.com/ecomm/servlet/Search?LBCID=12301479&keyWord=41965-039&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Bovine calf serum | Sigma-Aldrich | C8056-500ML | http://www.sigmaaldrich.com/catalog/product/sigma/c8056?lang=en®ion=CA |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200-072 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=25200-072&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS 1x | Fisher Scientific | 14200-067 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=14200-067&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS is at 10x and should be diluted to 1x using ddH2O | |||
| L-15 medium | Fisher Scientific | 21083-027 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=21083-027&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Medium for atmospheres without CO2 control | |||
| Fibronectin | Sigma-Aldrich | F1141-5MG | http://www.sigmaaldrich.com/catalog/search?interface=All&term=F1141-5MG&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Penicillin & Streptomycin | Fisher Scientific | 15140-122 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=15140-122&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=CHEM |
| Petri dish P35 | Greiner | 627102 | http://www.greinerbioone.com/en/row/articles/catalogue/article/144_11/12885/ |
| Petri dish P60 | Greiner | 628163 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/145_8_bl/24872/ |
| Petri dish P94 | Greiner | 633179 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/146_8_bl/24882/ |
| Paraformaldehyde 3 % | Sigma-Aldrich | P6148-500G | http://www.sigmaaldrich.com/catalog/product/sial/p6148?lang=fr®ion=FR |
| Harmful in-particular for the eyes, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Triton 0.5 % | Sigma-Aldrich | 93443-100ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=93443-100ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Phallodin-Green Fluorescent Alexa Fluor 488 | InVitrogen | A12379 | http://www.lifetechnologies.com/order/catalog/product/A12379?CID=search-a12379 |
| dissolve powder in 1.5 ml methanol | |||
| Alexa Fluor 647 | InVitrogen | A21245 | 1:200 dilution in PBS 1x |
| rabbit polyclonal anti-Giantin | Abcam | ab24586 | 1:500 dilution in PBS 1x |
| http://www.abcam.com/giantin-antibody-ab24586.html | |||
| rabbit anti-anillin | Courtesy of M. Glotzer, Published in Piekny, A. J. & Glotzer, M. Anillin is a scaffold protein that links RhoA, actin, and myosin during cytokinesis. Current biology 18, 30–6 (2008). | 1:500 dilution in PBS 1x | |
| Anti-phosphotyrosine | Transduction Lab | 610000 | http://www.bdbiosciences.com/ptProduct.jsp?ccn=610000 |
| Cy3 goat anti-rabbit | Jackson Immunoresearch | 111-166-047 | http://www.jacksonimmuno.com/catalog/catpages/fab-rab.asp |
| 1:1,000 dilution in PBS 1x | |||
| DAPI | Sigma-Aldrich | D8417 | http://www.sigmaaldrich.com/catalog/product/sigma/d8417?lang=fr®ion=FR |
| 1 mg/ml for 1 min | |||
| Glycerol | Sigma-Aldrich | G2025 | http://www.sigmaaldrich.com/catalog/search?interface=All&term=G2025&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Mineral oil | Sigma-Aldrich | M8410-500ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=M8410-500ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| HeLa cells | - | - | Mammalian cells are available from many companies. See also Table 1 |
| NIH3T3 cells | ATCC | - | Mammalian cells are available from many companies. See also Table 1 |
| Fission yeast | - | - | For details on strains, contact the corresponding author. See also Table 1 |
| C. elegans worms | - | - | For details, contact the corresponding author. See also Table 1 |
| YES (Agar) + 5 Supplements included | MP Biomedicals | 4101-732 | http://www.mpbio.com/search.php?q=4101-732&s=Search |
| For preparation: follow instructions as given on the box | |||
| YES (Media) + 5 Supplements included | MP Biomedicals | 4101-522 | http://www.mpbio.com/search.php?q=4101-522&s=Search |
| For preparation: follow the instructions as given on the box | |||
| EMM (Media) | MP Biomedicals | 4110-012 | http://www.mpbio.com/search.php?q=4110-012&s=Search |
| For preparation: follow instructions as given on the box | |||
| Filter sterilized EMM (Media) - Only for imaging | MP Biomedicals | 4110-012 | For preparation: follow instructions as given on the box. Filter sterilize the media using a 0.22 µm filter instead of autoclaving. This gives transparency to the media and reduces the autofluorescence. |
| Supplements (for EMM) | MP Biomedicals | 4104-012 | http://www.mpbio.com/search.php?q=4104-012&s=Search |
| (Add 225 mg/L into the EMM media before autoclaving or filtering) | |||
| Stericup and Steritop Vaccum driven sterile filters | Millipore | - | http://www.millipore.com/cellbiology/flx4/cellculture_prepare&tab1=2&tab2=1#tab2=1:tab1=2 |
Referencias
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294, 1708-1712 (2001).
- Azioune, A., Storch, M., Bornens, M., Thery, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab Chip. 9, 1640-1642 (2009).
- Mandal, K., Balland, M., Bureau, L. Thermoresponsive Micropatterned Substrates for Single Cell Studies. PLoS ONE. 7, e37548(2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nat Rev Mol Cell Biol. 8, 839-845 (2007).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. , (2012).
- Ghibaudo, M., Di Meglio, J. M., Hersen, P., Ladoux, B. Mechanics of cell spreading within 3D-micropatterned environments. Lab Chip. 11, 805-812 (2010).
- Greiner, A. M., Richter, B., Bastmeyer, M. Micro-Engineered 3D Scaffolds for Cell Culture Studies. Macromol Biosci. 12, 1301-1314 (2012).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat Mater. 12, 458-465 (2013).
- Legant, W. R., et al. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat Meth. 7, 969-971 (2010).
- Devices and methods for observing the cell division. , WO/2010/092116 (2010).
- Ochsner, M., et al. Micro-well arrays for 3D shape control and high resolution analysis of single cells. Lab Chip. 7, 1074-1077 (2007).
- Devices and methods for observing cells with cell wall or invertebrate embryos with oblong eggshell . , WO2013144302 (2012).
- Devices and methods for observing eukaryotic cells without cell wall. , WO2013135809 (2012).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends Biotech. 28, 237-245 (2010).
- Wolfe, D., Qin, D., Whitesides, G. Microengineering in Biotechnology, Ch 3. Methods in Molecular Biology. Hughes, M. P., Hoettges, K. F. 583, Humana Press. 81-107 (2010).
- Mehling, M., Tay, S. Microfluidic cell culture. Curr Op Biotech. 25, 95-102 (2014).
- Wollrab, V., Thiagarajan, R., Wald, A., Kruse, K., Riveline, D. Still and rotating myosin clusters determine cytokinetic ring constriction. Nat Commun. 7, 11860-11869 (2016).
- Yao, X., et al. Functional analysis of single cells identifies a rare subset of circulating tumor cells with malignant traits. Integr Biol. 6, 388-398 (2014).
- Eberwine, J., Sul, J. Y., Bartfai, T., Kim, J. The promise of single-cell sequencing. Nat Meth. 11, 25-27 (2014).
- Allen, T. D., et al. Generation of cell-free extracts of Xenopus eggs and demembranated sperm chromatin for the assembly and isolation of in vitro-formed nuclei for Western blotting and scanning electron microscopy (SEM). Nat. Protocols. 2, 1173-1179 (2007).
- Robbins, E., Marcus, P. I. Mitotically Synchronized Mammalian Cells: a Simple Method for Obtaining Large Populations. Science. 144, (1964).
- Whitfield, M. L., et al. Stem-loop binding protein, the protein that binds the 3" end of histone mRNA, is cell cycle regulated by both translational and posttranslational mechanisms. Molecular and Cellular Biology. 20, (2000).
- Straight, A. F., et al. Dissecting Temporal and Spatial Control of Cytokinesis with a Myosin II Inhibitor. Science. 299, 1743-1747 (2003).
- Tang, J., Erikson, R. L., Liu, X. Checkpoint kinase 1 (Chk1) is required for mitotic progression through negative regulation of polo-like kinase 1 (Plk1). Proc Natl Acad Sci. 103, 11964-11969 (2006).
- Zahreddine, H., Zhang, H., Diogon, M., Nagamatsu, Y., Labouesse, M. CRT-1/Calreticulin and the E3 Ligase EEL-1/HUWE1 Control Hemidesmosome Maturation in C. elegans Development. Curr Biol. 20, 322-327 (2010).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans Methods: Synchronization and Observation. JoVE. , e4019(2012).
- Saha, S., Pollard, T. D. Anillin-related protein Mid1p coordinates the assembly of the cytokinetic contractile ring in fission yeast. Mol Biol Cell. 23, 3982-3992 (2012).
- Prestwich, G. D. Evaluating Drug Efficacy and Toxicology in Three Dimensions: Using Synthetic Extracellular Matrices in Drug Discovery. Acc Chem Res. 41, 139-148 (2007).
- Futamura, Y., et al. Morphobase, an Encyclopedic Cell Morphology Database, and Its Use for Drug Target Identification. Chem Biol. 19, 1620-1630 (2012).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados