Method Article
Ordinazione di singole cellule e singola embrioni in 3D confinamento: Un nuovo dispositivo per l'alta Screening contenuti
In questo articolo
Riepilogo
Riportiamo un dispositivo ed un nuovo metodo per studiare le cellule ed embrioni. celle singole sono proprio ordinati in array microcavità. Il loro confinamento 3D è un passo verso ambienti 3D incontrate in condizioni fisiologiche e permette l'orientamento organelli. Controllando la forma delle cellule, questa configurazione riduce al minimo la variabilità riportata nei test standard.
Abstract
cellule biologiche si osservano di solito su superfici piane (2D). Questa condizione non è fisiologico, e fenotipi e le forme sono molto variabili. Lo screening basato su cellule in tali ambienti sono quindi gravi limitazioni: organelli cellulari mostrano fenotipi estremi, morfologie di cellule e le dimensioni sono organelli cellulari eterogenee e / o specifiche non possono essere adeguatamente visualizzati. Inoltre, le cellule in vivo si trovano in un ambiente 3D; in questa situazione, le cellule mostrano diversi fenotipi principalmente a causa della loro interazione con la circostante matrice extracellulare del tessuto. Al fine di standardizzare e generare ordine delle singole cellule in un ambiente 3D fisiologicamente rilevanti per saggi cellulari, riportiamo qui la microfabbricazione e le applicazioni di un dispositivo per vitro coltura cellulare 3D. Questo dispositivo è costituito da una matrice 2D di microcavità (tipicamente 10 5 cavità / cm 2), ciascuna riempita di singole cellule o embrioni. cellulare posizione, la forma, la polarità e l'organizzazione interna delle cellule diventano poi normalizzato che mostra un'architettura 3D. Abbiamo usato stampaggio replica a modello una serie di microcavità, (PDMS) strato 'portauova', SU UN polidimetilsilossano sottile aderito su un vetrino. Cavità sono state coperte con fibronectina per facilitare l'adesione. Le cellule sono state inserite mediante centrifugazione. percentuale di riempimento è stato ottimizzato per ciascun sistema consentendo fino al 80%. Le cellule ed embrioni viabilità è stata confermata. Abbiamo applicato questa metodologia per la visualizzazione di organelli cellulari, quali apparati nucleo e Golgi e studiare processi attivi, come la chiusura dell'anello cytokinetic durante la mitosi cellulare. Questo dispositivo ha permesso l'identificazione di nuove caratteristiche, come accumuli periodici e disomogeneità di miosina e actina durante la chiusura dell'anello cytokinetic e fenotipi compattati per Golgi e l'allineamento nucleo. Abbiamo caratterizzato il metodo per cellule di mammifero, lievito di fissione, lievito in erba, C. elegans wesimo adattamento specifico per ogni caso. Infine, le caratteristiche di questo dispositivo lo rendono particolarmente interessante per saggi di screening di farmaci e medicina personalizzata.
Introduzione
Di corrente in saggi cellulari in vitro sono bidimensionali (2D). Questa configurazione non è naturale per le cellule di mammifero e pertanto non è fisiologicamente rilevanti 1; cellule mostrano una varietà di forme, dimensioni e fenotipi eterogenee. Essi presentano gravi limitazioni aggiuntive quando applicato alle applicazioni di screening, come ad esempio una distribuzione disordinata all'interno del piano e fenotipi estremi di organelli cellulari (fibre di stress, in particolare). Ciò è particolarmente importante in studi clinici per i test di droga, in cui i budget elevati vengono spesi ogni anno. La maggior parte di questi farmaci se non riescono quando applicata a modelli animali a causa della condizione coltura 2D artificiale nelle prime fasi di screening di farmaci. Inoltre, utilizzando questo approccio, organelli cellulari specifici non possono essere correttamente visualizzati, ad esempio l'anello actomiosina cytokinetic durante la mitosi cellulare, e in generale strutture che si stanno evolvendo nel piano perpendicolare al piano di osservazione. Alcuninuovi test 2D sono stati proposti al fine di superare gli inconvenienti suddetti e importanti informazioni sull'organizzazione citoscheletro sono stati osservati 2,3. Tuttavia, questi test ancora presenti una seria limitazione: celle mostrano un fenotipo molto diffuse a differenza di quanto si osserva in vivo, in cui le cellule presentano un'architettura 3D. Tali artefatti associati al metodo di coltura possono innescare caratteristiche non fisiologici, come fibre di stress potenziate 1,4,5.
Tridimensionali saggi di colture cellulari forniscono molteplici vantaggi rispetto ai 2D ambienti 6,7. Essi sono fisiologicamente più rilevanti, ed i risultati sono quindi significativi. Come esempio, cellule incorporati in idrogel mostrano strutture 3D-like ma le loro morfologie differiscono da una cella all'altra 8,9. Tuttavia, le loro morfologie differiscono da una cella all'altra, il che complica applicazioni di screening. Una strategia alternativa è quella di incorporare singolocellule in cavità microfabbricate 10,11. la posizione delle cellule, la forma, la polarità e l'organizzazione interna delle cellule possono quindi diventare normalizzata. Oltre a fornire l'architettura 3D-come le cellule, microcavità permette anche per gli studi di screening ad alto contenuto 10,12-14; singole cellule possono essere ordinati in microarray e organelli cellulari e le loro evoluzioni possono essere osservati in parallelo. Questa regolarità fornisce buone statistiche con un basso numero di cellule e migliori risoluzioni temporali / spaziale. Composti utili sono facili da identificare in maniera affidabile.
In questo studio, dimostriamo la fabbricazione e l'applicazione di un nuovo sistema di celle singola cultura 3D come ad alto contenuto di screening applicazioni 10,12,13. Il dispositivo è costituito da una matrice di microcavità elastomerici (10 5 cavità / cm 2), coniati 'eggcups' (EC). Dimensioni e volume totale di CE in questo lavoro sono ottimizzati per il volume tipico delle singole cellule NIH3T3 e HeLadurante la divisione cellulare. Morfologia delle cavità cilindriche - - è selezionato per la forma delle cellule correttamente orientare per la visualizzazione dei processi attivi. Stampaggio replica viene utilizzato per una vasta gamma di modello CE su un (PDMS) strato sottile polidimetilsilossano aderito su un bicchiere coprivetrino 15,16. Le cellule vengono introdotti nella CE per centrifugazione. Riportiamo qui di osservazione e la normalizzazione degli organelli cellulari (stress fibers di actina, apparato del Golgi e nucleo) in 3D (CE) in confronto con le stesse celle 2D (piatta) superfici. Riportiamo anche l'osservazione dei processi dinamici attivi quali la chiusura dell'anello actomiosina cytokinetic durante la mitosi cellulare 17. Infine, mostriamo risultati di questa metodologia su altri sistemi con pareti rigide, come il lievito in erba, lievito di fissione e C. embrioni elegans che conferma l'applicabilità della nostra metodologia per una vasta gamma di sistemi modello.
Abbiamo poi presentiamo una p dettagliato ed esaustivoROTOCOLLO al fine di fabbricare e applicare le "Portauova" per microfabbricazione 3D. Il nostro approccio è semplice e non richiede una camera pulita. Prevediamo che questa nuova metodologia sarà particolarmente interessante per test di screening di farmaci e medicina personalizzata, in sostituzione di piastre di Petri. Infine, il dispositivo sarà utile per studiare le distribuzioni di cellule risposte a stimoli esterni, ad esempio nel cancro 18 o nella ricerca di base 19.
Protocollo
1. Microfabbricazione di 'Portauova'
- Realizzazione del Master: microcavità Array
- Scaldare un wafer 3 '' di silicio fino a 200 ° C per evaporare l'eventuale presenza di umidità.
- Spin-coat un sottile strato di SU-8 fotosensibile. Regolare il volume di resina e filatura velocità a seconda del tipo e dello spessore photoresist desiderato. Questo spessore detterà la profondità dei 'portauova' (EC). Per uno strato spesso 30 micron e SU-8 2025, spin-coat a 2.800 giri al minuto.
- Pre-cuocere il wafer a 65 ° C per 1 min (passaggio 1 di 2) per uno spesso strato 30 micron SU-8 il 2025. Adattare il tempo a seconda del tipo di photoresist e spessore desiderato. Controllare la scheda tecnica produttore per i dettagli.
- Pre-cuocere il wafer a 95 ° C per 3 minuti (passaggio 2 di 2) per uno spesso strato 30 micron SU-8 il 2025. Adattare il tempo a seconda del tipo di photoresist e spessore desiderato. Controllare la scheda tecnica produttore per i dettagli.
- caricare ilwafer sul allineatore maschera per esposizione ai raggi UV. Posizionare la maschera fotolitografica su di esso. La maschera mostra un modello di caratteristiche circolari (dischi) di 20 micron di diametro. Garantire un perfetto contatto tra loro.
NOTA: Diversi produttori offrono maschere di fotolitografia. La risoluzione spaziale determinerà il costo finale. maschere Acetato offrono una risoluzione accettabile (≈10 micron) a basso costo. maschere di cromo fornire una migliore risoluzione, ma sono più costosi. Adattare i diametri dei dischi (dalla maschera fotolitografica) al volume delle cellule. Dimensioni di dischi sulla maschera determinerà il diametro della cavità del dispositivo. I piccoli diametri porteranno ad un riempimento basso; troppo grande diametro non limiterà le cellule. Per le cellule HeLa e NIH3T3, diametro di 20 micron a 25 micron sono suggeriti. - Controllare l'alimentazione della lampada UV prima esposizione e ottimizzare il tempo di esposizione. Irradiare (lunghezza d'onda = 365 nm) per 41,5 secondi (o il tempo di esposizione ottimale) a250 mJ / cm 2.
NOTA: SU-8 2025 è un fotoresist negativo, il che significa che le regioni esposte a raggi UV saranno curate. In questo caso, le caratteristiche circolari erano nere e trasparente resto. lavoro fotosensibile positiva nel modo opposto: le regioni non esposte sono guariti. Selezionare fotoresist conseguenza, a seconda del design e foto-maschera.
NOTA: proteggere gli occhi dai raggi UV con occhiali di sicurezza adeguate. - Rimuovere delicatamente la maschera dallo strato fotosensibile.
- Post-bake il wafer a 65 ° C per 1 min (passaggio 1 di 2) per uno spesso strato 30 micron SU-8 il 2025. Post-bake il wafer a 95 ° C per 3 minuti (passaggio 2 di 2) per uno spesso strato 30 micron SU-8 il 2025. Adattare il tempo a seconda del tipo di photoresist e spessore desiderato. Controllare la scheda tecnica produttore per i dettagli. Dopo post-cottura, raffreddare la cialda a temperatura ambiente in panchina per circa 1 min.
- Posizionare il wafer nello spin-verniciatore e rilasciare qualche mm di SU-8 sviluppatore per coprirel'intera area wafer. Sviluppare per 2 minuti e poi spin-coat a 1.000 rpm per 30 sec. Ripetere la procedura per tre volte.
- Risciacquare con 2-propanolo per assicurare la completa rimozione non sviluppata SU-8. Aspetto delle regioni bianche è un'indicazione di sviluppo incompleto. Se è così, ripetere la fase di sviluppo di un tempo supplementare.
- Hard-bake il wafer a 200 ° C per assicurare robustezza delle microstrutture fabbricati. Questo passaggio è facoltativo.
- Conservare il 3 'wafer' con microstrutture all'interno di un 94 millimetri x 15 mm di polistirene Petri.
NOTA: Non vi è alcuna necessità di un trattamento di superficie, in particolare silanizzazione, per i passi successivi.
- Realizzazione della Polidimetilsilossano (PDMS) Replica: Colonne Array
- Mescolare in un rapporto 1:10 (w / w) il cross-linker e la pre-polimero per un totale di 30 g in un tubo da 50 ml.
NOTA: Utilizzando un rapporto 1:10 (v / v) sta lavorando. - Centrifugare la provetta a 1.800 xg per 5 min arimuovere le bolle d'aria.
- Eliminare delicatamente le PDMS sulla parte superiore delle microstrutture.
NOTA: Se le bolle d'aria appaiono durante questa fase, degassare il campione utilizzando una pompa a vuoto per 15-20 min. - Porre il campione in un forno a 65 ° C per 4 ore.
NOTA: Il tempo di indurimento varia tra utenti e, insieme con il cross-linker: percentuale pre-polimero. Questa volta detterà la rigidità dei PDMS. Si raccomanda di curare più di 2 ore e di attenersi a un tempo di polimerizzazione fisso. - Utilizzare un bisturi per tagliare delicatamente l'area di interesse (timbro) di circa 1 cm 2, che comprende circa 10 5 microcavità o 'portauova.
NOTA: Tagliare prima i PDMS e poi, buccia via delicatamente. Controllare la qualità della replica PDMS con un microscopio ottico.
- Mescolare in un rapporto 1:10 (w / w) il cross-linker e la pre-polimero per un totale di 30 g in un tubo da 50 ml.
- Fabbricazione di '' portauova per stampaggio replica. Nel seguito, sono descritti due strategie alternative per la realizzazione di "portauova. Entrambi i protocolli sono similar e fornire risultati identici:
- strategia 1
- Attivare il timbro PDMS fabbricato da trattamento al plasma di ossigeno per 30 sec. Memorizzare temporaneamente i francobolli attivati in un piatto chiuso Petri per impedire il deposito di polvere.
NOTA: Regolare il tempo di esposizione in caso di utilizzo di altri gas per il plasma. - Posizionare i PDMS attivate timbro a testa in su (il lato con le strutture) in una capsula di Petri accanto a un tappo di tubo da 15 ml. Riempire il tappo con 200 ml di Trimetilclorosilano (PTM). Chiudere la piastra di Petri e lasciare che il silanizzata francobollo per 7 min.
NOTA: Alcune deformazione temporanea sul timbro e / o cambiamenti di colore (bianco) si può osservare. Il francobollo sarà recuperare la sua forma originale in breve tempo e le strutture non saranno interessati.
NOTA: TMCS produce la tossicità per inalazione e per via cutanea acuta, ed è altamente infiammabile (con flashback di accensione in grado di verificarsi in tutta distanze considerevoli). Di conseguenza, dovrebbe essere usato in una cappa di distanza dalla sorgentes di accensione. - Posizionare il timbro PDMS sulla spin-coater con le strutture a testa in su. Mettere una piccola goccia di pochi microlitri (circa 20 ml) di PDMS liquidi (1:10 w / w cross-linker: pre-polimero) sopra le strutture. Spin-coat a 1.500 rpm per 30 sec per depositare un sottile strato di PDMS sopra le strutture.
NOTA: Se il timbro non si adatta il posto mandrino spin-coater il timbro sulla cima di un coperchio capsula di Petri con un piccolo foro al centro. - Posizionare il timbro in forno a 65 ° C per 4 ore per curare il livello PDMS spin-rivestito depositato.
- Attiva il livello PDMS sottile posizionando il timbro PDMS a testa, insieme con un vetro coprioggetti # 0 di 25 mm, utilizzando pulitore plasma di ossigeno per 30 sec. Procedere rapidamente alla fase successiva.
NOTA: coprioggetto con altri spessori, forme e dimensioni, può essere utilizzato come bene. Tuttavia, alcune strutture cellulari potrebbe essere difficile visualizzare a seconda dello spessore coprioggetto selezionato e obiettivoingrandimento e / o NA e / o la distanza di lavoro. Controllare il foglio di dati oggettivi. - Mettere in contatto il timbro (il lato con il sottile strato di spin-patinata) con il coprioggetto di vetro. Premete delicatamente tutto intorno alla superficie del timbro con una pinzetta per rendere il 'legame'. Infine, mantenere una pressione costante sulla parte superiore del timbro per circa 10 sec.
- Dopo 30 minuti delicatamente 'buccia' il timbro fuori dal vetrino, al fine di 'liberare' 'portauova' (vedi Figura 1). Sciacquare abbondantemente con etanolo e asciugare. Se PDMS 'portauova' non sono ben rispettati sul vetrino di vetro (ad esempio spiccano durante la fase di 'staccandosi'), prendere in considerazione la regolazione delle impostazioni del pulitore plasma e riavviare al punto 1.3.1.5.
NOTA: Questo passaggio è delicato. Prestare attenzione al fine di evitare la rottura del vetrino e / o distacco dello strato PDMS sottile. - Incollare un piccolo pezzo (maniglia) di PDMS curato di 1 mm x 1mm x 3 mm di volume al bordo del vetrino con una piccola goccia di PDMS liquidi e curare le PDMS come prima. Ciò faciliterà la manipolazione del campione in seguito (vedi Figura 1). Questo passaggio è facoltativo.
- Attivare il timbro PDMS fabbricato da trattamento al plasma di ossigeno per 30 sec. Memorizzare temporaneamente i francobolli attivati in un piatto chiuso Petri per impedire il deposito di polvere.
- strategia 2
- Hydrophilize il PDMS fabbricati francobolli di trattamento al plasma di ossigeno per 30 sec. Memorizzare temporaneamente i francobolli attivati in un piatto Petri chiusa per evitare la deposizione di polvere.
NOTA: Regolare il tempo di esposizione in caso di utilizzo di altri gas per il plasma. - Hydrophilize il coprioggetto di vetro del diametro # 0 ossigeno trattamento al plasma di 25 mm a 15 W per 30 sec. Procedere rapidamente alla fase successiva.
NOTA: coprioggetto con altri spessori, forme e dimensioni, può essere utilizzato come bene. Tuttavia, le strutture cellulari sarà difficile visualizzare a seconda dello spessore coprioggetto selezionato e caratteristiche oggettive (vedi nota sopra). - Spin-coat una piccola goccia di PDMS (1:10 w / w cross-linker: pre-polYmer) di pochi microlitri sul vetrino. Spin-coat a 1.500 rpm per 30 sec per uno spessore finale di circa 50 micron.
- Colla un piccolo pezzo (maniglia) di PDMS induriti 1 mm x 1 mm x 3 mm volume al bordo del vetrino con una piccola goccia di PDMS liquidi e curare le PDMS come prima. Ciò faciliterà la manipolazione del campione in seguito (vedi Figura 1). Questo passaggio è facoltativo.
- Memorizzare temporaneamente i coprioggetti PDMS-rivestiti su un panno pulito all'interno di una capsula di Petri per proteggere dal deposito di polvere.
- Mettere una goccia di reagente silanizzazione in cima ad ogni timbro e farlo evaporare per 1-2 min. Poi, asciugarle sotto flusso di N 2.
NOTA: In questa fase, una deformazione temporanea del timbro può essere osservato durante l'evaporazione. Il francobollo sarà recuperare la sua forma originale dopo l'asciugatura con N 2 senza alcuna deformazione permanente delle microstrutture. - Eliminare molto delicatamente il timbro silanizzata in cima allaPDMS-spin rivestite coprioggetto di vetro memorizzati nella scatola di Petri. Assicurarsi che entrambe le parti sono completamente parallelo durante il contatto. Evitare di premere o spostare il timbro dopo immissione sul vetrino PDMS rivestite.
- Porre la capsula di Petri con i campioni nel vuoto per 1-2 ore per rimuovere le bolle d'aria.
Nota: Assicurarsi che i campioni siano completamente orizzontale per evitare lo spostamento timbro. Anche evitare vibrazioni potenzialmente causata dalla pompa a vuoto. - Porre i campioni in forno a 65 ° C per 4 ore.
- Delicatamente, staccare il francobollo per rivelare 'portauova. Sciacquare abbondantemente con etanolo e asciugare.
La pratica è necessaria a questo punto: NOTA. Prestare attenzione per evitare la rottura del vetrino e / o distacco dello strato PDMS sottile.
- Hydrophilize il PDMS fabbricati francobolli di trattamento al plasma di ossigeno per 30 sec. Memorizzare temporaneamente i francobolli attivati in un piatto Petri chiusa per evitare la deposizione di polvere.
- strategia 1
2. L'introduzione di cellule nel 'Eggcups'
Al fine di introdurre all'interno di cellule di mammifero "portauova ', PDMS superficie needs essere funzionalizzati con proteine di adesione della matrice extracellulare. Questo esempio utilizza fibronectina ma altre proteine di interesse, come il collagene, potrebbe essere utilizzato.
- Hydrophilize il 'portauova' nel pulitore plasma di ossigeno per 30 sec.
NOTA: Ottimizzare i parametri, se necessario. - Preparare una soluzione in PBS 1x di 20 mg ml -1 fibronectina da fonti bovina.
- Sterilizzare il 'portauova' con UV per 5 min. Depositare una piccola goccia (circa 20-50 ml) di soluzione fibronectina per coprire l'intera area 'portauova' e incubare per 1 ora a RT. Proteggere il campione dalla essiccazione.
- Lavare delicatamente le 'portauova' con PBS 1x. Ripetere 3 volte.
NOTA: Il campione è pronto per l'uso immediatamente o conservato a 4 ° C al buio per diverse settimane. - Introdurre un pezzo di plastica su misura cilindrico di 63 mm di altezza, 26 mm di raggio esterno e 7 mm di dimensioni raggio interno in un tubo da 50 ml (vediFigura 2) 20
ATTENZIONE: gli elementi Usa UV-sterilizzato o sterilizzare loro utilizzo precedente.
NOTA: Questo pezzo può essere facilmente fabbricato in laboratorio. o da qualsiasi officina disponibili. - Mettere 13 ml di mezzo di coltura cellulare all'interno del tubo (vedi Tabella 1). Il mezzo deve riempire almeno 2 cm sopra il pezzo cilindrico per assicurare immersione completa del campione.
NOTA: Per i dettagli di specifici tipi cellulari e altri sistemi modello come il lievito o C. elegans embrioni, e il relativo supporto utilizzato, fare riferimento alla sezione 5 e Tabella 1. Il protocollo descritto è stato ottimizzato per HeLa, cellule NIH3T3, e altre linee cellulari (vedi tabella 1). - Introdurre delicatamente i "portauova 'all'interno del tubo e parallela al lato superiore della parte in plastica. Utilizzare le pinzette taglienti per tenere il campione utilizzando la maniglia PDMS. Premere delicatamente il coprioggetto fino giace sopra il lato superiore della parte in plastica, until è completamente immerso (vedi figura 2).
NOTA: Si consiglia di utilizzare le pinzette taglienti e dritto. Con pinzette curvi, la manipolazione del campione è difficile e può causare la rottura. - cellule di coltura fino a 80-100% confluenza in un P60 capsula di Petri e alla loro raccolta da tripsinizzazione.
NOTA: Le celle possono essere wild-type, trasfettate o trattati con qualsiasi farmaco di interesse.
NOTA: Evitare la formazione di aggregati di cellule che eviterà singole cellule per entrare nel 'portauova. Per ottimizzare questo passaggio, pipetta su e giù con cura dopo tripsinizzazione. - Risospendere le cellule in terreno di coltura 5 ml. Pipettare 200 microlitri di cellule sulla parte superiore dei 'portauova.
NOTA: goccia cellule più centrato possibile sopra dei 'portauova' ma evitando il contatto fisico. Questo impedirà la rottura e / o danneggiamento del campione. - Centrifugare a 1800 xg per 2 min.
NOTA: Dopo la prima centrifugazione, il check-in un microfonoROSCOPE la percentuale di riempimento dei 'portauova. - Dispensare ancora 200 ml di cellule sulla parte superiore dei 'Portauova' e centrifugare a 1.800 xg per 2 minuti. Ripetere per un totale di tre volte per ottimizzare la percentuale di riempimento.
NOTA: Dopo l'ultima centrifugazione, verificare con un microscopio la percentuale di riempimento del 'portauova. Se necessario, ripetere le operazioni di riempimento + centrifugazione fino a raggiungere la percentuale di riempimento desiderato. - Rimuovere il campione dalla provetta utilizzando le pinzette taglienti che fissano il manico PDMS. Assicurarsi di fare attenzione a non le cellule 'inquietanti' che si svolgono negli Portauova "(vedi figura 2).
- Trasferire il campione in una capsula di Petri con il mezzo. Risciacquare per rimuovere l'eccesso di cellule che non sono negli portauova 'pipettando su e giù tre volte dolcemente accanto a ciascun lato (totale 4 lati) della matrice microstruttura.
NOTA: Pipetting troppo forte può rilasciarealcune cellule dalla 'portauova'. - Sostituire il mezzo con terreno fresco per rimuovere le cellule nonattached.
NOTA: In questa fase un farmaco di interesse può essere aggiunto. - Fissare le cellule o prepararli per time-lapse imaging.See passo 4.1.
3. L'osservazione di dinamiche cellulari attivi in 'Eggcups': Cytokinetic Anello di chiusura
NOTA: Questo esempio utilizza cellule HeLa che sono trasfettate con MYH10-GFP e Lifeact-mCherry per miosina e actina, rispettivamente chiave molecole attive coinvolte nella chiusura dell'anello cytokinetic durante la mitosi cellulare. Il dispositivo è preparato con microcavità di 25 micron di diametro. Per loro osservazione, un microscopio invertito epifluorescenza è stato usato, equipaggiato con un obiettivo 60X olio (1,40 NA, DIC, Plan Apo) e GFP (miosina) e TxRed (actina) filtri. In alternativa un microscopio confocale eretta stato usato, dotato di 25X o obiettivo acqua L 63X HCX IR APO (0,95 NA). Per questo example, si consiglia vivamente di sincronizzare celle utilizzando il blocco doppio timidina, blocco mitotico o un metodo shake-off mitotico 21-24.
NOTA: Lo spessore dei PDMS utilizzati per il 'portauova' permette l'uso di una varietà di obiettivi sia in microscopi invertiti e retto posizionate.
- Place 'Portauova' in un supporto del microscopio e riempirlo con 1 ml di FCS L-15 medio di osservazione di 10%. Per evitare l'evaporazione, posizionare un coperchio di vetro sulla parte superiore del contenitore o applicare un sottile strato di olio minerale in cima alla medium.Select dell'obiettivo olio 60X.
NOTA: L-15 è sufficiente per non CO 2 atmosfere. Si noti inoltre che alcuni composti di DMEM sono auto-fluorescente. Quando si utilizza questo mezzo, si raccomanda di photobleach i composti fluorescenti illuminandolo con una lampada ad alta intensità per 1-2 ore.
NOTA: Evitare l'uso di coperchi di plastica quando si lavora con l'imaging DIC. - Posizionare il supporto con 'Portauova' e ossermedia vazione al microscopio. Primo accuratamente con luce brightfield fino agli portauova ', e le cellule sono nello stesso piano di osservazione.
- Aprire il software e regolare i parametri. Selezionare i filtri TxRed e GFP per actina e miosina; regolare il tempo di esposizione per ciascun canale. Un tasso di acquisizione tipico è 5 secondi per entrambi i canali.
NOTA: Il tempo di esposizione può essere regolata a seconda della configurazione utilizzata, tintura o di altri organelli cellulari di interesse. - Selezionare la regione di interesse e cercare un anello cytokinetic utilizzando la GFP o il canale TxRed. Mettere a fuoco con precisione.
NOTA: L'anello è più nitida in miosina e più facile da riconoscere. - Eseguire l'acquisizione automatica in entrambi i canali fino a quando l'anello è completamente chiuso.
NOTA: si può osservare Alcuni photobleaching. Regolare i parametri del microscopio per ridurlo.
4. L'osservazione di cellulari fissi Organelli nelle 'Eggcups'
Questa fase può essere eseguita prima o dopo il punto # 3. Le cellule possono essere fissate direttamente dopo la fase di centrifugazione e colorate per l'organello di interesse o dopo l'osservazione al microscopio. Questo esempio mostra la colorazione delle fibre apparato di Golgi, nucleo e actina su fibroblasti NIH3T3 in 'portauova.
- Fissazione delle cellule negli Eggcups '
- Preparare 3% paraformaldeide (PFA) e calda a 37 ° C. Rimuovere il campione '' portauova dal tubo da 50 ml (o il titolare del microscopio) e posizionarlo all'interno di una capsula di Petri P35. Risciacquare una volta con PBS 1x.
NOTA: Protocolli per la preparazione di 3% paraformaldeide sono ampiamente disponibili altrove.
ATTENZIONE: Utilizzare guanti di nitrile e occhiali protettivi durante la preparazione del PFA. - Rimuovere completamente il PBS e rilasciare 1 ml di 3% PFA e incubare per 17 min. Rimuovere la PFA e lavare due volte con 1 ml di PBS 1X. cellule permeabilize usando 1 ml di 0,5% Triton per 3 min e lavare due volte con PBS 1x per 5 min.
- Preparare 3% paraformaldeide (PFA) e calda a 37 ° C. Rimuovere il campione '' portauova dal tubo da 50 ml (o il titolare del microscopio) e posizionarlo all'interno di una capsula di Petri P35. Risciacquare una volta con PBS 1x.
- La colorazione delle cellule in '' Portauova
- Incubare le cellule per Golgi apparecchi colorazione con l'anticorpo primario policlonale di coniglio anti-Giantin in una diluizione 1: 500 in PBS. Mettere una goccia di 100 ml di soluzione di anticorpi su un foglio di pellicola di plastica e incubare le cellule all'interno dei 'portauova' a testa in giù per 45 min.
NOTA: Proteggere il campione con un coperchio per evitare l'essiccazione. - Rilasciare attentamente le 'Eggcups' e metterli in un P35 Petri. Lavare 3 volte, 5 minuti ciascuno, con PBS 1x.
- Preparare un cocktail in PBS con l'anticorpo secondario Cy3 capra anti-coniglio (1: 1.000) e con falloidina Alexa Fluor 488 (1: 200) per la colorazione stress fibers di actina.
- Incubare le cellule con una goccia di 100 ml di soluzione di anticorpi su un foglio di pellicola di plastica e incubare cellule all'interno dell 'portauova' a testa in giù per 45 min.
- Uscita con attenzione il 'eggcup 'e metterli in un P35 Petri. Lavare 3 volte, 5 minuti ciascuno, con PBS 1x.
- Incubare le cellule per la colorazione nucleo mettendo una goccia di 100 ml di 1 mg ml -1 DAPI in PBS su un foglio pellicola di plastica e incubare cellule all'interno dell 'portauova' a testa in giù per 45 min. Questa fase può essere eseguita con il punto 4.2.3.
- Rilasciare attentamente le 'portauova' e metterli in un P35 Petri. Lavare 3 volte, 5 minuti ciascuno, con PBS 1x.
- cellule Mount utilizzando una Glicerina 15 ml: PBS (1: 1 v / v) su un vetrino da microscopio di serie e sigillare il campione con smalto per evitare l'essiccamento.
NOTA: A seconda dello spessore '' portauova, il montaggio può essere difficile. Si consiglia di conservare il campione in un P35 Petri in PBS, protetto da essiccazione.
- Incubare le cellule per Golgi apparecchi colorazione con l'anticorpo primario policlonale di coniglio anti-Giantin in una diluizione 1: 500 in PBS. Mettere una goccia di 100 ml di soluzione di anticorpi su un foglio di pellicola di plastica e incubare le cellule all'interno dei 'portauova' a testa in giù per 45 min.
- Microscopio osservazione
NOTA: In questo esempio viene utilizzato un microscopio confocale verticale, dotata di rilevatori PMT e ibridi. Un 25X o 63 Obiettivo acqua L X HCX IR APO (0,95 NA) è stata selezionata per fornire un ampio campo del campione e mostra applicabilità del dispositivo per applicazioni ad alta contenuto screening.- Selezionare l'obiettivo 25X o 63X acqua.
NOTA: diversi obiettivi possono essere utilizzati a seconda dell'applicazione e del segnale. Ma si raccomanda l'utilizzo di elevati obiettivi apertura numerica. - Mettere il campione fissato con i "portauova 'e mettere a fuoco con cura usando la luce campo chiaro (contrasto di fase o DIC) fino agli Portauova' e le cellule sono nel piano di osservazione.
- Aprire il software e regolare i parametri. Selezionare i filtri GFP, Cy3 e DAPI per actina, Golgi e di osservazione nucleo, rispettivamente; regolare il tempo di esposizione per tutti i canali.
NOTA: Il tempo di esposizione può essere regolata a seconda della configurazione. - Selezionare e mettere a fuoco la regione di interesse; avviare l'acquisizione delle immagini (vedi figura 3).
- Selezionare l'obiettivo 25X o 63X acqua.
- Le cellule di lievito di fissione e in erba
NOTA: Questo esempio utilizza cellule di lievito di fissione, che sono contrassegnati con RLC1-mCherry e CHD-GFP rispettivamente miosina e actina,. Le cellule di lievito in erba non sono fluorescente qui. Per l'osservazione fissione lievito è stato utilizzato un disco rotante confocale microscopio invertito. Un obiettivo olio 100X HCX PL APO CS (1,4 NA) è stato utilizzato per tutte le acquisizioni. In alternativa, le cellule sono state anche osservate con un microscopio a contrasto di fase invertito dotato di un obiettivo di aria contrasto di fase 20X LCPlanFl (0,4 NA). In questo esempio, il protocollo è identica per entrambi i tipi di cellule.- Preparare la superficie 'portauova' come descritto sopra. Per la fissione e cellule di lievito in erba, preparare cavità di 5 micron di diametro (vedi tabella 1). In questo caso, la superficie non deve essere funzionalizzati con proteine di adesione.
NOTA: Il CA di riempimenton essere ottimizzato utilizzando 'portauova' coniche. Questa forma cattura e conserva le cellule evitando rilasciando durante la fase di risciacquo dopo centrifugazione. Riempimento percentuale ottimale a circa 80%. Questi '' portauova coniche possono essere fabbricati mediante profonda Reactive Ion Etching 13. - Cellule di lievito cultura in terreni di coltura corretto (vedere Tabella 1) fino a raggiungere una densità ottica (OD) nell'intervallo di 0,2 e 0,8. Sonicare la cultura di cellule di lievito per rimuovere aggregati.
- Inserire cellule di lievito in 'portauova' per centrifugazione. Per centrifugazione, 4 ml di cellule in coltura in OD venga aggiunta sul tubo con 'portauova. Dopo la prima centrifugazione, scuotere delicatamente il tubo per risospendere le cellule che non sono negli portauova ', mentre le cellule nel' portauova 'non sono disturbati. Senza aprire di nuovo il tubo, centrifuga e ripetere questo passaggio per due volte. Questo assicura la deposizionedi cellule della cultura nelle microcavità vuoti e aumenterà la percentuale di riempimento.
NOTA: Quando si lavora con il lievito, si raccomanda di preriscaldare la centrifuga alla temperatura di lavoro durante gli esperimenti
NOTA: Il protocollo può essere messo in pausa qui e ha continuato fino a 12 ore più tardi. In questo caso, conservare il campione alla temperatura di lavoro e coprire per evitare l'evaporazione. - Place 'portauova' in un supporto del microscopio e riempire il supporto con filtro sterilizzato media per l'imaging. Ora lavare le cellule con lo stesso supporto finché le cellule di lievito galleggianti sono rimossi efficientemente. Fare attenzione a non disturbare le cellule in 'portauova' durante il processo di risciacquo.
- Selezionare l'obiettivo di olio 100X e mettere a fuoco con attenzione. Aprire il software e regolare i parametri. Per lievito di fissione, selezionare la GFP filtri e TxRed per actina e miosina e regolare il tempo di esposizione per entrambi i canali. Un tasso di acquisizione tipico è 3 sec.
NOTA: a secondail fluoroforo, il tipo di tagging e il set-up, il tempo di esposizione varia per altri sistemi.
- Preparare la superficie 'portauova' come descritto sopra. Per la fissione e cellule di lievito in erba, preparare cavità di 5 micron di diametro (vedi tabella 1). In questo caso, la superficie non deve essere funzionalizzati con proteine di adesione.
- C. elegans Embrione
NOTA: Questo esempio utilizza C. elegans embrioni 25-30 micron di larghezza e 50-55 micron lungo. Embrioni sono state coltivate come indicato in 25. Un semplice protocollo visiva di come manipolare C. elegans può essere trovato in 26. L'osservazione è stata effettuata utilizzando un microscopio a contrasto di fase invertito dotato di un obiettivo di aria 40X 0,55 NA.- Preparare la superficie 'portauova' come sopra descritta e 25 micron di diametro (vedi Tabella 1). In questo caso, la superficie non deve essere funzionalizzati con proteine di adesione.
- Culture del C. embrioni elegans in terreni di coltura corretto (vedi tabella 1).
- Inserire embrioni in "Portauova" per centrifugazione come descritto in precedenza (vedi sezione 2,6-2,12) utilizzando acqua ultrapura come mezzo di coltura.
NOTA: Gli embrioni sono stati 'comportando' normalmente in acqua ultrapura per tutta la durata dell'esperimento. In alternativa, utilizzare un buffer fisiologico M9 per esperimenti a lungo termine. - Lavare il campione come sopra descritto (vedi paragrafo 2.14). Posizionare i 'portauova' in un supporto microscopio. Selezionare l'obiettivo di aria 40X e mettere a fuoco con attenzione. Aprire il software e regolare i parametri. Selezionare un tasso di acquisizione di 3 sec.
Risultati
Le '' portauova (CE) sono un metodo di screening ad alto contenuto-romanzo che permette la visualizzazione di cellule orientate ed embrioni in un ambiente 3D. Inoltre, alcuni processi cellulari, che sono difficili da osservare nelle culture standard, 2D (flat), possono essere osservati da questo nuovo metodo. La figura 1a mostra una sintesi della procedura per la microfabbricazione CE (vedi anche la sezione 1 del protocollo sopra descritto ). Il metodo è semplice, veloce, efficiente e senza alcun requisito di attrezzature speciali. Figura 1b e 1c mostra una immagine al microscopio elettronico a scansione ingrandita 'portauova' rispettivamente immagine larga scala e. Come si può osservare, la loro forma e le dimensioni sono molto regolare. Questo metodo è molto flessibile; diverse forme e dimensioni possono essere facilmente fabbricati e adattati per i diversi sistemi modello. Le dimensioni di'eggcups' sono stati selezionati nel seguente modo: dimensionidi cellule che subiscono divisione sono stati misurati su superfici 2D: essi hanno una forma sferica e il loro diametro è stato preso come una buona indicazione per il diametro CE. Le cellule in allungato'eggcups' e orientare lungo il loro asse lungo durante la divisione cellulare, per esempio. Questa dimensione dipende dal sistema - cellule ed embrioni - quindi questa dimensione deve essere valutata in ciascun caso.
La figura 2 mostra il materiale necessario (Figura 2a) e un protocollo step-by-step (Figura 2b) su come utilizzare il 'portauova' (vedi anche la sezione 2 nel protocollo sopra descritto). Il riempimento della CE con le cellule di interesse (o altri sistemi modello) è molto semplice e veloce. In genere, ci vogliono meno di 20-30 minuti, che comprende anche il tempo per tripsinizzazione cellulare. Dopo il riempimento, i campioni possono essere utilizzati per studiare processi attivi (imaging dal vivo) oppure possono essere fissate e colorate per la visualizzazione di organelli of interest (vedi anche le sezioni 3 e 4 nel protocollo di cui sopra).
Su superfici piane, le cellule mostrano risposte eterogenee e fenotipi estremi di organelli cellulari. In realtà, è stato suggerito che stress fibers di actina (e altri organelli cellulari) sono artefatti delle condizioni di coltura 1. Per dimostrare questa ipotesi, abbiamo coltivato le cellule NIH3T3 sia sul 'portauova' in 3D e su superfici piane e confrontato i fenotipi dei diversi organuli cellulari, vale a dire le fibre di stress di actina, apparato di Golgi e dei nuclei. La figura 3 mostra un esempio di come si organizzano le cellule su entrambe le configurazioni. In CE, le cellule sono distribuiti in una matrice ordinata mostra un fenotipo omogeneo sferico-like (Figura 3a). Su superfici piane, le cellule mostrano la tipica disordinato, la diffusione e la morfologia eterogenea (Figura 3b). Ci sono anche differenze significative nelle strutture del citoscheletro. In particolare, celle R16; portauova 'mostrano una riduzione del numero delle fibre di stress rispetto a superfici piane. Ciò è ulteriormente confermato nel 3D immagini in cui non fibre di stress chiare visibili (si veda la Figura 3c - d) ricostruito. Ciò conferma che alcune strutture cellulari sono amplificati in colture 2D. Questo è anche in accordo con le osservazioni eseguite in vivo in cui non possono essere identificati fibre di stress.
L'apparato di Golgi mostra anche significativa variazione della loro fenotipo seconda delle condizioni di coltura (vedere Figura 4). L'apparato di Golgi sulle culture 2D mostra tipicamente un fenotipo esteso 'abbracciare' la periferia nucleo mentre in 'portauova' mostra un fenotipo più compattato (vedi Figura 4a - b). Al fine di simulare una manipolazione screening di stupefacenti, abbiamo anche valutato l'effetto dei farmaci sulle cellule coltivate su entrambi gli ambienti. Abbiamo scelto blebbistatin mainly perché interrompe le fibre di stress di actina e potrebbe avere un effetto sulla morfologia del Golgi (vedi Figura 3c - d). Dal momento che la Golgi si trova vicino al nucleo della cellula, questo farmaco potrebbe anche avere un effetto sulla sua architettura. In primo luogo abbiamo osservato che le cellule trattate con questo farmaco hanno mostrato una morfologia meno regolare ed uniforme rispetto alle cellule wild type (WT) (vedi Figura 3c - d). Abbiamo quindi confrontato e quantificato il fenotipo Golgi osservato su 'portauova' e su superfici piane (vedi figura 4c). Abbiamo osservato che sulle superfici 2D cellule hanno mostrato principalmente un fenotipo esteso, mentre sulle cellule 'eggcups' hanno mostrato un fenotipo più compattato. Non abbiamo osservato però una differenza notevole fra WT e le cellule blebbistatin-trattati.
Infine, sul 2D superfici nucleo cellulare è orientata in modo casuale che per le celle nel CE è ortogonalmente orientato rispetto al piano XY siaWT e blebbistatin cellule trattate (vedi figura 5a - c). Ciò evidenzia la resistenza del dispositivo di organelli cellulari orientare, simile a un ex applicazione del metodo per l'orientamento del piano di osservazione dell'anello cytokinetic in lievito e cellule di mammifero 10,12,13. Infine, abbiamo studiato come la sfericità nucleo (definita come ψ = [π 1/3 di 6V n 2/3] / A n, dove V n è il volume del nucleo e A n sua superficie) risente seconda delle condizioni di coltura e dopo il trattamento delle cellule con blebbistatin. Figura 5d mostra i corrispondenti distribuzioni di ψ. Non abbiamo osservato una differenza per la WT piatto vs WT CE, il quale rivela che la CE non che influenzano la normale sfericità delle cellule. Tuttavia, abbiamo osservato undifferenza quando si confrontano WT CE Blebb CE suggerendo che la CE sono rivelando un vero e proprio effetto del farmaco che viene mascherato in 2D.
studi sulle cellule in diretta con '' portauova permettono anche l'identificazione dei processi attivi nuovi non visibili nelle culture standard. Abbiamo placcato cellule in CE e visualizzati divisione cellulare. La figura 6 mostra una sequenza di immagini della chiusura dell'anello cytokinetic durante la mitosi cellulare. Il dispositivo 'portauova' permette una visualizzazione completa del ring, mentre le culture 2D standard, mostra solo due aree che corrisponde ad un unico piano 10. Ricostruzione dell'anello da una sequenza di immagini z-stack con colture 2D può essere fatto 27, ma le informazioni importanti è perduto. La qualità è diminuita a causa della bassa risoluzione z e processi dinamici non può essere risolto. Actina e miosina sono le proteine chiave nella generazione della forza di divisione cellulare. Le loro dinamiche non possono be ripreso e studiato in 2D cultura (figura 6a), mentre con '' portauova è immediatamente rivelato. Abbiamo identificato nuove strutture e processi in cellule HeLa troviamo accumulazioni periodiche di miosina 17. Questi accumuli muovono radialmente l'anello si chiude (Figura 6b). Nel lievito di fissione troviamo anche disomogeneità in miosina e actina (Figura 6c, a destra) 17. Al contrario di ciò che vediamo in cellule HeLa, ruotano sul ring durante la chiusura. La velocità è nell'intervallo micron min -1 e non sarebbe risolvibile z ricostruzione con microscopi standard. Infine l'anello cytokinetic può essere ulteriormente studiato da colorazione per i suoi componenti. Troviamo che vi è un accumulo di fosfotirosina in prossimità dell'anello (figura 6d). Possiamo anche mostrare che anillin è colocalizing sul ring (Figura 6e). Con colorazione delle cellule in questo orientamento, we rivelano che anillin mostra anche una distribuzione disomogenea.
Sono state applicate le 'portauova' anche a diversi sistemi modello: abbiamo riportato le cellule di mammifero, lievito di fissione, ma abbiamo provato anche in erba lievito e C. elegans (vedi Figura 7a - e). In questo caso, il protocollo è stato adattato per ogni sistema specifico in termini di terreni di coltura, cavità dimensioni e morfologia (vedi Tabella 1). Come esempio, conica V a forma di 'portauova' erano la morfologia ottimale per immobilizzare lievito di fissione efficientemente 12, anziché completamente cilindrica (o ad U) Forma utilizzato per le cellule di mammifero 13. Questo ha permesso testare l'effetto di diversi farmaci citoscheletro con potenziali applicazioni nel campo della ricerca Life Science. Questo dimostra la flessibilità e l'affidabilità della metodologia sviluppata.
Inoltre, la disposizione altamente ordinata di celle consente unafacile, automatizzato lettura di fluorescenza di singole cellule. Illustriamo questo con l'inserimento di cellule NIH3T3 esprimono GFP in "Portauova" (Figura 8a). La posizione della cella può essere facilmente riconosciuto e il livello di espressione corrispondente misurata. Figura 8b mostra la distribuzione dei segnali di fluorescenza. Questo può essere applicato a qualsiasi-out lettura (immunofluorescenza, reporter fluorescenti nelle cellule, per esempio).
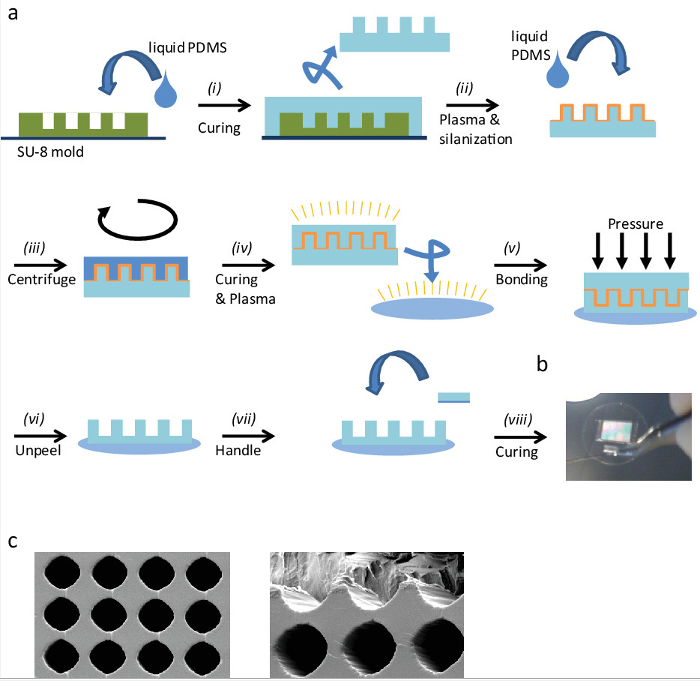
Figura 1: Costruzione di 'Portauova' (a) descrizione schematica della procedura di fabbricazione dei '' portauova per stampaggio replica:. (I) Versare PDMS liquidi sullo stampo SU-8 e curarla. (Ii) Tagliare il timbro e rimuovere accuratamente dalla superficie, quindi PLASMA attivarlo per silanizzare esso. (Iii) Versare PDMS liquido sul timbro silanizzatad centrifugare ad ottenere uno strato sottile PDMS. (Iv) Dopo il trattamento dello strato PDMS, plasma attivare timbro sia, i PDMS coperto e un vetrino di vetro. (V) Plasma legano sia applicando una leggera pressione omogenea. (Vi) dopo l'incollaggio al plasma, rimuovere con attenzione il timbro per scoprire la superficie 'portauova. (Vii) Per semplificare la movimentazione nelle fasi successive, aggiungere un piccolo pezzo maniglia PDMS. Associare il pezzo PDMS al coprioggetto mediante incollaggio con PDMS liquidi e (viii) curare poi nel forno. (B) L'immagine di un coprioggetto 25 mm di altezza PDMS 'portauova' e una maniglia. (C) elettronico a scansione immagini al microscopio di 'Portauova' PDMS. La distanza tra i centri di 'Portauova' è di 30 micron, e il loro diametro di circa 25 micron. (A sinistra) Vista. (A destra) sono tagliati per immagine 'Eggcups' la parte interna. Cliccate qui per vie wa più grande versione di questa figura.

Figura 2: (a) Gli elementi necessari per il riempimento CE. (1) provetta da 50 ml; (2) pezzo cilindrico (superiore e laterale); (3) mezzo di coltura cellulare; (4) "portauova '; (5) pinzette taglienti. (B) Schema della procedura di riempimento CE. (I) Un pezzo cilindrico viene introdotto in una provetta da 50 ml e riempito con 13 ml di mezzo di coltura cellulare. Avanti, (ii) i «portauova 'sono delicatamente depositati sulla parte superiore del pezzo cilindrico con una pinzetta affilati per manipolare il CE utilizzando il piccolo pezzo PDMS. (Iii) Celle a giusta densità vengono pipettati sulla parte superiore della CE. (Iv) Le cellule vengono introdotti negli portauova 'di centrifugazione. (V) Infine, il campione è rilasciato delicatamente dal tubo ed è pronto per l'uso. m / files / ftp_upload / 51880 / 51880fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
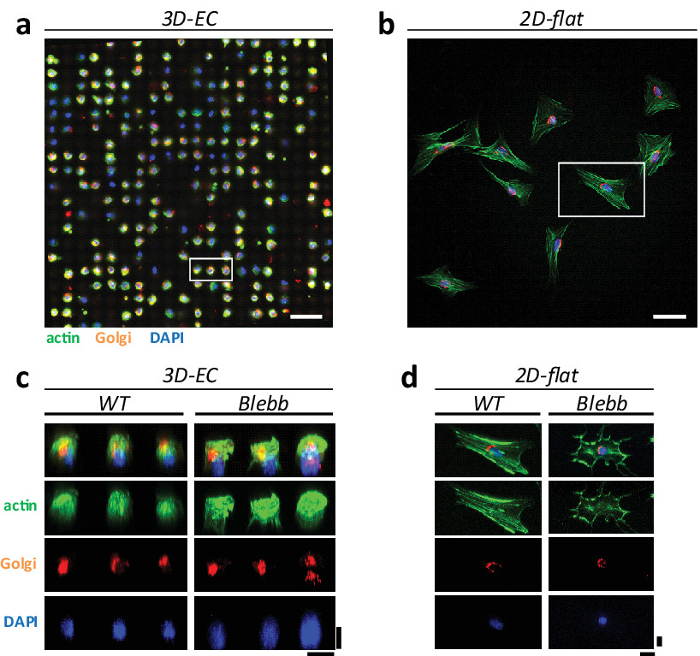
Figura 3: Confronto di fenotipi cellulari su 'Portauova' 3D e superfici piane in 2D. Microscopia confocale (obiettivo 25X acqua, 0,95 NA, Leica) immagine di cellule NIH3T3 su (a), CE che formano un array ordinato, e che mostrano un fenotipo sferica omogenea, e su (b) la cultura piatta standard 2D, distribuito in modo casuale con fenotipi eterogenei. Le cellule sono state colorate per actina (in verde), Golgi (in arancione) e il nucleo (in blu). Barre di scala = 100 micron. Ricostruzione (c) 3D delle cellule di CE e (d) su superfici piane per WT e le cellule blebbistatin-trattati. Barre di scala = 20 micron.880 / 51880fig3large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 4: Studio delle NIH3T3 Golgi apparato fenotipo schematica e di esempio immagine di Golgi classificazione fenotipo per le cellule su (a) piatta e (b), CE.. Le cellule sono state classificate come compattato, estesa o frammentato seconda delle α-value. (C) Quantificazione dei fenotipi Golgi. Barre di scala = 10 micron. Clicca qui per vedere una versione più grande di questa figura.
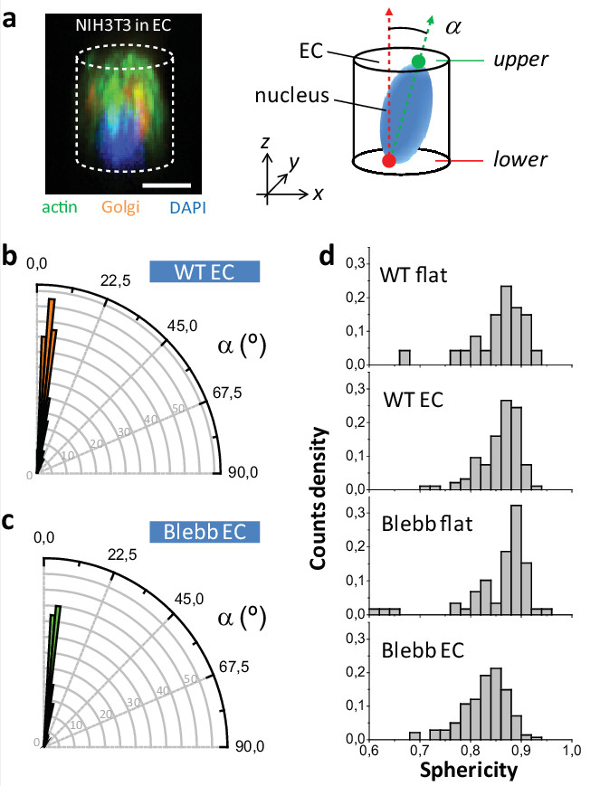
Figura 5: Studio del NIH3T3 nucleo fenotipo. (a) (Sinistra) immagine di microscopia confocale di una cellula NIH3T3 all'interno di un CE e colorate per actina (in verde), Golgi (in arancione) e il nucleo (in blu). (a destra) Schema di orientamento nuclei all'interno CE. (B) la distribuzione angolare dei nuclei all'interno CE per WT e (c), le cellule blebbistatin-trattati. (D) i valori sfericità Nucleo per le cellule WT e blebbistatin trattati sia per EC e superfici piane (P [WT CE -Blebb CE] <0,001, p [Blebb piatto -Blebb CE] <000.1; n = 47 WT piatta, n WT CE = 94, n = 59 Blebb piatta, n Blebb CE = 141 celle). Barra di scala = 10 micron. Cliccate qui per vedere una versione più grande di questa figura.
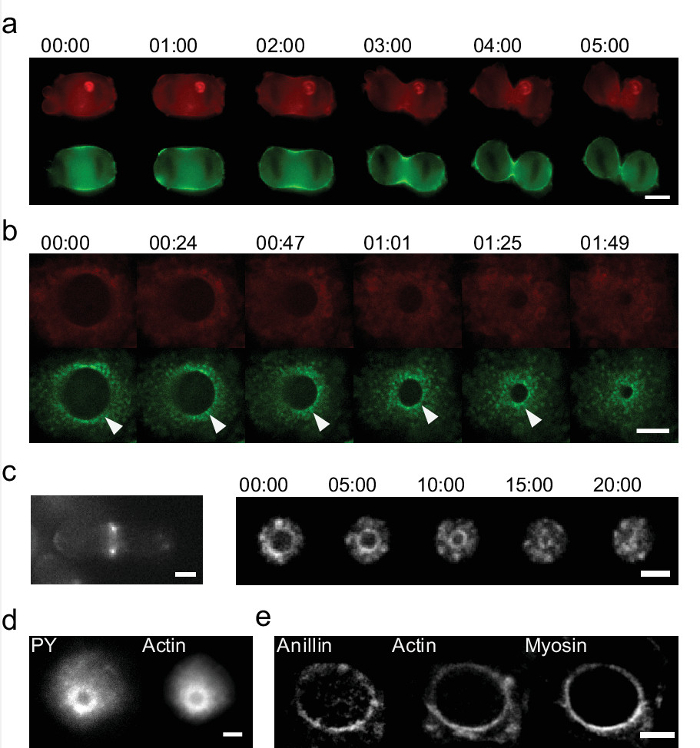
Figura 6: Studio dettagliato del ring cytokinetic in campioni dal vivo e fisse e in due sistemi che utilizzano 'portauova' (a) sequenza di tempo dell'anello cytokinetic utilizzando 2D cultura di serie in vitro.. Solo due punti luminosi in actina (Lifeact-mCherry, rosso) e miosina (GFP etichettati, verde) sono visibili nel solco scissione delle cellule HeLa (Barra di scala = 10 micron). (B) la sequenza momento della chiusura per l'anello cytokinetic in cellule HeLa durante la mitosi usando 'portauova. Le immagini mostrano actina (in rosso) e miosina (verde). 'Eggcups' permettono l'identificazione di accumuli ancora miosina. Un esempio è evidenziato con una freccia. (Scala bar = 5 micron). (C) L'anello cytokinetic può anche essere visualizzato in lievito di fissione. (A sinistra) Le cellule si trovano su una superficie piana, la cito anello cinetica è visibile solo da due punti (destra) Le cellule in 'portauova':. l'intero chiusura può essere catturato. Actina è etichettato con CHD-GFP (bar scala = 2 micron). Tempo in min: sec. (D - e) Esempi di anelli cytokinetic macchiati. (D) actina-GFP che esprimono le cellule HeLa sono macchiati per fosfotirosina (PY), che mostra anche il segnale sul ring (Scala bar = 5 micron). Cellule (e) HeLa che esprimono GFP etichettati miosina e Lifeact-mCherry (actina) sono macchiati per anillin. Anillin si rivela di localizzare sul ring cytokinetic e meno concentrato nella corteccia. Essa mostra co-localizzazione con l'actina e miosina (scala bar = 5 micron). Clicca qui per vedere una versione più grande di questa figura.
80 / 51880fig7.jpg "/>
Figura 7:. L'applicazione dei 'portauova' ad altri tipi di cellule e sistemi modello (a) U2OS (osteosarcoma umano). L'inserto mostra una cella di divisione. (Scala bar = 20 micron). (B) le cellule NIH3T3 esprimono GFP. Differenza di livelli di espressione può essere facilmente letta (Barra di scala = 20 micron). (C) le cellule SW480 (Scala bar = 20 micron). (D) il lievito; il tempo di ciclo è invariato. (Scala bar = 10 micron). (E) C. elegans vermi;. (a sinistra) su una superficie piana (a destra) '' portauova, embrione è visto da una prospettiva altrimenti nascosti. (Barre scale = 10 micron). Tempo in min. Sec Clicca qui per vedere una versione più grande di questa figura.
Figura 8: L'organizzazione in una serie di '' portauova consente un'analisi automatizzata di popolazione di cellule (a) cellule NIH3T3 in CE (scala bar = 20 micron).. Hanno diversi livelli di espressione di GFP. (B) il riconoscimento automatico di posizione della cella consente un'analisi individuale del livello di espressione. Si è riassunta nel istogramma della espressione GFP della popolazione cellulare. Clicca qui per vedere una versione più grande di questa figura.
| Modello di sistema | Digitare | Terreno di coltura | osservazione Media | diametro (μ 'eggcups'; M) | Commenti / Descrizione |
| Le cellule di mammiferi | NIH3T3 | 10% BCS DMEM ad alto glucosio | 10% BCS L-15 | 20 | Altre linee stabili di cellule, come REF52 o MDCK, così come le linee cellulari primarie, cellule cancerose e / o le cellule staminali possono essere inseriti anche negli portauova. |
| HeLa | 10% FCS DMEM ad alto glucosio | 10% FCS L-15 | 25 | Disponibile da molte fonti diverse. | |
| U2OS | 10% FCS DMEM ad alto glucosio | 10% FCS L-15 | 20-25 | Disponibile da molte fonti diverse. | |
| SW480 | 10% FCS DMEM ad alto glucosio | 10% FCS L-15 | 17-20 | Disponibile da molte fonti diverse. | |
| Lievito | lievito di fissione | agarpiastra (YE5S) e liquidi dei media (YE5S e EMM5S) | Filtro sterilizzato supporti EMM (si veda l'elenco dei materiali) | 5 | La superficie non deve essere funzionalizzati con proteine adesive. |
| lievito in erba | piastra di agar (YPD) e liquidi dei media (YEPD e SD) | supporto SD | 5 | La superficie non deve essere funzionalizzati con proteine adesive. | |
| Embrione | C. elegans | piatto NGM | acqua ultrapura | 25 | Alternativamente mezzo M9 può essere utilizzato per esperimenti a lungo termine. La ricetta di questa soluzione salata può essere trovato qui: http://cshprotocols.cshlp.org/content/2009/5/pdb.rec11798.full?text_only=true |
Tabella 1: Condizioni di coltura in 'portauova' per i diversi sistemi modello. Il protocollo di cui sopra relative può essere facilmente adattatosemplicemente sostituendo le condizioni di coltura descritte e la dimensione del "portauova.
Discussione
stampaggio replica è stato utilizzato per fabbricare i 'portauova. Il processo di fabbricazione non ha bisogno di una camera pulita; è facile e semplice, anche se una certa pratica può essere richiesto. In particolare, rilasciando il timbro PDMS è la fase più critica per produrre una vasta area di 'portauova' alta qualità. Per questo motivo, particolare attenzione deve essere presa in questo passo. Se questo passaggio è più volte fallendo, prendere in considerazione per ottimizzare i parametri del plasma puliti prima della silanizzazione e plasmatiche. silanizzazione insufficiente porterà a forte aderenza del timbro al film PDMS. Se si osserva, il tempo di incubazione con il reagente silanizzazione può essere aumentata. Notare che altre tecniche e materiali possono essere applicati per fabbricare i "portauova", che possono essere funzionalizzati con una vasta gamma di ligandi (fibronectina, gelatina, collagene, ecc). In particolare, microcavità in polistirene possono essere facilmente fabbricati mediante custom-made tecnica hot-goffratura. Questo assicura biocompatibilità e confronto diretto con i risultati ottenuti in piatti standard della cultura. Analogamente, particolare cura e pratica sono necessari al fine di ottimizzare la percentuale di riempimento. In particolare, la fase di risciacquo è fondamentale per garantire un riempimento adeguato senza eccesso di cellule, contribuendo al rumore e lo sfondo nel segnale. Se le cellule vengono rimosse facilmente dalla cavità, prendere in considerazione per modificare le dimensioni o la profondità delle cavità.
'Eggcups' forniscono l'architettura 3D-come le cellule e test di screening ad alto contenuto utilizzando un protocollo semplice. organelli cellulari ei processi attivi sconosciuti utilizzando analisi di coltura standard possono essere facilmente visualizzati mediante l'inserimento di singole cellule su singoli microcavità ( 'eggcups'). A seconda del sistema modello, la dimensione, la forma e le loro dimensioni possono essere facilmente adattati. In questo modo le cellule di mammifero, lievito di fissione, il lievito e C. elegans cun essere manipolati e studiati, così come tutti gli embrioni, come Drosophila, topi o embrioni umani per la fecondazione in vitro, o le cellule staminali, per esempio.
In questa configurazione singole cellule vengono catturati. Questo è in contrasto con tessuti epiteliali incontrati in vivo. Tuttavia, questo ambiente potrebbe essere riprodotta nei nostri 'portauova' rivestendo le pareti laterali con cadherins di imitare i contatti cellula-cellula utilizzando elastomeri più flessibili. contatti focali saranno promosse dal deposito di fibronectina al fondo dei pozzetti. Questi rispettive distribuzioni delle molecole di adesione dovrebbero consentire nel riprodurre ambienti cellulari riscontrate in vivo. Con questo metodo si potrebbe avvicinarsi alle condizioni fisiologiche.
cambio medio nel nostro test è assicurata. Le cellule in CE non mostrano alcuna degradazione durante l'esecuzione di esperimenti sia a breve che a lungo termine a causa della mancanza di mezzo di scambio. Si noti anche che le cellule in ca CEn essere coltivato fino confluenza anche se l'interesse principale è quando singole cellule o embrioni sono isolate all'interno delle cavità.
Orientamento di organelli o interi organismi sta rivelando nuove informazioni. Mostriamo diverse dinamiche di actina e miosina sul ring cytokinetic. Anche se l'anello cytokinetic nella fissione lievito e cellule di mammifero è composto da componenti chiave simili, mostriamo con questa configurazione, che le loro specifiche dinamiche è diverso 17. Questo sostiene il risultato che il meccanismo di chiusura nei due sistemi è differente. Per sviluppare e studiare questa ipotesi, l'orientamento della cella è indispensabile. In studi futuri, questo dispositivo può essere utilizzato anche per studiare altri eventi relativi alla organelli organizzazione in cellule.
Oltre a ciò, questa tecnica può essere di grande utilità in biologia dello sviluppo. embrioni allungati possono essere facilmente orientati, osservati o ulteriormente trattati in un orientamento definito.Probabilmente il nostro test non imporrebbe polarità embrioni, ma la percentuale elevata di riempimento permetterebbe di estrarre la visualizzazione desiderato in modo affidabile. Complessivamente 'portauova' potrebbe essere un buon dispositivo per proiezioni ad alta contenuto.
Sono stati proposti altri test di cultura. Questi metodi vanno da più celle di dimensioni 2D in piastre a pozzetti multipli, a singole celle depositate in motivi adesivi micropatterned con forma identica. Tuttavia, nessuno di essi è appropriato per superare le limitazioni descritte sopra sull'osservazione di organelli cellulari e processi dinamici 1.
Futuri miglioramenti al nostro sistema permetterà l'applicabilità 'portauova' a fini orientati al settore. Per esempio, applicazioni di screening farmaco in società farmaceutiche richiedono l'uso di piastre multipozzetto 14,28; attuazione '' portauova in tali piattaforme potenzialmente migliorare l'affidabilità deitest e risultati. Come tale, alti dosaggi contenuti di screening verranno eseguite utilizzando i processi automatizzati di uso comune delle aziende farmaceutiche (e laboratori di ricerca accademici) utilizzando robot. Questo assicurerà la ripetibilità e l'affidabilità con bassa variabilità. Alcuni prodotti commerciali a base di saggi in coltura 3D-cellulari sono già apparsi sul mercato evidenziando l'importanza di questo tipo di analisi. Infine, questi dispositivi aprono nuove prospettive per la medicina personalizzata: cellule dal paziente potrebbe essere collocato in 'portauova', e cocktail di trattamento potrebbero essere testati in un ambiente fisiologico; il biomarker read-out consentirà di anticipare un trattamento ottimale da dare al paziente 29. Complessivamente la forma fisica delle cellule ed embrioni stanno guidando l'architettura delle cavità, e speriamo che il dispositivo e questo metodo saranno ampiamente diffusi in futuro.
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Riconosciamo L. Brino (impianto di screening Content IGBMC alta, Illkirch, Francia) per averci fornito l'anticorpo anti-Giantin, M. Labouesse Lab. per C. elegans (IGBMC) e B. Séraphin Lab. per il lievito (IGBMC), E. Paluch e A. Hyman per le cellule HeLa fluorescenti (MPI-CBG, Dresda), J. Moseley (Dartmouth Medical School) e JQ Wu (Ohio State University) per le cellule di lievito di fissione; A. Hoël e F. Evenou aiuto sperimentale, C. Rick (IBMC, Strasburgo, Francia) per assistenza tecnica, e JC Jeannot (Femto-st, Francia) per un aiuto nella microfabbricazione. Questo lavoro è stato sostenuto da fondi del CNRS, l'Università di Strasburgo, Conectus, La Fondation pour la Recherche Médicale e la ci-FRC di Strasburgo.
Materiali
| Name | Company | Catalog Number | Comments |
| ddH20 (ultrapure) | Millipore | - | Use always fresh water. |
| Parafilm (plastic film) | Bemis | PM-999 | Adhere Parafilm to the lab bench using some water droplets and ensure a perfect surface flatness. |
| Photo-mask | Selba | - | http://www.selba.ch |
| Silicon wafer | Siltronix | - | http://www.siltronix.com/ |
| SU-8 photoresist | MicroChem | 2000 series | http://www.microchem.com/Prod-SU82000.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| SU-8 developer | MicroChem | - | http://microchem.com/Prod-Ancillaries.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information | |||
| 2-propanol | Sigma-Aldrich | 19030 | http://www.sigmaaldrich.com/catalog/product/sial/i9030?lang=en®ion=CA |
| Available from multiple companies. | |||
| Sigmacote (siliconizing reagent ) | Sigma-Aldrich | SL2-25ML | http://www.sigmaaldrich.com/catalog/product/sigma/sl2?lang=fr®ion=FR |
| harmful, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Chlorotrimethylsilane (TMCS) | Sigma-Aldrich | 386529-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/386529?lang=fr®ion=FR |
| TMCS produces acute inhalation and dermal toxicity, and is highly flammable (with ignition flashback able to occur across considerable distances), consequently it should be used in a fume cupboard away from sources of ignition | |||
| Nitrile gloves | Kleenguard | 57372 | http://www.kcprofessional.com/products/ppe/hand-gloves/thin-mil-/57372-kleenguard-g10-blue-nitrile-gloves-m |
| Available from multiple companies. | |||
| Glass coverslips #0 | Knittel glass | KN00010022593 | http://www.knittelglass.com/index_e.htm |
| Very fragile. Manipulate gently. | |||
| Sharp straight tweezers | SPI | 0WSSS-XD | http://www.2spi.com/catalog/tweezers/t/elec7 |
| 50 ml tube | BD Falcon | 352070 | http://www.bdbiosciences.com/cellculture/tubes/features/index.jsp |
| Available from multiple companies. | |||
| PDMS | Dow Corning | Sylgard 184 kit | http://www.dowcorning.com/applications/search/default.aspx?R=131EN |
| The package contains both PDMS base and curing agent. Similar elastomers are available from multiple companies. | |||
| Microscope glass slides | Dutscher | 100001 | http://www.dutscher.com/frontoffice/search |
| Available from multiple companies. | |||
| DMEM high-glucose medium | Fisher Scientific | 41965-039 | http://www.fishersci.com/ecomm/servlet/Search?LBCID=12301479&keyWord=41965-039&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Bovine calf serum | Sigma-Aldrich | C8056-500ML | http://www.sigmaaldrich.com/catalog/product/sigma/c8056?lang=en®ion=CA |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200-072 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=25200-072&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS 1x | Fisher Scientific | 14200-067 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=14200-067&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS is at 10x and should be diluted to 1x using ddH2O | |||
| L-15 medium | Fisher Scientific | 21083-027 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=21083-027&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Medium for atmospheres without CO2 control | |||
| Fibronectin | Sigma-Aldrich | F1141-5MG | http://www.sigmaaldrich.com/catalog/search?interface=All&term=F1141-5MG&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Penicillin & Streptomycin | Fisher Scientific | 15140-122 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=15140-122&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=CHEM |
| Petri dish P35 | Greiner | 627102 | http://www.greinerbioone.com/en/row/articles/catalogue/article/144_11/12885/ |
| Petri dish P60 | Greiner | 628163 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/145_8_bl/24872/ |
| Petri dish P94 | Greiner | 633179 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/146_8_bl/24882/ |
| Paraformaldehyde 3 % | Sigma-Aldrich | P6148-500G | http://www.sigmaaldrich.com/catalog/product/sial/p6148?lang=fr®ion=FR |
| Harmful in-particular for the eyes, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Triton 0.5 % | Sigma-Aldrich | 93443-100ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=93443-100ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Phallodin-Green Fluorescent Alexa Fluor 488 | InVitrogen | A12379 | http://www.lifetechnologies.com/order/catalog/product/A12379?CID=search-a12379 |
| dissolve powder in 1.5 ml methanol | |||
| Alexa Fluor 647 | InVitrogen | A21245 | 1:200 dilution in PBS 1x |
| rabbit polyclonal anti-Giantin | Abcam | ab24586 | 1:500 dilution in PBS 1x |
| http://www.abcam.com/giantin-antibody-ab24586.html | |||
| rabbit anti-anillin | Courtesy of M. Glotzer, Published in Piekny, A. J. & Glotzer, M. Anillin is a scaffold protein that links RhoA, actin, and myosin during cytokinesis. Current biology 18, 30–6 (2008). | 1:500 dilution in PBS 1x | |
| Anti-phosphotyrosine | Transduction Lab | 610000 | http://www.bdbiosciences.com/ptProduct.jsp?ccn=610000 |
| Cy3 goat anti-rabbit | Jackson Immunoresearch | 111-166-047 | http://www.jacksonimmuno.com/catalog/catpages/fab-rab.asp |
| 1:1,000 dilution in PBS 1x | |||
| DAPI | Sigma-Aldrich | D8417 | http://www.sigmaaldrich.com/catalog/product/sigma/d8417?lang=fr®ion=FR |
| 1 mg/ml for 1 min | |||
| Glycerol | Sigma-Aldrich | G2025 | http://www.sigmaaldrich.com/catalog/search?interface=All&term=G2025&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Mineral oil | Sigma-Aldrich | M8410-500ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=M8410-500ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| HeLa cells | - | - | Mammalian cells are available from many companies. See also Table 1 |
| NIH3T3 cells | ATCC | - | Mammalian cells are available from many companies. See also Table 1 |
| Fission yeast | - | - | For details on strains, contact the corresponding author. See also Table 1 |
| C. elegans worms | - | - | For details, contact the corresponding author. See also Table 1 |
| YES (Agar) + 5 Supplements included | MP Biomedicals | 4101-732 | http://www.mpbio.com/search.php?q=4101-732&s=Search |
| For preparation: follow instructions as given on the box | |||
| YES (Media) + 5 Supplements included | MP Biomedicals | 4101-522 | http://www.mpbio.com/search.php?q=4101-522&s=Search |
| For preparation: follow the instructions as given on the box | |||
| EMM (Media) | MP Biomedicals | 4110-012 | http://www.mpbio.com/search.php?q=4110-012&s=Search |
| For preparation: follow instructions as given on the box | |||
| Filter sterilized EMM (Media) - Only for imaging | MP Biomedicals | 4110-012 | For preparation: follow instructions as given on the box. Filter sterilize the media using a 0.22 µm filter instead of autoclaving. This gives transparency to the media and reduces the autofluorescence. |
| Supplements (for EMM) | MP Biomedicals | 4104-012 | http://www.mpbio.com/search.php?q=4104-012&s=Search |
| (Add 225 mg/L into the EMM media before autoclaving or filtering) | |||
| Stericup and Steritop Vaccum driven sterile filters | Millipore | - | http://www.millipore.com/cellbiology/flx4/cellculture_prepare&tab1=2&tab2=1#tab2=1:tab1=2 |
Riferimenti
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294, 1708-1712 (2001).
- Azioune, A., Storch, M., Bornens, M., Thery, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab Chip. 9, 1640-1642 (2009).
- Mandal, K., Balland, M., Bureau, L. Thermoresponsive Micropatterned Substrates for Single Cell Studies. PLoS ONE. 7, e37548(2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nat Rev Mol Cell Biol. 8, 839-845 (2007).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. , (2012).
- Ghibaudo, M., Di Meglio, J. M., Hersen, P., Ladoux, B. Mechanics of cell spreading within 3D-micropatterned environments. Lab Chip. 11, 805-812 (2010).
- Greiner, A. M., Richter, B., Bastmeyer, M. Micro-Engineered 3D Scaffolds for Cell Culture Studies. Macromol Biosci. 12, 1301-1314 (2012).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat Mater. 12, 458-465 (2013).
- Legant, W. R., et al. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat Meth. 7, 969-971 (2010).
- Devices and methods for observing the cell division. , WO/2010/092116 (2010).
- Ochsner, M., et al. Micro-well arrays for 3D shape control and high resolution analysis of single cells. Lab Chip. 7, 1074-1077 (2007).
- Devices and methods for observing cells with cell wall or invertebrate embryos with oblong eggshell . , WO2013144302 (2012).
- Devices and methods for observing eukaryotic cells without cell wall. , WO2013135809 (2012).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends Biotech. 28, 237-245 (2010).
- Wolfe, D., Qin, D., Whitesides, G. Microengineering in Biotechnology, Ch 3. Methods in Molecular Biology. Hughes, M. P., Hoettges, K. F. 583, Humana Press. 81-107 (2010).
- Mehling, M., Tay, S. Microfluidic cell culture. Curr Op Biotech. 25, 95-102 (2014).
- Wollrab, V., Thiagarajan, R., Wald, A., Kruse, K., Riveline, D. Still and rotating myosin clusters determine cytokinetic ring constriction. Nat Commun. 7, 11860-11869 (2016).
- Yao, X., et al. Functional analysis of single cells identifies a rare subset of circulating tumor cells with malignant traits. Integr Biol. 6, 388-398 (2014).
- Eberwine, J., Sul, J. Y., Bartfai, T., Kim, J. The promise of single-cell sequencing. Nat Meth. 11, 25-27 (2014).
- Allen, T. D., et al. Generation of cell-free extracts of Xenopus eggs and demembranated sperm chromatin for the assembly and isolation of in vitro-formed nuclei for Western blotting and scanning electron microscopy (SEM). Nat. Protocols. 2, 1173-1179 (2007).
- Robbins, E., Marcus, P. I. Mitotically Synchronized Mammalian Cells: a Simple Method for Obtaining Large Populations. Science. 144, (1964).
- Whitfield, M. L., et al. Stem-loop binding protein, the protein that binds the 3" end of histone mRNA, is cell cycle regulated by both translational and posttranslational mechanisms. Molecular and Cellular Biology. 20, (2000).
- Straight, A. F., et al. Dissecting Temporal and Spatial Control of Cytokinesis with a Myosin II Inhibitor. Science. 299, 1743-1747 (2003).
- Tang, J., Erikson, R. L., Liu, X. Checkpoint kinase 1 (Chk1) is required for mitotic progression through negative regulation of polo-like kinase 1 (Plk1). Proc Natl Acad Sci. 103, 11964-11969 (2006).
- Zahreddine, H., Zhang, H., Diogon, M., Nagamatsu, Y., Labouesse, M. CRT-1/Calreticulin and the E3 Ligase EEL-1/HUWE1 Control Hemidesmosome Maturation in C. elegans Development. Curr Biol. 20, 322-327 (2010).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans Methods: Synchronization and Observation. JoVE. , e4019(2012).
- Saha, S., Pollard, T. D. Anillin-related protein Mid1p coordinates the assembly of the cytokinetic contractile ring in fission yeast. Mol Biol Cell. 23, 3982-3992 (2012).
- Prestwich, G. D. Evaluating Drug Efficacy and Toxicology in Three Dimensions: Using Synthetic Extracellular Matrices in Drug Discovery. Acc Chem Res. 41, 139-148 (2007).
- Futamura, Y., et al. Morphobase, an Encyclopedic Cell Morphology Database, and Its Use for Drug Target Identification. Chem Biol. 19, 1620-1630 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon