Method Article
Bestellen Einzelzellen und Einzel Embryos in 3D Confinement: Ein neues Gerät für High Content Screening
In diesem Artikel
Zusammenfassung
Wir berichten über eine Vorrichtung und ein neues Verfahren Zellen und Embryonen zu untersuchen. Einzelne Zellen werden in Mikroresonator-Arrays genau bestellt. Ihre 3D Haft ist ein Schritt in Richtung 3D-Umgebungen unter physiologischen Bedingungen auf und lässt zu Organell Orientierung. Durch die Steuerung der Zellform, minimiert diese Setup-Variabilität in Standardtests berichtet.
Zusammenfassung
Biologische Zellen sind in der Regel auf ebenen (2D) Oberflächen beobachtet. Dieser Zustand ist nicht physiologisch, und Phänotypen und Formen sind sehr variabel. Screening auf Basis von Zellen in solchen Umgebungen haben daher gravierende Einschränkungen: Zellorganellen zeigen extreme Phänotypen, Zelle Morphologien und Größen sind heterogene und / oder spezifische Zellorganellen nicht richtig sichtbar gemacht werden kann. Darüber hinaus werden in vivo Zellen in einer 3D - Umgebung angeordnet ist ; In dieser Situation zeigen Zellen unterschiedliche Phänotypen vor allem wegen ihrer Wechselwirkung mit der umgebenden extrazellulären Matrix des Gewebes. Um Reihenfolge der einzelnen Zellen in einem physiologisch relevanten 3D - Umgebung für zellbasierte Assays zu standardisieren und zu erzeugen, berichten wir hier die Mikrofertigung und Anwendungen einer Vorrichtung zur In - vitro - 3D - Zellkultur. Diese Vorrichtung besteht aus einer 2D - Anordnung von Mikrokavitäten (typischerweise 10 5 Kavitäten / cm 2), die jeweils mit einzelnen Zellen oder Embryonen gefüllt. Zell position, Form, Polarität und interne Zellorganisation dann normalisiert werden eine 3D-Architektur zeigt. Wir verwendeten Replik Formens Muster eine Reihe von Mikrokavitäten, 'eggcups', auf eine dünne Polydimethylsiloxan (PDMS) Schicht auf einem Deckglas geklebt. Hohlräume wurden mit Fibronectin bedeckt Haftung zu erleichtern. Zellen wurden durch Zentrifugation eingesetzt. Füllprozentsatz wurde für jedes System optimiert, um 80% ermöglicht werden. Die Zellen und Embryonen Lebensfähigkeit wurde bestätigt. Wir wendeten diese Methode zur Visualisierung von Zellorganellen wie Nukleus und Golgi-Apparat, und aktive Verfahren, wie das Schließen des Rings während zytokinetischen Zellmitose zu studieren. Dieses Gerät erlaubt die Identifizierung von neuen Features, wie zB periodische Ansammlungen und Inhomogenitäten von Myosin und Aktin während der zytokinetischen Ringschluss und verdichtet Phänotypen für Golgi und Kern-Ausrichtung. Wir gekennzeichnet , das Verfahren für Säugetierzellen, Spalthefe, Bäckerhefe, C. elegans with spezifische Anpassung in jedem Fall. Schließlich machen die Eigenschaften dieses Gerät interessant besonders für Arzneimittel-Screening-Assays und personalisierte Medizin.
Einleitung
Strom in vitro zellbasierten Assays , sind zweidimensionale (2D). Diese Konfiguration ist nicht natürlich für Säugerzellen und ist daher nicht physiologisch relevant 1; Zellen zeigen eine Vielfalt von Formen, Größen und heterogenen Phänotypen. Sie stellen zusätzliche ernsthafte Einschränkungen bei dem Screening-Anwendungen angewandt, wie beispielsweise eine ungeordnete Verteilung innerhalb der Ebene und extreme Phenotypen von Zellorganellen (Stressfasern, insbesondere). Dies ist besonders wichtig in klinischen Studien für Drogentests, bei denen eine hohe Budgets jedes Jahr ausgegeben. Die meisten dieser Medikamente versagen jedoch, wenn die Tiermodelle angewandt wegen der künstlichen 2D-Kulturbedingungen in frühen Phasen der Wirkstoffscreening. Zusätzlich kann durch diesen Ansatz verwenden, bestimmte Zellorganellen nicht richtig dargestellt werden kann, wie beispielsweise die zytokinetischen Actomyosin Ring während Mitose und allgemein Strukturen, die in der Ebene senkrecht zur Ebene des Beobachtungs entwickeln sich. Etwasneue 2D - Assays wurden zu überwinden , um die oben erwähnten Nachteile und wichtige Erkenntnisse über Zytoskelettorganisation wurden 2,3 beobachtet vorgeschlagen. Allerdings sind diese Tests noch vorhanden eine ernsthafte Einschränkung: zeigen Zellen , die einen sehr Ausbreitung Phänotyp im Gegensatz zu dem, was in vivo beobachtet wird, wo Zellen , die eine 3D - Architektur präsentieren. Diese Artefakte mit dem Kulturverfahren verbunden sind, können auslösen nichtphysiologischen Eigenschaften wie verbesserte Stressfasern 1,4,5.
Dreidimensionale Zellkultur - Assays bieten mehrere Vorteile im Vergleich zu den 2D - Umgebungen 6,7. Sie sind physiologisch relevanter, und die Ergebnisse sind daher sinnvoll. Als Beispiel zeigen in Hydrogelen eingebetteten Zellen 3D-ähnliche Strukturen , aber ihre Morphologien unterscheiden sich von einer Zelle in eine andere 8,9. Jedoch ihre Morphologien unterscheiden sich von einer Zelle zur anderen, die Screening-Anwendungen erschwert. Eine alternative Strategie ist Single einzubettenZellen in mikrostrukturierten Hohlräumen 10,11. Zell Position, Form, Polarität und interne Zellorganisation kann dann normalisiert werden. Neben der Bereitstellung von 3D-like Architektur an Zellen, Mikrokavitäten ermöglicht auch für High-Content - Screening - Studien 10,12-14; Einzelzellen können in Microarrays und Zellorganellen und ihre Entwicklungen bestellt werden können parallel beobachtet werden. Diese Regelmäßigkeit liefert gute Statistiken mit geringen Anzahl von Zellen und eine bessere zeitliche / räumliche Auflösungen. Nützliche Verbindungen sind leichter zuverlässig zu identifizieren.
In dieser Studie zeigen wir die Herstellung und Anwendung einer neuen 3D-like Kultursystem einzelne Zellen für die High-Content-Screening - Anwendungen 10,12,13. Die Vorrichtung besteht aus einer Anordnung von elastomerem Mikrokavitäten (10 5 Hohlräumen / cm 2), geprägt 'eggcups' (EC). Abmessungen und das Gesamtvolumen der EG in dieser Arbeit sind mit dem typischen Volumen einzelner NIH3T3 und HeLa-Zellen optimiertwährend der Zellteilung. Morphologie der Hohlräume - zylindrisch - richtig zu orientieren Zellform zur Sichtbarmachung von aktiven Prozessen ausgewählt wird. Replica Form wird Muster eine Anordnung von EC auf einen dünnen Polydimethylsiloxan (PDMS) Schicht auf einem Glas geklebt verwendet 15,16 Deckglas. Die Zellen werden in der EC durch Zentrifugation eingeführt. Wir berichten hier über die Beobachtung und Normalisierung der Zellorganellen (Aktin-Stressfasern, Golgi-Apparat und Kern) in 3D (EG) im Vergleich zu den gleichen Zellen auf 2D (flach) Oberflächen. Wir berichten auch die Beobachtung der aktiven dynamische Prozesse wie die Schließung des zytokinetischen Aktomyosin Ring während Mitose 17. Schließlich zeigen wir Ergebnisse dieser Methodik auf anderen Systemen mit starren Wänden, wie Bäckerhefe, Spalthefe und C. elegans Embryonen , die die Anwendbarkeit unserer Methodik auf eine breite Palette von Modellsystemen bestätigt.
Wir präsentieren neben eine vollständige und genaue protokoll, um die 'eggcups' für 3D-Mikro herzustellen und anzuwenden. Unser Ansatz ist einfach und nicht ein sauberes Zimmer benötigen. Wir gehen davon aus, dass diese neue Methode besonders interessant für Wirkstoff-Screening werden Assays und personalisierte Medizin, in der Ersatz von Petrischalen. Schließlich wird unsere Vorrichtung zur Untersuchung der Verteilung von Zellen Reaktionen auf externe Stimuli, beispielsweise bei Krebs 18 oder in der Grundlagenforschung 19 nützlich sein.
Protokoll
1. Mikrofertigung von 'Eggcups'
- Die Herstellung des Master: Mikrokavitäten Array
- Erhitzen Sie eine 3 '' Silizium-Wafer auf 200 ° C bis ob Feuchtigkeit verdunsten.
- Spin-Mantel eine dünne Schicht aus SU-8 Photoresist. Einstellen der Lautstärke Harz und Spinngeschwindigkeit in Abhängigkeit von der gewünschten Dicke und Photoresisttyp. Diese Dicke wird die Tiefe der 'eggcups' (EG) diktieren. Für eine 30 & mgr; m dicke Schicht und SU-8 2025, Spin-Beschichtung bei 2800 Umdrehungen pro Minute.
- Pre-Bake-Wafer bei 65 ° C für 1 min (Schritt 1 von 2) für eine 30 & mgr; m dicken SU-8 2025 Schicht. Passen Sie die Zeit in Abhängigkeit von der Photoresist-Art und der Dicke gewünscht. Überprüfen Sie den Hersteller Datenblatt.
- Pre-Bake-Wafer bei 95 ° C für 3 min (Schritt 2 von 2) für eine 30 & mgr; m dicken SU-8 2025 Schicht. Passen Sie die Zeit in Abhängigkeit von der Photoresist-Art und der Dicke gewünscht. Überprüfen Sie den Hersteller Datenblatt.
- Laden Sie dasWafer auf der Mask Aligner für UV-Exposition. Legen Sie die photolithographische Maske auf sie. Die Maske zeigt ein Muster von kreisförmigen Merkmalen (Platten) von 20 & mgr; m im Durchmesser. Achten Sie auf einen einwandfreien Kontakt zwischen einander.
HINWEIS: Verschiedene Hersteller Photolithographiemasken bieten. Die räumliche Auflösung wird die endgültigen Kosten bestimmen. Acetate Masken eine akzeptable Auflösung (≈10 um) zu niedrigen Kosten. Chrommasken eine bessere Auflösung, sind aber teurer. Anpassung der Durchmesser der Scheiben (von der photolithographischen Maske) zu dem Volumen der Zellen. Abmessungen der Scheiben auf der Maske wird der Durchmesser der Hohlräume des Gerätes bestimmen. Kleine Durchmesser wird auf einen niedrigen Füllung führen; zu großen Durchmesser wird nicht die Zellen begrenzen. Für HeLa und NIH3T3-Zellen, mit Durchmessern von 20 um bis 25 um vorgeschlagen. - Überprüfen Sie die Leistung der UV-Lampe vor Exposition und entsprechend zu optimieren, die Belichtungszeit. Bestrahlen (Wellenlänge = 365 nm) 41,5 sec (oder die optimierte Belichtungszeit) bei250 mJ / cm 2.
HINWEIS: SU-8 2025 ein negativer Photoresist ist, was bedeutet, dass belichtete Bereiche mit UV ausgehärtet wird. In diesem Fall waren die kreisförmige Merkmale schwarz und der Rest transparent. Positive Photoresist-Arbeit auf dem umgekehrten Weg: nicht-belichteten Bereiche gehärtet sind. Wählen Sie die Photoresist entsprechend, abhängig von der Konstruktion und Photomaske.
Hinweis: Um die Augen vor UV-Licht mit einer geeigneten Schutzbrille schützen. - Entfernen Sie vorsichtig die Maske aus dem Photoresist-Schicht.
- Post-Bake dem Wafer bei 65 ° C für 1 min (Schritt 1 von 2) für eine 30 & mgr; m dicken SU-8 2025 Schicht. Post-Bake dem Wafer bei 95 ° C für 3 min (Schritt 2 von 2) für eine 30 & mgr; m dicken SU-8 2025 Schicht. Passen Sie die Zeit in Abhängigkeit von der Photoresist-Art und der Dicke gewünscht. Überprüfen Sie den Hersteller Datenblatt. Nach dem Post-Backen, Kühlen der Wafer auf Raumtemperatur auf der Bank für ca. 1 min.
- Platzieren Sie den Wafer in der Spin-Coater und fallen einige mm von SU-8-Entwickler zu deckendie gesamte Waferfläche. Entwickeln für 2 min und dann spin-coat für 30 sec bei 1000 rpm. Wiederholen Sie den Vorgang dreimal.
- Spülen Sie mit 2-Propanol die vollständige Entfernung von unbebauten SU-8 zu gewährleisten. Auftreten von weißen Regionen ist ein Hinweis auf unvollständige Entwicklung. Wenn ja, wiederholen Sie den Entwicklungsschritt ein weiteres Mal.
- Hart backen dem Wafer bei 200 ° C Robustheit der hergestellten Mikrostrukturen zu gewährleisten. Dieser Schritt ist optional.
- Lagern Sie das 3 '' Wafer mit Mikrostrukturen in einem 94 mm x 15 mm Petrischale aus Polystyrol.
HINWEIS: Es besteht keine Notwendigkeit für die Oberflächenbehandlung, insbesondere Silanisierung, für die nächsten Schritte.
- Herstellung des Polydimethylsiloxans (PDMS) Replica: Pfosten Array
- Gründlich mischen in einem Verhältnis von 1:10 (w / w) der Vernetzer und der Pre-Polymer für insgesamt 30 g in einem 50-ml-Tube.
HINWEIS: 1:10 (v / v) Verhältnis Verwendung auch arbeiten. - Zentrifugieren Sie die Röhrchen bei 1800 × g für 5 minLuftblasen zu entfernen.
- Lassen Sie sanft die PDMS auf der Oberseite der Mikrostrukturen.
HINWEIS: Wenn Luftblasen in diesem Schritt erscheinen, entgasen die Probe mit einer Vakuumpumpe für 15-20 min mit. - Die Probe wird in einem Ofen bei 65 ° C für 4 Stunden.
HINWEIS: Die Härtungszeit variiert zwischen Benutzern und zusammen mit dem Vernetzer: pre-Polymeranteil. Dieses Mal wird die Steifigkeit der PDMS diktieren. Es wird empfohlen, über 2 h zu härten und zu einem festen Härtungszeit zu haften. - Verwenden Sie ein Skalpell vorsichtig den Bereich von Interesse (Stempel) zu schneiden von etwa 1 cm 2 , die etwa 10 5 Mikrokavitäten oder 'eggcups' enthält.
HINWEIS: Schneiden Sie zuerst die PDMS und dann schälen Sie sie vorsichtig ab. Prüfen Sie die Qualität des PDMS-Replik mit einem optischen Mikroskop.
- Gründlich mischen in einem Verhältnis von 1:10 (w / w) der Vernetzer und der Pre-Polymer für insgesamt 30 g in einem 50-ml-Tube.
- Die Herstellung von 'eggcups' durch Replik Formen. Im Folgenden werden zwei alternative Strategien für die Herstellung von "eggcups 'beschrieben. Beide Protokolle sind Similar und identische Ergebnisse liefern:
- Strategie 1
- Aktivieren Sie die hergestellten PDMS-Stempel für 30 Sekunden durch Sauerstoffplasmabehandlung. Speichern vorübergehend die aktivierten Stempel in eine geschlossene Petrischale Ablagerung von Staub zu verhindern.
HINWEIS: Stellen Sie die Belichtungszeit, wenn andere Gase für das Plasma verwendet werden. - Platzieren Sie die aktivierten PDMS-Stempel der Oberseite nach oben (die Seite mit den Strukturen) in einer Petrischale neben einem 15-ml-Tube Kappe. Füllen Sie die Kappe mit 200 ul Trimethylchlorsilan (TMCS). Schließen Sie die Petrischale und lassen Sie den Stempel silanisieren für 7 min.
HINWEIS: Einige temporäre Verformung auf dem Stempel und / oder Veränderung der Farbe (weiß) beobachtet werden. Der Stempel wird seine ursprüngliche Form in kurzer Zeit zu erholen und die Strukturen sind nicht betroffen.
HINWEIS: TMCS produziert akute inhalative und dermale Toxizität und ist leicht entzündlich (bei Zündung Rückblende können über große Entfernungen zu kommen). Daher sollte sie weg in einem Abzug verwendet werden, von der Quelles der Zündung. - Legen Sie die PDMS-Stempel auf dem Spin-Coater mit den Strukturen der Oberseite nach oben. Einen kleinen Tropfen von wenigen Mikrolitern (etwa 20 ul) der Flüssigkeit PDMS (1:10 w / w Vernetzer: pre-Polymer) auf die Oberseite der Strukturen. Spin-Beschichtung bei 1500 Upm für 30 sec mit einer dünnen Schicht von PDMS auf der Oberseite der Strukturen abzuscheiden.
HINWEIS: den Stempel auf einer Petrischale Deckel mit einem kleinen Loch in der Mitte Wenn der Stempel nicht die Spin-Coater Futter Platz passt. - Platzieren Sie den Stempel in den Ofen bei 65 ° C für 4 Stunden die abgelagerte schleuderbeschichtet PDMS-Schicht zu härten.
- Aktiviere die dünne PDMS-Schicht durch die PDMS-Stempel upside up platzieren, zusammen mit einem Deckglas # 0 von 25 mm im Durchmesser, Sauerstoffplasmareiniger für 30 sec unter Verwendung von. Gehen schnell zum nächsten Schritt.
HINWEIS: Die Deckgläser mit anderen Dicken, Formen und Abmessungen können ebenfalls verwendet werden. Allerdings könnten einige zelluläre Strukturen schwierig sein, auf der gewählten Deck Dicke sichtbar zu machen abhängig und ZielVergrößerung und / oder NA und / oder Arbeitsabstand. Überprüfen Sie die objektive Datenblatt. - Legen Sie in Kontakt, um die Stempel (die Seite mit der dünnen spinnbeschichteten Schicht) mit dem Deckglas. Drücken Sie sanft auf der ganzen Oberfläche des Stempels mit einer Pinzette die "Bindung" zu machen. halten schließlich einen konstanten Druck auf die Oberseite des Stempels für ca. 10 sec.
- Nach 30 Minuten sanft 'schälen' der Stempel aus dem Deckglas , um zu "befreien" 'eggcups "(siehe Abbildung 1). Gründlich mit Ethanol und trocken. Wenn PDMS 'eggcups' sind nicht gut auf dem Deckglas geklebt ( das heißt , sie während der "unpeeling 'Schritt zu lösen), sollten Sie die Einstellungen des Plasma - Reiniger Einstellung und starten Sie in Schritt 1.3.1.5.
HINWEIS: Dieser Schritt ist heikel. Achten Sie darauf, um ein Brechen des Deckglases und / oder Ablösen der dünnen PDMS-Schicht zu vermeiden. - Kleben Sie ein kleines Stück (Handle) des gehärteten PDMS von 1 mm x 1mm x 3 mm am Rand des Deckglases mit einem kleinen Flüssigkeitstropfen PDMS in Volumen und die PDMS wie zuvor auszuhärten. Dadurch wird die Manipulation der Probe danach (siehe Abbildung 1) erleichtern. Dieser Schritt ist optional.
- Aktivieren Sie die hergestellten PDMS-Stempel für 30 Sekunden durch Sauerstoffplasmabehandlung. Speichern vorübergehend die aktivierten Stempel in eine geschlossene Petrischale Ablagerung von Staub zu verhindern.
- Strategie 2
- Hydrophilisierung der hergestellte PDMS-Stempel durch Sauerstoffplasmabehandlung für 30 Sekunden. Speichern vorübergehend die aktivierten Stempel in einer verschlossenen Petrischale bis Ablagerung von Staub zu verhindern.
HINWEIS: Stellen Sie die Belichtungszeit, wenn andere Gase für das Plasma verwendet werden. - Hydrophilisierung der Durchmesser von 25 mm Glasplättchen # 0 Sauerstoffplasmabehandlung bei 15 W für 30 Sekunden. Gehen schnell zum nächsten Schritt.
HINWEIS: Die Deckgläser mit anderen Dicken, Formen und Abmessungen können ebenfalls verwendet werden. Allerdings werden zelluläre Strukturen schwierig sein, zu visualisieren, auf der gewählten Deck Dicke und objektiven Merkmalen abhängig (siehe Hinweis oben). - Spin-coat ein kleiner Tropfen PDMS (1:10 w / w Vernetzer: pre-polYmer) von wenigen Mikrolitern auf die Glasplättchen. Spin-Beschichtung bei 1500 Upm für 30 sec für eine endgültige Dicke von etwa 50 um.
- Kleben ein kleines Stück (handle) des ausgehärteten PDMS von 1 mm x 1 mm x 3 mm in Volumen am Rand des Deckglases mit einem kleinen Tropfen der flüssigen PDMS und aushärten wie zuvor die PDMS. Dadurch wird die Manipulation der Probe danach (siehe Abbildung 1) erleichtern. Dieser Schritt ist optional.
- Bewahren Sie vorübergehend die PDMS-beschichtete Deckgläser auf ein sauberes in einer Petrischale abwischen von Staubablagerungen zu schützen.
- Geben Sie einen Tropfen Silanisierungsreagenz oben auf jeder Marke und lassen Sie es für 1-2 Minuten verdampfen. Dann trocknen Sie sie unter einem Strom von N 2.
HINWEIS: In diesem Schritt kann eine vorübergehende Verformung des Stempels während der Verdampfung beobachtet werden. Der Stempel wird seine ursprüngliche Form nach dem Trocknen mit N 2 ohne bleibende Verformung von Mikrostrukturen zu erholen. - Lassen Sie sehr vorsichtig auf die silanisierte Stempel oben auf derPDMS-Spin-beschichtet in der Petrischale aufbewahrt Deckglas. Stellen Sie sicher, dass beide Seiten vollständig während des Kontaktes parallel sind. Vermeiden Sie drücken oder den Stempel zu bewegen, nachdem sie auf die PDMS-beschichtete Deck platzieren.
- Platzieren Sie die Petrischale mit Proben im Vakuum für 1-2 h Luftblasen zu entfernen.
HINWEIS: Stellen Sie sicher, dass die Proben vollständig horizontal sind Stempel Verschiebung zu vermeiden. Vermeiden Sie auch möglicherweise Vibrationen durch die Vakuumpumpe verursacht. - Platzieren Sie die Proben im Ofen bei 65 ° C für 4 Stunden.
- Vorsichtig schälen den Stempel zu offenbaren 'eggcups' ab. Gründlich mit Ethanol und trocken.
HINWEIS: Praxis an dieser Stelle erforderlich ist. Achten Sie darauf, einen Bruch des Deckglases und / oder Ablösen der dünnen PDMS-Schicht zu vermeiden.
- Hydrophilisierung der hergestellte PDMS-Stempel durch Sauerstoffplasmabehandlung für 30 Sekunden. Speichern vorübergehend die aktivierten Stempel in einer verschlossenen Petrischale bis Ablagerung von Staub zu verhindern.
- Strategie 1
2. Einführung in Zellen in die 'Eggcups'
Um Säugerzellen im Inneren 'eggcups', PDMS-Oberfläche ne einführeneds um mit Adhäsionsproteine der extrazellulären Matrix funktionalisiert werden. Dieses Beispiel verwendet Fibronektin aber andere interessierende Proteine, wie Kollagen, verwendet werden könnten.
- Hydrophilisieren die 'eggcups' in der Sauerstoffplasma-Reiniger für 30 sec.
HINWEIS: Optimieren Sie die Parameter, wenn nötig. - Bereiten Sie eine Lösung in PBS 1x von 20 ug ml -1 Fibronektin aus Rinderquellen.
- Sterilisieren Sie die 'eggcups' mit UV für 5 min. Abzuscheiden einen kleinen Tropfen (etwa 20-50 & mgr; l) von Fibronektin-Lösung die gesamte 'eggcups' Bereich abzudecken und für 1 h bei RT inkubiert. Schützen Sie die Probe vor dem Austrocknen.
- Spülen Sie vorsichtig die 'eggcups' mit PBS 1x. 3-mal wiederholen.
ANMERKUNG: Die Probe ist fertig für mehrere Wochen im Dunkeln bei 4 ° C gelagert oder sofort verwendet werden. - Einführung eines zylindrischen maßgeschneiderten Kunststoff-Stück von 63 mm in der Höhe, 26 mm Außenradius und 7 mm Innenradius Dimensionen in einen 50-ml-Röhrchen (sieheAbbildung 2) 20
ACHTUNG: Verwenden Sie UV-Sterilgut oder sie vor Gebrauch sterilisiert werden.
HINWEIS: Dieses Stück leicht im Labor hergestellt werden. oder von jeder verfügbaren Werkstatt. - Stellen 13 ml Zellkulturmedium im Inneren des Rohres (siehe Tabelle 1). Das Medium sollte mindestens 2 cm über dem zylindrischen Stück füllen vollständiges Eintauchen der Probe zu gewährleisten.
Hinweis: Einzelheiten zu spezifischen Zelltypen und andere Modellsysteme wie Hefe oder C. elegans Embryonen und das entsprechende Medium verwendet wird , finden Sie in Abschnitt 5 und Tabelle 1. Das beschriebene Protokoll wurde optimiert für HeLa, NIH3T3 - Zellen und anderen Zelllinien (siehe Tabelle 1). - Einführung sehr sanft die 'eggcups' innerhalb des Rohrs und parallel zur Oberseite des Kunststoffteils. Scharfe Pinzette, um die Probe mit dem PDMS Griff zu halten. Drücken Sie vorsichtig das Deckglas, bis es liegt auf der Oberseite des Kunststoffteils, unbis es vollständig eingetaucht ist (siehe Abbildung 2).
HINWEIS: Es wird empfohlen, scharf und gerade Pinzette zu verwenden. Mit gebogenen Pinzette, ist die Manipulation der Probe schwierig und kann zum Bruch führen. - Kulturzellen bis 80-100% Zusammenfluß in einer P60 Petrischale und sammeln sie durch Trypsinierung.
HINWEIS: Die Zellen können bei jedem Medikament von Interesse Wildtyp transfiziert oder behandelt werden.
HINWEIS: Vermeiden Sie die Bildung von Zellaggregaten, die einzelnen Zellen zu vermeiden werden die 'eggcups' einzugeben. Zur Optimierung der diesen Schritt, Pipette nach oben und unten gründlich nach Trypsinierung. - Resuspendieren Zellen in 5 ml Kulturmedium. Je 200 & mgr; l von Zellen auf der Oberseite der 'eggcups'.
HINWEIS: Drop-Zellen so weit wie möglich an der Spitze der 'eggcups' zentriert aber körperlichen Kontakt zu vermeiden. Dies wird Bruch und / oder Beschädigungen der Probe zu verhindern. - Zentrifuge bei 1.800 × g für 2 min.
HINWEIS: Nach der ersten Zentrifugation, Check-in ein MikrofonROSCOPE den Füllgrad der 'eggcups'. - Pipette wieder 200 ul Zellen auf der Oberseite der 'eggcups' und Zentrifuge bei 1800 × g für 2 min. Wiederholen für insgesamt dreimal um den Füllgrad zu optimieren.
HINWEIS: Nach der letzten Zentrifugation, überprüfen Sie mit einem Mikroskop den Füllgrad von 'eggcups'. Falls erforderlich, wiederholen Sie die Füllung + Zentrifugationsschritte, bis die gewünschte Füllgrad erreicht. - Entfernen Sie die Probe aus dem Rohr die scharfen Pinzette Halten des PDMS Griff. Achten Sie darauf , in nicht 'störende' Zellen , vorsichtig zu sein , die in den 'eggcups' gehalten werden (siehe Abbildung 2).
- Die Probe wird in einer Petrischale mit Medium. Spülen Sie den Überschuss an Zellen zu entfernen, die nicht in den 'eggcups' sind durch Auf- und Abpipettieren dreimal sanft neben jeder Seite (insgesamt 4 Seiten) des Mikroarrays.
HINWEIS: Pipettieren zu stark freisetzen könneneinige Zellen aus den 'eggcups'. - Ersetzen Sie das Medium mit frischem Medium nicht gebundenen Zellen zu entfernen.
HINWEIS: In diesem Schritt ein Medikament von Interesse hinzugefügt werden können. - Fix-Zellen oder bereiten sie für Zeitraffer imaging.See Schritt 4.1.
3. Beobachtung von Active Cellular Dynamics in 'Eggcups': zytokinetischen Ringschluss
HINWEIS: In diesem Beispiel werden HeLa-Zellen, die mit MYH10-GFP und LifeAct-mCherry für Myosin und Aktin transfiziert sind jeweils Schlüssel aktive Moleküle in der zytokinetischen Ringschluss während Zellteilung beteiligt. Die Vorrichtung ist mit Mikrokavitäten von 25 um Durchmesser hergestellt. Für ihre Beobachtung wurde ein Epifluoreszenz inverses Mikroskop verwendet wird, mit einem 60x Öl-Objektiv (1,40 NA, DIC, Plan Apo) und GFP (Myosin) und TxRed (Aktin) Filter ausgestattet. Alternativ wurde ein aufrechter konfokalen Mikroskop, ausgestattet mit einem 25X oder 63X HCX IR APO L Wasser Ziel (0,95 NA). Aus diesem EXAmple, ist es sehr zu empfehlen Zellen zu synchronisieren , indem Sie den doppelten Thymidin Block, mitotischen Block oder mitotischen shake-off - Methode 21-24 mit.
HINWEIS: Die Dicke der verwendeten PDMS für die "eggcups 'erlaubt die Verwendung einer Vielzahl von Zielen sowohl in invertierter und aufrecht positioniert Mikroskopen.
- Place 'eggcups' in ein Mikroskop Halter und füllen Sie es mit 1 ml 10% FCS-L-15 Beobachtungsmedium. eine dünne Schicht von Mineralöl auf der Oberseite des medium.Select der 60X Öl-Objektiv Um zu vermeiden, Verdunstung, einen Glasdeckel auf der Oberseite des Halters oder anwenden.
HINWEIS: L-15 - Medium ist ausreichend für Nicht-CO 2 Atmosphären. Beachten Sie auch, dass einige Verbindungen von DMEM sind Autofluoreszenz. Wenn dieses Medium verwenden, empfiehlt es sich mit hoher Intensität Lampe die fluoreszierenden Verbindungen photobleach von 1-2 Stunden zu beleuchten.
HINWEIS: Vermeiden Sie Kunststoffdeckel mit, wenn sie mit der DIC-Bildgebung arbeiten. - Die Halterung mit 'eggcups' und Observation Medium in das Mikroskop. Konzentrieren Sie sorgfältig Hellfeld- Licht, bis die 'eggcups', und die Zellen sind in der gleichen Ebene der Beobachtung.
- Öffnen Sie die Software und passen Sie die Parameter. Wählen Sie die Filter TxRed und GFP für Aktin und Myosin; die Expositionszeit für jeden Kanal eingestellt werden. Eine typische Erfassungsrate beträgt 5 sec für beide Kanäle.
HINWEIS: Die Expositionszeit im Setup verwendet werden müssen angepasst je kann, Farbstoff oder andere Zellorganellen von Interesse. - Wählen Sie die Region von Interesse und suchen nach einem zytokinetischen Ring entweder mit dem GFP oder TxRed Kanal. genau im Fokus.
HINWEIS: Der Ring schärfer in Myosin und leichter zu erkennen. - Führen Sie die automatische Erfassung in beiden Kanälen, bis der Ring vollständig geschlossen ist.
HINWEIS: Einige können Photobleichens beobachtet werden. Passen Sie die Mikroskop-Parameter, um sie zu reduzieren.
4. Die Beobachtung der Festzellorganellen in die 'Eggcups'
Dieser Schritt kann vor oder nach dem Schritt # 3 durchgeführt werden. Zellen können direkt nach dem Zentrifugationsschritt befestigt werden und für das Organell von Interesse oder nach der Beobachtung im Mikroskop gefärbt. Dieses Beispiel zeigt die Färbung der Golgi Apparat, Kern und Aktin-Fasern auf NIH3T3 Fibroblasten in "eggcups '.
- Die Fixierung der Zellen in der 'Eggcups'
- Vorbereitung 3% Paraformaldehyd (PFA) und warm bei 37 ° C. Entfernen Sie die 'eggcups' Probe aus dem 50-ml-Röhrchen (oder dem Mikroskop Halter) und legen Sie sie in einer P35 Petrischale. Spülen Sie einmal mit PBS 1x.
HINWEIS: Protokolle für die Herstellung von 3% Paraformaldehyd sind weit anderswo erhältlich.
VORSICHT: Nitril Handschuhe und Augenschutz bei der Herstellung von PFA. - Entfernen Sie die PBS vollständig und legen 1 ml 3% PFA und Inkubation für 17 min. Entfernen Sie die PFA und spülen Sie zweimal mit 1 ml PBS 1X. Permeabilisieren Zellen unter Verwendung von 1 ml von 0,5% Tritauf 3 min und zweimal waschen mit PBS 1x 5 min.
- Vorbereitung 3% Paraformaldehyd (PFA) und warm bei 37 ° C. Entfernen Sie die 'eggcups' Probe aus dem 50-ml-Röhrchen (oder dem Mikroskop Halter) und legen Sie sie in einer P35 Petrischale. Spülen Sie einmal mit PBS 1x.
- Anfärben von Zellen in 'Eggcups'
- Inkubiere Zellen für Golgi-Apparat Färbung mit dem primären Antikörper polyklonalen Kaninchen-anti-Giantin in einer 1: 500-Verdünnung in PBS. Legen Sie ein 100 & mgr; l Tropfen Antikörperlösung auf eine Kunststofffilmblatt und Inkubation der Zellen innerhalb der 'eggcups' den Kopf für 45 min.
Hinweis: Schützen Sie die Probe mit einem Deckel zu Austrocknen zu verhindern. - Lösen Sie sorgfältig die 'Eggcups' und legen Sie sie in eine P35 Petrischale. Spülen Sie 3-mal, jeweils 5 min mit PBS 1x.
- Bereiten Sie einen Cocktail in PBS mit dem sekundären Antikörper Cy3 Ziege-Anti-Kaninchen (1: 1000) und mit Phalloidin Alexa Fluor 488 (1: 200) zum Färben von Aktin-Stressfasern.
- Inkubieren Zellen mit einer 100 & mgr; l Tropfen Antikörperlösung auf eine Kunststofffilmblatt und inkubieren Zellen im Inneren der 'eggcups' den Kopf für 45 min.
- Veröffentlichung sorgfältig die 'eggcups 'und sie in eine P35 Petrischale legen. Spülen Sie 3-mal, jeweils 5 min mit PBS 1x.
- Inkubieren Zellen für Kernfärbung 100 & mgr; l Tropfen von 1 & mgr; g ml -1 DAPI in PBS auf eine Kunststofffilmblatt und inkubieren Zellen im Inneren der 'eggcups' den Kopf für 45 Minuten setzen. Dieser Schritt kann mit Schritt 4.2.3 durchgeführt werden.
- Lösen Sie sorgfältig die 'eggcups' und legen Sie sie in eine P35 Petrischale. Spülen Sie 3-mal, jeweils 5 min mit PBS 1x.
- Berg-Zellen 15 & mgr; l Glycerin mit: PBS (1: 1 v / v) auf einem Standard-Mikroskopobjektträger aus Glas und versiegeln Sie die Probe mit Nagellack ein Austrocknen zu verhindern.
HINWEIS: In Abhängigkeit von der Dicke "eggcups ', Montage schwierig sein kann. Es wird empfohlen, die Probe in eine P35 Petrischale zu speichern dann in PBS, vor dem Austrocknen geschützt.
- Inkubiere Zellen für Golgi-Apparat Färbung mit dem primären Antikörper polyklonalen Kaninchen-anti-Giantin in einer 1: 500-Verdünnung in PBS. Legen Sie ein 100 & mgr; l Tropfen Antikörperlösung auf eine Kunststofffilmblatt und Inkubation der Zellen innerhalb der 'eggcups' den Kopf für 45 min.
- Mikroskop Beobachtung
HINWEIS: Für dieses Beispiel ein aufrechter konfokales Mikroskop verwendet wird, mit PMT und Hybrid-Detektoren ausgestattet. A 25X oder 63 X HCX IR APO L Wasser Ziel (0,95 NA) wurde ein weites Feld der Probe zu liefern ausgewählt und zeigen die Anwendbarkeit der Vorrichtung für High-Content-Screening-Anwendungen.- Wählen Sie das 25X oder 63X Wasser Ziel.
HINWEIS: Unterschiedliche Ziele können je nach Anwendung und Signal verwendet werden. Aber Nutzung der hohen numerischen Apertur Ziele wird empfohlen. - Legen Sie die feste Probe mit den 'eggcups' und konzentrieren sich sorgfältig Hell- Licht (Phasenkontrast oder DIC), bis die 'eggcups' und Zellen sind in der Ebene der Beobachtung.
- Öffnen Sie die Software und passen Sie die Parameter. Wählen Sie die Filter GFP, Cy3 und DAPI für Aktin, Golgi und Kern Beobachtung sind; die Expositionszeit für alle Kanäle einstellen.
HINWEIS: Die Belichtungszeit in Abhängigkeit von der Einrichtung angepasst werden müssen können. - Wählen Sie und die Region von Interesse zu konzentrieren; Start der Bildaufnahme (siehe Abbildung 3).
- Wählen Sie das 25X oder 63X Wasser Ziel.
- Fission und Budding Hefezellen
HINWEIS: In diesem Beispiel wird Spalthefezellen, die mit RLC1-mCherry und CHD-GFP für Myosin und Actin, jeweils markiert. Die angehenden Hefezellen sind nicht fluoreszierend hier markiert. Für Spalthefe Beobachtung wurde eine invertierte Kreiselscheibenapplikators konfokales Mikroskop verwendet. A 100X HCX PL APO CS Öl-Objektiv (1,4 NA) wurde für alle Akquisitionen verwendet. Alternativ wurden die Zellen auch einen invertierten Phasenkontrastmikroskop mit einer 20X Phasenkontrastluftziel ausgestattet beobachtet unter Verwendung LCPlanFl (0,4 NA). In diesem Beispiel ist das Protokoll für die beiden Zelltypen identisch.- Bereiten Sie die 'eggcups' Oberfläche wie oben beschrieben. Für Spaltung und Hefezellen Knospung, bereiten Hohlräume von 5 & mgr; m im Durchmesser (siehe Tabelle 1). In diesem Fall braucht die Oberfläche nicht mit Adhäsionsproteine funktionalisiert werden müssen.
HINWEIS: Die Füllung can unter Verwendung von konischen 'eggcups' optimiert werden. Diese Form fängt und hält die Zellen während der Spülschritt Freisetzung nach der Zentrifugation zu vermeiden. Prozentsatz Füllung ist bei etwa 80% optimal. Diese konischen 'eggcups' kann mittels Deep Reactive Ion Etching 13 hergestellt werden. - Kultur von Hefezellen in der richtigen Kulturmedium (siehe Tabelle 1) , bis eine optische Dichte (OD) im Bereich von 0,2 und 0,8 erreicht. Beschallen die Kultur von Hefezellen Aggregate zu entfernen.
- Legen Sie Hefezellen in 'eggcups' durch Zentrifugation. Für die Zentrifugation wurden 4 ml der kultivierten Zellen in dem entsprechenden OD wird mit 'eggcups' auf den Röhrchen zugesetzt. Nach der ersten Zentrifugation leicht schütteln die Röhre Zellen erneut zu suspendieren, die nicht in den "eggcups 'sind, während die Zellen in den" eggcups' nicht gestört werden. Ohne das Rohr, Zentrifuge wieder zu öffnen und zweimal wiederholen Sie diesen Schritt. Dies gewährleistet die Abscheidungsvon Zellen aus der Kultur in die leeren Mikrokavitäten und den Füllgrad zu erhöhen.
HINWEIS: Wenn mit Hefe funktioniert, ist es empfehlenswert, während der Experimente die Zentrifuge auf die Arbeitstemperatur vorzuheizen
HINWEIS: Das Protokoll hier angehalten und später bis 12 Stunden fortgesetzt werden kann. In diesem Fall speichern die Probe bei der Arbeitstemperatur und bedecken sie die Verdampfung zu verhindern. - Setzen Sie 'eggcups' in einem Mikroskop Halter und füllen Sie den Halter mit Filter sterilisierte Medium für die Bildgebung. Jetzt Spülen der Zellen mit dem gleichen Medium, bis die schwebenden Hefezellen effizient entfernt werden. Achten Sie darauf, nicht in Zellen 'eggcups' während des Spülvorgangs zu stören.
- Wählen Sie das 100X Öl-Objektiv und sorgfältig zu konzentrieren. Öffnen Sie die Software und passen Sie die Parameter. Für Spalthefe, wählen Sie den Filter GFP und TxRed für Aktin und Myosin und die Expositionszeit für beide Kanäle einzustellen. Eine typische Erfassungsrate beträgt 3 sec.
HINWEIS: Je nachdie Fluorophore, die Art der Kennzeichnung und der Set-up, Belichtungszeit variiert für andere Systeme.
- Bereiten Sie die 'eggcups' Oberfläche wie oben beschrieben. Für Spaltung und Hefezellen Knospung, bereiten Hohlräume von 5 & mgr; m im Durchmesser (siehe Tabelle 1). In diesem Fall braucht die Oberfläche nicht mit Adhäsionsproteine funktionalisiert werden müssen.
- C. elegans Embryo
HINWEIS: In diesem Beispiel wird C. elegans Embryonen 25-30 & mgr; m breit und 50 bis 55 & mgr; m lang. Die Embryonen kultiviert wurden angezeigt , wie in 25. Ein einfaches visuelles Protokoll, wie C. zu manipulieren elegans kann in 26 gefunden werden. Die Beobachtung wurde unter Verwendung eines invertierten Phasenkontrastmikroskop mit einem 40-fach Luftziel 0,55 NA ausgestattet war.- Bereiten Sie die 'eggcups' Oberfläche wie oben beschrieben , und 25 & mgr; m im Durchmesser (siehe Tabelle 1). In diesem Fall braucht die Oberfläche nicht mit Adhäsionsproteine funktionalisiert werden müssen.
- Kultur der C. elegans Embryonen in der richtigen Kulturmedien (siehe Tabelle 1).
- Legen Embryonen in 'eggcups' durch Zentrifugation wie oben beschrieben, unter Verwendung von Reinstwasser als Kulturmedium (Abschnitt 2,6-2,12 sehen).
HINWEIS: Die Embryonen wurden für die Dauer des Experiments normalerweise in Reinstwasser 'verhalten'. Als Alternative kann eine physiologische M9 Puffer für Langzeitexperimente. - Spülen Sie die Probe wie oben beschrieben (siehe Abschnitt 2.14). Legen Sie die 'eggcups' in ein Mikroskop Halter. Wählen Sie das Luftziel 40X und sorgfältig zu konzentrieren. Öffnen Sie die Software und passen Sie die Parameter. Wählen Sie eine Erfassungsrate von 3 sec.
Ergebnisse
Die 'eggcups' (EG) sind eine neue hohen Gehalt-Screening-Methode, die die Visualisierung von orientierten Zellen und Embryonen in einer 3D-Umgebung ermöglicht. Darüber hinaus werden einige zelluläre Prozesse, die in Standard - 2D (flach) Kulturen zu beobachten schwierig sind, können durch diese neue Methode zu beobachten. 1a zeigt eine Zusammenfassung des Verfahrens für die EG - Mikrofabrikations (siehe auch Abschnitt 1 in der oben beschriebenen Protokoll ). Das Verfahren ist einfach, schnell, effizient und ohne Erfordernis einer besonderen Ausrüstung. 1b und 1c zeigt eine groß angelegte Bild und eine vergrößerte rasterelektronenmikroskopische Aufnahme von 'eggcups' bezeichnet. Wie beobachtet werden kann, sind ihre Form und Größe sehr regelmäßig. Dieses Verfahren ist sehr flexibel; verschiedene Formen und Größen können leicht hergestellt und für verschiedene Modellsysteme angepasst werden. Die Abmessungen'eggcups' wurden in der folgenden Weise ausgewählt: Dimensionenvon Zellen, die Teilung durchlaufen wurden auf 2D Oberflächen gemessen: sie eine Kugelform, und ihr Durchmesser wurde als ein guter Indikator für die EC Durchmesser genommen. Die Zellen in'eggcups' länglichen und orientieren entlang ihrer langen Achse während der Zellteilung zum Beispiel. Diese Dimension ist abhängig von der System - Zellen und Embryonen - so dass diese Dimension sollte in jedem Fall ausgewertet werden.
Abbildung 2 zeigt das benötigte Material (Abbildung 2a) und eine Schritt- für -Schritt - Protokoll (Abbildung 2b) , wie die 'eggcups "zu verwenden (siehe auch Abschnitt 2 in der oben beschriebenen Protokoll). Die Befüllung der EG mit Zellen von Interesse (oder einem anderen Modellsystemen) ist sehr einfach und schnell. Normalerweise dauert es weniger als 20-30 min, was auch die Zeit für die Zelle Trypsinisierung umfasst. Nach dem Befüllen Proben können aktive Prozesse verwendet werden (live-Imaging) zu studieren oder für die Visualisierung von Organellen von intere fixiert und gefärbt werdenst (siehe Abschnitte 3 und 4 in dem oben beschriebenen Protokoll auch).
Auf ebenen Flächen, zeigen Zellen heterogene Reaktionen und extreme Phänotypen von Zellorganellen. Tatsächlich wurde vorgeschlagen , dass Aktin Stressfasern (und andere Zellorganellen) sind Artefakte der Kulturbedingungen 1. Um diese Hypothese zu beweisen, kultiviert wir Zellen NIH3T3 sowohl auf 3D 'eggcups' und auf ebenen Flächen und die Phänotypen der verschiedenen Zellorganellen verglichen, nämlich Aktin Stressfasern, Golgi - Apparat und Kerne. 3 zeigt ein Beispiel dafür , wie Zellen organisiert sind , auf beiden Konfigurationen. In EC sind die Zellen in einer geordneten Anordnung zeigt , die eine homogene kugelförmige artigen Phänotyp (3a) verteilt sind . Auf ebenen Flächen, zeigen Zellen die typische ungeordnet, Verbreitung und heterogene Morphologie (Abbildung 3b). Es gibt auch signifikante Unterschiede in Cytoskelett-Strukturen. Insbesondere Zellen auf R16; eggcups 'zeigen eine Verringerung der Anzahl von Stressfasern im Vergleich zu glatten Oberflächen. Dies wird in der 3D - Bilder bestätigt rekonstruiert , wo keine klaren Stressfasern sichtbar sind (Abbildung 3c sehen - d). Dies bestätigt, dass einige Zellstrukturen sind in 2D Kulturen vergrößert. Dies ist auch in Übereinstimmung mit den Beobachtungen in vivo durchgeführt , wo Stressfasern nicht identifiziert werden können.
Der Golgi - Apparat zeigt auch erhebliche Unterschiede in ihren Phänotyp auf der Kulturbedingungen abhängig (siehe Abbildung 4). Der Golgi - Apparat auf 2D - Kulturen zeigt typischerweise einen erweiterten Phänotyp den Kern Peripherie während in 'eggcups' zeigt es eine kompaktere Phänotyp 'umarmen' (siehe 4a - b). Um eine Wirkstoff-Screening-Manipulation zu simulieren, die wir getestet haben auch die Wirkung von Medikamenten auf Zellen, die auf beiden Umgebungen. Wir wählten blebbistatin mainly , weil es die Aktin - Stressfasern stört und könnten einen Einfluss auf Golgi Morphologie (siehe Abbildung 3c - d) aufweisen. Da der Golgi neben dem Zellkern angeordnet ist, kann das Medikament auch eine Wirkung auf die Architektur haben. Wir beobachteten zunächst , dass mit diesem Medikament behandelten Zellen eine weniger regelmäßige und einheitliche Morphologie zeigte im Vergleich zum Wildtyp (WT) Zellen (Abbildung 3c sehen - d). Wir verglichen und quantifiziert den Phänotyp Golgi beobachtet auf 'eggcups' und auf ebenen Flächen (siehe Abbildung 4c). Wir beobachteten, dass auf 2D-Oberflächen-Zellen zeigten meist einen erweiterten Phänotyp während auf 'eggcups' Zellen, die einen kompakteren Phänotyp zeigte. Wir nicht beobachten, obwohl ein auffallender Unterschied zwischen WT und blebbistatin behandelten Zellen.
Schließlich auf 2D den Zellkern Oberflächen zufällig orientiert, während für Zellen in EC es orthogonal zur XY-Ebene in beiden ausgerichtet istWT und blebbistatin behandelten Zellen (siehe 5a - c). Dies unterstreicht die Stärke der Vorrichtung zu orientieren Zellorganellen, ähnlich einer früheren Anwendung des Verfahrens zum Ausrichten der Ebene der Beobachtung des zytokinetischen Ring in Hefe und Säugerzellen 10,12,13. Wir untersuchten schließlich , wie der Nucleus Sphärizität (definiert als ψ = [π 1/3 6V n 2/3] / A n, wobei V n das Volumen des Kerns ist , und A n seine Fläche Oberfläche) wurde beeinflusst in Abhängigkeit von der Kultivierungsbedingung und bei der Behandlung von Zellen mit blebbistatin. 5d die entsprechenden Verteilungen von ψ zeigt. Wir hatten keinen Unterschied für WT flach vs WT EG beobachten , die zeigt , dass die EG nicht die normale Rundheitsgrad von Zellen beeinflussen. Jedoch beobachteten wir eineUnterschied , wenn WT EG Vergleich zu Blebb EG darauf hindeutet , dass die Europäische Kommission eine echte Wirkung des Medikaments sind aufschlussreich , die in 2D maskiert.
Studien an lebenden Zellen 'eggcups' unter Verwendung erlauben auch die Identifizierung neuer aktiver Prozesse, die in Standard-Kulturen nicht sichtbar sind. Wir plattierten Zellen in EG und visualisiert Zellteilung. 6 zeigt eine Sequenz von Bildern des zytokinetischen Ringschluss während Zellteilung. Die 'eggcups' Gerät erlaubt eine vollständige Visualisierung des Rings, während Standard - 2D - Kulturen nur zwei Bereiche zeigt , die 10 auf eine einzige Ebene entspricht. Die Rekonstruktion des Rings aus einer Folge von Z-Stapel - Bilder 2D - Kulturen unter Verwendung von 27 kann getan werden, aber wichtige Informationen verloren. Die Qualität ist vermindert aufgrund der niedrigen z-Auflösung und dynamische Prozesse können nicht aufgelöst werden. Actin und Myosin sind die wichtigsten Proteine in der Krafterzeugung der Zellteilung. Ihre Dynamik kann nicht be abgebildet und in 2D - Kultur (6a), während mit "eggcups 'wird sie sofort aufgedeckt sucht. Wir haben neue Strukturen und Prozesse identifiziert: in HeLa - Zellen , die wir periodisch Ansammlungen von Myosin 17 finden. Diese Ansammlungen bewegen radial als der Ring schließt (Abbildung 6b). In Spalthefe finden wir auch Inhomogenitäten in Myosin und Aktin (6c, rechts) 17. Im Gegensatz zu dem, was wir in HeLa-Zellen zu sehen, drehen sie auf dem Ring während des Schließens. Die Geschwindigkeit liegt im Bereich von & mgr; m min -1 und nicht durch z Rekonstruktion mit Standardmikroskopen auflösbar sein. Schließlich wird der zytokinetischen Ring kann weiter durch seine Komponenten Färbung untersucht werden. Wir finden , dass es eine Anhäufung von Phosphotyrosin in der Nähe des Rings (Figur 6d). Wir können auch zeigen , dass Anillin im Ring (6e) colocalizing. Indem man die Zellen in dieser Ausrichtung Anfärben, we zeigen, dass Anillin zeigt auch eine inhomogene Verteilung.
Die 'eggcups' wurden auch verschiedene Modellsysteme angewendet: wir Säugetierzellen berichtet, Spalthefe, aber wir nehmen auch Bäckerhefe und C getestet elegans (siehe Abbildung 7 a - e). In diesem Fall wurde das Protokoll für jedes spezifische System in Bezug auf Kulturmedien angepasst, Hohlräume Größe und Morphologie (siehe Tabelle 1). Als Beispiel -förmigen konischen V 'eggcups' die optimale Morphologie zur Immobilisierung von Spalthefe effizient 12, statt vollständig zylindrisch (oder U-förmige) wurden für Säugerzellen verwendet 13 formen. Dies ermöglichte die Wirkung verschiedener Zytoskelett Medikamente testen mit möglichen Anwendungen im Bereich Life Science Forschung. Dies zeigt die Flexibilität und Zuverlässigkeit der entwickelten Methodik.
Ferner ist ein die hochgeordnete Anordnung von Zellen erlaubt,einfache, automatisierte Auslesung der Fluoreszenz einzelner Zellen. Wir veranschaulichen dies durch NIH3T3 Zellen in 'eggcups' (Figur 8a), die GFP eingeführt wird . Die Zellenposition kann leicht erkannt und die entsprechenden Expressionsniveau gemessen. 8b zeigt die Verteilung von Fluoreszenzsignalen. Dies kann zu jedem Auslesen (Immunofluoreszenz, fluoreszierende Reporter in Zellen zum Beispiel) angewendet werden.
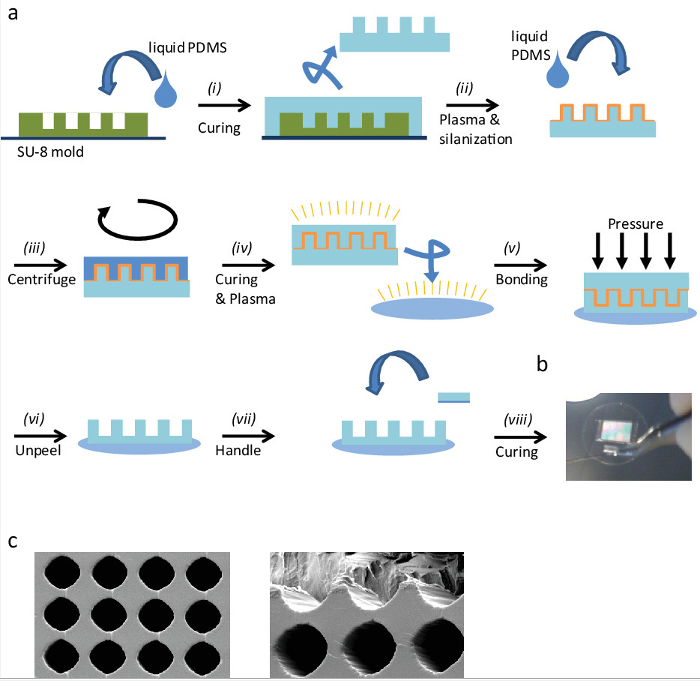
Abbildung 1: Die Herstellung von "eggcups '(a) Schematische Darstellung des Herstellungsverfahrens von' eggcups 'durch Replika - Formen:. (I) Gießen Flüssigkeit PDMS auf der SU-8 - Form und heilen sie. Ausschneiden (ii) den Stempel und ziehen Sie sie vorsichtig von der Oberfläche, dann plasma aktivieren sie es zu silanisieren. (Iii) Gießen Flüssigkeit PDMS auf der silanisierten Stempel einZentrifuge es d eine dünne PDMS-Schicht zu erhalten. (Iv) Nach dem PDMS-Schicht Aushärten Plasma aktivieren sowohl die PDMS abgedeckt Stempel und ein Deckglas. (V) Plasma binden sowohl durch eine sanfte, homogenen Druck. (Vi) Nach der Plasmabindung, entfernen Sie vorsichtig den Stempel der "eggcups 'Oberfläche aufzudecken. (Vii) Um die Handhabung in den nächsten Schritten zu vereinfachen, ein kleines PDMS Griffstück hinzufügen. Binden Sie das PDMS Stück auf dem Deckglas indem sie sie mit Flüssigkeit PDMS Kleben und (viii) heilen es dann in den Ofen. (B) Bild eines 25 mm Deckglas mit PDMS 'eggcups' und einem Griff. (C) Rasterelektronenmikroskopische Bilder von PDMS 'eggcups'. Der Abstand zwischen den Zentren von 'eggcups' ist 30 & mgr; m, und deren Durchmesser etwa 25 & mgr; m. (Links) Draufsicht. (Rechts) 'Eggcups' zu Bild geschnitten werden der innere Teil. Bitte hier klicken , um vie wa größere Version dieser Figur.

Abbildung 2: (a) Elemente für die EG - Füllung benötigt. (1) 50 ml Tube; (2) zylindrisches Stück (Aufsicht und Seitenansicht); (3) Zellkulturmedium; (4) 'eggcups'; (5) scharfe Pinzette. (B) Schematische Darstellung des EG - Füllvorgang. (I) ein zylindrisches Stück wird zuerst in ein 50-ml-Röhrchen gegeben und mit 13 ml Zellkulturmedium gefüllt. Als nächstes, (ii) die sanft auf der Oberseite des zylindrischen Stück ablagern 'eggcups' scharfe Pinzette mit der EG mit dem kleinen PDMS Stück zu manipulieren. (Iii) Die Zellen an der richtigen Dichte sind auf der Oberseite des EG pipettiert. (Iv) Die Zellen werden in den 'eggcups' durch Zentrifugation eingeführt. (V) Schließlich wird die Probe vorsichtig vom Rohr gelöst, und es ist gebrauchsfertig. m / files / ftp_upload / 51880 / 51880fig2large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
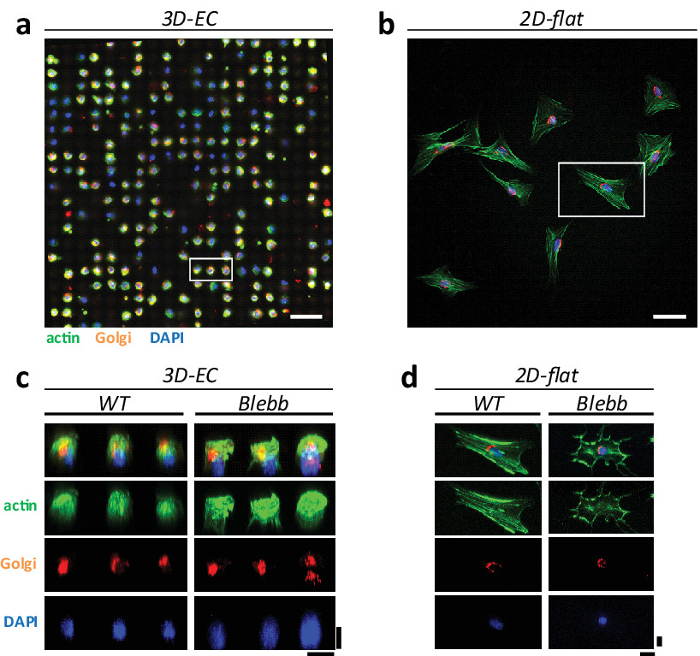
Abbildung 3: Vergleich der Zell Phänotypen auf 3D 'eggcups' und 2D flache Oberflächen. Die konfokale Mikroskopie (25X Wasser Ziel, 0,95 NA, Leica) Bild von NIH3T3 - Zellen auf (a) EG eine geordnete Anordnung zu bilden und zu einer homogenen sphärischen Phänotyp zeigen und auf (b) Standard - 2D - Flach Kultur, zufällig mit heterogenen Phänotypen verteilt. Die Zellen wurden gefärbt für Aktin (in grün), Golgi (in orange) und Kern (in blau). Maßstabsbalken = 100 & mgr; m. (C) 3D - Rekonstruktion von Zellen , die auf EG und (d) auf ebenen Flächen für WT und blebbistatin behandelten Zellen. Maßstabsbalken = 20 um.880 / 51880fig3large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 4: Studie von NIH3T3 Golgi - Apparat Phänotyp Schematic und Probenbild von Golgi - Phänotyp - Klassifizierung für Zellen , die auf (a) flach und (b) EG.. Die Zellen wurden als verdichtete klassifiziert, erweitert oder fragmentiert in Abhängigkeit von der α-Wert. (C) Quantifizierung der Golgi - Phänotypen. Maßstabsbalken = 10 & mgr; m. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
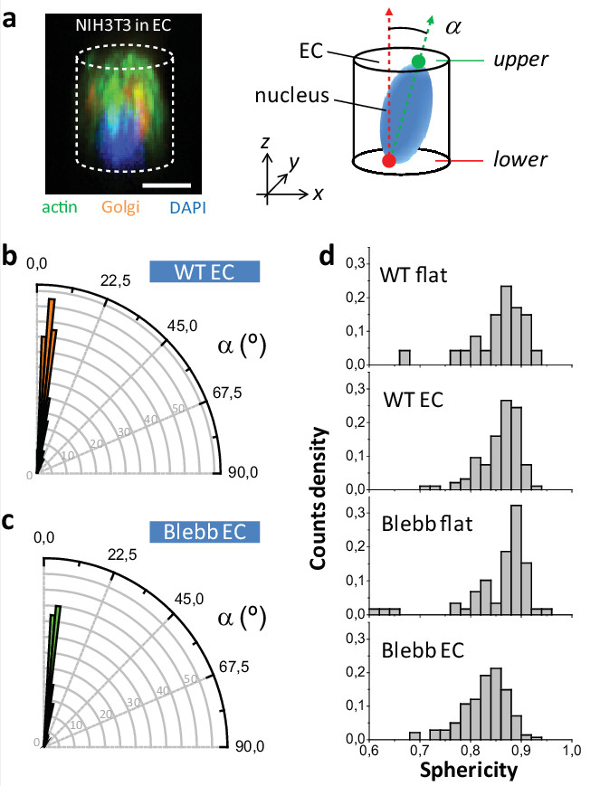
Abbildung 5: Studie von NIH3T3 Kern Phänotyp. (a) (links) konfokale Mikroskopie Bild einer NIH3T3 Zelle innerhalb eines EG und für Aktin (grün) gefärbt, Golgi (in orange) und Kern (in blau). (rechts) Schema Kerne Orientierung innerhalb EG. (B) Winkelverteilung der Kerne innerhalb EC für WT und (c) blebbistatin behandelten Zellen. (D) Nucleus Sphärizität Werte für WT und blebbistatin behandelten Zellen sowohl für die EG und flache Oberflächen (P [WT EG -Blebb EG] <0,001, P [Blebb flach -Blebb EG] <000.1; n WT flach = 47, n WT EC = 94, n Blebb flach = 59, n Blebb EC = 141 Zellen). Maßstabsbalken = 10 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
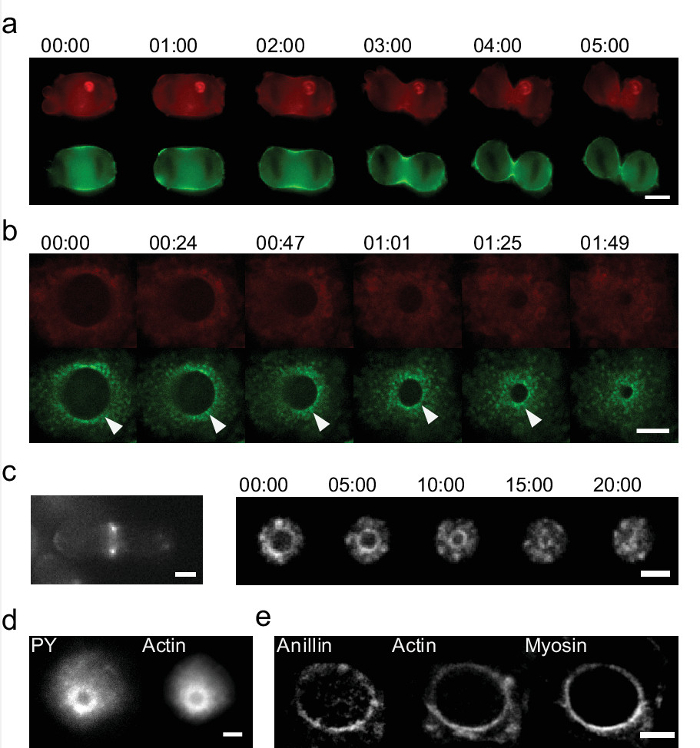
Abbildung 6: Detaillierte Untersuchung des zytokinetischen Ring in lebenden und fixierten Proben und in zwei Systemen mit 'eggcups' (a) Zeitfolge des zytokinetischen Ring mit Standard - 2D - in - vitro - Kultur.. Nur zwei helle Flecken in Aktin (LifeAct-mCherry, rot) und Myosin (GFP markiert, grün) sind sichtbar in der Teilungsfurche der HeLa-Zellen (Maßstabsbalken = 10 & mgr; m). (B) Zeitlicher Ablauf des Verschlusses für den zytokinetischen Ring in HeLa - Zellen während der Mitose mit 'eggcups'. Die Bilder zeigen Aktin (in rot) und Myosin (grün). 'Eggcups' ermöglichen die Identifizierung von noch Myosin Ansammlungen. Ein Beispiel ist mit einer Pfeilspitze markiert. (Maßstab = 5 & mgr; m). (C) Der zytokinetischen Ring auch in Spalthefe sichtbar gemacht werden kann. (Links) Die Zellen liegen auf einer ebenen Fläche, die Zyto kinetische Ring ist nur sichtbar , als zwei Punkte (rechts) Zellen in 'eggcups':. die gesamte Verschluss erfasst werden kann. Aktin ist mit CHD-GFP (Maßstabsbalken = 2 & mgr; m) markiert. Zeit in min: sek. (D - e) Beispiele von gefärbten zytokinetischen Ringe. (D) Aktin-GFP HeLa - Zellen exprimieren , werden für Phosphotyrosin (PY) gefärbt , die auch das Signal in den Ring (Maßstab = 5 & mgr; m) zeigt. (E) HeLa - Zellen GFP - exprimierenden getaggt Myosin und LifeAct-mCherry (Aktin) für Anillin gefärbt. Anillin enthüllt im zytokinetischen Ring und weniger konzentriert in der Hirnrinde zu lokalisieren. Es zeigt die Co-Lokalisierung mit Aktin und Myosin (Maßstab = 5 & mgr; m). Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
80 / 51880fig7.jpg "/>
Abbildung 7:. Die Anwendung der 'eggcups' zu anderen Zelltypen und Modellsysteme (a) U2OS (menschliche Osteosarkom). Der Einschub zeigt eine Trennzelle. (Maßstabsbalken = 20 & mgr; m). (B) NIH3T3 Zellen , die GFP exprimieren. Unterschied in Expressionsniveaus leicht ausgelesen werden (Maßstabsbalken = 20 & mgr; m) werden kann. (C) SW480 Zellen (Maßstabsbalken = 20 & mgr; m). (D) Bäckerhefe; die Zykluszeit unverändert. (Maßstabsbalken = 10 & mgr; m). (E) C. elegans Würmer;. (links) auf einer flachen Oberfläche (rechts) 'eggcups', Embryo aus einem sonst verborgen Perspektive gesehen. (Maßstabsbalken = 10 & mgr; m). Zeit in min: sec . Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 8: Die Organisation in einer Reihe von 'eggcups' ermöglicht eine automatisierte Analyse der Zellpopulation (a) NIH3T3 - Zellen in EG (Maßstabsbalken = 20 & mgr; m).. Sie haben unterschiedliche Expression von GFP. (B) automatische Erkennung von Zellenposition ermöglicht eine individuelle Analyse des Expressionsniveaus. Es wird in dem Histogramm der GFP - Expression der Zellpopulation zusammengefasst. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
| Modellsystem | Art | Nährboden | Beobachtung Medium | 'eggcups' Durchmesser (μ; M) | Kommentare / Beschreibung |
| Säugetierzellen | NIH3T3 | 10% BCS High-Glucose-DMEM | 10% BCS L-15 | 20 | Andere stabile Zelllinien, beispielsweise REF52 oder MDCK, sowie primäre Zellinien, Krebszellen und / oder Stammzellen können auch in den 'eggcups "eingefügt. |
| HeLa | 10% FCS High-Glucose DMEM | 10% FCS L-15 | 25 | Erhältlich aus vielen verschiedenen Quellen. | |
| U2OS | 10% FCS High-Glucose DMEM | 10% FCS L-15 | 20-25 | Erhältlich aus vielen verschiedenen Quellen. | |
| SW480 | 10% FCS High-Glucose DMEM | 10% FCS L-15 | 17-20 | Erhältlich aus vielen verschiedenen Quellen. | |
| Hefe | Fission Yeast | AgarPlatte (YE5S) und flüssige Medien (YE5S und EMM5S) | Filter sterilisiert EMM Medien (siehe die Liste der Materialien) | 5 | Die Oberfläche muss nicht mit adhäsiven Proteinen funktionalisiert werden. |
| Bäckerhefe | Agar-Platte (YPD) und flüssige Medien (YEPD und SD) | SD-Medien | 5 | Die Oberfläche muss nicht mit adhäsiven Proteinen funktionalisiert werden. | |
| Embryo | C. elegans | NGM Platte | Reinstwasser | 25 | Alternativ M9 Medium für die Langzeitversuche verwendet werden. Das Rezept dieser gesalzenen Lösung finden Sie hier: http://cshprotocols.cshlp.org/content/2009/5/pdb.rec11798.full?text_only=true |
Tabelle 1: Die Kulturbedingungen in 'eggcups' für verschiedene Modellsysteme. Die oben verwandten Protokoll kann leicht angepasst werdennur durch die beschriebenen Kulturbedingungen zu ersetzen und die Größe von 'eggcups'.
Diskussion
Replica Formen wurde verwendet, um die "eggcups 'herzustellen. Der Herstellungsprozess muss nicht ein sauberes Zimmer; es ist leicht und einfach, auch wenn einige der Praxis erforderlich sein kann. Insbesondere die PDMS-Stempel Loslassen ist der wichtigste Schritt, um einen großen Bereich von hoher Qualität "eggcups 'zu erzeugen. Aus diesem Grund hat besondere Sorgfalt in diesem Schritt genommen werden. Wenn dieser Schritt wiederholt fehlschlägt, sollten Sie die Plasma-Reiniger Parameter an die Silanisierung und Plasmaproteinbindung vor zu optimieren. Unzureichende Silanisierung wird stark Ankleben des Stempels auf die PDMS-Film führen. Wenn dies beobachtet wird, kann die Inkubationszeit mit dem Silanisierungsreagenz erhöht werden. Man beachte , dass andere Techniken und Materialien können angewendet werden , um die 'eggcups' herzustellen, die mit einer Vielzahl von Liganden funktionalisiert werden können (Fibronectin, Gelatine, Collagen, etc.). Insbesondere Mikrokavitäten in Polystyrol leicht durch cus hergestellt werden können,Heißprägetechnik tom hergestellt. Dadurch wird sichergestellt, Biokompatibilität und den direkten Vergleich mit den Ergebnissen in Standard-Kulturschalen erhalten. In ähnlicher Weise sind besondere Sorgfalt und Praxis erforderlich, um den Füllgrad zu optimieren. Insbesondere ist der Spülschritt kritisch, um eine angemessene Füllung ohne Überschuss an Zellen zu gewährleisten, einen Beitrag zur Geräusch- und Hintergrund in dem Signal. Wenn Zellen leicht von Hohlräumen entfernt werden, sollten Sie die Größe oder die Tiefe der Hohlräume zu ändern.
'Eggcups' 3D-ähnliche Architektur zu Zellen liefern und High-Content-Screening-Assays ein einfaches Protokoll. Zellorganellen und aktive Prozesse unbekannt Standard-Kulturtests unter Verwendung von leicht durch Einfügen einzelner Zellen auf einzelne Mikrokavitäten ( 'eggcups') sichtbar gemacht werden. Je nach dem Modellsystem kann die Größe, Form und ihre Abmessungen leicht angepasst werden. Auf diese Weise Säugetierzellen, Spalthefe, Bierhefe und C. elegans cein manipuliert und untersucht werden, sowie alle Embryonen wie Drosophila, Mäuse oder menschlichen Embryonen für in - vitro - Fertilisation oder Stammzellen zum Beispiel.
Bei diesem Aufbau werden einzelne Zellen eingefangen. Dies steht im Gegensatz zu epithelialen in vivo angetroffen Geweben. Verwendung flexibler Elastomere Jedoch könnte diese Umgebung in unserem 'eggcups' wiedergegeben werden, durch Beschichten der Seitenwände mit Cadherine Zell-Zell-Kontakte zu imitieren. Fokale Kontakte wird durch die Ablagerung von Fibronektin an der Unterseite der Wells gefördert werden. Diese jeweiligen Verteilungen der Adhäsionsmoleküle sollten bei der Reproduktion der zellulären Umgebungen angetroffen in vivo ermöglichen. Durch dieses Verfahren würde man die physiologischen Bedingungen annähern.
Mittelaustausch in unserem Test gewährleistet ist. Die Zellen in EC zeigen keine Verschlechterung, wenn wegen des Mangels an Trägeraustausch sowohl kurz- als auch langfristige Experimente durchführen. Beachten Sie auch, dass die Zellen in der EG-can kultiviert werden, bis Einmündung obwohl das Hauptinteresse ist es, wenn einzelne Zellen oder Embryonen innerhalb der Hohlräume isoliert sind.
Orientierung von Organellen oder ganze Organismen enthüllt neue Informationen. Wir zeigen unterschiedliche Dynamik von Aktin und Myosin in der zytokinetischen Ring. Obwohl der zytokinetischen Ring in Spalthefe und Säugerzellen von ähnlichen Schlüsselkomponenten zusammengesetzt ist, zeigen wir mit dieser Einstellung, dass ihre spezifischen Dynamik 17 unterscheidet. Dies unterstützt das Ergebnis, dass der Verschlussmechanismus in den beiden Systemen als auch unterschiedlich ist. Zu entwickeln und eine solche Hypothese zu untersuchen, ist die Orientierung der Zelle unverzichtbar. In zukünftigen Studien kann dieses Gerät auch im Zusammenhang mit anderen Ereignissen zu untersuchen Organisation in Zellen verwendet werden, um Organell.
Darüber hinaus kann diese Technik in der Entwicklungsbiologie von großem Nutzen sein. Elongated Embryonen leicht in einer definierten Orientierung orientiert sind, beobachtet oder weiter behandelt werden kann.Wahrscheinlich würde unser Test nicht Polarität von Embryonen zu verhängen, aber die hohen Füllgrad erlauben würde, die gewünschte Auslese in zuverlässiger Weise zu extrahieren. 'Eggcups' könnte Insgesamt ein gutes Gerät für High-Content-Screening sein.
Andere Kulturassays wurden vorgeschlagen. Diese Methoden reichen von mehreren Zellen in 2D Dimensionen in Mikrotiterplatten, auf einzelne Zellen in mikrostrukturierten Klebstoff Motive mit identischer Form abgeschieden. Jedoch ist keines von ihnen geeignet ist , die Grenzen detailliert oben auf der Beobachtung von Zellorganellen und dynamische Prozesse 1 zu überwinden.
Zukünftige Verbesserungen zu unserem System wird die Anwendbarkeit von 'eggcups' auf branchenorientierte Zwecke ermöglichen. Als Beispiel Arzneimittel - Screening - Anwendungen in der pharmazeutischen Unternehmen erfordern die Verwendung von Multi - Well - Platten 14,28; 'Eggcups' in solche Plattformen Umsetzung verbessert möglicherweise die Zuverlässigkeit derTests und Ergebnisse. Als solche hohen Gehalt-Screening-Assays werden die häufig verwendeten automatisierten Prozesse der pharmazeutischen Unternehmen (und akademischen Forschungslabors) unter Verwendung von Robotern durchgeführt werden. Dies wird die Wiederholbarkeit und Zuverlässigkeit mit geringen Variabilität zu gewährleisten. Einige handelsübliche Produkte auf Basis von 3D-Zellen kultiviert Assays auf dem Markt Hervorhebung der Bedeutung dieser Art von Assays bereits erschienen. Schließlich öffnen diese Geräte neue Perspektiven für die personalisierte Medizin: Zellen von Patienten in 'eggcups' platziert werden konnten, und die Behandlung Cocktails konnte in einer physiologischen Umgebung getestet werden; der Biomarker Auslesen ermöglicht eine optimale Behandlung zu antizipieren 29 an den Patienten gegeben werden. Insgesamt ist die physikalische Form der Zellen und Embryonen führen die Architektur der Hohlräume, und wir hoffen, dass das Gerät und das Verfahren wird weit in der Zukunft verteilt werden.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Wir erkennen an L. Brino (IGBMC High Content Screening-Anlage, Illkirch, Frankreich) für die Bereitstellung von uns mit dem Anti-Giantin Antikörper, M. Labouesse Lab. für C. elegans (IGBMC) und B. Séraphin Lab. für Bäckerhefe (IGBMC), E. Paluch und A. Hyman für fluoreszierende HeLa-Zellen (MPI-CBG, Dresden), J. Moseley (Dartmouth Medical School) und JQ Wu (Ohio State University) für Spalthefezellen; A. Hoël und F. Evenou für experimentelle Hilfe, C. Rick (IBMC, Straßburg, Frankreich) für technische Hilfe und JC Jeannot (Femto-st, Frankreich) für die Hilfe in Mikrofabrikations. Diese Arbeit wurde durch Mittel aus dem CNRS, der Universität Straßburg unterstützt wurde, Conectus, La Fondation pour la Recherche Médicale und die ci-FRC von Straßburg.
Materialien
| Name | Company | Catalog Number | Comments |
| ddH20 (ultrapure) | Millipore | - | Use always fresh water. |
| Parafilm (plastic film) | Bemis | PM-999 | Adhere Parafilm to the lab bench using some water droplets and ensure a perfect surface flatness. |
| Photo-mask | Selba | - | http://www.selba.ch |
| Silicon wafer | Siltronix | - | http://www.siltronix.com/ |
| SU-8 photoresist | MicroChem | 2000 series | http://www.microchem.com/Prod-SU82000.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| SU-8 developer | MicroChem | - | http://microchem.com/Prod-Ancillaries.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information | |||
| 2-propanol | Sigma-Aldrich | 19030 | http://www.sigmaaldrich.com/catalog/product/sial/i9030?lang=en®ion=CA |
| Available from multiple companies. | |||
| Sigmacote (siliconizing reagent ) | Sigma-Aldrich | SL2-25ML | http://www.sigmaaldrich.com/catalog/product/sigma/sl2?lang=fr®ion=FR |
| harmful, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Chlorotrimethylsilane (TMCS) | Sigma-Aldrich | 386529-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/386529?lang=fr®ion=FR |
| TMCS produces acute inhalation and dermal toxicity, and is highly flammable (with ignition flashback able to occur across considerable distances), consequently it should be used in a fume cupboard away from sources of ignition | |||
| Nitrile gloves | Kleenguard | 57372 | http://www.kcprofessional.com/products/ppe/hand-gloves/thin-mil-/57372-kleenguard-g10-blue-nitrile-gloves-m |
| Available from multiple companies. | |||
| Glass coverslips #0 | Knittel glass | KN00010022593 | http://www.knittelglass.com/index_e.htm |
| Very fragile. Manipulate gently. | |||
| Sharp straight tweezers | SPI | 0WSSS-XD | http://www.2spi.com/catalog/tweezers/t/elec7 |
| 50 ml tube | BD Falcon | 352070 | http://www.bdbiosciences.com/cellculture/tubes/features/index.jsp |
| Available from multiple companies. | |||
| PDMS | Dow Corning | Sylgard 184 kit | http://www.dowcorning.com/applications/search/default.aspx?R=131EN |
| The package contains both PDMS base and curing agent. Similar elastomers are available from multiple companies. | |||
| Microscope glass slides | Dutscher | 100001 | http://www.dutscher.com/frontoffice/search |
| Available from multiple companies. | |||
| DMEM high-glucose medium | Fisher Scientific | 41965-039 | http://www.fishersci.com/ecomm/servlet/Search?LBCID=12301479&keyWord=41965-039&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Bovine calf serum | Sigma-Aldrich | C8056-500ML | http://www.sigmaaldrich.com/catalog/product/sigma/c8056?lang=en®ion=CA |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200-072 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=25200-072&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS 1x | Fisher Scientific | 14200-067 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=14200-067&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS is at 10x and should be diluted to 1x using ddH2O | |||
| L-15 medium | Fisher Scientific | 21083-027 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=21083-027&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Medium for atmospheres without CO2 control | |||
| Fibronectin | Sigma-Aldrich | F1141-5MG | http://www.sigmaaldrich.com/catalog/search?interface=All&term=F1141-5MG&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Penicillin & Streptomycin | Fisher Scientific | 15140-122 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=15140-122&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=CHEM |
| Petri dish P35 | Greiner | 627102 | http://www.greinerbioone.com/en/row/articles/catalogue/article/144_11/12885/ |
| Petri dish P60 | Greiner | 628163 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/145_8_bl/24872/ |
| Petri dish P94 | Greiner | 633179 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/146_8_bl/24882/ |
| Paraformaldehyde 3 % | Sigma-Aldrich | P6148-500G | http://www.sigmaaldrich.com/catalog/product/sial/p6148?lang=fr®ion=FR |
| Harmful in-particular for the eyes, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Triton 0.5 % | Sigma-Aldrich | 93443-100ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=93443-100ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Phallodin-Green Fluorescent Alexa Fluor 488 | InVitrogen | A12379 | http://www.lifetechnologies.com/order/catalog/product/A12379?CID=search-a12379 |
| dissolve powder in 1.5 ml methanol | |||
| Alexa Fluor 647 | InVitrogen | A21245 | 1:200 dilution in PBS 1x |
| rabbit polyclonal anti-Giantin | Abcam | ab24586 | 1:500 dilution in PBS 1x |
| http://www.abcam.com/giantin-antibody-ab24586.html | |||
| rabbit anti-anillin | Courtesy of M. Glotzer, Published in Piekny, A. J. & Glotzer, M. Anillin is a scaffold protein that links RhoA, actin, and myosin during cytokinesis. Current biology 18, 30–6 (2008). | 1:500 dilution in PBS 1x | |
| Anti-phosphotyrosine | Transduction Lab | 610000 | http://www.bdbiosciences.com/ptProduct.jsp?ccn=610000 |
| Cy3 goat anti-rabbit | Jackson Immunoresearch | 111-166-047 | http://www.jacksonimmuno.com/catalog/catpages/fab-rab.asp |
| 1:1,000 dilution in PBS 1x | |||
| DAPI | Sigma-Aldrich | D8417 | http://www.sigmaaldrich.com/catalog/product/sigma/d8417?lang=fr®ion=FR |
| 1 mg/ml for 1 min | |||
| Glycerol | Sigma-Aldrich | G2025 | http://www.sigmaaldrich.com/catalog/search?interface=All&term=G2025&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Mineral oil | Sigma-Aldrich | M8410-500ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=M8410-500ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| HeLa cells | - | - | Mammalian cells are available from many companies. See also Table 1 |
| NIH3T3 cells | ATCC | - | Mammalian cells are available from many companies. See also Table 1 |
| Fission yeast | - | - | For details on strains, contact the corresponding author. See also Table 1 |
| C. elegans worms | - | - | For details, contact the corresponding author. See also Table 1 |
| YES (Agar) + 5 Supplements included | MP Biomedicals | 4101-732 | http://www.mpbio.com/search.php?q=4101-732&s=Search |
| For preparation: follow instructions as given on the box | |||
| YES (Media) + 5 Supplements included | MP Biomedicals | 4101-522 | http://www.mpbio.com/search.php?q=4101-522&s=Search |
| For preparation: follow the instructions as given on the box | |||
| EMM (Media) | MP Biomedicals | 4110-012 | http://www.mpbio.com/search.php?q=4110-012&s=Search |
| For preparation: follow instructions as given on the box | |||
| Filter sterilized EMM (Media) - Only for imaging | MP Biomedicals | 4110-012 | For preparation: follow instructions as given on the box. Filter sterilize the media using a 0.22 µm filter instead of autoclaving. This gives transparency to the media and reduces the autofluorescence. |
| Supplements (for EMM) | MP Biomedicals | 4104-012 | http://www.mpbio.com/search.php?q=4104-012&s=Search |
| (Add 225 mg/L into the EMM media before autoclaving or filtering) | |||
| Stericup and Steritop Vaccum driven sterile filters | Millipore | - | http://www.millipore.com/cellbiology/flx4/cellculture_prepare&tab1=2&tab2=1#tab2=1:tab1=2 |
Referenzen
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294, 1708-1712 (2001).
- Azioune, A., Storch, M., Bornens, M., Thery, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab Chip. 9, 1640-1642 (2009).
- Mandal, K., Balland, M., Bureau, L. Thermoresponsive Micropatterned Substrates for Single Cell Studies. PLoS ONE. 7, e37548(2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nat Rev Mol Cell Biol. 8, 839-845 (2007).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. , (2012).
- Ghibaudo, M., Di Meglio, J. M., Hersen, P., Ladoux, B. Mechanics of cell spreading within 3D-micropatterned environments. Lab Chip. 11, 805-812 (2010).
- Greiner, A. M., Richter, B., Bastmeyer, M. Micro-Engineered 3D Scaffolds for Cell Culture Studies. Macromol Biosci. 12, 1301-1314 (2012).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat Mater. 12, 458-465 (2013).
- Legant, W. R., et al. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat Meth. 7, 969-971 (2010).
- Devices and methods for observing the cell division. , WO/2010/092116 (2010).
- Ochsner, M., et al. Micro-well arrays for 3D shape control and high resolution analysis of single cells. Lab Chip. 7, 1074-1077 (2007).
- Devices and methods for observing cells with cell wall or invertebrate embryos with oblong eggshell . , WO2013144302 (2012).
- Devices and methods for observing eukaryotic cells without cell wall. , WO2013135809 (2012).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends Biotech. 28, 237-245 (2010).
- Wolfe, D., Qin, D., Whitesides, G. Microengineering in Biotechnology, Ch 3. Methods in Molecular Biology. Hughes, M. P., Hoettges, K. F. 583, Humana Press. 81-107 (2010).
- Mehling, M., Tay, S. Microfluidic cell culture. Curr Op Biotech. 25, 95-102 (2014).
- Wollrab, V., Thiagarajan, R., Wald, A., Kruse, K., Riveline, D. Still and rotating myosin clusters determine cytokinetic ring constriction. Nat Commun. 7, 11860-11869 (2016).
- Yao, X., et al. Functional analysis of single cells identifies a rare subset of circulating tumor cells with malignant traits. Integr Biol. 6, 388-398 (2014).
- Eberwine, J., Sul, J. Y., Bartfai, T., Kim, J. The promise of single-cell sequencing. Nat Meth. 11, 25-27 (2014).
- Allen, T. D., et al. Generation of cell-free extracts of Xenopus eggs and demembranated sperm chromatin for the assembly and isolation of in vitro-formed nuclei for Western blotting and scanning electron microscopy (SEM). Nat. Protocols. 2, 1173-1179 (2007).
- Robbins, E., Marcus, P. I. Mitotically Synchronized Mammalian Cells: a Simple Method for Obtaining Large Populations. Science. 144, (1964).
- Whitfield, M. L., et al. Stem-loop binding protein, the protein that binds the 3" end of histone mRNA, is cell cycle regulated by both translational and posttranslational mechanisms. Molecular and Cellular Biology. 20, (2000).
- Straight, A. F., et al. Dissecting Temporal and Spatial Control of Cytokinesis with a Myosin II Inhibitor. Science. 299, 1743-1747 (2003).
- Tang, J., Erikson, R. L., Liu, X. Checkpoint kinase 1 (Chk1) is required for mitotic progression through negative regulation of polo-like kinase 1 (Plk1). Proc Natl Acad Sci. 103, 11964-11969 (2006).
- Zahreddine, H., Zhang, H., Diogon, M., Nagamatsu, Y., Labouesse, M. CRT-1/Calreticulin and the E3 Ligase EEL-1/HUWE1 Control Hemidesmosome Maturation in C. elegans Development. Curr Biol. 20, 322-327 (2010).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans Methods: Synchronization and Observation. JoVE. , e4019(2012).
- Saha, S., Pollard, T. D. Anillin-related protein Mid1p coordinates the assembly of the cytokinetic contractile ring in fission yeast. Mol Biol Cell. 23, 3982-3992 (2012).
- Prestwich, G. D. Evaluating Drug Efficacy and Toxicology in Three Dimensions: Using Synthetic Extracellular Matrices in Drug Discovery. Acc Chem Res. 41, 139-148 (2007).
- Futamura, Y., et al. Morphobase, an Encyclopedic Cell Morphology Database, and Its Use for Drug Target Identification. Chem Biol. 19, 1620-1630 (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten