Method Article
シングルセルおよび3D閉じ込めにおける単一胚を注文:ハイコンテントスクリーニングのための新しいデバイスを
要約
私たちは、デバイスと、細胞や胚を研究するための新しい方法を報告しています。単一細胞が正確にマイクロキャビティアレイに並べられます。その3Dの閉じ込めは、生理的条件に遭遇した3D環境への第一歩であり、細胞小器官の向きを可能にします。セル形状を制御することにより、この設定は、標準的なアッセイで報告変動を最小限に抑えることができます。
要約
生物細胞は、通常、平坦(2D)表面上に観察されます。この条件は、生理的ではなく、表現型と形状は非常に可変です。そのような環境下での細胞に基づくスクリーニングは、したがって、重大な制限があります細胞小器官は、異種および/または特定の細胞小器官が適切に可視化することができない極端な表現型、細胞形態とサイズを示しています。また、in vivoでの細胞は、3D環境に位置しています。このような状況では、細胞は主に組織の周囲の細胞外マトリックスとの相互作用の異なる表現型を示します。標準及び細胞ベースのアッセイのための生理学的に関連する3次元環境内の単一のセルの順序を生成するために、ここでは、インビトロの3D細胞培養のためのデバイスの微細化およびアプリケーションを報告します。このデバイスは、マイクロキャビティの2次元配列(典型的には、10 5の空洞/ cm 2)を、単一細胞または胚で満たされ、それぞれ構成されています。細胞ポジション、形状、極性および内部細胞組織は、3Dアーキテクチャを示す正規化となります。私たちは、カバーガラスに付着した薄いポリジメチルシロキサン(PDMS)層の上に、「eggcups '、パターンにマイクロキャビティの配列をレプリカ成形を使用していました。空洞は、接着を促進するために、フィブロネクチンで被覆しました。細胞を遠心分離により挿入しました。充填率は80%まで許容するシステムごとに最適化しました。細胞および胚の生存率を確認しました。私たちは、このような核やゴルジ装置などの細胞小器官の可視化のためにこの手法を適用し、このような細胞有糸分裂中の細胞質分裂のリングの閉鎖などのアクティブなプロセスを、研究します。このデバイスは、ゴルジ体や核の位置合わせのための細胞質分裂の閉環と固めの表現型の間に、このような定期的な蓄積とミオシンとアクチンの不均一性などの新機能、の同定を可能にしました。我々は、哺乳動物細胞、分裂酵母、出芽酵母、C.するための方法を特徴としますエレガンスワットそれぞれの場合の具体的な適応i番目。最後に、このデバイスの特性は、薬物スクリーニングアッセイおよびパーソナライズされた医療のために特に興味深いもの。
概要
インビトロでの細胞ベースのアッセイにおける電流は、(2D)二次元です。この構成では、哺乳動物細胞のための自然ではないので、1生理学的に関連はありません。細胞は形状、サイズおよび異種の表現型の多様性を示します。このような平面や細胞小器官の極端な表現型(特にストレスファイバー)内の無秩序分布として、スクリーニング用途に適用されるとき、彼らは追加の重大な制限を提示します。これは、高予算が毎年費やされている薬物検査のための臨床試験において特に重要です。薬剤スクリーニングの初期段階であるため、人工2D培養条件の動物モデルに適用した場合、これらの薬物のほとんどはいえません。また、このアプローチを使用することによって、特定の細胞小器官は、適切に、そのような細胞質分裂のアクトミオシン細胞の有糸分裂の間にリング、および観察面に垂直な面内で進化している一般的な構造として、視覚化することができません。一部新しい2Dアッセイは、細胞骨格組織の上述の欠点及び重要な洞察が2,3観察されている解決するために提案されています。しかしながら、これらのアッセイは、まだ現在のもの重大な制限:細胞は、細胞が3次元構造を提示し、インビボで観察されるものとは対照的に、非常に広がり表現型を示します。培養法に関連したこれらのアーティファクトは、強化されたストレスファイバー1,4,5などの非生理的な機能をトリガすることができます。
2D環境6,7と比較した場合、三次元細胞培養アッセイは、多数の利点を提供します。彼らは、生理的に、より関連性の高い、との結果は、したがって、意味があります。一例として、ヒドロゲルに埋め込 まれた細胞は、3Dのような構造を示すが、その形態は、他の8,9、1つのセルから異なります。しかし、その形態は、スクリーニングアプリケーションを複雑に別のセルとは異なります。別の戦略は、単一埋め込むことです微細加工キャビティ10,11内の細胞。セル位置、形状、極性および内部セル組織が正規化になることができます。細胞に3Dのようなアーキテクチャを提供するだけでなく、マイクロキャビティは、高コンテンツスクリーニング研究10,12-14を可能にします。単一細胞は、マイクロアレイおよび細胞小器官に注文することができ、それらの進化を並行して観察することができます。この規則は、細胞の数が少ない、より良い空間的/時間的解像度との良好な統計情報を提供します。有用な化合物を確実に識別しやすくなります。
本研究では、高コンテンツスクリーニングアプリケーション10,12,13のための新しい3Dのような単一細胞培養システムの製作と応用を示しています。デバイスは、エラストマーマイクロキャビティ(10 5の空洞/ cm 2)で、造語「eggcups」(EC)の配列で構成されます。この作品での寸法とECの総容積は、個々のNIH3T3およびHeLa細胞の典型的なボリュームに最適化されています細胞分裂時に。円筒 - - 空洞の形態は、アクティブなプロセスの可視化のための適切配向セルの形状に選択されています。 15,16カバースリップレプリカモールディングをガラスに付着した薄いポリジメチルシロキサン(PDMS)層上にパターンにECのアレイを使用します。遠心分離により細胞をECに導入されます。ここでは、2D(平らな)表面上の同じ細胞と比較して、3D(EC)における細胞小器官(アクチンストレスファイバー、ゴルジ装置および核)の観察および正規化を報告しています。我々はまた、このような細胞有糸分裂17の間の細胞質分裂のアクトミオシンリングの閉鎖などの活性力学過程の観察を報告しています。最後に、我々はそのような出芽酵母、分裂酵母とCのような剛性の壁、と他のシステムでこの方法論の結果を示しますモデルシステムの広い範囲に私達の方法の適用性を確認するエレガンス胚 。
私たちは、詳細かつ網羅pは次の提示します3次元微細加工のための「eggcups」を製作し、適用するためにrotocol。我々のアプローチはシンプルで、クリーンルームを必要としません。私たちは、この新しい方法論がペトリ皿の代わりに、薬物スクリーニングアッセイおよびオーダーメイド医療のために特に興味深いものになることを期待しています。最後に、私たちのデバイスは、ガン18内または基礎研究19、例えば、外部刺激に対する細胞応答の分布を研究するために有用であろう。
プロトコル
「Eggcups」の1微細加工
- マスターの作製:マイクロキャビティアレイ
- 湿度の任意の存在を蒸発させ、200℃に3 ''シリコンウエハを加熱。
- スピンコートSU-8フォトレジストの薄層を。所望の厚さとフォトレジストの種類に応じて樹脂と紡糸速度の音量を調整します。この厚さは「eggcups」(EC)の深さを決定するであろう。厚さ30μmの層とSU-8 2025、2800 rpmでスピンコートしました。
- 厚さ30μmのSU-8 2025層のための1分(2のステップ1)65℃でのウエハプリベーク。希望するフォトレジストの種類や厚さに応じて時間を調整します。詳細については、メーカーのデータシートを確認してください。
- 厚さ30μmのSU-8 2025層のための3分(2のステップ2)95℃でのウエハプリベーク。希望するフォトレジストの種類や厚さに応じて時間を調整します。詳細については、メーカーのデータシートを確認してください。
- ロードUV露光用マスクアライナー上のウエハ。その上に、フォトリソグラフィマスクを配置します。マスクは、直径20μmの円形の特徴(ディスク)のパターンを示しています。互いの間の完全な接触を確保します。
注:別のメーカーは、フォトリソグラフィマスクを提供しています。空間分解能は、最終的なコストを決定します。酢酸マスクは、低コストで許容可能な解像度(≈10μm)を提供しています。クロムマスクは、良好な分解能を提供するが、より高価です。細胞の容積に(フォトリソグラフィマスクからの)ディスクの直径を適応させます。マスク上のディスクの寸法は、デバイス内の空洞の直径を決定します。小さい直径は、低充填につながります。あまりにも大きな直径は、細胞を閉じ込めることはありません。 HeLa細胞およびNIH3T3細胞の場合、20〜25μmでミクロンの直径が提案されています。 - UVランプの前博覧会の力を確認し、それに従って露光時間を最適化します。 41.5秒(または最適化された露光時間)にするために(波長= 365 nm)を照射250mJ / cm 2です。
注:SU-8 2025 UVに露光領域が硬化されることを意味ネガ型フォトレジストです。この場合には、円形の特徴は、黒、残りは透明でした。反対の方法で、ポジ型フォトレジストの作業:非露光領域が硬化されます。デザインやフォトマスクに応じて、それに応じてフォトレジストを選択します。
注:適切な安全メガネを有するUV光から目を保護します。 - 静かにフォトレジスト層からマスクを削除します。
- ポストベーク厚さ30μmのSU-8 2025層のための1分(2のステップ1)65℃でのウェハ。ポストベーク厚さ30μmのSU-8 2025層のための3分(2のステップ2)95℃でのウェハ。希望するフォトレジストの種類や厚さに応じて時間を調整します。詳細については、メーカーのデータシートを確認してください。ポストベークした後、約1分間のベンチ上で室温にウェーハを冷却します。
- スピンコーターにウェハを置き、カバーするために、SU-8の開発者の数mmをドロップ全体のウエハ領域。スピンコートを1000rpmで30秒間、その後2分間の開発と。手順を3回繰り返します。
- 未開発のSU-8の完全な除去を確実にするために、2-プロパノールで洗浄します。ホワイト領域の外観は、不完全な開発の指標です。そうであれば、現像工程に追加の時間を繰り返します。
- ハードベーク200℃でのウェハ製造された微細構造の堅牢性を確保するために。このステップはオプションです。
- 94ミリメートル×15ミリメートルのポリスチレンペトリ皿の内側微細構造を有する3 ''ウエハを保管してください。
注:表面処理のための、特にシラン化で、次のステップのための必要はありません。
- 柱アレイ:ポリジメチルシロキサン(PDMS)のレプリカの作製
- 完全に1:10(w / w)の50mlチューブ30内gで合計架橋剤とプレポリマーに混合します。
注:1:10(v / v)の比率を使用しても働いています。 - に5分間1800×gでチューブを遠心気泡を除去。
- 微細構造の上に静かにPDMSをドロップします。
注記:気泡がこのステップの間に表示された場合、15〜20分間真空ポンプを使用してサンプルを脱気。 - 4時間65℃のオーブンでサンプルを置きます。
注:プレポリマーの割合:硬化時間は一緒に架橋剤とユーザとの間で変化します。この時間は、PDMSの剛性を決定するであろう。 2つ以上の時間を硬化させるために、固定硬化時間に固執することをお勧めします。 - 穏やかに約10 5マイクロキャビティまたは'eggcups'を含む約1cm 2の関心領域(スタンプ)をカットしてメスを使用してください。
注:最初のPDMSをカットした後、静かにはがし。光学顕微鏡でPDMSレプリカの品質を確認してください。
- 完全に1:10(w / w)の50mlチューブ30内gで合計架橋剤とプレポリマーに混合します。
- レプリカ成形による「eggcups」の製作。以下では、「eggcups」の製造のための2つの代替戦略が記載されています。どちらのプロトコルも、シミありLARと同一の結果を提供します。
- 戦略1
- 30秒間酸素プラズマ処理により作製したPDMSスタンプを有効にします。埃の付着を防止するために、閉じたペトリ皿に一時的に活性化されたスタンプを保管してください。
注:プラズマのための他のガスが使用されている場合は露出時間を調整します。 - 活性化されたPDMSは、次の15 mlチューブのキャップにペトリ皿に逆さまアップ(構造を持つ側)スタンプ置きます。トリメチルクロロシラン200μlの(TMCS)とキャップを埋めます。ペトリ皿を閉じ、7分間スタンプsilanizeをしましょう。
注:スタンプおよび/または色(白)の変化のいくつかの一時的な変形を観察することができます。スタンプは、短時間で元の形状に回復すると構造が影響を受けることはありません。
注:TMCSは急性吸入と皮膚毒性を生成し、(かなりの距離を横切って発生することができ、点火フラッシュバックで)非常に可燃性です。これにより、離れたソースからヒュームカップボード中で使用されるべきです点火の秒。 - アップ逆さま構造をスピンコーター上にPDMSスタンプを配置します。構造物の上に:(プレポリマー1:10 w / wの架橋剤)液体PDMSの(20μlの周りの)数マイクロリットルの小滴を入れてください。 30秒間1500rpmでスピンコートは、構造体の上にPDMSの薄層を堆積させます。
注:スタンプは、その中央に小さな穴を持つペトリ皿のふたの上にスピンコータチャック場所スタンプに合わない場合。 - 堆積スピンコートPDMS層を硬化するために4時間65℃のオーブン中でスタンプを置きます。
- 30秒間酸素プラズマクリーナーを使用して、一緒に直径25mmのガラスカバースリップ#0で、逆さまアップPDMSスタンプを配置することによって、薄いPDMS層をアクティブ化します。次のステップに迅速に進んでください。
注:他の厚さ、形状、及び寸法を有するカバーガラスを用いることもできます。しかし、いくつかの細胞構造は、選択されたカバースリップの厚さや目的に応じて視覚化することは困難かもしれません倍率および/またはNAおよび/または作動距離。客観的なデータシートを確認してください。 - ガラスカバースリップでスタンプ(薄いスピンコートされた層を有する側)に接触して配置します。 「ボンディング」を作るためにピンセットで静かにすべてのスタンプの表面の周りを押し。最後に、約10秒間、スタンプの上に一定の圧力を保ちます。
- 30分間穏やかに「ピール''解放'' eggcups」の順にカバースリップのうちスタンプした後( 図1を参照)。エタノールとドライで十分に洗い流してください。 PDMS「eggcups 'が十分にカバーガラスに付着されていない場合( すなわち、それらは「unpeeling'ステップの間にデタッチ)は、プラズマクリーナーの設定を調整することを検討し、ステップ1.3.1.5で再起動します。
注:この手順はデリケートです。カバーガラスおよび/または薄いPDMS層の剥離の破損を避けるために注意を払います。 - 1ミリメートル×1の硬化PDMSの小片(ハンドル)グルー液体PDMSの小滴とカバーガラスの端の体積中のx 3ミリメートルミリメートル、前と同様にPDMSを治します。これは、( 図1を参照)、その後、試料の操作を容易にします。このステップはオプションです。
- 30秒間酸素プラズマ処理により作製したPDMSスタンプを有効にします。埃の付着を防止するために、閉じたペトリ皿に一時的に活性化されたスタンプを保管してください。
- 戦略2
- 30秒間酸素プラズマ処理によって作製PDMSスタンプを親水。埃の付着を防止するために、閉じたペトリ皿に一時的に活性化されたスタンプを保管してください。
注:プラズマのための他のガスが使用されている場合は露出時間を調整します。 - 30秒間15 Wで直径25mmのガラス製カバースリップ#0、酸素プラズマ処理を親水。次のステップに迅速に進んでください。
注:他の厚さ、形状、及び寸法を有するカバーガラスを用いることもできます。しかし、細胞構造が選択されたカバーガラスの厚さと客観的な特性に応じて視覚化することは困難になります(上記の注を参照)。 - スピンコート架橋剤w / wのPDMS(1:10の小滴:プレPOLカバーガラス上に数マイクロリットルのymer)。スピンコートを1,500 rpmで30秒間、約50ミクロンの最終的な厚さのために。
- 液体PDMSの小滴とカバーガラスの端の体積の1ミリメートル×1ミリメートル×3mmの硬化PDMSの小片(ハンドル)を接着し、前と同様にPDMSを治します。これは、( 図1を参照)、その後、試料の操作を容易にします。このステップはオプションです。
- きれいな上に一時的にPDMSでコーティングされたカバースリップを保存埃の付着から保護するために、ペトリ皿の内側に拭いてください。
- 各スタンプの上にシラン化試薬の滴を入れて、それが1-2分間蒸発してみましょう。その後、N 2気流下でそれらを乾燥させます。
注:このステップでは、スタンプの一時的な変形が蒸発中に観察することができます。スタンプは、微細構造の任意の永久変形することなく、N 2で乾燥させた後、元の形状を回復します。 - の上に非常に優しくシラン化スタンプをドロップペトリ皿に格納されたPDMS-スピンコーティングされたガラスカバースリップ。両側が接触時に完全に平行であることを確認してください。 PDMSコーティングされたカバーガラスの上に配置した後、スタンプを押したり、移動しないでください。
- 気泡を除去するために1〜2時間、真空中で試料を用いてペトリ皿を置きます。
注:サンプルは、スタンプのずれを回避するために、完全に水平であることを確認してください。また、潜在的に真空ポンプによる振動を避けてください。 - 4時間65℃のオーブンでサンプルを置きます。
- 静かに、「eggcups」を明らかにするためにスタンプをはがし。エタノールとドライで十分に洗い流してください。
注:この時点での練習が必要です。カバーガラスおよび/または薄いPDMS層の剥離の破損を回避することに注意を払ってください。
- 30秒間酸素プラズマ処理によって作製PDMSスタンプを親水。埃の付着を防止するために、閉じたペトリ皿に一時的に活性化されたスタンプを保管してください。
- 戦略1
2.「Eggcups '内に細胞を導入
「eggcups '内部哺乳動物細胞を導入するために、PDMS表面NEEDSは、細胞外マトリックスの接着タンパク質で官能化することができます。この例では、フィブロネクチンが、コラーゲンのような関心のある他のタンパク質を使用して、使用することができます。
- 30秒間酸素プラズマクリーナーの「eggcups 'を親水。
注:必要に応じてパラメータを最適化します。 - ウシ源から20μgのミリリットル-1フィブロネクチンのPBS 1X中の溶液を調製します。
- 5分間UVと「eggcups」を滅菌します。全体の「eggcups」の領域をカバーし、室温で1時間インキュベートしたフィブロネクチン溶液(20-50μlの周りの)小滴を堆積させます。乾燥からサンプルを保護します。
- 静かにPBS 1Xで「eggcups」をすすぎます。 3回繰り返します。
注:サンプルは数週間のために直ちにまたは暗所で4℃で保存し使用できるようになりました。 - (参照50ミリリットルチューブに高さ63ミリメートル、外径の26ミリメートルと内部半径寸法の7ミリメートルの円筒形のカスタムメイドのプラスチック片を導入図2)20
注意:使用UV殺菌アイテムまたはそれらを使用前に滅菌します。
注:この作品は、簡単に実験室で製造することができます。または使用可能な任意の機械工場によります。 - チューブ内の細胞培養培地の13ミ リリットルを入れて( 表1参照)。媒体は、サンプルの完全な浸漬を保証するために、少なくとも2センチメートル円筒形のピースの上に記入する必要があります。
注:酵母などの特定の細胞タイプの詳細、および他のモデル系またはC.エレガンス胚、および使用される対応する媒体は、セクション5および表1を参照してください。記載されているプロトコルは、HeLa、NIH3T3細胞、および他の細胞株( 表1を参照)のために最適化しました。 - プラスチック片の上側に非常に穏やかにチューブと並列内側「eggcups」を紹介します。 PDMSハンドルを使用してサンプルを保持するために鋭いピンセットを使用してください。押して、静かにそれまでのカバーガラスはプラスチック片、国連の上側の上にありますそれが完全に浸されるTIL( 図2参照 )。
注:これは、シャープでストレートピンセットを使用することをお勧めします。曲がったピンセットで、サンプルの操作は困難であり、破損の原因になります。 - 培養細胞P60シャーレで80から100パーセントコンフルエンスになるまで、トリプシン処理によってそれらを収集。
注:細胞は、野生型、トランスフェクトまたは目的の任意の薬剤で治療することができます。
注:「eggcups 'を入力するために、単一の細胞を避けることができます細胞凝集体の形成を避けてください。このステップ、ピペット上下徹底的にトリプシン処理した後を最適化するには。 - 再懸濁5mLの培養培地に細胞。 「eggcups」の上に細胞を200μlをピペット。
注:可能な限り中心として「eggcups」の上にセルをドロップしますが、物理的な接触を避けること。これは、破損および/または試料の損傷を防ぐことができます。 - 2分間1800×gで遠心分離します。
注:最初の遠心分離の後、マイクをチェック「eggcups」の充填率をroscope。 - 2分間、1800×gで「eggcups 'と遠心機の上に細胞のピペットを再度200μlの。充填率を最適化するために、全部で3回繰り返します。
注:最後の遠心分離した後、顕微鏡で「eggcups」の充填率を確認してください。必要に応じて、所望の充填率に達するまで充填+遠心分離手順を繰り返します。 - PDMSハンドルを保持鋭いピンセットを使用してチューブからサンプルを削除します。 「eggcups」で開催されていない「不穏'細胞には注意していることを確認します( 図2を参照)。
- 媒体とのペトリ皿にサンプルを置きます。微細構造アレイの各側に静かに次のピペッティングにより3回ダウン」eggcups '(合計4辺)に含まれていない細胞の過剰を除去するために洗浄します。
注:ピペッティングがあまりにも強く解放してもよいです「eggcups」からいくつかの細胞外。 - 非取付け細胞を除去するために新鮮な培地で培地を交換してください。
注:このステップでは、目的の薬剤を添加することができます。 - 細胞を修正またはタイムラプスimaging.Seeステップ4.1のためにそれらを準備します。
「Eggcups」で活躍細胞ダイナミクスの3観察:細胞質分裂の閉環
注:この例では、それぞれ、キー活性分子は、細胞の有糸分裂時に細胞質分裂の閉環に関与し、ミオシンとアクチンのためMYH10-GFPとLifeact-mCherryを用いてトランスフェクトされたHeLa細胞を使用しています。デバイスは、直径25μmのマイクロキャビティを用いて調製されます。彼らの観察のために、エピ蛍光倒立顕微鏡を使用し、60倍の油浸対物レンズ(1.40 NA、DIC、プランアポ)とGFP(ミオシン)とTxRed(アクチン)フィルタを装備します。あるいは直立共焦点顕微鏡は、25Xまたは63X HCX IR APO Lの水の対物レンズ(NA 0.95)を備え、使用されました。このエクサのためmple、非常に二重チミジンブロック、有糸分裂ブロックまたは有糸分裂シェイクオフ法21-24を使用して細胞を同期することをお勧めします。
注:「eggcups」のために使用されるPDMSの厚さは両方反転して直立に配置顕微鏡で目的の様々な使用を可能にします。
- 場所顕微鏡ホルダーに「eggcups 'および10%FCS、L-15観察培地1mlでそれを埋めます。蒸発を避けるために、ホルダの上にガラス蓋を置くかmedium.Select 60X油対物レンズの上にミネラルオイルの薄い層を適用します。
注:L-15培地は、非CO 2気圧に適しています。 DMEMのいくつかの化合物が自動蛍光性であることにも注意してください。このメディアを使用する場合は、1〜2時間のための高輝度ランプとそれを照射することによって蛍光化合物を光退色することをお勧めします。
注:DIC画像で作業するとき、プラスチックのふたを使用しないでください。 - 「eggcups 'とobserでホルダーを配置顕微鏡でvation媒体。 「eggcups '、及び細胞観察の同一平面上になるまで、明視野光を用いて慎重に焦点を当てます。
- ソフトウェアを開き、パラメータを調整します。アクチンとミオシンのためのフィルタTxRedとGFPを選択します。各チャネルの露出時間を調整します。典型的な取得率は、両チャンネルの5秒です。
注:露出時間は、セットアップに使用、染料または関心のある他の細胞小器官に応じて調整する必要があります。 - 関心領域を選択し、GFPまたはTxRedチャネルのいずれかを使用して、細胞質分裂のリングを求めます。正確に焦点を当てています。
注:リングはミオシンで鮮明で認識しやすくなります。 - リングが完全に閉じられるまで、両方のチャネルでの自動取得を実行します。
注:一部の光退色が観察されてもよいです。それを低減するために、顕微鏡のパラメータを調整します。
「Eggcups」に修正された細胞小器官の4観測
このステップは、ステップ#3の前または後に行うことができます。細胞は、直接、遠心分離工程の後に固定され、関心のオルガネラ、または顕微鏡で観察した後に染色することができます。この例では、「eggcups」でNIH3T3線維芽細胞上のゴルジ装置、核とアクチン繊維の染色を示します。
- 「Eggcups」中の細胞の固定化
- 37℃で3%パラホルムアルデヒド(PFA)と暖かいを準備します。 50mlのチューブ(または顕微鏡ホルダー)から「eggcups」のサンプルを削除し、P35ペトリ皿の内側に配置します。 PBS 1×で一回すすいでください。
注:3%パラホルムアルデヒドを製造するためのプロトコルは、他の場所で広く利用可能です。
注意:PFAの準備中にニトリル手袋と目の保護具を使用してください。 - 完全にPBSを削除し、3%PFAの1ミリリットルをドロップし、17分間インキュベートします。 PFAを削除し、PBS 1Xの1ミリリットルで二回すすいでください。 0.5%トリットの1ミリリットルを使用して透過処理細胞3分間で5分間、PBS 1Xで二回洗浄します。
- 37℃で3%パラホルムアルデヒド(PFA)と暖かいを準備します。 50mlのチューブ(または顕微鏡ホルダー)から「eggcups」のサンプルを削除し、P35ペトリ皿の内側に配置します。 PBS 1×で一回すすいでください。
- 「Eggcups」での細胞の染色
- PBSで1:500希釈で一次抗体ウサギポリクローナル抗Giantinとゴルジ体染色用の細胞をインキュベートします。プラスチックフィルムシート上に抗体溶液の100μlのドロップを置き、45分間逆さまに「eggcups」内部の細胞を培養します。
注:乾燥を防ぐためにカバーでサンプルを保護します。 - 慎重に「Eggcups」をリリースし、P35ペトリ皿に入れます。 PBS 1×で、3回、各5分洗浄します。
- (1:200)ファロイジンアレクサフルオロ488とアクチンストレスファイバーを染色するための:二次抗体のCy3ヤギ抗ウサギ(千1)を含むPBSでカクテルを準備します。
- プラスチックフィルムシート上に抗体溶液の100μlのドロップで細胞をインキュベートし、45分間逆さまに「eggcups」の内側の細胞を培養します。
- リリース慎重に」eggcアップ 'とP35ペトリ皿に入れます。 PBS 1×で、3回、各5分洗浄します。
- プラスチックフィルムシート上に1μgのml -1のPBS中DAPI100μlの低下を置く核染色のための細胞をインキュベートし、逆さまに45分間「eggcups」の内側の細胞を培養します。このステップは、ステップ4.2.3で行うことができます。
- 慎重に「eggcups」をリリースし、P35ペトリ皿に入れます。 PBS 1×で、3回、各5分洗浄します。
- 標準的な顕微鏡用スライドガラス上に:(1 V / V 1)と乾燥を避けるためにマニキュアでサンプルを密封PBS:マウント細胞は、15μlのグリセロールを使用しました。
注:「eggcups 'の厚さに応じて、実装が困難であり得ます。乾燥から保護PBS中P35ペトリ皿の中に、サンプルを保存することをお勧めします。
- PBSで1:500希釈で一次抗体ウサギポリクローナル抗Giantinとゴルジ体染色用の細胞をインキュベートします。プラスチックフィルムシート上に抗体溶液の100μlのドロップを置き、45分間逆さまに「eggcups」内部の細胞を培養します。
- 顕微鏡観察
注:この例では直立共焦点顕微鏡を使用している、PMTおよびハイブリッドの検出器を装備。 25Xまたは63 X HCX IR APO Lの水目標(0.95 NA)は、サンプルの広いフィールドを提供し、高コンテンツスクリーニングアプリケーションのための装置の適用性を示すために選ばれました。- 25Xや63X水の目的を選択します。
注:アプリケーション、信号に応じて、異なる目的に使用することができます。しかし、高開口数の対物レンズの使用が推奨されます。 - 「eggcups 'で固定した試料を置き、注意深く観察の平面内にある「eggcups'と細胞まで、明視野光(位相コントラストやDIC)を使用して焦点を合わせます。
- ソフトウェアを開き、パラメータを調整します。それぞれ、アクチン、ゴルジおよび核観察用フィルタGFP、Cy3およびDAPIを選択します。すべてのチャンネルの露出時間を調整します。
注:暴露時間の設定に応じて調整されなければなりません。 - 関心領域を選択し、焦点を合わせます。画像キャプチャを開始する( 図3参照 )。
- 25Xや63X水の目的を選択します。
- 核分裂と出芽酵母細胞
注:この例では、それぞれ、ミオシンとアクチンのためのRLC1-mCherryをとCHD-GFPでタグ付けされた分裂酵母細胞を使用しています。出芽酵母細胞を蛍光ここで標識されていません。分裂酵母観察用反転スピニングディスク共焦点顕微鏡を使用しました。 100X HCX PL APO CS油対物レンズ(1.4 NA)は、すべての取得のために使用しました。あるいは、細胞は、20X位相差空気目的LCPlanFl(0.4 NA)を備えた倒立位相差顕微鏡を用いて観察しました。この例では、プロトコルは、両方の細胞タイプについて同じです。- 上記のように「eggcups」表面を準備します。分裂および出芽酵母細胞を、直径5ミクロンのキャビティを調製した( 表1参照)。この場合、表面は、接着タンパク質で官能化される必要はありません。
注:充填CAnは円錐形の「eggcups 'を使用することによって最適化すること。この形状は、キャプチャし、遠心分離後のリンス工程中に放出さ回避の細胞を保持します。充填率は約80%で最適です。これらの円錐'eggcups'は、ディープ反応性イオンエッチング13を用いて製造することができます。 - 適切な培地中で培養酵母細胞は、0.2〜0.8の範囲の光学密度(OD)に達するまで( 表1参照します)。凝集物を除去するために、酵母細胞の培養物を超音波処理します。
- 遠心分離により「eggcups」で酵母細胞を挿入します。遠心分離のために、適切なODで培養した細胞の4ミリリットルを「eggcups 'でチューブに追加されます。 「eggcups」のセルが乱されていないながら、最初の遠心分離した後、静かに、「eggcups」に含まれていない細胞を再懸濁するためにチューブを振ります。再びチューブ、遠心分離機を開くことなく二回、この手順を繰り返します。これは、堆積を保証します空のマイクロキャビティへの培養物からの細胞の充填率が増加します。
注:酵母で作業する場合、それは実験中の作業温度に予熱遠心分離することをお勧めします
注:このプロトコルは、ここで一時停止し、後12時間まで継続することができます。この場合には、使用温度で試料を保存し、蒸発を防ぐためにそれをカバー。 - 顕微鏡ホルダーに「eggcups」を置き、撮影用のフィルター滅菌媒体とホルダーを埋めます。浮遊酵母細胞を効率的に除去されるまで、今同じメディアで細胞を洗浄。すすぎ工程中に「eggcups」で細胞を乱さないように注意してください。
- 100Xの油浸対物レンズを選択して、慎重に焦点を当てています。ソフトウェアを開き、パラメータを調整します。分裂酵母の場合は、アクチンとミオシンのためのフィルタのGFPとTxRedを選択して、両チャンネルの露出時間を調整します。典型的な取得率は3秒です。
注:上の依存フルオロフォア、タグの種類や設定、露出時間は、他のシステムのために変化します。
- 上記のように「eggcups」表面を準備します。分裂および出芽酵母細胞を、直径5ミクロンのキャビティを調製した( 表1参照)。この場合、表面は、接着タンパク質で官能化される必要はありません。
- C.エレガンス胚
注:この例では、Cを使用しています25-30μmの幅と長い50〜55μmのエレガンス胚。 25に示すように胚を培養しました。 C.を操作する方法の簡単な視覚的なプロトコルエレガンスは 26で見つけることができます。観察は40倍の空気対物0.55 NAを備えた倒立位相差顕微鏡を用いて行きました。- 上述した、直径25ミクロンとして「eggcups」表面を調製する( 表1参照)。この場合、表面は、接着タンパク質で官能化される必要はありません。
- 文化C. ( 表1参照)、適切な培養培地中で胚をエレガンス 。
- 上記のように培養液として超純水を使用して(2.12へのセクション2.6を参照)遠心分離によって「eggcups」で胚を挿入します。
注:胚は実験期間中、通常、超純水に「振る舞う」しました。あるいは、長期的な実験のための生理的M9バッファを使用しています。 - (セクション2.14を参照)は、上述したようにサンプルをすすぎます。顕微鏡ホルダーに「eggcups」を置きます。 40Xエア目的を選択して、慎重に焦点を当てています。ソフトウェアを開き、パラメータを調整します。 3秒の取得速度を選択します。
結果
「eggcups '(EC)は、3D環境に配向した細胞と胚の可視化を可能にする新たな高コンテンツのスクリーニング方法論です。さらに、標準的な2D(フラット)培養物中で観察することが困難であるいくつかの細胞プロセスは、この新たな方法により観察することができる。 図1aは、ECの微細加工のための手順の概要を示している(上記のプロトコルでも、第1参照)。この方法は、簡単、迅速、効率的かつ特別な装置の任意の必要がない。 図1Bおよび1Cは、それぞれ、大規模な画像と'eggcups」の拡大された走査型電子顕微鏡画像を示します。それを観察できるように、その形状及び大きさは、非常に規則的です。この方法は非常に柔軟です。異なる形状およびサイズを容易に製造し、別のモデル系に適合させることができます。 'eggcups'の寸法は、次のように選択した:寸法を分裂する細胞の2D表面上で測定した:彼らは球状の形状を有し、その直径は、EC直径のための良い指標としました。例えば、細胞分裂時にその長軸に沿って'eggcups'細長いと東洋における細胞。細胞や胚 - - この寸法はシステムによって異なりますので、この寸法は、それぞれの場合に評価されるべきです。
図2は、必要とされる材料( 図2a)を示し、「eggcups 'を使用する方法についてステップバイステップのプロトコル( 図2b)(上記のプロトコルでも、第2節を参照してください)。目的の細胞(または他のモデル系)とECの充填は非常にシンプルで早いのが特長です。典型的に、それはまた、細胞のトリプシン処理のための時間を含む20〜30分未満を要します。充填後、サンプルを(ライブイメージング)アクティブなプロセスを研究するために使用され得るか、または固定さintereの細胞小器官の視覚化のために染色することができますST(上述のプロトコルでも、セクション3および4を参照のこと)。
平坦な表面上では、細胞は、異種応答および細胞小器官の極端な表現型を示しました。実際には、アクチンストレスファイバー(および他の細胞小器官)は 、培養条件1のアーティファクトであることが示唆されています。この仮説を証明するために、我々は3D」eggcups」に、平らな面の両方NIH3T3細胞を培養し、異なる細胞小器官の表現型、すなわちアクチンストレスファイバー、ゴルジ装置および核を比較した。 図3は、細胞が組織化されている方法の例を示しています両方の構成に。 ECにおいて、細胞は均一な球状様表現型( 図3a)を示す規則配列に分布しています。平坦な表面上では、細胞は、典型的な無秩序、普及と異種の形態( 図3b)を示します。細胞骨格構造に大きな違いがあります。 R上の特定には、細胞16; eggcups 'は平らな面に比べてストレスファイバーの数の減少を示しています。これをさらに明確なストレスファイバーが( - D 図3cを参照してください)表示されていない画像を再構成し、3Dで確認されています。これは、いくつかの細胞構造は、2D培養中で拡大していることを確認します。これは、ストレスファイバーを識別することができないインビボで行わ観察と一致してもなります。
ゴルジ装置はまた、培養条件に応じてそれらの表現型に有意な変化を示している( 図4参照)。 2D培養物に対するゴルジ装置は、典型的には、それがより圧縮された表現型を示している」eggcups」のに対して核周囲を「受け入れる」の拡張表現型を示した( 図4aを参照してください- b)に示します。薬剤スクリーニング操作をシミュレートするために、我々はまた、両方の環境で培養した細胞に対する薬物の効果を評価しました。私たちは、ブレビスタチンmainlを選択しましたYは( 図3cを参照してください- d)のアクチンストレスファイバーを破壊し、ゴルジ形態に影響を与える可能性があるため。ゴルジは、細胞核の隣に位置しているので、この薬はまた、そのアーキテクチャに影響を与える可能性があります。私たちは、最初にこの薬剤で処理された細胞は、野生型(WT)細胞( - D 図3cを参照)に比べて少なく、定期的かつ均一な形態を示したことを観察しました。私たちは、その後、比較と'eggcups'上に、平らな面( 図4cを参照)上で観察ゴルジ表現型を定量化しました。私たちは、2Dは表面上「eggcups '細胞は、より圧縮された表現型を示した上で、一方の細胞は主に拡張表現型を示したことを観察しました。私たちは、WT及びブレビスタチン処理細胞との間の顕著な違いかかわらず、観察しませんでした。
最後に、2DのEC内の細胞のために、それが直交の両方で、XY平面に対して配向されているのに対し、細胞核がランダムに配向されている面WT及びブレビスタチンは、( - C 図5aを参照)の細胞を処理しました。これは、酵母および哺乳動物細胞10,12,13に細胞質分裂のリングの観察面を配向させる方法の元のアプリケーションに似た東洋の細胞小器官へのデバイスの強さを強調しています。我々は最終的に核の真球度がどのように学ん(ψ=のように定義されたV nは核のボリュームであり、A nは 、その表面積が/ nを、[1月3日 6V nは 2月3日 π])の培養条件によって影響を受けましたそして、ブレビスタチンによる細胞の処理時。 図5dは、ψの対応する分布を示しています。私たちは、ECは細胞の正常な球形度に影響を与えていないことが明らかになったWT EC、 対 フラット WTのための違いを観察しませんでした。しかし、我々が観察しました違いBlebb ECは、ECは2Dでマスクされる薬剤の実際の効果を明らかにしていることを示唆しているにWT ECを比較します 。
「eggcups」を使用して、生細胞の研究はまた、標準的な文化では表示されません小説アクティブなプロセスの識別を可能にします。我々は、ECで細胞を平板培養し、細胞分裂を可視化した。 図6は、細胞有糸分裂中の細胞質分裂の閉環の画像のシーケンスを示しています。標準的な2D培養はただ1つの平面10に対応する二つの領域を示しているのに対し、「eggcups」デバイスは、リングの完全な可視化を可能にします。 2D培養を用いてzスタック画像のシーケンスからリングの再構成が27を行うことができますが、重要な情報が失われます。品質が低いのz解像度に減少され、動的プロセスは解決できません。アクチンとミオシンは細胞分裂の力発生における重要なタンパク質です。そのダイナミクスはbはできません「eggcups 'で、それはすぐに明らかにされているのに対し、eは、2D培養物( 図6a)で画像化し、研究します。我々はミオシン17の定期的な蓄積を見つけるHeLa細胞に:私たちは、新規な構造とプロセスを特定しました。リング( 図6b)を閉じているように、これらの蓄積は、半径方向に移動します。分裂酵母では、我々はまた、ミオシンとアクチンにおける不均一性( 図6c、右)17を見つけます。我々は、HeLa細胞中で見たものとは対照的に、彼らは閉鎖時にリング上で回転します。速度は分-150μmの範囲内にあり、標準的な顕微鏡とzの再構築で解決ではないであろう。最後に、細胞質分裂のリングは、さらにその構成要素のために染色することにより研究することができます。我々は、リング( 図6d)付近のホスホチロシンの蓄積があることがわかります。また、anillinがリング( 図6E)に共局在していることを示すことができます。この配向で細胞を染色することにより、W電子anillinも不均一な分布を示していることを明らかにしました。
我々は、哺乳動物細胞、分裂酵母を報告したが、我々はまた、出芽酵母とCをテストした: 'eggcups'も異なるモデルシステムに適用しましたエレガンスは、( - 電子 図7aを参照してください)。この場合、プロトコルは、培地の条件で各特定のシステムのために適合された、空洞のサイズ及び形態( 表1参照します)。例として、円錐形のV ' は eggcups」は、最適な効率12を分裂酵母を固定化するための形態の代わりに、完全に円筒状(またはU字型)であった字型哺乳類細胞13のために用いられる形状。これは、ライフサイエンス研究の潜在的なアプリケーションと異なる細胞骨格の薬の効果を試験することができました。これは、開発方法論の柔軟性と信頼性を実証します。
さらに、細胞の高度に秩序配置が可能に単一細胞の蛍光の容易な、自動化された読み出し。我々は、「eggcups '( 図8a)にGFPを発現するNIH3T3細胞を挿入することによってこれを示します。セルの位置を容易に認識することができ、対応する発現レベルを測定した。 図8bは、蛍光シグナルの分布を示しています。これは、読み出し(免疫蛍光法、例えば、細胞内の蛍光レポーター)に適用することができます。
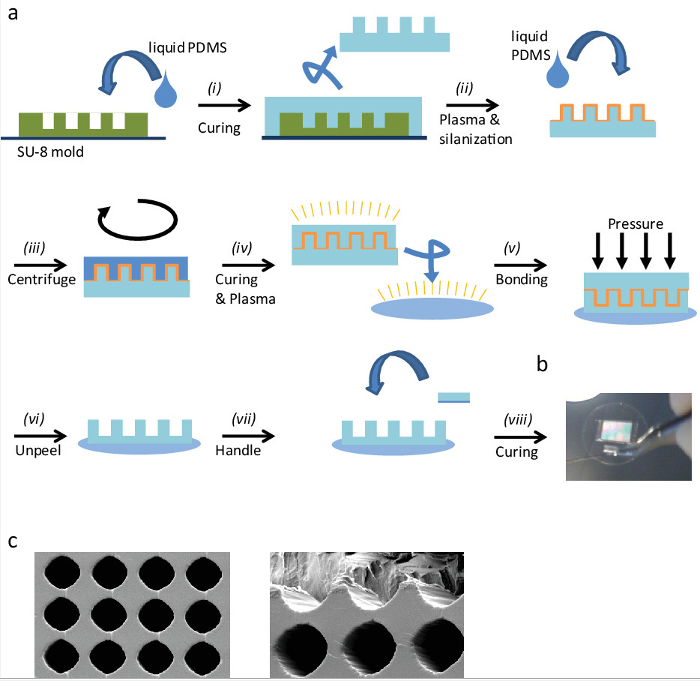
図1:「eggcups」の作製 (a)のレプリカ成形により「eggcups」の作製手順の概略説明:。(i)は、SU-8型の上に液体PDMSを注ぎ、それを治します。 (ii)のスタンプを切り取り、表面から慎重に取り外し、その後、プラズマはそれをsilanizeするためにそれを有効にします。 (iii)のシラン化スタンプANに液体PDMSを注ぎます薄いPDMS層を得るために、それを遠心dは。 (ⅳ)PDMS層を硬化させた後、プラズマは両方のアクティブ化、PDMSスタンプとガラスカバースリップをカバーしました。 (v)で穏やか、均一な圧力を加えることにより双方が結合プラズマ。 (VI)、プラズマボンディングした後、慎重に「eggcups」面を明らかにするスタンプを削除します。 (VII)、次の手順で処理を簡素化する小さなPDMSのハンドル部品を追加します。液体PDMSとそれを接着することによってカバースリップにPDMSピースと結合し、(VIII)オーブンで、それを治します。 (b)は PDMS」eggcups 'とハンドル25ミリメートルカバースリップのイメージ。 PDMS 'eggcups」の(c)の走査型電子顕微鏡画像。 「eggcups」の中心間の距離は30μmであり、その直径約25μm。(左)上から見た図である。(右)「Eggcups」は画像にカットされている内側の部分。 争うにはこちらをクリックしてください。この図のWA拡大版。

図2(a) は、ECの充填のために必要な要素。 (1)50mlチューブ。 (2)筒状ピース(上面及び側面図)。 (3)細胞培養培地。 (4)「eggcups '; (5)鋭いピンセット。 (b)は、EC充填手順の概略図。 (I)筒状片を最初の50 mlチューブに導入し、細胞培養培地13 mlを充填します。次に、(II) 'eggcups'は穏やか小さなPDMS片を用いてECを操作するための鋭利なピンセットを用いて円筒状片の上に堆積されます。 (iii)は、適切な密度で細胞をECの上にピペットで。 (IV)細胞を遠心分離により「eggcups 'に導入されています。 (v)の最後に、サンプルを穏やかにチューブから解放され、それを使用する準備ができています。メートル/ファイル/ ftp_upload / 51880 / 51880fig2large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
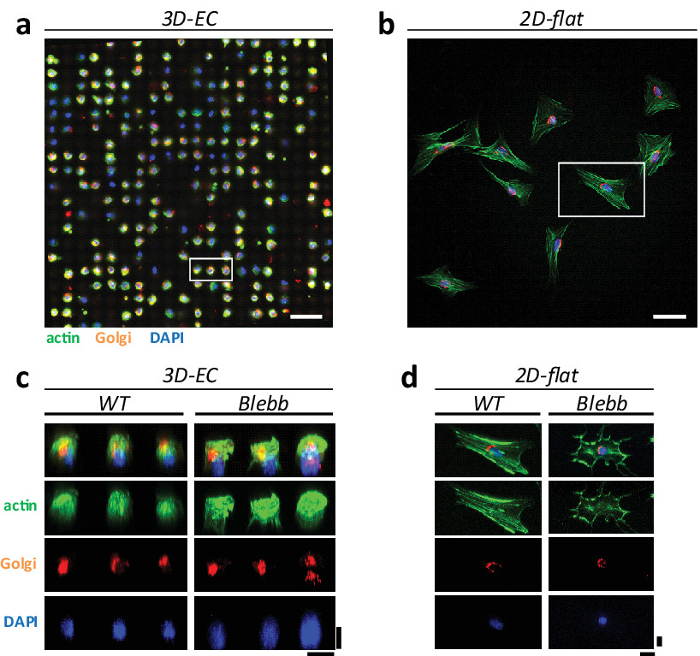
図3:3D 'eggcups'と2Dの平面上での細胞の表現型の比較。共焦点顕微鏡(25X水目的、0.95 NA、ライカ)(a)の EC上のNIH3T3細胞規則配列を形成し、均質な球状の表現型を示す、および(b)は 、標準的な2Dフラット文化上の画像は、ランダム不均質な表現型と一緒に配布します。細胞は、(緑色)アクチンを染色した、ゴルジ(オレンジ)と核(青)。スケールバー=100μmです。 WT及びブレビスタチン処理細胞のための平坦な表面上のECおよび(d)上の細胞の(c)の 3D再構成。スケールバー=20μmです。880 / 51880fig3large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図4:NIH3T3 ゴルジ体の表現型の研究 (a)のフラットと(b)の EC上の細胞のためのゴルジ表現型分類の回路図とサンプル画像。細胞は、α-値に応じて拡張または断片化、コンパクト化に分類されました。ゴルジ表現型の(c)の定量。スケールバー=10μmとは。 この図の拡大版をご覧になるにはこちらをクリックしてください。
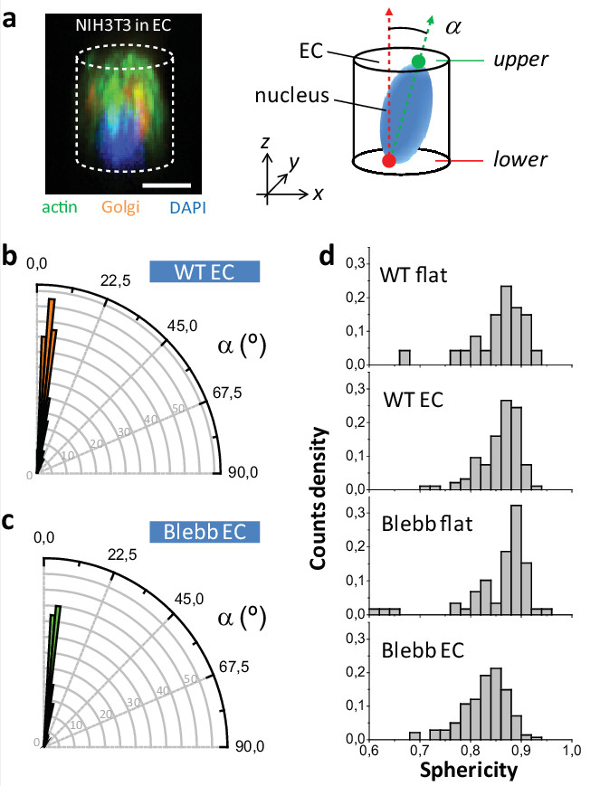
図5: EC内部NIH3T3核表現型の研究。(a)の (左)NIH3T3細胞の共焦点顕微鏡画像と(緑色)アクチンについて染色し、ゴルジ(オレンジ)と核(青)。の(右)スキームEC内側核向き。 WTのEC内部核および(c)は、ブレビスタチン処理細胞の(b)の角度分布。 (d)の核の球形のEC WT及びブレビスタチン処理細胞の両方についての値と平坦面(P [WT EC -Blebb EC] <0.001、P [Blebb フラット -Blebb EC] <000.1; nはWT フラット = 47、nはWT EC = 94、nはフラット Blebb = 59、nはBlebb EC = 141細胞)。スケールバー=10μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
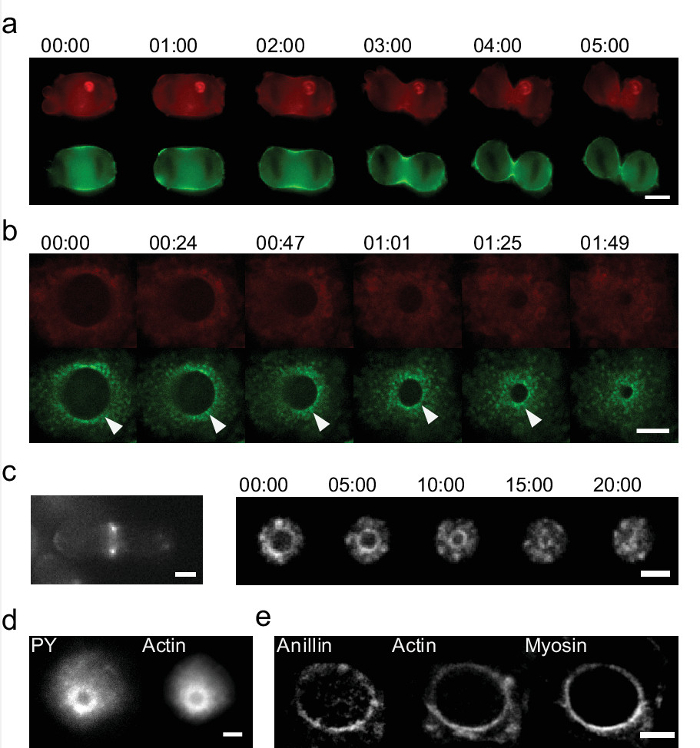
図6:「eggcups」 を使用して、ライブと固定試料中の2つのシステム内の細胞質分裂のリングの詳細な研究 体外培養における標準2Dを使用して、細胞質分裂のリングの(a)の時系列。 (、緑タグ付けされたGFP)アクチン(Lifeact-mCherryを、赤)とミオシンで唯一の2明るいスポットは、HeLa細胞の分裂溝(スケールバー=10μm)をに表示されます。 「eggcups」を使用して、有糸分裂中のHeLa細胞における細胞質分裂のリングのための閉鎖の(b)の時系列。画像は(赤)アクチンとミオシン(緑)を示します。 「Eggcups 'はまだ蓄積をミオシンの同定を可能に。一例は、矢印で強調表示されます。 (スケールバー= 5μm)で。 (c)の細胞質分裂のリングはまた、分裂酵母で可視化することができる。(左 )細胞は、平らな面にインサイトうそ運動リングは、2つのドットとしてのみ表示されます「eggcups '内(右)細胞:。全体の閉鎖を捕捉することができます。アクチンは、CHD-GFP(スケールバー=2μmの)で標識されます。分での時間:秒。 (D - E)染色された細胞質分裂の環の例。 (D)アクチン-GFPを発現するHeLa細胞はまた、環(スケールバー=5μm)を、信号を示しホスホチロシン(PY)について染色されます。 GFPを発現する(e)の HeLa細胞はミオシンとLifeact-mCherryを(アクチン)がanillinについて染色されているタグ付けされています。 Anillinは、細胞質分裂のリングと皮質におけるより低濃度に局在することが明らかにされています。これは、アクチンとミオシン(スケールバー= 5μmの)との共局在を示す。 この図の拡大版をご覧になるにはこちらをクリックしてください。
80 / 51880fig7.jpg "/>
図7:他の細胞型とモデル系への「eggcups」の応用 (a)の U2OS(ヒト骨肉腫)。挿入図は、分割セルを示しています。 (スケールバー=20μm)を。 (b)は、GFPを発現するNIH3T3細胞。発現レベルの差は、容易に(スケールバー=20μm)を読み出すことができます。 (C)SW480細胞(スケールバー=20μm)を。 (D)出芽酵母。そのサイクルタイムは変更されません。 (スケールバー=10μm)を。 (E)C.エレガンスワーム;平らな表面上(左)( 右)「eggcups」には、胚は、そうでなければ隠された視点から見られています。 (スケールバー=10μm)を。分の時間:秒この図の拡大版をご覧になるにはこちらをクリックしてください。

図8:「eggcups」 の配列内の組織は、細胞集団の自動解析を可能にする (a)は、ECにおけるNIH3T3細胞(スケールバー=20μm)を。これらは、GFPの異なる発現レベルを有します。 (b)細胞の位置の自動認識は、発現レベルの個々の分析を可能にします。細胞集団のGFP発現のヒストグラムに要約されている。 この図の拡大版をご覧になるにはこちらをクリックしてください。
| モデル系 | タイプ | 培養培地 | 観察中 | 「eggcups」径(μ;メートル) | コメント/説明 |
| 哺乳動物細胞 | NIH3T3 | 10%のBCS高グルコースDMEM | 10%BCSのL-15 | 20 | 例えばREF52またはMDCK、ならびに初代細胞株、癌細胞のような他の安定な細胞株、および/または幹細胞も「eggcups 'に挿入することができます。 |
| HeLa細胞 | 10%FCS高グルコースDMEM | 10%FCS、L-15 | 25 | 多くの異なるソースから入手できます。 | |
| U2OS | 10%FCS高グルコースDMEM | 10%FCS、L-15 | 20-25 | 多くの異なるソースから入手できます。 | |
| SW480 | 10%FCS高グルコースDMEM | 10%FCS、L-15 | 17-20 | 多くの異なるソースから入手できます。 | |
| 酵母 | 分裂酵母 | 寒天プレート(YE5S)および液体培地(YE5SとEMM5S) | 濾過滅菌EMMメディア(材料のリストを参照してください) | 5 | 表面は接着性タンパク質で官能化する必要はありません。 |
| 出芽酵母 | 寒天プレート(YPD)と液体培地(YEPDとSD) | SDメディア | 5 | 表面は接着性タンパク質で官能化する必要はありません。 | |
| 胚 | C.エレガンス | NGMプレート | 超純水 | 25 | あるいはM9培地は、長期の実験のために使用することができます。この塩漬け液のレシピはここで見つけることができます:http://cshprotocols.cshlp.org/content/2009/5/pdb.rec11798.full?text_only=true |
表1: 異なるモデル系のための「eggcups」における培養条件。上記に関連するプロトコルは、容易に適合させることができます今説明した培養条件と 'eggcups」のサイズを交換することもできます。
ディスカッション
レプリカ成形は「eggcups」を作製するために使用しました。製造プロセスは、クリーンルームを必要としません。いくつかの練習が必要になることがありますが、それは、簡単でシンプルです。具体的には、PDMSスタンプを解放すると、高品質」eggcups 'の大きな領域を生成するための最も重要なステップです。このため、特別な注意は、このステップで注意しなければなりません。このステップが繰り返し失敗する場合、シラン化およびプラズマ結合する前に、プラズマクリーナーのパラメータを最適化することを検討してください。不十分なシラン化は、PDMSフィルムにスタンプの強い固着につながります。これが観察された場合、シラン化試薬とのインキュベーション時間を増加させることができます。他の技術および材料は、リガンド(フィブロネクチン、ゼラチン、コラーゲンなど )の広い範囲で官能化することができる「eggcups 'を製造するのに適用することができます。特に、ポリスチレンにおけるマイクロキャビティは容易にCUSによって製造することができますトム製ホットエンボス加工技術。これは、生体適合性および標準的な培養皿で得られた結果との直接比較を保証します。同様に、特別な注意と実践は、充填率を最適化するために必要とされます。具体的には、すすぎ工程は、信号のノイズや背景に貢献し、細胞の無い過剰の適切な充填を確実にするために重要です。細胞は空洞から容易に除去されている場合は、空洞の大きさや深さを変更することを検討してください。
「Eggcups」は単純なプロトコルを用いて細胞と高コンテンツスクリーニングアッセイに3Dのようなアーキテクチャを提供します。細胞小器官および標準培養アッセイを使用して、未知のアクティブなプロセスを容易に個々のマイクロキャビティ( 'eggcups')の単一細胞を挿入することによって視覚化することができます。モデル系に応じて、大きさ、形状及びその寸法を容易に適合させることができます。このように、哺乳動物細胞、分裂酵母、出芽酵母及びC.エレガンス C操作および研究され、そのようなショウジョウバエ 、マウスまたは体外受精のためのヒト胚、または、例えば幹細胞としてだけでなく、任意の胚。
この設定では、単一の細胞が捕捉されます。これは、in vivoで遭遇する上皮組織とは対照的です。しかしながら、このような環境は、より柔軟なエラストマーを用いた細胞 - 細胞接触を模倣するカドヘリンと側壁をコーティングすることによって我々の「eggcups」で再現することができます。フォーカルコンタクトは、ウェルの底にフィブロネクチンの沈着によって促進されます。接着分子のこれらのそれぞれの分布は、in vivoで遭遇する細胞環境を再現することに許可する必要があります。この方法により1は、生理学的条件に近づくことになります。
私たちのアッセイで培地交換が確保されています。培地交換の不足のために短期および長期の両方の実験を行う際に、ECにおける細胞は、任意の劣化を示しません。 ECカリフォルニア州にも注意している細胞個々の細胞や胚を空洞内で分離されたときに主な関心があるが、nは合流するまで培養すること。
細胞小器官または生物全体のオリエンテーションは、新しい情報を明らかにされています。我々は、細胞質分裂のリング内のアクチンとミオシンの異なるダイナミクスを示します。分裂酵母および哺乳動物細胞における細胞質分裂のリングは同様の主要コンポーネントで構成されているが、我々は彼らの特定のダイナミクスが17種類であることを、このセットアップを示しています。これは、2つのシステムにおける閉鎖機構も同様に異なっていることが、この結果を支持しています。開発し、そのような仮説を調べるために、細胞の配向が必須です。将来の研究では、この装置は、細胞内小器官の組織に関連する他のイベントを調査するために使用することができます。
それを超えると、この技術は、発生生物学に非常に有用であることができます。細長い胚は容易に、配向観察またはさらに定義さ方向で処理することができます。おそらく私たちのアッセイは、胚の極性を課さないだろうが、高充填率は確実に目的の読み出しを抽出することが可能になります。要するに「eggcupsは「高コンテンツのスクリーニングのための良好なデバイスである可能性があります。
他の培養アッセイが提案されています。これらの方法は、マルチウェルプレート中の2D寸法の複数のセルから、同一形状のマイクロパターン接着モチーフに堆積し、単一の細胞に及びます。しかし、それらのいずれも、細胞小器官および動的プロセス1の観察に上記に詳述制限を克服するために適切ではありません。
私たちのシステムへの将来の改善は、業界指向の目的に「eggcups」の適用が可能になります。一例として、製薬会社における薬物スクリーニング用途は、マルチウェルプレート14,28の使用を必要とします。このようなプラットフォームに「eggcups」を実装することは、潜在的に信頼性を向上しますテストとその結果。このように、高含量スクリーニングアッセイは、ロボットを使用して製薬会社(および学術研究機関)の一般的に使用される自動化さプロセスを使用して実行されます。これは、低い変動性で再現性と信頼性を確保します。 3D細胞培養アッセイに基づいていくつかの商用製品はすでにアッセイのこの種の重要性を強調し、市場に登場しています。最後に、これらのデバイスは、個別化医療のための新たな展望を開く:患者由来の細胞は、「eggcups」に配置することができ、治療カクテルは、生理学的環境でテストすることができました。バイオマーカー読み出しは、患者29に与えられる最適な治療を予測することができます。要するに、細胞や胚の物理的形状は、空洞のアーキテクチャを案内され、我々は、デバイスと、この方法は、広く将来的に広げられることを願っています。
開示事項
我々は、開示することは何もありません。
謝辞
我々は、抗Giantin抗体、M. Labouesseラボで私たちを提供するためのL. Brino(IGBMCハイコンテントスクリーニング施設、イルキルシュ、フランス)を認めます。 C.のためのエレガンス (IGBMC)とBセラフィンラボ。酵母(IGBMC)、分裂酵母細胞用の蛍光HeLa細胞(MPI-CBG、ドレスデン)、J.モーズリー(ダートマス医科大学)とJQウー(オハイオ州立大学)のためのE. PaluchとA.ハイマンを出芽するため、 A.フールと実験の助けのためのF. Evenou、技術的なヘルプのためのC.リック(IBMC、ストラスブール、フランス)、および微細加工のヘルプのためのJC Jeannot(フェムト-ST、フランス)。この作品は、CNRS、ストラスブール大学、CONECTUS、ラ財団ラRECHERCHEMédicaleとCI-FRCストラスブールのを注ぐからの資金によってサポートされていました。
資料
| Name | Company | Catalog Number | Comments |
| ddH20 (ultrapure) | Millipore | - | Use always fresh water. |
| Parafilm (plastic film) | Bemis | PM-999 | Adhere Parafilm to the lab bench using some water droplets and ensure a perfect surface flatness. |
| Photo-mask | Selba | - | http://www.selba.ch |
| Silicon wafer | Siltronix | - | http://www.siltronix.com/ |
| SU-8 photoresist | MicroChem | 2000 series | http://www.microchem.com/Prod-SU82000.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| SU-8 developer | MicroChem | - | http://microchem.com/Prod-Ancillaries.htm |
| working in a fumehood is required; check the data sheet from the manufacturer for more information | |||
| 2-propanol | Sigma-Aldrich | 19030 | http://www.sigmaaldrich.com/catalog/product/sial/i9030?lang=en®ion=CA |
| Available from multiple companies. | |||
| Sigmacote (siliconizing reagent ) | Sigma-Aldrich | SL2-25ML | http://www.sigmaaldrich.com/catalog/product/sigma/sl2?lang=fr®ion=FR |
| harmful, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Chlorotrimethylsilane (TMCS) | Sigma-Aldrich | 386529-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/386529?lang=fr®ion=FR |
| TMCS produces acute inhalation and dermal toxicity, and is highly flammable (with ignition flashback able to occur across considerable distances), consequently it should be used in a fume cupboard away from sources of ignition | |||
| Nitrile gloves | Kleenguard | 57372 | http://www.kcprofessional.com/products/ppe/hand-gloves/thin-mil-/57372-kleenguard-g10-blue-nitrile-gloves-m |
| Available from multiple companies. | |||
| Glass coverslips #0 | Knittel glass | KN00010022593 | http://www.knittelglass.com/index_e.htm |
| Very fragile. Manipulate gently. | |||
| Sharp straight tweezers | SPI | 0WSSS-XD | http://www.2spi.com/catalog/tweezers/t/elec7 |
| 50 ml tube | BD Falcon | 352070 | http://www.bdbiosciences.com/cellculture/tubes/features/index.jsp |
| Available from multiple companies. | |||
| PDMS | Dow Corning | Sylgard 184 kit | http://www.dowcorning.com/applications/search/default.aspx?R=131EN |
| The package contains both PDMS base and curing agent. Similar elastomers are available from multiple companies. | |||
| Microscope glass slides | Dutscher | 100001 | http://www.dutscher.com/frontoffice/search |
| Available from multiple companies. | |||
| DMEM high-glucose medium | Fisher Scientific | 41965-039 | http://www.fishersci.com/ecomm/servlet/Search?LBCID=12301479&keyWord=41965-039&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Bovine calf serum | Sigma-Aldrich | C8056-500ML | http://www.sigmaaldrich.com/catalog/product/sigma/c8056?lang=en®ion=CA |
| 0.25% Trypsin-EDTA | Fisher Scientific | 25200-072 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=25200-072&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS 1x | Fisher Scientific | 14200-067 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=14200-067&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| PBS is at 10x and should be diluted to 1x using ddH2O | |||
| L-15 medium | Fisher Scientific | 21083-027 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=21083-027&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=PROD |
| Medium for atmospheres without CO2 control | |||
| Fibronectin | Sigma-Aldrich | F1141-5MG | http://www.sigmaaldrich.com/catalog/search?interface=All&term=F1141-5MG&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Penicillin & Streptomycin | Fisher Scientific | 15140-122 | http://www.fishersci.com/ecomm/servlet/Search?keyWord=15140-122&store=Scientific&nav=0&offSet=0&storeId=10652&langId=-1&fromSearchPage=1&searchType=CHEM |
| Petri dish P35 | Greiner | 627102 | http://www.greinerbioone.com/en/row/articles/catalogue/article/144_11/12885/ |
| Petri dish P60 | Greiner | 628163 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/145_8_bl/24872/ |
| Petri dish P94 | Greiner | 633179 | http://www.greinerbioone.com/nl/belgium/articles/catalogue/article/146_8_bl/24882/ |
| Paraformaldehyde 3 % | Sigma-Aldrich | P6148-500G | http://www.sigmaaldrich.com/catalog/product/sial/p6148?lang=fr®ion=FR |
| Harmful in-particular for the eyes, working in a fumehood is required; check the data sheet from the manufacturer for more information. | |||
| Triton 0.5 % | Sigma-Aldrich | 93443-100ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=93443-100ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Phallodin-Green Fluorescent Alexa Fluor 488 | InVitrogen | A12379 | http://www.lifetechnologies.com/order/catalog/product/A12379?CID=search-a12379 |
| dissolve powder in 1.5 ml methanol | |||
| Alexa Fluor 647 | InVitrogen | A21245 | 1:200 dilution in PBS 1x |
| rabbit polyclonal anti-Giantin | Abcam | ab24586 | 1:500 dilution in PBS 1x |
| http://www.abcam.com/giantin-antibody-ab24586.html | |||
| rabbit anti-anillin | Courtesy of M. Glotzer, Published in Piekny, A. J. & Glotzer, M. Anillin is a scaffold protein that links RhoA, actin, and myosin during cytokinesis. Current biology 18, 30–6 (2008). | 1:500 dilution in PBS 1x | |
| Anti-phosphotyrosine | Transduction Lab | 610000 | http://www.bdbiosciences.com/ptProduct.jsp?ccn=610000 |
| Cy3 goat anti-rabbit | Jackson Immunoresearch | 111-166-047 | http://www.jacksonimmuno.com/catalog/catpages/fab-rab.asp |
| 1:1,000 dilution in PBS 1x | |||
| DAPI | Sigma-Aldrich | D8417 | http://www.sigmaaldrich.com/catalog/product/sigma/d8417?lang=fr®ion=FR |
| 1 mg/ml for 1 min | |||
| Glycerol | Sigma-Aldrich | G2025 | http://www.sigmaaldrich.com/catalog/search?interface=All&term=G2025&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| Mineral oil | Sigma-Aldrich | M8410-500ML | http://www.sigmaaldrich.com/catalog/search?interface=All&term=M8410-500ML&lang=en®ion=CA&focus=product&N=0+220003048+219853082+219853286&mode=match%20partialmax |
| HeLa cells | - | - | Mammalian cells are available from many companies. See also Table 1 |
| NIH3T3 cells | ATCC | - | Mammalian cells are available from many companies. See also Table 1 |
| Fission yeast | - | - | For details on strains, contact the corresponding author. See also Table 1 |
| C. elegans worms | - | - | For details, contact the corresponding author. See also Table 1 |
| YES (Agar) + 5 Supplements included | MP Biomedicals | 4101-732 | http://www.mpbio.com/search.php?q=4101-732&s=Search |
| For preparation: follow instructions as given on the box | |||
| YES (Media) + 5 Supplements included | MP Biomedicals | 4101-522 | http://www.mpbio.com/search.php?q=4101-522&s=Search |
| For preparation: follow the instructions as given on the box | |||
| EMM (Media) | MP Biomedicals | 4110-012 | http://www.mpbio.com/search.php?q=4110-012&s=Search |
| For preparation: follow instructions as given on the box | |||
| Filter sterilized EMM (Media) - Only for imaging | MP Biomedicals | 4110-012 | For preparation: follow instructions as given on the box. Filter sterilize the media using a 0.22 µm filter instead of autoclaving. This gives transparency to the media and reduces the autofluorescence. |
| Supplements (for EMM) | MP Biomedicals | 4104-012 | http://www.mpbio.com/search.php?q=4104-012&s=Search |
| (Add 225 mg/L into the EMM media before autoclaving or filtering) | |||
| Stericup and Steritop Vaccum driven sterile filters | Millipore | - | http://www.millipore.com/cellbiology/flx4/cellculture_prepare&tab1=2&tab2=1#tab2=1:tab1=2 |
参考文献
- Cukierman, E., Pankov, R., Stevens, D. R., Yamada, K. M. Taking Cell-Matrix Adhesions to the Third Dimension. Science. 294, 1708-1712 (2001).
- Azioune, A., Storch, M., Bornens, M., Thery, M., Piel, M. Simple and rapid process for single cell micro-patterning. Lab Chip. 9, 1640-1642 (2009).
- Mandal, K., Balland, M., Bureau, L. Thermoresponsive Micropatterned Substrates for Single Cell Studies. PLoS ONE. 7, e37548(2012).
- Pampaloni, F., Reynaud, E. G., Stelzer, E. H. K. The third dimension bridges the gap between cell culture and live tissue. Nat Rev Mol Cell Biol. 8, 839-845 (2007).
- Baker, B. M., Chen, C. S. Deconstructing the third dimension: how 3D culture microenvironments alter cellular cues. J Cell Sci. , (2012).
- Ghibaudo, M., Di Meglio, J. M., Hersen, P., Ladoux, B. Mechanics of cell spreading within 3D-micropatterned environments. Lab Chip. 11, 805-812 (2010).
- Greiner, A. M., Richter, B., Bastmeyer, M. Micro-Engineered 3D Scaffolds for Cell Culture Studies. Macromol Biosci. 12, 1301-1314 (2012).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat Mater. 12, 458-465 (2013).
- Legant, W. R., et al. Measurement of mechanical tractions exerted by cells in three-dimensional matrices. Nat Meth. 7, 969-971 (2010).
- Devices and methods for observing the cell division. , WO/2010/092116 (2010).
- Ochsner, M., et al. Micro-well arrays for 3D shape control and high resolution analysis of single cells. Lab Chip. 7, 1074-1077 (2007).
- Devices and methods for observing cells with cell wall or invertebrate embryos with oblong eggshell . , WO2013144302 (2012).
- Devices and methods for observing eukaryotic cells without cell wall. , WO2013135809 (2012).
- Zanella, F., Lorens, J. B., Link, W. High content screening: seeing is believing. Trends Biotech. 28, 237-245 (2010).
- Wolfe, D., Qin, D., Whitesides, G. Microengineering in Biotechnology, Ch 3. Methods in Molecular Biology. Hughes, M. P., Hoettges, K. F. 583, Humana Press. 81-107 (2010).
- Mehling, M., Tay, S. Microfluidic cell culture. Curr Op Biotech. 25, 95-102 (2014).
- Wollrab, V., Thiagarajan, R., Wald, A., Kruse, K., Riveline, D. Still and rotating myosin clusters determine cytokinetic ring constriction. Nat Commun. 7, 11860-11869 (2016).
- Yao, X., et al. Functional analysis of single cells identifies a rare subset of circulating tumor cells with malignant traits. Integr Biol. 6, 388-398 (2014).
- Eberwine, J., Sul, J. Y., Bartfai, T., Kim, J. The promise of single-cell sequencing. Nat Meth. 11, 25-27 (2014).
- Allen, T. D., et al. Generation of cell-free extracts of Xenopus eggs and demembranated sperm chromatin for the assembly and isolation of in vitro-formed nuclei for Western blotting and scanning electron microscopy (SEM). Nat. Protocols. 2, 1173-1179 (2007).
- Robbins, E., Marcus, P. I. Mitotically Synchronized Mammalian Cells: a Simple Method for Obtaining Large Populations. Science. 144, (1964).
- Whitfield, M. L., et al. Stem-loop binding protein, the protein that binds the 3" end of histone mRNA, is cell cycle regulated by both translational and posttranslational mechanisms. Molecular and Cellular Biology. 20, (2000).
- Straight, A. F., et al. Dissecting Temporal and Spatial Control of Cytokinesis with a Myosin II Inhibitor. Science. 299, 1743-1747 (2003).
- Tang, J., Erikson, R. L., Liu, X. Checkpoint kinase 1 (Chk1) is required for mitotic progression through negative regulation of polo-like kinase 1 (Plk1). Proc Natl Acad Sci. 103, 11964-11969 (2006).
- Zahreddine, H., Zhang, H., Diogon, M., Nagamatsu, Y., Labouesse, M. CRT-1/Calreticulin and the E3 Ligase EEL-1/HUWE1 Control Hemidesmosome Maturation in C. elegans Development. Curr Biol. 20, 322-327 (2010).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans Methods: Synchronization and Observation. JoVE. , e4019(2012).
- Saha, S., Pollard, T. D. Anillin-related protein Mid1p coordinates the assembly of the cytokinetic contractile ring in fission yeast. Mol Biol Cell. 23, 3982-3992 (2012).
- Prestwich, G. D. Evaluating Drug Efficacy and Toxicology in Three Dimensions: Using Synthetic Extracellular Matrices in Drug Discovery. Acc Chem Res. 41, 139-148 (2007).
- Futamura, Y., et al. Morphobase, an Encyclopedic Cell Morphology Database, and Its Use for Drug Target Identification. Chem Biol. 19, 1620-1630 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved