Method Article
Um Modelo de Rato Baixa Mortalidade para Avaliar vasoespasmo cerebral adiada após hemorragia subaracnóide Experimental
Neste Artigo
Resumo
Hemorragia subaracnóide aneurismática (HAS) é o sangramento que ocorre no espaço subaracnóide, quando uma ruptura de aneurisma. Enquanto a morbidade e mortalidade por este evento foi em um declínio devido a abordagens de tratamento melhores, o risco de vasoespasmo após hemorragia subaracnóide continua a ser o mesmo que era há alguns anos. A importância de estabelecer um modelo animal abrangente e reprodutível para identificar eventos de iniciação de vasoespasmo cerebral tem sido o foco de pesquisa desde o primeiro uso de ratos em um modelo experimental vasoespasmo em 1979 por Barry Et al. Os trabalhos iniciais em ratos demonstraram que uma única injecção de sangue autólogo para a cisterna magna levou a aguda (dentro de minutos), mas não vasoespasmo cerebral atrasado 3, 6, 14. Aqui nós caracterizar uma baixa mortalidade ratos HAS que resulta em atraso vasoespasmo reprodutível.
Resumo
Objectivo: Para caracterizar e estabelecer um modelo reprodutível que demonstra atrasado vasoespasmo cerebral após hemorragia subaracnóide aneurismática (SAH) em ratos, de modo a identificar os eventos que iniciam, alterações fisiopatológicas e potenciais alvos para o tratamento.
Métodos: Vinte e oito ratos machos Sprague-Dawley (250-300 g) foram arbitrariamente atribuídos a um de dois grupos - HSA ou solução salina de controlo. Hemorragia subaracnóide rato no grupo HAS (n = 15) foi induzido por injecção dupla de sangue autólogo, 48 hr à parte, para a cisterna magna. Da mesma forma, uma solução salina normal (n = 13) foi injectado na cisterna magna do grupo de controlo de solução salina. Os ratos foram sacrificados no quinto dia após a injecção de segundo sangue e os cérebros foram conservadas para análise histológica. O grau de vasoespasmo foi medida utilizando-se secções da artéria basilar, medindo-se a área da secção transversal interna do lúmen utilizando NIH software Image J-. O significado eratestado utilizando Tukey / Kramer análise estatística.
Resultados: Após a análise de secções histológicas, artéria basilar área seccional transversal luminal foram menores no SAH do que no grupo de solução salina, de acordo com o vasoespasmo cerebral no primeiro grupo. No grupo HAS, basilar área da artéria interna (0,056 ± 3 uM) foram significativamente menores do vasoespasmo cinco dias após a injecção de sangue segundo (sete dias após a injecção inicial de sangue), em comparação com o grupo de controlo de solução salina com área interna (0,069 ± 3, p = 0,004). Não houve mortalidade de vasoespasmo cerebral.
Conclusão: O modelo do rato induz uma dupla HAS leve, sobrevivência, vasoespasmo da artéria basilar, que pode ser usado para estudar os mecanismos patofisiológicos de vasoespasmo cerebral num modelo de animal de pequeno porte. A baixa taxa de mortalidade e aceitável é um critério importante de ser satisfeita para um modelo ideal de animais SAH de modo que os mecanismos de vasoespasmo pode ser Elucidated 7, 8. Outras modificações do modelo pode ser feita para ajustar a gravidade aumentada de vasoespasmo e as alterações neurológicas.
Protocolo
1. Cirurgia de rato para Assunto HAS injetado com 0,15 ml de sangue autólogo Arterial
- O rato é anestesiado utilizando 0,1 mg / kg de Cetamina / Xilazina cocktail roedor e deixada em repouso durante 5 min.
- Anestesia adequada é confirmado pela redução no reflexo membro posterior.
- Usando um barbeador eletrônico um pescoço com nariz área de cabelo em torno da sub-região occipital é raspada.
- O animal é colocado em decúbito dorsal sobre a mesa de cirurgia e a cauda é esfregada com betadine para assegurar uma incisão estéril.
- A reta uma incisão na linha centímetros é tomada na face ventral da cauda
- A dissecção é prorrogado até a artéria cauda é identificada e isolada.
- Através de um cateter de calibre 26 estéril, a artéria da cauda é canulada e 0,15 ml de sangue arterial é retirada para uma seringa.
- A gaze estéril é enrolado em torno da incisão para garantir a hemostase antes da aplicação do vetbond para selar a incisão.
- Tele virou rato é de bruços em cima da mesa e da área raspada sobre a região sub-occipital é limpo com betadine.
- Usando uma incisão vertical na linha média de acesso é obtido para a cisterna magna.
- Uma vez identificada uma agulha de calibre 25 é inserida dentro da cisterna magna e 0,15 ml de CSF é retirada para uma seringa para evitar o aumento da pressão intracraniana com injecção de volume de sangue autólogo.
- Agora, a 0,15 ml de sangue extraído a partir da artéria da cauda é injectada lentamente para a cisterna magna.
- A agulha é deixado no local durante 30 segundos para assegurar a coagulação no espaço subaracnóide e então cuidadosamente retirada.
- Hemostasia é assegurada e a incisão é fechada através de um dispositivo de grampeamento.
- O animal é agora colocado inclinado sobre uma superfície de aquecimento, com uma cabeça de 20 ° para baixo a posição durante 20 minutos para permitir que o sangue coagular nas cisternas ao redor da artéria basilar.
- 1,1-1,15 passos são repetidos durante a segunda hora de cirurgia 48 separados.
2. Cirurgia de rato para Assunto HAS injetado com 0,15 ml de soro
- O rato é anestesiado utilizando 0,1 mg / kg de Cetamina / Xilazina cocktail roedor e deixada em repouso durante 5 min.
- Anestesia adequada é confirmado pela redução no reflexo membro posterior.
- Usando um barbeador eletrônico um pescoço com nariz área de cabelo em torno da sub-região occipital é raspada.
- O animal é colocado em decúbito dorsal sobre a mesa de cirurgia e a cauda é esfregada com betadine para assegurar uma incisão estéril.
- A reta uma incisão na linha centímetros é tomada na face ventral da cauda
- A dissecção é prorrogado até a artéria cauda é identificada e isolada.
- Através de um cateter de calibre 26 estéril, a artéria da cauda é canulada e 0,15 ml de sangue arterial é retirada para uma seringa.
- A gaze estéril é enrolado em torno da incisão para garantir a hemostase antes da aplicação do vetbond para selar a incisão.
- O rat é ligado bruços em cima da mesa e da área raspada sobre a região sub-occipital é pintado com betadine.
- Usando uma incisão vertical na linha média de acesso é obtido para a cisterna magna.
- Uma vez identificada uma agulha de calibre 25 é inserida dentro da cisterna magna e 0,15 ml de CSF é retirada para uma seringa e a amostra é armazenada.
- Agora, a 0,15 ml de solução salina normal (37 ° C) é injectado lentamente na cisterna magna.
- A agulha é deixado no local durante 30 segundos e cuidadosamente retirado.
- Hemostasia é assegurada e a incisão é fechada através de um dispositivo de grampeamento.
- O animal é agora colocado inclinado sobre uma superfície de aquecimento, com uma cabeça de 20 ° para baixo a posição durante 20 minutos.
- 2,1-2,15 passos são repetidos durante a segunda hora de cirurgia 48 separados.
3. Sacrifício rato
- No dia 5 após a segunda cirurgia, os ratos são sacrificados por perfusão cardíaca.
- O rato é dada uma dose fatal (00,2 ml / kg) do Plus Fatal (Vortech PHARMACEUTICALS LTD., Dearborn, MI)
- Com uma incisão na linha média vertical, a cavidade abdominal é aproximado e do peritoneu é aberto.
- Uma toracotomia anterior é realizada e o coração é exposto.
- Através de um cateter de calibre 26 ligada a uma solução de tampão fosfato (PBS pH 7,4 e a 37 °), o animal é drenado de sangue e em seguida é submetido a perfusão com paraformaldeído a 4%.
- Depois de se assegurar de perfusão adequada, a perfusão é interrompida e o rato é colocado sobre a mesa de decapitação.
- Após decapitação, um rongeur óssea é utilizada para remover o crânio para a remoção do cérebro.
- O cérebro e do tronco cerebral são cuidadosamente extraídas da calota craniana e colocados numa solução de paraformaldeído a 4% e armazenados a 4 ° C durante 48 horas.
4. Criando seções para avaliar Vasoespasmo
- O cérebro de rato que foi agora submerso em sacarose a 30%, durante 4 dias é trazido a thcriostato e para corte.
- Uma vez cryoprotected, 12 seções pM são criados usando o criostato, com a artéria cerebelar ântero-inferior (AICA) como o ponto de partida para garantir a inter-sujeitos consistência.
- 20 seções são criados para cada animal, terminando na artéria cerebelar superior (SCA).
- As secções são colocadas sobre uma lâmina de vidro e avaliou por vasoespasmo utilizando metodologia histológica
Resultados
Dentro dos protocolos descritos acima, há vários passos que acreditamos que requerem uma melhor caracterização do modelo do que o que foi anteriormente descrito na literatura. Aqui vamos focalizar os passos que são essenciais para atingir um reprodutível baixa mortalidade cerebral vasoespasmo modelo animal pequeno e evitar as armadilhas potenciais associados com este modelo se não for feito corretamente.
1. Coleta de sangue autólogo da artéria da cauda:
Colocação cuidadosa do angiocateter na artéria da cauda é o primeiro passo essencial para o modelo. Figura-1 mostra a colocação de um cateter de calibre 26 na artéria da cauda da ratazana. Isso representa uma boa colocação com um mínimo de trauma e perda de sangue. A colocação adequada do angiocateter pode ser confirmada por retorno de sangue bom.
2. A injeção de sangue autólogo na Cisterna Magna:
Dissecção profunda de tele região suboccipital é realizada até que a membrana atlanto-occipital é visualizada como uma membrana branca brilhante (Figura-2). A cisterna magna é acedido através de uma punção através da membrana com uma agulha de calibre 25. Após a retirada da agulha, a partilha de sangue deve notar-se, para assegurar um volume suficiente de sangue autólogo permanece dentro do espaço subaracnoideo da cisterna magna. Excessivo acúmulo de sangue no aspecto exterior da membrana atlanto-occipital é indesejável porque o nosso modelo utiliza volumes relativamente baixos (0,15 ml) de sangue autólogo em comparação com os modelos existentes e agrupamento podem resultar em volumes ineficazes de sangue no espaço subaracnóideo. Maiores volumes de sangue freqüentemente resultou em insuficiência respiratória presumivelmente de pressão intracraniana elevada e produtos de sangue logo após a injeção. A recolha de sangue em torno de artérias no espaço subaracnóideo é um dos vários métodos possíveis para iniciar vasoespasmo experimental 8 . Na altura da cirurgia, em segundo lugar, a membrana atlanto-occipital podem, ocasionalmente, ser difícil de visualizar, embora o local da punção da primeira cirurgia é geralmente visível.
3. Espécime
Figura-3 mostra uma amostra de tronco cerebral recuperada a partir de um rato sem (Figura-3A) e com (Figura 3B) hemorragia subaracnóide. Note-se a recolha de sangue no espaço subaracnóideo em torno da artéria basilar na Figura 3B. Isto representa um volume suficiente de sangue para induzir vasoespasmo da artéria basilar. As setas na Figura 3A e Figura 3B-definir a extensão da artéria basilar (AB). As secções (12 um) são tomadas a partir do comprimento da BA estendendo-se desde a AICA ao SCA.
4. Os cortes histológicos
Vinte secções foram analisadas para cada espécime da artéria basilar no controle e solução salina SAHgrupos (Figura-4). A área interna da secção transversal do lúmen da artéria basilar eram menores e não havia ondulação significativa da lâmina elástica interna sugestivo de vasoespasmo, no grupo HAS (Figura-4A). A artéria basilar a partir do grupo de controlo de solução salina foi maior na área e não tem uma lâmina interna elástica ondulada (Figura-4B). A quantificação do grau de redução da área entre os dois grupos podem ser encontrados na Figura 5. Estes estudos confirmam que este modelo de SAH não produz vasoespasmo cerebral que pode ser avaliada através de métodos histológicos. Área em corte transversal do lúmen foi utilizado para determinar o vasoespasmo porque o processamento de tecidos eventualmente resulta em amorfos secções transversais dos vasos, o que torna difícil determinar um diâmetro apropriado para medir e utilizar para a análise de dados. Todas as medições foram realizadas utilizando o software NIH Image J-. No grupo HAS, a artéria basilar sãoA (interna = 0,056 mM ± 3) foram significativamente menores do que o grupo controle salina (interno = 0,069 mM ± 3, p = 0,004), devido a vasoespasmo. A significância foi testada utilizando Tukey / Kramer análise estatística. A Tabela 1 ilustra os valores calculados com desvios padrão e erros-padrão para ambos os grupos.
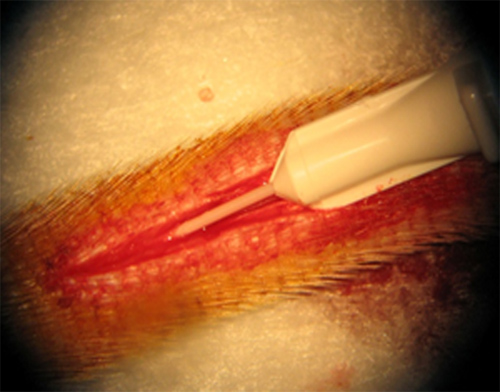
Figura 1. Inserção de um cateter de calibre 26 é inserida na artéria da cauda.
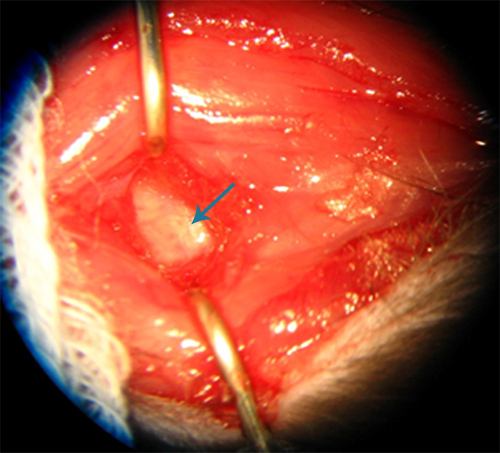
Figura 2. Aspecto da membrana atlanto-occipital (seta) no rato.
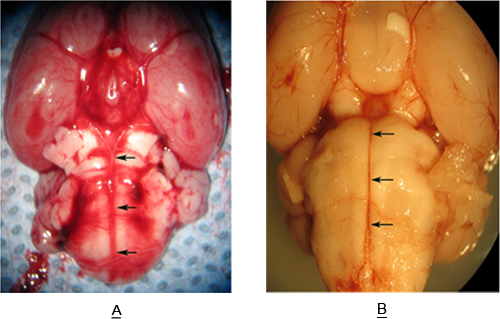
Figura 3. Superfície ventral do sutiã ratoinstem uma artéria basilar (setas) com (A) e sem (B), HAS.

Figura 4. Cortes histológicos mostram artéria basilar em HSA (A) e controlo de solução salina (B) os grupos. Note-se que a área seccional transversal do lúmen da artéria basilar é menor e a lâmina elástica interna é ondulado (seta) no grupo HAS, tanto de acordo com o vasoespasmo.

Figura 5. Comparação da artéria basilar luminais áreas seccionais entre os grupos de controlo com HSA e solução salina.
| Contar | A média (área seccional transversal Luminal) | Std. Desenv. | Std. Err. | |
| HAS | 15 | 0,056 milímetros | 0,01 | 0,003 |
| Salina | 13 | 0,069 milímetros | 0,012 | 0,003 |
Tabela 1. Calculado médias e desvios padrão de HAS e grupos de controle salien.
| Autores | 2 º HAS | Fonte | Volume injetado (1 º / 2 º) | Sacrifício (pós 2 ª HAS) | Métodos de Análise | Mortalidade |
| Ryba et al. (1999) | 48 | Arterial | 0.1/0.1 ml | Dia 5 | EM | 25% |
| Suzuki et al. (1999) | 48 | Arterial | 0.3/0.3 ml | Dia 5 | Angiografia | Desconhecido |
| Sato et al. (2002) | 48 | Arterial | 0.35/0.35 ml | Dia 5 | Histologia | 20% |
| Aladag et al. (2003) | 48 | Venoso | 0.3/0.3 ml | Dia 4 | Histologia | 18% |
| Vatter et al. (2006) | 24 | Arterial | 0.2/0.2 ml | Dia 3 | Angiografia, MRI | 47% |
| Lee et al. (2008) | 24 | Arterial | 0.3/0.2ml (n = 15) 0.2/0.1 ml (n = 54) | Dias 1/3/4/7/9 * | Histologia | 40% (n = 15) 1,5% (n = 54) |
| * Os ratos foram sacrificados diferencialmente dia 1 (n = 7), dia 3 (n = 7), Dia 5 (n = 7), Dia 7 (n = 7), o Dia 9 (n = 7) * Tabela modificado de Lee et al. (2008) | ||||||
Tabela 2 Resumo. Dos publicados duplas subaracnóides modelos de ratos hemorragia.
Discussão
Primatas, que tem uma composição mais semelhante genética e características anatómicas para o ser humano, imitar mais de perto os acontecimentos de vasoespasmo cerebral retardado e pode mais facilmente ser submetido a não-invasivo (RNM e angiografia) para monitorar as alterações arteriais, do que os roedores 8. No entanto, os modelos de primatas são um custo proibitivo e associada aos cuidados mais complexos e questões éticas, que os modelos animais de pequeno porte. Modelos animais pequenos SAH que têm sido desenvolvidos anteriormente têm-se centrado em três métodos de indução de HAS: 1) perfuração Endovascular arterial de uma artéria intracraniana permitindo que o sangue de escapar para dentro do espaço subaracnóide e recolher em torno da artéria lesionada, 2) a exposição cirúrgica da artéria e injecção de coágulo autólogo locais, 3) A injecção directa do sangue (autólogo ou dador) para o espaço subaracnóide 8. Cada modelo tem seus próprios méritos e desvantagens. Por exemplo, o modelo de perfuração endovascular mais imita os eventos de uma Aneurysm ruptura, mas está associada a uma taxa de mortalidade muito elevada e vasoespasmo precoce, ao passo que a abordagem cirúrgica é artificial e não imitam os eventos da apresentação humano típico de HAS de aneurisma. O modelo de injeção direta que descrevemos aqui tem uma mortalidade mais baixa do que o modelo de perfuração endovascular e mais imita a condição humana HAS do que um modelo cirúrgico aberto. Embora modelos similares foram descritos anteriormente, tivemos uma grande curva de aprendizagem com HAS modelo de desenvolvimento porque as complicações potenciais das nuances do modelo, não foram bem descrito em qualquer lugar anteriormente. Era nossa intenção de definir melhor essas armadilhas potenciais para que futuros pesquisadores poderiam mais facilmente utilizar este modelo HAS reprodutível.
Enquanto propomos um modelo simples e de custo eficaz para estudar os efeitos de vasoespasmo atrasada, não é sem as suas limitações. Devido à capacidade de ratos para rapidamente limpar o sangue a partir do espaço subaracnóide,e as diferenças anatômicas nas artérias cerebrais próprios, as ratazanas são consideradas um modelo pobre para o estudo da hemorragia subaracnóide retardada 6, 8. Existem alguns passos críticos que afetam o resultado do modelo. A dose de ketamina / xilazina cocktail não deve exceder 0,1 ml / kg para assegurar a anestesia adequada. Qualquer quantidade de acúmulo de sangue após injecção na cisterna magna deve ser observado e documentado como já observamos que acúmulo de sangue leva a um menor grau de vasoespasmo 9, 13, 15. Outros estudos têm mostrado que a injecção de segunda hr arterial 24 separados podem induzir um grau significativo de mais vasoespasmo 6, acreditamos que não iriam imitar o curso de tempo de vasoespasmo em humanos onde vasoespasmo raramente ocorre antes de três dias após SAH. A fim de imitar mais de perto este curso vez que fez a segunda injecção de sangue 48 horas após a primeira injeção.
Possíveis modificações do modelo, descrevendoe incluem injecção de volumes maiores de sangue no espaço subaracnóide, alterando a fonte do sangue, alterando o período de tempo para a segunda injecção, e sacrificar mais para fora do que cinco dias após a injecção de sangue segundo. Tais variações nos modelos anteriores podem ser encontrados na Tabela 2 acima. Durante o curso do nosso modelo de desenvolvimento, usamos dois modelos de injeção individuais e duplos, alterou o tempo entre as injeções com o modelo HAS dupla, testou vários volumes de sangue, testou os efeitos de sangue hemolisadas, tentou venosa e arterial e autólogo versus doador de sangue injecções. Cada uma destas modificações levar a complicações que resultaram em um modelo inutilizável para testar o vasoespasmo retardado. O modelo descrito acima produziu consistentemente uma baixa mortalidade artéria basilar SAH modelo animal pequeno de vasoespasmo cerebral retardado (CV) 6, 7, 11, 13, 15.
Baixas taxas de mortalidade permitem uma compreensão mais aprofundada do PTmecanismo de pneu de vasoespasmo cerebral 13. Bederson et al. 1 têm utilizado o modelo de perfuração endovascular, reportando uma taxa de mortalidade de 50% dentro de 24 horas de observação. Veelken et al. 16 com o seu modelo de perfuração endovascular filamento ICA descrita uma taxa de mortalidade de 100% no grupo de perfusão normal dentro de 3 horas do procedimento. O modelo de perfuração endovascular realizado por Lee et al. 7 mostraram um significativo grau de vasoespasmo (BA diâmetro 230 mM ± 70) em comparação com o modelo de hemorragia duplo dentro do mesmo estudo (diâmetro BA 320 ± 36 fiM), e a taxa de mortalidade para o modelo de perfuração foi relatada a ser de 44%. O aumento de cinco vezes nos níveis de glutamato, bem como aumentos da lactato e livre de ácidos graxos são alguns dos efeitos metabólicos prejudiciais observados alguns minutos após a indução da SAH, que contribuem para o aumento da mortalidade no modelo de perfuração 10. Are há evidências suficientes para apoiar que o modelo de perfuração precisa de aperfeiçoamento, a fim de controlar as altas taxas de mortalidade.
As taxas de mortalidade utilizando o modelo de duplo-SAH variar muito, dependendo do volume de injecção de sangue e da taxa de injecção. Nós descobrimos que grandes volumes de sangue e as taxas mais rápidas de injeção, tudo levar a parada respiratória e freqüentemente morte durante ou imediatamente após a injeção de sangue. Durante o desenvolvimento do modelo, as taxas de mortalidade variaram de 1,5% a 47%, com volume de sangue sendo o fator mais importante que afeta a mortalidade. Com o aperfeiçoamento do modelo atual descrevemos aqui, nós não relatam mortalidade. Existem várias ferramentas disponíveis para identificar com sucesso e avaliar o grau de CV; histologia, microscopia eletrônica, angiografia, e RM 5, 6, 11, 12, 15. Em nosso modelo, nenhuma tentativa foi feita para usar outros métodos além da histologia.
Na busca de uma melhor compreensão dasubjacente a fisiopatologia da CV atraso em modelos de ratos, pode-se realizar uma miríade de aplicações futuras como uma extensão do nosso modelo. O objectivo essencial é o desenvolvimento de agentes que podem prevenir e tratar com sucesso CV em seres humanos. A fim de fazê-lo é preciso entender as complexas interações e processos multifatoriais que iniciam e sustenta CV em humanos 17. Com o estabelecimento de um modelo de rato sobrevivência HAS adequado, os investigadores podem se concentrar sobre os mecanismos de curto e longo prazo de vasoespasmo cerebral e evitar conflito de dados típicos de lesão isquêmica secundária em ratos neurônios 2, 4, 8. Acreditamos que o modelo de SAH descrito aqui será uma ferramenta útil de investigação para a compreensão dos processos que iniciar e manter o CV.
Divulgações
Não temos nada a divulgar referentes a este estudo.
Agradecimentos
Gostaríamos de reconhecer os esforços do Dr. Mary-Lou Vallano, do Departamento de Neurociências e Fisiologia, por suas valiosas contribuições na escrever para este manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do equipamento / reagente | Companhia | Número de Catálogo | |
| Ratos machos SD (250-300 g) | Taconic | SD-M | |
| 26 Cateteres G | Webster | 8416683 | |
| 25 agulhas G | Búfalo | 305122 | |
| Seringas de 1 cc | Lojas centrais | 54245 | |
| Cetamina / Xilazina cocktail | Animal Care (SUNY) * | - | |
| Betadine | Lojas centrais | 51458 | |
| Sacarose | Sigma | S9378-1kg | |
| Paraformaldeído | Sigma | P6148-500G | |
| Tampão fosfato | Pescador | BP-399-4 | |
| Mesa cirúrgica | Harvard | PY2 72-2590 | |
| Outubro Composto (crioprotecção) | VWR | 25608-930 | |
| Slides SuperFrost | Pescador | 12-550-15 |
* Sintetizado no Departamento de Laboratório Animal Care, SUNY Upstate Medical University. Adicionar 1 cc [100 mg / ml] de xilazina a 10 ml [100 mg / ml] de cetamina.
Referências
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26, 1086-1091 (1995).
- Cheng, G., Wei, L., Zhi-Dan, S., Shi-Guang, Z., Xiang-Zhen, L. Atorvastatin ameliorates cerebral vasospasm and early brain injury after subarachnoid hemorrhage and inhibits caspase-dependent apoptosis pathway. BMC Neurosci. 10, 7-17 (2009).
- Jackowski, A., Crockard, A., Burnstock, G., Russell, R. R., Kristek, F. The time course of intracranial pathophysiological changes following experimental subarachnoid hemorrhage in the rat. J. Cereb. Blood Flow Metab. 10, 835-849 (1990).
- Kaoutzanis, M., Yokota, M., Sibilia, R., Peterson, J. W. Neurologic evaluation in a canine model of single and double subarachnoid hemorrhage. J. Neurosci. Methods. 50, 301-307 (1993).
- Karaoglan, A., Akdemir, O., Barut, S., Kokturk, S., Uzun, H., Tasyurekli, M., Colak, A. The effects of resveratrol on vasospasm after experimental subarachnoid hemorrhage in rats. Surg. Neurol. 70, 337-343 (2008).
- Lee, J. Y., Huang, D. L., Keep, R., Sagher, O. Characterization of an improved double hemorrhage rat model for the study of delayed cerebral vasospasm. J. Neurosci. Methods. 168, 358-366 (2008).
- Lee, J. Y., Sagher, O., Keep, R., Hua, Y., Xi, G. Comparison of experimental rat models of early brain injury after subarachnoid hemorrhage. Neurosurgery. 65 (2), 331-343 (2009).
- Megyesi, J. F., Vollrath, B., Cook, D. A., Findlay, J. M. In vivo animal models of cerebral vasospasm: a review. Neurosurgery. 46, 448-460 (2000).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52, 165-176 (2003).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54, 426-436 (2004).
- Ryba, M. S., Gordon-Krajcer, W., Walski, M., Chalimoniuk, M., Chrapusta, S. J. Hydroxylamine attenuates the effects of simulated subarachnoid hemorrhage: implication for the role of oxidative stress in cerebral vasospasm. Neurol. Res. 31, 195-199 (1999).
- Satoh, M., Parent, A. D., Zhang, J. H. Inhibitory effect with antisense mitogen-activated protein kinase oligodeoxynucleotide against cerebral vasospasm in rats. Stroke. 33, 775-781 (2002).
- Suzuki, H., Kanamaru, K., Tsunoda, H., Inada, H., Kuroki, M., Sun, H., Waga, S., Tanaka, T. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. J. Clin. Invest. 104, 59-66 (1999).
- Swift, D. M., Solomon, R. A. Subarachnoid hemorrhage fails to produce vasculopathy or chronic blood flow changes in rats. Stroke. 19, 878-882 (1988).
- Vatter, H., Weidauer, S., Konczalla, J., Dettmann, E., Zimmermann, M., Raabe, A., Preibisch, C., Zanella, F., Seifert, V. Time course in the development of cerebral vasospasm after experimental subarachnoid hemorrhage: clinical and neuroradiological assessment of the rat double hemorrhage model. Neurosurgery. 58, 1190-1197 (2006).
- Veelken, J. A., Laing, R. J., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26, 1279-1283 (1995).
- Zubkov, A. Y., Nanda, A., Zhang, J. H. Signal transduction pathways in cerebral vasospasm. Pathophysiology. 9, 47-61 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados