Method Article
Una baja mortalidad modelo de rata para evaluar vasoespasmo cerebral retardado tras la hemorragia subaracnoidea experimental
En este artículo
Resumen
Hemorragia subaracnoidea aneurismática (HSA) es la hemorragia que se produce en el espacio subaracnoideo cuando un aneurisma se rompe. Mientras que la morbilidad y la mortalidad por este evento ha estado en un declive debido a la mejora de los métodos de tratamiento, el riesgo de vasoespasmo después de la hemorragia subaracnoidea continúa siendo el mismo que era hace unos años. La importancia de establecer un modelo animal completo y reproducible para identificar sucesos iniciadores de vasoespasmo cerebral ha sido el foco de investigación desde el primer uso de ratas en un modelo experimental de vasoespasmo en 1979 por Barry Et al. El trabajo inicial en ratas demostraron que una única inyección de sangre autóloga en la cisterna magna llevó a aguda (en minutos), pero no con retraso vasoespasmo cerebral 3, 6, 14. Aquí caracterizar un modelo de rata de mortalidad baja SAH que da lugar a vasoespasmo retardado reproducible.
Resumen
Objetivo: Caracterizar y establecer un modelo reproducible que demuestre vasoespasmo cerebral retardada después de la hemorragia subaracnoidea por aneurisma (HSA) en ratas, con el fin de identificar los sucesos iniciadores, los cambios fisiopatológicos y objetivos potenciales para el tratamiento.
Métodos: Veintiocho ratas macho Sprague-Dawley (250 - 300 g) se asignaron arbitrariamente a uno de dos grupos - SAH o control de solución salina. Hemorragia subaracnoidea rata en el grupo HSA (n = 15) fue inducida por doble inyección de sangre autóloga, 48 hr aparte, en la cisterna magna. Del mismo modo, la solución salina normal (n = 13) se inyectaron en la cisterna magna del grupo de control de solución salina. Las ratas se sacrificaron en el día cinco después de la inyección de sangre segundos y los cerebros se conservan para el análisis histológico. El grado de vasoespasmo se midió utilizando secciones de la arteria basilar, midiendo el área en sección transversal interna luminal utilizando NIH Image J-software. La significación fueprueba utilizando Tukey / Kramer 's análisis estadístico.
Resultados: Tras el análisis de las secciones histológicas, área luminal de la arteria basilar de la sección transversal fueron más pequeños en la HSA que en el grupo de solución salina, de acuerdo con el vasoespasmo cerebral en el primer grupo. En el grupo de SAH, área basilar arteria interna (0,056 micras ± 3) fueron significativamente más pequeños de vasoespasmo cinco días después de la inyección de sangre segundos (siete días después de la inyección inicial de sangre), en comparación con el grupo control de solución salina con área interna (0,069 ± 3, p = 0,004). No hubo mortalidad de vasoespasmo cerebral.
Conclusión: El modelo de rata doble SAH induce una leve, vasoespasmo de supervivencia, arteria basilar que puede ser usado para estudiar los mecanismos fisiopatológicos de vasoespasmo cerebral en un modelo animal pequeño. Una baja tasa de mortalidad y aceptable es un criterio importante que se cumpla para un modelo animal ideal SAH para que los mecanismos de vasoespasmo puede ser ElucidATED 7, 8. Otras modificaciones del modelo se puede hacer para ajustar por aumento de la severidad del vasoespasmo y exámenes neurológicos.
Protocolo
1. Cirugía para Rat Asunto SAH inyectados con 0,15 ml de sangre autóloga Arterial
- La rata se anestesia con 0,1 mg / kg de cóctel roedor ketamina / xilazina y se dejó reposar durante 5 min.
- Anestesia adecuada es confirmado por la reducción de reflejo en la extremidad posterior.
- Usando una máquina de afeitar electrónico un cuello a la nariz área de pelo alrededor de la región sub-occipital se afeita.
- El animal se coloca en posición supina sobre la mesa de cirugía y la cola se limpia con betadine para garantizar una incisión estéril.
- Una regla de 1 cm de la línea media incisión se toma en la cara ventral de la cola
- La disección se extiende hasta la arteria de la cola es identificado y aislado.
- El uso de un estéril de calibre 26-catéter, la arteria de la cola se canuló y 0,15 ml de sangre arterial se debe extraer con una jeringa.
- Una gasa estéril se envuelve alrededor de la incisión para asegurar la hemostasis antes de la aplicación de la Vetbond para sellar la incisión.
- Tél rata se volvió boca abajo en la mesa y la zona afeitada sobre la región suboccipital se limpió con betadine.
- El uso de un acceso vertical incisión de línea media se gana a la cisterna magna.
- Una vez identificada una aguja de calibre 25 se inserta en la cisterna magna y 0,15 ml de líquido cerebroespinal es sacada en una jeringa para evitar el aumento de la presión intracraneal con inyección de volumen de sangre autóloga.
- Ahora, el 0,15 ml de sangre extraída de la arteria de la cola se inyecta lentamente en la cisterna magna.
- La aguja se deja en su lugar durante 30 segundos para asegurar la coagulación en el espacio subaracnoideo y luego cuidadosamente retirado.
- La hemostasia está garantizada, y la incisión se cierra utilizando un dispositivo de grapado.
- El animal se coloca ahora en decúbito prono sobre una superficie de calentamiento con una cabeza de 20 ° hacia abajo posición durante 20 minutos para permitir que la sangre coagularse en las cisternas alrededor de la arteria basilar.
- Pasos 1,1 a 1,15 se repiten durante la cirugía segundo 48 horas aparte.
2. Cirugía para Rat Asunto SAH inyectados con solución salina 0,15 ml
- La rata se anestesia con 0,1 mg / kg de cóctel roedor ketamina / xilazina y se dejó reposar durante 5 min.
- Anestesia adecuada es confirmado por la reducción de reflejo en la extremidad posterior.
- Usando una máquina de afeitar electrónico un cuello a la nariz área de pelo alrededor de la región sub-occipital se afeita.
- El animal se coloca en posición supina sobre la mesa de cirugía y la cola se limpia con betadine para garantizar una incisión estéril.
- Una regla de 1 cm de la línea media incisión se toma en la cara ventral de la cola
- La disección se extiende hasta la arteria de la cola es identificado y aislado.
- El uso de un estéril de calibre 26-catéter, la arteria de la cola se canuló y 0,15 ml de sangre arterial se debe extraer con una jeringa.
- Una gasa estéril se envuelve alrededor de la incisión para asegurar la hemostasis antes de la aplicación de la Vetbond para sellar la incisión.
- La rat se gira boca abajo sobre la mesa y la zona de afeitado sobre la región sub-occipital está pintado con betadine.
- El uso de un acceso vertical incisión de línea media se gana a la cisterna magna.
- Una vez identificada una aguja de calibre 25 se inserta en la cisterna magna y 0,15 ml de líquido cerebroespinal es sacada en una jeringa y la muestra se almacena.
- Ahora, el 0,15 ml de solución salina normal (37 ° C) se inyecta lentamente en la cisterna magna.
- La aguja se deja en su lugar durante 30 segundos y se retira cuidadosamente.
- La hemostasia está garantizada, y la incisión se cierra utilizando un dispositivo de grapado.
- El animal se coloca ahora en decúbito prono sobre una superficie de calentamiento con una cabeza de 20 ° hacia abajo posición durante 20 min.
- Pasos 2,1 a 2,15 se repiten durante la cirugía segundo 48 horas aparte.
3. Rata Sacrificio
- El día 5 después de la segunda cirugía, las ratas se sacrificaron por perfusión cardiaca.
- La rata se les administró una dosis letal (00,2 ml / kg) de Fatal Plus (Vortech PHARMACEUTICALS LTD., Dearborn, MI)
- Con una incisión de línea media vertical, la cavidad abdominal se acercó y el peritoneo se abre.
- Una toracotomía anterior se lleva a cabo y el corazón está expuesto.
- El uso de un catéter de calibre 26-conectado con una solución tampón de fosfato (PBS pH 7,4 y en ° 37) el animal se drena de la sangre y después se perfundieron con 4% de paraformaldehído.
- Después de asegurarse de la adecuada perfusión, la perfusión se detuvo y la rata se lleva a la mesa de decapitación.
- Después de la decapitación, una gubia ósea se utiliza para eliminar el cráneo para la extracción del cerebro.
- El cerebro y el tronco cerebral se extraen cuidadosamente de la bóveda craneal y se coloca en una solución de paraformaldehído al 4% y se almacenaron a 4 ° C durante 48 hr.
4. Crear secciones para evaluar Vasoespasmo
- El cerebro de la rata que ha sido sumergido en 30% de sacarosa durante 4 días se lleva a the criostato para seccionar.
- Una vez crioprotegidas, 12 secciones mu M se crean utilizando el criostato, con la anterior arteria cerebelosa (AICA) como punto de partida para asegurar la coherencia entre los sujetos.
- 20 secciones se crean para cada animal, que termina en la arteria cerebelosa superior (SCA).
- Las secciones se colocan en un portaobjetos de vidrio y se evaluó utilizando la metodología vasoespasmo histológico
Resultados
Dentro de los protocolos descritos anteriormente, hay varios pasos que creemos que requieren una mejor caracterización del modelo de lo que se ha descrito previamente en la literatura. Aquí nos centramos en los pasos que son esenciales para lograr una baja mortalidad reproducible modelo vasoespasmo cerebral pequeño animal y evitar posibles dificultades asociadas con este modelo, si no se hace correctamente.
1. Extracción de sangre autóloga de la arteria de la cola:
La colocación cuidadosa de la angiocatéter en la arteria de la cola es el primer paso esencial en el modelo. Figura-1 muestra la colocación de un catéter de calibre 26 en la arteria de la cola de la rata. Esto representa una buena colocación con un mínimo trauma y pérdida de sangre. La colocación correcta de la angiocatéter se puede confirmar por el retorno de sangre buena.
2. La inyección de sangre autóloga en la cisterna magna:
Disección profunda de tél región suboccipital se lleva a cabo hasta que la membrana atlanto-occipital se visualiza como una membrana brillante blanco (Figura-2). La cisterna magna se accede a través de una punción a través de la membrana con una aguja de calibre 25. Después de la retirada de la aguja, la acumulación de sangre que señalar, para asegurar un volumen suficiente de sangre autóloga se mantiene dentro del espacio subaracnoideo de la cisterna magna. El exceso de la acumulación de sangre en el aspecto exterior de la membrana atlanto-occipital es indeseable debido a nuestro modelo utiliza volúmenes relativamente baja (0,15 ml) de sangre autóloga en comparación con los modelos existentes y de mezcla puede resultar ineficaces en los volúmenes de sangre en el espacio subaracnoideo. Los mayores volúmenes de sangre con frecuencia dio lugar a una insuficiencia respiratoria presumiblemente de elevación de la presión intracraneal y los productos sanguíneos poco después de la inyección. La recogida de sangre alrededor de las arterias en el espacio subaracnoideo es uno de varios métodos posibles para iniciar vasoespasmo experimental 8 . En el momento de la cirugía de segundos, la membrana atlanto-occipital en ocasiones puede ser difícil de visualizar, aunque el sitio de la punción de la primera cirugía es a menudo visible.
3. Espécimen
Figura-3 muestra una muestra de tallo cerebral extraído de una rata sin (Figura 3A-) y con hemorragia subaracnoidea (Figura 3B-). Tenga en cuenta la acumulación de sangre en el espacio subaracnoideo alrededor de la arteria basilar en la Figura 3B-. Esto representa un volumen suficiente de sangre para inducir vasoespasmo de la arteria basilar. Las flechas en la figura-3A y la Figura 3B-definir la extensión de la arteria basilar (BA). Secciones (12 micras) se toman de la longitud de la BA se extiende desde la AICA a la SCA.
4. Secciones histológicas
Veinte secciones se analizaron para cada espécimen de la arteria basilar en el control de la HSA y la solución salinagrupos (Figura-4). El interior luminal área de sección transversal de la arteria basilar eran más pequeñas y no había corrugación significativa de la lámina elástica interna sugestiva de vasoespasmo, en el grupo HSA (Figura 4A-). La arteria basilar del grupo control de solución salina era más grande en área y no tienen un corrugado lámina elástica interna (Figura 4B-). Una cuantificación del grado de reducción en el área entre los dos grupos se pueden encontrar en la Figura 5. Estos estudios confirman que este modelo SAH no produce vasoespasmo cerebral que se puede evaluar utilizando métodos histológicos. Luminal área de la sección transversal se utilizó para determinar el vasoespasmo porque el procesamiento de tejido en ocasiones resulta en amorfos secciones transversales de los vasos, lo que hace difícil determinar un diámetro apropiado para medir y usar para el análisis de datos. Todas las mediciones se realizaron utilizando el NIH Image-J software. En el grupo de HSA, la arteria basilar estána (interno = 0,056 micras ± 3) fueron significativamente menores que el grupo control salina (= 0,069 m ± 3 en la residencia, p = 0,004), debido a vasoespasmo. La significancia fue probada usando Tukey / Kramer 's análisis estadístico. Tabla 1 ilustra estos valores calculados con las desviaciones estándar y los errores estándar para ambos grupos.
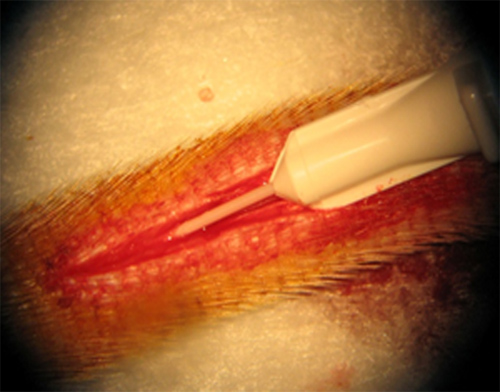
Figura 1. La inserción de un catéter de calibre 26 se inserta en la arteria de la cola.
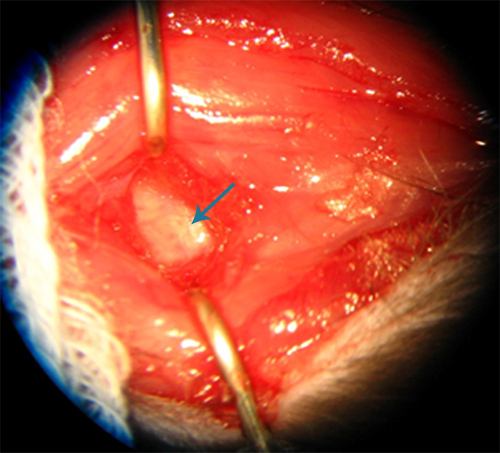
Figura 2. Apariencia de membrana atlanto-occipital (flecha) en la rata.
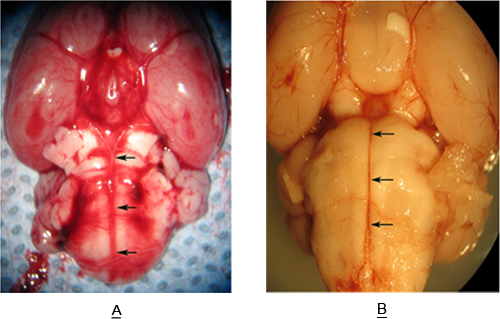
Figura 3. Superficie ventral de la rata sujetadorinstem una arteria basilar (flechas), con (A), y sin (B), SAH.

Figura 4. Histológico de secciones arteria basilar en SAH (A) y solución salina de control (B) grupos. Tenga en cuenta que el área de sección transversal luminal de la arteria basilar es más pequeño y la lámina elástica interna es corrugada (flecha) en el grupo HSA, a la vez coherente con vasoespasmo.

Figura 5. Comparación de la arteria basilar luminales áreas de sección transversal entre los grupos de control de HSA y la solución salina.
| Contar | La media (Luminal área de la sección transversal) | Std. Dev. | Std. Err. | |
| SAH | 15 | 0,056 mm | 0,01 | 0,003 |
| Salina | 13 | 0,069 mm | 0,012 | 0,003 |
Tabla 1. Calculado medias y desviaciones estándar de la HSA y los grupos de control salios.
| Autores | 2 º SAH | Fuente | Volumen inyectado (1 º / º 2) | Sacrifice (post 2 ª SAH) | Métodos de Análisis | Mortalidad |
| Ryba et al. (1999) | 48 | Arterial | 0.1/0.1 ml | Día 5 | EM | 25% |
| Suzuki et al. (1999) | 48 | Arterial | 0.3/0.3 ml | Día 5 | Angiografía | Desconocido |
| Sato et al. (2002) | 48 | Arterial | 0.35/0.35 ml | Día 5 | Histología | 20% |
| Aladag et al. (2003) | 48 | Venoso | 0.3/0.3 ml | Día 4 | Histología | 18% |
| Vatter et al. (2006) | 24 | Arterial | 0.2/0.2 ml | Día 3 | La angiografía, resonancia magnética | 47% |
| Lee et al. (2008) | 24 | Arterial | 0.3/0.2ml (n = 15) 0.2/0.1 ml (n = 54) | Días 1/3/4/7/9 * | Histología | 40% (n = 15) 1,5% (n = 54) |
| * Las ratas se sacrificaron diferencialmente día 1 (n = 7), Día 3 (n = 7), Día 5 (n = 7), Día 7 (n = 7), Día 9 (n = 7) * Tabla modificada de Lee et al. (2008) | ||||||
Tabla 2. Resumen de los modelos publicados dobles subaracnoidea rata hemorragia.
Discusión
Primates, que tiene una composición genética similar y más características anatómicas de la humana, imitar más de cerca los acontecimientos del vasoespasmo cerebral retardado y es más fácil someterse no invasiva de imágenes (MRI y angiografía) para controlar los cambios arteriales, que los roedores 8. Sin embargo, los modelos de primates son un costo prohibitivo y se asocia con una atención más compleja y los problemas éticos, que los modelos animales pequeños. Pequeños animales modelos de HSA que se han desarrollado anteriormente se han centrado en tres métodos de inducción SAH: 1) perforación arterial endovascular de una arteria intracraneal permite que la sangre escape hacia el espacio subaracnoideo y recoger alrededor de la arteria lesionada, 2) la exposición quirúrgica de una arteria y inyección local coágulo autólogo; 3) La inyección directa de sangre (autólogo o donante) en el espacio subaracnoideo 8. Cada modelo tiene sus propias ventajas y desventajas. Por ejemplo, el modelo de perforación endovascular se asemeja más a los acontecimientos de un Aneurysruptura m, pero se asocia con una tasa de mortalidad muy alta y el vasoespasmo temprano, mientras que el abordaje quirúrgico es artificial y no imitar a los acontecimientos de la presentación típica humana de HSA por aneurisma. El modelo de inyección directa que se describe aquí tiene una mortalidad más baja que el modelo de perforación endovascular y reproduce mejor la condición humana HSA de un modelo quirúrgico abierto. Aunque los modelos similares se han descrito anteriormente, tuvimos una gran curva de aprendizaje con el desarrollo del modelo SAH porque las complicaciones potenciales de los matices del modelo, no fueron bien descritas anteriormente en cualquier lugar. Era nuestra intención de definir mejor estas trampas posibles para que los futuros investigadores sería más fácil utilizar este modelo SAH reproducible.
Si bien se propone un modelo simple y rentable para estudiar los efectos de vasoespasmo retardado, no está exento de limitaciones. Debido a la capacidad de las ratas para desactivar rápidamente la sangre del espacio subaracnoideo,y las diferencias anatómicas en las arterias cerebrales mismos, las ratas se considera un mal modelo para el estudio de la hemorragia subaracnoidea retardada 6, 8. Hay algunos pasos críticos que podrían afectar el resultado del modelo. La dosis de ketamina / xilazina cóctel no debe exceder de 0,1 ml / kg para asegurar una anestesia adecuada. Cualquier cantidad de la acumulación de sangre después de la inyección en la cisterna magna debe ser observado y documentado como hemos observado que la concentración de la sangre conduce a un menor grado de vasoespasmo 9, 13, 15. Otros estudios han demostrado que las inyecciones de sangre 24 segundos hr aparte puede inducir un grado más significativo de vasoespasmo 6, creemos que no debería imitar el curso del tiempo de vasoespasmo en los seres humanos, donde el vasoespasmo rara vez ocurre antes de tres días después de la HSA. Con el fin de imitar más estrechamente este curso vez que hicimos la segunda inyección de sangre 48 horas después de la primera inyección.
Modificaciones potenciales del modelo que describiendoe incluyen la inyección de grandes volúmenes de sangre en el espacio subaracnoideo, el cambio de la fuente de sangre, alterando el curso de tiempo para la segunda inyección, y sacrificar más alejado que cinco días después de la inyección de sangre segundos. Tales variaciones en los modelos anteriores pueden encontrarse anteriormente en la Tabla 2. En el curso de nuestro modelo de desarrollo, hemos utilizado dos modelos de inyección individuales y dobles, alteró el tiempo entre las inyecciones con el doble modelo SAH, probado varios volúmenes de sangre, probaron los efectos de sangre hemolizada, trató venoso arterial y frente a frente a donantes de sangre autóloga inyecciones. Cada una de estas modificaciones llevar a complicaciones que resultaron en un modelo inservible para probar vasoespasmo retardado. El modelo descrito anteriormente produjo consistentemente una baja mortalidad arteria basilar SAH modelo animal pequeño del vasoespasmo cerebral retardada (CV) 6, 7, 11, 13, 15.
Las bajas tasas de mortalidad permiten una comprensión más a fondo de la en-mecanismo neumático de vasoespasmo cerebral 13. Bederson et al. 1 han utilizado el modelo de perforación endovascular, registrando una tasa de mortalidad del 50% en un plazo de 24 horas de observación. Veelken et al. 16 con su modelo de perforación filamento endovascular ICA se describe una tasa de mortalidad del 100% en el grupo de perfusión normal dentro de 3 horas del procedimiento. El modelo de perforación endovascular realizado por Lee et al. 7 mostraron un grado significativo de vasoespasmo (diámetro BA 230 micras ± 70) en comparación con el modelo de hemorragia doble en el mismo estudio (diámetro BA 320 micras ± 36), y la tasa de mortalidad para la modelo de perforación fue del 44%. El aumento de cinco veces en los niveles de glutamato, así como aumentos en las concentraciones de ácidos grasos libres y de lactato son algunos de los efectos metabólicos perjudiciales visto unos minutos después de la inducción de la HSA que contribuyen al aumento de la mortalidad en el modelo de perforación 10. Lare hay suficiente evidencia para apoyar que el modelo de perforación necesita un mayor refinamiento con el fin de controlar las altas tasas de mortalidad.
Las tasas de mortalidad utilizando el modelo de doble-SAH variar ampliamente, dependiendo del volumen de inyección de la sangre y la velocidad de inyección. Se encontró que el mayor volumen de sangre y con tasas de inyección, todos conducen a un paro respiratorio y la muerte con frecuencia durante o inmediatamente después de la inyección de sangre. Durante el desarrollo del modelo, las tasas de mortalidad varió de 1,5% a 47% con el volumen de sangre es el factor más importante que afecta la mortalidad. Con el perfeccionamiento del actual modelo que describimos aquí, no reportan muertes. Hay varias herramientas disponibles para identificar con éxito y evaluar el grado de CV, histología, microscopía electrónica, angiografía, resonancia magnética y 5, 6, 11, 12, 15. En nuestro modelo, no se trató de utilizar cualquier otro método aparte de la histología.
En la búsqueda de una mejor comprensión de lasubyacente fisiopatología de CV retardada en modelos de rata, se puede realizar una gran variedad de aplicaciones futuras como una extensión de nuestro modelo. El objetivo esencial es el desarrollo de agentes que con éxito podría prevenir y tratar la CV en los seres humanos. Para ello hay que entender las complejas interacciones y procesos multifactoriales que inician y sostiene CV en humanos 17. Con el establecimiento de un adecuado modelo de rata de supervivencia SAH, los investigadores pueden centrarse en los mecanismos a corto y largo plazo de vasoespasmo cerebral y evitar el conflicto de datos típicos de daño isquémico secundario en la rata neuronas 2, 4, 8. Creemos que el modelo de SAH descrito aquí será una herramienta útil de investigación para la comprensión de los procesos que inician y sostienen CV.
Divulgaciones
No tenemos nada que revelar relacionada con este estudio.
Agradecimientos
Nos gustaría agradecer los esfuerzos de la Dra. Mary-Lou Vallano, Departamento de Neurociencia y Fisiología, por sus valiosos aportes en la reseña de este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de equipo / reactivo | Empresa | Número de catálogo | |
| Ratas SD macho (250-300 g) | Taconic | SD-M | |
| 26 g catéteres | Webster | 8416683 | |
| 25 G Agujas | Búfalo | 305122 | |
| Jeringas de 1 cc | Almacenes centrales | 54245 | |
| La ketamina / xilazina cóctel | Animal Care (SUNY) * | - | |
| Betadine | Almacenes centrales | 51458 | |
| Sacarosa | Sigma | S9378-1kg | |
| Paraformaldehído | Sigma | P6148-500G | |
| Solución tampón | Pescador | BP-399-4 | |
| Mesa Quirúrgica | Harvard | PY2 72-2590 | |
| Octubre Compuesto (crioprotección) | VWR | 25608-930 | |
| Superfrost Diapositivas | Pescador | 12-550-15 |
* Sintetizado en el Departamento de Cuidado de Animales de Laboratorio, SUNY Upstate Medical University. Añadir 1 cc [100 mg / ml] de Xilazina a 10 ml [100 mg / ml] de ketamina.
Referencias
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26, 1086-1091 (1995).
- Cheng, G., Wei, L., Zhi-Dan, S., Shi-Guang, Z., Xiang-Zhen, L. Atorvastatin ameliorates cerebral vasospasm and early brain injury after subarachnoid hemorrhage and inhibits caspase-dependent apoptosis pathway. BMC Neurosci. 10, 7-17 (2009).
- Jackowski, A., Crockard, A., Burnstock, G., Russell, R. R., Kristek, F. The time course of intracranial pathophysiological changes following experimental subarachnoid hemorrhage in the rat. J. Cereb. Blood Flow Metab. 10, 835-849 (1990).
- Kaoutzanis, M., Yokota, M., Sibilia, R., Peterson, J. W. Neurologic evaluation in a canine model of single and double subarachnoid hemorrhage. J. Neurosci. Methods. 50, 301-307 (1993).
- Karaoglan, A., Akdemir, O., Barut, S., Kokturk, S., Uzun, H., Tasyurekli, M., Colak, A. The effects of resveratrol on vasospasm after experimental subarachnoid hemorrhage in rats. Surg. Neurol. 70, 337-343 (2008).
- Lee, J. Y., Huang, D. L., Keep, R., Sagher, O. Characterization of an improved double hemorrhage rat model for the study of delayed cerebral vasospasm. J. Neurosci. Methods. 168, 358-366 (2008).
- Lee, J. Y., Sagher, O., Keep, R., Hua, Y., Xi, G. Comparison of experimental rat models of early brain injury after subarachnoid hemorrhage. Neurosurgery. 65 (2), 331-343 (2009).
- Megyesi, J. F., Vollrath, B., Cook, D. A., Findlay, J. M. In vivo animal models of cerebral vasospasm: a review. Neurosurgery. 46, 448-460 (2000).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52, 165-176 (2003).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54, 426-436 (2004).
- Ryba, M. S., Gordon-Krajcer, W., Walski, M., Chalimoniuk, M., Chrapusta, S. J. Hydroxylamine attenuates the effects of simulated subarachnoid hemorrhage: implication for the role of oxidative stress in cerebral vasospasm. Neurol. Res. 31, 195-199 (1999).
- Satoh, M., Parent, A. D., Zhang, J. H. Inhibitory effect with antisense mitogen-activated protein kinase oligodeoxynucleotide against cerebral vasospasm in rats. Stroke. 33, 775-781 (2002).
- Suzuki, H., Kanamaru, K., Tsunoda, H., Inada, H., Kuroki, M., Sun, H., Waga, S., Tanaka, T. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. J. Clin. Invest. 104, 59-66 (1999).
- Swift, D. M., Solomon, R. A. Subarachnoid hemorrhage fails to produce vasculopathy or chronic blood flow changes in rats. Stroke. 19, 878-882 (1988).
- Vatter, H., Weidauer, S., Konczalla, J., Dettmann, E., Zimmermann, M., Raabe, A., Preibisch, C., Zanella, F., Seifert, V. Time course in the development of cerebral vasospasm after experimental subarachnoid hemorrhage: clinical and neuroradiological assessment of the rat double hemorrhage model. Neurosurgery. 58, 1190-1197 (2006).
- Veelken, J. A., Laing, R. J., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26, 1279-1283 (1995).
- Zubkov, A. Y., Nanda, A., Zhang, J. H. Signal transduction pathways in cerebral vasospasm. Pathophysiology. 9, 47-61 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados