Method Article
Un basso Rat modello di mortalità per valutare ritardata vasospasmo cerebrale dopo emorragia subaracnoidea sperimentale
In questo articolo
Riepilogo
Emorragia subaracnoidea aneurismatica (SAH) è il sanguinamento che si verifica nello spazio subaracnoideo quando una rottura dell'aneurisma. Mentre la morbilità e la mortalità di questo evento è stato su un declino a causa di migliori approcci terapeutici, il rischio di vasospasmo dopo emorragia subaracnoidea continua ad essere la stessa che era diversi anni fa. L'importanza della creazione di un modello animale completo e riproducibile per identificare gli eventi scatenanti di vasospasmo cerebrale è stato al centro di ricerche sin dal primo utilizzo di ratti in un modello sperimentale di vasospasmo nel 1979 da Barry Et al. I primi lavori nei ratti ha dimostrato che una singola iniezione di sangue autologo nella cisterna magna portato a acuta (entro pochi minuti), ma non in ritardo vasospasmo cerebrale 3, 6, 14. Qui caratterizzare una bassa mortalità modello di ratto SAH che si traduce in riproducibili vasospasmo ritardato.
Abstract
Obiettivo: caratterizzare e stabilire un modello riproducibile che dimostra in ritardo vasospasmo cerebrale dopo emorragia subaracnoidea aneurismatica (SAH) nei ratti, al fine di individuare gli eventi scatenanti, i cambiamenti fisiopatologici e target potenziali per il trattamento.
Metodi: Ventotto maschi Sprague-Dawley (250-300 g) sono stati arbitrariamente assegnati ad uno dei due gruppi - SAH o controllo salino. Emorragia subaracnoidea ratto nel gruppo SAH (n = 15) è stata indotta mediante doppia iniezione di sangue autologo, 48 hr a parte, nella cisterna magna. Analogamente, soluzione salina normale (n = 13) è stato iniettato nella cisterna magna del gruppo di controllo salina. Ratti sono stati sacrificati al giorno cinque dopo l'iniezione e sangue secondo i cervelli sono stati conservati per l'analisi istologica. Il grado di vasospasmo è stata misurata utilizzando sezioni dell'arteria basilare, misurando l'area in sezione trasversale interna luminale utilizzando NIH Image-J software. Il significato eratestato con Tukey / Kramer 's l'analisi statistica.
Risultati: Dopo l'analisi delle sezioni istologiche, basilare superficie luminale dell'arteria sezione trasversale erano più piccole in SAH rispetto al gruppo salina, coerente con vasospasmo cerebrale nel primo gruppo. Nel gruppo SAH, zona interna dell'arteria basilare (0,056 micron ± 3) erano significativamente più piccole da vasospasmo cinque giorni dopo l'iniezione di sangue secondo (sette giorni dopo l'iniezione di sangue iniziale), rispetto al gruppo di controllo salina con area interna (0,069 ± 3, p = 0,004). Non ci sono stati casi di mortalità da vasospasmo cerebrale.
Conclusione: Il doppio ratto induce una lieve emorragia subaracnoidea, capaci di mantenersi, vasospasmo dell'arteria basilare che può essere utilizzato per studiare i meccanismi fisiopatologici di vasospasmo cerebrale in un modello animale di piccole dimensioni. Un tasso di mortalità basso e accettabile è un criterio significativo per essere soddisfatti per un ideale modello animale SAH in modo che i meccanismi di vasospasmo può essere elucidated 7, 8. Ulteriori modifiche del modello può essere fatto per regolare la maggiore gravità del vasospasmo e gli esami neurologici.
Protocollo
1. Chirurgia per Rat Oggetto SAH iniettato con 0,15 ml di sangue autologo arteriosa
- Il ratto è anestetizzato con 0,1 mg / kg di ketamina / TMA cocktail roditore e lasciata riposare per 5 min.
- Anestesia adeguata è confermato dalla riduzione di riflesso degli arti posteriori.
- L'utilizzo di un rasoio elettronico un collo al naso zona di capelli intorno al sub-occipitale è rasata.
- L'animale viene posto supino sul tavolo operatorio e la coda è deterso con Betadine per garantire una incisione sterile.
- Un diritto da 1 centimetro linea mediana incisione è assunto l'aspetto ventrale della coda
- La dissezione è prorogata fino l'arteria coda è identificato e isolato.
- Utilizzando una sterile 26-gauge catetere, l'arteria coda è cannulata e 0,15 ml di sangue arterioso viene aspirata in una siringa.
- Una garza sterile viene avvolto intorno alla incisione per assicurare emostasi prima dell'applicazione del vetbond per sigillare l'incisione.
- Tratto si è attivata prono sul tavolo e la zona rasata sul sub-occipitale è deterso con betadine.
- Utilizzo di un accesso verticale incisione mediana si ottiene l'cisterna magna.
- Una volta identificato un ago calibro 25 è inserito nella cisterna magna e 0,15 ml di CSF viene prelevata con una siringa per evitare maggiori pressioni intracranici con iniezione di volume di sangue autologo.
- Ora, il 0,15 ml di sangue estratto dall'arteria coda viene iniettata lentamente in cisterna magna.
- L'ago rimane in posizione per 30 sec per garantire la coagulazione nello spazio subaracnoideo e poi estratto con cautela.
- L'emostasi è assicurata e l'incisione viene chiusa con un dispositivo di pinzatura.
- L'animale è ora posizionato prono su una superficie di riscaldamento con una testa 20 ° verso il basso la posizione per 20 min per permettere al sangue di coagularsi nelle cisterne intorno dell'arteria basilare.
- Passi 1,1-1,15 si ripetono nel corso del secondo intervento 48 ore di distanza.
2. Chirurgia per Rat Oggetto SAH iniettato con 0,15 ml di soluzione salina
- Il ratto è anestetizzato con 0,1 mg / kg di ketamina / TMA cocktail roditore e lasciata riposare per 5 min.
- Anestesia adeguata è confermato dalla riduzione di riflesso degli arti posteriori.
- L'utilizzo di un rasoio elettronico un collo al naso zona di capelli intorno al sub-occipitale è rasata.
- L'animale viene posto supino sul tavolo operatorio e la coda è deterso con Betadine per garantire una incisione sterile.
- Un diritto da 1 centimetro linea mediana incisione è assunto l'aspetto ventrale della coda
- La dissezione è prorogata fino l'arteria coda è identificato e isolato.
- Utilizzando una sterile 26-gauge catetere, l'arteria coda è cannulata e 0,15 ml di sangue arterioso viene aspirata in una siringa.
- Una garza sterile viene avvolto intorno alla incisione per assicurare emostasi prima dell'applicazione del vetbond per sigillare l'incisione.
- Il rat è attivata prona sul tavolo e la zona rasata sul sub-occipitale è verniciato con betadine.
- Utilizzo di un accesso verticale incisione mediana si ottiene l'cisterna magna.
- Una volta identificato un ago calibro 25 è inserito nella cisterna magna e 0,15 ml di CSF viene prelevata con una siringa ed il campione viene memorizzato.
- Ora, il 0,15 ml di soluzione salina normale (37 ° C) viene iniettata lentamente in cisterna magna.
- L'ago viene lasciato in sede per 30 sec e estratto con cautela.
- L'emostasi è assicurata e l'incisione viene chiusa con un dispositivo di pinzatura.
- L'animale è ora posizionato prono su una superficie di riscaldamento con una testa 20 ° verso il basso la posizione per 20 min.
- Passi 2,1-2,15 si ripetono nel corso del secondo intervento 48 ore di distanza.
3. Rat Sacrificio
- Il giorno 5 dopo il secondo intervento chirurgico, i ratti vengono sacrificati mediante perfusione cardiaca.
- Il ratto è dato una dose letale (00,2 ml / kg) di Fatal Plus (Vortech PHARMACEUTICALS LTD., Dearborn, MI)
- Con una incisione mediana verticale, la cavità addominale viene raggiunta e il peritoneo è aperto.
- Una toracotomia anteriore viene eseguita e il cuore è esposto.
- Utilizzando un 26-gauge catetere collegato ad una soluzione di tampone fosfato (PBS pH 7,4 ea 37 °), l'animale viene svuotato di sangue e viene poi perfusi con paraformaldeide al 4%.
- Dopo garantendo un'adeguata perfusione, la perfusione viene arrestata e il ratto viene portata al tavolo decapitazione.
- Dopo decapitazione, un rongeur osso viene utilizzato per rimuovere il cranio per la rimozione del cervello.
- Il cervello e del tronco cerebrale sono accuratamente estratta dalla volta cranica e posto in una soluzione di paraformaldeide 4% e conservata a 4 ° C per 48 ore.
4. Creazione di sezioni per valutare vasospasmo
- Il cervello di ratto che è stato immerso in 30% saccarosio per 4 giorni è portato a thcriostato e per il sezionamento.
- Una volta crioprotetti, 12 sezioni di m sono creati utilizzando il criostato, con l'anteriore arteria cerebellare inferiore (AICA) come punto di partenza per garantire la coerenza tra soggetti.
- 20 sezioni vengono creati per ogni animale, che termina a livello dell'arteria cerebellare superiore (SCA).
- Le sezioni sono posti su un vetrino e valutati per vasospasmo con metodologia istologica
Risultati
Entro i protocolli descritti sopra, ci sono diversi passaggi che riteniamo richiedono una migliore caratterizzazione del modello di quello che è stato descritto precedentemente in letteratura. Qui ci concentriamo sui passi che sono essenziali al fine di ottenere una bassa mortalità riproducibile cerebrale modello animale piccolo vasospasmo ed evitare potenziali problemi associati a questo modello se non effettuate correttamente.
1. Il sangue autologo Draw dal Arteria Tail:
Posizionamento accurato del angiocatheter nell'arteria coda è il primo passo essenziale nel modello. Figura 1 mostra il posizionamento di un catetere 26 gauge nell'arteria coda del topo. Si tratta di un buon piazzamento con il minimo trauma e la perdita di sangue. Il posizionamento corretto del angiocatheter può essere confermata dal ritorno buon sangue.
2. L'iniezione di sangue autologo nella Magna Cisterna:
Dissezione profonda di tegli regione suboccipitale viene eseguita fino a quando la membrana atlanto-occipitale è visualizzato come una membrana lucida bianca (Figura 2). Cisterna magna si accede tramite una puntura attraverso la membrana con un ago calibro 25. Dopo aver estratto l'ago, ristagno del sangue deve rilevare, per garantire un sufficiente volume di sangue autologo rimane all'interno dello spazio subaracnoideo della cisterna magna. Eccessivo ristagno del sangue sulla faccia esterna della membrana atlanto-occipitale è indesiderabile perché il nostro modello utilizza volumi relativamente bassi (0,15 ml) di sangue autologo rispetto ai modelli esistenti e pooling potrebbero provocare inefficaci volumi di sangue nello spazio subaracnoideo. I maggiori volumi di sangue spesso come conseguenza insufficienza respiratoria presumibilmente da un aumento della pressione intracranica e prodotti del sangue subito dopo l'iniezione. La raccolta di sangue intorno arterie nello spazio subaracnoideo è uno dei vari metodi possibili per avviare vasospasmo sperimentale 8 . Al momento del secondo intervento, la membrana atlanto-occipitale può occasionalmente essere difficili da visualizzare, anche se il sito di puntura dal primo intervento è spesso visibile.
3. Campione
Figura 3 mostra un esemplare tronco recuperato da un ratto senza (Figura 3A-) e con (Figura 3B) emorragia subaracnoidea. Notare la raccolta di sangue nello spazio subaracnoideo intorno dell'arteria basilare nella figura 3B. Questo rappresenta un volume sufficiente di sangue per indurre vasospasmo dell'arteria basilare. Le frecce in figura 3A-3B-e Figure definire l'estensione dell'arteria basilare (BA). Sezioni (12 um) sono prese dalla lunghezza della BA estende dal AICA alla SCA.
4. Sezioni istologiche
Venti sezioni sono stati analizzati per ciascun campione arteria basilare nel controllo SAH e salinagruppi (Figura 4). L'interno luminale area della sezione trasversale dell'arteria basilare erano più piccole e c'era corrugazione significativa della lamina elastica interna indicativa di vasospasmo, nel gruppo SAH (Figura 4A). Dell'arteria basilare del gruppo di controllo salina era più grande in zona e non hanno un ondulato lamina elastica interna (Figura 4B). Una quantificazione del grado di riduzione di area tra i due gruppi possono essere trovati in figura 5. Questi studi confermano che questo modello SAH produce vasospasmo cerebrale che possono essere valutati con metodi istologici. Luminale sezione trasversale è stata usata per determinare vasospasmo perché processazione occasionalmente risultati in amorfi sezioni trasversali delle navi, rendendo difficile determinare un diametro appropriato per misurare e utilizzare per l'analisi dei dati. Tutte le misurazioni sono state eseguite utilizzando il NIH Image-J software. Nel gruppo SAH, dell'arteria basilare sonobis (interni = 0,056 micron ± 3) erano significativamente più piccolo del gruppo di controllo salina (= 0,069 micron ± 3 interno; p = 0.004) a causa di vasospasmo. La significatività è stata testata usando Tukey / Kramer 's l'analisi statistica. Tabella 1 illustra i valori calcolati con deviazioni standard e gli errori standard per entrambi i gruppi.
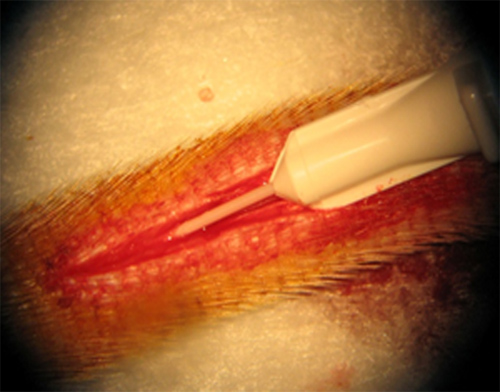
Figura 1. Inserimento di un catetere 26 gauge viene inserito nell'arteria coda.
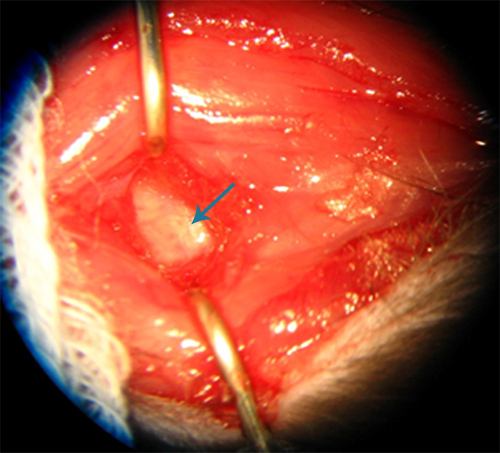
Figura 2. Aspetto di membrana atlanto-occipitale (freccia) nel ratto.
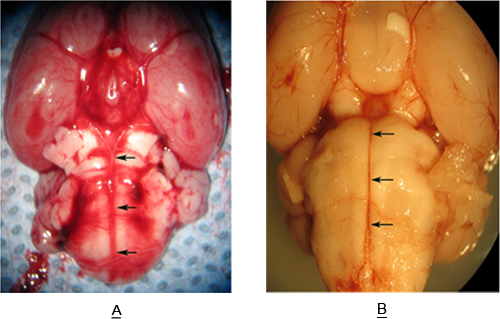
Figura 3. Superficie ventrale del reggiseno rattoinstem un'arteria basilare (frecce) con (A) e senza (B), SAH.

Figura 4. Sezioni istologiche mostrano arteria basilare in SAH (A) e soluzione salina di controllo (B) gruppi. Si noti che l'area della sezione trasversale del lume dell'arteria basilare è più piccola e la lamina elastica interna è ondulato (freccia) nel gruppo SAH, sia coerente con vasospasmo.

Figura 5. Confronto tra Basilar Arteria luminali aree delle sezioni trasversali tra i gruppi di controllo SAH e alle nebbie saline.
| Contare | Media (Luminal area della sezione trasversale) | Std. Dev. | Std. Err. | |
| SAH | 15 | 0,056 millimetri | 0,01 | 0,003 |
| Salino | 13 | 0,069 millimetri | 0,012 | 0,003 |
Tabella 1. Calcolo medie e deviazioni standard di SAH e gruppi di controllo salien.
| Autori | 2 ° SAH | Fonte | Volume iniettato (1 ° / 2 °) | Sacrifice (post 2 ° SAH) | Metodi di analisi | Mortalità |
| Ryba et al. (1999) | 48 | Arterioso | 0.1/0.1 ml | Giorno 5 | EM | 25% |
| Suzuki et al. (1999) | 48 | Arterial | 0.3/0.3 ml | Giorno 5 | Angiografia | Sconosciuto |
| Sato et al. (2002) | 48 | Arterioso | 0.35/0.35 ml | Giorno 5 | Istologia | 20% |
| Aladag et al. (2003) | 48 | Venoso | 0.3/0.3 ml | Giorno 4 | Istologia | 18% |
| Vatter et al. (2006) | 24 | Arterioso | 0.2/0.2 ml | Giorno 3 | Angiografia, risonanza magnetica | 47% |
| Lee et al. (2008) | 24 | Arterioso | 0.3/0.2ml (n = 15) 0.2/0.1 ml (n = 54) | Giorni 1/3/4/7/9 * | Istologia | 40% (n = 15) 1,5% (n = 54) |
| Ratti * sono stati sacrificati in modo differenziale 1 ° giorno (n = 7), 3 ° giorno (n = 7), 5 ° giorno (n = 7), 7 ° giorno (n = 7), 9 ° giorno (n = 7) * Tabella modificato da Lee et al. (2008) | ||||||
Tabella 2. Sintesi dei modelli pubblicati doppia emorragia subaracnoidea di ratto.
Discussione
Primati, con una composizione più simile genetica e caratteristiche anatomiche per l'umano, più strettamente imitare gli eventi di ritardo vasospasmo cerebrale e possono più facilmente subire non invasiva per immagini (risonanza magnetica e angiografia) per monitorare i cambiamenti delle arterie, che roditori 8. Tuttavia, i modelli di primati sono un costo proibitivo e associato con cura più complessa e le questioni etiche, di modelli animali di piccole dimensioni. Piccoli animali SAH modelli che sono stati sviluppati in precedenza sono concentrati su tre metodi per indurre SAH: 1) perforazione endovascolare arteriosa di un'arteria intracranica permettendo al sangue di sfuggire nello spazio subaracnoideo e raccogliere intorno all'arteria danneggiato; 2) esposizione chirurgica di un'arteria e iniezione locale autologo coagulo; 3) l'iniezione diretta del sangue (autologo o donatore) nello spazio subaracnoideo 8. Ogni modello ha i suoi meriti e svantaggi. Ad esempio, il modello di perforazione endovascolare più strettamente imita gli eventi di un aneurysrottura m, ma è associata ad un tasso di mortalità molto elevato e vasospasmo presto, mentre l'approccio chirurgico è artificiale e non imitare gli eventi della presentazione umano tipico di emorragia subaracnoidea aneurismatica. Il modello di iniezione diretta che descriviamo qui ha ancora una mortalità inferiore rispetto al modello perforazione endovascolare e più da vicino imita la condizione umana SAH di un modello aperto chirurgico. Anche se i modelli simili sono stati descritti in precedenza, abbiamo avuto una grande curva di apprendimento con lo sviluppo del modello SAH perché le complicazioni potenziali le sfumature del modello, non erano ben descritto da nessuna parte in precedenza. Era il nostro intento di definire meglio queste trappole potenziali in modo che gli investigatori futuri potrebbero più facilmente utilizzare questo modello riproducibile SAH.
Mentre noi proponiamo un modello semplice e conveniente per studiare gli effetti di vasospasmo ritardata, non è senza i suoi limiti. A causa della capacità di ratti per eliminare rapidamente dal sangue nello spazio subaracnoideo,e le differenze anatomiche delle arterie cerebrali stessi, i ratti sono considerati un modello povero per lo studio di emorragia subaracnoidea ritardato 6, 8. Ci sono alcuni punti critici che influenzano il risultato del modello. La dose di ketamina / TMA cocktail non deve superare 0,1 ml / kg per garantire l'anestesia adeguata. Qualsiasi quantità di ristagno del sangue dopo l'iniezione nella cisterna magna va osservato e documentato come abbiamo osservato che la concentrazione di sangue porta ad un minor grado di vasospasmo 9, 13, 15. Altri studi hanno dimostrato che le iniezioni secondo di sangue 24 ore a parte può indurre un grado più significativo di vasospasmo 6, riteniamo che non imitare l'andamento nel tempo del vasospasmo negli esseri umani in cui vasospasmo si verifica raramente prima di tre giorni dopo emorragia subaracnoidea. Al fine di imitare più da vicino questo corso volta abbiamo fatto la seconda iniezione di sangue 48 ore dopo la prima iniezione.
Le eventuali modifiche del modello che descrie comprendono iniettare grandi volumi di sangue nello spazio subaracnoideo, cambiando la fonte di sangue, alterando il corso di tempo per la seconda iniezione, e sacrificando ulteriormente fuori cinque giorni dopo l'iniezione di sangue secondo. Tali variazioni di modelli precedenti si trovano sopra nella tabella 2. Nel corso del nostro modello di sviluppo, abbiamo utilizzato entrambi i modelli ad iniezione singole e doppie, alterato il tempo tra le iniezioni con il modello a doppia SAH, testato diversi volumi di sangue, testato gli effetti di sangue emolizzati, provato contro arterioso e venoso autologo rispetto donatori di sangue iniezioni. Ognuna di queste modifiche portare a complicazioni che hanno comportato un modello inutilizzabile per testare vasospasmo ritardata. Il modello sopra descritto costantemente prodotto un basso basilare mortalità piccola arteria SAH modello animale di ritardato vasospasmo cerebrale (CV) 6, 7, 11, 13, 15.
Tassi di mortalità bassi permettono una comprensione più approfondita della enmeccanismo pneumatico di vasospasmo cerebrale 13. Bederson et al. 1 hanno utilizzato il modello endovascolare perforazione, riportando un tasso di mortalità del 50% entro 24 ore di osservazione. Veelken et al. 16 con il loro modello endovascolare filamento perforazione ICA descritta una mortalità del 100% nel gruppo normale perfusione entro 3 ore della procedura. Il modello di perforazione endovascolare eseguita da Lee et al. 7 ha mostrato un significativo grado di vasospasmo (diametro BA 230 micron ± 70) rispetto al modello di emorragia doppia all'interno dello stesso studio (diametro BA 320 ± 36 micron), e il tasso di mortalità per l' modello di perforazione è stato segnalato per essere il 44%. L'aumento di cinque volte i livelli di glutammato, così come aumenti lattato e concentrazioni di acidi grassi liberi sono alcuni degli effetti metabolici negativi osservati alcuni minuti dopo l'induzione della SAH che contribuiscono alla maggiore mortalità nel modello di perforazione 10. Lare sono prove sufficienti per sostenere che il modello di perforazione necessita di un ulteriore perfezionamento al fine di controllare i tassi di mortalità elevati.
I tassi di mortalità utilizzando il doppio SAH modello variano ampiamente a seconda del volume iniettato di sangue e la velocità di iniezione. Abbiamo scoperto che un maggior volume di sangue e tassi di iniezione più veloci, guidati fino all'arresto respiratorio e spesso la morte durante o immediatamente dopo l'iniezione di sangue. Durante lo sviluppo del modello, i tassi di mortalità variava da 1,5% al 47% con il volume di sangue è il fattore più importante che influenza la mortalità. Con la perfezione del modello attuale che descriviamo qui, si segnala nessuna mortalità. Ci sono diversi strumenti per individuare con successo e valutare il grado di CV, istologia, microscopia elettronica, l'angiografia, risonanza magnetica e 5, 6, 11, 12, 15. Nel nostro modello, non si è cercato di utilizzare qualsiasi altro metodo a parte istologia.
Nella ricerca di una migliore comprensione delfisiopatologia alla base di CV ritardato in modelli di ratto, si può intraprendere una miriade di applicazioni future come estensione del nostro modello. Lo scopo essenziale è lo sviluppo di agenti che potrebbe efficacemente prevenire e trattare CV nell'uomo. Per fare ciò è necessario comprendere le complesse interazioni e dei processi multifattoriali che avviano e sostiene CV negli esseri umani 17. Con l'istituzione di un adeguato modello di ratto resiliente SAH, gli investigatori possono concentrarsi sui meccanismi di breve e lungo termine di vasospasmo cerebrale e di evitare un conflitto di dati tipici di secondaria danno ischemico nel ratto neuroni 2, 4, 8. Noi crediamo che il modello qui descritto SAH sarà uno strumento utile di indagine per la comprensione dei processi che danno inizio e sostengono CV.
Divulgazioni
Non abbiamo nulla da comunicare riguardo a questo studio.
Riconoscimenti
Vorremmo riconoscere gli sforzi del Dr. Mary-Lou Vallano, Dipartimento di Neuroscienze e Fisiologia, per i suoi preziosi contributi nel scrivere per questo manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome di attrezzature / reagente | Azienda | Numero di catalogo | |
| Ratti maschi SD (250-300 g) | Taconic | SD-M | |
| 26 g Cateteri | Webster | 8416683 | |
| 25 G Aghi | Bufalo | 305122 | |
| 1 cc Siringhe | Negozi centrali | 54245 | |
| La ketamina / Xylazina cocktail | Animal Care (SUNY) * | - | |
| Betadine | Negozi centrali | 51458 | |
| Saccarosio | Sigma | S9378-1kg | |
| Paraformaldeide | Sigma | P6148-500G | |
| Soluzione tampone fosfato | Pescatore | BP-399-4 | |
| Tavolo operatorio | Harvard | PY2 72-2590 | |
| Ottobre composto (crioprotezione) | VWR | 25608-930 | |
| SuperFrost diapositive | Pescatore | 12-550-15 |
* Sintetizzato presso il Dipartimento di cura degli animali da laboratorio, SUNY Upstate Medical University. Aggiungere 1 cc [100 mg / ml] di DBU a 10 ml [100 mg / ml] di Ketamina.
Riferimenti
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26, 1086-1091 (1995).
- Cheng, G., Wei, L., Zhi-Dan, S., Shi-Guang, Z., Xiang-Zhen, L. Atorvastatin ameliorates cerebral vasospasm and early brain injury after subarachnoid hemorrhage and inhibits caspase-dependent apoptosis pathway. BMC Neurosci. 10, 7-17 (2009).
- Jackowski, A., Crockard, A., Burnstock, G., Russell, R. R., Kristek, F. The time course of intracranial pathophysiological changes following experimental subarachnoid hemorrhage in the rat. J. Cereb. Blood Flow Metab. 10, 835-849 (1990).
- Kaoutzanis, M., Yokota, M., Sibilia, R., Peterson, J. W. Neurologic evaluation in a canine model of single and double subarachnoid hemorrhage. J. Neurosci. Methods. 50, 301-307 (1993).
- Karaoglan, A., Akdemir, O., Barut, S., Kokturk, S., Uzun, H., Tasyurekli, M., Colak, A. The effects of resveratrol on vasospasm after experimental subarachnoid hemorrhage in rats. Surg. Neurol. 70, 337-343 (2008).
- Lee, J. Y., Huang, D. L., Keep, R., Sagher, O. Characterization of an improved double hemorrhage rat model for the study of delayed cerebral vasospasm. J. Neurosci. Methods. 168, 358-366 (2008).
- Lee, J. Y., Sagher, O., Keep, R., Hua, Y., Xi, G. Comparison of experimental rat models of early brain injury after subarachnoid hemorrhage. Neurosurgery. 65 (2), 331-343 (2009).
- Megyesi, J. F., Vollrath, B., Cook, D. A., Findlay, J. M. In vivo animal models of cerebral vasospasm: a review. Neurosurgery. 46, 448-460 (2000).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52, 165-176 (2003).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54, 426-436 (2004).
- Ryba, M. S., Gordon-Krajcer, W., Walski, M., Chalimoniuk, M., Chrapusta, S. J. Hydroxylamine attenuates the effects of simulated subarachnoid hemorrhage: implication for the role of oxidative stress in cerebral vasospasm. Neurol. Res. 31, 195-199 (1999).
- Satoh, M., Parent, A. D., Zhang, J. H. Inhibitory effect with antisense mitogen-activated protein kinase oligodeoxynucleotide against cerebral vasospasm in rats. Stroke. 33, 775-781 (2002).
- Suzuki, H., Kanamaru, K., Tsunoda, H., Inada, H., Kuroki, M., Sun, H., Waga, S., Tanaka, T. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. J. Clin. Invest. 104, 59-66 (1999).
- Swift, D. M., Solomon, R. A. Subarachnoid hemorrhage fails to produce vasculopathy or chronic blood flow changes in rats. Stroke. 19, 878-882 (1988).
- Vatter, H., Weidauer, S., Konczalla, J., Dettmann, E., Zimmermann, M., Raabe, A., Preibisch, C., Zanella, F., Seifert, V. Time course in the development of cerebral vasospasm after experimental subarachnoid hemorrhage: clinical and neuroradiological assessment of the rat double hemorrhage model. Neurosurgery. 58, 1190-1197 (2006).
- Veelken, J. A., Laing, R. J., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26, 1279-1283 (1995).
- Zubkov, A. Y., Nanda, A., Zhang, J. H. Signal transduction pathways in cerebral vasospasm. Pathophysiology. 9, 47-61 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon