Method Article
死亡率低大鼠模型的实验性蛛网膜下腔出血后迟发性脑血管痉挛评估
摘要
动脉瘤性蛛网膜下腔出血(SAH)出血,进入蛛网膜下腔动脉瘤破裂时发生的。虽然此事件的发病率和死亡率一直在下降,由于更好的治疗方法,血管痉挛的风险蛛网膜下腔出血后仍然是相同的,因为它是几年前的。建立一个全面的和可再生的动物模型来确定启动事件,脑血管痉挛的重要性一直是研究的重点,因为在第一次使用的一个实验性血管痉挛大鼠模型于1979年由巴里等。 3,6,14。在这里,我们描述SAH大鼠模型死亡率低,可复制的延迟血管痉挛的结果。
摘要
目的:描述并建立一个可重复的模型,演示了在大鼠动脉瘤性蛛网膜下腔出血(SAH)后迟发性脑血管痉挛,以确定始发事件,病理生理变化和潜在的治疗目标。
方法:对28只雄性SD大鼠(250 - 300克)任意分配给其中的两个群体 - 蛛网膜下腔出血或生理盐水对照组。 SAH组(n = 15)的大鼠蛛网膜下腔出血引起的双注射自体血液,相隔48小时,枕大池。同样,生理盐水组(n = 13)被注入到小脑延髓池的盐水对照组。 5天处死大鼠后,第二次注血和被保存下来的大脑进行组织学分析。血管痉挛的程度,测定使用的基底动脉的部分,通过测量使用NIH图像J软件的内部管腔的横截面面积。的意义测试使用的杜克/克莱默的统计分析。
结果:组织切片分析后,基底动脉管腔截面积较生理盐水组在SAH,脑血管痉挛,前一组一致的。在SAH组,基底动脉的内部面积(0.056微米±3)从血管痉挛5天之后,第二次血液注射液(七天后的初始注血),较生理盐水对照组的内部区域(0.069 ±3,P = 0.004)。有没有脑血管痉挛死亡率。
结论:双SAH模型大鼠诱导温和的,生存能力,基底动脉血管痉挛,在小动物模型,可用于研究脑血管痉挛的病理生理机制。低和可接受的死亡率是一个重要的标准,需要满足的一个理想的SAH动物模型,使血管痉挛的机制可以elucidated 7,8。进一步修改的模型可以进行调整日益严重的血管痉挛和神经系统检查。
研究方案
1。大鼠SAH主题的手术治疗注射0.15毫升自体动脉血
- 大鼠麻醉用0.1毫克/公斤的氯胺酮/甲苯噻嗪啮齿动物的鸡尾酒,坐5分钟。
- 适当的麻醉也证实了减少后肢反射。
- 使用电子剃须刀的脖子,以鼻子枕区的区周围的头发被剃光了。
- 动物置于仰卧在手术台上和尾部被擦拭用优碘,以确保无菌切口。
- 一条笔直的1厘米正中切口方面的尾部腹侧
- 延长至尾动脉解剖鉴定和分离。
- 使用无菌的26号的导管,尾动脉插管和0.15毫升动脉血被撤回到一个注射器。
- 的无菌纱布包裹切口周围,以确保密封切口vetbond应用前止血。
- Ţ他大鼠变成容易在桌子上和剃区域的子枕区与Betadine被擦拭。
- 使用垂直正中切口连接获得枕大池。
- 一旦确定了25号针插入到小脑延髓池和0.15毫升的CSF被撤回到一个注射器,以避免增加颅内压力与自体血液体积注射。
- 现在,从尾动脉中提取的0.15毫升的血液缓慢注入枕大池。
- 针留在的地方,持续30秒,以确保在蛛网膜下腔凝血,然后小心地撤回。
- 止血确保使用缝合装置关闭切口。
- 动物放在容易变暖的表面上20分钟,20°头向下的位置,让血液凝结水箱周围基底动脉。
- 在第二次手术后48小时,除了重复步骤1.1至1.15。
2。大鼠SAH主题的手术治疗注射0.15毫升生理盐水
- 大鼠麻醉用0.1毫克/公斤的氯胺酮/甲苯噻嗪啮齿动物的鸡尾酒,坐5分钟。
- 适当的麻醉也证实了减少后肢反射。
- 使用电子剃须刀的脖子,以鼻子枕区的区周围的头发被剃光了。
- 动物置于仰卧在手术台上和尾部被擦拭用优碘,以确保无菌切口。
- 一条笔直的1厘米正中切口方面的尾部腹侧
- 延长至尾动脉解剖鉴定和分离。
- 使用无菌的26号的导管,尾动脉插管和0.15毫升动脉血被撤回到一个注射器。
- 的无菌纱布包裹切口周围,以确保密封切口vetbond应用前止血。
- 在RAt是打开容易在桌子上和剃区域的子枕区涂上优碘。
- 使用垂直正中切口连接获得枕大池。
- 一旦确定了25号针插入到小脑延髓池和0.15毫升的CSF被撤回到一个注射器中,样品被存储。
- 现在,0.15毫升的生理盐水(37°C)缓慢注入枕大池。
- 针留在30秒的地方,并仔细撤回。
- 止血确保使用缝合装置关闭切口。
- 现在被置于该动物俯卧变暖的表面上20分钟与20°头向下的位置。
- 在第二次手术后48小时,除了重复步骤2.1至2.15。
3。大鼠牺牲
- 第二次手术后第5天,将大鼠处死,通过心脏灌注。
- 大鼠给予了致命剂量(0.2毫升/公斤)的致命加(VORTECH制药有限公司,迪尔伯恩,MI)
- 具有垂直的正中切口,腹腔是接近和打开腹膜。
- 前开胸手术和心脏暴露。
- 使用的磷酸盐缓冲溶液(PBS pH 7.4和在37℃)的动物的血液排出,然后用4%多聚甲醛灌流,连接到26号的导管。
- 确保足够的灌注后,被停止灌注,,和大鼠带过来的断头表。
- 断头后,咬骨钳是用来去除去除对大脑的头盖骨。
- 的脑和脑干仔细从颅腔萃取,并放入4%多聚甲醛溶液,并储存在4℃下48小时。
4。创建节,以评估血管痉挛
- 现在已经被淹没在4天的30%蔗糖的大鼠脑带到第Ë低温恒温器的切片。
- 使用低温恒温器,小脑前下动脉(AICA)为出发点,以确保跨学科的一致性一旦cryoprotected,12μM部分。
- 20节创建的每一个动物,在小脑上动脉(SCA)结束。
- 部分放置在载玻片上,并评估血管痉挛使用组织学方法
结果
在上面描述的协议中,有以下几个步骤,我们相信需要比以前已在文献中描述的模型更好地表征。在这里,我们专注于以实现可重复的低死亡率脑血管痉挛的小动物模型,并避免潜在的缺陷与这种模式,如果没有正确的步骤是必不可少的。
1。自体尾动脉抽血:
精心安排的angiocatheter尾动脉模型中是必不可少的第一步。 图1显示了一个26号的大鼠尾动脉导管的位置。这是一个良好的位置,以最小的创伤和失血。良好的血液回流,可以确认的angiocatheter妥善安置。
2。注射自体血枕大池:
深刻的解剖吨他枕下区进行,直到寰枕膜是可视化的一个闪亮的白色膜( 图2)。小脑延髓池是通过访问一个通过膜用25号针头穿刺。应当指出,停药后的针,血液汇集,以确保有足够量的自体血停留在蛛网膜下腔的小脑延髓池。在外面方面,寰枕膜的血液过度集中是不可取的,因为我们的模型中自体血使用量相对较低(0.15毫升),相比现有的模式和池可能会导致无效的血量在蛛网膜下腔。更大量的血液经常导致呼吸衰竭,颅内压增高和血液制品,注射后不久,大概是从。采集血液在蛛网膜下腔动脉周围是几个可能的方法之一,启动实验性血管痉挛8 。在第二次手术时,有时可能会是困难的寰枕膜来可视化,虽然从第一手术穿刺部位往往是可见的。
3。标本
图3显示了一个的脑干标本中检索老鼠( 图3A)和蛛网膜下腔出血( 图3B)。请注意在图3B的基底动脉周围的血液收集在蛛网膜下腔。这代表了足够体积的血液诱导的基底动脉的血管痉挛。 图3A和图3B中的箭头定义的基底动脉(BA)的程度。第(12微米)AICA SCA BA延长的长度。
4。组织切片
二十每个基底动脉标本进行了分析在SAH和生理盐水对照的组( 图4)。内部基底动脉管腔的横截面面积为小,并有显着的波纹的内部弹性薄片提示血管痉挛,在SAH组( 图4A)。从盐水对照组的时间是基底动脉的面积大,并且不具有波纹的内弹性膜( 图4B)。在图5中,可以发现甲量化的程度的面积的减少,两组之间。这些研究证实,这SAH模型并产生脑血管痉挛,可通过组织学方法评估。管腔的横截面面积,因为偶尔组织处理的查询结果在非晶形的横截面的船只,使得难以确定一个适当的直径来测量和用于数据分析,用于确定血管痉挛。所有的测量都是使用的的NIH图片-J软件。在SAH组,基底动脉(内部= 0.056微米±3)明显小于生理盐水对照组,(内部= 0.069微米±3,P = 0.004),由于血管痉挛。意义进行了测试,应用Tukey /克莱默的统计分析。 表1说明了这些值与计算标准差和标准差为这两个群体。
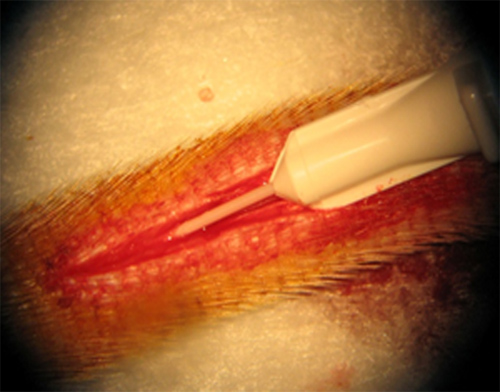
图1的插入的26号导管被插入到尾动脉。
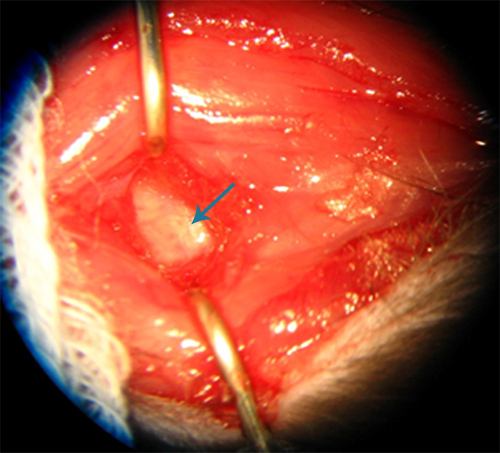
图2。寰枕膜(箭头)在大鼠的外观。
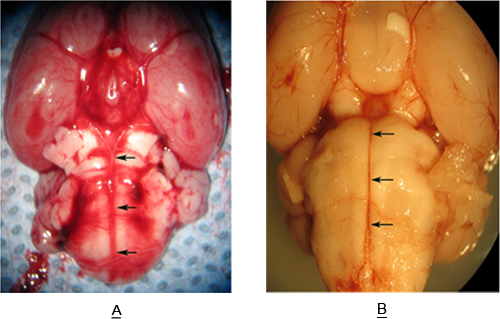
图3。腹面大鼠胸罩Instem的基底动脉(箭头)与(A),和没有(B),SAH。

图4显示基底动脉SAH(A)和生理盐水对照组(B)组的组织切片。请注意,基底动脉的腔的横截面面积更小,内弹性膜是波纹(箭头所示)在SAH组,既符合血管痉挛。

图5。基底动脉管腔的横截面面积为SAH和生理盐水对照组比较。
| 数 | 平均值(管腔的横截面面积) | 标准。开发。 | 标准。错误。 | |
| SAH | 15 | 0.056毫米 | 0.01 | 0.003 |
| 盐水 | 13 | 0.069毫米 | 0.012 | 0.003 |
表1计算的SAH和salien的对照组的均值和标准差。
| 作者 | 第二届 SAH | 源 | 注射量(1/2 次 ) | 牺牲(后第二届 SAH) | 分析方法 | 死亡 |
| ryba 等人 (1999年)。 | 48 | 动脉 | 0.1/0.1毫升 | 第5天 | EM | 25% |
| Suzuki 等人 (1999年)。 | 48 | 动脉升 | 0.3/0.3毫升 | 第5天 | 血管造影术 | 未知 |
| Sato 等人 (2002年)。 | 48 | 动脉 | 0.35/0.35毫升 | 第5天 | 组织学 | 20% |
| aladag 等人 (2003年)。 | 48 | 静脉 | 0.3/0.3毫升 | 第4天 | 组织学 | 18% |
| vatter 等人 (2006年)。 | 24 | 动脉 | 0.2/0.2毫升 | 第3天 | 血管造影,MRI | 47% |
| Lee 等人 (2008) | 24 | 动脉 | 0.3/0.2ml组(n = 15) 0.2/0.1毫升组(n = 54) | 天1/3/4/7/9 * | 组织学 | 40%(N = 15) 1.5%(n = 54) |
| *大鼠差异而牺牲的第1天(N = 7),第3天(n = 7),5天(N = 7),7天(N = 7),第9天(N = 7) 等人(2008年) | ||||||
表2:发布的双蛛网膜下腔出血大鼠模型。
讨论
灵长类动物,具有更相似的遗传组成和解剖特征的人,更紧密地模仿迟发性脑血管痉挛的事件,可以更容易地进行非侵入性成像(MRI和血管造影),以监测动脉的变化,比啮齿类动物8。然而,灵长类动物模型的成本过高,与更复杂的护理和道德问题,不是小动物模型。已开发的小动物SAH模型以前主要集中在诱导SAH的三种方法:1)血管内动脉的颅内动脉使血液进入蛛网膜下腔逃脱,周围动脉损伤穿孔; 2)动脉的外科手术暴露,自体血凝块注入; 3)直接注入血液进入蛛网膜下腔8(自体或捐助方)。每一个模型都有自己的优点和缺点。例如,血管腔内穿孔模型最密切的模仿的aneurys事件米破裂,但与非常高的死亡率和早期血管痉挛,而手术的方法是人为的,不模仿人介绍动脉瘤性SAH的典型事件。直接注入我们在这里描述的模型,并有较低的死亡率比血管内穿孔模型更加紧密地模仿人类SAH的条件比开放手术模型。虽然类似的模型如前所述,我们有一个大的学习曲线与SAH模式的发展,因为潜在的并发症,从细微之处的模型,没有详细说明任何地方以前。这是我们的意图,更好地确定这些潜在的陷阱,使未来的研究人员可以更方便地使用可重复SAH模型。
虽然我们提出了一个简单的和成本有效的模型来研究迟发性脑血管痉挛的影响,但也不是没有它的局限性。由于大鼠的能力迅速清除血液从蛛网膜下腔,和在脑动脉自己的解剖学上的差异,大鼠模型的研究蛛网膜下腔出血延迟6,8被认为是一个贫穷的。有几个会影响对模型结果的关键步骤。氯胺酮/甲苯噻嗪鸡尾酒的剂量不应超过0.1毫升/公斤,以确保有足够的麻醉。正如我们已经指出,池的血液导致血管痉挛9在较小的程度,13,15,应注意和记录在任何量汇集到小脑延髓池注射后血液。其他的研究也表明,第二次注射血液24小时,除了可以诱发一个更重要的血管痉挛的程度6,我们相信它会在人类无法模仿的过程中血管痉挛,血管痉挛很少发生SAH后3天前。为了更紧密地模仿这个时间过程中,我们血48小时后进行第二次注射,第一次注射。
潜在的修改模型,我们describË包括注入更大量的血液进入蛛网膜下腔,改变血液的来源,改变第二次注射的时间过程,而牺牲进一步超过五天后第二次血液注入。于表2中,在以前的模型的这种变化可查到以上。在我们的模型发展的过程中,我们使用了单,双注射模型,改变之间的时间间隔注射双SAH模型,测试了不同体积的血液,测试血液溶血的影响,试图静脉与动脉和自体与捐赠者的血液注射。这些修改导致无法使用的模型测试延迟血管痉挛导致的并发症。上述模型生产死亡率低基底动脉SAH小动物模型的迟发性脑血管痉挛(CV)6,7,11,13,15。
低死亡率允许的连接更深入的了解脑血管痉挛13轮胎机制。 Bederson 等。血管内穿孔模型,在24小时内观察报告的死亡率为50%。 Veelken 等16腔内长丝的ICA穿孔模型描述的正常灌注组的死亡率为100%,在3小时内的程序。进行血管内穿孔模型由Lee 等[7]发现一个显著的血管痉挛程度(BA直径为230μm±70)相比,双出血模型在同一研究(BA直径为320μm±36),死亡率为穿孔模型报道是44%。谷氨酸含量增加5倍,乳酸,游离脂肪酸浓度的增加以及一些诱导SAH后几分钟,有助于增加死亡率穿孔模型10的有害代谢的影响。再是足够的证据支持,穿孔模型还需要进一步完善,以控制高死亡率。
死亡率使用双SAH模型变化很大,取决于血液注入和注射速率的体积。我们发现,较大体积的血液和较快的注射速率,所有导致呼吸骤停和经常的血液注射期间或之后立即死亡。在模型开发,,血容量是最重要的因素,影响死亡率的死亡率从1.5%到47%不等。我们在这里描述的模型的完善,我们的报告没有死亡。有一些工具可以成功地识别和评估CV的程度,组织学,电子显微镜,血管造影,MRI 5,6,11,12,15。在我们的模型中,没有试图用任何其他方法,除了从组织学。
在追求更好的理解延迟CV模型大鼠的病理生理基础,可以进行无数的应用前景,我们的模型的延伸。基本目标是发展代理商,可以成功地在人类预防和治疗CV。为了做到这一点,必须了解复杂的相互作用和多因素过程的启动和维持人类的简历17。一个合适的生存能力SAH大鼠模型的建立,研究人员可以专注于短期和长期的脑血管痉挛的机制,避免相互矛盾的数据,典型的继发性脑缺血损伤的大鼠神经元2,4,8。我们相信,SAH模型描述这里将是一个有利的调查工具的进程的启动和维持CV的理解。
披露声明
我们什么都没有透露有关这项研究。
致谢
在写这篇稿子,我们要感谢的努力,玛丽娄医生,神经科学和生理学系,Vallano的宝贵意见。
材料
| Name | Company | Catalog Number | Comments |
| 设备/试剂名称 | 公司 | 目录编号 | |
| 雄性SD大鼠(250-300克) | Taconic公司 | SD-M | |
| 26 G导管 | 韦伯斯特 | 8416683 | |
| 25 G针 | 水牛 | 305122 | |
| 1毫升注射器 | 中央商场 | 54245 | |
| 氯胺酮/甲苯噻嗪鸡尾酒 | 动物保健(SUNY) | - | |
| 聚维酮碘 | 中央商场 | 51458 | |
| 蔗糖 | 西格玛 | S9378-1KG | |
| 多聚甲醛 | 西格玛 | P6148-500G | |
| 磷酸盐缓冲溶液 | 费舍尔 | BP-399-4 | |
| 手术台 | 哈佛 | PY2 72-2590 | |
| OCT化合物(抗冻剂) | VWR | 25608-930 | |
| Superfrost防脱载玻片 | 费舍尔 | 12-550-15 |
*合成,美国纽约州立大学上州医科大学实验动物护理系。加入1毫升[100毫克/毫升]的甲苯噻嗪[100毫克/毫升]氯胺酮至10毫升。
参考文献
- Bederson, J. B., Germano, I. M., Guarino, L. Cortical blood flow and cerebral perfusion pressure in a new noncraniotomy model of subarachnoid hemorrhage in the rat. Stroke. 26, 1086-1091 (1995).
- Cheng, G., Wei, L., Zhi-Dan, S., Shi-Guang, Z., Xiang-Zhen, L. Atorvastatin ameliorates cerebral vasospasm and early brain injury after subarachnoid hemorrhage and inhibits caspase-dependent apoptosis pathway. BMC Neurosci. 10, 7-17 (2009).
- Jackowski, A., Crockard, A., Burnstock, G., Russell, R. R., Kristek, F. The time course of intracranial pathophysiological changes following experimental subarachnoid hemorrhage in the rat. J. Cereb. Blood Flow Metab. 10, 835-849 (1990).
- Kaoutzanis, M., Yokota, M., Sibilia, R., Peterson, J. W. Neurologic evaluation in a canine model of single and double subarachnoid hemorrhage. J. Neurosci. Methods. 50, 301-307 (1993).
- Karaoglan, A., Akdemir, O., Barut, S., Kokturk, S., Uzun, H., Tasyurekli, M., Colak, A. The effects of resveratrol on vasospasm after experimental subarachnoid hemorrhage in rats. Surg. Neurol. 70, 337-343 (2008).
- Lee, J. Y., Huang, D. L., Keep, R., Sagher, O. Characterization of an improved double hemorrhage rat model for the study of delayed cerebral vasospasm. J. Neurosci. Methods. 168, 358-366 (2008).
- Lee, J. Y., Sagher, O., Keep, R., Hua, Y., Xi, G. Comparison of experimental rat models of early brain injury after subarachnoid hemorrhage. Neurosurgery. 65 (2), 331-343 (2009).
- Megyesi, J. F., Vollrath, B., Cook, D. A., Findlay, J. M. In vivo animal models of cerebral vasospasm: a review. Neurosurgery. 46, 448-460 (2000).
- Prunell, G. F., Mathiesen, T., Diemer, N. H., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Subarachnoid blood volume, mortality rate, neuronal death, cerebral blood flow, and perfusion pressure in three different rat models. Neurosurgery. 52, 165-176 (2003).
- Prunell, G. F., Mathiesen, T., Svendgaard, N. A. Experimental subarachnoid hemorrhage: Cerebral blood flow and brain metabolism during the acute phase in three different models in the rat. Neurosurgery. 54, 426-436 (2004).
- Ryba, M. S., Gordon-Krajcer, W., Walski, M., Chalimoniuk, M., Chrapusta, S. J. Hydroxylamine attenuates the effects of simulated subarachnoid hemorrhage: implication for the role of oxidative stress in cerebral vasospasm. Neurol. Res. 31, 195-199 (1999).
- Satoh, M., Parent, A. D., Zhang, J. H. Inhibitory effect with antisense mitogen-activated protein kinase oligodeoxynucleotide against cerebral vasospasm in rats. Stroke. 33, 775-781 (2002).
- Suzuki, H., Kanamaru, K., Tsunoda, H., Inada, H., Kuroki, M., Sun, H., Waga, S., Tanaka, T. Heme oxygenase-1 gene induction as an intrinsic regulation against delayed cerebral vasospasm in rats. J. Clin. Invest. 104, 59-66 (1999).
- Swift, D. M., Solomon, R. A. Subarachnoid hemorrhage fails to produce vasculopathy or chronic blood flow changes in rats. Stroke. 19, 878-882 (1988).
- Vatter, H., Weidauer, S., Konczalla, J., Dettmann, E., Zimmermann, M., Raabe, A., Preibisch, C., Zanella, F., Seifert, V. Time course in the development of cerebral vasospasm after experimental subarachnoid hemorrhage: clinical and neuroradiological assessment of the rat double hemorrhage model. Neurosurgery. 58, 1190-1197 (2006).
- Veelken, J. A., Laing, R. J., Jakubowski, J. The Sheffield model of subarachnoid hemorrhage in rats. Stroke. 26, 1279-1283 (1995).
- Zubkov, A. Y., Nanda, A., Zhang, J. H. Signal transduction pathways in cerebral vasospasm. Pathophysiology. 9, 47-61 (2003).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。