Method Article
Preparação de fatias do hipocampo aguda de ratos e camundongos transgênicos para o Estudo das Alterações Synaptic durante o envelhecimento e amilóide Patologia
Neste Artigo
Resumo
Este artigo descreve procedimentos para preparar fatias do hipocampo de ratos e camundongos transgênicos para o estudo de alterações sinápticas do cérebro associadas ao envelhecimento e relacionadas com a idade as doenças neurodegenerativas, como doença de Alzheimer.
Resumo
O roedor preparação fatia do hipocampo é talvez a ferramenta mais amplamente utilizado para investigar função sináptica mamíferos e plasticidade. O hipocampo pode ser extraído de forma rápida e facilmente de ratos e camundongos e fatias de permanecer viável por horas em oxigenado líquido cefalorraquidiano artificial. Além disso, técnicas básicas electrophysisologic são facilmente aplicadas à investigação da função sináptica em fatias do hipocampo e forneceram algumas das melhores biomarcadores para deficiências cognitivas. A fatia do hipocampo é especialmente popular para o estudo de mecanismos de plasticidade sináptica envolvida na aprendizagem e memória. Mudanças na indução de potenciação de longa duração e depressão (LTP e LTD) da eficácia sináptica em fatias do hipocampo (ou falta dele) são freqüentemente usados para descrever o fenótipo neurológico de animais com deficiência cognitiva e / ou para avaliar o mecanismo de ação da compostos nootropic. Este artigo descreve os procedimentos que usamos para preparar fatias do hipocampo de ratos e camundongos transgênicos para o estudo de alterações sinápticas do cérebro associadas com o envelhecimento ea doença de Alzheimer (AD) 1-3. Uso de ratos e camundongos com idade modelo AD pode apresentar um conjunto único de desafios para os pesquisadores acostumados a usar ratos mais jovens e / ou ratos em suas pesquisas. Ratos idosos têm crânios mais espessa e mais resistente do tecido conjuntivo de ratos mais jovens e camundongos, o que pode atrasar extração de cérebro e / ou dissecção e, conseqüentemente, negar ou exagerar verdadeira idade diferenças na função sináptica e plasticidade. Envelhecimento e patologia amilóide também pode agravar a lesão do hipocampo sustentada durante o processo de dissecação, novamente complicando qualquer inferências a partir da avaliação fisiológica. Aqui, discutimos as medidas tomadas durante o processo de dissecção para minimizar esses problemas. Exemplos de respostas sinápticas adquiridos em "saudável" e "insalubre" fatias de ratos e camundongos são fornecidos, bem como representante experimentos plasticidade sináptica. O possível impacto de outros fatores metodológicos sobre a função sináptica nestes modelos animais (por exemplo, componentes de gravação solução, parâmetros de estimulação) também são discutidos. Embora o foco deste artigo é sobre o uso de ratos idosos e camundongos transgênicos, os novatos para cortar fisiologia deve encontrar detalhes suficientes aqui para começar a fazer seus próprios estudos, usando uma variedade de modelos de roedores.
Protocolo
1. Preparando Ice-frio oxigenada Líquido Cefalorraquidiano Artificial (ACSF)
- Prepare 2 L de "Ca 2 +-free" ACSF. Em um Erlenmeyer de 2L, adicione aproximadamente 1,5 L de estéril ou bidestilada H 2 O, e começar a mexer vigorosamente sobre uma placa de agitação. Adicione os seguintes componentes ACSF (em mM): 124 NaCl, 2 KCl, 1,25 KH 2 PO 4, 2 MgSO 4, 26 NaHCO 3, e 10 dextrose (ver Tabela 1). Levar o volume de 2 L com água destilada H 2 O.
- Utilizando um borbulhador de aquário e tubos ligados a um 95% O 2 / 5% CO 2 tanque de ar, ACSF oxigenar vigorosamente por aproximadamente 20-30 min. Verifique o pH e, se necessário, ajustar para 7,4 usando NaOH ou HCl.
- Despeje 750 ml de Ca 2 +-oxigenado livre ACSF para um balão Erlenmeyer separado, cobrir a abertura com parafilme, e transferir para um Ultrafreezer (-80 ° C) por 20-30 min. Essa mídia será utilizada para dissecção aguda do cérebro e fatias hipocampais *. Adicione 2 mM CaCl 2 com o volume de 1,25 L restantes ACSF #, mexa bem, e retomar a oxigenação com 95% O 2 / 5% CO 2. Essa mídia será utilizada para armazenar fatias de cérebro depois de dissecções, e para perfusão fatias durante as gravações eletrofisiológicas.
* Ice-frio Ca 2 + de mídia livre é usado para desacelerar o metabolismo e minimizar Ca 2 + dependentes de excitotoxicidade durante a dissecção.
# Alterações na Ca 2 + desregulação durante o envelhecimento e AD pode ter um impacto importante sobre a indução de Ca 2 + dependentes de plasticidade sináptica 4-9. Relatos conflitantes sobre as diferenças de idade na LTD pode ser parcialmente atribuído ao uso de diferentes ACSF Ca 2 +: Mg2 + taxas durante as gravações fatia (ver 2,4,10). A importância do Ca 2 + a regulamentação eo Ca 2 + ACSF nível em estudos de envelhecimento é abordado em maior detalhe na seção Discussão. - Enquanto o Ca 2 + livre ACSF está congelando, prepare uma câmara de holding para a manutenção de fatias do cérebro antes e durante as gravações eletrofisiológicas *. Nós usamos uma câmara de macro-holding personalizado que contém quatro microchambers individual (ver figura 2). O macrochamber está cheia de estéril, oxigenada H 2 O e os microchambers são essencialmente as ilhas que se projetam acima da superfície da água. Dentro de cada MicroChamber, fatias de descanso na inserção de compensação, uma piscina rasa de ACSF oxigenado. Postas não estão completamente submerso, mas se sentar em uma interface com o ar umidificado. Um elemento de aquecimento isolada dentro do macrochamber permite o ajuste de temperatura.
* Existem diversas variedades de exploração câmaras também estão disponíveis comercialmente (eg Warner Instruments faz uma imersão no estilo "Pre Chamber # BSC-PC) e deve ser adequado para uso em estudos de envelhecimento e fatia transgênicos mouse. Em uma pitada, fatias pode ser mantido por várias horas em uma pequena placa de Petri cheia de ACSF. Faça um pequeno furo na tampa de Petri para um tubo de fornecimento de oxigênio. Tenha cuidado para que as bolhas de oxigênio não fisicamente agitar as fatias. Slices vai ter oxigênio suficiente se o tubo de entrega é elevado para apenas acima da superfície ACSF (dispersão de gases deve causar um recuo na superfície de líquidos).
2. A remoção do hipocampo do cérebro e dissecção em idosos (> 20 meses de idade, ratos)
- Prepare a * área de dissecção ao lado de uma pia grande (ver Figura 1 e Tabela 2). Coloque uma guilhotina de pequenos animais na pia e lay out instrumentos cirúrgicos e materiais para a remoção do hipocampo do cérebro e dissecção incluindo uma toalha de papel dobrado, uma lâmina de bisturi # 11, tesouras BeeBee, fórceps osso, uma "ferramenta Hippocampus" (uma espátula especializados dupla de multa instrumentos cirúrgicos), pequenas tesouras cirúrgicas, uma espátula dupla fina, de plástico pipeta Pasteur, 110 mm de diâmetro de filtro Whatman papel, com tampa de vidro 100 milímetros placa de Petri cheia de gelo e uma colher de plástico. Também manter um saco plástico próximo à eliminação da carcaça.
* Extração do cérebro deve ser concluída o mais rápido possível, por isso é uma boa idéia mentalmente "atravessar" o processo e colocar seus instrumentos na ordem de uso. - Remover Ca 2 + livre ACSF do freezer. Mídia deve ser parcialmente, não completamente, congelados. Despeje cerca de 50 mL de ACSF em um copo de vidro, cubra com Parafilm e coloque ao lado da área de dissecção. Essa mídia será usada para armazenar brevemente o cérebro, uma vez que é removido. O Ca 2 + restantes livre de mídia será usada para encher o reservatório no Vibratome para a preparação de fatia. Esta mídia pode ser reoxigenado, ou simplesmente coberto com parafilme e colocados na geladeira a 4 ° C.
- Euthanize o rato usando métodos aprovados pelo Institutional Animal Care e do Comitê de Uso (IACUC). Nossos animais são colocados em uma câmara de Plexiglas pequeno que é gradualmente preenchido com 100% de CO 2. Perda de consciência geralmente ocorre dentro de cinco minutos e é confirmado pela ausência de atividade reflexaseguir uma pitada dedo do pé.
- Decapitar o rato imediatamente rostral à primeira vértebra cervical e coloque a cabeça na toalha de papel dobrado. Usando o bisturi # 11, rapidamente fazer uma incisão no meio do couro cabeludo começando perto do osso nasal e funcionando caudalmente ao osso occipital. Certifique-se de cortar completamente através do músculo cutâneo, totalmente expondo as suturas na superfície dorsal do crânio.
- Cortar as placas scull com tesoura BeeBee. Em ratos jovens e camundongos, o crânio pode ser rapidamente removido com o uso de fórceps osso sozinho. Contudo, os ratos idosos têm crânios mais espessa do que ratos e camundongos adultos jovens que podem fazer este procedimento difícil. Descobrimos que o corte através do crânio facilita muito remoção óssea com fórceps, diminui lesão no cérebro, e economiza preciosos segundos. Com a cabeça do rato com firmeza em cima do balcão, coloque a ponta da parte inferior da tesoura pura BeeBee para a região superior do forame magno na porção posterior do crânio. Mantendo o menor pura firmemente contra a superfície interna do crânio (e longe do cérebro) *, cortar a placa occipital, e depois ao longo da sutura mediana das placas parietal. Proceder rostralmente até que você cortar as placas crânio frontal.
* É extremamente importante que a pressão é direcionado para longe do cérebro para evitar a aferição inadvertida. - Separar o occipital, parietal, e placas de crânio temporal do cérebro. Continue segurando a cabeça com firmeza para a bancada para a estabilidade e alavancagem e deslize o maxilar inferior do fórceps sob a pressão parietal esquerdo placa mantido contra a superfície interna do crânio. Em seguida, aperte as garras do fórceps juntos and roll seu pulso para cima e em direção a você para puxar o parietal occipital e placas longe do cérebro. Este deve expor maior parte da superfície dorsal do hemisfério esquerdo. Se necessário, use o fórceps para remover a placa frontal esquerdo também. Repita esse processo para o outro hemisfério. Uma vez que as placas são deslocadas, de forma rápida para inspecionar qualquer matéria dura que podem ser associadas às placas temporal e estendeu por toda a superfície do cérebro. Puxe esses acabar com a fórceps ou cortar com uma tesoura *. Agora, deslize o maxilar superior do fórceps entre o cérebro ea placa temporal direito, mais uma vez mantendo a pressão em direção ao crânio e longe do cérebro. Aperte e torça o prato temporais longe do cérebro. Você deve ouvir / sentir um "crunch", como você faz isso. Repita o procedimento para o lado esquerdo.
* A dura-máter pode ser difícil de detectar, especialmente se o animal foi perfundido com transcardially ACSF. No entanto, se dura não são removidos, eles vão cortar o cérebro (e muito provavelmente o hipocampo) como uma navalha quando as placas temporais são removidas. Recorte a dura-máter de distância, perto das placas temporais irá minimizar a probabilidade de esfaquear o cérebro. - Extrair o cérebro *. Remover rapidamente o parafilme do Ca 2 + livre ACSF "piegas". Agora desloque a cabeça de uma espátula larga da ferramenta Hippocampal entre a superfície ventral do cérebro e do crânio, as placas de fundo até que esteja completamente sob o cérebro. Mover a espátula lateralmente de um lado-a-lado e depois para a frente e para trás algumas vezes para cortar intacta nervos cranianos. Agora colher o cérebro com a ferramenta do hipocampo e submergir em Ca 2 + livre ACSF e cubra com parafilme. Deixe o frio cérebro para cerca de um minuto. Este é um momento oportuno para limpar a guilhotina, descarte da carcaça, e reorganizar a área de dissecção.
* Para obter as etapas 2,3-2,7, a rapidez é essencial. Nós tentamos concluir esse procedimento (de decapitação ao cérebro submersão em ACSF) em 30-35 seg. Em nossa experiência, extrações demorando mais do que um minuto parecem afectar negativamente a saúde fatia do hipocampo, especialmente para ratos idosos. Com estes procedimentos, temos observado nenhuma diferença no tempo de extração entre os ratos idosos e jovens para os nossos estudos. - Extraia o hipocampo. Coloque o papel de filtro Whatman na tampa da placa de Petri gelada e umedecer o papel com ACSF usando a pipeta de transferência de plástico. Recuperar o cérebro do ACSF usando uma colher e coloque no papel Whatman umedecido. Com a lâmina de bisturi, remove o cerebelo e aproximadamente um quarto dos lobos rostral frontal. Executar a lâmina de bisturi através da fissura intrahemispheric separar completamente os dois hemisférios. Coloque um hemisfério de volta para o piegas ACSF e "stand" para cima outras em fase de dissecação tal que o plano coronal do lobo frontal está voltada para baixo. Você deve ser claramente capazes de distinguir o tronco cerebral e cérebro médio (que são brancos) do córtex suprajacente (que é rosa / cinza). Localize o colículos superior e inferior de mesencéfalo, estes parecem duas brancas "knobs" e estará no "top" do cérebro nesta orientação. Usando a tesoura cirúrgica, segure o mesencéfalo no lugar e deslize a espátula pesando na brecha serentre os colículos e do neocórtex. Muito gentilmente, continue a deslizar a espátula para baixo e puxe o tronco cerebral / mesencéfalo / tálamo afastado revelando o interior do ventrículo lateral ea superfície medial do hipocampo. Use a borda afiada da espátula para cortar o fundo de saco sem problemas, um feixe de fibras brancas localizada na porção anterior / dorsal do hipocampo. Com a tesoura, gentilmente continuar a puxar o tronco cerebral / mesencéfalo / tálamo afastado completamente sem rasgá-la do resto do cérebro. O córtex com hipocampo deve agora lançar livremente para trás do tronco cerebral *. Em seguida, vire o estágio de dissecação de modo que você está olhando para o hipocampo eo córtex medial sobrejacente como se fosse um corte sagital (menos o tálamo). Você deve ver agora as fibras brancas fimbria que formam uma hipérbole rasas na parte inferior do hipocampo neste plano. Usando a pipeta de transferência de plástico, gentilmente esguicho ACSF alguns na abertura embaixo da fimbria para ajudar o hipocampo separada do córtex. Deslize suavemente a espátula para esta lacuna, de modo que o lado longo da espátula corre em paralelo com o longo eixo do hipocampo. Uma vez que a espátula está completamente sob o hipocampo, mantenha o tronco cerebral / mesencéfalo / tálamo firmemente com a tesoura e rolar a espátula longe de seu corpo para separar fisicamente o hipocampo do resto do cérebro. Uma vez que o hipocampo é livre, delicadamente aparar qualquer córtex restantes, vasos sanguíneos, e da substância branca. Colher uma pequena quantidade de ACSF piegas para o outro lado do palco de dissecação. Suavemente a posição do hipocampo ao lado da lama e apagar com alguns mililitros de ACSF usando a pipeta de transferência de plástico. Em seguida, remova o outro hemisfério e repita a dissecção.
* Você pode precisar a tesoura para cortar o tecido conjuntivo adicionais, substância branca, ou vasculatura que impede a separação do córtex do tronco cerebral. Os pontos de sua tesoura será muito perto do hipocampo, por isso não deixe para entregar snips muito precisas (tesoura afiada são um must).
3. A remoção do hipocampo do cérebro e dissecção em Aged Ratos transgênicos
- Eutanásia e decapitar o mouse e fazer uma incisão mediana no couro cabeludo, conforme descrito na seção 2.3. Os ratos têm crânios muito mais fino do que os ratos que simplifica muito a extração do cérebro. Cortando o crânio com uma tesoura é, portanto, desnecessário. Use rongeurs osso com mandíbulas menores (Tabela 2) a se afastar parietal, occipital, e placas de crânio temporal. Tal como acontece com o rato, lembre-se de usar movimentos controlados e firmemente puxe o maxilar inferior do fórceps na superfície interna do crânio e longe do cérebro à medida que você remove as placas. Uma vez que as placas são removidas, use a parte mais estreita da ferramenta do hipocampo para cortar demais nervos cranianos e colher o cérebro em gelada Ca 2 + livre ACSF.
- Prepare fatias de cérebro. Devido ao menor tamanho do cérebro do rato, dissecando o hipocampo pode ser um pouco mais difícil (embora certamente factível) do que usando ratos. Então, para facilitar as coisas, nós removemos o cerebelo e dicas rostral dos lobos frontais, mas não dissecar o hipocampo. Em vez disso, os hemisférios cerebrais são separados fisicamente com uma lâmina de bisturi e deixadas intactas para o seccionamento Vibratome (ver Secção 4 abaixo).
4. Tissue seção do cérebro em fatias usando um micrótomo vibratório (Vibratome) e Transferência à Holding Câmara *
- Encher o reservatório do Vibratome com gelado Ca 2 + livre ACSF, de tal forma que o estágio de corte e lâmina são completamente submersas. Para a tomada de fatias de rato, corte as pontas rostral e caudal de cada hipocampo com uma lâmina de bisturi. Estes cortes irá permitir que você posicione verticalmente o hipocampo juntos como duas colunas. Isso funciona melhor se o giro denteado do hipocampo é de cada um diante do outro e CA3 regiões são orientadas na mesma direção. Para fazer fatias mouse, verticalmente a posição de cada hemisfério em estreita colaboração com lobos frontais virados para baixo. Cola de tecido cerebral em um bloco de montagem e transferência para o estágio de corte do Vibratome. Normalmente, prepare ~ 400 seções uM para experimentos fisiologia sináptica. Cortes mais finos devem estar preparados, se fluorescentes imagem será realizado (por exemplo, investigações de Ca 2 + e os níveis de transientes). Colete fatias com uma pipeta de boca larga ou um pincel # e transferir para um pequena placa de Petri contendo gelada Ca 2 + livre ACSF.
* O uso de um dano Vibratome minimiza às superfícies superior e inferior da fatia e é definitivamente recomendado para estudos que necessitem de análise de células perto da superfície fatia (por exemplo, grampo de tensão e Ca 2 + estudos de imagem). No entanto, alternativas mais baratas estão disponíveis e adequados para a geração de fatias para experimentos fisiologia extracelular. Temos utilizado um helicóptero gravidade controlada pequena 2,11 e um Chopper Tissue McIlwain 12 com bom êxito. Para this procedimento hipocampos são colocadas em um palco e seccionados com um helicóptero vertical. Um pincel é usado para transferir as fatias (uma de cada vez) para segurar um prato cheio de pequenas gelada Ca 2 + livre ACSF. Um problema com essa abordagem é que o hipocampo pode se mover entre costeletas resultando em seções irregulares. Além disso, ter o cuidado de remover como substância branca muito, e especialmente como vasculatura muito, quanto possível antes de cortar. Este material vai ficar com o pincel, a lâmina de barbear, ou ambos, tornando a transferência fatia muito difícil e aumentando a probabilidade de alongamento ou danificar o tecido.
# Ao usar uma escova, procure descansar a fatia de comprimento sábio em todo o cerdas. Envolvendo a fatia em torno da ponta do pincel pode causar tecido desnecessário alongamento. - Transferência de fatias do cérebro para a câmara de exploração onde são banhadas em Ca 2 + oxigenada contendo ACSF. Aos poucos, trazer a temperatura da câmara de 27 ° a 32 ° C (1 º a cada cinco minutos). Permitir fatias para incubar por 1-1,5 h antes dos experimentos eletrofisiológicos.
5. Suscitar e Record CA3-CA1 Responses Synaptic
- Para básica gravações extracelular em fatias aguda, sua estação de eletrofisiologia terá de incluir *: uma câmara de gravação, um sistema de perfusão; um microscópio com> capacidade de ampliação de 4X; gravação, estimulante, e eletrodos de terra; macro e micromanipuladores, uma rígida vibração-resistente de mesa e gaiola de Faraday, um estimulador, amplificador e analógico-digital (A / D) conversor; osciloscópio (de preferência) e PC com software de aquisição de pessoal apropriado.
* Kerr Scientific Instruments oferece um fantástico e barato sistema de eletrofisiologia (ou seja, o Sistema de Gravação Kerr tecido) para realizar uma variedade de experimentos de eletrofisiologia básica fatia. Este sistema tem uma pegada pequena, estimuladores portáteis e amplificadores, e pode ser usado em um padrão de laboratório banco-sem a necessidade de uma gaiola de Faraday volumosos.
É claro, fatias do cérebro também pode ser usado para a realização de inúmeras técnicas elaboradas eletrofisiológicos e de imagem, que vai exigir equipamentos adicionais e materiais. Por exemplo, a nossa estação de eletrofisiologia principal contém um amplificador com tensão e corrente de fixação rápida capacidades, um sistema de iluminação fluorescente, e uma câmera digital. Esta estação é utilizada para gravações de campo extracelular em fatias do cérebro, bem como patch-clamp gravações e de imagens fluorescentes em fatias e culturas de células 3,12,13. Ver Tabela 3 para obter uma listagem completa de equipamentos e componentes. - Com uma pipeta de boca larga ou pincel pequeno, de transferência de uma ou mais fatias para a câmara de gravação * permitindo que ele se adapte por 10-15 min antes do estímulo / gravação. Para os nossos estudos, as fatias estão submersos na ACSF e descansar em redes inserido em uma câmara de RC-22 pela Warner Instruments (ver Figura 3). ACSF é a gravidade-alimentado através de um regulador para ajustar o fluxo de taxa, e pré-aquecido a 32 ° C por uma linha micro-aquecedor antes de chegar à câmara de gravação. A linha de aspiração central é usado para remover ASCF.
* Muitas variedades diferentes de submersíveis e câmaras de interface de estilo de gravação estão disponíveis comercialmente. Temos observado que exibem fatias mais robusto respostas sinápticas em uma câmara de interface (fatia ou seja senta-se uma interface com o ar umidificado e ACSF) 2,11. No entanto, responsividade é geralmente mais estável quando fatias são submersos em ACSF. Perfusão de drogas também é mais eficiente em câmaras de submersão. - Posição estimulante e eletrodos de registro. Com o isolador estimulador ou estímulo ligado, mas de saída marcado para baixo a 0, a posição de um eletrodo estimulante sobre a fatia na região radiatum estrato de CA2, perto da fronteira CA3 (ver Figura 4). Nós usamos um fio de platina irídio torcida para entregar 5-10 uS pulsos bifásico para CA3 garantia Schaffer (SC) fibras. O uso de fio de platina irídio e pulsos bifásico pode ajudar a polarização do eletrodo minimizado. Menores de um eletrodo de gravação em CA1 estrato radiatum, apenas quebrar a superfície da fatia. Nosso eletrodo de registro é um fio de Ag / AgCl em uma ACSF cheio de vidro micropipeta (resistência de ponta de ~ 7 mohms). Ligue a saída do estimulador até um nível moderado (nós colocamos nossos isolador estímulo para ~ 150 mA) e começar a administrar pulsos de estímulo e aquisição de atividade utilizando o software de aquisição, tais como Clampex da Axon Instruments, Inc. Abaixe lentamente o eletrodo estimulando em pequenas intervalos de até uma artificact estímulo é registrado em CA1. Em seguida, continuar a abaixe lentamente ambos os eletrodos estimulantes e gravação em intervalos ao adquirir CA1 respostas até o vôlei de fibra (FV) eo potencial excitatório pós-sináptico (EPSP) amplitudes atingir níveis máxima (ver Figura 4B).
- Estabelecer uma curva de força sináptica e investigar a plasticidade sináptica. Para gerar uma curva de força sináptica, entregar pulsos estímulo para SC em intensidades cada vez maiores e th registroe atividade de correspondente no CA1. A faixa eo número de níveis de intensidade de estímulo utilizado pode variar, mas deve ser suficiente para gerar uma curva sigmoidal quando plotados contra qualquer FV ou valores EPSP (Figura 5). A amplitude FV fornece uma estimativa confiável da proporção de fibras pré-sinápticas ativadas, enquanto a inclinação EPSP fornece uma medida pura do monossináptico CA3-CA1 correntes. Plotagem a inclinação EPSP contra a FV em níveis de intensidade de estímulo, portanto, reflete o tamanho da EPSP por número de aferentes ativado e fornece uma estimativa excelente de CA3-CA1 força sináptica. Normalmente, os níveis de força sináptica são significativamente reduzidos em CA1 área de ratos idosos e APP/PS1 ratos, em relação a ratos jovens e de mesma faixa etária do tipo selvagem camundongos por exemplo, ver 4,14.
- Fatias que mostram sinais de má saúde (ou seja, uma amplitude máxima EPSP <1 mV) ou hiperexcitabilidade (isto é, o aparecimento de dois ou mais picos de população) durante a curva de força sináptica são excluídos da análise estatística (ver Figura 4C). Descobrimos que essas fatias raramente apresentam respostas estável através de um período de 60 min e / ou mostrar as respostas altamente variável após a indução da plasticidade sináptica. Merece destacar que "fatias insalubres" representam apenas cerca de 10-20% de todas as fatias transferidos para a câmara de gravação. Além disso, em nossa experiência, a freqüência de identificação de uma fatia saudável é muito semelhante em toda a idade, espécie e genótipo.
- Induzir a potenciação de longa duração (LTP) ou depressão a longo prazo (LTD) em fatias. LTP e LTD são aumenta duração (LTP) e diminui (LTD), em função sináptica em resposta a diferentes padrões de ativação sináptica. Ambos os processos são amplamente acreditado para refletir mecanismos críticos para o aprendizado e memória15 e fornecer medidas de resultados úteis para a investigação de mecanismos celulares de disfunção neural e / ou para avaliar estratégias farmacológicas para amenizar os déficits de memória e neurodegeneração 16.
Para experimentos plasticidade sináptica, redefinir a intensidade do estímulo para todas as fatias de 1 * mV e começar a estimulação de base a uma freqüência de 0,033 Hz. Valores EPSP inclinação deve ser estável durante pelo menos 20 min antes da indução de LTP ou LTD. Acompanhar de perto EPSPs durante este tempo e redefinir a intensidade do estímulo se a inclinação varia mais de 10% e começar uma nova linha de base. Induzir LTP usando um trem de um segundo estímulo de 100 Hz ou múltiplas rajadas curtas (~ 10 pulsos) de 100 Hz a estimulação dada a cada 200 ms. Para a indução LTD, entregar 900 pulsos de estímulo a uma taxa de 1 Hz. Após a indução da LTP ou LTD, coletar respostas sinápticas para um 60 min adicionais ou mais. Valores inclinação EPSP obtidas antes e 60 min após a alta / baixa freqüência de estimulação são comparados para determinar a presença de LTP ou LTD.
Ratos idosos e APP/PS1 ratos tendem a mostrar LTP deficiente e maior LTD (ver Figura 5), e essas mudanças têm sido sugeridos para contribuir para a cognição prejudicada nestes modelos animais 6,16. No entanto, ao contrário APP/PS1 camundongos, as mudanças na LTP / LTD em ratos idosos são variáveis entre laboratórios. Ratos idosos geralmente apresentam níveis semelhantes LTP em comparação com adultos em resposta a "intensa" estimulação (ou seja, 100 Hz), mas os défices mostram mais brandas quando os parâmetros de estimulação são usados (ou seja, freqüências mais baixas estímulo ou menos pulsos de estímulo) (para revisão ver 4,6, 16). Além disso, alguns laboratórios, incluindo o nosso, têm observado aumento da susceptibilidade à indução de LTD em ratos idosos 2,17-19, enquanto outros grupos não encontraram nenhuma diferença ou susceptibilidade reduzida em seus animais de idade. Como discutido brevemente a seguir (ver discussão), diferenças sutis, mas crítica em protocolo experimental pode explicar essas discrepâncias.
* A intensidade de estimulação e amplitude EPSP pode influenciar a indução LTP e pode ser uma causa importante de resultados discrepantes na literatura. Esta questão será analisada mais detalhadamente na seção Discussão.
6. Resultados representante
Nosso trabalho, eo trabalho de outros grupos, sugere que as mudanças no astrócito baseado sinalização inflamatória podem desencadear e / ou acelerar a disfunção neurológica durante o envelhecimento e AD 13,20,21. Recentemente, temos usado a força sináptica, LTP e LTD como medidas de desfecho para investigar a eficácia e os mecanismos de ação de vários novos medicamentos anti-inflamatórios reagentes em meados de idade APP/PS1 camundongos (22 para ver descrição deste modelo) e com idades entre Fischer 344 ratos. Os resultados apresentados a seguir foram obtidas utilizando os protocolos descritos neste artigo.
Um dos novos anti-inflamatórios viral adeno-associado (AAV) reagentes desenvolvidos por nosso laboratório tem sido demonstrado em estudos-piloto para aumentar significativamente a força sináptica (p <0,05) e evitar déficits LTP (p <0,05) na meia-idade (16 meses de idade) APP/PS1 camundongos (n = 4-6 fatias por condição de tratamento). Representante sináptica curvas de força e experimentos LTP de duas fatias diferentes, collected do mouse de 16 meses de idade, mesmo APP/PS1, são mostrados na Figura 5A-C. Uma fatia foi extraído do hemisfério tratados com nosso romance AAV (Reagente A), enquanto outra fatia foi tratado com um reagente de controlo AAV (Control). LTP foi induzida em ambas as fatias com dois trens 1 seg de 100 Hz de estimulação (10 seg intertrain intervalo). Note que a curva de força sináptica para o reagente A-tratados fatia é deslocado para a esquerda da fatia de controle, indicativo de maior força sináptica. Observe também que, típico de meia-idade APP/PS1 camundongos, LTP deteriorado rapidamente a linha de base na fatia de controle (por exemplo, 23). Por outro lado, LTP decadente pouco na fatia tratados com reagente de nosso romance.
Em um segundo estudo recente, observamos LTD significativo em ratos tratados com veículo com idade (85% da linha de base pré-LTD, p <0,05). Em contraste, não LTD foi observado em ratos idosos tratados com o romance anti-inflamatório "Drogas A" (97% dos pré-LTD linha de base, não significativo). Nenhum efeito de drogas na força sináptica foram observados. Experimentos representante LTD deste conjunto de dados (n = 8-10 ratos por grupo) estão ilustrados na Figura 5D-F.
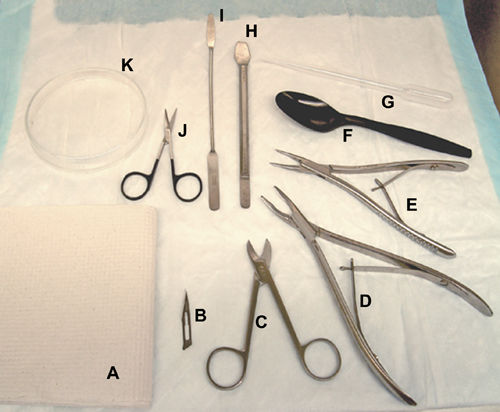
Figura 1. Ferramentas e materiais utilizados para a dissecação do cérebro. A toalha de papel,. B, lâmina de bisturi. C, Beebee tesoura. D, fórceps óssea (para ratos). E, fórceps óssea (para camundongos / ratos). F, colher de plástico. G, pipeta de plástico. H, ferramenta do hipocampo. I, espátula. J, tesouras cirúrgicas. K, placa de Petri de vidro.

Figura 2. Fatia do cérebro personalizado segurando câmara. Macrochamber A,. B, tampa. C, H 2 O reservatório com tubo de silicone perfurado. D, MicroChamber. E, ACSF tubo de entrega (polietileno). F, O tubo de entrada 2. G, porta para controle de temperatura. H, insira MicroChamber saldada.

Figura 3. RC22 câmara de submersão. A câmara de Gravação,. B, eletrodo de aterramento. C, a agulha de aspiração.

Figura 4. Ilustração fatia do hipocampo e formas de onda extracelular. Um dos desenhos animados, de uma seção transversal do hipocampo utilizados em experimentos de eletrofisiologia. CA = cornu Ammonis. DG giro denteado =. SC = colaterais Schaffer. S = radiatum estrato radiatum. B, a estimulação elétrica do SC (a CA3 axônio trato) provoca um artefato de estímulo, seguido quase imediatamente por um aumento da população pré-sináptica, ou vôlei de fibra (FV). A amplitude da FV é diretamente proporcional ao número de fibras SC ativado. A inclinação da fase negativa contínua do campo potencial excitatório pós-sináptico (EPSP) corresponde diretamente à ativação de correntes de despolarização sináptica em neurônios piramidais CA1 em resposta ao glutamato liberação dos terminais, SC. C, sobreposição de formas de onda representante extracelular registrado em CA1 estrato radiatum em resposta a estímulo nove níveis diferentes de intensidade (3-50 mA) em uma "saudável" (painel esquerdo), "não saudáveis", e fatia "hiper". Cinco formas de onda foram em média por nível. Fatias saudável responder de forma dinâmica em toda esta gama de estímulos e exibem uma única positiva curso população pico (refletindo CA1 descarga neuronal) nos níveis mais elevados de estímulo. Na câmara RC22 submersão, EPSPs máxima normalmente variam entre 1,5 e 3 mV em amplitude. Fatias insalubres (painel do meio), muitas vezes exibem um FV grande, mas um pequeno EPSP máxima (<1 mV) e, geralmente, mostram plasticidade pobres. Fatias hiperexcitável (painel direito) mostram dois ou mais picos de população regenerativa no ramo ascendente da EPSP. Respostas em fatias hiperexcitável são freqüentemente lábeis e são variavelmente afetados pela LTD / LTP estimulação.

Figura 5. Experimentos realizados representante eletrofisiologia em fatias aguda de meia-idade (16 meses) APP/PS1 ratos e idade (22 meses) Fisher 344 ratos. Painéis de dados coletados de AB mostrar APP/PS1 camundongos tratados com um controle adeno-associados (AAV) viral construção (Control) ou um reagente AAV romance (Reagente A) que tem sido desenvolvido pelo nosso grupo de laboratório. Em relação à fatia de controle, a fatia tratados com Reagente A apresenta uma mudança acentuada para a esquerda na EPSP: FV curva (A) indicativo de maior força sináptica. A fatia Reagente-A-tratados também mostra LTP robusto e estável (B) após a entrega de dois 1 seg, 100 trens de estímulo Hz, enquanto a fatia de controle exibe LTP deficiente, típico deste modelo animal. Painéis DF dados mostram coletados a partir de duas individuais ratos idosos que receberam crônica (4 semanas) perfusões intrahippocampal de veículo ou de uma droga anti-inflammatory romance (droga A). Força sináptica basal foi relativamente pouco afetado pelo tratamento de drogas(D). No entanto, a droga A foi muito eficaz na prevenção da indução de LTD (E). Painéis C e F mostram representante EPSP waveforms gravado a partir de fatias individuais antes (pré) e 60 min após (pós) a entrega de LTP / LTD estimulação. Note-se que artefatos de estímulo não são mostradas.
Discussão
Os passos descritos neste protocolo vai ajudar a garantir que dissecações do cérebro são realizadas pelo menos tão rapidamente e eficientemente em idosos, como em ratos adultos jovens. Nós também fornecemos detalhes suficientes para o iniciante a criarem a sua própria fatia estudos sobre LTP e LTD. Se uma maior exploração do envelhecimento e as mudanças AD em função sináptica e plasticidade é um dos seus objetivos, existem pelo menos duas outras questões metodológicas, aludido acima, que merecem análise mais aprofundada. Primeiro, vários laboratórios têm mostrado que o Ca 2 +: Mg2 + taxa em gravação ACSF pode ter um efeito marcante sobre a plasticidade sináptica indução em fatias do hipocampo 2,10,24,25. CSF em mamíferos, o Ca 2 +: Mg2 + taxa é de aproximadamente um (por exemplo, ver 26). No entanto, ACSF Ca 2 +: Mg2 + taxas mais próximas a 2 são comumente usados em estudos fatia de função sináptica e plasticidade. Nos primeiros estudos, esta prática foi provavelmente adaptado para otimizar a indução da LTP e, posteriormente tornou-se rotina para todos os estudos de plasticidade. No entanto, esta prática pode ser problemático em estudos de envelhecimento e AD por causa das diferenças bem caracterizadas em Ca 2 neuronal regulação +. Especificamente, Ca 2 + fluxo e / ou Ca 2 + induzida por Ca 2 +-lançamento é elevada em ratos idosos e / ou camundongos modelo AD durante a ativação neuronal 3,27-31. Indução de LTD é particularmente sensível a mudanças sutis na ACSF Ca 2 + níveis. Nosso protocolo, que usa 2mM Ca 2 + e 2 mM Mg2 +, geralmente resulta em LTD para idosos, mas não jovens animais adultos 2, enquanto que estudos usando um Ca 2 +: Mg2 + relação próxima dos dois, observaram LTD robusta em adultos no ausência de uma diferença de idade 2,10 ou em conjunto com LTD reduzidos em ratos de 32 anos. Estas observações evidenciam a necessidade de considerar cuidadosamente ACSF Ca 2 + e Mg 2 + quando se comparam os níveis de Ca 2 + dependentes de plasticidade em animais adultos idosos e jovens.
A segunda questão metodológica diz respeito à forte dependência da LTP na despolarização pós-sináptica 33 e possíveis envelhecimento / genótipo diferenças na força sináptica. Em um experimento de LTP típica, linha de base e LTP a intensidade do estímulo é geralmente ajustada para produzir uma meia máxima (ou três quartos máxima) amplitude EPSP. O problema potencial é que os ratos idosos e APP/PS1 ratos geralmente mostram redução da força sináptica em relação aos seus colegas mais jovens tipo e / ou selvagens, o que significa que os valores EPSP base também será menor em ratos idosos e APP/PS1 camundongos. EPSPs menores podem traduzir para menos despolarização durante a estimulação LTP, resultando em uma menor probabilidade de induzir LTP 33. Devido a isso confundir potencial, é difícil determinar se esses animais apresentam um déficit de transmissão, o déficit de plasticidade, ou ambos. Ou seja, mecanismos de indução de LTP em idade e / ou APP/PS1 ratos podem ser funcionalmente intacto (sem déficit de plasticidade), mas insuficientemente estimuladas (déficit throughput) nessas condições. Esta distinção é fundamental, como mecanismos de transferência e os mecanismos de plasticidade podem responder de forma muito diferente a um tratamento farmacológico específico. Tentamos minimizar o impacto da vazão reduzida na indução de LTP através da normalização da amplitude EPSP ao mesmo nível (por exemplo, 1 mV) em todas as fatias anterior à estimulação LTP. Outras estratégias podem ser eficazes, bem como (por exemplo, utilização de tensão ou pinça de corrente para igualar o potencial de membrana entre os grupos durante a estimulação LTP), e devem ser considerados quando se investiga LTP nestes modelos animais.
Divulgações
Agradecimentos
Trabalho apoiado pelo NIH conceder AG027297, um prêmio do Cabo de Kentucky e Confiança Spinal Injury Research cabeça, e um presente da Fundação Kleberg.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| NaCl | Pescador | BP358-1 | |
| KCl | Pescador | BP366-500 | |
| KH 2 PO 4 (monossódico) | Sigma | P5379-100G | |
| MgSO 4 | Sigma | M2643-500G | |
| CaCl 2 (di) | Sigma | C3306-250G | |
| NaHCO 3 | Pescador | S233-500 | |
| C 6 H 12 O 6 (dextrose) | Pescador | BP350-1 |
Reagentes tabela 1. Necessárias
| Nome do equipamento | Companhia | Número de catálogo | Comentários |
| Erlenmeyers | Pescador | FB-500-2000 FB-500-1000 | |
| Aquarium Bubbler | Usado para oxigenar mídia. Disponíveis na maioria das lojas de animais | ||
| 50 copo de vidro mL | Pescador | 02-540g | Para storarge cérebro em ACSF |
| Parafilm | Pescador | 13-374-10 | |
| Guilhotina de Pequenos Animais | Mundial Precision Instruments (WPI) | DCAP-M | |
| Toalha de papel plano | |||
| # Feather lâmina cirúrgica 11 | Pescador | 08-916-5B | |
| Beebee osso tesoura | Multa Ferramentas da Ciência (FST) | 16044-10 | |
| Lempert Rongeurs | Roboz | RS-8321 | Use para ratos |
| Friedman-Pearson Rongeurs | FST | 16020-14 | Use para camundongos ou ratos |
| Ferramenta hipocampo | FST | 10099-15 | |
| Colher | Uma colher de chá vai fazer plástica | ||
| Espátula | Pescador | 21-401-25A | Espátula |
| Cirúrgica da íris tesoura | FST | 14058-09 | |
| plástico pipetas de transferência | Pescador | 13-711-43 | |
| 110 milímetros de papel de filtro Whatman | Pescador | 09-805E | Whatman cat. 1001-110 |
| Placa de Petri de vidro | Pescador | ||
| Leica VT1000P manual vibratório micrótomo | Vibratome | ||
| Lâmina de 0,1 milímetros FA-10 Feather S | Ted Pella | 121-9 | Lâmina de 0,1 milímetros FA-10 Feather S |
| Vidro borosilicato Pipetar Pasteur (com bulbo de borracha) | Pescador | 13-678-20A | Para a transferência de fatias: Dica está quebrado e calor polida para maior abertura |
| 35 prato de Cultura milímetros Polysterine | Corning | 430588 | Utilizado para a recolha de cortes após a dissecção |
Tabela 2. Ferramentas e materiais para dissecção
| Equipamentos / materiais | Companhia | Comentários (opcional) |
| Segurando câmara | Custom Built | |
| P-97 Horizontal Pipetar Puller | Sutter Instrument Co. | |
| Mesa de isolamento de vibração | Técnico Manufacturing Corporation (TMC) | |
| Gaiola de Faraday | Personalizado construído | |
| Pyrex Garrafa Aspirador com Sidearm Inferior (Produto # 1220-1E) | Corning | |
| Gravidade contolled set IV com regulador (Produto # 2C8891) | Baxter | |
| Linha de Aspiração Central | Disponível na maioria dos laboratórios modernos | |
| 95% O 2 / 5% CO 2 Gas Mix | Escocêst-Gross Co. | |
| TygonTM tubulação Lab Para O 2 / CO 2 de entrega | Fisher Scientific | Não-tóxica, não-oxidantes, vem em uma variedade de tamanhos. |
| Microscópio Eclipse E600FN | Nikon | com os objetivos de 10x e 40x, perto do filtro infared e GFP, DS-Red2 filtros |
| Legal snap ES Câmera Digital | Fotométricos | Legal snap ES Câmera Digital |
| X-Cite Iluminador Fluorescente | EXFO | X-Cite Iluminador Fluorescente |
| Plataforma microscópio | Siskiyou | Personalizado montado |
| RC-22 submersíveis de gravação da câmara (Produto # 64-0228) | Warner Instruments (WI) | Requer P-1 adaptador de plataforma e palco (Produto # 64-0277 De Warner) |
| TC2BIP controlador de temperatura 2/3Ch | Microcontrols celular | TC2BIP controlador de temperatura 2/3Ch |
| 4 Axis manipulador Miniature manual | Siskiyou | |
| Fio de platina Iridium (0,002 in) (Item # PTT0203) | WPI | |
| A365 Isolator Stimulus | WPI | A365 Isolator Stimulus |
| Multiclamp Amplificador 700B | Axon Instruments | |
| Digidata 1322A conversor A / D | Axon Instruments | |
| Software PClamp | Axon Instruments | |
| Computador pessoal (Pentium 4) | Dell |
Tabela 3. Eletrofisiologia equipamentos e materiais
Referências
- Norris, C. M., Halpain, S., Foster, T. C. Alterations in the balance of protein kinase/phosphatase activities parallel reduced synaptic strength during aging. J Neurophysiol. 80, 1567-1570 (1998).
- Norris, C. M., Korol, D. L., Foster, T. C. Increased susceptibility to induction of long-term depression and long-term potentiation reversal during aging. J Neurosci. 16, 5382-5392 (1996).
- Norris, C. M. Hippocampal 'zipper' slice studies reveal a necessary role for calcineurin in the increased activity of L-type Ca(2+) channels with aging. Neurobiol Aging. 31, 328-338 (2010).
- Burke, S. N., Barnes, C. A. Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161 (2010).
- Foster, T. C. Calcium homeostasis and modulation of synaptic plasticity in the aged brain. Aging Cell. 6, 319-325 (2007).
- Foster, T. C., Norris, C. M. Age-associated changes in Ca(2+)-dependent processes: relation to hippocampal synaptic plasticity. Hippocampus. 7, 602-612 (1997).
- Thibault, O., Gant, J. C., Landfield, P. W. Expansion of the calcium hypothesis of brain aging and Alzheimer's disease: minding the store. Aging Cell. 6, 307-317 (2007).
- Demuro, A., Parker, I., Stutzmann, G. E. Calcium signaling and amyloid toxicity in Alzheimer disease. J Biol Chem. 285, 12463-12468 (2010).
- Green, K. N., LaFerla, F. M. Linking calcium to Abeta and Alzheimer's disease. Neuron. 59, 190-194 (2008).
- Kumar, A., Thinschmidt, J. S., Foster, T. C., King, M. A. Aging effects on the limits and stability of long-term synaptic potentiation and depression in rat hippocampal area CA1. J Neurophysiol. 98, 594-601 (2007).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of age-related alterations in synaptic plasticity by blockade of L-type Ca2+ channels. J Neurosci. 18, 3171-3179 (1998).
- Norris, C. M., Scheff, S. W. Recovery of afferent function and synaptic strength in hippocampal CA1 following traumatic brain injury. J Neurotrauma. 26, 2269-2278 (2009).
- Sama, M. A. Interleukin-1beta-dependent signaling between astrocytes and neurons depends critically on astrocytic calcineurin/NFAT activity. J Biol Chem. 283, 21953-21964 (2008).
- Ye, H., Jalini, S., Mylvaganam, S., Carlen, P. Activation of large-conductance Ca(2+)-activated K(+) channels depresses basal synaptic transmission in the hippocampal CA1 area in APP (swe/ind) TgCRND8 mice. Neurobiol Aging. 31, 591-604 (2010).
- Bear, M. F., Malenka, R. C. Synaptic plasticity: LTP and LTD. Curr Opin Neurobiol. 4, 389-399 (1994).
- Foster, T. C. Involvement of hippocampal synaptic plasticity in age-related memory decline. Brain Res Brain Res Rev. 30, 236-249 (1999).
- Foster, T. C., Kumar, A. Susceptibility to induction of long-term depression is associated with impaired memory in aged Fischer 344 rats. Neurobiol Learn Mem. 87, 522-535 (2007).
- Hsu, K. S. Alterations in the balance of protein kinase and phosphatase activities and age-related impairments of synaptic transmission and long-term potentiation. Hippocampus. 12, 787-802 (2002).
- Vouimba, R. M., Foy, M. R., Foy, J. G., Thompson, R. F. 17beta-estradiol suppresses expression of long-term depression in aged rats. Brain Res Bull. 53, 783-787 (2000).
- Abdul, H. M., Furman, J. L., Sama, M. A., Mathis, D. M., Norris, C. M. NFATs and Alzheimer's Disease. Mol Cell Pharmacol. 2, 7-14 (2010).
- Abdul, H. M. Cognitive decline in Alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling. J Neurosci. 29, 12957-12969 (2009).
- Anantharaman, M. Beta-amyloid mediated nitration of manganese superoxide dismutase: implication for oxidative stress in a APPNLH/NLH X PS-1P264L/P264L double knock-in mouse model of Alzheimer's disease. Am J Pathol. 168, 1608-1618 (2006).
- Gengler, S., Hamilton, A., Holscher, C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 5, e9764-e9764 (2010).
- Stringer, J. L., Lothman, E. W. In vitro effects of extracellular calcium concentrations on hippocampal pyramidal cell responses. Exp Neurol. 101, 132-146 (1988).
- Landfield, P. W., Pitler, T. A., Applegate, M. D. The effects of high Mg2+-to-Ca2+ ratios on frequency potentiation in hippocampal slices of young and aged rats. J Neurophysiol. 56, 797-811 (1986).
- Ames, A. 3rd, Sakanoue, M., Endo, S. NA, K, CA, MG, AND C1 CONCENTRATIONS IN CHOROID PLEXUS FLUID AND CISTERNAL FLUID COMPARED WITH PLASMA ULTRAFILTRATE. J Neurophysiol. 27, 672-681 (1964).
- Gant, J. C., Sama, M. M., Landfield, P. W., Thibault, O. Early and simultaneous emergence of multiple hippocampal biomarkers of aging is mediated by Ca2+-induced Ca2+ release. J Neurosci. 26, 3482-3490 (2006).
- Thibault, O., Hadley, R., Landfield, P. W. Elevated postsynaptic [Ca2+]i and L-type calcium channel activity in aged hippocampal neurons: relationship to impaired synaptic plasticity. J Neurosci. 21, 9744-9756 (2001).
- Thibault, O., Landfield, P. W. Increase in single L-type calcium channels in hippocampal neurons during aging. Science. 272, 1017-1020 (1996).
- Stutzmann, G. E., Caccamo, A., LaFerla, F. M., Parker, I. Dysregulated IP3 signaling in cortical neurons of knock-in mice expressing an Alzheimer's-linked mutation in presenilin1 results in exaggerated Ca2+ signals and altered membrane excitability. J Neurosci. 24, 508-513 (2004).
- Stutzmann, G. E. Enhanced ryanodine receptor recruitment contributes to Ca2+ disruptions in young, adult, and aged Alzheimer's disease mice. J Neurosci. 26, 5180-5189 (2006).
- Lee, H. K., Min, S. S., Gallagher, M., Kirkwood, A. NMDA receptor-independent long-term depression correlates with successful aging in rats. Nat Neurosci. 8, 1657-1659 (2005).
- McNaughton, B. L., Douglas, R. M., Goddard, G. V. Synaptic enhancement in fascia dentata: cooperativity among coactive afferents. Brain Res. 157, 277-293 (1978).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados