Method Article
Preparazione di acuta fettine di ippocampo di ratti e topi transgenici per lo studio delle alterazioni sinaptiche durante l'invecchiamento e Amiloide Patologia
In questo articolo
Riepilogo
Questo articolo descrive le procedure per la preparazione di fettine di ippocampo di ratti e topi transgenici per lo studio delle alterazioni sinaptiche associate con l'invecchiamento cerebrale e le malattie neurodegenerative legate all'età, come la malattia di Alzheimer.
Abstract
L'ippocampo preparazione fetta roditore è forse lo strumento più largamente utilizzato per lo studio dei mammiferi funzione sinaptica e la plasticità. L'ippocampo può essere estratto rapidamente e facilmente da ratti e topi e fette rimangono vitali per ore in ossigenato artificiale liquido cerebrospinale. Inoltre, le tecniche di base electrophysisologic sono facilmente applicati allo studio di funzione sinaptica in fettine di ippocampo e hanno fornito alcuni dei migliori marcatori di disturbi cognitivi. La fetta ippocampo è particolarmente popolare per lo studio dei meccanismi di plasticità sinaptica coinvolti nell'apprendimento e nella memoria. Cambiamenti nella induzione di potenziamento a lungo termine e la depressione (LTP e LTD) di efficacia sinaptica in fettine di ippocampo (o la loro mancanza) sono spesso usate per descrivere il fenotipo neurologico di animali con problemi cognitivo e / o per valutare il meccanismo d'azione di composti nootropica. Questo articolo descrive le procedure che utilizziamo per la preparazione di fettine di ippocampo di ratti e topi transgenici per lo studio delle alterazioni sinaptiche del cervello associata con l'invecchiamento e la malattia di Alzheimer (AD) 1-3. Uso dei ratti anziani e topi modello AD può presentare una serie di sfide per i ricercatori abituati ad usare i ratti più giovani e / o topi nelle loro ricerche. Ratti anziani hanno spesso teschi e più dura del tessuto connettivo più giovani ratti e topi, che può ritardare l'estrazione del cervello e / o di dissezione e di conseguenza negare o esagerare reali differenze età-correlate in funzione sinaptica e la plasticità. Invecchiamento e patologia amiloide può anche aggravare i danni subiti dell'ippocampo durante la procedura di dissezione, di nuovo complicando ogni deduzioni tratte dalla valutazione fisiologica. Qui, discutiamo i passi compiuti durante la procedura di dissezione per minimizzare questi problemi. Esempi di risposte sinaptiche acquisite in "buona salute" e "malsana" fette di ratti e topi vengono forniti, oltre che rappresentante esperimenti di plasticità sinaptica. L'eventuale impatto di altri fattori metodologici sulla funzione sinaptica in questi modelli animali (ad esempio i componenti della soluzione di registrazione, i parametri di stimolazione) vengono anche discussi. Mentre l'attenzione di questo articolo è l'utilizzo di ratti anziani e topi transgenici, i novizi di tagliare fisiologia dovrebbe trovare abbastanza dettagli qui per iniziare i propri studi, utilizzando una varietà di modelli di roditori.
Protocollo
1. Preparazione ghiaccio freddo ossigenati fluido cerebrospinale artificiale (ACSF)
- Preparare 2 L di "Ca 2 +-free" ACSF. In una beuta 2L, aggiungere circa 1,5 L di sterile o bidistillata H 2 O, e iniziare a mescolare vigorosamente su un piatto mescolare. Aggiungere i seguenti componenti ACSF (in mm): 124 NaCl, 2 KCl, 1,25 KH 2 PO 4, 2 MgSO 4, 26 NaHCO 3, e 10 destrosio (vedi tabella 1). Portare ad un volume di 2 L con acqua distillata H 2 O.
- Utilizzando un gorgogliatore acquario e tubo collegato a una% O 95 2 / 5% CO 2 serbatoio d'aria, ACSF ossigenare energicamente per circa 20-30 min. Controllare il pH e, se necessario, regolare a 7,4 con NaOH o HCl.
- Versare 750 mL di Ca 2 + ossigenato senza ACSF in una beuta a parte, coprire l'apertura con parafilm, e il trasferimento ad un ultrafreezer (-80 ° C) per 20-30 minuti. Questo supporto sarà utilizzata per la dissezione di fettine di ippocampo cervello e acuto *. Aggiungere 2 mM CaCl 2 per il restante 1,25 litri di volume di ACSF #, mescolare bene, e riprendere l'ossigenazione con il 95% O 2 / 5% di CO 2. Questo supporto sarà utilizzato per la memorizzazione di sezioni di cervello dopo dissezioni e per la perfusione fette durante le registrazioni elettrofisiologiche.
* Ice-freddo Ca 2 + libero mezzi di comunicazione viene utilizzata per rallentare il metabolismo e ridurre al minimo Ca 2 +-dipendente eccitotossicità durante la dissezione.
# Variazioni Ca 2 + disregolazione durante l'invecchiamento e AD possono avere un impatto importante sulla induzione di Ca 2 +-dipendente plasticità sinaptica 4-9. Notizie contrastanti sulle differenze di età a LTD può essere in parte attribuibile all'uso di differenti ACSF Ca 2 +: Mg2 + rapporti durante le registrazioni fetta (vedi 2,4,10). L'importanza di Ca 2 + regolamento e Ca 2 + ACSF livello negli studi di invecchiamento è affrontato in maggiore dettaglio nella sezione di discussione. - Mentre il Ca 2 +-free ACSF è il congelamento, preparare una camera di holding per il mantenimento di fette di cervello prima e durante le registrazioni elettrofisiologiche *. Noi usiamo una consuetudine macro-holding camera che contiene quattro microchambers individuali (vedi Figura 2). Il macrochamber è pieno di sterile, ossigenata H 2 O e la microchambers sono essenzialmente isole che sporgono sopra la superficie dell'acqua. All'interno di ogni microchamber, fette di riposare sugli inserire compensate in una pozza poco profonda di ACSF ossigenato. Fette non sono completamente sommerse, ma sedersi ad un'interfaccia con l'aria umidificata. Un elemento riscaldante isolato all'interno del macrochamber permette la regolazione della temperatura.
* Molte varietà di camere di partecipazione sono anche disponibili in commercio (es. Warner Instruments fa un immersione in stile "Pre Camera # BSC-PC) e dovrebbe essere adatto per l'uso in invecchiamento e transgenici studi fetta del mouse. In un pizzico, fette può essere mantenuta per diverse ore in una piccola scatola di Petri riempite con ACSF. Fai un piccolo foro nel coperchio di Petri di un tubo di erogazione di ossigeno. Fare attenzione a che le bolle di ossigeno non fisicamente agitare le fette. Slice ottenere l'ossigeno sufficiente se il tubo di erogazione si alza di poco sopra la superficie ACSF (dispersione di gas dovrebbe causare una rientranza della superficie del liquido).
2. Cervello di rimozione e dissezione ippocampale in Aged (> 20 mesi di età-ratti)
- * Preparare la zona dissezione accanto a un dissipatore di grandi dimensioni (vedi Figura 1 e Tabella 2). Inserire una ghigliottina piccolo animale nel lavandino e lay out strumenti chirurgici e materiali per la rimozione del cervello e la dissezione dell'ippocampo tra cui un tovagliolo di carta piegato, un # 11 bisturi, forbici BEEBEE, Rongeurs osso, uno "strumento Hippocampus" (una spatola specializzata doppio da Belle strumenti chirurgici), piccole forbici chirurgiche, un sottile doppio attacco spatola di plastica pipetta Pasteur, 110 mm di diametro del filtro di carta Whatman, un piatto di vetro con coperchio 100 millimetri Petri riempite con ghiaccio e un cucchiaio di plastica. Anche tenere un sacchetto di plastica vicino per lo smaltimento della carcassa.
Cervello * estrazione dovrebbe essere completato nel più breve tempo possibile, quindi è una buona idea mentalmente "passeggiata" la procedura e laici tuoi strumenti nel modo di utilizzo. - Rimuovere Ca 2 + senza ACSF dal congelatore. Media dovrebbero essere parzialmente, non completamente, congelato. Versare circa 50 ml di ACSF in un bicchiere di vetro, coprire con Parafilm, e posto vicino alla zona dissezione. Questo supporto sarà utilizzato per memorizzare brevemente il cervello una volta che è stato rimosso. I restanti Ca 2 + senza mezzi saranno utilizzati per riempire il serbatoio in Vibratome per la preparazione fetta. Questo supporto può essere reoxygenated, o semplicemente coperto con parafilm e poste in frigorifero a 4 ° C.
- Euthanize il topo utilizzando metodi approvati dalla cura degli animali e del Comitato Istituzionale uso (IACUC). I nostri animali sono posti in una piccola camera in plexiglass che viene gradualmente riempito con il 100% di CO 2. Perdita di coscienza avviene generalmente entro cinque minuti ed è confermato dalla assenza di attività riflessaa seguito di un pizzico punta.
- Decapitare il ratto subito rostrale alla prima vertebra cervicale e posizionare la testa sul tovagliolo di carta piegato. Utilizzando il bisturi # 11, rapidamente fare un'incisione nel mezzo del cuoio capelluto di partenza nei pressi del osso nasale e la gestione caudalmente fino all'osso occipitale. Assicuratevi di tagliare completamente attraverso il muscolo cutanei, completamente esponendo le suture sulla superficie dorsale del cranio.
- Tagliare le piastre di coppia con le forbici BEEBEE. Nei ratti giovani e nel topo, il cranio può essere rapidamente rimosso con l'utilizzo di Rongeurs ossa da solo. Tuttavia, ratti anziani hanno spesso crani di giovani ratti adulti e topi che possono rendere difficile questa procedura. Abbiamo scoperto che il taglio attraverso il cranio facilita enormemente la rimozione ossea con Rongeurs, diminuisce lesioni al cervello, e fa risparmiare secondi preziosi. Con la testa del topo saldamente sul piano di lavoro, posto all'avanguardia della pura inferiore della forbice BEEBEE nella regione superiore del foro occipitale alla parte posteriore del cranio. Mantenere il puro inferiore fermamente contro la superficie interna del cranio (e lontano dal cervello) *, tagliare la piastra occipitale, e poi lungo la linea mediana sutura delle placche parietali. Procedere rostralmente fino a tagliare il cranio piastre frontali.
* E 'estremamente importante che la pressione è diretto lontano dal cervello per prevenire misurazione involontario. - Separare il occipitale, parietale, temporale e piastre cranio dal cervello. Continuare a tenere la testa saldamente al ripiano per la stabilità e la leva e far scorrere la mascella inferiore del Rongeurs sotto la pressione parietale sinistra piastra mantenendo contro la superficie interna del cranio. Avanti, stringere le mascelle del Rongeurs insieme e rotolare il polso verso l'alto e verso di sé per tirare il parietale e occipitale piatti lontano dal cervello. Questo dovrebbe esporre la maggior parte della superficie dorsale dell'emisfero sinistro. Se necessario, utilizzare il Rongeurs per rimuovere la placca frontale sinistra pure. Ripetere la procedura per l'altro emisfero. Una volta che i piatti sono sfollati, per verificare rapidamente qualsiasi questione dura che possono essere fissati alle piastre temporale e si estendeva su tutta la superficie del cervello. Estrarre con cautela questi via con il Rongeurs o tagliata con le forbici *. Ora, far scorrere la mascella superiore del Rongeurs tra il cervello e la piastra temporale destro, sempre mantenendo la pressione verso il cranio e lontano dal cervello. Premere e ruotare la piastra temporale lontano dal cervello. Dovreste sentire / sentire un "crunch", come si esegue questa operazione. Ripetere l'operazione per il lato sinistro.
* La durata può essere difficile da individuare, soprattutto se l'animale è stato transcardially perfusi con ACSF. Tuttavia, se dura non vengono rimossi, saranno fetta attraverso il cervello (e molto probabilmente l'ippocampo) come un rasoio, quando le piastre temporali vengono rimossi. Cattura la dura via vicino le piastre temporale ridurre al minimo la probabilità di pugnalare il cervello. - Estrarre il cervello *. Rimuovere rapidamente il parafilm dalla Ca 2 + senza ACSF "fangosa". Ora far scivolare la testa larga spatola dello strumento ippocampale tra la superficie ventrale del cervello e le piastre del cranio in basso fino a quando non è completamente sotto il cervello. Spostare la spatola lateralmente da lato a lato e poi in avanti e indietro un paio di volte a tagliare intatti i nervi cranici. Ora scoop il cervello con lo strumento ippocampale e sommergere di Ca 2 + senza ACSF e coprire con parafilm. Lasciate che il freddo cervello per circa un minuto. Questo è un momento opportuno per pulire la ghigliottina, smaltire la carcassa, e riorganizzare l'area dissezione.
* Per la procedura 2,3-2,7, la velocità è essenziale. Cerchiamo di completare questa procedura (dalla decapitazione al cervello immersione in ACSF) in 30-35 sec. Nella nostra esperienza, estrazioni prendendo più di un minuto sembra influenzare negativamente la salute dell'ippocampo fetta, soprattutto per i ratti anziani. Utilizzando queste procedure, abbiamo osservato alcuna differenza nei tempi di estrazione tra ratti anziani e giovani per i nostri studi. - Estrarre il dell'ippocampo. Posizionare la carta da filtro Whatman sul coperchio della gelida capsula di Petri e inumidire la carta con ACSF con la pipetta di plastica trasferimento. Recuperare il cervello dal ACSF con un cucchiaio e posizionare sulla carta inumidita Whatman. Usando il bisturi, rimuovere il cervelletto e circa un quarto dei lobi frontali rostrale. Eseguire il bisturi attraverso la fessura intrahemispheric di separare completamente i due emisferi. Posizionare un emisfero di nuovo nel fangosa ACSF e "stand" del backup di altri sul palco sezionare modo che il piano coronale del lobo frontale è rivolto verso il basso. Si dovrebbe chiaramente essere in grado di distinguere il tronco cerebrale e del cervello medio (che sono di colore bianco) dalla corteccia sovrastante (che è rosa / grigio). Individuare il collicoli superiore ed inferiore del mesencefalo; questi sarà simile a due bianche "manopole" e sarà al "top" del cervello in questo orientamento. Utilizzando le forbici chirurgiche Premere delicatamente il mesencefalo in posizione e scivolare la spatola pesa il divariotra i collicoli e la neocorteccia. Molto delicatamente, continuano a far scorrere la spatola verso il basso e tirare il tronco cerebrale / mesencefalo / talamo via rivelando l'interno del ventricolo laterale e la superficie mediale dell'ippocampo. Utilizzare il bordo tagliente della spatola per tagliare agevolmente il fornice, un fascio di fibre bianche situato nella porzione anteriore / dorsale dell'ippocampo. Con le forbici, delicatamente continuare a tirare il tronco cerebrale / mesencefalo / talamo via senza recidere completamente dal resto del cervello. La corteccia con ippocampo dovrebbe ora porre liberamente avanti dal tronco encefalico *. Poi, girare la scena dissezione in modo che si sta guardando l'ippocampo e la corteccia mediale sovrastante come se si trattasse di una sezione sagittale (meno il talamo). Ora dovreste vedere le fibre bianche fimbria che formano una iperbole superficiale in fondo l'ippocampo in questo piano. Utilizzando la pipetta in plastica trasferimento, delicatamente squirt alcuni ACSF nella fessura sotto la fimbria per separare l'ippocampo dalla corteccia. Far scorrere con la spatola in questo vuoto, in modo tale che il lato lungo della spatola corre parallela con l'asse lungo dell'ippocampo. Una volta che la spatola è completamente sotto l'ippocampo, tenere premuto il tronco cerebrale / mesencefalo / talamo saldamente con le forbici e ruotare la spatola dal corpo di separare fisicamente l'ippocampo dal resto del cervello. Una volta che l'ippocampo è libero, delicatamente troncare qualsiasi corteccia rimanenti, i vasi sanguigni, e la materia bianca. Scoop una piccola quantità di ACSF fangosa sul lato opposto del palcoscenico dissezione. Delicatamente l'ippocampo posizione accanto al fango e bagnare con pochi millilitri di ACSF con la pipetta di plastica trasferimento. Quindi, rimuovere l'altro emisfero e ripetere la dissezione.
* Potrebbe essere necessario le forbici per tagliare via supplementare del tessuto connettivo, della sostanza bianca, o vascolare che impedisce la separazione della corteccia dal tronco encefalico. I punti del vostro forbici sarà molto vicino a l'ippocampo, in modo da essere sicuri di fornire tagli molto precisi (forbici affilate sono un must).
3. Cervello di rimozione e dissezione ippocampale in invecchiato topi transgenici
- Eutanasia e decapitare il mouse e fare una incisione sulla linea mediana del cuoio capelluto, come descritto nella sezione 2.3. Topi hanno crani molto più sottile rispetto ai ratti che semplifica notevolmente l'estrazione del cervello. Taglio attraverso il cranio con le forbici è quindi necessaria. Usa Rongeurs osso con minore mascelle (Tabella 2) a tirare fuori occipitale, parietale, temporale e piastre cranio. Come con il topo, ricordatevi di usare movimenti controllati e con fermezza tirare la mascella inferiore del Rongeurs nella superficie interna del cranio e lontano dal cervello, come si rimuovono i piatti. Una volta che i piatti vengono rimossi, utilizzare l'estremità più stretta dello strumento ippocampale di tagliare ancora i nervi cranici e scoop del cervello in ghiacciato Ca 2 + senza ACSF.
- Preparare fettine di cervello. A causa delle dimensioni ridotte del cervello del mouse, sezionare il ippocampi può essere un po 'più impegnativo (anche se certamente fattibile) rispetto a quando si utilizzano topi. Così, per facilitare le cose, togliamo il cervelletto e suggerimenti rostrale del lobo frontale, ma non sezionare il dell'ippocampo. Invece, gli emisferi cerebrali sono fisicamente separati con una lama di bisturi e lasciato intatto per il sezionamento Vibratome (vedi sezione 4).
4. Sezione di tessuto cerebrale a fette con un microtomo vibrante (Vibratome) e trasferimento a Holding Camera *
- Riempire il serbatoio del Vibratome con gelida Ca 2 + senza ACSF, in modo che la fase di taglio e la lama sono completamente sommerse. Per fare fette ratto, tagliare le punte rostrale e caudale di ogni dell'ippocampo con una lama di bisturi. Questi tagli vi permetterà di posizionare in verticale il dell'ippocampo a stretto contatto come due colonne. Questo funziona meglio se il giro dentato dell'ippocampo è di ogni uno di fronte all'altro e CA3 regioni sono orientate nella stessa direzione. Per fare fette del mouse, in verticale la posizione di ogni emisfero stretta collaborazione con i lobi frontali verso il basso. Colla tessuto cerebrale su un blocco di montaggio e trasferimento allo stadio sezionamento del Vibratome. Noi di solito preparare ~ 400 sezioni uM per esperimenti di fisiologia sinaptica. Sezioni più sottili devono essere preparati, se fluorescente immagini saranno condotte (ad esempio, indagini di Ca 2 + livelli e transitori). Raccogliere le fette con una bocca larga pipetta o un pennello # e trasferirli in un piccolo piatto di Petri contenente ghiacciata Ca 2 + senza ACSF.
* L'utilizzo di un danno Vibratome minimizza le superfici superiori ed inferiori della fetta ed è decisamente consigliata per studi che richiedono l'analisi di cellule in prossimità della superficie slice (ad esempio tensione morsetto e Ca 2 + studi di imaging). Tuttavia, sono disponibili alternative più economiche e adatte per la generazione di fette per esperimenti di fisiologia extracellulare. Abbiamo usato una piccola gravità controllato chopper 2,11 e un Chopper tessuto McIlwain 12 con buon successo. Per this procedura dell'ippocampo sono disposti su un messo in scena e sezionato con un elicottero verticale. Un pennello è usato per trasferire fette (uno alla volta) per un piatto piccola azienda pieno di ghiaccio-freddo Ca 2 + senza ACSF. Un problema con questo approccio è che il dell'ippocampo possibile spostarsi tra braciole con conseguente sezioni irregolari. Inoltre, fare attenzione a rimuovere il più materia bianca, e soprattutto come vascolarizzazione molto, come possibile prima di tagliare. Questo materiale si attacchi al pennello, la lama di rasoio, o entrambi, rendendo il trasferimento fetta molto difficile e aumentando la probabilità di stiramento o di danneggiare il tessuto.
# Quando si utilizza un pennello, cerca di riposare le fette nel senso della lunghezza tra le setole. Avvolgere la fetta attorno la punta del pennello può causare inutili tessuto stretching. - Trasferimento fettine di cervello alla camera di un'azienda in cui sono immersi a loro ossigenato Ca 2 + contenenti ACSF. Gradualmente portare la temperatura della camera da 27 ° a 32 ° C (+1 ° ogni cinque minuti). Lasciare fette di incubare per 1-1,5 ore prima esperimenti elettrofisiologici.
5. Suscitare e Record CA3-CA1 Risposte Synaptic
- Di base per le registrazioni extracellulari a fette acuta, la stazione di elettrofisiologia avrà bisogno di includere *: una camera di registrazione, un sistema di perfusione, un microscopio con capacità di ingrandimento> 4X; registrazione, stimolante, e gli elettrodi di terra, macro e micromanipolatori, un rigido resistente alle vibrazioni da tavolo e di gabbia di Faraday, uno stimolatore, amplificatore e analogico-digitale (A / D); oscilloscopio (preferibilmente) e PC personale con software di acquisizione appropriata.
* Kerr Scientific Instruments offre un fantastico sistema di elettrofisiologia ed economico (cioè il sistema del tessuto Kerr registrazione) per lo svolgimento di una serie di esperimenti di base elettrofisiologia fetta. Questo sistema ha un ingombro ridotto, stimolatori portatili e amplificatori, e può essere utilizzato su uno standard di laboratorio banco senza la necessità di una gabbia di Faraday ingombranti.
Naturalmente, fettine di cervello può essere utilizzato anche per eseguire numerose tecniche elaborate elettrofisiologiche e di imaging, che richiederà ulteriori attrezzature e materiali. Per esempio, la nostra stazione principale di elettrofisiologia contiene un amplificatore con veloce tensione e corrente-clamp funzionalità, un sistema di illuminazione a fluorescenza, e una fotocamera digitale. Questa stazione è utilizzata per le registrazioni di campo extracellulare in fettine di cervello, così come patch-clamp registrazioni e immagini fluorescenti a fette e colture cellulari 3,12,13. Vedere la Tabella 3 per una lista completa di attrezzature e componenti. - Usando una pipetta a bocca larga o pennello piccolo, trasferire una o più sezioni per la camera di registrazione * permettendogli di acclimatare per 10-15 minuti prima della stimolazione / registrazione. Per i nostri studi, le fette sono immersi in ACSF e poggiano su rete inserito in una camera-22 RC da Warner Instruments (vedi figura 3). ACSF di gravità alimentato attraverso un regolatore per regolare portata e preriscaldata a 32 ° C da una linea di micro-riscaldamento prima di raggiungere la camera di registrazione. Una linea di vuoto centrale viene utilizzato per rimuovere ASCF.
* Molte varietà differenti di sommergibili e l'interfaccia in stile camere di registrazione sono disponibili in commercio. Abbiamo osservato che presentano risposte sinaptiche fette più robuste in una camera di interfaccia (cioè fetta siede a un'interfaccia con aria umidificata e ACSF) 2,11. Tuttavia, responsività è generalmente più stabile quando le fette sono immersi in ACSF. Perfusione farmaco è anche più efficiente in camere di immersione. - Posizione stimolante e registrazione elettrodi. Con l'isolatore stimolatore o stimolo acceso, ma in uscita effettuate fino a 0, la posizione di un elettrodo stimolante sulla fetta della regione strato radiatum di CA2 vicino al confine CA3 (vedi Figura 4). Usiamo un filo intrecciato di platino iridio per fornire impulsi di 50-100 uS bifasico di CA3 collaterali Schaffer (SC) delle fibre. L'uso del filo di platino iridio e legumi bifasico può aiutare la polarizzazione degli elettrodi ridotto al minimo. Abbassare un elettrodo di registrazione in CA1 strato radiatum, proprio rompendo la superficie della fetta. Il nostro elettrodo di registrazione è un Ag / AgCl filo ACSF in un bicchiere con micropipetta (resistenza alla punta del ~ 7 MΩ). Accendere l'output sullo stimolatore fino ad un livello moderato (abbiamo impostato il nostro isolatore stimolo a ~ 150 mA) e iniziare a gestire gli impulsi di stimolo e l'acquisizione di attività utilizzando il software di acquisizione, come CLAMPEX da Axon Instruments, Inc. Abbassare lentamente l'elettrodo stimolante in piccoli intervalli fino a artificact stimolo è registrato in CA1. Quindi, continuare ad abbassare lentamente entrambi gli elettrodi di stimolazione e registrazione ad intervalli durante l'acquisizione CA1 risposte fino a quando il volley in fibra (FV) e il potenziale postsinaptico eccitatorio (EPSP) ampiezze raggiungere livelli di massima (vedi Figura 4B).
- Costruire una curva di forza sinaptica e indagare la plasticità sinaptica. Per generare una curva di forza sinaptica, fornire impulsi di stimolo alla SC ad intensità sempre maggiore e registrare °e corrispondente attività in CA1. La gamma e il numero di livelli di intensità dello stimolo utilizzate possono variare, ma dovrebbe essere sufficiente a generare una curva sigmoidale in fase di stampa contro l'uno o FV o valori EPSP (Figura 5). L'ampiezza FV fornisce una stima attendibile della percentuale di fibre presinaptiche attivato, mentre la pendenza EPSP fornisce una misura incontaminata monosinaptico CA3-CA1 correnti. Tracciando la pendenza EPSP contro il FV tra i vari livelli di intensità stimolo riflette quindi le dimensioni della EPSP per numero di afferenze attivato e fornisce una stima eccellente di CA3-CA1 forza sinaptica. Tipicamente, i livelli di forza sinaptica sono significativamente ridotti in zona CA1 di ratti anziani e APP/PS1 topi, rispetto ai ratti giovani e di pari età topi wild-type vedi ad esempio 4,14.
- Fette che mostrano segni di cattiva salute (cioè un'ampiezza massima EPSP <1 mV) o ipereccitabilità (cioè la comparsa di 2 o più picchi di popolazione) durante la curva di forza sinaptica sono esclusi dalle analisi statistiche (figura 4). Abbiamo scoperto che queste fette raramente mostrano risposte stabile attraverso un periodo di 60 min e / o mostrare le risposte molto variabili a seguito di induzione della plasticità sinaptica. Merita notare che "fette malsano" costituiscono solo circa il 10-20% di tutte le sezioni trasferiti alla camera di registrazione. Inoltre, nella nostra esperienza, la frequenza di identificazione di un malsano fetta è molto simile per età, specie e genotipo.
- Indurre il potenziamento a lungo termine (LTP) o depressione a lungo termine (LTD) a fette. LTP e LTD sono aumenti duraturi (LTP) e diminuisce (LTD), in funzione sinaptica in risposta a diversi pattern di attivazione sinaptica. Entrambi i processi sono ampiamente considerato un riflesso dei meccanismi fondamentali per l'apprendimento e memory15 e fornire misure di esito utili per lo studio dei meccanismi cellulari della disfunzione neuronale e / o per la valutazione strategies farmacologico per ameliorating deficit di memoria e neurodegeneration 16.
Per gli esperimenti plasticità sinaptica, ripristinare l'intensità stimolo per tutte le sezioni a 1 * mV e iniziare la stimolazione basale a una frequenza di 0,033 Hz. Valori di pendenza EPSP deve essere stabile per almeno 20 minuti prima della induzione di LTP o LTD. Monitorare attentamente EPSPS durante questo periodo e azzerare l'intensità stimolo se la pendenza oscilla più del 10% e iniziare una nuova linea di base. Indurre LTP con un secondo treno di 100 Hz stimolazione o più brevi (~ 10 impulsi) di 100 Hz stimolazione dato ogni 200 ms. Per l'induzione LTD, consegnare 900 impulsi di stimolo ad una velocità di 1 Hz. Dopo l'induzione di LTP o LTD, raccogliere le risposte sinaptiche per altri 60 minuti o più. Valori di pendenza EPSP ottenuti prima e dopo 60 minuti ad alta / bassa frequenza di stimolazione vengono confrontati per determinare la presenza di LTP o LTD.
Ratti anziani e APP/PS1 topi tendono a mostrare carenti LTP e LTD maggiore (vedi figura 5), e questi cambiamenti sono stati proposti di contribuire a disturbi cognitivi in questi modelli animali 6,16. Tuttavia, a differenza APP/PS1 topi, i cambiamenti in LTP / LTD in ratti anziani sono variabili tra laboratori. Ratti anziani in genere presentano livelli LTP simili rispetto agli adulti in risposta a "intenso" (cioè 100 Hz) stimolazione, ma il deficit mostrare quando i parametri di stimolazione più lievi vengono utilizzati (cioè frequenze stimolo inferiore o impulsi di stimolo meno) (per una rassegna vedi 4,6, 16). Inoltre, alcuni laboratori, compreso il nostro, hanno osservato una maggiore suscettibilità ad induzione LTD in ratti anziani 2,17-19, mentre altri gruppi hanno trovato alcuna differenza o ridotta sensibilità nei loro animali di età. Come discusso brevemente di seguito (vedi discussione), differenze sottili ma fondamentali per protocollo sperimentale può tenere conto di queste discrepanze.
* L'intensità di stimolazione e l'ampiezza EPSP possono influenzare l'induzione LTP e può essere una causa importante di risultati discrepanti in letteratura. La questione sarà esaminata ulteriormente nella sezione di discussione.
6. Rappresentante Risultati
Il nostro lavoro, e il lavoro di altri gruppi, suggerisce che i cambiamenti in astrociti-infiammatori a base di segnalazione può scatenare e / o accelerare disfunzione neurologica durante l'invecchiamento e AD 13,20,21. Recentemente, abbiamo usato la forza sinaptica, LTP e LTD come misure endpoint per valutare l'efficacia e meccanismi di azione di diversi nuovi agenti anti-infiammatori reattivi a metà di età compresa tra APP/PS1 topi (v. 22 per la descrizione di questo modello) e di età compresa tra Fischer 344 ratti. I risultati forniti di seguito sono stati ottenuti utilizzando i protocolli descritti in questo articolo.
Uno dei nuovi agenti anti-infiammatori virale adeno-associato (AAV) reagenti sviluppato dal nostro laboratorio è stato dimostrato in studi pilota per aumentare significativamente la forza sinaptica (p <0,05) e prevenire i deficit LTP (p <0,05) a metà anni (16 mesi di età) APP/PS1 topi (n = 4-6 fette per condizione di trattamento). Rappresentante curve forza sinaptica e sperimentazioni LTP da due fette diverse, collperturbato dalla stessa di 16 mesi del mouse APP/PS1, sono mostrati nella Figura 5A-C. Una fetta è stato estratto dalle dell'emisfero trattati con AAV nostro romanzo (Reagente A), mentre l'altra fetta è stata trattata con un reagente di controllo AAV (Control). LTP è stato indotto in entrambe le fette con due treni 1 sec di 100 Hz stimolazione (10 sec intertrain intervallo). Si noti che la curva di forza sinaptica per il reagente A-trattati fetta è spostato a sinistra della fetta di controllo, indicativo di una maggiore forza sinaptica. Si noti inoltre che, tipico per la metà di età compresa tra APP/PS1 topi, LTP decadde rapidamente ai valori basali nella fetta di controllo (ad esempio 23). Al contrario, LTP decaduto poco la fetta trattati con i nostri reagente romanzo.
In un secondo studio recente, abbiamo osservato significative LTD in veicoli trattati ratti anziani (85% di pre-LTD basale, p <0,05). Al contrario, LTD non è stata osservata nei ratti anziani trattati con il romanzo "Un farmaco" anti-infiammatori (97% delle pre-LTD basale, non significativo). Nessun effetto della droga sulla forza sinaptica sono stati osservati. Rappresentante esperimenti LTD da questo insieme di dati (n = 8-10 ratti per gruppo) sono illustrati nella Figura 5D-F.
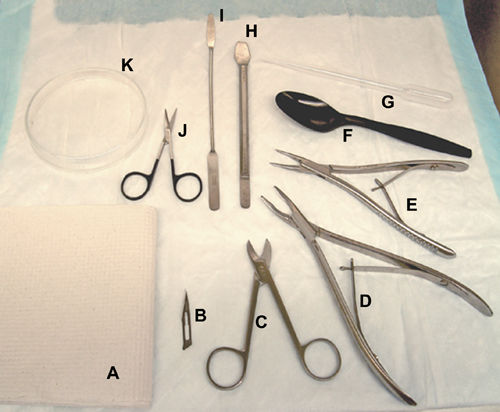
Figura 1. Strumenti e materiali utilizzati per la dissezione del cervello. Un fazzoletto di carta. B, lama di bisturi. C, forbici Beebee. D, Rongeurs ossea (per i ratti). E, Rongeurs ossea (per i topi / ratti). F, cucchiaio di plastica. G, pipetta di trasferimento di plastica. H, strumento ippocampale. Io, spatola. J, forbici chirurgiche. K, il vetro capsula di Petri.

Figura 2. Fetta cervello personalizzati tenendo da camera. A, macrochamber. B, coperchio. C, H 2 O serbatoio con un tubo in silicone traforato. D, microchamber. E, ACSF consegna tubo (polietilene). F, O 2 tubo di erogazione. G, porta per il controllo della temperatura. H, inserire microchamber compensate.

Figura 3. RC22 camera di immersione. A, camera di registrazione. B, elettrodo di terra. C, ago aspirazione.

Figura 4. Fetta illustrazione dell'ippocampo e forme d'onda extracellulare. A, Cartoon di una sezione trasversale dell'ippocampo usati negli esperimenti di elettrofisiologia. CA = Cornu Ammonis. DG = giro dentato. SC = collaterali Schaffer. S = radiatum strato radiatum. B, la stimolazione elettrica del SC (un CA3 assone tratto) suscita un artefatto di stimolo, seguito quasi immediatamente da un picco di popolazione presinaptico, o volley in fibra (FV). L'ampiezza di FV è direttamente proporzionale al numero di fibre SC attivata. La pendenza della fase negativa in corso del potenziale eccitatorio postsinaptico campo (EPSP), corrisponde direttamente alla attivazione di depolarizzante correnti sinaptiche in neuroni piramidali CA1 in risposta al rilascio di glutammato dai terminali SC. C, sovrapposizione delle forme d'onda rappresentante extracellulare registrati in CA1 strato radiatum in risposta a nove diversi livelli di intensità dello stimolo (3-50 mA) in un "sano" (riquadro a sinistra), "malsano", e fetta "ipereccitabilità". Cinque forme d'onda sono stati in media per ogni livello. Fette sano rispondere dinamicamente tutta questa gamma di stimolo e mostrano un unico positivo in corso popolazione picco (che riflette CA1 scarica neuronale) ai livelli di stimolo maggiore. Nella camera RC22 sommersione, EPSPS massima di solito variano da 1,5 a 3 mV in ampiezza. Fette malsano (pannello centrale) spesso mostrano un grande FV, ma un piccolo EPSP massima (<1 mV) e di solito mostrano plasticità poveri. Fette ipereccitabili (pannello di destra) mostrano due o più picchi popolazione rigenerativa nel tratto ascendente della EPSP. Le risposte a fette ipereccitabili sono spesso labili e sono variabilmente affetti da LTD / LTP stimolazione.

Figura 5. Rappresentante esperimenti di elettrofisiologia eseguite su fette acuta da metà anni (16 mos) APP/PS1 topi e invecchiato (22 mos) Fisher 344 ratti. Pannelli AB dati mostrano raccolti da APP/PS1 topi trattati con un controllo adeno-associato (AAV) virale costruzione (Control) o un romanzo AAV reagente (reagente A) che è stato sviluppato dal nostro gruppo di laboratorio. Rispetto alla fetta di controllo, la fetta trattati con Reagente A mostra un marcato spostamento verso sinistra nel EPSP: FV curva (A), indicativo di una maggiore forza sinaptica. La fetta Reagente-A-trattati mostra anche LTP robusto e stabile (B) dopo la consegna di due 1 sec, 100 treni stimolo Hz, mentre la fetta di controllo mostre LTP carente, tipiche di questo modello animale. Pannelli DF dati mostrano raccolti da due ratti di età compresa tra i singoli che hanno ricevuto cronica (4 settimane) perfusione intrahippocampal di veicolo o di un romanzo anti-infiammatori farmaci (Drug A). Basale forza sinaptica è stata relativamente inalterata a trattamento farmacologico(D). Tuttavia, un farmaco molto efficace nel prevenire l'induzione di LTD (E). Pannelli C e F mostrano rappresentante forme d'onda EPSP registrati da singole sezioni prima (pre) e 60 minuti dopo (post) la fornitura di LTP / LTD stimolazione. Si noti che gli artefatti stimoli non vengono visualizzati.
Discussione
La procedura descritta in questo protocollo aiuterà ad assicurare che dissezioni del cervello sono effettuati almeno più rapidamente ed efficacemente in età, come nei ratti adulti giovani. Inoltre fornisce dettagli sufficienti per il principiante di stabilire la loro fetta propri studi su LTP e LTD. Se ulteriori esplorazioni di invecchiamento e le modifiche dC in funzione sinaptica e la plasticità è uno dei vostri obiettivi, ci sono almeno due altre questioni metodologiche, accennato sopra, che meritano ulteriore considerazione. In primo luogo, molti laboratori hanno dimostrato che il Ca 2 +: Mg2 + in rapporto registrazione ACSF può avere un effetto marcato sulla plasticità sinaptica induzione in fettine di ippocampo 2,10,24,25. Nel liquor dei mammiferi, il Ca 2 +: Mg2 + rapporto è di circa un (vedi ad esempio 26). Tuttavia, ACSF Ca 2 +: Mg2 + rapporto più vicino al 2 sono comunemente utilizzati negli studi fetta di funzione sinaptica e della plasticità. Nei primi studi, questa pratica era probabilmente adattato per ottimizzare l'induzione di LTP, poi successivamente è diventato di routine per tutti gli studi plasticità. Tuttavia, questa pratica può essere problematico in studi di invecchiamento e dC a causa delle differenze ben caratterizzato in neuronale Ca 2 + regolamento. In particolare, Ca 2 + afflusso e / o Ca 2 + indotto da Ca 2 +-release è elevato in ratti anziani e / o topi modello dC durante l'attivazione neuronale 3,27-31. Induzione di LTD è particolarmente sensibile ai cambiamenti sottili ACSF Ca 2 + livelli. Il nostro protocollo, che utilizza 2mM Ca 2 + e 2 mM Mg2 +, comunemente risultati LTD per anziani, ma non animali giovani adulti 2, mentre gli studi con un Ca 2 +: Mg2 rapporto + vicino a due, hanno osservato LTD robusto negli adulti in assenza di una differenza di età 2,10 o in combinazione con LTD ridotto nei ratti di 32 anni. Queste osservazioni evidenziano la necessità di considerare attentamente ACSF Ca 2 + e Mg2 + quando si confrontano livelli di Ca 2 +-dipendente plasticità in animali adulti anziani e giovani.
Il secondo problema metodologico riguarda la forte dipendenza della LTP in depolarizzazione postsinaptica 33 e possibile l'invecchiamento / genotipo differenze nella forza sinaptica. In un esperimento tipico LTP, al basale e l'intensità di stimolazione LTP è generalmente regolata per produrre una mezza massimo (o di tre quarti massima) EPSP ampiezza. Il problema potenziale è che ratti anziani e APP/PS1 topi di solito mostrano una ridotta forza sinaptica rispetto alle loro controparti più giovani tipo e / o selvatici, il che significa che i valori basali EPSP sarà anche più piccolo in ratti anziani e APP/PS1 topi. Piccoli EPSPS può tradurre a meno depolarizzazione durante la stimolazione LTP, con un conseguente probabilità ridotta per indurre LTP 33. A causa di questo potenziale confondere, è difficile stabilire se questi animali presentano un deficit di produttività, un deficit di plasticità o entrambi. Cioè, i meccanismi di induzione LTP in età e / o APP/PS1 topi possono essere funzionalmente intatta (nessun deficit di plasticità), ma non sufficientemente stimolato (deficit di throughput) in queste condizioni. Questa distinzione è fondamentale, come i meccanismi di velocità e meccanismi di plasticità può rispondere in modo molto diverso a un determinato trattamento farmacologico. Cerchiamo di minimizzare l'impatto di throughput ridotto sull'induzione LTP normalizzando l'ampiezza EPSP allo stesso livello (ad esempio 1 mV) in tutte le sezioni prima di stimolazione LTP. Altre strategie possono essere efficaci anche (ad esempio l'uso di tensione o corrente pinza per equalizzare il potenziale di membrana tra i gruppi durante la stimolazione LTP), e deve essere considerata nell'ambito delle indagini sulla LTP in questi modelli animali.
Divulgazioni
Riconoscimenti
Lavoro sostenuto da NIH concedere AG027297, un premio dal Kentucky Spinal Cord Injury e fiducia capo della ricerca, e un dono da parte della Fondazione Kleberg.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | |
| NaCl | Pescatore | BP358-1 | |
| KCl | Pescatore | BP366-500 | |
| KH 2 PO 4 (monobasico) | Sigma | P5379-100G | |
| MgSO 4 | Sigma | M2643-500G | |
| CaCl 2 (diidrato) | Sigma | C3306-250G | |
| NaHCO 3 | Pescatore | S233-500 | |
| C 6 H 12 O 6 (destrosio) | Pescatore | BP350-1 |
Reagenti Tabella 1. Necessaria
| Nome del materiale | Azienda | Numero di catalogo | Commenti |
| Beute | Pescatore | FB-500-2000 FB-500-1000 | |
| Acquario Bubbler | Utilizzati per i media ossigenante. Disponibile nella maggior parte negozi di animali | ||
| 50 ml di vetro bicchiere | Pescatore | 02-540g | Per storarge cervello in ACSF |
| Parafilm | Pescatore | 13-374-10 | |
| Animali piccola ghigliottina | Mondo Strumenti di precisione (WPI) | DCAP-M | |
| Tovagliolo di carta piatto | |||
| # 11 Feather lama chirurgica | Pescatore | 08-916-5B | |
| Beebee osso forbici | Strumenti Scienza Fine (FST) | 16044-10 | |
| Lempert Rongeurs | Roboz | RS-8321 | Utilizzare per i ratti |
| Friedman-Pearson Rongeurs | FST | 16020-14 | Da utilizzare per topi o ratti |
| Hippocampus strumento | FST | 10099-15 | |
| Cucchiaio | Un cucchiaino di plastica farà | ||
| Spatola | Pescatore | 21-401-25A | Spatola |
| Iris forbici chirurgiche | FST | 14058-09 | |
| pipette di trasferimento di plastica | Pescatore | 13-711-43 | |
| 110 millimetri filtro di carta Whatman | Pescatore | 09-805E | Cat Whatman. 1001-110 |
| Vetro scatola di Petri | Pescatore | ||
| Leica VT1000P manuale vibrante microtomo | Vibratome | ||
| 0,1 millimetri FA-10 Feather S lama | Ted Pella | 121-9 | 0,1 millimetri FA-10 Feather S lama |
| Pipettare Pasteur in vetro borosilicato (con gommino) | Pescatore | 13-678-20A | Per il trasferimento di fette: Tip è rotto e il calore-lucido per le più grandi di apertura |
| Piatto 35 millimetri Cultura Polysterine | Corning | 430588 | Utilizzati per la raccolta fette dopo la dissezione |
Strumenti tabella 2. E materiali per la dissezione
| Attrezzature / Materiali | Azienda | Commenti (opzionale) |
| Tenendo camera | Custom Built | |
| P-97 orizzontale pipette Puller | Sutter Instrument Co. | |
| Isolamento dalle vibrazioni tavolo | Tecnico Manufacturing Corporation (TMC) | |
| Gabbia di Faraday | Su misura | |
| Pirex Bottiglia Aspiratore con Sidearm inferiore (Product # 1220-1L) | Corning | |
| Gravità contolled serie IV con regolatore (Product # 2C8891) | Baxter | |
| Vuoto Central Line | Disponibile nella maggior parte dei laboratori moderni | |
| 95% O 2 / 5% di CO 2 Mix Gas | Scozzeset-Gross Co. | |
| TygonTM Lab tubi Per O 2 / CO 2 di consegna | Fisher Scientific | Non tossico, non ossidanti, è disponibile in una varietà di formati. |
| Eclipse E600FN Microscopio | Nikon | con obiettivi 10x e 40x, vicino infared filtro, e GFP, DS-Rosso2 filtri |
| Raffreddare ES Snap Digital Camera | Fotometrici | Raffreddare ES Snap Digital Camera |
| X-Cite Illuminatore fluorescente | EXFO | X-Cite Illuminatore fluorescente |
| Microscopio Piattaforma | Siskiyou | Assemblati su misura |
| RC-22 sommergibili camera di registrazione (Product # 64-0228) | Warner Instruments (WI) | Richiede P-1 adattatore piattaforma e lo stadio (Product # 64-0277 da Warner) |
| TC2BIP 2/3Ch Regolatore di temperatura | Cellula Microcontrols | TC2BIP 2/3Ch Regolatore di temperatura |
| 4 assi manuale manipolatore in miniatura | Siskiyou | |
| Filo di platino iridio (0,002 in) (Articolo # PTT0203) | WPI | |
| A365 Stimolo isolatore | WPI | A365 Stimolo isolatore |
| Multiclamp Amplificatore 700B | Axon Instruments | |
| Digidata 1322A convertitore A / D | Axon Instruments | |
| PClamp software | Axon Instruments | |
| Personal Computer (Pentium 4) | Conca |
Tabella 3. Elettrofisiologia attrezzature e materiali
Riferimenti
- Norris, C. M., Halpain, S., Foster, T. C. Alterations in the balance of protein kinase/phosphatase activities parallel reduced synaptic strength during aging. J Neurophysiol. 80, 1567-1570 (1998).
- Norris, C. M., Korol, D. L., Foster, T. C. Increased susceptibility to induction of long-term depression and long-term potentiation reversal during aging. J Neurosci. 16, 5382-5392 (1996).
- Norris, C. M. Hippocampal 'zipper' slice studies reveal a necessary role for calcineurin in the increased activity of L-type Ca(2+) channels with aging. Neurobiol Aging. 31, 328-338 (2010).
- Burke, S. N., Barnes, C. A. Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161 (2010).
- Foster, T. C. Calcium homeostasis and modulation of synaptic plasticity in the aged brain. Aging Cell. 6, 319-325 (2007).
- Foster, T. C., Norris, C. M. Age-associated changes in Ca(2+)-dependent processes: relation to hippocampal synaptic plasticity. Hippocampus. 7, 602-612 (1997).
- Thibault, O., Gant, J. C., Landfield, P. W. Expansion of the calcium hypothesis of brain aging and Alzheimer's disease: minding the store. Aging Cell. 6, 307-317 (2007).
- Demuro, A., Parker, I., Stutzmann, G. E. Calcium signaling and amyloid toxicity in Alzheimer disease. J Biol Chem. 285, 12463-12468 (2010).
- Green, K. N., LaFerla, F. M. Linking calcium to Abeta and Alzheimer's disease. Neuron. 59, 190-194 (2008).
- Kumar, A., Thinschmidt, J. S., Foster, T. C., King, M. A. Aging effects on the limits and stability of long-term synaptic potentiation and depression in rat hippocampal area CA1. J Neurophysiol. 98, 594-601 (2007).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of age-related alterations in synaptic plasticity by blockade of L-type Ca2+ channels. J Neurosci. 18, 3171-3179 (1998).
- Norris, C. M., Scheff, S. W. Recovery of afferent function and synaptic strength in hippocampal CA1 following traumatic brain injury. J Neurotrauma. 26, 2269-2278 (2009).
- Sama, M. A. Interleukin-1beta-dependent signaling between astrocytes and neurons depends critically on astrocytic calcineurin/NFAT activity. J Biol Chem. 283, 21953-21964 (2008).
- Ye, H., Jalini, S., Mylvaganam, S., Carlen, P. Activation of large-conductance Ca(2+)-activated K(+) channels depresses basal synaptic transmission in the hippocampal CA1 area in APP (swe/ind) TgCRND8 mice. Neurobiol Aging. 31, 591-604 (2010).
- Bear, M. F., Malenka, R. C. Synaptic plasticity: LTP and LTD. Curr Opin Neurobiol. 4, 389-399 (1994).
- Foster, T. C. Involvement of hippocampal synaptic plasticity in age-related memory decline. Brain Res Brain Res Rev. 30, 236-249 (1999).
- Foster, T. C., Kumar, A. Susceptibility to induction of long-term depression is associated with impaired memory in aged Fischer 344 rats. Neurobiol Learn Mem. 87, 522-535 (2007).
- Hsu, K. S. Alterations in the balance of protein kinase and phosphatase activities and age-related impairments of synaptic transmission and long-term potentiation. Hippocampus. 12, 787-802 (2002).
- Vouimba, R. M., Foy, M. R., Foy, J. G., Thompson, R. F. 17beta-estradiol suppresses expression of long-term depression in aged rats. Brain Res Bull. 53, 783-787 (2000).
- Abdul, H. M., Furman, J. L., Sama, M. A., Mathis, D. M., Norris, C. M. NFATs and Alzheimer's Disease. Mol Cell Pharmacol. 2, 7-14 (2010).
- Abdul, H. M. Cognitive decline in Alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling. J Neurosci. 29, 12957-12969 (2009).
- Anantharaman, M. Beta-amyloid mediated nitration of manganese superoxide dismutase: implication for oxidative stress in a APPNLH/NLH X PS-1P264L/P264L double knock-in mouse model of Alzheimer's disease. Am J Pathol. 168, 1608-1618 (2006).
- Gengler, S., Hamilton, A., Holscher, C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 5, e9764-e9764 (2010).
- Stringer, J. L., Lothman, E. W. In vitro effects of extracellular calcium concentrations on hippocampal pyramidal cell responses. Exp Neurol. 101, 132-146 (1988).
- Landfield, P. W., Pitler, T. A., Applegate, M. D. The effects of high Mg2+-to-Ca2+ ratios on frequency potentiation in hippocampal slices of young and aged rats. J Neurophysiol. 56, 797-811 (1986).
- Ames, A. 3rd, Sakanoue, M., Endo, S. NA, K, CA, MG, AND C1 CONCENTRATIONS IN CHOROID PLEXUS FLUID AND CISTERNAL FLUID COMPARED WITH PLASMA ULTRAFILTRATE. J Neurophysiol. 27, 672-681 (1964).
- Gant, J. C., Sama, M. M., Landfield, P. W., Thibault, O. Early and simultaneous emergence of multiple hippocampal biomarkers of aging is mediated by Ca2+-induced Ca2+ release. J Neurosci. 26, 3482-3490 (2006).
- Thibault, O., Hadley, R., Landfield, P. W. Elevated postsynaptic [Ca2+]i and L-type calcium channel activity in aged hippocampal neurons: relationship to impaired synaptic plasticity. J Neurosci. 21, 9744-9756 (2001).
- Thibault, O., Landfield, P. W. Increase in single L-type calcium channels in hippocampal neurons during aging. Science. 272, 1017-1020 (1996).
- Stutzmann, G. E., Caccamo, A., LaFerla, F. M., Parker, I. Dysregulated IP3 signaling in cortical neurons of knock-in mice expressing an Alzheimer's-linked mutation in presenilin1 results in exaggerated Ca2+ signals and altered membrane excitability. J Neurosci. 24, 508-513 (2004).
- Stutzmann, G. E. Enhanced ryanodine receptor recruitment contributes to Ca2+ disruptions in young, adult, and aged Alzheimer's disease mice. J Neurosci. 26, 5180-5189 (2006).
- Lee, H. K., Min, S. S., Gallagher, M., Kirkwood, A. NMDA receptor-independent long-term depression correlates with successful aging in rats. Nat Neurosci. 8, 1657-1659 (2005).
- McNaughton, B. L., Douglas, R. M., Goddard, G. V. Synaptic enhancement in fascia dentata: cooperativity among coactive afferents. Brain Res. 157, 277-293 (1978).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon