Method Article
Préparation des coupes d'hippocampe aiguë chez des rats et des souris transgéniques pour l'étude des altérations synaptiques au cours du vieillissement et de l'amylose pathologie
Dans cet article
Résumé
Cet article décrit les procédures pour la préparation de coupes d'hippocampe de rats et de souris transgéniques pour l'étude des altérations synaptiques associés au vieillissement du cerveau et liée à l'âge des maladies neurodégénératives comme la maladie d'Alzheimer.
Résumé
La préparation de tranches de rongeurs hippocampe est peut-être l'outil le plus largement utilisé pour étudier les mammifères fonction synaptique et la plasticité. L'hippocampe peut être extraite facilement et rapidement à partir de rats et de souris et de tranches de rester viables pendant des heures dans oxygénée liquide céphalorachidien artificiel. Par ailleurs, les techniques de base sont electrophysisologic facilement appliquée à l'enquête de la fonction synaptique dans des coupes d'hippocampe et ont fourni certains des meilleurs biomarqueurs pour des troubles cognitifs. La tranche d'hippocampe est particulièrement populaire pour l'étude des mécanismes de plasticité synaptique impliqués dans l'apprentissage et la mémoire. Les changements dans l'induction de la potentialisation à long terme et la dépression (LTP et LTD) de l'efficacité synaptique dans les coupes d'hippocampe (ou leur absence) sont fréquemment utilisés pour décrire le phénotype neurologique des animaux ayant une déficience cognitive et / ou pour évaluer le mécanisme d'action des composés nootropique. Cet article décrit les procédures que nous utilisons pour la préparation de coupes d'hippocampe de rats et de souris transgéniques pour l'étude des altérations synaptiques associés à vieillissement du cerveau et la maladie d'Alzheimer (MA) 1-3. Utilisez des rats âgés et les souris modèle AD peuvent présenter un ensemble unique de défis pour les chercheurs habitués à utiliser des jeunes rats et / ou des souris dans leurs recherches. Les rats âgés ont plus épais et plus dur crânes des tissus conjonctifs que les jeunes rats et des souris, ce qui peut retarder l'extraction du cerveau et / ou de dissection et par conséquent nier ni exagérer réelles différences d'âge dans la fonction synaptique et la plasticité. Le vieillissement et la pathologie amyloïde peut également exacerber les dommages subis pendant l'hippocampe à la procédure de dissection, encore une fois toute complication conclusions tirées de l'évaluation physiologique. Ici, nous discutons des mesures prises pendant la procédure de dissection afin de minimiser ces problèmes. Exemples de réponses synaptiques acquis en «bonne santé» et «malsain» tranches de rats et de souris sont fournis, ainsi que le représentant des expériences plasticité synaptique. L'impact possible d'autres facteurs méthodologiques sur la fonction synaptique dans ces modèles animaux (par exemple composants solution d'enregistrement, les paramètres de stimulation) sont également discutés. Bien que l'accent de cet article est sur l'utilisation des rats âgés et les souris transgéniques, les novices pour trancher la physiologie devrait trouver suffisamment de détails ici pour obtenir commencé sur leurs propres études, en utilisant une variété de modèles de rongeurs.
Protocole
1. Préparation glacée oxygénés Fluide céphalorachidien artificiel (ACSF)
- Préparer 2 L de "Ca 2 + libre" ACSF. Dans un erlenmeyer 2L, ajouter environ 1,5 L d'stérile ou bidistillée H 2 O, et de commencer en remuant vigoureusement sur une plaque d'agitation. Ajouter les éléments suivants ACSF (en mM): 124 NaCl, 2 KCl, 1,25 KH 2 PO 4, 2 MgSO 4, 26 NaHCO 3, et 10 de dextrose (voir tableau 1). Porter à un volume de 2 L d'eau distillée H 2 O.
- Avec un bulleur d'aquarium et les tubes attachés à un 95% O 2 / 5% CO 2 réservoir d'air, l'ACSF oxygènent vigoureusement pendant environ 20-30 min. Vérifiez le pH et, si nécessaire, ajuster à 7,4 avec NaOH ou HCl.
- Verser 750 ml d'oxygénation de Ca 2 + libre ACSF dans une fiole Erlenmeyer séparée, couvrir l'ouverture avec du parafilm, et le transfert d'une ultrafreezer (-80 ° C) pendant 20-30 min. Ce support sera utilisé pour la dissection du cerveau et de coupes d'hippocampe aiguë *. Ajouter 2 mM de CaCl2 à l'restantes 1,25 litres d'ACSF #, bien mélanger, et de reprendre l'oxygénation avec 95% d'O 2 / 5% CO 2. Ce support sera utilisé pour stocker des tranches de cerveau après les dissections, et de perfusion lors des enregistrements électrophysiologiques tranches.
* Glacée Ca 2 + liberté des médias est utilisée pour ralentir le métabolisme et minimiser Ca 2 +-dépendante excitotoxicité lors de la dissection.
# Modification de Ca 2 + dysrégulation au cours du vieillissement et AD peut avoir un impact majeur sur l'induction de Ca 2 +-dépendante plasticité synaptique 4-9. Des rapports contradictoires sur les différences d'âge dans LTD peut être en partie attribuable à l'utilisation de différents ACSF Ca 2 +: Mg2 + ratios lors des enregistrements tranche (voir 2,4,10). L'importance de Ca 2 + régulation et le Ca 2 + ACSF niveau dans les études de vieillissement est traitée plus en détail dans la section Discussion. - Alors que le Ca 2 + libre ACSF est le gel, préparer une chambre de retenue pour l'entretien des tranches de cerveau avant et pendant les enregistrements électrophysiologiques *. Nous utilisons une coutume macro-tenant de chambre qui contient quatre microchambres individuels (voir figure 2). Le macrochamber est rempli de stériles, oxygénée H 2 O et le microchambres sont essentiellement les îles qui font saillie au-dessus de la surface de l'eau. Dans chaque microchambre, des tranches de filet reposer sur insérer dans une piscine peu profonde de l'ACSF oxygénée. Les tranches sont pas complètement submergés, mais assis à une interface avec l'air humidifié. Un élément chauffant isolé au sein de l'macrochamber permet de régler la température.
* Plusieurs variétés de chambres holding sont également disponibles dans le commerce (par exemple, Warner Instruments fait une submersion de style "Pre Chambre # BSC-PC) et doit être adapté pour une utilisation dans le vieillissement et les études transgéniques tranche de la souris. Dans un pincement, des tranches peut être maintenue pour plusieurs heures dans une petite boîte de Petri remplie de l'ACSF. Faire un petit trou dans le couvercle de Pétri pour la livraison d'un tube d'oxygène. Veillez à ce que des bulles d'oxygène ne pas physiquement agiter les tranches. Tranches obtiendrez suffisamment d'oxygène si le tube de distribution est soulevé à juste dessus de la surface ACSF (dispersion de gaz devrait provoquer une indentation dans la surface du liquide).
2. Retrait du cerveau et de dissection de l'hippocampe chez personnes âgées (> 20-month-old-rats)
- Préparer la zone de dissection * à côté d'un grand lavabo (voir figure 1 et tableau 2). Placez une guillotine petit animal dans l'évier et disposer des instruments chirurgicaux et des matériaux pour l'enlèvement et la dissection du cerveau hippocampique comprenant une serviette de papier plié, une lame # 11 scalpel, ciseaux beebee, rongeurs d'os, un «outil Hippocampe" (une spatule spécialisée double à partir de Beaux-outils chirurgicales), des petits ciseaux chirurgicaux, une fine spatule double culot, plastique pipette Pasteur, 110 mm de diamètre papier filtre Whatman, un couvercle en verre de 100 mm boîte de Petri remplie de glace, et une cuillère en plastique. Gardez également un sac en plastique à proximité pour l'élimination de la carcasse.
L'extraction du cerveau * devrait être achevé aussi rapidement que possible, donc c'est une bonne idée de mental "promenade à travers" la procédure et de jeter vos instruments dans l'ordre d'utilisation. - Retirer Ca 2 + libre ACSF du congélateur. Les médias devraient être partiellement, pas complètement, congelés. Verser environ 50 mL de l'ACSF, dans un bécher en verre, couvrir avec du Parafilm et place à côté de la zone de dissection. Ce support sera utilisé pour stocker brièvement le cerveau une fois qu'il est retiré. Le reste de Ca 2 +-médias libres seront utilisés pour remplir le réservoir dans le Vibratome pour la préparation de tranche. Ce support peut être réoxygéné, ou simplement recouverts de parafilm et placé au réfrigérateur à 4 ° C.
- Euthanasier le rat en utilisant des méthodes approuvés par le soin des animaux institutionnelles et Use Committee (IACUC). Nos animaux sont placés dans une petite chambre en plexiglas qui est progressivement remplie avec 100% de CO 2. Perte de conscience se produit généralement dans les cinq minutes et est confirmée par l'absence de l'activité réflexela suite d'un pincement de l'orteil.
- Décapiter le rat immédiatement rostrale à la première vertèbre cervicale et placer la tête sur la serviette en papier plié. Utilisation du bistouri n ° 11, a rapidement fait une incision au milieu du cuir chevelu de départ près de l'os nasal et courir caudalement à l'os occipital. Veillez à couper complètement à travers le muscle cutané, totalement exposer les points de suture sur la surface dorsale du crâne.
- Couper à travers les plaques crâne avec des ciseaux beebee. Chez les jeunes rats et les souris, le crâne peut être rapidement enlevée avec l'utilisation d'Os Rongeurs seul. Cependant, les rats âgés ont plus épais que les crânes de jeunes rats adultes et des souris qui peuvent rendre cette procédure difficile. Nous avons constaté que la coupe à travers le crâne facilite grandement l'élimination osseuse avec Rongeurs, diminue blessure au cerveau, et économise de précieuses secondes. Avec la tête du rat fermement sur le comptoir, placez la pointe du bas même de la paire de ciseaux beebee dans la région supérieure du foramen magnum à la partie postérieure du crâne. Garder le bas pure fermement contre la surface interne du crâne (et loin du cerveau) *, couper à travers la plaque occipitale, et puis le long de la suture médiane des plaques pariétales. Procéder rostralement jusqu'à ce que vous couper à travers les plaques frontales du crâne.
* Il est extrêmement important que la pression est dirigé loin du cerveau pour empêcher mesurer par inadvertance. - Séparez les occipitale, pariétale et temporale du crâne plaques dans le cerveau. Continuez à maintenir fermement la tête sur le comptoir pour plus de stabilité et de tirer parti et faire glisser la mâchoire inférieure de la pince gouge sous la pression plaque de maintien pariétal gauche contre la surface intérieure du crâne. Ensuite, serrer les mâchoires de la pince gouge ensemble et rouler votre poignet vers le haut et vers vous pour tirer le pariétal et occipital, loin de plaques dans le cerveau. Cela devrait exposer la plupart de la surface dorsale de l'hémisphère gauche. Si nécessaire, utilisez la pince gouge pour enlever la plaque frontale gauche aussi. Répétez cette procédure pour l'autre hémisphère. Une fois les plaques sont déplacées, examiner rapidement pour toute question durée qui peuvent être attachés aux plaques temporelles et étiré sur toute la surface du cerveau. Tirez doucement sur ces supprimer les rongeurs ou les couper avec des ciseaux *. Maintenant, faites glisser la mâchoire supérieure de la pince gouge entre le cerveau et la plaque temporal droit, encore une fois de maintenir la pression vers le crâne et loin du cerveau. Serrez et tournez la plaque temporelle loin du cerveau. Vous devriez entendre / sentir un "crunch" comme vous le faites. Répétez l'opération pour le côté gauche.
* La durée peut être difficile à repérer, surtout si l'animal a été perfusé avec transcardiaque ACSF. Cependant, si Dura sont pas enlevés, ils seront tranche à travers le cerveau (et très probablement l'hippocampe) comme un rasoir lorsque les plaques temporelles sont supprimés. Snipping l'dura près de la distance temporelle plaques permettra de minimiser la probabilité d'avoir poignardé le cerveau. - Extrait du cerveau *. Vite retirer le parafilm de la Ca 2 + libre ACSF «gadoue». Maintenant, glissez une spatule large de la tête de l'outil de l'hippocampe entre la surface ventrale du cerveau et du crâne en bas des plaques jusqu'à ce qu'il soit complètement sous le cerveau. Déplacer la spatule latéralement d'un côté à-côté et puis vers l'avant et en arrière à quelques reprises de rompre intacts les nerfs crâniens. Maintenant scoop du cerveau avec l'outil de l'hippocampe et plonger dans Ca 2 + libre ACSF et couvrir avec du parafilm. Laissez le froid du cerveau pendant une minute environ. Ceci est un moment opportun pour nettoyer la guillotine, disposer de la carcasse, et à réorganiser la zone de dissection.
* Pour les étapes 2.3 à 2.7, la vitesse est de l'essence. Nous essayons de terminer cette procédure (de la décapitation d'immersion dans le cerveau ACSF) dans 30 à 35 sec. Dans notre expérience, les extractions de prendre plus d'une minute semblent nuire à la santé tranche de l'hippocampe, en particulier pour les rats âgés. L'utilisation de ces procédures, nous avons observé aucune différence dans les temps d'extraction entre les rats âgés et les jeunes pour nos études. - Extrait de l'hippocampe. Placez le papier Whatman filtre sur le couvercle du plat glacée de Pétri et humidifier le papier avec l'ACSF aide de la pipette de transfert en plastique. Récupérer le cerveau de l'ACSF aide d'une cuillère et les placer sur le papier humidifié Whatman. Utilisation de la lame du scalpel, enlever le cervelet, et environ un quart des lobes frontaux rostrale. Exécutez le bistouri à travers les fissures intrahemispheric de séparer complètement les deux hémisphères. Placer un hémisphère de retour dans la gadoue ACSF et "stand" de la place d'autres sur la scène de dissection de telle sorte que le plan frontal du lobe frontal est orientée vers le bas. Vous devriez clairement être capable de distinguer le tronc cérébral et le cerveau mi (qui sont blancs) dans le cortex sus-jacent (qui est rose / gris). Localisez le colliculi supérieures et inférieures sur le mésencéphale; ceux-ci ressemblent à deux blancs «boutons» et sera au "sommet" du cerveau dans cette orientation. En utilisant les ciseaux chirurgicaux, délicatement tenir le mésencéphale en place et faire glisser la spatule de pesage dans le fossé seentre les colliculi et le néocortex. Très doucement, continuer à glisser la spatule vers le bas et tirer sur le tronc cérébral / mésencéphale / thalamus loin révélant l'intérieur du ventricule latéral et la face médiale de l'hippocampe. Utilisez le tranchant de la spatule pour couper facilement le fornix; un faisceau de fibres blanches situées à la partie antérieure / postérieure de l'hippocampe. Avec les ciseaux, doucement continuer à tirer le tronc cérébral / mésencéphale / thalamus loin sans rompre complètement du reste du cerveau. Le cortex avec hippocampe doivent désormais librement dans le tronc cérébral *. Ensuite, tournez la scène de dissection, afin que vous recherchez à l'hippocampe et le cortex médial recouvrant comme s'il s'agissait d'une coupe sagittale (moins le thalamus). Vous devriez maintenant voir les fibres blanches qui forment fimbria une hyperbole peu profonde au fond de l'hippocampe dans ce plan. Utilisation de la pipette en plastique, délicatement gicler quelques ACSF dans l'espace sous le fimbria pour aider à séparer l'hippocampe du cortex. Faites glisser doucement la spatule dans cet écart, tels que le côté long de la spatule est parallèle à l'axe longitudinal de l'hippocampe. Une fois que la spatule est complètement sous l'hippocampe, maintenez le tronc cérébral / mésencéphale / thalamus fermement avec les ciseaux et le déploiement de la spatule loin de votre corps pour séparer physiquement l'hippocampe par rapport au reste du cerveau. Une fois que l'hippocampe est libre, doucement rogner toute cortex restant, les vaisseaux sanguins, et la substance blanche. Scoop une petite quantité de l'ACSF gadoue sur le côté éloigné de la scène de dissection. Doucement la position de l'hippocampe à côté de la gadoue et asperger avec quelques millilitres d'ACSF aide de la pipette de transfert en plastique. Ensuite, retirez l'autre hémisphère et répétez la dissection.
* Vous pouvez avoir besoin de ciseaux pour couper l'écart supplémentaires tissu conjonctif, la substance blanche, ou vascularisation qui empêche la séparation du cortex du tronc cérébral. Les points de vos ciseaux seront très proches de l'hippocampe, donc soyez sûr de livrer cisailles très précises (des ciseaux pointus sont un must).
3. Retrait du cerveau et de dissection de l'hippocampe chez les souris transgéniques âgées
- Euthanasier et de décapiter la souris et faire une incision médiane sur le cuir chevelu comme décrit dans la section 2.3. Les souris ont crânes beaucoup plus mince que le rat qui simplifie grandement l'extraction du cerveau. Coupe à travers le crâne avec des ciseaux est donc inutile. Utilisez Os Rongeurs avec de petites mâchoires (tableau 2) à se détacher occipitale, pariétale et temporale du crâne plaques. Comme avec le rat, n'oubliez pas d'utiliser les mouvements contrôlés et tirez fermement la mâchoire inférieure de l'rongeurs dans la surface interne du crâne et loin du cerveau que vous retirez les plaques. Une fois les plaques sont retirées, utilisez l'extrémité étroite de l'outil pour rompre l'hippocampe reste nerfs crâniens et le cerveau en primeur glacée Ca 2 + libre ACSF.
- Préparer des tranches de cerveau. En raison de la petite taille du cerveau de souris, disséquer l'hippocampe peut être un peu plus difficile (quoique certainement faisable) que lors de l'utilisation des rats. Ainsi, pour faciliter les choses, nous supprimons le cervelet et des conseils rostrale des lobes frontaux, mais ne pas disséquer l'hippocampe. Au lieu de cela, hémisphères du cerveau sont physiquement séparés par une lame de scalpel et laissée intacte pour sectionner Vibratome (voir section 4 ci-dessous).
4. Tissu cérébral section en tranches utilisant un microtome vibrant (Vibratome) et transfert à Holding Chambre *
- Remplir le réservoir de la Vibratome avec glacée Ca 2 + libre ACSF, tels que le stade de coupe et lame sont complètement submergés. Pour faire des tranches rat, couper les extrémités rostrale et caudale de chaque hippocampe avec une lame de bistouri. Ces réductions vous permettront de positionner verticalement l'hippocampe étroitement ensemble comme deux colonnes. Cela fonctionne mieux si le gyrus denté de l'hippocampe est chaque face de l'autre et CA3 régions sont orientées dans la même direction. Pour faire des tranches de la souris, verticalement, la position de chaque hémisphère en étroite collaboration avec des lobes frontaux vers le bas. Tissu cérébral colle sur un bloc de montage et transfert à l'étape de la coupe de l'Vibratome. Nous préparent habituellement ~ 400 sections UM pour expériences sur la physiologie synaptique. Diluant sections doivent être prêts si fluorescentes imagerie sera réalisée (par exemple les enquêtes de Ca 2 + et des niveaux transitoires). Recueillir les tranches avec une pipette à large ouverture ou un pinceau # et le transfert à une petite boîte de Petri contenant glacée Ca 2 + libre ACSF.
* L'utilisation d'un dommage Vibratome minimise les faces supérieure et inférieure de la tranche et est fortement recommandé pour les études nécessitant une analyse des cellules de proximité de la surface de coupe (par exemple voltage et de Ca 2 + des études d'imagerie). Cependant, des alternatives moins chères sont disponibles et adaptés pour générer des expériences de physiologie tranches extracellulaire. Nous avons utilisé une petite gravité contrôlé chopper 2,11 et un Chopper tissu McIlwain 12 avec un bon succès. Pour this la procédure hippocampes sont placés sur une scène et sectionné avec un hacheur verticale. Une brosse est utilisée pour transférer les tranches (une à la fois) dans un plat rempli de petite exploitation glacée Ca 2 + libre ACSF. Un problème avec cette approche est que les hippocampes peuvent se déplacer entre les côtelettes résultant en sections inégales. Aussi, veillez à retirer le plus de matière blanche beaucoup, et surtout que la vascularisation bien, autant que possible avant de les hacher. Ce matériel sera coller à la brosse, la lame de rasoir, ou les deux, ce qui rend le transfert de tranches très difficile et en augmentant la probabilité d'étirement ou d'endommager les tissus.
# Lorsque vous utilisez un pinceau, essayez de vous reposer la tranche sens de la longueur à travers les poils. Emballage de la tranche autour de la pointe du pinceau peut causer des tissus inutiles étirements. - Transfert des tranches de cerveau de la chambre de détention où ils sont baignés dans oxygénée Ca 2 + contenant ACSF. Peu à peu amener la température de chambre de 27 ° à 32 ° C (1 ° toutes les cinq minutes). Autoriser les tranches d'incuber pendant 1-1,5 h avant les expériences électrophysiologiques.
5. Susciter et Record CA3-CA1 réponses synaptiques
- Pour base des enregistrements extracellulaires en tranches aiguës, votre station électrophysiologie devrez inclure *: une chambre d'enregistrement; un système de perfusion; un microscope avec une capacité> grossissement 4x, enregistrement, stimulant et électrodes de masse; macro et micro-manipulateurs; rigide résistant aux vibrations table et la cage de Faraday; un stimulateur; amplificateur et analogique-numérique (A / D); oscilloscope (de préférence), et PC personnel avec logiciel d'acquisition appropriés.
* Kerr Scientific Instruments propose un système de fantastique et peu coûteuse électrophysiologie (c'est à dire le système d'enregistrement Kerr tissus) pour la réalisation d'une variété de base des expériences d'électrophysiologie tranche. Ce système a un faible encombrement, les stimulateurs portables et les amplificateurs, et peut être utilisé sur une norme de paillasse sans avoir besoin d'une cage de Faraday encombrants.
Bien sûr, des tranches de cerveau peut aussi être utilisé pour effectuer de nombreuses techniques élaborées électrophysiologiques et d'imagerie, qui nécessitent des équipements et matériaux supplémentaires. Par exemple, notre station principale électrophysiologie contient un amplificateur avec une tension et courant rapide-clamp capacités, un système d'éclairage fluorescent et un appareil photo numérique. Cette station est utilisée pour les enregistrements de domaine extracellulaire dans des tranches de cerveau, ainsi que des enregistrements de patch-clamp et imagerie de fluorescence en tranches et des cultures de cellules 3,12,13. Voir le tableau 3 pour une liste complète d'équipements et de composants. - Avec une pipette à large bouche ou petit pinceau, le transfert d'un ou plusieurs tranches à la chambre d'enregistrement * lui permettant de s'acclimater pendant 10-15 min avant la stimulation / enregistrement. Pour nos études, les tranches sont immergées dans l'ACSF et de repos sur la compensation insérée dans une chambre de RC-22 par Warner Instruments (voir Figure 3). ACSF est alimenté par gravité à travers un régulateur pour ajuster débit, et préchauffé à 32 ° C par une ligne micro-chauffe avant d'atteindre la chambre d'enregistrement. Une ligne d'aspirateur central est utilisé pour enlever la FCSA.
* Beaucoup de variétés différentes de submersibles et des chambres d'enregistrement d'interface de style sont disponibles commercialement. Nous avons observé que les tranches d'exposition plus robuste réponses synaptiques dans une chambre d'interface (tranche-dire assis à une interface avec l'air et humidifié ACSF) 2,11. Toutefois, la réceptivité est généralement plus stable lorsque les tranches sont immergées dans l'ACSF. Perfusion de drogues est également plus efficace dans des chambres de submersion. - Position stimulant et d'enregistrement des électrodes. Avec l'isolateur stimulateur ou de relance en marche, mais la production composé à 0, la position d'une électrode de stimulation sur la tranche de la région du stratum radiatum CA2 CA3 près de la frontière (voir figure 4). Nous utilisons un fil de platine iridié tordus pour livrer 50 à 100 uS impulsions diphasique à CA3 Schaffer collatéral (SC) des fibres. L'utilisation de fil de platine iridium et de légumineuses peut aider diphasique polarisation d'électrode minimisés. Basse une électrode d'enregistrement dans CA1 stratum radiatum, juste briser la surface de la tranche. Notre électrode d'enregistrement est un fil d'Ag / AgCl dans une micropipette ACSF-remplie en verre (résistance de pointe d'environ 7 MQ). Tourner la sortie sur le stimulateur à un niveau modéré (nous fixons nos isolateurs stimulus à ~ 150 mA) et de commencer à administrer des impulsions de stimulation et d'acquisition de l'activité en utilisant le logiciel d'acquisition, tels que Clampex d'Axon Instruments, Inc descendre lentement l'électrode de stimulation dans les petites intervalles jusqu'à une artificact stimulus est enregistrée dans CA1. Ensuite, continuez à descendre lentement la fois les électrodes de stimulation et d'enregistrement à intervalles tout en acquérant CA1 réponses jusqu'à ce que le volley-fibre (FV) et le potentiel postsynaptique excitateur (EPSP) amplitudes atteignent des niveaux maximaux (voir figure 4B).
- Établir une courbe de la force synaptique et d'enquêter sur la plasticité synaptique. Pour générer une courbe de la force synaptique, délivrer des impulsions de stimulation à SC à des intensités plus élevées et d'enregistrement ee activité correspondante dans CA1. L'éventail et le nombre de niveaux d'intensité de stimulation utilisé peut varier, mais doivent être suffisantes pour générer une courbe sigmoïde où comploté contre soit FV ou les valeurs EPSP (figure 5). L'amplitude FV fournit une estimation fiable de la proportion de fibres présynaptiques activés, tandis que la pente EPSP fournit une mesure non contaminée de monosynaptique CA3-CA1 courants. Tracé de la pente contre l'EPSP FV travers les niveaux d'intensité de stimulation reflète donc la taille de l'EPSP par nombre d'afférences activées et fournit une excellente estimation de la CA3-CA1 force synaptique. Typiquement, les niveaux de la force synaptique sont sensiblement réduits dans la région CA1 de rats âgés et APP/PS1 souris, par rapport à des rats jeunes et d'âge comparable souris de type sauvage par exemple, voir 4,14.
- Tranches qui montrent des signes de mauvaise santé (par exemple une amplitude maximale EPSP <1 mV) ou hyperexcitabilité (c'est à dire l'apparition de deux ou plusieurs pics de population) pendant la courbe de la force synaptique sont exclus de l'analyse statistique (voir la figure 4C). Nous avons constaté que ces tranches présentent rarement des réponses stables dans une période de 60 min et / ou montrent des réponses très variables suivant l'induction de la plasticité synaptique. Il mérite de noter que «tranches malsains» ne représentent que 10-20% de toutes les tranches transférés à la chambre d'enregistrement. Par ailleurs, dans notre expérience, la fréquence d'identification d'une tranche de malsain est très similaire dans l'âge, l'espèce et le génotype.
- Provoquer potentialisation à long terme (LTP) ou dépression à long terme (LTD) en tranches. LTP et LTD sont des augmentations durables (LTP) et diminue (ILD) dans la fonction synaptique en réponse à différents modes d'activation synaptique. Les deux processus sont largement considérées afin de refléter des mécanismes essentiels pour l'apprentissage et memory15 et fournir des mesures des résultats utiles pour étudier les mécanismes cellulaires du dysfonctionnement neuronal et / ou pour évaluer des stratégies pharmacologiques pour améliorant les déficits de mémoire et la neurodégénérescence 16.
Pour les expériences plasticité synaptique, réinitialiser l'intensité du stimulus pour toutes les tranches d'une * mV et de commencer la stimulation de base à une fréquence de 0.033 Hz. Valeurs de pente EPSP devrait être stable pendant au moins 20 min avant l'induction de la LTP ou LTD. Surveiller de près RPEB pendant ce temps et de réinitialiser l'intensité du stimulus si la pente varie de plus de 10% et de commencer une nouvelle ligne de base. Provoquer LTP en utilisant un train d'une seconde de 100 Hz ou la stimulation de multiples éclats courts (~ 10 impulsions) de 100 Hz de stimulation donnée toutes les 200 ms. Pour l'induction de LTD, livrer 900 impulsions de stimulation à un taux de 1 Hz. Après l'induction de LTP ou LTD, de recueillir les réponses synaptiques pour une supplémentaire de 60 min ou plus. Valeurs de pente EPSP obtenues avant et 60 min après la stimulation à haute fréquence / basse sont comparés pour déterminer la présence de LTP ou LTD.
Rats âgés et APP/PS1 souris tendent à montrer déficient LTP et LTD amélioré (voir figure 5), et ces changements ont été suggérés pour contribuer à la cognition altérée dans ces modèles animaux 6,16. Cependant, contrairement APP/PS1 souris, des changements dans la LTP / LTD chez les rats âgés sont variables selon les laboratoires. Rats âgés présentent généralement des niveaux similaires LTP par rapport aux adultes en réponse à "intenses" (soit 100 Hz) la stimulation, mais les déficits montrer quand les paramètres de stimulation douce sont utilisés (c.-fréquences de stimulation inférieure ou impulsions de stimulation moins) (pour revue, voir 4,6, 16). En outre, certains laboratoires, y compris la nôtre, ont observé une susceptibilité accrue à l'induction de LTD chez les rats âgés 2,17-19, tandis que d'autres groupes n'ont trouvé aucune différence ou une sensibilité réduite dans leurs animaux âgés. Comme nous l'avons brièvement ci-dessous (voir discussion), des différences subtiles mais essentielles dans le protocole expérimental peut tenir compte de ces divergences.
* L'intensité de la stimulation et l'amplitude EPSP peut influencer l'induction LTP et peut être une cause importante de résultats discordants dans la littérature. Cette question sera examinée plus loin dans la section Discussion.
6. Les résultats représentatifs
Notre travail, et d'autres groupes de travail, suggère que les changements dans les astrocytes basée signalisation inflammatoire peut déclencher et / ou accélérer dysfonctionnement neurologique au cours du vieillissement et AD 13,20,21. Récemment, nous avons utilisé la force synaptique, LTP et LTD en tant que mesures critère d'étudier l'efficacité et les mécanismes d'action de plusieurs nouveaux anti-inflammatoires réactifs à la mi-âgés APP/PS1 souris (voir 22 pour la description de ce modèle) et âgés de Fischer 344 rats. Les résultats fournis ci-dessous ont été obtenus en utilisant les protocoles décrits dans cet article.
Un des nouveaux anti-inflammatoires adeno-associated virus (AAV) réactifs développés par notre laboratoire a été démontré dans des études pilotes pour augmenter significativement la force synaptique (p <0,05) et d'éviter les déficits LTP (p <0,05) à la mi-âgés (16 -month-old) APP/PS1 souris (n = 4-6 tranches par condition de traitement). Représentant des courbes force synaptique et des expériences LTP de deux tranches différentes, collectés de la même 16-month-old souris APP/PS1, sont présentés dans la figure 5A-C. Une tranche a été extrait de l'hémisphère traitée avec notre AAV roman (Réactif A), tandis que l'autre tranche a été traité avec un réactif de contrôle AAV (Control). LTP est induite dans les deux tranches en utilisant deux trains 1 sec de 100 Hz de stimulation (10 sec intertrain intervalle). Notez que la courbe de la force synaptique pour le réactif A-traitée tranche est déplacée vers la gauche de la tranche de contrôle, indiquant une plus grande force synaptique. A noter également que, typique pour la mi-âgés APP/PS1 souris, LTP connu une chute brutale au niveau de base dans la tranche de contrôle (par exemple 23). Inversement, LTP cariées peu dans la tranche traitée avec nos réactifs roman.
Dans une deuxième étude récente, nous avons observé significative LTD en traité avec le véhicule rats âgés (85% des pré-LTD base, p <0,05). En revanche, aucun LTD a été observée chez les rats âgés traités avec nouvel anti-inflammatoire "Drug A" (97% de pré-base LTD, non significatif). Aucun effet de drogues sur la force synaptique ont été observées. Représentant expériences LTD partir de cet ensemble de données (n = 8-10 rats par groupe) sont illustrés dans la Figure 5D-F.
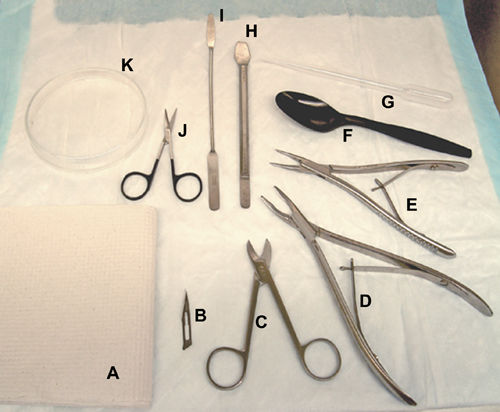
Figure 1. Outils et matériaux utilisés pour la dissection du cerveau. Une serviette en papier,. B, lame de bistouri. C, ciseaux Beebee. D, rongeurs d'os (pour le rat). E, Os Rongeurs (pour les souris / rat). F, une cuillère en plastique. G, une pipette de transfert en plastique. H, outil de l'hippocampe. J'ai, d'une spatule. J, ciseaux chirurgicaux. K, le verre de Petri.

Figure 2. Tranche de cerveau personnalisé tenant chambre. Un macrochamber,. B, le couvercle. C, H 2 O réservoir avec des tubes de silicone perforée. D, microchambre. E, le tube de livraison ACSF (polyéthylène). F, tube O livraison 2. G, un port pour le contrôle de la température. H, insérez microchambre compensées.

Figure 3. RC22 chambre de submersion. Une chambre d'enregistrement,. B, électrode de masse. C, aspiration à l'aiguille.

Figure 4. Illustration tranche de l'hippocampe et des formes d'onde extracellulaire. Un dessin animé, d'une section transversale hippocampique utilisés dans des expériences d'électrophysiologie. CA = corne Ammon. DG = gyrus denté. SC = collatérales de Schaffer. S = radiatum stratum radiatum. B, la stimulation électrique de la SC (une CA3 axone voies) provoque un artefact de stimulation, suivi presque immédiatement par un pic de population présynaptique, le volley de fibres (FV). L'amplitude de la FV est directement proportionnelle au nombre de fibres SC activé. La pente de la phase négative en cours du champ de potentiel postsynaptique excitateur (EPSP) correspond directement à l'activation de courants de dépolarisation synaptique dans les neurones pyramidaux CA1 en réponse à libérer le glutamate à partir de terminaux SC. C, qui se chevauchent représentatifs des signaux extracellulaires enregistrées dans CA1 stratum radiatum en réponse à neuf différents niveaux d'intensité de stimulation (de 30 à 500 mA) dans une «saine» (panneau de gauche), "malsaine", et "hyperexcitables" tranche. Cinq formes d'onde ont été en moyenne par niveau. Tranches saine répondre de façon dynamique à travers cette gamme de relance et d'exposer un seul positive de la population va-spike (reflétant CA1 décharge neuronale) aux niveaux de stimulation plus élevé. Dans la chambre de RC22 immersion, RPEB maximal généralement de 1,5 à 3 mV en amplitude. Tranches malsains (panneau du milieu) présentent souvent un grand FV, mais une petite EPSP maximale (<1 mV) et montrent habituellement la plasticité pauvres. Tranches hyperexcitables (panneau de droite) montrent deux ou plusieurs pics de la population de régénération dans la branche ascendante de l'EPSP. Les réponses en tranches hyperexcitables sont souvent instables et sont variablement affectée par LTD / LTP stimulation.

Figure 5. Représentant des expériences d'électrophysiologie réalisées sur des tranches aiguës de la mi-âgés (16 mois) APP/PS1 souris et âgés (22 mois) des rats Fisher 344. Panneaux AB données montrent recueillies auprès APP/PS1 souris traitées avec un contrôle adéno-associé (AAV) virale construction (contrôle) ou d'un réactif roman AAV (Réactif A) qui a été développé par notre groupe de laboratoire. Par rapport à la tranche de contrôle, la tranche traitée par le réactif A présente une évolution marquée vers la gauche dans l'EPSP: FV courbe (A) indicatif de la force synaptique plus. La tranche Réactif-A-traitée montre également LTP robuste et stable (B) après la livraison de deux 1 sec, 100 trains de relance Hz, tandis que la tranche de contrôle des expositions LTP déficiente, typique de ce modèle animal. Panneaux DF données montrent individuelles recueillies auprès de deux rats âgés ayant reçu chronique (4 semaines) perfusions intra-hippocampique de véhicule ou un roman anti-inflammatoire (médicament A). Basal force synaptique a été relativement peu affectée par le traitement médicamenteux(D). Toutefois, médicament A a été très efficace pour prévenir l'induction de la LTD (E). Panneaux C et F montrent des signaux représentatifs EPSP enregistrées à partir de tranches individuelles avant (pré) et 60 min après (post) la livraison de LTP / LTD stimulation. Notez que les artefacts de stimulation ne sont pas représentés.
Discussion
Les étapes décrites dans ce protocole aidera à assurer que les dissections du cerveau sont effectués au moins aussi rapidement et efficacement en âge, comme chez les rats adultes jeunes. Nous avons aussi fournir suffisamment de détails pour le débutant de créer leur propre tranche d'études sur la LTP et LTD. Si une exploration plus poussée du vieillissement et des changements AD dans la fonction synaptique et la plasticité est l'un de vos objectifs, il ya au moins deux autres questions méthodologiques, évoqué ci-dessus, qui méritent un examen plus approfondi. D'abord, plusieurs laboratoires ont montré que le Ca 2 +: Mg2 + ratio de l'enregistrement de l'ACSF peut avoir un effet marqué sur la plasticité synaptique dans l'induction des coupes d'hippocampe 2,10,24,25. Dans le LCR chez les mammifères, le Ca 2 +: Mg2 + taux est d'environ un (voir par exemple 26). Toutefois, l'ACSF Ca 2 +: Mg2 + ratios plus proche de 2 sont couramment utilisés dans les études de tranche de la fonction synaptique et la plasticité. Dans les premières études, cette pratique a probablement été adapté pour optimiser l'induction de la LTP, puis est ensuite devenu la routine pour toutes les études de plasticité. Toutefois, cette pratique peut être problématique dans les études de vieillissement et AD en raison des différences bien caractérisées dans les neurones de Ca 2 + règlement. Plus précisément, l'afflux de Ca 2 + et / ou Ca 2 + induite par Ca 2 +-release est élevée chez les rats âgés et / ou des souris modèles AD lors de l'activation neuronale 3,27-31. L'induction de LTD est particulièrement sensible aux changements subtils dans les niveaux de Ca + 2 ACSF. Notre protocole, qui utilise 2 mM de Ca 2 + et 2 mM Mg 2 +, communément traduit par LTD pour personnes âgées, mais pas de jeunes animaux adultes 2, tandis que les études utilisant une Ca 2 +: Mg2 ratio de + près de deux, ont observé LTD robustes chez les adultes dans le absence d'une différence de 2,10 âge ou en conjonction avec réduction LTD chez les rats âgés 32. Ces observations soulignent la nécessité d'examiner attentivement ACSF Ca 2 + et Mg 2 + lors de la comparaison des niveaux de Ca 2 +-dépendante la plasticité chez les animaux adultes jeunes et d'âge.
Le deuxième problème méthodologique concerne la forte dépendance de la LTP sur dépolarisation postsynaptique 33 et possibles du vieillissement / génotype des différences dans la force synaptique. Dans une expérience typique de LTP, de base et de l'intensité de stimulation LTP est généralement ajustée pour produire un demi maximal (ou de trois-quarts maximale) EPSP amplitude. Le problème potentiel est que les rats âgés et APP/PS1 souris montrent habituellement réduite force synaptique par rapport à leurs homologues de type plus jeunes et / ou sauvages, ce qui signifie que les valeurs de base EPSP sera également moindre chez les rats âgés et APP/PS1 souris. Les petits RPEB peut se traduire à moins dépolarisation lors de la stimulation LTP, résultant en une probabilité réduite pour induire la LTP 33. En raison de cette confondent potentiel, il est difficile de déterminer si ces animaux présentent un déficit de débit, un déficit de plasticité, ou les deux. C'est, dans les mécanismes d'induction LTP âgés et / ou APP/PS1 souris peuvent être fonctionnellement intactes (pas de déficit plasticité), mais insuffisamment stimulés (déficit débit) dans ces conditions. Cette distinction est cruciale, car les mécanismes de débit et les mécanismes de la plasticité peut réagir très différemment à un traitement spécifique pharmacologique. Nous nous efforçons de minimiser l'impact de débit réduit sur l'induction de la LTP en normalisant l'amplitude EPSP au même niveau (par exemple 1 mV) à travers toutes les tranches avant la stimulation LTP. D'autres stratégies peuvent être efficaces aussi bien (par exemple l'utilisation de la pince de tension ou de courant pour égaliser le potentiel de membrane entre les groupes lors de la stimulation LTP), et devrait être considéré lors des enquêtes LTP dans ces modèles animaux.
Déclarations de divulgation
Remerciements
Les travaux pris en charge par NIH AG027297, un prix de la moelle épinière et le Kentucky Research Trust blessure à la tête, et un don de la Fondation Kleberg.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | |
| NaCl | Fisher | BP358-1 | |
| KCl | Fisher | BP366-500 | |
| KH 2 PO 4 (monobasique) | Sigma | P5379-100G | |
| MgSO 4 | Sigma | M2643-500G | |
| CaCl 2 (dihydrate) | Sigma | C3306-250G | |
| NaHCO 3 | Fisher | S233-500 | |
| C 6 H 12 O 6 (dextrose) | Fisher | BP350-1 |
Réactifs Tableau 1. Requise
| Nom de l'équipement | Société | Numéro de catalogue | Commentaires |
| Erlenmeyer | Fisher | FB-500-2000 FB-500-1000 | |
| Aquarium Bulleur | Utilisé pour les médias oxygénant. Disponible dans la plupart des magasins d'animaux | ||
| 50 ml en verre bécher | Fisher | 02-540G | Pour storarge cerveau dans l'ACSF |
| Parafilm | Fisher | 13-374-10 | |
| Guillotine pour petits animaux | World Precision Instruments (WPI) | PACD-M | |
| Serviette en papier plat | |||
| # 11 lames Feather chirurgicale | Fisher | 08 à 916-5B | |
| Beebee Ciseaux d'os | Outils Fine Science (FST) | 16044-10 | |
| Lempert Rongeurs | Roboz | RS-8321 | Utilisez pour les rats |
| Friedman-Pearson Rongeurs | TSF | 16020-14 | Utilisez pour les souris ou les rats |
| Outil de Hippocampus | TSF | 10099-15 | |
| Cuillère | Une cuillère à café en plastique fera | ||
| Spatule | Fisher | 21 à 401-25A | Spatule |
| Chirurgical ciseaux à iris | TSF | 14058-09 | |
| pipettes de transfert en plastique | Fisher | 13-711-43 | |
| 110mm papier filtre Whatman | Fisher | 09-805E | Cat Whatman. 1001-110 |
| Verre de Petri | Fisher | ||
| Leica VT1000P Manuel vibrant microtome | Vibratome | ||
| 0.1mm FA-10 S Feather lame | Ted Pella | 121-9 | 0.1mm FA-10 S Feather lame |
| Verre borosilicate Pasteur Pipet (avec poire en caoutchouc) | Fisher | 13-678-20A | Pour transférer des tranches: La pointe est cassée et polies au feu pour la plus grande ouverture |
| Boîte de 35 mm Culture Polysterine | Corning | 430588 | Utilisé pour la collecte des tranches après dissection |
Outils de tableau 2. Et des matériaux pour la dissection
| Équipement / matériel | Société | Commentaires (optionnel) |
| Tenir la chambre | Custom Built | |
| P-97 Extracteur horizontal pipette | Sutter Instrument Co. | |
| Table d'isolation vibratoire | Technique Manufacturing Corporation (TMC) | |
| Cage de Faraday | Fabriquée | |
| Pyrex Aspirateur Bouteille avec Sidearm Bas (Produit # 1220-1L) | Corning | |
| Gravity-contolled mis IV avec régulateur (Produit # 2C8891) | Baxter | |
| Ligne d'aspiration centrale | Disponible dans la plupart des laboratoires modernes | |
| 95% 2 / 5% CO 2 mélange de gaz O | Écossaist-Gross Co. | |
| TygonTM Lab tube Pour O 2 / CO 2 de livraison | Fisher Scientific | Non toxique, non-oxydant, vient dans une variété de tailles. |
| Eclipse E600FN Microscope | Nikon | avec des objectifs 10x et 40x, près infrarouge filtre, et la GFP, DS-RED2 filtres |
| Refroidir Aligner ES Appareil Photo Numérique | Photometrics | Refroidir Aligner ES Appareil Photo Numérique |
| X-Cite illuminateur fluorescent | EXFO | X-Cite illuminateur fluorescent |
| Platform Microscope | Siskiyou | Personnalisé assemblés |
| RC-22 submersibles d'enregistrement de chambre (Produit # 64-0228) | Warner Instruments (WI) | Nécessite P-1 adaptateur plateforme et le stade (Produit # 64-0277 De Warner) |
| Contrôleur de température TC2BIP 2/3Ch | Microcontrols cellulaire | Contrôleur de température TC2BIP 2/3Ch |
| 4 manipulateur miniature axe manuel | Siskiyou | |
| Fil Iridium Platine (0,002 po) (Item # PTT0203) | WPI | |
| A365 Isolateur Stimulus | WPI | A365 Isolateur Stimulus |
| Multiclamp amplificateur 700b | Axon Instruments | |
| Digidata 1322A convertisseur A / D | Axon Instruments | |
| Logiciels pClamp | Axon Instruments | |
| Personal Computer (Pentium 4) | Dell |
Tableau 3. Équipements d'électrophysiologie et de matériaux
Références
- Norris, C. M., Halpain, S., Foster, T. C. Alterations in the balance of protein kinase/phosphatase activities parallel reduced synaptic strength during aging. J Neurophysiol. 80, 1567-1570 (1998).
- Norris, C. M., Korol, D. L., Foster, T. C. Increased susceptibility to induction of long-term depression and long-term potentiation reversal during aging. J Neurosci. 16, 5382-5392 (1996).
- Norris, C. M. Hippocampal 'zipper' slice studies reveal a necessary role for calcineurin in the increased activity of L-type Ca(2+) channels with aging. Neurobiol Aging. 31, 328-338 (2010).
- Burke, S. N., Barnes, C. A. Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161 (2010).
- Foster, T. C. Calcium homeostasis and modulation of synaptic plasticity in the aged brain. Aging Cell. 6, 319-325 (2007).
- Foster, T. C., Norris, C. M. Age-associated changes in Ca(2+)-dependent processes: relation to hippocampal synaptic plasticity. Hippocampus. 7, 602-612 (1997).
- Thibault, O., Gant, J. C., Landfield, P. W. Expansion of the calcium hypothesis of brain aging and Alzheimer's disease: minding the store. Aging Cell. 6, 307-317 (2007).
- Demuro, A., Parker, I., Stutzmann, G. E. Calcium signaling and amyloid toxicity in Alzheimer disease. J Biol Chem. 285, 12463-12468 (2010).
- Green, K. N., LaFerla, F. M. Linking calcium to Abeta and Alzheimer's disease. Neuron. 59, 190-194 (2008).
- Kumar, A., Thinschmidt, J. S., Foster, T. C., King, M. A. Aging effects on the limits and stability of long-term synaptic potentiation and depression in rat hippocampal area CA1. J Neurophysiol. 98, 594-601 (2007).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of age-related alterations in synaptic plasticity by blockade of L-type Ca2+ channels. J Neurosci. 18, 3171-3179 (1998).
- Norris, C. M., Scheff, S. W. Recovery of afferent function and synaptic strength in hippocampal CA1 following traumatic brain injury. J Neurotrauma. 26, 2269-2278 (2009).
- Sama, M. A. Interleukin-1beta-dependent signaling between astrocytes and neurons depends critically on astrocytic calcineurin/NFAT activity. J Biol Chem. 283, 21953-21964 (2008).
- Ye, H., Jalini, S., Mylvaganam, S., Carlen, P. Activation of large-conductance Ca(2+)-activated K(+) channels depresses basal synaptic transmission in the hippocampal CA1 area in APP (swe/ind) TgCRND8 mice. Neurobiol Aging. 31, 591-604 (2010).
- Bear, M. F., Malenka, R. C. Synaptic plasticity: LTP and LTD. Curr Opin Neurobiol. 4, 389-399 (1994).
- Foster, T. C. Involvement of hippocampal synaptic plasticity in age-related memory decline. Brain Res Brain Res Rev. 30, 236-249 (1999).
- Foster, T. C., Kumar, A. Susceptibility to induction of long-term depression is associated with impaired memory in aged Fischer 344 rats. Neurobiol Learn Mem. 87, 522-535 (2007).
- Hsu, K. S. Alterations in the balance of protein kinase and phosphatase activities and age-related impairments of synaptic transmission and long-term potentiation. Hippocampus. 12, 787-802 (2002).
- Vouimba, R. M., Foy, M. R., Foy, J. G., Thompson, R. F. 17beta-estradiol suppresses expression of long-term depression in aged rats. Brain Res Bull. 53, 783-787 (2000).
- Abdul, H. M., Furman, J. L., Sama, M. A., Mathis, D. M., Norris, C. M. NFATs and Alzheimer's Disease. Mol Cell Pharmacol. 2, 7-14 (2010).
- Abdul, H. M. Cognitive decline in Alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling. J Neurosci. 29, 12957-12969 (2009).
- Anantharaman, M. Beta-amyloid mediated nitration of manganese superoxide dismutase: implication for oxidative stress in a APPNLH/NLH X PS-1P264L/P264L double knock-in mouse model of Alzheimer's disease. Am J Pathol. 168, 1608-1618 (2006).
- Gengler, S., Hamilton, A., Holscher, C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 5, e9764-e9764 (2010).
- Stringer, J. L., Lothman, E. W. In vitro effects of extracellular calcium concentrations on hippocampal pyramidal cell responses. Exp Neurol. 101, 132-146 (1988).
- Landfield, P. W., Pitler, T. A., Applegate, M. D. The effects of high Mg2+-to-Ca2+ ratios on frequency potentiation in hippocampal slices of young and aged rats. J Neurophysiol. 56, 797-811 (1986).
- Ames, A. 3rd, Sakanoue, M., Endo, S. NA, K, CA, MG, AND C1 CONCENTRATIONS IN CHOROID PLEXUS FLUID AND CISTERNAL FLUID COMPARED WITH PLASMA ULTRAFILTRATE. J Neurophysiol. 27, 672-681 (1964).
- Gant, J. C., Sama, M. M., Landfield, P. W., Thibault, O. Early and simultaneous emergence of multiple hippocampal biomarkers of aging is mediated by Ca2+-induced Ca2+ release. J Neurosci. 26, 3482-3490 (2006).
- Thibault, O., Hadley, R., Landfield, P. W. Elevated postsynaptic [Ca2+]i and L-type calcium channel activity in aged hippocampal neurons: relationship to impaired synaptic plasticity. J Neurosci. 21, 9744-9756 (2001).
- Thibault, O., Landfield, P. W. Increase in single L-type calcium channels in hippocampal neurons during aging. Science. 272, 1017-1020 (1996).
- Stutzmann, G. E., Caccamo, A., LaFerla, F. M., Parker, I. Dysregulated IP3 signaling in cortical neurons of knock-in mice expressing an Alzheimer's-linked mutation in presenilin1 results in exaggerated Ca2+ signals and altered membrane excitability. J Neurosci. 24, 508-513 (2004).
- Stutzmann, G. E. Enhanced ryanodine receptor recruitment contributes to Ca2+ disruptions in young, adult, and aged Alzheimer's disease mice. J Neurosci. 26, 5180-5189 (2006).
- Lee, H. K., Min, S. S., Gallagher, M., Kirkwood, A. NMDA receptor-independent long-term depression correlates with successful aging in rats. Nat Neurosci. 8, 1657-1659 (2005).
- McNaughton, B. L., Douglas, R. M., Goddard, G. V. Synaptic enhancement in fascia dentata: cooperativity among coactive afferents. Brain Res. 157, 277-293 (1978).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon