Method Article
Vorbereitung der akuten Schnitten des Hippocampus von Ratten und transgenen Mäusen für das Studium der Synaptic Veränderungen während des Alterns und Amyloid-Pathologie
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt Verfahren zur Herstellung von Schnitten des Hippocampus von Ratten und transgenen Mäusen für die Untersuchung der synaptischen Veränderungen mit Gehirn Altern und altersbedingte neurodegenerative Erkrankungen wie Alzheimer-Krankheit.
Zusammenfassung
Das Nagetier Hippocampus Scheibe Vorbereitung ist vielleicht die am weitesten verwendete Werkzeug zur Untersuchung von Säugetieren synaptische Funktion und Plastizität. Der Hippocampus kann schnell und einfach von Ratten und Mäusen gewonnen werden und Scheiben bleiben für Stunden in Sauerstoff künstlichen Liquor lebensfähig. Darüber hinaus werden grundlegende Techniken electrophysisologic leicht auf die Untersuchung der synaptischen Funktion im Hippocampus Scheiben aufgebracht und haben lieferte einige der besten Biomarker für kognitive Beeinträchtigungen. Der Hippocampus Scheibe ist besonders beliebt für das Studium der synaptischen Plastizität Mechanismen für Lernen und Gedächtnis beteiligt. Änderungen in der Induktion der Langzeit-Potenzierung und Depression (LTP und LTD) der synaptischen Wirksamkeit in Schnitten des Hippocampus (oder deren Fehlen) werden häufig verwendet, um den neurologischen Phänotyp der kognitiv-beeinträchtigten Tieren und / oder beschreiben die Wirkungsweise von bewerten nootropische Verbindungen. Dieser Artikel beschreibt die Verfahren verwenden wir für die Vorbereitung Schnitten des Hippocampus von Ratten und transgenen Mäusen für die Untersuchung der synaptischen Veränderungen mit Gehirn Altern und Alzheimer-Krankheit (AD) 1-3 verbunden. Verwenden von gealterten Ratten und AD-Modell Mäuse bieten eine einzigartige Reihe von Herausforderungen für Forscher daran gewöhnt, mit jüngeren Ratten und / oder Mäuse in ihrer Forschung. Aged Ratten haben dickere Schädel und härter Bindegewebe als jüngere Ratten und Mäusen, die Hirn-Extraktion und / oder Dissektion Verzögerung und damit zu negieren oder zu übertreiben wirkliche Alter-Unterschiede in der synaptischen Funktion und Plastizität können. Altern und Amyloid-Pathologie kann auch verschärfen Hippocampus Schaden während der Dissektion Verfahren nachhaltig, wieder verkompliziert keine Rückschlüsse aus physiologischen Beurteilung erstellt. Hier diskutieren wir die Schritte während der Dissektion Verfahren, um diese Probleme zu minimieren. Beispiele der synaptischen Antworten in "gesund" und "ungesund" Scheiben von Ratten und Mäusen gewonnen vorgesehen sind, sowie Vertreter der synaptischen Plastizität Experimente. Die möglichen Auswirkungen der anderen methodologischen Faktoren auf die synaptische Funktion in diesen Tiermodellen (zB Aufnahme-Lösungskomponenten, Stimulationsparameter) werden ebenfalls diskutiert. Während der Schwerpunkt dieses Artikels basiert auf der Verwendung von alten Ratten und transgenen Mäusen, Novizen auf die Physiologie Scheibe finden sollten detailliert genug hier, um auf ihre eigenen Studien zu beginnen, mit einer Vielzahl von Tiermodellen.
Protokoll
1. Vorbereitung Eiskalte Oxygeniertes Artificial Liquor (ACSF)
- Bereiten Sie 2 L von "Ca 2 +-freien" ACSF. In einem 2L-Erlenmeyerkolben, fügen Sie ca. 1,5 l sterile oder doppelt destilliertem H 2 O, und beginnen unter kräftigem Rühren auf einer Rührplatte. Fügen Sie die folgenden ACSF Komponenten (in mM): 124 NaCl, 2 KCl, 1,25 KH 2 PO 4, 2 MgSO 4, 26 NaHCO 3 und 10 Dextrose (siehe Tabelle 1). Bringen Sie auf ein Volumen von 2 L mit destilliertem H 2 O.
- Mit einem Aquarium Bubbler und Schlauch an einem 95% O 2 / 5% CO 2 Luftbehälter, Oxygenat ACSF kräftig ca. 20-30 min. Prüfen Sie den pH-Wert und, falls erforderlich, auf 7,4 einstellen mit NaOH oder HCl.
- Gießen Sie 750 ml Sauerstoff Ca 2 +-freiem ACSF in eine separate Erlenmeyerkolben, decken Sie die Öffnung mit Parafilm und Überweisung auf ein ultrafreezer (-80 ° C) für 20-30 min. Diese Medien werden für die Präparation des Gehirns und des akuten Schnitten des Hippocampus verwendet werden *. Add 2 mM CaCl 2, um die verbleibenden 1,25 L Volumen von ACSF #, gut umrühren und wieder Oxygenierung mit 95% O 2 / 5% CO 2. Diese Medien werden für die Speicherung von Hirnschnitten nach dem Sezieren und für Perfusion Scheiben während der elektrophysiologischen Aufnahmen verwendet werden.
* Eiskalte Ca 2 + freie Medien wird verwendet, um den Stoffwechsel verlangsamen und minimieren Ca 2 +-abhängige Exzitotoxizität beim Präparieren.
# Änderungen in Ca 2 + Dysregulation während des Alterns und AD können einen großen Einfluss auf die Induktion von Ca 2 +-abhängige synaptische Plastizität 4-9. Widersprüchliche Berichte über altersspezifische Unterschiede in LTD kann teilweise auf die Verwendung von verschiedenen ACSF Ca 2 +: Mg2 +-Verhältnisse während der Scheibe Aufnahmen (siehe 2,4,10). Die Bedeutung der Ca 2 +-Regulation und die ACSF Ca 2 +-Ebene in Aging-Studien in größerem Detail in der Diskussion angesprochen. - Während die Ca 2 +-freiem ACSF friert, bereiten Sie einen Aufnahmekammer für die Wartung von Hirnschnitten vor und während der elektrophysiologischen Aufnahmen *. Wir verwenden ein benutzerdefiniertes Makro-Aufnahmekammer, die vier einzelnen Mikrokammern (siehe Abbildung 2) enthält. Die macrochamber mit steriler gefüllt ist, Sauerstoff H 2 O und die Mikrokammern sind im Wesentlichen Inseln, die über der Wasseroberfläche herausragen. Innerhalb der einzelnen Mikrokammer, Ruhe Scheiben auf saldiert einfügen in ein seichtes Becken des oxygenierten ACSF. Scheiben sind nicht vollständig untergetaucht, sondern sitzen an einer Schnittstelle mit der befeuchteten Luft. Eine isolierte Heizelement innerhalb der macrochamber ermöglicht die Temperatureinstellung.
* Mehrere Sorten von Haltekammern sind auch kommerziell erhältlich (z. B. Warner Instruments macht ein Untertauchen-style "Pre Chamber # BSC-PC) und sollte für den Einsatz in Alterungs-und transgenen Maus Scheibe Studien. In einer Prise, können Scheiben für aufrechterhalten werden mehrere Stunden in einer kleinen Petrischale mit ACSF gefüllt. Machen Sie ein kleines Loch in die Petri-Deckel für eine Sauerstoffzufuhr Rohr. Achten Sie darauf, dass Sauerstoffblasen nicht körperlich bewegen die Scheiben. Slices wird ausreichend Sauerstoff zu bekommen, wenn die Lieferung Rohr nur angehoben wird über dem ACSF Oberfläche (Gas Dispersion sollte zu einer Vertiefung in der Oberfläche der Flüssigkeit).
2. Brain-Removal-und Hippocampus Dissection in Aged (> 20-Monate alten Ratten-)
- Bereiten Sie die Dissektion Bereich * neben einem großen Becken (siehe Abbildung 1 und Tabelle 2). Legen Sie ein kleines Tier Guillotine in die Spüle und das Layout von chirurgischen Instrumenten und Materialien für Gehirn entfernt und Hippocampus Dissektion darunter ein gefaltetes Papier Handtuch, eine Nr. 11 Skalpell, Schere beebee, Knochen Rongeure, ein "Hippocampus-Tool" (eine spezielle Dual-Spatel aus Feine Chirurgische Tools), kleine chirurgische Schere, einen dünnen double-ended Spachtel, Kunststoff Pasteurpipette, 110 mm Durchmesser Whatman Filterpapier, ein Deckel 100 mm Glas-Petrischale mit Eis gefüllt und einem Plastiklöffel. Halten Sie auch eine Plastiktüte in der Nähe zur Entsorgung des Kadavers.
* Brain-Extraktion so schnell wie möglich abgeschlossen werden sollte, so ist es eine gute Idee, geistig das Verfahren "durch gehen" und legen Sie Ihre Instrumente in der Reihenfolge der Verwendung. - Entfernen Ca 2 +-freiem ACSF aus der Tiefkühltruhe. Die Medien sollten teilweise, nicht ganz, gefroren. Gießen Sie etwa 50 ml ACSF in ein Becherglas, Deckel mit Parafilm und Platz neben der Präparation Bereich. Diese Medien werden verwendet, um kurz zu speichern das Gehirn, wenn es entfernt wird. Die restlichen Ca 2 +-freien Medien werden verwendet, um das Reservoir in der Vibratom für Stück Vorbereitung zu füllen. Diese Medien können reoxygenated, oder einfach mit Parafilm abgedeckt und im Kühlschrank bei 4 ° C.
- Euthanize der Ratte mit Methoden, die von der Institutional Animal Care und Verwenden Committee (IACUC) zugelassen. Unsere Tiere sind in einem kleinen Plexiglas-Kammer, die sich allmählich mit 100% CO 2 ausgefüllt ist. Verlust des Bewusstseins erfolgt in der Regel innerhalb von fünf Minuten und ist durch das Fehlen der Reflex-Aktivität bestätigtnach einem Zeh kneifen.
- Enthaupten die Ratte unmittelbar rostral des ersten Halswirbels und platzieren Sie den Kopf auf die gefalteten Papiertuch. Mit der Nr. 11 Skalpell, schnell einen Einschnitt in der Mitte der Kopfhaut ab in der Nähe des Nasenbeins und läuft kaudal des Os occipitale. Achten Sie darauf, vollständig durch die Hautmuskel, voll Freilegung der Nähte auf der dorsalen Oberfläche des Schädels.
- Schnitt durch den Schädel Platten mit beebee Schere. Bei jungen Ratten und Mäusen, kann der Schädel schnell mit der Verwendung von Knochen Rongeure allein entfernt werden. Allerdings haben im Alter von Ratten dickeren Schädel als junger Erwachsener Ratten und Mäusen, die dieses Verfahren schwierig sein kann. Wir haben festgestellt, dass Schneiden durch den Schädel erleichtert Knochenentfernung mit Rongeuren, verringert Schädigung des Gehirns, und spart wertvolle Sekunden. Mit der Ratte den Kopf fest auf die Tischplatte, legen Sie die Schneide des unteren schiere des beebee Schere in die überlegene Bereich des Foramen magnum am hinteren Teil des Schädels. Keeping the unteren schiere fest gegen den Schädel der inneren Oberfläche (und Entfernung aus dem Gehirn) *, durch den Hinterkopf Platte geschnitten und dann entlang der Mittellinie Naht der Parietal-Platten. Gehen rostral bis Sie durch den frontalen Schädel Platten geschnitten.
* Es ist sehr wichtig, dass der Druck weg vom Gehirn ist, um eine versehentliche Messung zu verhindern gerichtet. - Trennen Sie die occipital, parietal und zeitliche Schädel Platten aus dem Gehirn. Halten Sie den Kopf fest auf der Arbeitsplatte für die Stabilität und Leverage und schieben Sie den Unterkiefer des Rongeure unter dem linken parietalen Platte Aufrechterhaltung Druck gegen die Innenseite des Schädels. Anschließend drücken Sie die Kiefer der Rongeure zusammen und rollen Sie Ihr Handgelenk nach oben und zu sich auf die parietalen und okzipitalen Platten wegziehen aus dem Gehirn. Dies sollte ebenfalls die meisten der dorsalen Oberfläche der linken Hemisphäre. Wenn nötig, verwenden Sie die Rongeure nach links Frontplatte sowie zu entfernen. Wiederholen Sie diesen Vorgang für die andere Hemisphäre. Sobald die Platten verschoben sind, schnell für jede dura Rolle, dass die zeitliche Platten angebracht werden kann und erstreckte sich über die Oberfläche des Gehirns zu untersuchen. Ziehen Sie diese weg mit dem Rongeure oder wegschneiden mit einer Schere *. Nun schieben Sie den Oberkiefer des Rongeure zwischen dem Gehirn und der rechten Schläfe Platte, wieder halten den Druck auf den Schädel und vom Gehirn. Squeeze und drehen Sie den zeitlichen Teller weg vom Gehirn. Sie hören / fühlen "Crunch", wie Sie dies tun. Wiederholen Sie für die linke Seite.
* Die Dura kann schwer zu erkennen, vor allem wenn das Tier wurde transkardial mit ACSF perfundiert. Allerdings, wenn dura nicht entfernt werden, werden sie durch das Gehirn (und wahrscheinlich der Hippocampus) wie ein Rasiermesser, wenn zeitliche Platten entfernt werden Scheiben schneiden. Snipping die Dura entfernt in der Nähe des zeitlichen Platten minimiert die Wahrscheinlichkeit von stechenden des Gehirns. - Entpacken Sie das Gehirn *. Schnelles Entfernen der Parafilm von der Ca 2 +-freiem ACSF "matschig". Schieben Sie nun den breiten Spatel Leiter des Hippocampus Werkzeug zwischen dem ventralen Oberfläche des Gehirns und der unteren Schädel-Platten, bis sie vollständig unter das Gehirn. Bewegen Sie den Spachtel seitlich von einer Seite zur Seite und dann nach vorne und hinten ein paar Mal auf intakte Hirnnerven zu durchtrennen. Jetzt schöpfen das Gehirn mit dem Hippocampus-Tool und tauchen in Ca 2 +-freiem ACSF und Deckel mit Parafilm. Lassen Sie das Gehirn Chill für etwa eine Minute. Dies ist ein günstiger Zeitpunkt, um sauber aus der Guillotine, entsorgen Sie die Karkasse und Reorganisation der Dissektion Bereich.
* Für die Schritte 2,3-2,7, ist Eile geboten. Wir versuchen, dieses Verfahren (aus Enthauptung des Gehirns Untertauchen in ACSF) in 30-35 sec abgeschlossen. In unserer Erfahrung, wobei Extraktionen länger als eine Minute angezeigt zu beeinträchtigen Hippocampus Scheibe Gesundheit, insbesondere für ältere Ratten. Mit diesen Verfahren haben wir keine Unterschiede in Extraktionszeiten zwischen alten und jungen Ratten, die für unsere Studien beobachtet. - Entpacken Sie die hippocampi. Legen Sie die Whatman Filterpapier auf dem Deckel des eiskalten Petrischale und dämpfen das Papier mit ACSF mit dem Kunststoff Transferpipette. Rufen Sie das Gehirn aus dem ACSF mit einem Löffel und auf den angefeuchteten Whatman-Papier. Mit dem Skalpell entfernen des Kleinhirns und rund ein Viertel des rostralen Frontallappen. Führen Sie das Skalpell durch die intrahemispheric Riss vollständig zu trennen die beiden Hemisphären. Legen Sie eine Hemisphäre zurück in die ACSF matschig und "stand" der anderen auf dem Sezieren der Bühne, so dass der koronalen Ebene der Frontallappen nach unten zeigt. Sie sollten eindeutig in der Lage an den Hirnstamm und Mittelhirn (die weißen) von der darüber liegenden Kortex (die rosa / grau) zu unterscheiden. Suchen Sie den oberen und unteren Colliculi auf dem Mittelhirn, diese werden wie zwei weiße "Knöpfe" Look und wird an der "Spitze" des Gehirns in dieser Ausrichtung werden. Mit dem OP-Schere, sanft halten das Mittelhirn, und schieben Sie die Waage Spatel in die Lückezwischen den Colliculi und der Neocortex. Sehr sanft, weiterhin dem Spatel nach unten rutschen und ziehen Sie den Hirnstamm / Mittelhirn / Thalamus weg enthüllt die Innenseite des lateralen Ventrikel und der medialen Oberfläche des Hippocampus. Verwenden Sie die scharfe Kante der Spachtel glatt durchtrennen die Fornix, ein weißes Faserbündel an der vorderen / hinteren Teil des Hippocampus entfernt. Mit der Schere vorsichtig weiter zum Hirnstamm / Mittelhirn / Thalamus weg, ohne vollständig durchtrennen sie vom Rest des Gehirns ziehen. Der Kortex mit Hippocampus sollte nun frei zurück legen aus dem Hirnstamm *. Als nächstes drehen Sie das Sezieren der Bühne, so dass Sie an der medialen Hippocampus und Kortex darüberliegenden suchen, als ob es einen Sagittalschnitt (minus den Thalamus) wurden. Sie sollten nun die weiße fimbria Fasern, die eine flache Hyperbel an der Unterseite des Hippocampus in dieser Ebene bilden. Mit den Kunststoff übertragen Pipette vorsichtig spritzen einige ACSF in den Spalt unter der Fimbrien zur Trennung der Hippocampus aus der Rinde zu helfen. Schieben Sie den Spatel in diese Lücke, so dass die lange Seite des Spatels verläuft parallel mit der Längsachse des Hippocampus. Nach dem Spatel ist komplett unter der Hippocampus, halten Sie den Hirnstamm / Mittelhirn / Thalamus fest mit der Schere und rollen Sie den Spatel weg von Ihrem Körper die physikalische Trennung der Hippocampus aus dem Rest des Gehirns. Sobald der Hippocampus ist kostenlos, leicht wegschneiden verbleibende Cortex, Blutgefäße und weißen Substanz. Scoop eine kleine Menge von ACSF matschigen auf der anderen Seite des Sezieren der Bühne. Vorsichtig Position der Hippocampus neben dem Schneematsch und begießen mit ein paar Milliliter ACSF mit dem Kunststoff Transferpipette. Dann entfernen Sie die andere Hemisphäre, und wiederholen Sie das Sezieren.
* Sie müssen die Schere snip weg zusätzliche Bindegewebe, weißen Substanz oder Gefäße, die Trennung der Hirnrinde verhindert den Hirnstamm. Die Punkte der Schere wird in unmittelbarer Nähe des Hippocampus, so sicher sein, sehr präzise Schnitte (scharfe Schere sind ein Muss) zu liefern.
3. Brain-Removal-und Hippocampus Dissection in Aged transgenen Mäusen
- Euthanize und köpfen die Maus und eine Mittellinienschnitt auf der Kopfhaut, wie in Abschnitt 2.3 beschrieben. Mäuse haben viel dünneren Schädel als Ratten, die stark vereinfacht Gehirn Extraktion. Schneiden durch den Schädel mit einer Schere ist daher nicht erforderlich. Verwenden Knochen Rongeure mit kleineren Kiefer (Tabelle 2), wegzuziehen, occipital, parietal und zeitliche Schädel-Platten. Wie bei der Ratte, denken Sie daran, kontrollierte Bewegungen verwenden, und ziehen Sie den Unterkiefer des Rongeure in die innere Oberfläche des Schädels und der Entfernung aus dem Gehirn, wie Sie die Platten zu entfernen. Sobald die Platten entfernt werden, verwenden Sie das schmale Ende der Hippocampus-Tool, um die verbleibenden Hirnnerven sever und Schaufel das Gehirn in eiskaltes Ca 2 +-freiem ACSF.
- Bereiten Hirnschnitten. Aufgrund der geringeren Größe der Maus Gehirn sezieren die hippocampi kann ein bisschen schwieriger (wenn auch sicherlich machbar) als bei Verwendung von Ratten. So, Dinge einfacher zu machen, entfernen wir das Kleinhirn und rostralen Spitzen der Frontallappen, aber nicht sezieren die hippocampi. Stattdessen werden Gehirnhälften physisch mit einem Skalpell abgetrennt und intakt gelassen für Vibratom Schnitte (siehe Abschnitt 4 unten).
4. § Hirngewebe in Scheiben mit einer Vibrating Mikrotom (Vibratom) und Transfer zum Aufnahmekammer *
- Füllen Sie das Reservoir des Vibratom mit eiskaltem Ca 2 +-freiem ACSF, so dass die Schneiden der Bühne und Klinge sind komplett überflutet. Für die Herstellung Ratte Scheiben schneiden, schneiden Sie die rostralen und kaudalen Spitzen der Hippocampus mit einem Skalpell. Diese Kürzungen können Sie vertikal Position der Hippocampus eng zusammen wie zwei Säulen. Dies funktioniert am besten, wenn der Gyrus dentatus des Hippocampus ist jeweils einander zugewandt und CA3 Regionen sind in der gleichen Richtung ausgerichtet sind. Für die Herstellung Maus Scheiben, vertikal Position jeder Hemisphäre eng mit Stirnlappen nach unten. Kleber Hirngewebe auf einem Montageblock und Transfer zum Schneiden Phase des Vibratom. Wir bereiten in der Regel ~ 400 uM Abschnitte für die synaptische Physiologie Experimente. Dünnere Schnitte sollten darauf vorbereitet sein, wenn Fluoreszenz-Imaging wird durchgeführt (z. B. Untersuchungen der Ca 2 +-Spiegel und Transienten) werden. Sammeln Scheiben mit einem breit-Mund-Pipette oder einem Pinsel # und Transfer zu einem kleinen Petrischale mit eiskaltem Ca 2 +-freiem ACSF.
* Einer Vibratom minimiert Schäden an der Ober-und Unterseite der Scheibe verwenden und ist definitiv für Studien erfordern Analyse von Zellen in der Nähe der Scheibe Oberfläche (zB Voltage-Clamp-und Ca 2 +-Imaging-Studien) empfohlen. Jedoch sind preiswertere Alternativen verfügbar und geeignet zur Erzeugung von Scheiben für extrazelluläre Physiologie Experimente. Wir haben einen kleinen Schwerpunkt-gesteuerte Chopper 2,11 und eine McIlwain Tissue Chopper 12 mit gutem Erfolg eingesetzt. Für this Verfahren hippocampi sind auf einer inszenierten und geschnittenen mit einer vertikalen Chopper platziert. Eine Bürste wird verwendet, um Scheiben (eins zu einem Zeitpunkt), um eine Parzelle Schüssel mit eiskaltem Ca 2 +-freiem ACSF gefüllt zu übertragen. Ein Problem bei diesem Ansatz ist, dass der Hippocampus kann zwischen Koteletts was zu ungleichen Teilen bewegen. Achten Sie auch darauf, so viel der weißen Substanz, und vor allem so viel Gefäßsystem, wie möglich, bevor Hacken entfernen. Dieses Material wird auf die Bürste, die Rasierklinge, oder beides, was slice Transfer sehr schwierig und die Wahrscheinlichkeit erhöht, der Dehnung oder eine Beschädigung des Gewebes kleben.
# Bei Verwendung einer Bürste, versuchen, die Scheibe Länge nach über die Borsten ruhen. Wrapping der Scheibe um die Pinselspitze können unnötige Gewebe dehnen. - Transfer Hirnschnitten der Aufnahmekammer, wo sie in Sauerstoff Ca 2 +-haltigen ACSF gebadet werden. Allmählich bringen die Kammer Temperatur von 27 ° bis 32 ° C (+1 ° alle fünf Minuten). Lassen Sie Slices für 1-1.5 h, bevor elektrophysiologische Experimente inkubieren.
5. Elicit und Record CA3-CA1 Synaptic Responses
- Für grundlegende extrazelluläre Ableitungen in akuten Schnitten, wird Ihr Elektrophysiologie-Station müssen * sind: eine Aufnahme Kammer, eine Perfusion System, ein Mikroskop mit> 4-fache Vergrößerung Fähigkeit, Aufzeichnung, anregend und Masseelektroden; Makro-und Mikromanipulatoren, eine starre vibrationsfest Tisch-und Faraday-Käfig, ein Stimulator, Verstärker und Analog-Digital-(A / D-Wandler); Oszilloskop (vorzugsweise) und persönliche PC mit entsprechender Software zur Erfassung.
* Kerr Scientific Instruments bietet eine fantastische und preiswerte Elektrophysiologie-System (dh die Kerr Tissue Recording System) für die Durchführung einer Vielzahl von grundlegenden Scheibe Elektrophysiologie Experimente. Dieses System hat einen geringen Platzbedarf, portable Stimulatoren und Verstärker, und kann auf einem Standard-Labor-Bank ohne die Notwendigkeit eines sperrigen Faraday-Käfig verwendet werden.
Natürlich können Hirnschnitten auch für die Durchführung von zahlreichen aufwendigen elektrophysiologische und bildgebende Verfahren, die zusätzliche Ausrüstung und Materialien erfordern verwendet werden. Zum Beispiel enthält unsere Elektrophysiologie-Station einen Verstärker mit schnellen Spannungs-und Strom-Clamp-Funktionen, eine fluoreszierende Beleuchtungssystem und eine Digitalkamera. Diese Station ist für extrazelluläre field recordings in Hirnschnitten sowie Patch-Clamp-Aufnahmen und Fluoreszenz-Imaging in Scheiben schneiden und Zellkulturen 3,12,13 verwendet. Siehe Tabelle 3 für eine vollständige Liste der Geräte und Komponenten. - Mit einem breit-Mund-Pipette oder kleinen Pinsel, Transfer ein oder mehrere Segmente, um die Aufnahme Kammer * so dass sie für 10-15 min vor der Stimulation / Aufnahme akklimatisieren. Für unsere Untersuchungen sind Scheiben in ACSF und Ruhe zur Verrechnung in ein RC-22 Kammer von Warner Instruments eingefügt (siehe Abbildung 3) untergetaucht. ACSF ist die Schwerkraft-fed durch einen Regler zur Durchfluss-Einstellung, und vorgewärmt auf 32 ° C durch ein Inline-Mikro-Heizelement vor Erreichen der Aufnahme Kammer. Eine zentrale Vakuum-Leitung wird verwendet, um ASCF entfernen.
* Viele verschiedene Unterwasser-und Interface-Stil Aufnahme Kammern sind im Handel erhältlich. Wir haben beobachtet, dass Scheiben robuster synaptischen Antworten weisen in eine Schnittstelle Kammer (dh Scheibe sitzt an einer Schnittstelle mit feuchter Luft und ACSF) 2,11. Allerdings ist Empfindlichkeit der Regel stabiler, wenn Scheiben in ACSF sind untergetaucht. Drug Perfusion ist auch effizienter in Untertauchen Kammern. - Position anregend und Aufnahme-Elektroden. Mit dem Stimulator oder Stimulus Isolator eingeschaltet, aber Ausgang gewählt bis 0, Position eine stimulierende Elektrode über die Scheibe in das Stratum radiatum Region CA2 in der Nähe der CA3 Grenze (siehe Abbildung 4). Wir verwenden ein Twisted-Platin-Iridium-Draht auf 50-100 uS diphasische Impulse an CA3 Schaffer Sicherheiten (SC) Fasern liefern. Die Verwendung von Platin-Iridium-Draht-und zweiphasige Impulse helfen können minimiert Elektrodenpolarisation. Lower eine Aufnahme Elektrode in CA1 Stratum radiatum, nur bricht die Oberfläche der Scheibe. Unsere Aufnahme-Elektrode ist eine Ag / AgCl Draht in einer ACSF gefüllt Glasmikropipette (tip Widerstand von ~ 7 MOhm). Schalten Sie die Ausgabe auf dem Stimulator bis auf ein moderates Niveau (wir setzen unsere Stimulus Isolator auf ~ 150 uA) und beginnen die Verwaltung Reizimpulse und den Erwerb von Tätigkeit, bei der Übernahme-Software, wie CLAMPEX von Axon Instruments, Inc. Langsam senken die stimulierenden Elektrode in kleinen Abständen, bis ein Stimulus artificact ist in CA1 aufgezeichnet. Next weiterhin langsam senken sowohl die anregende und Aufzeichnung Elektroden in Abständen während erwerben CA1 Antworten, bis die Faser volley (FV) und die exzitatorischen postsynaptischen Potentials (EPSP) Amplituden erreichen maximal Werte (siehe Abbildung 4B).
- Stellen Sie eine synaptische Stärke Kurve und untersuchen synaptische Plastizität. Zur Erzeugung einer synaptischen Stärke Kurve liefern Impulse Impulse SC in immer höhere Intensitäten und aufzeichnen the entsprechende Aktivität in CA1. Die Reichweite und die Anzahl der Stimuluspegeln kann variieren, sollte aber ausreichen, um eine sigmoide Kurve zu erzeugen, wenn aufgetragen entweder FV oder EPSP-Werte (Abb. 5). Der FV Amplitude liefert eine zuverlässige Schätzung des Anteils der präsynaptischen Fasern aktiviert, während die EPSP Hang bietet eine unberührte Maß monosynaptische CA3-CA1 Ströme. Trägt man die EPSP Hang gegen den FV über Stimuluspegeln spiegelt daher die Größe des EPSP pro Anzahl der aktivierten Afferenzen und bietet eine ausgezeichnete Schätzung der CA3-CA1 synaptischen Stärke. Typischerweise sind synaptischen Stärke signifikant in der CA1 im Alter von Ratten und Mäusen APP/PS1, bezogen auf junge Ratten und gleichaltrigen Wildtyp-Mäusen siehe zB 4,14 reduziert.
- Slices, die Anzeichen von schlechter Gesundheit (dh eine maximale EPSP Amplitude <1 mV) oder Übererregbarkeit (dh das Auftreten von 2 oder mehr der Bevölkerung Spikes) zeigen während der synaptischen Stärke Kurve aus der statistischen Analyse (siehe Abbildung 4C) ausgeschlossen. Wir haben festgestellt, dass diese Scheiben nur selten zeigen stabile Reaktionen über eine 60 min Zeit und / oder zeigen sehr variable Reaktionen nach Induktion der synaptischen Plastizität. Es verdient darauf hingewiesen, dass "ungesunde Scheiben" machen nur etwa 10-20% aller Scheiben übertragen, um die Aufnahme Kammer. Außerdem in unserer Erfahrung ist die Häufigkeit der Identifizierung eines ungesunden Scheibe sehr ähnlich über Alter, Spezies und Genotyp.
- Induce Langzeit-Potenzierung (LTP) oder Langzeit-Depression (LTD) in Scheiben schneiden. LTP und LTD sind dauerhafte Erhöhungen (LTP) und nimmt (LTD) der synaptischen Funktion als Reaktion auf verschiedene Muster der synaptischen Aktivierung. Beide Prozesse sind allgemein angenommen, dass kritische Mechanismen für das Lernen und memory15 reflektieren und nützliche Ergebnisse Maßnahmen zur Untersuchung von zellulären Mechanismen der neuronalen Dysfunktion und / oder für die Beurteilung der pharmakologischen Strategien zur Linderung von Gedächtnisstörungen und Neurodegeneration 16.
Für synaptische Plastizität Experimente, setzen Sie die Reizstärke für alle Scheiben zu 1 mV * und beginnen Baseline Stimulation mit einer Frequenz von 0,033 Hz. EPSP Hang Werte sollten für mindestens 20 min vor der Induktion von LTP oder LTD stabil. Genau zu überwachen EPSPs während dieser Zeit und setzen Sie die Reizintensität, wenn die Steigung schwankt mehr als 10% und starten Sie eine neue Baseline. Induce LTP mit einem zweiten Zug von 100 Hz Stimulation oder mehrere kurze Bursts (~ 10 Impulse) von 100 Hz Stimulation gegeben alle 200 ms. Für LTD Induktion, liefern 900 Reizimpulse mit einer Rate von 1 Hz. Nach der Induktion von LTP oder LTD, sammeln synaptischen Antworten für weitere 60 min oder mehr. EPSP Hang Werte vor und 60 min nach dem high / low-Frequenz Stimulation vorhanden sind, verglichen mit der Anwesenheit von LTP oder LTD bestimmen.
Aged Ratten und Mäusen APP/PS1 eher mangelhaft LTP und verbesserte LTD (siehe Abbildung 5) zeigen, und diese Änderungen vorgeschlagen worden, um zu einer Beeinträchtigung der Kognition in diesen Tiermodellen 6,16 beitragen. Doch im Gegensatz zu APP/PS1 Mäuse, sind Veränderungen in LTP / LTD in alten Ratten Variable über Labore. Aged Ratten weisen in der Regel ähnlich LTP Ebenen im Vergleich zu Erwachsenen in Reaktion auf die "intensiven" (dh 100 Hz) Stimulation, sondern zeigen Defizite bei milder Stimulation Parameter verwendet werden (dh niedrigere Reiz Frequenzen oder weniger Reizimpulse) (für einen Überblick siehe 4,6, 16). Auch haben einige Labors, einschließlich der unsrigen, erhöhte Anfälligkeit für LTD Induktion beobachtet bei älteren Ratten 2,17-19, während andere Gruppen keinen Unterschied oder eine reduzierte Empfindlichkeit in ihre alten Tieren gefunden haben. Wie oben kurz beschrieben (siehe Diskussion), kann feine, aber entscheidende Unterschiede in der experimentellen Protokoll für diese Diskrepanzen Konto.
* Die Intensität der Stimulation und EPSP Amplitude beeinflussen können LTP Induktion und kann eine wichtige Ursache für abweichende Ergebnisse in der Literatur. Dies wird in der Diskussion berücksichtigt werden.
6. Repräsentative Ergebnisse
Unsere Arbeit und die Arbeit von anderen Gruppen, legt nahe, dass Veränderungen in Astrozyten-basierte entzündlichen Signalisierung auslösen können und / oder zu beschleunigen neurologische Dysfunktion während des Alterns und AD 13,20,21. Vor kurzem haben wir synaptischen Stärke, LTP und LTD als Endpunkt Maßnahmen verwendet werden, um die Wirksamkeit und Wirkmechanismen von mehreren neuartigen anti-inflammatory Reagenzien in Mitte im Alter APP/PS1 Mäusen (siehe 22 für die Beschreibung dieses Modells) zu untersuchen und im Alter von Fischer 344 Ratten. Die Ergebnisse lieferten unten wurden unter Verwendung der Protokolle in diesem Artikel beschrieben.
Einer der neuen anti-inflammatory Adeno-assoziierte Viren (AAV) Reagenzien, die von unserem Labor entwickelt hat in Pilotstudien konnte gezeigt werden deutlich erhöhen synaptischen Stärke (p <0,05) und verhindern, dass LTP Defizite (p <0,05) in Mitte im Alter (16 Monate alt) APP/PS1 Mäusen (n = 4-6 Scheiben pro Behandlung Zustand). Vertreter synaptischen Stärke Kurven und LTP Experimente aus zwei verschiedenen Scheiben, collected aus dem gleichen 16-Monate alten APP/PS1 Maus, sind in Abbildung 5A-C gezeigt. Eine Scheibe wurde von der Hemisphäre mit unserem neuartigen AAV behandelt extrahiert (Reagenz A), während die andere Scheibe mit einer Kontrollgruppe AAV-Reagenz (Control) behandelt wurde. LTP wurde in beiden Scheiben mit zwei 1 sec Züge von 100 Hz Stimulation (10 sec intertrain Intervall) induziert. Beachten Sie, dass die synaptische Stärke-Kurve für das Reagenz A-behandelten Scheiben auf der linken Seite der Steuerung Scheibe, was auf höhere synaptische Stärke verschoben wird. Beachten Sie auch, dass typisch für Mitte im Alter APP/PS1 Mäuse, LTP schnell zerfallen zum Ausgangswert in der Kontrollgruppe Scheibe (zB 23). Umgekehrt zerfallen LTP wenig in die Scheibe mit unserem neuartigen Reagenz behandelt.
In einer zweiten Studie beobachteten wir signifikante LTD in Vehikel-behandelten Ratten im Alter (85% der pre-LTD Baseline, p <0,05). Im Gegensatz dazu war keine LTD in alten Ratten mit neuartigen anti-inflammatory "Drug A" (97% der pre-LTD Grundlinie, nicht signifikant) behandelten Patienten beobachtet. Kein Medikament Auswirkungen auf die synaptische Stärke beobachtet. Vertreter LTD Experimente aus diesem Datensatz (n = 8-10 Ratten pro Gruppe) sind in Abbildung 5D-F dargestellt.
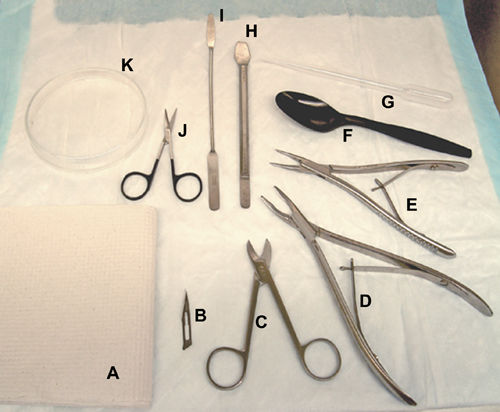
Abbildung 1. Werkzeuge und Materialien für Gehirn Dissektion verwendet. A, Papiertuch. B, Skalpell. C, Beebee Schere. D-, Knochen-Rongeure (für Ratten). E-, Knochen-Rongeure (für Mäuse / Ratten). F, Plastiklöffel. G-, Kunststoff-Transferpipette. H, Hippocampus-Tool. I, Spachtel. J, chirurgische Scheren. K-, Glas-Petrischale.

Abbildung 2. Benutzerdefinierte Hirnschnitt Aufnahmekammer. A, macrochamber. B, Deckel. C, H 2 O-Reservoir mit perforierten Silikonschlauch. D, Mikrokammer. E, ACSF Zuführungsrohr (Polyethylen). F, O 2 Zuführungsrohr. G, Port für die Temperaturregelung. H, saldiert Mikrokammer einzufügen.

Abbildung 3. RC22 Versenkkammer. A, Recording Kammer. B, Ground-Elektrode. C, Aspiration Nadel.

Abbildung 4. Hippocampus Scheibe Illustration und extrazellulären Signalen. A, Cartoon einer transversalen Hippocampus Abschnitt in der Elektrophysiologie Experimente verwendet. CA = Ammonshorn. DG = Gyrus dentatus. SC = Schaffer-Kollateralen. S radiatum = Stratum radiatum. B, elektrische Stimulation des SC (a CA3 Axon-Darm-Trakt) ein Stimulus Artefakt hervorruft, folgte fast sofort durch einen präsynaptischen Bevölkerung spike oder Faser-Volley (FV). Die Amplitude der FV ist direkt proportional zu der Anzahl der SC-Fasern aktiviert. Die Steigung der negativen laufenden Phase des Feldes exzitatorischen postsynaptischen Potentials (EPSP) bezieht sich direkt auf die Aktivierung von depolarisierende synaptische Ströme in CA1 pyramidalen Neuronen in Reaktion auf Entlassung aus dem SC-Terminals Glutamat. C, Overlapping Vertreter extrazellulären Signalen in CA1 Stratum radiatum in Reaktion auf neun verschiedene Stimuluspegeln (3-50 uA) in eine "gesunde" (linkes Bild) aufgenommen, "ungesund" und "hypererregbarer" Scheibe. Fünf Kurven wurden pro Stufe gemittelt. Gesunde Scheiben reagieren dynamisch auf dieses Stimulus-Bereich und weisen eine einzige positive laufenden Bevölkerung spike (reflektierende CA1 neuronaler Entladung) auf den höheren Ebenen Reiz. In der RC22 Versenkkammer, maximal EPSPs typischerweise im Bereich von 1,5 bis 3 mV Amplitude. Ungesunde Scheiben (Mitte) zeigen oft eine große FV, aber eine kleine maximale EPSP (<1 mV) und in der Regel eine schlechte Plastizität. Hypererregbarer Scheiben (rechts) zeigen zwei oder mehr regenerative Bevölkerung Spikes in den aufsteigenden Teil des EPSP. Responses in hypererregbarer Scheiben sind oft labil und sind variabel LTD / LTP Stimulation beeinflusst.

Abbildung 5. Vertreter Elektrophysiologie Experimente an akuten Schnitten ab Mitte im Alter (16 mos) APP/PS1 Mäusen und Alter (22 mos) Fisher 344 Ratten durchgeführt. Panels AB zeigen Daten aus APP/PS1 Mäusen mit einer Kontrollgruppe Adeno-assoziierte (AAV) viral behandelt gesammelt Konstrukt (Control) oder eine neuartige AAV (Reagenz A), die von unserem Labor Gruppe entwickelt wurde. Bezogen auf die Kontrolle Scheibe, die Scheibe mit Reagenz behandelt A weist eine deutliche Linksverschiebung in der EPSP: FV-Kurve (A), was auf höhere synaptische Stärke. Das Reagenz-A-behandelten Scheibe zeigt auch robust und stabil LTP (B) nach der Lieferung von zwei 1 sec, 100 Hz Stimulus Züge, während die Kontrollgruppe Scheibe weist mangelhafte LTP, die typisch für dieses Tiermodell. Panels DF zeigen Daten aus zwei einzelnen alten Ratten, dass eine chronische (4 Wochen) intrahippocampal Perfusionen eines Fahrzeugs oder einer neuartigen anti-inflammatory Droge (Drug A) erhielt gesammelt. Basal synaptischen Stärke war relativ unbeeindruckt von medikamentösen Behandlung(D). Allerdings Drug A war sehr wirksam bei der Verhinderung der Induktion von LTD (E). Panels C und F zeigen repräsentative EPSP Wellenformen aus einzelnen Scheiben, bevor aufgezeichnet (pre) und 60 min nach (post) die Lieferung von LTP / LTD Stimulation. Beachten Sie, dass Stimulus Artefakte sind nicht dargestellt.
Diskussion
Die Schritte in diesem Protokoll beschriebenen hilft sicherzustellen, dass Gehirn Dissektionen out sind mindestens so schnell und effizient in Jahren durchgeführt, wie in jungen erwachsenen Ratten. Wir bieten auch ausreichend detailliert für den Anfänger für die Errichtung ihrer eigenen Slice Studien LTP und LTD. Wenn die weitere Erforschung des Alterns und AD Veränderungen der synaptischen Funktion und Plastizität ist eines Ihrer Ziele, gibt es mindestens zwei weitere methodische Fragen, oben angedeutet, dass weitere Beachtung verdienen. Zunächst in verschiedenen Laboren haben gezeigt, dass die Ca 2 +: Mg2 +-Verhältnis in der Aufnahme ACSF eine deutliche Wirkung auf die Induktion synaptischer Plastizität im Hippocampus Scheiben 2,10,24,25 können. In Säugetierzellen CSF, die Ca 2 +: Mg2 +-Verhältnis von rund eins (siehe zB 26). Allerdings ACSF Ca 2 +: Mg2 +-Verhältnisse näher zu 2 werden in der Regel in Scheiben Studien der synaptischen Funktion und Plastizität eingesetzt. In frühen Studien, diese Praxis wahrscheinlich wurde angepasst, um die Induktion von LTP zu optimieren, anschließend wurden zur Routine für alle Plastizität Studien. Allerdings kann diese Praxis in Alterungs-und AD-Studien problematisch, weil der gut charakterisierten Unterschiede in der neuronalen Ca 2 +-Regulation. Genauer gesagt, Ca 2 +-Einstrom und / oder Ca 2 +-induzierte Ca 2 +-Version ist in alten Ratten und / oder AD-Modell-Mäusen während der neuronalen Aktivierung 3,27-31 erhöht. Induktion von LTD ist besonders empfindlich auf subtile Veränderungen in ACSF Ca 2 +-Spiegel. Unser Protokoll, das 2 mM Ca 2 + und 2 mM Mg2 +, führt häufig zu LTD für ältere, nicht aber junge Tiere 2, während Studien mit einem Ca 2 + verwendet: Mg2 + Verhältnis näher bei zwei, haben robuste LTD bei Erwachsenen beobachtet in der Abwesenheit von einem Altersunterschied 2,10 oder in Verbindung mit reduzierten LTD in alten Ratten 32. Diese Beobachtungen unterstreichen die Notwendigkeit, sorgfältig zu prüfen, ACSF Ca 2 + und Mg2 +-Konzentrationen beim Vergleich Ca 2 +-abhängige Plastizität in alten und jungen erwachsenen Tieren.
Das zweite methodische Problem betrifft die starke Abhängigkeit von LTP auf postsynaptische Depolarisation 33 und die Alterung / Genotyp Unterschiede in der synaptischen Stärke. In einem typischen Experiment LTP, Baseline und LTP Stimulationsintensität ist in der Regel eingestellt, um eine halbmaximale (oder drei Viertel maximal) EPSP Amplitude zu erzeugen. Das mögliche Problem ist, dass im Alter von Ratten und Mäusen APP/PS1 zeigen meist synaptischen Stärke im Verhältnis zu ihren jüngeren und / oder Wildtyp-Gegenstücke reduziert, so dass Baseline EPSP Werte werden auch kleinere in alten Ratten und Mäusen APP/PS1. Kleinere EPSPs kann auf weniger Depolarisation während LTP Stimulation zu übersetzen, was zu einer verringerten Wahrscheinlichkeit für die Induktion LTP 33. Aufgrund dieser potenziellen verwechseln, ist es schwierig, festzustellen, ob diese Tiere einen Durchsatz Defizit, eine Plastizität Defizit oder beides aufweisen. Das heißt, LTP Induktion Mechanismen in Alter und / oder APP/PS1 Mäusen funktionell intakt (keine Plastizität Defizit), aber nicht ausreichend stimuliert (Durchsatz Defizit) unter diesen Bedingungen. Diese Unterscheidung ist wichtig, da die Mechanismen für den Durchsatz und Mechanismen für die Plastizität sehr unterschiedlich reagieren können, um eine spezifische pharmakologische Behandlung. Wir versuchen, die Auswirkungen eines geringeren Durchsatz auf LTP-Induktion durch die Normalisierung der EPSP Amplitude auf der gleichen Ebene (z. B. 1 mV) über alle Scheiben vor der LTP Stimulation zu minimieren. Andere Strategien können wirksam sein, als auch (zB Verwendung von Spannung oder Strom Klemme an das Membranpotential zwischen Gruppen auszugleichen während LTP-Stimulation), und sollte bei der Untersuchung von LTP in diesen Tiermodellen werden.
Offenlegungen
Danksagungen
Arbeit unterstützt durch NIH AG027297, eine Auszeichnung von der Kentucky Spinal Cord und Head Injury Research Trust, und ein Geschenk der Kleberg Foundation.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | |
| NaCl | Fischer | BP358-1 | |
| KCl | Fischer | BP366-500 | |
| KH 2 PO 4 (einbasischen) | Sigma | P5379-100G | |
| MgSO 4 | Sigma | M2643-500G | |
| CaCl 2 (Dihydrat) | Sigma | C3306-250G | |
| NaHCO 3 | Fischer | S233-500 | |
| C 6 H 12 O 6 (Dextrose) | Fischer | BP350-1 |
Tabelle 1. Reagenzien erforderlich
| Bezeichnung des Geräts | Firma | Katalog-Nummer | Kommentare |
| Erlenmeyerkolben | Fischer | FB-500-2000 FB-500-1000 | |
| Aquarium Bubbler | Wird für sauerstoffartig Medien. Erhältlich in den meisten Zoohandlungen | ||
| 50 ml Becherglas | Fischer | 02-540G | Für Gehirn storarge in ACSF |
| Parafilm | Fischer | 13-374-10 | |
| Small Animal Guillotine | World Precision Instruments (WPI) | DCAP-M | |
| Flache Papiertuch | |||
| Nr. 11 Feather Skalpell | Fischer | 08 bis 916-5B | |
| Beebee Knochen Schere | Feine Science Tools (FST) | 16044-10 | |
| Lempert Rongeure | Roboz | RS-8321 | Verwenden Sie für Ratten |
| Friedman-Pearson Rongeure | FST | 16020-14 | Verwenden Sie für Mäuse oder Ratten |
| Hippocampus-Tool | FST | 10099-15 | |
| Löffel | Ein Kunststoff Teelöffel tun | ||
| Spachtel | Fischer | 21 bis 401-25A | Spachtel |
| Chirurgische Iris Schere | FST | 14058-09 | |
| Kunststoff-Transfer Pipetten | Fischer | 13-711-43 | |
| 110mm Whatman Filterpapier | Fischer | 09-805E | Whatman Katze. 1001-110 |
| Glas-Petrischale | Fischer | ||
| Leica VT1000P Manuelle Vibrating Mikrotom | Vibratom | ||
| 0.1mm FA-10 Feather S Klinge | Ted Pella | 121-9 | 0.1mm FA-10 Feather S Klinge |
| Borosilikatglas Pasteur-Pipette (mit Gummiball) | Fischer | 13 bis 678-20A | Für die Übertragung von Scheiben: Tip abgebrochen und Wärme-poliert für größere Öffnung |
| 35 mm Polysterine Kulturschale | Corning | 430588 | Wird für das Sammeln Scheiben nach der Sektion |
Tabelle 2. Werkzeuge und Materialien für die Präparation
| Ausstattung / Werkstoffe | Firma | Kommentare (optional) |
| Aufnahmekammer | Custom Built | |
| P-97 Horizontal Pipette Puller | Sutter Instrument Co. | |
| Schwingungsisolierung Tabelle | Technische Manufacturing Corporation (TMC) | |
| Faraday-Käfig | Maßarbeit | |
| Pyrex Aspirator Flasche mit Bottom Sidearm (Product # 1220-1L) | Corning | |
| Gravity-kontrollierter IV Set mit Regler (Product # 2C8891) | Baxter | |
| Zentrale Vakuum-Leitung | Erhältlich in den meisten modernen Labors | |
| 95% O 2 / 5% CO 2 Gas Mix | Schottet-Gross Co. | |
| TygonTM Lab Schlauch Für O 2 / CO 2 Lieferung | Fisher Scientific | Nicht giftig, nicht oxidierenden, kommt in einer Vielzahl von Größen. |
| Eclipse-E600FN Mikroskop | Nikon | mit 10x und 40x-Objektive, in der Nähe infared Filter und GFP, DS-Red2 Filter |
| Coole Snap-ES Digital Camera | Photometrics | Coole Snap-ES Digital Camera |
| X-Cite Fluorescent Illuminator | EXFO | X-Cite Fluorescent Illuminator |
| Mikroskop-Plattform | Siskiyou | Benutzerdefinierte montiert |
| RC-22 Submersible Aufnahme Kammer (Product # 64-0228) | Warner Instruments (WI) | Benötigt P-1-Plattform und Bühne Adapter (Product # 64-0277 Von Warner) |
| TC2BIP 2/3Ch Temperaturregler | Zell Microcontrols | TC2BIP 2/3Ch Temperaturregler |
| 4-Achsen-Handbuch Miniature Manipulator | Siskiyou | |
| Platinum Iridium-Draht (0,002 in) (Teil # PTT0203) | WPI | |
| A365 Stimulus Isolator | WPI | A365 Stimulus Isolator |
| Multiclamp 700b Verstärker | Axon Instruments | |
| Digidata 1322a A / D-Wandler | Axon Instruments | |
| PClamp Software | Axon Instruments | |
| Personal Computer (Pentium 4) | Dell |
Tabelle 3. Elektrophysiologie Ausrüstung und Materialien
Referenzen
- Norris, C. M., Halpain, S., Foster, T. C. Alterations in the balance of protein kinase/phosphatase activities parallel reduced synaptic strength during aging. J Neurophysiol. 80, 1567-1570 (1998).
- Norris, C. M., Korol, D. L., Foster, T. C. Increased susceptibility to induction of long-term depression and long-term potentiation reversal during aging. J Neurosci. 16, 5382-5392 (1996).
- Norris, C. M. Hippocampal 'zipper' slice studies reveal a necessary role for calcineurin in the increased activity of L-type Ca(2+) channels with aging. Neurobiol Aging. 31, 328-338 (2010).
- Burke, S. N., Barnes, C. A. Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161 (2010).
- Foster, T. C. Calcium homeostasis and modulation of synaptic plasticity in the aged brain. Aging Cell. 6, 319-325 (2007).
- Foster, T. C., Norris, C. M. Age-associated changes in Ca(2+)-dependent processes: relation to hippocampal synaptic plasticity. Hippocampus. 7, 602-612 (1997).
- Thibault, O., Gant, J. C., Landfield, P. W. Expansion of the calcium hypothesis of brain aging and Alzheimer's disease: minding the store. Aging Cell. 6, 307-317 (2007).
- Demuro, A., Parker, I., Stutzmann, G. E. Calcium signaling and amyloid toxicity in Alzheimer disease. J Biol Chem. 285, 12463-12468 (2010).
- Green, K. N., LaFerla, F. M. Linking calcium to Abeta and Alzheimer's disease. Neuron. 59, 190-194 (2008).
- Kumar, A., Thinschmidt, J. S., Foster, T. C., King, M. A. Aging effects on the limits and stability of long-term synaptic potentiation and depression in rat hippocampal area CA1. J Neurophysiol. 98, 594-601 (2007).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of age-related alterations in synaptic plasticity by blockade of L-type Ca2+ channels. J Neurosci. 18, 3171-3179 (1998).
- Norris, C. M., Scheff, S. W. Recovery of afferent function and synaptic strength in hippocampal CA1 following traumatic brain injury. J Neurotrauma. 26, 2269-2278 (2009).
- Sama, M. A. Interleukin-1beta-dependent signaling between astrocytes and neurons depends critically on astrocytic calcineurin/NFAT activity. J Biol Chem. 283, 21953-21964 (2008).
- Ye, H., Jalini, S., Mylvaganam, S., Carlen, P. Activation of large-conductance Ca(2+)-activated K(+) channels depresses basal synaptic transmission in the hippocampal CA1 area in APP (swe/ind) TgCRND8 mice. Neurobiol Aging. 31, 591-604 (2010).
- Bear, M. F., Malenka, R. C. Synaptic plasticity: LTP and LTD. Curr Opin Neurobiol. 4, 389-399 (1994).
- Foster, T. C. Involvement of hippocampal synaptic plasticity in age-related memory decline. Brain Res Brain Res Rev. 30, 236-249 (1999).
- Foster, T. C., Kumar, A. Susceptibility to induction of long-term depression is associated with impaired memory in aged Fischer 344 rats. Neurobiol Learn Mem. 87, 522-535 (2007).
- Hsu, K. S. Alterations in the balance of protein kinase and phosphatase activities and age-related impairments of synaptic transmission and long-term potentiation. Hippocampus. 12, 787-802 (2002).
- Vouimba, R. M., Foy, M. R., Foy, J. G., Thompson, R. F. 17beta-estradiol suppresses expression of long-term depression in aged rats. Brain Res Bull. 53, 783-787 (2000).
- Abdul, H. M., Furman, J. L., Sama, M. A., Mathis, D. M., Norris, C. M. NFATs and Alzheimer's Disease. Mol Cell Pharmacol. 2, 7-14 (2010).
- Abdul, H. M. Cognitive decline in Alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling. J Neurosci. 29, 12957-12969 (2009).
- Anantharaman, M. Beta-amyloid mediated nitration of manganese superoxide dismutase: implication for oxidative stress in a APPNLH/NLH X PS-1P264L/P264L double knock-in mouse model of Alzheimer's disease. Am J Pathol. 168, 1608-1618 (2006).
- Gengler, S., Hamilton, A., Holscher, C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 5, e9764-e9764 (2010).
- Stringer, J. L., Lothman, E. W. In vitro effects of extracellular calcium concentrations on hippocampal pyramidal cell responses. Exp Neurol. 101, 132-146 (1988).
- Landfield, P. W., Pitler, T. A., Applegate, M. D. The effects of high Mg2+-to-Ca2+ ratios on frequency potentiation in hippocampal slices of young and aged rats. J Neurophysiol. 56, 797-811 (1986).
- Ames, A. 3rd, Sakanoue, M., Endo, S. NA, K, CA, MG, AND C1 CONCENTRATIONS IN CHOROID PLEXUS FLUID AND CISTERNAL FLUID COMPARED WITH PLASMA ULTRAFILTRATE. J Neurophysiol. 27, 672-681 (1964).
- Gant, J. C., Sama, M. M., Landfield, P. W., Thibault, O. Early and simultaneous emergence of multiple hippocampal biomarkers of aging is mediated by Ca2+-induced Ca2+ release. J Neurosci. 26, 3482-3490 (2006).
- Thibault, O., Hadley, R., Landfield, P. W. Elevated postsynaptic [Ca2+]i and L-type calcium channel activity in aged hippocampal neurons: relationship to impaired synaptic plasticity. J Neurosci. 21, 9744-9756 (2001).
- Thibault, O., Landfield, P. W. Increase in single L-type calcium channels in hippocampal neurons during aging. Science. 272, 1017-1020 (1996).
- Stutzmann, G. E., Caccamo, A., LaFerla, F. M., Parker, I. Dysregulated IP3 signaling in cortical neurons of knock-in mice expressing an Alzheimer's-linked mutation in presenilin1 results in exaggerated Ca2+ signals and altered membrane excitability. J Neurosci. 24, 508-513 (2004).
- Stutzmann, G. E. Enhanced ryanodine receptor recruitment contributes to Ca2+ disruptions in young, adult, and aged Alzheimer's disease mice. J Neurosci. 26, 5180-5189 (2006).
- Lee, H. K., Min, S. S., Gallagher, M., Kirkwood, A. NMDA receptor-independent long-term depression correlates with successful aging in rats. Nat Neurosci. 8, 1657-1659 (2005).
- McNaughton, B. L., Douglas, R. M., Goddard, G. V. Synaptic enhancement in fascia dentata: cooperativity among coactive afferents. Brain Res. 157, 277-293 (1978).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten