Method Article
老化とアミロイド病理の間にシナプス変化の研究のためのラットおよびトランスジェニックマウスからの急性海馬スライスの準備
要約
この記事では、ラットと脳の老化とアルツハイマー病などの加齢に伴う神経変性疾患、関連付けられているシナプスの変化の研究のためのトランスジェニックマウスから海馬切片を調製するための手順の概要を説明します。
要約
げっ歯類の海馬スライス標本では、おそらく哺乳類のシナプス機能と可塑性を調査するための最も広く使用されるツールです。海馬は、酸素、人工脳脊髄液中の時間のために実行可能なまま、ラットやマウスとスライスから迅速かつ容易に抽出することができます。また、基本的なelectrophysisologicテクニックは簡単に海馬スライスにおけるシナプス機能の研究に適用され、認知障害のための最適なバイオマーカーのいくつかを提供している。海馬スライスは、学習や記憶に関与するシナプス可塑性のメカニズムの研究のために特に人気があります。海馬スライス(またはその欠如)のシナプス伝達効率の長期増強と抑うつ(LTPとLTD)の誘導の変化が頻繁に認知障害のある動物の神経学的表現型を記述すると/またはの作用機序を評価するために使用されます向知性化合物。この記事では、我々はラットおよび脳老化とアルツハイマー病(AD)1-3に関連付けられているシナプスの変化の研究のためのトランスジェニックマウスから海馬切片を調製するために使用する手順の概要を示します。老齢ラットとADのモデルマウスの使用は、その研究に若いラット及び/またはマウスを使うことに慣れ研究者への挑戦の固有のセットを提示することができます。老齢ラットでは、厚い頭蓋骨と脳の抽出及び/または解剖を遅らせ、その結果、シナプス機能と可塑性の本当の年齢の違いを無効にするか、または誇張することができます若いラットとマウスに、より厳しい結合組織を持っている。老化とアミロイド病理がまた再び生理的な評価から引き出された推論を複雑にして、解剖の手順の間に持続的な海馬の損傷を悪化させる可能性があります。ここで、我々はこれらの問題を最小限に抑えるために解剖の手順の実行中に実行する手順を説明します。 "健康"とラットやマウスからの"不健康"のスライスに取得したシナプス応答の例も同様に代表的なシナプス可塑性の実験として、提供されています。これらの動物モデルにおけるシナプス機能(例えば、記録のソリューションコンポーネント、刺激パラメータ)上の他の方法論的な要因の影響の可能性についても議論されています。この記事の焦点は老齢ラット、トランスジェニックマウスの使用上にある間、生理をスライスする初心者は、齧歯類モデルのさまざまな方法を使って、自分の研究をはじめるためにはここに十分な詳細を見つける必要があります。
プロトコル
1。氷冷酸素化人工脳脊髄液(ACSF)を準備
- "のCa 2 + - free"のACSFの2リットルを準備。 2Lの三角フラスコに、滅菌または再蒸留H 2 Oの約1.5 Lを追加し、攪拌プレート上で激しく攪拌し始める。 124のNaCl、2のKCl、1.25 KH 2 PO 4、2のMgSO 4、26のNaHCO 3、および10デキストロース(表1参照):以下のACSFのコンポーネントを(mMで)を追加します。蒸留H 2 Oで2リットルの体積に持参
- 酸素をACSFは約20〜30分間激しく、95%O 2 / 5%CO 2空気タンクに接続された水槽のバブラーとチューブを使用する。 pHを確認し、必要に応じて、NaOHまたはHClを用いて7.4に調整する。
- 、別の三角フラスコに酸素のCa 2 + -フリーACSFの750mlを注ぎ、パラフィルムで開口部をカバーし、20〜30分間ultrafreezer(-80℃)に移す。このメディアは、脳や急性海馬スライスの解剖のために使用されます* 、ACSFの残りの1.25 Lのボリューム#に2mMのCaCl 2を追加してよくかき混ぜ、そして95%O 2 / 5%CO 2で酸素化を再開する。このメディアは、解剖後に脳スライスを格納するための、および電気生理学的記録中のスライスを灌流するために使用されます。
*氷冷したCa 2 +の無料メディアは新陳代謝を遅くし、解剖時のCa 2 +依存性の興奮毒性を最小限に抑えるために使用されます。
のCa 2#変化老化とADの間に+調節不全は、+ -依存性のシナプス可塑性4-9は、Ca 2 +の誘導に大きな影響を持つことができます。のMg2 +比スライスの録音(2,4,10を参照)中:LTDの年齢差について相反する報告は、+別のACSFのCa 2の使用に一部起因かもしれません。のCa 2の重要性は、+規制とACSFのCa 2 +老化の研究のレベルは、ディスカッションのセクションで詳しく扱われている。 - のCa 2 + -フリーACSFは凍結ですが、電気生理学的記録の実行前と実行中の脳のスライスのメンテナンスのために保持室を準備*我々は4つの個々のmicrochambersを(図2参照)が含まれているカスタムマクロを保持するチャンバーを使用してください。 macrochamberが無菌で満たされ、酸素をH 2 Oとmicrochambersは本質的に水の表面の上に出るの島です。各マイクロチャンバー内で、スライスは酸素ACSFの浅いプールで網状インサート上に置きます。スライスが完全に水没が、加湿空気との界面で座っているされていません。 macrochamber内断熱加熱素子は、温度の調節が可能です。
保持室の*いくつかの品種も市販されている(例えばワーナーインスツルメンツは、浸水式の"プレチャンバー#BSC - PCになります)と高齢化とトランスジェニックマウスのスライスの研究での使用に適している必要があります。ピンチでは、スライスを維持することができるACSFで満たされた小さなペトリ皿で数時間は。酸素デリバリーチューブ用シャーレのふたに小さな穴をあけます。酸素の泡が物理的にスライスを撹拌しないように注意してください。デリバリーチューブがちょうどに発生した場合、スライスは十分な酸素を得られるACSFの表面上に(ガス分散は液体の表面にインデントされるようにする必要があります)。
2。高齢者の脳の取り外しと海馬解剖(> 20ヶ月の、ラット)
- 大型ヒートシンクへ*次の解剖の領域を準備します(図1と表2を参照)。 、#11手術用メスの刃、ビービーのはさみ、骨Rongeurs、"海馬のツール"(からの専門的なデュアルスパチュラをシンクに小さな動物のギロチンを配置し、折り畳んだペーパータオルを含む脳の除去と海馬解離の手術器具や材料を敷くファイン手術器具)、小さな手術用はさみ、薄いダブルエンドへら、プラスチック製パスツールピペット、110 mm径のワットマンろ紙、氷で満たされた蓋付きの100mmのガラスのペトリ皿、そしてプラスチックのスプーン。また、死体の処分のために近くのビニール袋を保持する。
*脳の抽出は、できるだけ早く完了するので、精神的に手順を"ウォークスルー"と使用のために、楽器をレイアウトしておくことをお勧めしてください。 - 冷凍庫からのCa 2 + -フリーACSFを削除します。メディアは、完全ではない、部分的に凍結されたはずです。パラフィルムで覆い、ガラスビーカーにACSFの約50mLを注ぎ、そして解剖領域の横に置きます。このメディアは、それが解消されると、簡単に脳を格納するために使用されます。残りのCa 2 + -フリーのメディアは、スライスの準備のためのビブラトームでタンクを埋めるために使用されます。このメディアはreoxygenated、または単純にパラフィルムで覆い、4℃で冷蔵庫に入れることができます℃の
- 動物実験により認可された方法を用いて、ラットを安楽死させると委員会(IACUC)を使用してください。私たちの動物は徐々に100%のCO 2が充填された小型のプレキシグラスのチャンバー内に配置されます。意識の喪失は、通常5分以内に発生し、反射活動の有無によって確認されつま先のピンチを以下。
- 第一頸椎のすぐ吻側ラットの首を切ると折られた紙タオルで頭を置きます。 #11メスを使用して、すぐに鼻の骨付近から始まると後頭骨に尾側に実行されている頭皮の中央に切開を行います。完全に頭蓋骨の背側表面に縫合糸を露出させる、皮膚の筋肉を通して完全にカットしてください。
- ビービーはさみとスカルのプレートを介してカット。幼若ラットとマウスでは、頭蓋骨はすぐに単独で骨Rongeursの使用で削除することができます。しかし、老齢ラットでは、この手順を困難にすることができる若い成体ラットとマウスに比べて厚い頭蓋骨を持っている。我々は、頭蓋骨を切断すると、大きく、rongeursと骨の除去を容易に脳に損傷を軽減し、貴重な数秒を節約することを見出した。しっかりとカウンターの上にネズミの頭と、頭蓋骨の後部にある後頭孔の優れた領域にビービーはさみの低い薄手の最先端を置きます。後頭板を切って頭蓋骨の内面(と離れて脳から)*、しっかりと下の切り立ったを維持し、頭頂板の正中縫合に沿って。あなたが前頭頭蓋骨の板を切ってまで吻方進みます。
*それは圧力が離れて不注意なゲージを防ぐために脳から送られることが非常に重要です。 - 後頭葉、頭頂葉、および脳からの時間的な頭蓋骨のプレートを区切ります。安定性と活用のためにカウンタートップにしっかりと頭を保持し続けると、頭蓋骨の内側面に対する圧力を維持し、左頭頂プレートの下にrongeursの底顎をスライドさせます。次に、一緒にrongeursの顎をつまみ、脳から離れて頭頂部と後頭部板を引っ張って上方向とに向かって手首をロールバックします。これは、左半球の背側表面の大部分を公開する必要があります。必要に応じて、同様に左前頭葉プレートを削除するrongeursを使用。他の半球のためにこのプロセスを繰り返します。プレートがずれていると、すぐに時間的なプレートに付着し、脳の表面にまたがっている可能性のある硬膜を点検してください。優しくrongeursと離れてこれらを引っ張ったり、はさみで切り取る*.今、再び頭蓋骨に向かって離れて脳からの圧力を保ち、脳と右の側頭板との間rongeursの上顎をスライドさせます。離れて脳からの一時的なプレートを押しながらねじります。これを行うように、"クランチ"を聞く/感じるでしょう。左側で繰り返します。
*硬膜は、動物がtranscardially ACSFを灌流されていた場合、発見が困難な場合があります。しかし、硬膜が除去されていない場合、彼らは時間的なプレートが取り外されているかみそりのような脳(そしておそらく海馬)を介してスライスになります。時間的なプレートの近くに離れて硬膜をSnippingと脳を刺すの可能性を最小限に抑えることができます。 - 脳を抽出*すぐに"雪解け"のCa 2 + -フリーACSFからパラフィルムを取り外します。それは脳の下に完全に固定されるまで、今、脳の腹側表面と底頭蓋骨のプレートの間に海馬ツールの広範なヘラのヘッドをスライドさせます。無傷の脳神経を切断する横方向にサイドツーサイドからして前方と後方に数回ヘラを移動します。今のCa 2 + -フリーACSFとパラフィルムでカバーにおける海馬ツールと水没して脳をかき出す。約1分間脳の寒さをしてみましょう。これは、ギロチンをきれい死体を処分し、解剖領域を再編成する時期かもしれない。
ステップ2.3から2.7の*は、速度が非常に重要である。我々が30〜35秒でこの手順を(斬首からACSFで浸水脳に)完了してみてください。我々の経験では、分よりも長く取るの抽出は、特に老齢ラットに対して、悪影響を海馬スライスの健康に影響を与えるように見える。これらの手順を使用して、我々の研究のための高齢者と若いラットとの間の抽出時間に差を認めていない。 - 海馬を抽出する。氷冷したペトリ皿の蓋の上にワットマンろ紙を置き、プラスチック製のトランスファーピペットを使用してACSFで紙を湿らせてください。湿らせたワットマン濾紙上にスプーンと場所を使用してACSFから脳を取り出す。手術用メスの刃を使用して、小脳および吻側前頭葉の約4分の1を削除します。完全に二つの半球を分けるためにintrahemispheric割れ目を通して手術用メスの刃を実行します。場所バックACSFのぬかるみに一方の半球と前頭葉の前頭面が下に向いているような解剖ステージ上の他の設定を"スタンド"。あなたは明らかに(ピンク/灰色である)上層の皮質から脳幹や中脳を(白である)を区別することができるはずです。中脳での優れたと下丘を見つけ、これらの2つの白の"ノブ"のように見て、この方向での脳の"一番上"になります。外科はさみを使用して、静かになる代わりに、中脳を保持し、ギャップでの計量ヘラをスライドさせトゥイーンの丘と新皮質。非常に穏やかに、へらを下にスライドし、側脳室と海馬の内側表面の内部を明らかに脳幹/中脳/視床を引き離し続ける。スムーズに弓を断つためにヘラの鋭いエッジを使用して、海馬の前方/背部にある白い繊維束。はさみで、優しく完全に脳の他の部分から、それを切断することなく、離れて脳幹/中脳/視床をプルし続ける。海馬と皮質は脳幹から戻って自由にレイアウトしてください*.それは矢状断面(マイナス視床)であるかのように、内側海馬及びその上の皮質を見ているように次に、解剖の段階を回します。これで、この面での海馬の下部に浅い双曲線を形成する白采繊維が表示されるはずです。皮質とは別の海馬を助けるために采の下の隙間にプラスチック製のトランスファーピペット、静かに噴出いくつかACSFを使用する。静かにへらの長辺が、海馬の長軸と平行に実行されるように、この隙間にヘラをスライドさせます。ヘラは、海馬の下に完全になると、ハサミでしっかりと脳幹/中脳/視床を押しながら、物理的に脳の他の部分から海馬を分離するためにあなたの体から離れてへらをロールバックします。海馬がフリーになると、静かに残りの皮質、血管、および白質を切り落とす。解剖ステージの反対側にACSFぬかるみの少量をスクープ。優しくプラスチック転送ピペットを使用してACSFの数ミリリットルでスラッシュと濡らす隣に海馬を置きます。次に、他の半球を削除し、解剖を繰り返します。
*あなたは、脳幹から皮質の分離を阻止するために新しく追加された結合組織、白質、または血管を離れてスニップにハサミが必要になることがあります。あなたのはさみのポイントが海馬に非常に近くなるので、非常に正確な切れ端を(鋭いはさみが必要です)を提供するようにしてください。
3。高齢者のトランスジェニックマウスの脳の除去と海馬解剖
- 安楽死させると頭部を除去するマウスを、セクション2.3で説明したように頭皮に正中切開を行います。マウスは、大幅に脳の抽出を簡素化したラットよりもはるかに薄い頭蓋骨を持っている。はさみで頭蓋骨を切開するため、不要です。離れて後頭葉、頭頂葉、および時間的な頭蓋骨のプレートを引っ張る小さな顎(表2)と骨Rongeursを使用してください。ラットと同様に、制御された動きを使用して、プレートを取り外す際にしっかりと脳から頭蓋骨の内部表面にrongeursの下顎を引くとすることを忘れないでください。プレートを削除したら、残りの脳神経を切断し、氷冷のCa 2 + -フリーACSFに脳をすくうために海馬工具の狭い方の端を使用してください。
- 脳スライスを準備します。海馬の解剖マウスの脳のサイズが小さくなる、のためにラットを用いた場合よりも(確かになんとかですが)もう少し挑戦することができます。そう、物事を簡単にするために、我々は、小脳や前頭葉の吻側のヒントを削除するが、海馬を解剖していない。代わりに、脳の半球は、物理的にメス刃を分離し、(下のセクション4を参照)ビブラトームのセクショニングのためそのまま残されている。
4。振動ミクロトーム(ビブラトーム)と保持室へ転送*を使用してスライスにセクションの脳組織
- カットステージと刃が完全に水没していることなどを氷冷のCa 2 + -フリーACSFでビブラトームの貯水池を埋める。ラットのスライスを作るために、手術用メスの刃でそれぞれ海馬の吻側および尾側ヒントを断つ。これらのカットは、垂直に2つの列のように密接に一緒に海馬を配置することができます。それぞれの海馬の歯状回が互いに直面しているとCA3領域が同じ方向に配向している場合に最適です。マウスのスライスを作るために、垂直に下向きに前頭葉と密接に一緒にそれぞれの半球を置きます。取り付けブロックとビブラトームのセクショニングの段階への移行上に接着剤の脳組織。我々は一般的にシナプスの生理学実験のための〜400μMのセクションを用意する。蛍光イメージングは、(Ca 2 +の例:調査+レベルとトランジェント)を実施する場合より薄い切片を作製する必要があります。 #広口ピペットまたはペイントブラシでスライスを収集し、氷冷のCa 2 + -フリーACSFを含む小型のペトリ皿に移す。
*スライスの上下面にビブラトームを最小限に抑え損傷の使用と間違いなくスライスの表面近くの細胞(例えば、電圧クランプとCa 2 +イメージングの研究)の分析を必要とする研究のために推奨されます。しかし、安価な代替品が入手可能と細胞生理学実験用のスライスを生成するのに適しています。私たちは小さな重力制御チョッパ2,11と良好な成功とマッキルウェーンのティッシュチョッパー12を使用している。 THIのためのの手順海馬は、垂直チョッパーで上演し、切片上に配置されます。ブラシは、氷冷のCa 2 + -フリーACSFで満たされた小さな持株皿にスライスを(一度に1つずつ)を転送するために使用されます。このアプローチの一つの問題は、海馬が不均一のセクションで、その結果チョップ間を移動できることです。また、チョッピングの前に、可能な限り、多くの白質として、そして特に多くの血管系として削除するように注意してください。この材料は、組織を伸ばしたり、損傷の確率をスライスの転送が非常に困難になると増加し、ブラシ、カミソリの刃、またはその両方に固執するだろう。
#ブラシを使用する場合は、スライスの長さごとの毛全体を休ましてみてください。ブラシの先端の周りにスライスをラップすると、不要な組織をストレッチすることがあります。 - 彼らは酸素のCa 2 +含有ACSFを浴びている保持室に脳スライスを転送する。徐々に27 °〜32 ° C(+1℃5分ごとに)チャンバーの温度をもたらす。スライスの電気生理学的実験の前に1〜1.5時間インキュベートすることができます。
5。 CA3 - CA1シナプス応答を誘発し、記録
- 刺激、記録、および接地電極;灌流系;> 4倍の機能を持つ顕微鏡記録チャンバーマクロとマイクロマニピュレータ、剛性耐振動性:急性スライスの基本的な細胞外記録のために、あなたの電気生理学ステーションは、*をインクルードする必要があります。テーブルトップとファラデーケージ、刺激、アンプとアナログ - デジタル(A / D)コンバータ、適切な買収のソフトウェアとし、個人のPC、オシロスコープ(できれば)。
*カー科学機器は、基本的なスライスの電気生理学的実験の様々な実施のための幻想的で安価な電気生理学的システム(すなわちカーの組織のレコーディングシステム)を提供しています。このシステムは、小さなフットプリント、ポータブル刺激とアンプを持っており、かさばるファラデーケージを必要とせず、標準の実験室のベンチに使用することができます。
もちろん、脳スライスはまた、追加の機器や材料を必要とする数多くの精巧な電気生理学とイメージング技術を、実行するために使用することができます。例えば、私たちの主な電気生理学の駅は高速の電圧及び電流クランプ機能、蛍光灯照明システム、およびデジタルカメラを持つアンプが含まれています。この駅は、脳スライスだけでなく、パッチクランプ記録とスライスと細胞培養3,12,13の蛍光イメージングにおける細胞外フィールドレコーディングに使用されます。機器とコンポーネントの完全なリストは、表3を参照してください。 - 広口ピペットまたは小規模なペイントブラシを使用して、*それが刺激/録音の前に10-15分のために順応できるように録音室に1つまたは複数のスライスを転送する。私たちの研究のために、スライスはワーナーインスツルメンツ(図3参照)により、RC - 22チャンバー内に挿入ネッティングにACSFと残りに沈めている。 ACSFは、流量を調整するレギュレータを介して重力葉であり、そして℃のインラインマイクロヒーターによる記録チャンバーに到達する前に32に温した。中央の真空ラインがASCFを削除するために使用されます。
潜水艇とインタフェース型の録音室の*多くの異なった品種が市販されている。我々は、スライスは、インターフェイスのチャンバー(すなわちスライスは加湿空気とACSFとのインタフェースに座って)2,11で、より強固なシナプス応答を示すことを観察した。しかし、感度はスライスがACSFで水没しているときに一般的に、より安定しています。薬剤の潅流が水没室でも、より効率的です。 - 電極を刺激し、記録位置。刺激や刺激アイソレータはオンですが、出力は位置CA3国境近くCA2の地層radiatum領域(図4を参照)のスライス上に刺激電極を、0にダウンダイヤルで。我々は、CA3シェーファーの担保(SC)繊維に50から100まで私達二相パルスを提供するためにツイストプラチナイリジウムのワイヤーを使用してください。プラチナイリジウム線と二相パルスの使用は最小限に抑え、電極の分極を助けることができる。ただスライスの表面を壊し、CA1層radiatumに記録電極を下ろします。私たちの記録電極は、ACSFで満たされたガラスマイクロピペット(MΩ〜7の先端の抵抗)にAg / AgCl電極線です。中程度のレベル(私たちは〜150μAに私達の刺激アイソレータを設定)する刺激の出力を上にし、刺激パルスを管理し、買収のソフトウェアを使用して、アクティビティの取得を開始、そのようなClampexとアクソンインスツルメンツ社からゆっくりと小さなの刺激電極を下げる刺激artificactまでの間隔はCA1に記録されます。次に、繊維のボレー(FV)まで、CA1のレスポンスを獲得しながら徐々に間隔の刺激と記録電極の両方を下げるために継続して興奮性シナプス後電位(EPSP)の振幅は(図4Bを参照)最大レベルに達する。
- シナプス強度曲線を確立し、シナプス可塑性を調査する。シナプス強度曲線を生成するには、ますます高い強度と、レコードの目でSCへの刺激パルスを実現CA1の電子対応するアクティビティ。使用される刺激強度レベルの範囲と数は変わる場合がありますが、FVまたはEPSPの値(図5)のいずれかに対してプロットしたときにS字状曲線を生成するために十分なはずです。 EPSPの傾きは単シナプスCA3 - CA1の電流の汚染されていない指標を提供する一方、FV振幅は、活性化シナプス前線維の割合の信頼できる推定値を提供します。刺激強度の水準を越えFVに対してEPSP勾配をプロットすると、したがって、活性化求心性神経の数あたりのEPSPの大きさを反映し、CA3 - CA1シナプス強度の優れた推定値を提供します。通常は、シナプス強度レベルが大幅に幼若ラットへの相対、老齢ラットとAPP/PS1マウスの領域のCA1に減少していると年齢をマッチさせた野生型マウスは、例えば4,14を参照してください。
- シナプス強度曲線の間に体調不良の徴候(すなわち最大EPSPの振幅<1 mVの)や興奮を(すなわち2つ以上の人口のスパイクの外観)を示すのスライスは、統計分析(図4Cを参照)から除外されます。我々は、これらのスライスはほとんど60分の期間にわたって安定した反応を示さないと/またはシナプス可塑性の誘導後の非常に可変応答を示すことを見出した。それは"不健康なスライスは"録音室に転送されるすべてのスライスの約10-20%を構成していることは注目に値する。また、我々の経験で、不健康なスライスを特定の周波数は、年齢、種、および遺伝子型間で非常によく似ています。
- スライスにおける長期増強(LTP)や長期抑圧(LTD)を誘発する。 LTPとLTDはシナプス活性化のさまざまなパターンに応じて、シナプス機能の持続的な増加(LTP)と減少(LTD)です。両方のプロセスが広く、重要な学習のためのメカニズムとmemory15を反映し、神経機能障害および/ または記憶障害と神経変性16を改善するための薬理学的戦略を評価するための細胞メカニズムを調べるために有用なアウトカム指標を提供すると考えられている。
シナプス可塑性の実験については、1mVの*にすべてのスライスに対して刺激強度をリセットし、0.033 Hzの周波数でベースラインの刺激を始める。 EPSPの傾きの値は、LTPやLTDの誘導に先立って少なくとも20分間安定している必要があります。密接にこの時間の間にEPSPのを監視し、傾きが10%以上変動する場合刺激強度をリセットし、新しいベースラインを開始します。 200ms毎に与えられる100 Hzの刺激の100 Hzの刺激や、複数の短時間のバースト(〜10パルス)の1秒列車を使用してLTPを誘導する。 LTDの誘導のために、1Hzの速度で900刺激パルスを実現。 LTPやLTDの誘導の後、追加の60分以上のためのシナプス応答を収集する。 EPSPスロープの前に得られた値と高/低周波の刺激60分後には、LTPやLTDの存在を決定するために比較されます。
老齢ラットとAPP/PS1マウスでは(図5を参照)欠損LTPと強化されたLTDを示す傾向にある、とこれらの変更は、これらの動物モデル6,16の認知障害に寄与することが示唆されている。しかし、APP/PS1マウスとは異なり、老齢ラットにおけるLTP / LTDの変化は、ラボ全体の変数です。 、老齢ラットでは、一般的に"強い"(つまり、100 Hz)の刺激に反応して成人と比較して同様のLTPのレベルを示すが、穏やかな刺激のパラメータが使用されている番組の赤字(低刺激の周波数またはより少ない刺激パルスをIE)が(レビューのための4,6を参照してください。 16)。他のグループが彼らの老齢動物に差や感受性低下を発見したままでも、我を含むいくつかのラボでは、、、老齢ラット2,17-19でLTDの誘導に感受性の増加を観察している。 (説明を参照)以下に簡単に説明したように、実験的なプロトコルに、微妙だか重要な違いは、これらの矛盾を占める可能性があります。
*刺激の強度とEPSPの振幅は、LTP誘導に影響を与えることができると文学における矛盾した結果の重要な原因である可能性があります。これは、ディスカッションのセクションでさらに検討されます。
6。代表的な結果
私たちの仕事、および他のグループからの仕事は、アストロサイトベースの炎症性シグナル伝達の変化が引き金と/または老化とAD 13,20,21時の神経学的機能不全を早める可能性を示唆している。最近、我々はシナプス強度、LTP、と半ば高齢APP/PS1マウスのいくつかの新規抗炎症薬の作用の有効性とメカニズムを調べるために、エンドポイント対策として株式会社(このモデルの説明については、22を参照)と高齢者フィッシャーを使用している344ラット。以下に示す結果は、この資料に記載されているプロトコルを使用して得られた。
私たちの研究室が開発した新規の抗炎症性アデノ随伴ウイルス(AAV)試薬の一つは、大幅にシナプス強度(P <0.05)増加し、16(中期高齢者ではLTPの赤字(P <0.05)を防止するためのパイロット研究で示されているカ月齢)APP/PS1マウス(処理条件ごとに、nは= 4-6スライス)。二つの異なるスライス、コルから代表的なシナプス強度曲線とLTP実験同じ16カ月齢APP/PS1マウスからected、図5A - Cに示されています。他のスライスをコントロールAAVの試薬(コントロール)で処理しながら、一つのスライスは、私たちの新たなAAV(試薬)で処理半球から抽出した。 LTPは、100 Hzの刺激(10秒intertrain間隔)の2つの1秒の列車を使用して両方のスライスで誘発された。処理されたスライス試薬のためのシナプス強度曲線が大きくシナプス強度を示す制御のスライス、の左にシフトされていることに注意してください。また、中期高齢APP/PS1マウスのための典型的な、LTPはコントロールのスライス(例えば23)でベースラインに急速に減衰し、注意してください。逆に、LTPは、私たちの新たな試薬で処理スライスはほとんど減衰し。
第二最近の研究では、車両処理した老齢ラット(プレLTDベースライン、P <0.05の85%)で有意な株式会社を観察した。対照的に、株式会社は、新規の抗炎症作用"薬剤"(プレLTDのベースラインの97%、有意ではない)で処置された老齢ラットでは観察されなかった。シナプスの強さには薬の影響は認められなかった。このデータセット(グループあたりnは= 80〜10匹)からの代表的な会社の実験は、図5D - Fに示されています。
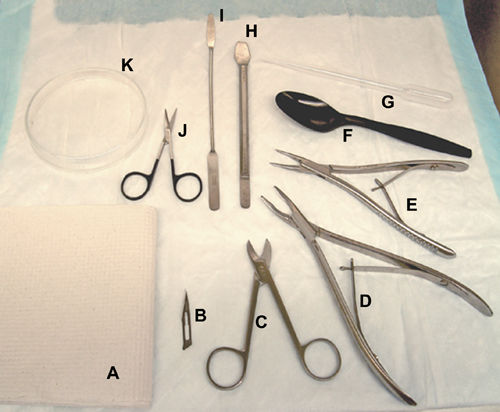
図1。脳の解剖のために使用されるツールと材料。、ペーパータオル。 B、手術用メスの刃。 C、ビービーはさみ。 D、骨Rongeurs(ラット)。 E、骨Rongeurs(マウス/ラット用)。 F、プラスチックスプーン。 G、プラスチック製のトランスファーピペット。 H、海馬ツール。私、へら。 J、手術用はさみ。 K、ガラスのペトリ皿。

図2。チャンバーを保持するカスタム脳スライス。、macrochamber。 B、蓋。 C、穿孔シリコンチューブとH 2 Oの貯水池。 D、マイクロチャンバー。 E、ACSFデリバリーチューブ(ポリエチレン)。 F、O 2運搬のチューブ。 G、温度制御のためのポート。 H、網状マイクロチャンバーインサート。

図3。 RC22水没室。、録音室。 B、グラウンド電極。 C、吸引針。

図4。海馬スライスのイラストと細胞外の波形。電気生理学的実験で使用した横断海馬セクションの、漫画。 CA =アンモン角。 DG =歯状回。 SC =シェーファーの担保。 S radiatum =地層radiatum。 B、SC(CA3軸索管)の電気刺激は、シナプス前の人口のスパイク、または繊維のボレー(FV)で、ほぼ直後に、刺激のアーティファクトを誘発する。 FVの振幅は、活性化SC繊維の数に直接比例します。フィールド興奮性シナプス後電位(EPSP)の負方向の位相の傾きは、SCの端子からのリリースをグルタミン酸に反応してCA1錐体ニューロンにおけるシナプス電流を脱分極性の活性化に直接対応しています。 、(左パネル)"健康""不健康"、および"hyperexcitable"スライスの9種類の刺激の強さのレベル(30から500μA)に応答して、CA1層radiatumに記録されている代表的な細胞外の波形を重複C、。五波形はレベルごとに平均した。健全なスライスはこの刺激の範囲にわたってダイナミックに対応し、スパイクは(CA1ニューロンの放電を反映して)より高い刺激レベルで単一の正方向の人口を示す。 RC22水没室では、最大EPSPのは、通常、1.5〜振幅の3 mVの範囲です。不健康なスライスは(中央のパネル)は、しばしば大規模なFVを示すが、小さな最大EPSP(<1 mV)と、通常は悪い可塑性を示す。 Hyperexcitableスライス(右パネル)は、EPSPの上行脚で2つ以上の再生人口の急増を示しています。 hyperexcitableスライスの応答は、しばしば不安定であり、可変LTD / LTP刺激によって影響を受けます。

図5。中期高齢者(16 MOS)APP/PS1マウスから急性スライスと高齢者(22 MOS)Fisher 344ラットで行わ代表的な電気生理学的実験。ABのショーデータは、コントロールのアデノ随伴(AAV)のウイルスで処理APP/PS1マウスから採取したパネル構築する(コントロール)または研究室のグループによって開発された新たなAAVの試薬(試薬)。よりシナプス強度を示すFV曲線():制御スライスに相対、スライスは試薬展示EPSPの顕著な左方移動で処理。試薬 - 処理スライスはまた、(B)2つの1秒、100 Hzの刺激の列車の配信後に堅牢で安定したLTPを示していますが、この動物モデルの典型的な制御のスライスは、展示欠損LTPを、。車両や新規抗炎症薬(医薬品)の慢性的(4週間)海馬内perfusionsを受け取った2つの個々の老齢ラットから採取したパネルDFのデータを表示します。基礎シナプスの強さは、薬物治療では比較的影響を受けなかった(D)。しかし、薬物はLTD(E)の誘導を防ぐことで非常に効果的であった。パネルC、Fショー代表EPSP前に、個々のスライスから記録された波形(プリ)と60分後(ポスト)LTP / LTD刺激の配達。刺激アーチファクトが表示されないことに注意してください。
ディスカッション
このプロトコルで説明する手順は、脳の解剖は、若い成体ラットのように、熟成に最低でも迅速かつ効率的に行われることを保証するのに役立ちます。我々はまた、LTPとLTDに独自のスライスの調査をセットアップする初心者のために十分な詳細を提供します。高齢化とシナプス機能と可塑性の広告の変更の更なる探査が目標の一つである場合は、さらに検討に値する上記alluded少なくとも2つの他の方法論上の問題は、、そこです。最初に、いくつかのラボは、Ca 2ことが示されている+:録音ACSFでのMg2 +比は、海馬スライス2,10,24,25で誘導シナプス可塑性に著しい影響を持つことができます。哺乳類の脳脊髄液は、Ca 2 +に:Mg2 +の比は約1(例えば26を参照)です。しかし、ACSF のCa 2 +:Mg2 +の比に近い2〜一般的にシナプス機能と可塑性のスライスの研究に使用されています。初期の研究では、この方法はおそらく、その後、すべての可塑性の研究のためのルーチンになってから、LTPの誘導を最適化するために適応されました。しかし、この習慣が原因の神経のCa 2 +調節でよく特徴の違いの老化とADの研究で問題となる可能性があります。具体的には、Ca 2 +流入及び/またはCa 2 +誘発Ca 2 +放出は、神経細胞活性化3,27-31時の老齢ラットおよび/ またはADのモデルマウスで上昇している。 LTDの誘導は、ACSFのCa 2 +濃度の微妙な変化に特に敏感である。 2〜Mg2 +の比が近い、としている成人で堅牢な会社を見てきた:Ca 2 +を用いた研究は、一方2mMのカルシウムの+と2mMのMg 2 +を、一般的に歳のための株式会社の結果ではなく、若い成人の動物2を 、使用している我々のプロトコル、 32老齢ラットで低下LTDと一緒に年齢の差が2,10またはの不在。これらの観察は慎重にACSFのCa 2 +とMg2 +のレベル高齢者と若年成人の動物では、Ca 2 +依存性の可塑性を比較する際に考慮する必要性を強調。
第二の方法論的問題は、シナプス強度のシナプス後脱分極33と可能老化/遺伝子型の違いでLTPの強い依存性を懸念。で典型的なLTPの実験、ベースラインとLTPの刺激強度は、一般的に半最大(または三四半期最大)EPSPの振幅を生成するために調整されます。潜在的な問題は、老齢ラットとAPP/PS1マウスには、通常、ベースラインEPSPの値も老齢ラットとAPP/PS1マウスで小さくなることを意味し、彼らの若いおよび/または野生型の対応への相対的なシナプス強度の低下を示すということです。小さ いEPSPのは、LTP 33を誘導するための低下の確率で、その結果、LTPの刺激の間に以下の脱分極に変換する場合があります。このため潜在的な混同するから、それはこれらの動物は、スループットの赤字、可塑性の欠損または両方を示すかどうかを決定することは困難である。つまり、高齢者および/またはAPP/PS1マウスにおけるLTP誘導メカニズムは、(無可塑性の赤字)機能的に無傷かもしれませんが、十分にこれらの条件下で(スループットの赤字)刺激。スループットと可塑性のメカニズムのためのメカニズムは、特定の薬理学的治療に非常に異なった反応を可能性があるため、この区別は、非常に重要です。我々は、前のLTPの刺激へのすべてのスライスに同じレベル(例えば1 mVの)にEPSPの振幅を正規化することによってLTP誘導に対するスループットが低下の影響を最小限に抑えるようにしてください。他の戦略は(LTPの刺激の間にグループ間での膜電位を等しくする電圧または電流クランプの例を使用)だけでなく、効果的かもしれない、とこれらの動物モデルでLTPを調査する際に考慮する必要があります。
開示事項
謝辞
NIHの助成金AG027297、ケンタッキー州脊髄と頭部外傷の研究のトラストからの賞を受賞、とクレバーグ財団からの贈り物でサポートされて働く。
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| NaClの | フィッシャー | BP358 - 1 | |
| 塩化カリウム | フィッシャー | BP366 - 500 | |
| KH 2 PO 4(一塩基) | シグマ | P5379 - 100G | |
| MgSO 4を | シグマ | M2643 - 500G | |
| のCaCl 2(二水和物) | シグマ | C3306 - 250G | |
| NaHCO 3の | フィッシャー | S233 - 500 | |
| C 6 H 12 O 6(ブドウ糖) | フィッシャー | BP350 - 1 |
表1。必要な試薬
| 機器の名前 | 会社 | カタログ番号 | コメント |
| 三角フラスコ | フィッシャー | FB - 500 - 2000 FB - 500 - 1000 | |
| 水族館バブラー | オキシメディアのために使用。ほとんどのペット店で購入できます | ||
| 50mLのガラスビーカー | フィッシャー | 02 - 540G | ACSFで脳storarge用 |
| パラフィルム | フィッシャー | 13-374-10 | |
| 小動物のギロチン | 世界精密機器(WPI) | DCAP - M | |
| 平らな紙タオル | |||
| #11フェザー外科ブレード | フィッシャー | 08から916 - 5B | |
| ビービー骨はさみ | ファイン科学ツール(FST) | 16044〜10 | |
| Lempert Rongeurs | Roboz | RS - 8321 | ラットのために使用します。 |
| フリードマン-ピアソンRongeurs | FST | 16020〜14 | マウスやラットのために使用します。 |
| 海馬のツール | FST | 10099〜15 | |
| スプーン | プラスチック製のティースプーンが行います | ||
| へら | フィッシャー | 21から401 - 25A | へら |
| 外科的虹彩鋏 | FST | 14058〜09 | |
| プラスチック製のトランスファーピペット | フィッシャー | 13-711-43 | |
| 110ミリメートルワットマンろ紙 | フィッシャー | 09 - 805E | ワットマンの猫。 1001-110 |
| ガラスのペトリ皿 | フィッシャー | ||
| ミクロトームを振動ライカVT1000Pマニュアル | ビブラトーム | ||
| 0.1ミリメートルFA - 10フェザーSブレード | テッドペラ | 121から9 | 0.1ミリメートルFA - 10フェザーSブレード |
| ホウケイ酸ガラスパスツールピペット(ゴム球付き) | フィッシャー | 13から678 - 20A | 大きな開口部のためにヒントが破損していると熱研磨:スライスを転送するための |
| 35ミリメートルPolysterine培養皿 | コーニング | 430588 | 解剖後にスライスを収集するために使用 |
表2。解剖のためのツールと材料
| 装置/材料 | 会社 | コメント(省略可能) |
| 保持チャンバー | カスタムは、内蔵 | |
| P - 97水平ピペットプラー | サター器械(株) | |
| 防振テーブル | テクニカルマニュファクチャリング株式会社(TMC) | |
| ファラデー箱 | カスタムの構築 | |
| ボトムサイドアーム付きパイレックスアスピレータボトル(製品番号1220 - 1L) | コーニング | |
| レギュレータと重力contolled IVセット(製品#2C8891) | バクスター | |
| 中央の真空ライン | 最も近代的なラボで利用できる | |
| 95%O 2 / 5%CO 2ガスのミックス | スコットT -グロス(株) | |
| TygonTMラボチューブ O 2 / CO 2の配信のための | フィッシャーサイエンティフィック | 非毒性、非酸化性、さまざまなサイズで提供されます。 |
| EclipseのE600FN顕微鏡 | ニコン | infaredフィルタの近くに、10倍および40倍の目標とし、GFP、DS - Red2フィルター |
| クールなスナップESデジタルカメラ | Photometrics | クールなスナップESデジタルカメラ |
| X - Citeの蛍光灯照明装置 | EXFO | X - Citeの蛍光灯照明装置 |
| 顕微鏡プラットフォーム | シスキユー | カスタムは、組み立て |
| RC - 22水中録音室(製品番号64から0228まで) | ワーナーインスツルメンツ(WI) | P - 1プラットフォームとステージアダプタ(ワーナーから製品#64〜0277)が必要です |
| TC2BIP 2/3Ch温度コントローラ | セルMicrocontrols | TC2BIP 2/3Ch温度コントローラ |
| 4軸手動ミニチュアマニピュレータ | シスキユー | |
| プラチナイリジウムワイヤー(0.002で) (項目#PTT0203) | WPI | |
| A365刺激アイソレータ | WPI | A365刺激アイソレータ |
| 700BアンプをMulticlamp | アクソンインスツルメンツ | |
| Digidata 1322A / Dコンバータ | アクソンインスツルメンツ | |
| ソフトウェアをPClamp | アクソンインスツルメンツ | |
| パーソナルコンピュータ(Pentium 4プロセッサ) | デル |
表3。電気生理学的機器と材料
参考文献
- Norris, C. M., Halpain, S., Foster, T. C. Alterations in the balance of protein kinase/phosphatase activities parallel reduced synaptic strength during aging. J Neurophysiol. 80, 1567-1570 (1998).
- Norris, C. M., Korol, D. L., Foster, T. C. Increased susceptibility to induction of long-term depression and long-term potentiation reversal during aging. J Neurosci. 16, 5382-5392 (1996).
- Norris, C. M. Hippocampal 'zipper' slice studies reveal a necessary role for calcineurin in the increased activity of L-type Ca(2+) channels with aging. Neurobiol Aging. 31, 328-338 (2010).
- Burke, S. N., Barnes, C. A. Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161 (2010).
- Foster, T. C. Calcium homeostasis and modulation of synaptic plasticity in the aged brain. Aging Cell. 6, 319-325 (2007).
- Foster, T. C., Norris, C. M. Age-associated changes in Ca(2+)-dependent processes: relation to hippocampal synaptic plasticity. Hippocampus. 7, 602-612 (1997).
- Thibault, O., Gant, J. C., Landfield, P. W. Expansion of the calcium hypothesis of brain aging and Alzheimer's disease: minding the store. Aging Cell. 6, 307-317 (2007).
- Demuro, A., Parker, I., Stutzmann, G. E. Calcium signaling and amyloid toxicity in Alzheimer disease. J Biol Chem. 285, 12463-12468 (2010).
- Green, K. N., LaFerla, F. M. Linking calcium to Abeta and Alzheimer's disease. Neuron. 59, 190-194 (2008).
- Kumar, A., Thinschmidt, J. S., Foster, T. C., King, M. A. Aging effects on the limits and stability of long-term synaptic potentiation and depression in rat hippocampal area CA1. J Neurophysiol. 98, 594-601 (2007).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of age-related alterations in synaptic plasticity by blockade of L-type Ca2+ channels. J Neurosci. 18, 3171-3179 (1998).
- Norris, C. M., Scheff, S. W. Recovery of afferent function and synaptic strength in hippocampal CA1 following traumatic brain injury. J Neurotrauma. 26, 2269-2278 (2009).
- Sama, M. A. Interleukin-1beta-dependent signaling between astrocytes and neurons depends critically on astrocytic calcineurin/NFAT activity. J Biol Chem. 283, 21953-21964 (2008).
- Ye, H., Jalini, S., Mylvaganam, S., Carlen, P. Activation of large-conductance Ca(2+)-activated K(+) channels depresses basal synaptic transmission in the hippocampal CA1 area in APP (swe/ind) TgCRND8 mice. Neurobiol Aging. 31, 591-604 (2010).
- Bear, M. F., Malenka, R. C. Synaptic plasticity: LTP and LTD. Curr Opin Neurobiol. 4, 389-399 (1994).
- Foster, T. C. Involvement of hippocampal synaptic plasticity in age-related memory decline. Brain Res Brain Res Rev. 30, 236-249 (1999).
- Foster, T. C., Kumar, A. Susceptibility to induction of long-term depression is associated with impaired memory in aged Fischer 344 rats. Neurobiol Learn Mem. 87, 522-535 (2007).
- Hsu, K. S. Alterations in the balance of protein kinase and phosphatase activities and age-related impairments of synaptic transmission and long-term potentiation. Hippocampus. 12, 787-802 (2002).
- Vouimba, R. M., Foy, M. R., Foy, J. G., Thompson, R. F. 17beta-estradiol suppresses expression of long-term depression in aged rats. Brain Res Bull. 53, 783-787 (2000).
- Abdul, H. M., Furman, J. L., Sama, M. A., Mathis, D. M., Norris, C. M. NFATs and Alzheimer's Disease. Mol Cell Pharmacol. 2, 7-14 (2010).
- Abdul, H. M. Cognitive decline in Alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling. J Neurosci. 29, 12957-12969 (2009).
- Anantharaman, M. Beta-amyloid mediated nitration of manganese superoxide dismutase: implication for oxidative stress in a APPNLH/NLH X PS-1P264L/P264L double knock-in mouse model of Alzheimer's disease. Am J Pathol. 168, 1608-1618 (2006).
- Gengler, S., Hamilton, A., Holscher, C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 5, e9764-e9764 (2010).
- Stringer, J. L., Lothman, E. W. In vitro effects of extracellular calcium concentrations on hippocampal pyramidal cell responses. Exp Neurol. 101, 132-146 (1988).
- Landfield, P. W., Pitler, T. A., Applegate, M. D. The effects of high Mg2+-to-Ca2+ ratios on frequency potentiation in hippocampal slices of young and aged rats. J Neurophysiol. 56, 797-811 (1986).
- Ames, A. 3rd, Sakanoue, M., Endo, S. NA, K, CA, MG, AND C1 CONCENTRATIONS IN CHOROID PLEXUS FLUID AND CISTERNAL FLUID COMPARED WITH PLASMA ULTRAFILTRATE. J Neurophysiol. 27, 672-681 (1964).
- Gant, J. C., Sama, M. M., Landfield, P. W., Thibault, O. Early and simultaneous emergence of multiple hippocampal biomarkers of aging is mediated by Ca2+-induced Ca2+ release. J Neurosci. 26, 3482-3490 (2006).
- Thibault, O., Hadley, R., Landfield, P. W. Elevated postsynaptic [Ca2+]i and L-type calcium channel activity in aged hippocampal neurons: relationship to impaired synaptic plasticity. J Neurosci. 21, 9744-9756 (2001).
- Thibault, O., Landfield, P. W. Increase in single L-type calcium channels in hippocampal neurons during aging. Science. 272, 1017-1020 (1996).
- Stutzmann, G. E., Caccamo, A., LaFerla, F. M., Parker, I. Dysregulated IP3 signaling in cortical neurons of knock-in mice expressing an Alzheimer's-linked mutation in presenilin1 results in exaggerated Ca2+ signals and altered membrane excitability. J Neurosci. 24, 508-513 (2004).
- Stutzmann, G. E. Enhanced ryanodine receptor recruitment contributes to Ca2+ disruptions in young, adult, and aged Alzheimer's disease mice. J Neurosci. 26, 5180-5189 (2006).
- Lee, H. K., Min, S. S., Gallagher, M., Kirkwood, A. NMDA receptor-independent long-term depression correlates with successful aging in rats. Nat Neurosci. 8, 1657-1659 (2005).
- McNaughton, B. L., Douglas, R. M., Goddard, G. V. Synaptic enhancement in fascia dentata: cooperativity among coactive afferents. Brain Res. 157, 277-293 (1978).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved