Method Article
Preparación de la aguda rodajas de hipocampo de ratas y ratones transgénicos para el estudio de las alteraciones sinápticas durante el envejecimiento y la patología amiloide
En este artículo
Resumen
En este artículo se describen los procedimientos para la preparación de rodajas de hipocampo de ratas y ratones transgénicos para el estudio de las alteraciones sinápticas del cerebro asociadas con el envejecimiento y relacionadas con la edad las enfermedades neurodegenerativas, tales como la enfermedad de Alzheimer.
Resumen
La preparación de roedores rebanada hipocampo es quizás la herramienta más ampliamente utilizada para la investigación de la función sináptica y la plasticidad de mamíferos. El hipocampo se pueden extraer de forma rápida y fácil de ratas y ratones y las rodajas de permanecer viables durante horas en el líquido cefalorraquídeo artificial oxigenada. Por otra parte, las técnicas básicas de electrophysisologic se aplican fácilmente a la investigación de la función sináptica en rodajas de hipocampo y han proporcionado algunos de los mejores biomarcadores para el deterioro cognitivo. El corte del hipocampo es especialmente popular para el estudio de los mecanismos de plasticidad sináptica involucrados en el aprendizaje y la memoria. Los cambios en la inducción de la potenciación a largo plazo y la depresión (LTP y LTD) de la eficacia sináptica en rodajas de hipocampo (o falta de ella) se utilizan con frecuencia para describir el fenotipo neurológico de los animales con deficiencias cognitivas y / o para evaluar el mecanismo de acción de compuestos nootrópicos. En este artículo se describen los procedimientos que utilizamos para la preparación de rodajas de hipocampo de ratas y ratones transgénicos para el estudio de las alteraciones sinápticas del cerebro asociada con el envejecimiento y la enfermedad de Alzheimer (EA) 3.1. El uso de ratas y ratones de edad AD modelo puede presentar una serie de desafíos para los investigadores acostumbrados a usar las ratas más jóvenes y / o ratones en sus investigaciones. Ratas de edad avanzada tienen más grueso y más resistente cráneos del tejido conectivo que los más jóvenes ratas y ratones, lo que puede retrasar la extracción del cerebro y / o la disección y, en consecuencia negar o exagerar las diferencias reales con la edad en la función sináptica y la plasticidad. El envejecimiento y la patología amiloide también pueden exacerbar el daño del hipocampo sostenido durante el proceso de disección, una vez más que complica cualquier inferencias extraídas de la evaluación fisiológica. En este caso, hablamos de las medidas adoptadas durante el procedimiento de disección para minimizar estos problemas. Ejemplos de las respuestas sinápticas adquiridos en "saludable" y "poco saludables" rebanadas de ratas y ratones se proporcionan, así como representante de los experimentos de plasticidad sináptica. El posible impacto de otros factores metodológicos en la función sináptica en estos modelos animales (por ejemplo, componentes de la solución de grabación, los parámetros de estimulación) también se discuten. Aunque el foco de este artículo es sobre el uso de las ratas viejas y en ratones transgénicos, los novatos para cortar la fisiología debe encontrar suficiente detalle aquí para empezar a trabajar en sus propios estudios, usando una variedad de modelos de roedores.
Protocolo
1. La preparación de helado líquido cefalorraquídeo artificial oxigenada (ACSF)
- Preparar 2 L de "Ca 2 + libre" ACSF. En un erlenmeyer 2L, añadir aproximadamente 1,5 l de agua estéril o destilada dos veces-H 2 O, y comenzar a agitar vigorosamente en una placa de agitación. Agregue los siguientes componentes ACSF (en mM): 124 NaCl, 2 KCl, 1,25 KH 2 PO 4, 2 MgSO 4, 26 NaHCO 3, y 10 de dextrosa (ver Tabla 1). Llevar a un volumen de 2 litros con agua destilada H 2 O.
- El uso de un acuario de burbuja y el tubo conectado a un 95% O 2 / 5% CO 2 tanques de aire, oxigenar ACSF enérgicamente durante unos 20-30 min. Compruebe el pH, y si es necesario, ajustar a 7,4 con NaOH o HCl.
- Vierta 750 ml de oxigenada Ca 2 + libre ACSF en un matraz Erlenmeyer separado, cubra la abertura con parafilm, y la transferencia a un ultracongelador (-80 ° C) durante 20-30 min. Este medio se utilizará para la disección de rodajas de hipocampo del cerebro y aguda *. Añadir 2 mM CaCl 2 al volumen restante 1,25 L de ACSF #, revuelva bien y reanudar la oxigenación, con un 95% O 2 / 5% CO 2. Este medio se utiliza para almacenar las secciones de cerebro después de las disecciones, y para perfusión cortes durante las grabaciones electrofisiológicas.
* Helado de Ca 2 + libre de los medios de comunicación se utiliza para disminuir el metabolismo y reducir al mínimo Ca 2 +-dependiente de la excitotoxicidad durante la disección.
# Los cambios en la desregulación del Ca 2 + durante el envejecimiento y la EA puede tener un impacto importante en la inducción de la Ca 2 +-dependiente de la plasticidad sináptica 4-9. Informes contradictorios sobre las diferencias de edad en LTD puede atribuirse en parte al uso de diferentes ACSF Ca 2 +: Mg2 + ratios durante las grabaciones corte (ver 2,4,10). La importancia de la Ca 2 + regulación y el Ca 2 + ACSF nivel de estudios de envejecimiento se aborda con mayor detalle en la sección de Discusión. - Mientras que el Ca 2 + libre ACSF es la congelación, prepare una cámara de retención para el mantenimiento de las secciones de cerebro antes y durante las grabaciones electrofisiológicas *. Usamos una medida macro-celebración de la cámara que contiene cuatro microcámaras individual (ver Figura 2). El macrochamber se llena con agua estéril, oxigenada H 2 O y el microcámaras son esencialmente las islas que sobresalen por encima de la superficie del agua. Dentro de cada una microcámara, rodajas de descanso en el inserto anotó en una piscina de ACSF oxigenada. Rodajas no están completamente sumergidas, pero se sientan en una interfaz con el aire húmedo. Un elemento de calefacción aislado dentro de la macrochamber permite ajustar la temperatura.
* Algunas variedades de las cámaras también están disponibles en el mercado (por ejemplo, Warner Instrumentos hace una inmersión al estilo de "Pre # Cámara BSC-PC) y debe ser adecuado para su uso en el envejecimiento y transgénicos estudios rebanada del ratón. En caso de necesidad, las rebanadas se puede mantener por varias horas en una pequeña placa de Petri llena de ACSF. Haz un pequeño agujero en la tapa de Petri de un tubo de oxígeno. Tenga cuidado de que las burbujas de oxígeno físicamente no agitar las rebanadas. Slices obtener oxígeno suficiente si el tubo de salida se eleva a sólo por encima de la superficie ACSF (dispersión de gas debería causar una hendidura en la superficie del líquido).
2. Eliminación del cerebro y del hipocampo en la disección de edad avanzada (> 20 meses de edad, las ratas)
- * Prepare el área de disección junto a un lavabo grande (ver Figura 1 y Tabla 2). Coloque una guillotina de pequeños animales en el fregadero y diseñar los instrumentos y materiales para la extracción del cerebro y la disección del hipocampo como una toalla de papel doblada, una hoja de bisturí # 11, tijeras BeeBee, gubias hueso, una "herramienta de Hipocampo" (una espátula especializados doble de Bellas instrumentos quirúrgicos), pequeñas tijeras quirúrgicas, una capa fina de dos extremos espátula de plástico pipeta Pasteur, 110 mm de diámetro, papel de filtro Whatman, una tapa de vidrio de 100 mm de una caja de petri con hielo, y una cuchara de plástico. También hay que tener una bolsa de plástico cerca de la eliminación de la canal.
* Extracción del cerebro debe ser completada lo más pronto posible, así que es una buena idea mental "caminar a través" del procedimiento y establecer los instrumentos en el orden de uso. - Quitar Ca 2 + libre ACSF del congelador. Los medios de comunicación debe ser parcialmente, no completamente, congelados. Vierta aproximadamente 50 ml de ACSF en un vaso de vidrio, cubierta con Parafilm, y el lugar junto a la zona de disección. Este medio se utiliza para almacenar brevemente el cerebro una vez que se retira. El resto de Ca 2 + libre de los medios de comunicación se utilizará para llenar el depósito en el Vibratome para la preparación del corte. Este medio puede ser reoxygenated, o simplemente cubiertos con parafilm y se coloca en el refrigerador a 4 ° C.
- La eutanasia a la rata con métodos autorizados por el Comité Institucional y el empleo Comisión (IACUC). Nuestros animales son colocados en una pequeña cámara de plexiglás que se va llenando con 100% de CO 2. Pérdida de la conciencia general se produce dentro de cinco minutos y se confirma por la ausencia de la actividad reflejadespués de una pizca dedo del pie.
- Decapitar a la rata inmediatamente rostral a la primera vértebra cervical y el lugar de la cabeza en la toalla de papel doblada. Utilizando el bisturí # 11, rápidamente hace una incisión en el medio del cuero cabelludo de partida, cerca del hueso nasal y corriendo en dirección caudal hasta el hueso occipital. Asegúrese de cortar por completo a través del músculo cutáneo, totalmente exponer los puntos de sutura en la superficie dorsal del cráneo.
- Corte a través de las placas de cráneo con tijeras BeeBee. En ratas y ratones jóvenes, el cráneo puede ser removido rápidamente con el uso de pinzas para huesos solo. Sin embargo, las ratas de edad tienen más gruesos cráneos que las ratas y los ratones adultos jóvenes que pueden hacer este procedimiento difícil. Hemos encontrado que el corte a través del cráneo facilita enormemente la extracción de hueso con gubia, disminuye la lesión en el cerebro, y guarda unos segundos preciosos. Con la cabeza de la rata firmemente en el mostrador, el lugar de la vanguardia de la enorme baja de las tijeras beebee, en la región superior del agujero occipital en la parte posterior del cráneo. Mantener la enorme baja con firmeza contra la superficie interna del cráneo (y lejos del cerebro) *, cortar a través de la placa occipital, y luego a lo largo de la línea media de la sutura de las placas parietales. Proceder rostral hasta que se corte a través de las placas de cráneo frontal.
* Es muy importante que la presión se dirige lejos del cerebro para prevenir la medición inadvertida. - Separar el occipital, parietal, temporal y las placas del cráneo del cerebro. Seguir sosteniendo la cabeza con firmeza a la encimera para la estabilidad y el apalancamiento y deslice la mandíbula inferior de la gubia en la presión parietal izquierda manteniendo la placa contra la superficie interna del cráneo. A continuación, apretar las mandíbulas de la gubia y rodar juntos la muñeca hacia arriba y hacia delante para tirar del parietal y occipital placas fuera del cerebro. Esto se debe exponer la mayor parte de la superficie dorsal del hemisferio izquierdo. Si es necesario, utilizar la gubia para quitar la placa frontal izquierdo también. Repita este proceso para el otro hemisferio. Una vez que las placas se desplazan, de forma rápida inspección para detectar cualquier dura que se puede unir a las placas temporales y se extendía por toda la superficie del cerebro. Tire suavemente de estas acabar con la gubia o cortar con una tijera *. Ahora, deslice la mandíbula superior de la gubia entre el cerebro y la placa temporal derecha, de nuevo manteniendo la presión hacia el cráneo y fuera del cerebro. Apretar y girar la placa temporal fuera del cerebro. Usted debe oír / sentir una "crisis" como hacer esto. Repita para el lado izquierdo.
* La duración puede ser difícil de detectar, sobre todo si el animal ha sido transcardially perfundidos con ACSF. Sin embargo, si dura no se retiran, se cortan el cerebro (y más probable es que el hipocampo) como una navaja cuando las placas temporales son eliminados. Recortes de la duramadre de distancia cerca de las placas temporales reducirá al mínimo la probabilidad de apuñalar en el cerebro. - Extraer el cerebro *. Quite rápidamente la parafina de la Ca 2 + libre ACSF "aguanieve". Ahora deslice la cabeza espátula ancha de la herramienta del hipocampo entre la superficie ventral del cerebro y las placas del cráneo abajo hasta que esté completamente en el cerebro. Mover la espátula lateralmente de lado a lado y luego hacia adelante y hacia atrás varias veces para cortar intactos los nervios craneales. Ahora saque el cerebro con la herramienta del hipocampo y se sumergen en Ca 2 + libre ACSF y cubrir con parafilm. Deje que el frío del cerebro durante un minuto aproximadamente. Este es un momento oportuno para limpiar la guillotina, a disponer de la canal, y reorganizar el área de disección.
* Para ver los pasos 2.3 a 2.7, la velocidad es la esencia. Tratamos de completar este procedimiento (de la decapitación de la inmersión en el cerebro ACSF) en 30-35 segundos. En nuestra experiencia, las extracciones de tomar más de un minuto parece afectar negativamente a la salud rebanada hipocampo, especialmente para las ratas de edad avanzada. El uso de estos procedimientos, se ha observado ninguna diferencia en los tiempos de extracción entre las ratas viejas y jóvenes de nuestros estudios. - Extraer el hipocampo. Coloque el papel de filtro Whatman en la tapa de la placa helada de Petri y humedecer el papel con ACSF con la pipeta de transferencia de plástico. Recuperar el cerebro de la ACSF con una cuchara y colocarla en el papel húmedo Whatman. Usando la hoja del bisturí, quitar el cerebelo, y aproximadamente una cuarta parte de los lóbulos frontales rostral. Ejecute el bisturí a través de la fisura intrahemisférica para separar completamente los dos hemisferios. Coloque un hemisferio de nuevo en el fangoso ACSF y "stand" de la otra hasta la etapa de disección de tal manera que el plano coronal del lóbulo frontal es hacia abajo. Que claramente debe ser capaz de distinguir el tronco cerebral y el cerebro medio (que son de color blanco) de la corteza que recubre (que es de color rosa / gris). Localice los tubérculos cuadrigéminos superiores e inferiores en el cerebro medio, los cuales se ven como dos blancas "botones" y estará en el "top" del cerebro en esta orientación. Con las tijeras quirúrgicas, aplique un lado del cerebro medio y deslice la espátula con un peso de la brecha seentre los tubérculos cuadrigéminos y el neocórtex. Muy suavemente, continúan cayendo la espátula y tire del tronco cerebral / cerebro medio / tálamo, lo cual revela el interior de los ventrículos laterales y la superficie medial del hipocampo. Use el filo de la espátula para separar suavemente el fondo de saco, un haz de fibras blancas ubicado en la parte anterior / dorsal del hipocampo. Con la tijera, suavemente continúe tirando del tallo cerebral / cerebro medio / tálamo lejos sin cortar por completo del resto del cerebro. La corteza de hipocampo ahora deben determinar libremente hacia la base del cerebro *. A continuación, a su vez la etapa de la disección de lo que usted está buscando en el hipocampo y la corteza medial que cubre como si fuera un corte sagital (menos el tálamo). Ahora debe ver el blanco fibras fimbria que forman una hipérbola poco profundas en la parte inferior del hipocampo en este plano. Usando la pipeta de transferencia de plástico, con cuidado chorro algunos ACSF en el hueco debajo de la fimbria para ayudar a separar el hipocampo de la corteza. Deslice suavemente la espátula en la brecha, de tal manera que el lado largo de la espátula corre paralela con el eje longitudinal del hipocampo. Una vez que la espátula está completamente bajo el hipocampo, mantenga pulsado el tronco cerebral / cerebro medio / tálamo firmemente con las tijeras y el rollo de la espátula lejos de su cuerpo para separar físicamente el hipocampo del resto del cerebro. Una vez que el hipocampo es gratis, recortar con cuidado cualquier resto de la corteza, los vasos sanguíneos, y la materia blanca. Coloque un poco de ACSF fangoso en el otro lado de la fase de disección. Suavemente la posición del hipocampo al lado de la aguanieve y rociar con unos pocos mililitros de ACSF con la pipeta de transferencia de plástico. A continuación, retire el otro hemisferio y repetir la disección.
* Es posible que tenga las tijeras para cortar el tejido conectivo adicional, la materia blanca, o vascular que impide la separación de la corteza del tronco cerebral. Los puntos de las tijeras se muy cerca del hipocampo, así que asegúrese de ofrecer recortes muy precisa (unas tijeras afiladas son una necesidad).
3. Extracción y disección del cerebro del hipocampo en ratones transgénicos Ancianos
- La eutanasia y decapitar el ratón y hacer una incisión en el cuero cabelludo como se describe en la sección 2.3. Los ratones tienen cráneos más delgados que las ratas que simplifica enormemente la extracción del cerebro. Corte a través del cráneo con tijeras es por lo tanto, innecesarios. Use pinzas para huesos maxilares más pequeños (Tabla 2) para alejarse occipital, parietal, temporal y las placas de cráneo. Al igual que con la rata, recuerde usar movimientos controlados y tire firmemente la mandíbula inferior de la gubia en la superficie interna del cráneo y lejos del cerebro a medida que quitar las placas. Una vez que las placas se retiran, use el extremo angosto de la herramienta para cortar del hipocampo resto de los nervios craneales y saca el cerebro en helado Ca 2 + libre ACSF.
- Preparar las secciones de cerebro. Debido al menor tamaño del cerebro del ratón, la disección de la hipocampo puede ser un poco más difícil (aunque ciertamente factible) que cuando se utiliza ratas. Por lo tanto, para facilitar las cosas, le quitamos el cerebelo y consejos rostral de los lóbulos frontales, pero no diseccionar el hipocampo. En cambio, los hemisferios del cerebro están físicamente separados con una hoja de bisturí y dejó intacta para seccionar Vibratome (véase la sección 4 más abajo).
4. Sección de tejido cerebral en rodajas con un microtomo de vibración (Vibratome) y la transferencia de cámara de retención *
- Llene el depósito de la Vibratome con helado de Ca 2 + libre ACSF, de tal manera que la etapa de corte y la hoja están completamente sumergidos. Para hacer cortes de ratas, cortar las puntas rostral y caudal de cada hipocampo con una hoja de bisturí. Estos cortes le permitirá a la posición vertical del hipocampo en estrecha colaboración, como dos columnas. Esto funciona mejor si el giro dentado del hipocampo es cada uno frente al otro y CA3 regiones están orientados en la misma dirección. Para hacer cortes del ratón, la posición vertical de cada hemisferio en estrecha colaboración con los lóbulos frontales hacia abajo. Pegue el tejido cerebral en un bloque de montaje y traslado a la etapa de corte de la Vibratome. Nos suelen preparar ~ 400 secciones uM para experimentos de fisiología sináptica. Secciones más delgadas deben estar preparados en caso de imágenes fluorescentes se llevará a cabo (por ejemplo, las investigaciones de los niveles de Ca 2 + y transitorios). Recoger las rebanadas con una pipeta de boca ancha o un pincel # y la transferencia a una pequeña placa de Petri que contiene helada Ca 2 + libre ACSF.
* El uso de un daño Vibratome minimiza a las superficies superior e inferior de la división y es sin duda recomendable para los estudios que requieren un análisis de las células cerca de la superficie de corte (por ejemplo, la abrazadera de tensión y Ca 2 + estudios de imagen). Sin embargo, alternativas más baratas están disponibles y son adecuados para la generación de cortes para los experimentos de fisiología extracelular. Hemos utilizado una pequeña gravedad controlada helicóptero 2,11 y un helicóptero del tejido McIlwain 12 con buenos resultados. Para this procedimiento hipocampo se colocan en una escena y se secciona con un helicóptero vertical. Un cepillo se utiliza para transferir las rebanadas (de uno en uno) para la celebración de un plato pequeño lleno con helado de Ca 2 + libre ACSF. Un problema con este enfoque es que el hipocampo se pueden mover entre las chuletas que resulta en secciones irregulares. Además, tenga cuidado para eliminar la mayor cantidad de sustancia blanca, y sobre todo como la vasculatura tanto como sea posible antes de cortar. Este material se pegue a la brocha, la hoja de afeitar, o ambos, por lo que la transferencia de corte muy difícil y aumenta la probabilidad de estiramiento o dañar el tejido.
# Cuando se utiliza un cepillo, trate de descansar el corte en sentido longitudinal a través de las cerdas. Envolver la parte alrededor de la punta del pincel puede causar que el tejido innecesario estiramiento. - Transferencia de las secciones de cerebro de la cámara de explotación en la que se bañan en oxigenada Ca 2 + que contienen ACSF. Poco a poco llevar la temperatura de la cámara de 27 ° a 32 ° C (1 ° cada cinco minutos). Permitir rebanadas de incubar durante 1 a 1,5 h antes de los experimentos electrofisiológicos.
5. Obtener y CA3-CA1 Registro de las respuestas sinápticas
- Para básicos grabaciones extracelular en rodajas aguda, su estación de electrofisiología tendrá que incluir *: una cámara de registro, un sistema de perfusión, un microscopio con capacidad de> 4 aumentos, grabación, estimulante y electrodos de tierra, macro y micromanipulador, un rígido resistente a las vibraciones mesa y jaula de Faraday, un estimulador, amplificador y de analógico a digital (A / D); osciloscopio (de preferencia), y ordenador personal con software de adquisición correspondiente.
* Kerr Scientific Instruments ofrece un sistema de electrofisiología fantástico y de bajo costo (es decir, el tejido Kerr sistema de grabación) para llevar a cabo una variedad de experimentos de corte básico de electrofisiología. Este sistema tiene una huella pequeña, estimuladores portátiles y amplificadores, y puede ser utilizado en un estándar de laboratorio, banco, sin la necesidad de una jaula de Faraday voluminosos.
Por supuesto, las secciones de cerebro también se puede utilizar para la realización de numerosas técnicas electrofisiológicas y de imagen elaborada, que se requiere equipo adicional y materiales. Por ejemplo, nuestra principal estación de electrofisiología contiene un amplificador con tensión de rápido-y las capacidades actuales-clamp, un sistema de iluminación fluorescente, y una cámara digital. Esta estación es utilizada para grabaciones de campo extracelular en rodajas de cerebro, así como patch-clamp grabaciones y las imágenes fluorescentes en rodajas y los cultivos celulares 3,12,13. Ver Tabla 3 para una lista completa de equipos y componentes. - Con una pipeta de boca ancha o el pincel pequeño, la transferencia de uno o más sectores a la cámara de grabación * permitir que se aclimate durante 10-15 minutos antes de la estimulación / grabación. Para nuestros estudios, las rebanadas se sumergen en ACSF y el resto en la red se inserta en una cámara RC-22 por parte de Warner Instruments (ver Figura 3). ACSF es alimentada por gravedad a través de un regulador para ajustar el caudal y, previamente calentada a 32 ° C por una línea de micro-calentador antes de llegar a la cámara de grabación. Una línea central de vacío se utiliza para eliminar ASCF.
* Muchas variedades de sumergibles y una interfaz al estilo de las cámaras de grabación están disponibles comercialmente. Hemos observado que las rebanadas muestran las respuestas sinápticas más sólido en una cámara de interfaz (es decir, parte se sienta en una interfaz con el aire y humidificado ACSF) 2,11. Sin embargo, la capacidad de respuesta en general es más estable cuando se sumergen en rodajas ACSF. La perfusión del fármaco es más eficaz en las cámaras de inmersión. - Posición de estimulación y registro de los electrodos. Con el seccionador estimulador o estímulo encendido, pero la producción marcó a 0, la posición de un electrodo de estimulación sobre la rebanada de la región estrato radiatum de CA2 CA3 cerca de la frontera (ver Figura 4). Nosotros utilizamos un alambre de platino iridio trenzado para entregar 50-100 pulsos difásica nos CA3 Schaffer garantía (SC) de fibras. El uso de alambre de platino iridio y legumbres difásica puede ayudar a minimizar la polarización de los electrodos. Bajar un electrodo de registro en CA1 estrato radiatum, sólo salir a la superficie de la rebanada. Nuestro electrodo de registro es un alambre de Ag / AgCl en una micropipeta ACSF lleno de vidrio (resistencia a la punta de aproximadamente 7 MW). A su vez la salida del estimulador hasta un nivel moderado (hemos puesto nuestro aislador de estímulo a ~ 150 mA) y comenzar la administración de pulsos de estímulo y la adquisición de la actividad utilizando el software de adquisición, tales como Clampex de Axon Instruments, Inc. Baje lentamente el electrodo de estimulación en los pequeños intervalos de hasta una artificact estímulo es registrado en CA1. A continuación, seguir bajando poco a poco tanto los electrodos de estimulación y registro en intervalos de tiempo que adquieren CA1 respuestas hasta que la descarga de fibra (FV) y el potencial postsináptico excitador (PPSE) amplitudes llegar a los niveles máximos (ver Figura 4B).
- Establecer una curva de la fuerza sináptica y la plasticidad sináptica investigar. Para generar una curva de la fuerza sináptica, entregar pulsos de estímulo a la SC a intensidades cada vez mayor y th registroe la actividad correspondiente en CA1. La gama y el número de niveles de intensidad del estímulo utilizado puede variar, pero debe ser suficiente para generar una curva sigmoidal cuando se traza contra de cualquiera de FV o valores EPSP (Figura 5). La amplitud de la FV proporciona una estimación fiable de la proporción de fibras presinápticas activa, mientras que la pendiente EPSP proporciona una medida no contaminada de CA3-CA1 monosináptica corrientes. El trazado de la pendiente en contra de la EPSP FV a través de los niveles de intensidad del estímulo por lo tanto, refleja el tamaño de la EPSP por el número de las fibras aferentes activadas y proporciona una excelente estimación del CA3-CA1 fuerza sináptica. Por lo general, los niveles de la fuerza sináptica se redujo significativamente en área CA1 de ratas y ratones de edad APP/PS1, en comparación con las ratas jóvenes y emparejados por edad ratones de tipo salvaje por ejemplo, ver a 4,14.
- Sectores que muestran signos de mala salud (es decir, un máximo de amplitud EPSP <1 mV) o bien hiperexcitabilidad (es decir, la aparición de dos o más picos de población) en la curva de la fuerza sináptica se excluyen del análisis estadístico (véase la Figura 4C). Hemos encontrado que estos cortes rara vez presentan respuestas estables a través de un periodo de 60 minutos y / o muestran respuestas muy variables después de la inducción de la plasticidad sináptica. Merece destacar que "cortes no saludables" representan sólo aproximadamente el 10-20% de todos los sectores transferidos a la cámara de grabación. Por otra parte, en nuestra experiencia, la frecuencia de la identificación de un segmento poco saludables es muy similar en edad, la especie, y el genotipo.
- Inducir la potenciación a largo plazo (LTP) o depresión a largo plazo (LTD) en rodajas. LTP y LTD se aumenta la duración (LTP) y disminuye (LTD) en la función sináptica en respuesta a los diferentes patrones de activación sináptica. Ambos procesos se cree ampliamente que reflejan los mecanismos fundamentales para el aprendizaje y memory15 y ofrecer medidas útiles para la investigación de resultados los mecanismos celulares de la disfunción neuronal y / o para la evaluación de estrategias farmacológicas para aminorar el déficit de memoria y neurodegeneración 16.
Para los experimentos de plasticidad sináptica, restablecer la intensidad del estímulo para todos los sectores para * 1 mV y empezar la estimulación basal a una frecuencia de 0.033 Hz. Valores EPSP pendiente debe ser estable durante al menos 20 minutos antes de la inducción de LTP o LTD. Vigilar de cerca PPSE durante este tiempo y restablecer la intensidad del estímulo si la pendiente fluctúa más del 10% y comenzar una nueva línea de base. Inducir LTP con un tren de un segundo de estimulación de 100 Hz o múltiples explosiones cortas (~ 10 pulsos) de estímulo de 100 Hz da cada 200 ms. Para la inducción de LTD, entregar 900 pulsos de estímulo a un ritmo de 1 Hz. Después de la inducción de LTP o LTD, recoger las respuestas sinápticas por un período adicional de 60 minutos o más. Valores EPSP pendiente obtenidos antes y 60 minutos después de la estimulación de alta frecuencia / baja se comparan para determinar la presencia de LTP o LTD.
Ratas y ratones de edad APP/PS1 tienden a mostrar déficit LTP y LTD mayor (ver Figura 5), y estos cambios se han sugerido para contribuir al deterioro cognitivo en estos modelos animales 6,16. Sin embargo, a diferencia de APP/PS1 ratones, los cambios en la LTP / LTD en ratas de edad son variables a través de los laboratorios. Ratas de edad avanzada por lo general presentan niveles similares LTP comparación con los adultos en respuesta a la "intensa" (es decir, 100 Hz) de estimulación, pero los déficit mostrar leves cuando se utilizan los parámetros de estimulación (es decir, las frecuencias más bajas de estímulo o menos pulsos de estímulo) (para una revisión ver 4,6, 16). Además, algunos laboratorios, incluido el nuestro, han observado una mayor susceptibilidad a la inducción LTD en ratas de edad 2,17-19, mientras que otros grupos no han encontrado ninguna diferencia o menor susceptibilidad de los animales de edad avanzada. Como se discutió brevemente a continuación (véase la discusión), las diferencias sutiles pero fundamentales en el protocolo experimental puede dar cuenta de estas discrepancias.
* La intensidad de la estimulación y la amplitud EPSP puede influir en la inducción de LTP y puede ser una causa importante de resultados discrepantes en la literatura. Esta cuestión será analizada más en la sección de Discusión.
6. Resultados representante
Nuestro trabajo, y el trabajo de otros grupos, sugiere que los cambios en los astrocitos basada en la señalización inflamatoria puede provocar y / o acelerar la disfunción neurológica durante el envejecimiento y la EA 13,20,21. Recientemente, se ha utilizado la fuerza sináptica, LTP y LTD como medidas de punto final para investigar la eficacia y los mecanismos de acción de varios nuevos anti-inflamatorios reactivos de mediana edad APP/PS1 ratones (ver 22 para la descripción de este modelo) y entre Fischer 344 ratas. Los resultados a continuación se obtuvieron utilizando los protocolos descritos en este artículo.
Uno de los nuevos anti-inflamatorios viral adeno-asociado (AAV) reactivos desarrollados por nuestro laboratorio se ha demostrado en estudios piloto para aumentar significativamente la fuerza sináptica (p <0,05) y evitar que el déficit LTP (p <0,05) en los de mediana edad (16 meses de edad) APP/PS1 ratones (n = 4-6 rebanadas por la condición de tratamiento). Representante de las curvas de la fuerza sináptica y experimentos de LTP a partir de dos cortes diferentes, colleja de los mismos 16 meses del ratón APP/PS1, se muestra en la Figura 5A-C. Una rebanada se extrajo del hemisferio tratado con nuestra novela AAV (Reactivo A), mientras que la otra rebanada fue tratada con un reactivo de control AAV (Control). LTP fue inducida en ambos segmentos con dos trenes de una sección de la estimulación de 100 Hz (10 seg intertrain intervalo). Tenga en cuenta que la curva de la fuerza sináptica para el reactivo A-tratados corte se desplaza a la izquierda de la parte de control, lo que indica una mayor fuerza sináptica. Observamos también que, típica de mediados de los años APP/PS1 ratones, LTP decayó rápidamente a los valores basales en la parte de control (por ejemplo, 23). Por el contrario, LTP decayó poco en la parte tratada con reactivos nuestra novela.
En un estudio reciente en segundo lugar, hemos observado importantes LTD en el vehículo de las ratas tratadas con edad (85% de los pre-LTD inicial, p <0,05). Por el contrario, no LTD se observó en ratas de edad avanzada tratados con el nuevo anti-inflamatorio "Drogas A" (97% de los pre-LTD línea de base, no significativo). No hay efectos de drogas en la fuerza sináptica se observaron. Representante experimentos LTD de este conjunto de datos (n = 8-10 ratas por grupo) se ilustra en la figura 5D-F.
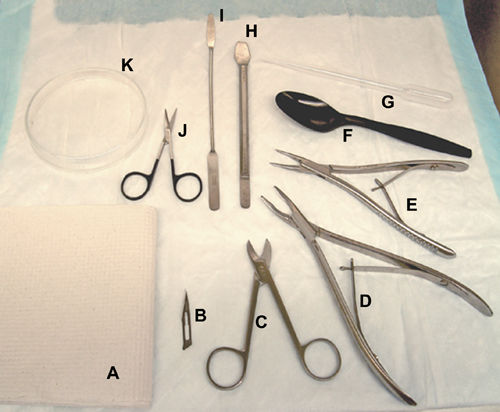
Figura 1. Herramientas y materiales utilizados para la disección del cerebro. Una toalla de papel,. B, hoja de bisturí. C, tijeras Bibi. D, los huesos gubia (para ratas). E, gubias hueso (para ratones / ratas). F, una cuchara de plástico. G, una pipeta de transferencia de plástico. H, la herramienta del hipocampo. I, espátula. J, tijeras quirúrgicas. K, placa de Petri de vidrio.

Figura 2. Cortes de cerebro personalizado cámara de retención. Macrochamber A,. B, la tapa. C, H 2 O, con depósito de tubo de silicona perforada. D, microcámara. E, tubo ACSF entrega (polietileno). F, O 2 tubo de suministro. G, el puerto para el control de la temperatura. H, inserte anotó microcámara.

Figura 3. RC22 cámara de inmersión. Una cámara de grabación,. B, el electrodo de tierra. C, por aspiración con aguja.

Figura 4. Ilustración corte del hipocampo y formas de onda extracelular. Una historieta, de una sección transversal del hipocampo utilizados en los experimentos de electrofisiología. CA = cuerno Ammonis. DG = giro dentado. SC = colaterales Schaffer. S = radiatum estrato radiatum. B, la estimulación eléctrica de la SC (CA3 axón vías) provoca un artefacto de estímulo, seguido casi inmediatamente por un aumento de la población pre-sináptica, o la volea de fibra (FV). La amplitud de la FV es directamente proporcional a la cantidad de fibras SC activado. La pendiente de la fase negativa continua del campo de potencial postsináptico excitatorio (PPSE) se corresponde directamente con la activación de la despolarización de las corrientes sinápticas en las neuronas piramidales CA1 en respuesta a la liberación de glutamato de terminales SC. C, la superposición de formas de onda representante extracelular registrado en CA1 estrato radiatum en respuesta a nueve diferentes niveles de intensidad de estímulo (30 a 500 mA) en una "sana" (panel izquierdo), "no saludable", y el tramo "hiperexcitabilidad". Cinco formas de onda se promediaron por nivel. Cortes sanos responden dinámicamente a través de este rango de estímulo y muestran una sola positiva continua de la población espiga (que refleja CA1 descarga neuronal) a nivel de estímulo mayor. En la cámara RC22 inmersión, PPSE máxima típicamente rango de 1.5 a 3 mV de amplitud. Cortes no son saludables (panel central) presentan a menudo una gran FV, pero una pequeña EPSP máxima (<1 mV) y por lo general muestran la plasticidad pobres. Rebanadas de hiperexcitabilidad (panel derecho) muestran dos o más picos de población de regeneración en la rama ascendente de la EPSP. Respuestas en rodajas hiperexcitables son a menudo inestables y están afectados por variable LTD / LTP estimulación.

Figura 5. Representante experimentos de electrofisiología realizaron en rebanadas aguda de mediana edad (16 meses) y los ratones APP/PS1 años (22 meses) Fisher 344 ratas. Paneles AB datos recogidos muestran APP/PS1 los ratones tratados con un control de virus adeno-asociados (AAV) viral construcción (control) o una novela reactivo AAV (Reactivo A) que ha sido desarrollado por nuestro grupo de laboratorio. Relativa a la división de control, la porción tratada con el reactivo A muestra un marcado cambio hacia la izquierda en la EPSP: FV curva (A) indicativo de una mayor fuerza sináptica. La porción de reactivo-A-tratados también muestra LTP robusto y estable (B) después de la entrega de dos de 1 seg, 100 trenes de estímulo Hz, mientras que la porción de control de exposiciones LTP deficiente, típico de este modelo animal. Paneles DF datos muestran recogidos a partir de dos ratas que recibieron individuo de edad avanzada crónica (4 semanas) perfusiones intrahippocampal de vehículo o de una novela de medicamento antiinflamatorio (un fármaco). La fuerza sináptica basal fue relativamente poco afectada por el tratamiento farmacológico(D). Sin embargo, una droga muy eficaz en la prevención de la inducción de LTD (E). Los paneles C y F muestran formas de onda EPSP representante registrado de cortes individuales antes (pre) y 60 min después (post) la entrega de LTP / LTD estimulación. Tenga en cuenta que los artefactos de estímulo no se muestran.
Discusión
Los pasos descritos en este protocolo ayudará a asegurar que la disección del cerebro se llevan a cabo al menos tan rápida y eficientemente en la edad, como en ratas adultas jóvenes. También proporcionan suficiente detalle para los principiantes a crear sus propios estudios de corte en la LTP y LTD. Si una mayor exploración del envejecimiento y los cambios de AD en la función sináptica y la plasticidad es una de sus metas, hay al menos otras dos cuestiones metodológicas, ha aludido más arriba, que merecen mayor consideración. Laboratorios de primera, han mostrado que el Ca 2 +: Mg2 + en relación ACSF grabación puede tener un efecto marcado en la plasticidad sináptica de inducción en rodajas de hipocampo 2,10,24,25. En el LCR de mamíferos, el Ca 2 +: Mg2 + proporción es de aproximadamente una (por ejemplo, ver 26). Sin embargo, ACSF Ca 2 +: Mg2 + ratios más cercano a 2 se utilizan comúnmente en los estudios de corte de la función sináptica y la plasticidad. En los primeros estudios, esta práctica se adaptó probablemente para optimizar la inducción de la LTP, y posteriormente se convirtió en rutina para todos los estudios de plasticidad. Sin embargo, esta práctica puede ser problemático en los estudios de envejecimiento y la EA debido a las diferencias bien caracterizado en la regulación neuronal de Ca 2 +. En concreto, Ca 2 + afluencia y / o Ca 2 + inducida por Ca 2 + de liberación se encuentra elevada en ratas de edad avanzada y / o ratones modelo AD durante la activación neuronal 3,27-31. La inducción de LTD es particularmente sensible a los cambios sutiles en los niveles de ACSF + Ca 2. El protocolo, que utiliza 2 mM Ca 2 + y 2 mM Mg 2 +, suele dar lugar a LTD para la edad, pero no animales adultos jóvenes y 2, mientras que los estudios que utilizan un Ca 2 +: Mg2 relación + más cercano a dos, se ha observado LTD sólida en los adultos en el ausencia de una diferencia de edad 2,10 o en conjunto con la reducción de LTD en ratas de 32 años. Estas observaciones ponen de relieve la necesidad de considerar cuidadosamente ACSF Ca 2 + y Mg 2 + cuando se comparan los niveles de Ca 2 +-dependiente de la plasticidad en los animales adultos mayores y jóvenes.
El segundo problema metodológico se refiere a la fuerte dependencia de la LTP en la despolarización postsináptica 33 y posible envejecimiento / genotipo las diferencias en la fuerza sináptica. En un experimento típico de LTP, de base y la intensidad de la estimulación LTP se ajusta para producir una media máxima (o de tres cuartos de máxima) EPSP amplitud. El problema potencial es que las ratas y los ratones de edad por lo general muestran una reducción APP/PS1 fuerza sináptica relación con sus homólogos de tipo menor y / o silvestres, lo que significa que los valores basales EPSP también será menor en las ratas y los ratones de edad APP/PS1. PPSE pequeños se puede traducir en menos de despolarización durante la estimulación LTP, resultando en una menor probabilidad de inducir LTP 33. Debido a este potencial de confundir, es difícil determinar si estos animales presentan un déficit de rendimiento, un déficit de la plasticidad o ambas cosas. Es decir, los mecanismos de inducción de LTP en ratones de edad y / o APP/PS1 puede ser funcionalmente intacto (sin déficit de plasticidad), pero lo suficientemente estimuladas (déficit de rendimiento) en estas condiciones. Esta distinción es fundamental, como mecanismos para el rendimiento y los mecanismos de plasticidad puede responder de manera muy diferente a un determinado tratamiento farmacológico. Tratamos de minimizar el impacto de rendimiento reducido en la inducción de LTP por la normalización de la amplitud de la EPSP al mismo nivel (por ejemplo 1 mV) a través de todos los cortes antes de la estimulación LTP. Otras estrategias pueden ser eficaces también (por ejemplo el uso de la tensión o la pinza de corriente para igualar el potencial de membrana entre los grupos durante la estimulación LTP), y deben ser considerados en la investigación de LTP en estos modelos animales.
Divulgaciones
Agradecimientos
El trabajo apoyado por el NIH subvención AG027297, un premio de la médula espinal y la confianza Kentucky Head Injury Research, y un regalo de la Fundación Kleberg.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| NaCl | Pescador | BP358-1 | |
| KCl | Pescador | BP366-500 | |
| KH 2 PO 4 (monobásico) | Sigma | P5379-100G | |
| MgSO4 | Sigma | M2643-500G | |
| CaCl2 (dihidrato) | Sigma | C3306-250G | |
| NaHCO3 | Pescador | S233-500 | |
| C 6 H 12 O 6 (glucosa) | Pescador | BP350-1 |
Reactivos Tabla 1. Requeridas
| Nombre del equipo | Empresa | Número de catálogo | Comentarios |
| Erlenmeyer Frascos | Pescador | FB-500-2000 FB-500-1000 | |
| Acuario pelele | Se utiliza para oxigenar los medios de comunicación. Disponible en la mayoría de las tiendas de mascotas | ||
| 50 ml vaso de vidrio | Pescador | 02-540g | Para storarge cerebro en ACSF |
| Parafilm | Pescador | 13-374-10 | |
| Guillotina de Pequeños Animales | World Precision Instruments (IPM) | DCAP-M | |
| Una toalla de papel plana | |||
| # 11 pluma quirúrgica hoja | Pescador | 08 a 916-5B | |
| Bibi hueso tijeras | Herramientas de Bellas Ciencia (FST) | 16044-10 | |
| Lempert Pinzas | Roboz | RS-8,321 | Se utiliza para las ratas |
| Friedman-Pearson Pinzas | FST | 16020-14 | El uso de ratones o ratas |
| Hipocampo herramienta | FST | 10099-15 | |
| Cuchara | Una cucharilla de plástico va a hacer | ||
| Espátula | Pescador | 21-401-25A | Espátula |
| Quirúrgico tijeras iris | FST | 14058-09 | |
| pipetas de plástico de transferencia | Pescador | 13-711-43 | |
| 110 mm de papel de filtro Whatman | Pescador | 09-805E | Cat Whatman. 1001-110 |
| Vidrio una caja de petri | Pescador | ||
| Leica VT1000P Manual vibración micrótomo | Vibratome | ||
| 0,1 mm FA-10 Pluma S blade | Ted Pella | 121-9 | 0,1 mm FA-10 Pluma S blade |
| Pipeta Pasteur de vidrio de borosilicato (con perilla de goma) | Pescador | 13 a 678-20A | Para la transferencia de sectores: Consejo se interrumpe y el calor pulido para mayor apertura |
| 35 mm plato Cultura Polysterine | Corning | 430588 | Se utiliza para recoger trozos después de la disección |
Tabla 2. Herramientas y materiales para la disección
| Equipos / Materiales | Empresa | Comentarios (opcional) |
| Cámara de retención | Hecha a la medida | |
| P-97 Extractor horizontal con una pipeta | Sutter Instrument Co. | |
| Vibraciones mesa aislamiento | Técnica Manufacturing Corporation (TMC) | |
| Jaula de Faraday | Hecha a la medida | |
| Pyrex Aspirador Botella con brazo lateral inferior (Product # 1220-1L) | Corning | |
| Gravedad controló conjunto con el regulador IV (Producto # 2C8891) | Baxter | |
| Línea de aspiración central | Disponible en la mayoría de los modernos laboratorios | |
| 95% O 2 / 5% CO 2 mezcla de gases | Escocést-bruto Co. | |
| TygonTM Laboratorio de tubos De O 2 / CO 2 de entrega | Fisher Scientific | No es tóxico, no oxidante, viene en una variedad de tamaños. |
| Eclipse E600FN microscopio | Nikon | con los objetivos de 10x y 40x, cerca de infrarrojo de filtro, y las buenas prácticas agrarias, DS-Rojo2 filtros |
| Ajustar Cool ES la cámara digital | Fotometría | Ajustar Cool ES la cámara digital |
| X-Cite iluminador fluorescente | EXFO | X-Cite iluminador fluorescente |
| Microscopio Plataforma | Siskiyou | Costumbre montado |
| RC-22 sumergibles grabación de la cámara (Producto # 64-0228) | Warner Instruments (WI) | Requiere P-1 adaptador de la plataforma y el escenario (Producto # 64-0277 de Warner) |
| TC2BIP 2/3Ch controlador de temperatura | Microcontrols celular | TC2BIP 2/3Ch controlador de temperatura |
| 4 Manual del Eje en miniatura manipulador | Siskiyou | |
| De alambre de platino iridio (0,002 in) (Artículo # PTT0203) | WPI | |
| A365 estímulo aislador | WPI | A365 estímulo aislador |
| MultiClamp amplificador 700b | Axon Instruments | |
| Digidata 1322A convertidor A / D | Axon Instruments | |
| PCLAMP software | Axon Instruments | |
| Ordenador personal (Pentium 4) | Dell |
Tabla 3. Electrofisiología equipos y materiales
Referencias
- Norris, C. M., Halpain, S., Foster, T. C. Alterations in the balance of protein kinase/phosphatase activities parallel reduced synaptic strength during aging. J Neurophysiol. 80, 1567-1570 (1998).
- Norris, C. M., Korol, D. L., Foster, T. C. Increased susceptibility to induction of long-term depression and long-term potentiation reversal during aging. J Neurosci. 16, 5382-5392 (1996).
- Norris, C. M. Hippocampal 'zipper' slice studies reveal a necessary role for calcineurin in the increased activity of L-type Ca(2+) channels with aging. Neurobiol Aging. 31, 328-338 (2010).
- Burke, S. N., Barnes, C. A. Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161 (2010).
- Foster, T. C. Calcium homeostasis and modulation of synaptic plasticity in the aged brain. Aging Cell. 6, 319-325 (2007).
- Foster, T. C., Norris, C. M. Age-associated changes in Ca(2+)-dependent processes: relation to hippocampal synaptic plasticity. Hippocampus. 7, 602-612 (1997).
- Thibault, O., Gant, J. C., Landfield, P. W. Expansion of the calcium hypothesis of brain aging and Alzheimer's disease: minding the store. Aging Cell. 6, 307-317 (2007).
- Demuro, A., Parker, I., Stutzmann, G. E. Calcium signaling and amyloid toxicity in Alzheimer disease. J Biol Chem. 285, 12463-12468 (2010).
- Green, K. N., LaFerla, F. M. Linking calcium to Abeta and Alzheimer's disease. Neuron. 59, 190-194 (2008).
- Kumar, A., Thinschmidt, J. S., Foster, T. C., King, M. A. Aging effects on the limits and stability of long-term synaptic potentiation and depression in rat hippocampal area CA1. J Neurophysiol. 98, 594-601 (2007).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of age-related alterations in synaptic plasticity by blockade of L-type Ca2+ channels. J Neurosci. 18, 3171-3179 (1998).
- Norris, C. M., Scheff, S. W. Recovery of afferent function and synaptic strength in hippocampal CA1 following traumatic brain injury. J Neurotrauma. 26, 2269-2278 (2009).
- Sama, M. A. Interleukin-1beta-dependent signaling between astrocytes and neurons depends critically on astrocytic calcineurin/NFAT activity. J Biol Chem. 283, 21953-21964 (2008).
- Ye, H., Jalini, S., Mylvaganam, S., Carlen, P. Activation of large-conductance Ca(2+)-activated K(+) channels depresses basal synaptic transmission in the hippocampal CA1 area in APP (swe/ind) TgCRND8 mice. Neurobiol Aging. 31, 591-604 (2010).
- Bear, M. F., Malenka, R. C. Synaptic plasticity: LTP and LTD. Curr Opin Neurobiol. 4, 389-399 (1994).
- Foster, T. C. Involvement of hippocampal synaptic plasticity in age-related memory decline. Brain Res Brain Res Rev. 30, 236-249 (1999).
- Foster, T. C., Kumar, A. Susceptibility to induction of long-term depression is associated with impaired memory in aged Fischer 344 rats. Neurobiol Learn Mem. 87, 522-535 (2007).
- Hsu, K. S. Alterations in the balance of protein kinase and phosphatase activities and age-related impairments of synaptic transmission and long-term potentiation. Hippocampus. 12, 787-802 (2002).
- Vouimba, R. M., Foy, M. R., Foy, J. G., Thompson, R. F. 17beta-estradiol suppresses expression of long-term depression in aged rats. Brain Res Bull. 53, 783-787 (2000).
- Abdul, H. M., Furman, J. L., Sama, M. A., Mathis, D. M., Norris, C. M. NFATs and Alzheimer's Disease. Mol Cell Pharmacol. 2, 7-14 (2010).
- Abdul, H. M. Cognitive decline in Alzheimer's disease is associated with selective changes in calcineurin/NFAT signaling. J Neurosci. 29, 12957-12969 (2009).
- Anantharaman, M. Beta-amyloid mediated nitration of manganese superoxide dismutase: implication for oxidative stress in a APPNLH/NLH X PS-1P264L/P264L double knock-in mouse model of Alzheimer's disease. Am J Pathol. 168, 1608-1618 (2006).
- Gengler, S., Hamilton, A., Holscher, C. Synaptic plasticity in the hippocampus of a APP/PS1 mouse model of Alzheimer's disease is impaired in old but not young mice. PLoS One. 5, e9764-e9764 (2010).
- Stringer, J. L., Lothman, E. W. In vitro effects of extracellular calcium concentrations on hippocampal pyramidal cell responses. Exp Neurol. 101, 132-146 (1988).
- Landfield, P. W., Pitler, T. A., Applegate, M. D. The effects of high Mg2+-to-Ca2+ ratios on frequency potentiation in hippocampal slices of young and aged rats. J Neurophysiol. 56, 797-811 (1986).
- Ames, A. 3rd, Sakanoue, M., Endo, S. NA, K, CA, MG, AND C1 CONCENTRATIONS IN CHOROID PLEXUS FLUID AND CISTERNAL FLUID COMPARED WITH PLASMA ULTRAFILTRATE. J Neurophysiol. 27, 672-681 (1964).
- Gant, J. C., Sama, M. M., Landfield, P. W., Thibault, O. Early and simultaneous emergence of multiple hippocampal biomarkers of aging is mediated by Ca2+-induced Ca2+ release. J Neurosci. 26, 3482-3490 (2006).
- Thibault, O., Hadley, R., Landfield, P. W. Elevated postsynaptic [Ca2+]i and L-type calcium channel activity in aged hippocampal neurons: relationship to impaired synaptic plasticity. J Neurosci. 21, 9744-9756 (2001).
- Thibault, O., Landfield, P. W. Increase in single L-type calcium channels in hippocampal neurons during aging. Science. 272, 1017-1020 (1996).
- Stutzmann, G. E., Caccamo, A., LaFerla, F. M., Parker, I. Dysregulated IP3 signaling in cortical neurons of knock-in mice expressing an Alzheimer's-linked mutation in presenilin1 results in exaggerated Ca2+ signals and altered membrane excitability. J Neurosci. 24, 508-513 (2004).
- Stutzmann, G. E. Enhanced ryanodine receptor recruitment contributes to Ca2+ disruptions in young, adult, and aged Alzheimer's disease mice. J Neurosci. 26, 5180-5189 (2006).
- Lee, H. K., Min, S. S., Gallagher, M., Kirkwood, A. NMDA receptor-independent long-term depression correlates with successful aging in rats. Nat Neurosci. 8, 1657-1659 (2005).
- McNaughton, B. L., Douglas, R. M., Goddard, G. V. Synaptic enhancement in fascia dentata: cooperativity among coactive afferents. Brain Res. 157, 277-293 (1978).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados