Method Article
다양한 훈련 접근법을 위한 수영 유도 제브라피시 운동 기구
요약
불우한 물고기를 위해 설계된 운동 기구는 유변 축성을 통해 달성할 수 있는 물의 흐름 속도를 조작하여 다양한 강도의 다양한 운동 프로토콜의 구현을 용이하게 합니다.
초록
운동이 건강과 질병에 미치는 영향을 종합적으로 조사하기 위해서는 동물 모델이 중추적인 역할을 합니다. 널리 활용되는 척추동물 모델 유기체인 제브라피쉬는 이러한 연구를 위한 독특한 플랫폼을 제공합니다. 이 연구는 쉽게 구할 수 있는 재료를 활용하여 제브라피시 운동 연구에 맞춤화된 비용 효율적인 장치 개발을 소개했습니다. 이 장치는 수영 터널의 원리에 기반을 두고 있으며 수중 펌프에 연결된 파이프 및 밸브 네트워크를 포함합니다. 물의 흐름은 센서에 의해 꼼꼼하게 모니터링되고 밸브를 통해 조절됩니다. 기구의 효과를 평가하기 위해 중간 강도 연속 훈련(MICT)과 고강도 인터벌 훈련(HIIT)의 두 가지 훈련 프로토콜이 구현되었습니다. 물고기는 집단적으로 훈련을 받았고, 지구력 테스트를 통해 수영 성능을 평가했습니다. 두 훈련 프로토콜 모두 30일간의 훈련 후 수영 수행 능력의 개선으로 이어졌으며 앉아서 생활하는 대조군에 비해 운동에 대한 분자 반응의 변화를 유도했습니다. 특히 HIIT는 MICT보다 우수한 효율성을 보여주었습니다. 제브라피시 훈련 시스템은 운동 생리학 연구에 유용한 도구임이 입증되었으며 이 분야에서 제브라피시 모델의 유용성을 더욱 발전시켰습니다.
서문
신체 운동은 에너지 소비를 증가시키는 골격근에 의해 수행되는 모든 신체 움직임을 포함하며, 운동은 신체 활동의 구조적이고 반복적인 하위 집합입니다1. 운동은 몸 전체를 포함하는 다요인적이고 비용 효율적인 활동으로, 대사 증후군과 근감소증 예방과 같은 수많은 건강상의 이점을 제공한다2. 결과적으로, 운동생리학 분야는 운동의 급성 스트레스, 신체 훈련의 만성 스트레스, 운동이 건강에 미치는 전반적인 영향에 신체가 어떻게 적응하는지 밝히는 데 큰 관심을 가지고 있습니다1.
인간을 대상으로 운동 생리학 연구를 수행하는 것은 실험 설계 및 참가자 모니터링의 문제로 인해 비용과 시간이 많이 소요될 수 있습니다3. 따라서 유전적 및 생리적 균일성으로 인해 실험실 환경에서 동물 모델을 사용하는 것이 적극 권장됩니다. 더욱이, 통제된 실험실 조건 하에서, 동물들은 전형적으로 주로 앉아서 생활하고 음식 섭취를 조절한다4. 동물 모델 중에서, 설치류는 신체 운동과 관련된 연구에서 가장 널리 사용되어 왔다1. 그러나 제브라피시(Danio rerio; Hamilton, 1822)는 운동 연구를 위한 쥐 및 다른 종에 대한 보완 모델이다 5,6,7,8.
제브라피시 연구에서 신체 운동은 상업적으로 이용 가능하거나 맞춤형 수영 터널을 사용하여 수행할 수 있습니다. 상업적으로 이용 가능한 옵션 중 Loligo System에서 개발 한 Blazka 형 터널이 가장 자주 사용되는 7,9,10입니다. 이 시스템은 전기 모터에 연결된 프로펠러를 통해 강제 수영을 유도하여 터널 내에서 연속적인 물 흐름을 생성합니다. 이 수영 능력은 유변 주성(rheotaxis)의 원리에 뿌리를 두고 있는데, 이는 물고기가 물의 흐름을 거슬러 헤엄치고 위치를 유지하도록 유도하는 타고난 행동입니다11. Rheotaxis를 사용하면 물고기가 특정 시간 동안 유지할 수 있는 최대 속도를 나타내는 임계 수영 속도(Ucrit)를 측정할 수 있습니다. 그러나 이 장비는 수영 행동과 산소 소비량을 평가하는 데 유용하지만 상당한 비용이 든다는 점은 주목할 가치가 있습니다12.
연구자들은 제브라피시를 운동시키기 위한 대체 기구를 개발했는데, 이는 종종 블라즈카(Blazka) 유형의 메커니즘(10,13,14) 또는 더 간단한 메커니즘(8,15,16)에 기초한다. 그럼에도 불구하고 이러한 방법은 연장된 기간, 상당한 장비 비용, 처리량 및 정밀도의 제한을 포함하여 프로토콜의 기술적 요구 사항에 의해 제한될 수 있습니다. 결과적으로, 이 연구의 주요 목적은 쉽게 구할 수 있는 재료를 사용하여 저렴하고 사용자 친화적인 제브라피시 운동 시스템을 설계하여 물고기의 신체 운동을 위한 새로운 대체 장치를 제공하는 것이었습니다. 두 번째 목표는 제브라피시에서 유산소 및 무산소 운동 요법을 모두 구현하여 운동 연구의 중재 전략으로 제브라피시 모델의 활용을 더욱 발전시키는 것이었습니다.
프로토콜
이 절차는 상파울루 연방 대학의 동물 사용 윤리 위원회(CEUA/UNIFESP 번호 9206260521)로부터 사전 승인을 받았습니다. 이 연구에는 생후 6개월, 체중 2.5-3g의 성체 암컷 야생형 Danio rerio만 사용되었습니다. 연구에 필요한 장비 및 시약은 재료 표에 나열되어 있습니다.
1. 맞춤형 제브라피시 운동기구
알림: 운동 기구는 맞춤 제작되었습니다. 자세한 내용은 그림 1, 보충 표 1, 보충 파일 1 및 보충 파일 2를 참조하십시오.
- 물탱크(O)(≥30L) 안에 수중 펌프(N)를 넣습니다. 물이 pH 7.2 ± 0.5 및 400 ± 50 μS, 28 ± 1 °C의 조건을 충족하는지 확인하십시오.
- 보충표 1 및 그림 1을 참조하여 파이프(I)를 티파이프(B)를 가리키도록 연결하고, B측에 작은 파이프(G)를 부착한다. G에서 글로브 밸브 (F), 다른 G, 파이프 엘보 (A) 및 I에 차례로 연결하여 시스템 내 수압 조절을 담당하는 세그먼트를 완성합니다. 이 조절은 물 탱크(O)로의 복귀 흐름을 통해 달성됩니다.
- B의 대체 섹션에서 파이프(J)에 연결한 다음 A와 G에 연결합니다. 소켓 파이프 피팅(D)을 사용하여 게이트 워터 밸브(E)를 G에 연결합니다.
- 한쪽 끝에서 B를 G에 연결하고 반대쪽 끝에 다른 G를 연결하여 물고기 진입 포트를 시스템에 통합합니다. 그런 다음 소켓 파이프 피팅(C)을 이 두 번째 G에 연결하여 수영 동작을 시각화하는 데 중요한 아크릴 파이프(K)에 연결되는 시퀀스를 설정합니다.
- K를 수류 센서(M)에 연결하려면 파이프 C, G, D를 활용하고 D를 사용하여 M을 G로 연결한 다음 A, G, H를 적분하여 물이 저수지로 쉽게 돌아갈 수 있도록 합니다.
알림: 게이트와 글로브 밸브(F2) 사이의 짧은 파이프 부분에 모기 방충망을 삽입하여 물고기가 장치의 다른 부분에 접근하는 것을 방지합니다. 글로브 밸브(F)는 두 가지 용도로 사용됩니다. 첫 번째 글로브 밸브 (F1)는 시스템의 압력 제어 밸브 역할을하는 장치의 나머지 부분으로 들어가기 전에 저장소로 돌아가는 물의 흐름을 제어합니다. 글로브 밸브(F2)는 시스템 내 제브라피시의 진입 및 출구 지점입니다.
- K를 수류 센서(M)에 연결하려면 파이프 C, G, D를 활용하고 D를 사용하여 M을 G로 연결한 다음 A, G, H를 적분하여 물이 저수지로 쉽게 돌아갈 수 있도록 합니다.
- 아크릴 파이프의 하류에 물 흐름 센서를 부착합니다.
알림: 유량 센서는 LCD 디스플레이에 연결하고 Arduino를 사용하여 프로그래밍해야 합니다(그림 1). Arduino 설정에 대한 자세한 내용은 보충 파일 2에 나와 있습니다.
2. 장치 작동
- 물고기를 시스템에 안전하게 도입하려면 물의 흐름을 차단하는 것이 필수적입니다. 이를 위해 글로브 밸브(F1)를 열어 둔 상태에서 게이트 밸브(E)를 닫으십시오. 그런 다음 시스템의 입구 역할을 하는 글로브 밸브(F2)를 열고 물고기를 부드럽게 소개한 다음 F2 밸브를 즉시 닫습니다. 마지막으로 E 밸브를 열어 운동 공간을 물로 채웁니다.
- 글로브 밸브를 사용하여 흐름 속도를 제어하고 필요할 때 물을 저장소로 다시 전환합니다.
- 게이트 밸브(F2)를 사용하여 정확한 유량 조정과 물고기 접근을 관리합니다.
- 테스트가 끝날 때 물고기를 제거하려면 배기 기준을 준수한 후 밸브(E)를 닫으십시오. 그런 다음 밸브 F를 열고 아크릴 튜브의 축을 기준으로 180° 회전합니다. 이것은 지친 물고기를 운반하는 물의 배수를 용이하게 할 것입니다.
- 유량 모니터링을 수행합니다.
알림: Arduino Nano, 16 x 2 LCD 화면, 10kΩ, 0.25W 스루홀 저항기 및 10kΩ 전위차계가 통합된 시스템을 통해 물의 흐름 속도를 모니터링해야 합니다. 유량 센서는 홀 효과 기술17을 기반으로 물의 흐름 속도를 지속적으로 모니터링합니다. 각 전류 펄스는 센서 플로퍼의 1회전에 해당하며, 그 결과 주파수(Hz)는 6.6 x Q(L/min 단위의 유속)가 됩니다.- 유량 센서의 해당 전선을 Arduino Nano의 5V, GND 및 D2 핀에 연결합니다(보충 표 1). Arduino IDE를 사용하여 제공된 스케치(보충 파일 1)를 Arduino에 로드합니다. Arduino USB 포트를 통해 시스템에 전원을 공급합니다.
알림: 유량 측정은 16 x 2 LCD 화면에 표시됩니다. 물 흐름 센서의 보정은 그림 2에 나와 있습니다. LCD에 대한 Arduino 연결의 회로도는 그림 3에 나와 있습니다.
- 유량 센서의 해당 전선을 Arduino Nano의 5V, GND 및 D2 핀에 연결합니다(보충 표 1). Arduino IDE를 사용하여 제공된 스케치(보충 파일 1)를 Arduino에 로드합니다. Arduino USB 포트를 통해 시스템에 전원을 공급합니다.
3. 내구성 테스트
알림: 이 단계는 제브라피쉬의 최대 수영 속도(Umax)를 결정하기 위한 내구성 테스트 절차를 간략하게 설명합니다.
- 먼저 물고기가 2주 동안 수영 터널 내부의 낮은 수속(0.06m/s)에 하루 60분 동안 적응하도록 합니다.
참고: 24시간의 사전 컨디셔닝 기간이 끝나면 개별 제브라피쉬는 지속적인 수영 성능 테스트를 받게 됩니다. 이 테스트의 목적은 각 물고기의 Umax를 설정하는 것입니다. - 제브라피시를 장치에 개별적으로 놓습니다.
- 테스트 조건: 10분 동안 초기 속도 0.06m/s의 물 흐름에 대해 물고기를 배치합니다.
- 속도 증가: 40-50분 동안 분당 0.02m/s의 속도 증가로 개별 단계로 물 흐름을 증가시킵니다.
- Umax 결정: 물고기가 탈진 기준을 충족할 때 최대 수영 속도(Umax)를 조정합니다.
알림: 탈진은 다음 상황 중 첫 번째 상황이 관찰될 때 정의됩니다: (1) 세 번 이상 물의 흐름에 대해 위치를 유지할 수 없거나 (2) 5초 이상 위치를 유지할 수 없음. - 배기 기준을 준수한 후 밸브(E)를 닫습니다. 그런 다음 밸브 F를 열고 아크릴 튜브의 축을 기준으로 180° 회전합니다. 이것은 물의 배수를 용이하게하여 지친 물고기를 운반합니다.
4. 운동 그룹 및 절차
참고: 뚜렷한 운동 프로토콜을 설정하려면 고강도 운동을 하지 않더라도 운동 프로토콜의 효과를 비교하기 위해 동일한 실험 조건에 노출된 앉아있는 그룹을 포함하는 것이 필수적입니다. Umax 값의 분율이 운동 프로토콜의 강도를 결정하는 데 필요하기 때문에 Umax를 설정하는 것도 중요합니다.
- 앉아있는 (SED) 그룹: 물고기를 60분 동안 0.06m/s의 물 흐름에 맞서 강제로 수영하도록 합니다.
알림: 이 장치는 연속적인 물 흐름을 생성하여 rheotaxis11의 원리에 따라 물고기가 이 흐름에 맞서 수영하도록 합니다. - 중간 강도 연속 훈련(MICT) 그룹: 최대 용량 테스트에서 결정된 대로 Umax의 60%에서 35분 동안 물고기를 물 흐름에 맞서 강제로 수영하도록 합니다.
참고: 이 프로토콜은 Húngaro et al.18에서 채택되었습니다. 처음 10분 동안 물고기는 앉아있는 그룹과 동일한 속도(0.05m/s)에 적응했습니다. - 고강도 인터벌 트레이닝(HIIT) 그룹: 물고기에게 Umax의 90%에서 2분, Umax의 30%에서 2분을 번갈아 가며 강제로 수영하도록 합니다. 이 프로토콜은 Marcinko et al.19에서 채택되었습니다.
알림: 운동 시간의 처음 10분 동안은 물고기가 앉아있는 그룹과 동일한 속도(0.06m/s)로 적응해야 합니다. - 4주 동안 일주일에 5일 동안 모든 운동 프로토콜을 시행합니다.
알림: 물고기는 적절한 조건을 제공하는 수족관에 수용해야 하며 지정된 운동 시간 동안에만 운동 기구에 넣어야 합니다. 물고기에게는 하루에 세 번 열대어 박편 먹이를 제공해야 하며, 유지 관리 수족관의 물은 2일에 한 번씩 부분적으로 교체해야 합니다. - 매주 말에 내구성 테스트를 반복하고, 피로 지점의 지연 시간 및 속도 데이터를 신체 컨디셔닝 매개변수의 지표로 사용합니다.
- 과도한 훈련 효과를 유도하려면 각 4일 훈련 주기 후에 수행된 지구력 테스트 결과에 따라 매주 물 흐름 속도를 높이십시오. 훈련 시간은 이동 거리(속도 × 시간)를 고려하여 조정해야 하며, 이러한 지속 시간은 운동한 그룹 간에 일관되게 유지되어야 합니다.
- 증가된 물의 흐름에 대응하여 수영 시간을 조정하여 운동한 그룹 전체의 훈련 부하를 표준화합니다.
5. 신체 측정
- 신체 측정(체중 및 크기)을 수행하기 위해 침지로 0.0075% 트리카인(w/v)으로 물고기를 마취합니다20.
- ImageJ 소프트웨어를 사용하여 물고기의 몸 치수를 결정하기 위해 사진을 찍고 무게를 잰다.
- 신체 상태 지수(체중 [g]/표준 길이 [mm]2; BMI) 및 신체 상태 점수(BCS)20.
- 알 형성으로 인한 크기 및 무게 변화를 제거하려면 물고기를 표준 번식20 한 다음 측정 및 무게를 측정합니다.
결과
운동 기구는 유속을 조절하는 데 놀라운 효율성을 보여주었습니다. 수영 속도를 점진적으로 향상시키기 위해 0.06m/s의 일정한 유속으로 유지된 SED 그룹을 제외한 모든 그룹에 대해 물의 흐름을 매주 점진적으로 증가시켰습니다. 특히, 이 장치는 0.001m/s의 미세한 유속 조정을 달성하여 놀라운 수준의 정밀도를 허용했습니다. 그러나 오류율은 0.06m/s와 같은 저속에서 30%였습니다. 0.3m/s 및 0.5m/s와 같은 고속에서 오류율은 3%-4%였습니다(그림 2). 훈련 중 도달한 최대 속도는 SED에서 0.4m/s, MICT에서 0.44m/s, 마지막 지구력에서 HIIT 그룹에서 0.49m/s였습니다.
제브라피시의 신체적 성능은 내구성 테스트에서 Umax를 사용하여 매주 평가되었습니다. 그 결과, MICT와 HIIT를 투여받은 제브라피시의 신체 능력이 SED 그룹에 비해 크게 향상된 것으로 나타났습니다(그림 4). MICT와 HIIT는 모두 훈련 중 이동한 동일한 거리에 제출되었습니다. 그러나 HIIT 그룹은 단 2주 만에 Umax가 유의하게 증가하는 등 빠른 개선을 유도했습니다(p =0.0003). 훈련 기간 동안 HIIT 그룹은 매주 10%의 지속적인 개선을 보였으며 그 결과 약 30%의 전반적인 향상을 보였습니다. 대조적으로, MICT 훈련은 훈련 3주에만 Umax의 눈에 띄는 ~10% 증가를 기록한 후 다음 주에는 추가 개선이 없는 등 보다 점진적인 증가를 보였습니다(p =0.0024). 이러한 결과는 HIIT 및 MICT 훈련 프로토콜이 제브라피시의 신체 능력에 미치는 차별적인 효과를 강조합니다.

그림 1: 장치 설계. (A) 수영 장치의 개략도. 파란색 화살표는 물의 흐름 방향을 나타냅니다. 관련 파이프 길이가 표시되어 있습니다. 문자는 보충 표 1에 설명된 각 장치 구성 요소를 나타냅니다. (B) 장치의 사진. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
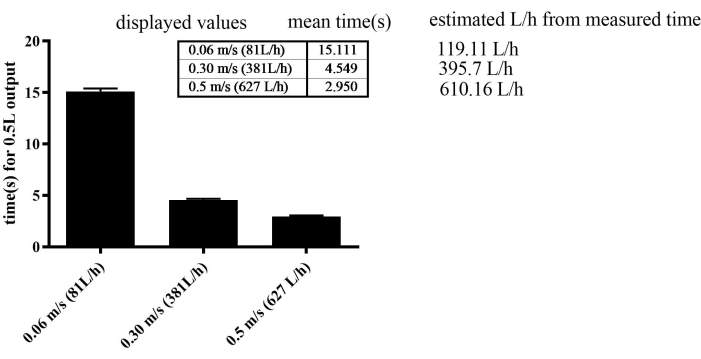
그림 2: 0.5L 유량에 필요한 시간을 측정하여 물 흐름 센서를 보정합니다. SEM은 0.06m/s에서 0.277, 0.3m/s에서 0.123, 0.5m/s 그룹에서 0.109였습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
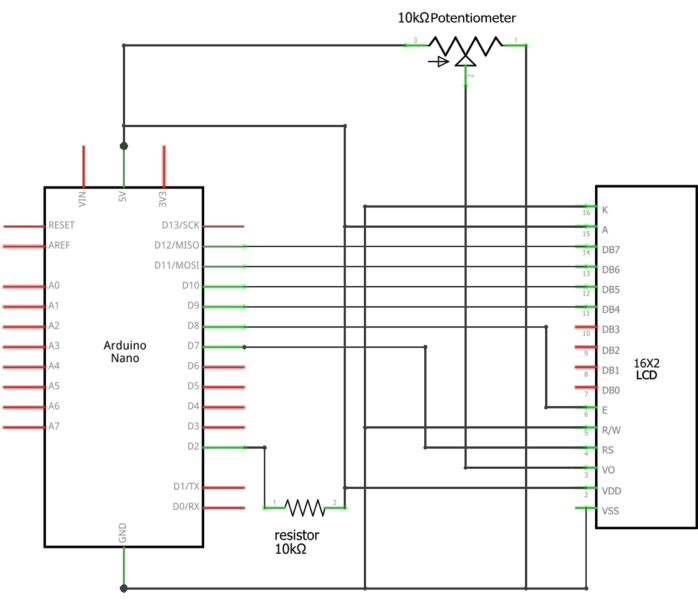
그림 3: LCD에 대한 Arduino 연결의 개략도. 센서의 적절한 전선은 Arduino의 D2 핀과 10kΩ 저항(신호선), Arduino의 접지(검은색 선) 및 Arduino의 5V(빨간색 선) 사이에 연결하거나 납땜해야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 최대 수영 속도(Umax)로 표현된 수영 성능. a, b, c는 각 그룹 내의 주간 수영 능력 추정치 간의 통계적 차이를 나타냅니다. *그룹 간의 차이를 나타내며 양방향 분산 분석(Tukey posthoc)을 사용하여 비교합니다. *p = 0.01; **p = 0.001; p = 0.0001입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 형태학적 측정. (A) 신체 상태 지표 (체중 [g] / 표준 길이 [mm]2; BMI)를 선택합니다. (B) 신체 측정의 대표 이미지. (C) 신체 상태 점수(BCS). 오차 막대는 BMI의 경우 0.026에서 0.045 사이, BCS의 경우 0.4에서 0.96 사이의 범위에 해당합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 제브라피시 운동 기구에 대한 재료 및 조립 가이드. 테이블에는 그림에 표시된 조립 순서와 일치하는 문자가 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 유속을 측정하기 위해 주석이 달린 Arduino 스케치. 각 코드 줄에 대한 주석은 이중 슬래시 뒤에 통합됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
추가 파일 2: 설정 세부 정보를 포함한 Arduino 파일. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 연구에서는 제브라피시 수영 성능을 종합적으로 검사하기 위해 Loligo Systems21 의 수영 터널 호흡계와 수로 시스템22 에서 영감을 받아 혁신적이고 비용 효율적인 운동 시스템을 개발했습니다. Umax는 물고기가 탈진에 도달 할 때까지 짧은 간격 (20-30 분)에 걸쳐 속도 증가와 함께 불연속적인 단계로 물의 흐름을 체계적으로 증가시켜 결정되었으며, 이는 3 회 연속 피로 또는 수영 터널의 조류를 극복 할 수 없음을 특징으로합니다. 이러한 결정은 두 가지 운동 프로토콜(MICT 및 HIIT)을 설계하는 데 중요한 역할을 했습니다. 상대적으로 장시간 동안(1시간에서 몇 시간까지)을 포함하는 프로토콜과 달리, 고갈 시 물의 흐름 속도는 임계 수영 속도(Ucri)12로 알려져 있습니다. 운동 시스템을 사용하여 계산된 Umax 값은 다른 연구7에서 관찰된 범위 내에 있었으며, 이는 제브라피시의 신체 성능을 평가하기 위한 이 터널 수영 장치의 효능을 확인시켜 주었다. 또한, 이 소형 장치는 물 흐름 속도의 전체 스펙트럼을 포괄할 수 있는 다양성을 가지고 있어 적용된 교육 프로토콜의 사용자 정의를 용이하게 합니다.
이 장치 개발에서는 물의 흐름 속도만 제어하여 다양한 운동 프로토콜을 만들 수 있습니다. 물의 유속을 정확하게 측정하는 것은 저속에서 문제가 발생하여 약 30%의 오류율이 발생했습니다. 그럼에도 불구하고 정밀도는 중속 및 고속에서 향상되어 Umax에 가까워졌으며 보다 안정적인 속도 측정과 3%-4%의 오류율 감소로 나타났습니다. 결과적으로, 저속에서 장치 정밀도의 한계가 확인되었습니다. 이러한 한계에도 불구하고, 이 연구는 0.02m/s의 속도 변화에도 불구하고 훈련 중 SED 그룹의 신체 능력에 큰 영향을 미치지 않는다는 것을 발견했습니다. 이는 저강도 훈련의 변화가 적어도 이 연구에서 제시된 모델에서는 신체 능력에 큰 영향을 미치지 않을 수 있음을 시사합니다. 제안된 장치의 또 다른 한계는 산소 센서가 없어 산소 소비량을 측정할 수 없다는 것입니다.
이전 연구에서는 성인 수컷과 암컷 제브라피시 사이의 수영 속도에 현저한 차이가 있음을 보여주었으며, 제안된 원인에는 gravid 암컷의 둘레 증가와 같은 형태학적 차이와 gravid fish의 근력 출력 감소와 같은 생리학적 차이가 포함됩니다 5,23,24. 이 조사는 암컷 제브라피시에게만 훈련 요법을 적용했으며, 이 암컷이 훈련 전, 훈련 중, 훈련 후 세 번의 번식 주기를 겪었으며 일관되게 신체 측정에 앞서 이루어졌다는 것을 인정했습니다. 이 전략적 접근법은 성별 간 신체 차이를 효과적으로 완화했습니다. 더욱이, 이 연구는 훈련 그룹 간의 신체 매개변수(그림 5) 또는 여성의 훈련 전후 조건을 비교할 때 눈에 띄는 차이를 발견하지 못했습니다. 개체 간의 연령 차이에 대한 통제는 없었지만, 수영 수행 능력과 운동 에너지 요구량이 존재 발생, 번식 및 노화로 인해 생애 주기 전반에 걸쳐 현저하게 변동할 수 있다는 것은 잘 문서화되어 있습니다 25,26,27. 각 그룹 내의 잠재적인 연령 차이에도 불구하고 모든 동물은 크기, 체중 및 일관된 성적으로 성숙한 성인 단계에 따라 세심하게 그룹화되었습니다. 주목할 만한 점은, 운동 요법을 시작하기 전에 그룹들 간에 통계적으로 유의미한 차이가 관찰되지 않았다는 점이다. 결과적으로, 수영 능력에서 관찰 된 향상은 전적으로 채택 된 운동 프로토콜에 자신있게 기인 할 수 있다고 가정되었습니다.
이 연구는 두 가지 별개의 운동 프로토콜을 구현하여 운동 시스템의 효과를 평가하는 것을 목표로 했습니다. MICT는 지속적이고 지속적인 운동 요법을 포함하지만, HIIT는 최대 강도의 짧은 운동과 짧고 덜 격렬한 회복 기간을 포함합니다. 두 프로토콜 모두 피로를 유발하지 않고 훈련 기간 동안 동일한 훈련 부하를 제공하도록 세심하게 조정되었습니다. SED 그룹은 다른 운동 그룹과 마찬가지로 4주 동안 일주일에 한 번씩 동일한 지구력 테스트를 받았지만 최소한의 성능 향상을 보였습니다. 지구력 훈련은 심박출량, 최대 산소 소비량 및 미토콘드리아 생체 발생을 향상시키는 것으로 인정받고 있습니다28; 그러나 주간 운동 빈도는 수영 능력에 유의미한 변화를 이끌어내기에는 불충분한 것으로 판명되었습니다. 제브라피시가 MICT 훈련을 받았을 때, 훈련 3주차 후에 수영 성능이 눈에 띄게 향상되는 것이 관찰되었습니다. 그러나 그 다음 주에도 더 이상의 개선은 없었습니다. MICT는 개인이 장기간 동안 최대 이하의 작업량을 유지하는 것을 포함하며, 평균보다 높은 전력 출력(22)을 필요로 한다. 가장 주목할 만한 것은 HIIT 그룹이 가장 실질적인 개선을 보였는데, 단 2주간의 훈련 후 4주째까지 지속된 후 상당한 성능 향상이 눈에 띄었습니다. 짧고 고강도의 운동이 지구력 적응으로 이어진다는 것은 잘 알려져 있지만, 표현형 근육 변화를 유발하는 특정 운동 유형은 여전히 진행 중인 연구 주제로 남아 있다28.
공개
이 원고에 제시된 연구와 관련하여 경쟁하는 재정적 이익이 없다는 것을 명확히 하는 것이 중요합니다. 이 작업의 결과에 잠재적으로 영향을 미치거나 편향될 수 있는 조직 또는 단체와의 재정적 파트너십 또는 제휴가 확립되지 않았습니다. 이 진술은 연구 과정이 간단하고 정직했으며 결과에 영향을 미치는 재정적 갈등이 없었다는 보증의 역할을 합니다. 이 작품의 발표는 학문에 대한 사랑과 과학적 지식의 추구에 의해 주도되는 주제에 대한 진정한 열정에 의해 동기가 부여됩니다.
감사의 말
오마르 메르틴스(Omar Mertins) 박사에게 물고기 관리 및 테스트 실행을 위해 실험실에 대한 접근을 아낌없이 제공한 것에 대해 감사를 표합니다. 또한 이 연구를 지원하기 위해 펠로우십을 수여한 FAPESP, CNPq 및 CAPES에 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| CPVC Female 90-Degree Elbow for Plumbing | Tigre | 22150260 | 3/4-inch |
| 24AWG Wire | Sky Cablo Store | Connection between components in the Perforated Circuit Board (1m) | |
| Acrylic pipe | The Clear Plastic Shop | 41138408 | 3/4-inch |
| Aquarium Submersible Fish Tank | Aqua Tank | 300w | |
| CPVC Pipe | Tigre | 10121787 | 3/4-inch |
| Female Threaded Gate Water Valve | Tigre | 27950310 | 3/4-inch |
| Female Threaded Globe Water Valve | Tigre | 27940510 | 3/4-inch |
| hrough-hole resistor | BXV | 10 kΩ, 0.25W t | |
| Lab Support Stand With Clamp with 30 inch rod | Masiye Labs | RSC0001 | Support the horizontal pipes |
| LCD screen | Eichip | 16 x 2, model JHD162A | |
| Male x Male Dupont Jumpers | Chyan | Connection between arduino and flow sensor (30 cm) | |
| Perforated Circuit Board single sided | KY WIN ROBOT | 5 x 10 cm | |
| Potentiometer | LUSYA | DL-ALPSA01 | 10kΩ |
| Roll of Water Blocking Tape | One World | 5603131000 | To avoid leaks |
| Silicone hose | Tigre | 14211250 | 2 cm inner |
| Solder Station | QHTITEC | EU/US PLUG | Arduine system welding |
| Solder Wire Spool | BEEYIHF | I001-A001-Set | Arduine system welding |
| Threaded Male Socket and Unthreaded Female Socket CPVC Pipe Fitting | TIgre | 35447849 | 3/4-inch |
| Tricaine (MS-222) | Sigma-Aldrich | E10521 | Anesthetic |
| UNO-R3 board UNO R3 CH340G+MEGA328P Chip 16Mhz | FSXSEMI | For Arduino UNO R3 Development board | |
| Unthreaded CPVC Tee Pipe Fitting, Female | Tigre | 22200267 | 3/4-inch |
| Unthreaded Female CPVC Socket Pipe Fitting | Tigre | 22170260 | 3/4-inch |
| Water Flow Sensor model YF-B5 | Siqma Robotics | SQ8659 | 1-25 L/min |
| Water Pump | Sunsun | Model HJ-2041, 3000L/h, 65W | |
| Water reservoir | Custom | 30 L |
참고문헌
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflugers Arch Eur. J Physiol. 466 (9), 1673-1687 (2014).
- Nylén, E. S., Gandhi, S. M., Lakshman, R. Cardiorespiratory fitness, physical activity, and metabolic syndrome. Cardiorespiratory Fitness in Cardiometabolic Diseases: Prev. & Manag. in Clin. Pract. , Springer. 207-215 (2019).
- Cholewa, J., et al. Basic models modeling resistance training: an update for basic scientists interested in study skeletal muscle hypertrophy. J Cell Physiol. 229 (9), 1148-1156 (2014).
- Martin, B., Ji, S., Maudsley, S., Mattson, M. P. 34;Control" laboratory rodents are metabolically morbid: Why it matters. Proc Natl Acad Sci USA. 107 (14), 6127-6133 (2010).
- Palstra, A. P., et al. Swimming-induced exercise promotes hypertrophy and vascularization of fast skeletal muscle fibres and activation of myogenic and angiogenic transcriptional programs in adult zebrafish. BMC Genomics. 15 (1), 1-20 (2014).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50, 106-113 (2014).
- Usui, T., et al. The French press: A repeatable and high-throughput approach to exercising zebrafish (Danio rerio). Peer J. 2018 (1), 1-12 (2018).
- Tierney, K. B. Swimming performance assessment in fishes. J. Vis. Exp. (51), e2572(2011).
- Palstra, A. P., et al. Establishing zebrafish as a novel exercise model: Swimming economy, swimming-enhanced growth and muscle growth marker gene expression. PLoS One. 5 (12), e0014483(2010).
- Arnold, G. P. Rheotropism in fishes. Biol Rev Camb Philos Soc. 49 (4), 515-576 (1974).
- Messerli, M., et al. Adaptation mechanism of the adult zebrafish respiratory organ to endurance training. PLoS One. 15 (2), 1-20 (2020).
- Bek, J. W., De Clercq, A., Coucke, P. J., Willaert, A. The ZE-tunnel: An affordable, easy-to-assemble, and user-friendly benchtop zebrafish swim tunnel. Zebrafish. 18 (1), 29-41 (2021).
- Lucon-Xiccato, T., et al. An automated low-cost swim tunnel for measuring swimming performance in fish. Zebrafish. 18 (3), 231-234 (2021).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Depasquale, C., Leri, J. The influence of exercise on anxiety-like behavior in zebrafish (Danio rerio). Behav Processes. 157, 638-644 (2018).
- Karsenty, A. A comprehensive review of integrated hall effects in macro-, micro-, nanoscales, and quantum devices. Sensors. 20 (15), Basel, Switzerland. 4163(2020).
- Húngaro, T. G. R., et al. Physical exercise exacerbates acute kidney injury induced by LPS via toll-like receptor 4. Front Physiol. 11, 1-13 (2020).
- Marcinko, K., et al. High intensity interval training improves liver and adipose tissue insulin sensitivity. Mol Metab. 4 (12), 903-915 (2015).
- Chen, W., Ge, W. Gonad differentiation and puberty onset in the zebrafish: Evidence for the dependence of puberty onset on body growth but not age in females. Mol Reprod Develop. 80 (5), 384-392 (2013).
- Conradsen, C., Walker, J. A., Perna, C., McGuigan, K. Repeatability of locomotor performance and morphology-locomotor performance relationships. J Exp Biol. 219 (18), 2888-2897 (2016).
- Widrick, J. J., et al. An open source microcontroller based flume for evaluating swimming performance of larval, juvenile, and adult zebrafish. PLoS ONE. 13 (6), 1-14 (2018).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50 (1), 106-113 (2013).
- Hammer, C. Fatigue and exercise tests with fish. Exp Gerontol. 112 (1), 1-20 (1995).
- Takahiro Hasumura, S. M. Exercise quantity-dependent muscle hypertrophy in adult zebrafish (Danio rerio). J Comp Physiol B. 186, 603-614 (2016).
- Wang, L., et al. Effect of aerobic exercise as a treatment on type 2 diabetes mellitus with depression-like behavior zebrafish. Life Sciences. 300, 120578(2022).
- Conradsen, C., McGuigan, K. Sexually dimorphic morphology and swimming performance relationships in wild-type zebrafish Danio rerio. J Fish Bio. 87 (5), 1219-1233 (2015).
- Hughes, D. C., Ellefsen, S., Baar, K. Adaptations to endurance and strength training. Cold Spring Harb Perspect Med. 8 (6), 1-18 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유