Method Article
Un attrezzo per esercizi di zebrafish indotto dal nuoto per approcci di allenamento versatili
In questo articolo
Riepilogo
L'attrezzo per esercizi progettato per i pesci meno fortunati facilita l'implementazione di diversi protocolli di esercizio con intensità variabili manipolando la velocità del flusso d'acqua, ottenibile attraverso la reotassi.
Abstract
Per studiare in modo completo gli effetti dell'esercizio fisico sulla salute e sulla malattia, i modelli animali svolgono un ruolo fondamentale. Il pesce zebra, un organismo modello di vertebrato ampiamente utilizzato, offre una piattaforma unica per tali studi. Questo studio ha introdotto lo sviluppo di un apparato economico su misura per gli studi di esercizio del pesce zebra utilizzando materiali prontamente disponibili. Il dispositivo si basa sui principi di un tunnel natatorio e comprende una rete di tubi e valvole collegati a una pompa sommersa. Il flusso d'acqua è meticolosamente monitorato da un sensore e regolato tramite valvole. Per valutare l'efficacia dell'attrezzo, sono stati implementati due protocolli di allenamento: l'allenamento continuo a intensità moderata (MICT) e l'allenamento a intervalli ad alta intensità (HIIT). I pesci sono stati addestrati collettivamente e le loro prestazioni di nuoto sono state valutate attraverso un test di resistenza. Entrambi i protocolli di allenamento hanno portato a miglioramenti delle prestazioni di nuoto dopo 30 giorni di allenamento e hanno indotto alterazioni nella risposta molecolare all'esercizio rispetto a un gruppo di controllo sedentario. In particolare, l'HIIT ha dimostrato un'efficienza superiore rispetto al MICT. Il sistema di addestramento del pesce zebra si è rivelato uno strumento prezioso per le indagini sulla fisiologia dell'esercizio e fa progredire ulteriormente l'utilità del modello del pesce zebra in questo campo.
Introduzione
L'esercizio fisico comprende qualsiasi movimento corporeo eseguito dai muscoli scheletrici che provoca un aumento del dispendio energetico, con l'esercizio che è un sottoinsieme strutturato e ripetitivo delle attività fisiche1. L'esercizio fisico, un'attività multifattoriale ed economica che coinvolge tutto l'organismo, apporta numerosi benefici per la salute, come la prevenzione della sindrome metabolica e della sarcopenia2. Di conseguenza, il campo della fisiologia dell'esercizio ha un interesse significativo in quanto cerca di chiarire come il corpo si adatta allo stress acuto dell'esercizio, allo stress cronico dell'allenamento fisico e all'impatto complessivo dell'esercizio sulla salute1.
Condurre studi di fisiologia dell'esercizio nell'uomo può essere costoso e dispendioso in termini di tempo a causa delle sfide nella progettazione sperimentale e nel monitoraggio dei partecipanti3. Pertanto, l'uso di modelli animali in ambito di laboratorio è stato altamente raccomandato a causa della loro uniformità genetica e fisiologica. Inoltre, in condizioni di laboratorio controllate, gli animali hanno tipicamente uno stile di vita sedentario e un'assunzione di cibo regolata4. Tra i modelli animali, i roditori sono stati i più utilizzati nella ricerca che coinvolge l'esercizio fisico1. Tuttavia, il pesce zebra (Danio rerio; Hamilton, 1822) è un modello complementare alle specie murine e ad altre specie per gli studi sull'eserciziofisico 5,6,7,8.
Nella ricerca sul pesce zebra, l'esercizio fisico può essere condotto utilizzando tunnel natatori disponibili in commercio o costruiti su misura. Tra le opzioni disponibili in commercio, il tunnel di tipo Blazka, sviluppato da Loligo System, è il 7,9,10 più utilizzato. Questo sistema induce il nuoto forzato attraverso un'elica accoppiata ad un motore elettrico, generando un flusso d'acqua continuo all'interno del tunnel. Questa capacità di nuoto è radicata nel principio della reotassi, un comportamento innato nei pesci che li spinge a nuotare contro le correnti d'acqua e a mantenere la loro posizione11. La reotassi consente la misurazione della velocità critica di nuoto (Ucrit), che rappresenta la velocità massima che un pesce può sostenere per una durata specifica. Tuttavia, vale la pena notare che questa attrezzatura, sebbene preziosa per valutare il comportamento di nuoto e il consumo di ossigeno, ha un costo significativo12.
I ricercatori hanno sviluppato un apparato alternativo per l'esercizio del pesce zebra, spesso basato sul meccanismo di tipo Blazka10,13,14 o su meccanismi più semplici 8,15,16. Tuttavia, questi metodi possono essere limitati dalle esigenze tecniche del protocollo, tra cui durate prolungate, spese sostanziali per le apparecchiature e limitazioni in termini di produttività e precisione. Di conseguenza, l'obiettivo principale dello studio era quello di progettare un sistema di esercizio per pesci zebra economico e facile da usare utilizzando materiali prontamente disponibili, fornendo un nuovo apparato alternativo per l'esercizio fisico nei pesci. Un obiettivo secondario era quello di implementare regimi di esercizio aerobico e anaerobico in zebrafish, facendo avanzare ulteriormente l'utilizzo del modello zebrafish come strategia di intervento nella ricerca sull'esercizio.
Protocollo
Le procedure hanno ricevuto l'approvazione preventiva del Comitato Etico per l'Uso degli Animali dell'Università Federale di San Paolo (CEUA/UNIFESP n. 9206260521). In questo studio sono state impiegate solo femmine adulte di Danio rerio wild-type, di età pari a 6 mesi e del peso di 2,5-3 g. L'attrezzatura e i reagenti necessari per lo studio sono elencati nella tabella dei materiali.
1. Attrezzo per esercizi Zebrafish su misura
NOTA: L'attrezzo per esercizi è stato costruito su misura. Per informazioni dettagliate, vedere Figura 1, Tabella supplementare 1, File supplementare 1 e File supplementare 2.
- Posizionare una pompa sommersa (N) all'interno di un serbatoio dell'acqua (O) (≥30 L). Assicurarsi che l'acqua soddisfi le seguenti condizioni: pH di 7,2 ± 0,5 e 400 ± 50 μS, 28 ± 1 °C.
- Flusso Tabella supplementare 1 e Figura 1, collegare il tubo (I) al punto Tee Pipe (B) e collegare un piccolo tubo (G) al lato di B. Da G, stabilire i collegamenti alla valvola a globo (F), quindi a un'altra G e in sequenza al gomito del tubo (A) e I, completando così il segmento responsabile della regolazione della pressione dell'acqua all'interno del sistema. Questa regolazione si ottiene attraverso un flusso di ritorno al serbatoio dell'acqua (O).
- Nella sezione alternata di B, collegarlo a un tubo (J), seguito dai collegamenti ad A e G. Utilizzare il raccordo per tubo a presa (D) per collegare la valvola dell'acqua a saracinesca (E) a G.
- Integrare una porta di ingresso per i pesci nel sistema collegando B a G a un'estremità e collegando un altro G all'estremità opposta. Successivamente, collegare il raccordo del tubo della presa (C) a questo secondo G, stabilendo una sequenza che si collega al tubo acrilico (K), che è fondamentale per visualizzare il comportamento del nuoto.
- Per collegare K al sensore di flusso dell'acqua (M), utilizzare i tubi C, G e D. Procedere con il collegamento da M a G utilizzando D, quindi integrare A, G e H per facilitare il ritorno dell'acqua al serbatoio.
NOTA: Inserire una zanzariera nel segmento corto del tubo tra la saracinesca e la valvola a globo (F2) per impedire ai pesci di accedere ad altre sezioni dell'apparecchio. La valvola a globo (F) ha un duplice scopo. La prima valvola a globo (F1) controlla il flusso d'acqua che ritorna al serbatoio prima di entrare nel resto dell'apparato, fungendo da valvola di controllo della pressione del sistema. La valvola a globo (F2) è un punto di ingresso e di uscita per il pesce zebra all'interno del sistema.
- Per collegare K al sensore di flusso dell'acqua (M), utilizzare i tubi C, G e D. Procedere con il collegamento da M a G utilizzando D, quindi integrare A, G e H per facilitare il ritorno dell'acqua al serbatoio.
- Collegare un sensore di flusso d'acqua a valle del tubo acrilico.
NOTA: Il sensore di flusso deve essere collegato a un display LCD e programmato utilizzando un Arduino (Figura 1). I dettagli della configurazione di Arduino sono forniti nel file supplementare 2.
2. Funzionamento dell'apparecchio
- Per introdurre in sicurezza i pesci nel sistema, è fondamentale interrompere il flusso dell'acqua. Per ottenere ciò, chiudere la valvola a saracinesca (E) mantenendo aperta la valvola a globo (F1). Successivamente, aprire la valvola a globo (F2), che funge da ingresso al sistema, introdurre delicatamente il pesce e chiudere prontamente la valvola F2. Infine, aprire la valvola E per riempire d'acqua l'area di esercizio.
- Utilizzare la valvola a globo per controllare la velocità del flusso, deviando l'acqua verso il serbatoio quando necessario.
- Utilizzare la valvola a saracinesca (F2) per una regolazione precisa del flusso e per gestire l'accesso dei pesci.
- Per rimuovere il pesce al termine della prova, chiudere la valvola (E) rispettando i criteri di esaurimento. Quindi, aprire la valvola F e ruotarla di 180° rispetto all'asse del tubo acrilico; Questo faciliterà il drenaggio dell'acqua portando con sé il pesce esausto.
- Eseguire il monitoraggio del flusso.
NOTA: È necessario monitorare la velocità del flusso d'acqua attraverso un sistema che incorpora un Arduino Nano, uno schermo LCD 16 x 2, una resistenza a foro passante da 10 kΩ, 0,25 W e un potenziometro da 10 kΩ. Il sensore di flusso monitora continuamente la velocità del flusso d'acqua basato sulla tecnologia ad effetto Hall17. Ogni impulso di corrente corrisponde a un giro del flopper del sensore, risultando in una frequenza (Hz) di 6,6 x Q (portata in L/min).- Collegare i fili appropriati del sensore di flusso ai pin 5 V, GND e D2 di Arduino Nano (Tabella supplementare 1). Caricare lo schizzo fornito (file supplementare 1) in Arduino utilizzando l'IDE di Arduino. Alimenta il sistema tramite la porta USB di Arduino.
NOTA: Le misurazioni della portata vengono visualizzate sullo schermo LCD 16 x 2. La calibrazione del sensore di flusso d'acqua è illustrata nella Figura 2. Gli schemi dei collegamenti di Arduino all'LCD sono illustrati nella Figura 3.
- Collegare i fili appropriati del sensore di flusso ai pin 5 V, GND e D2 di Arduino Nano (Tabella supplementare 1). Caricare lo schizzo fornito (file supplementare 1) in Arduino utilizzando l'IDE di Arduino. Alimenta il sistema tramite la porta USB di Arduino.
3. Test di resistenza
NOTA: Questo passaggio descrive la procedura per il test di resistenza per determinare la velocità massima di nuoto (Umax) del pesce zebra.
- Per prima cosa, lasciare che i pesci si adattino per 60 minuti al giorno a una bassa velocità del flusso d'acqua (0,06 m/s) all'interno del tunnel di nuoto per due settimane.
NOTA: Dopo un periodo di precondizionamento di 24 ore, i singoli pesci zebra saranno sottoposti al test delle prestazioni di nuoto sostenuto. Lo scopo di questo test è quello di stabilire l'Umax di ogni pesce. - Posizionare il pesce zebra singolarmente nell'apparecchiatura.
- Condizioni di prova: Posizionare il pesce contro un flusso d'acqua con una velocità iniziale di 0,06 m/s per 10 minuti.
- Incrementi di velocità: Aumentare il flusso d'acqua in fasi discrete, con incrementi di velocità di 0,02 m/s che si verificano ogni minuto per 40-50 minuti.
- Determinazione Umax: Recpod la velocità massima di nuoto (Umax) quando i pesci soddisfano i criteri di esaurimento.
NOTA: L'esaurimento è definito quando si osserva la prima delle seguenti situazioni: (1) Incapacità di mantenere la posizione contro il flusso d'acqua per più di tre volte, o (2) Incapacità di mantenere la posizione per più di 5 s. - Chiudere la valvola (E) dopo aver rispettato i criteri di esaurimento. Quindi, aprire la valvola F e ruotarla di 180° rispetto all'asse del tubo acrilico. Questo faciliterà il drenaggio dell'acqua, trasportando il pesce esausto.
4. Gruppi di esercizi e procedura
NOTA: Per stabilire protocolli di esercizio distinti, è essenziale includere un gruppo sedentario esposto a condizioni sperimentali identiche per confrontare gli effetti dei protocolli di esercizio, anche se senza sottoporsi a esercizio ad alta intensità. È inoltre essenziale stabilire l'Umax perché le frazioni del valore Umax sono necessarie per determinare l'intensità dei protocolli di esercizio.
- Gruppo sedentario (SED): Sottoporre il pesce a nuoto forzato contro il flusso d'acqua a 0,06 m/s per 60 minuti.
NOTA: L'apparecchio genera un flusso d'acqua continuo, costringendo i pesci a nuotare contro questa corrente in base al principio della reotassi11. - Gruppo di allenamento continuo a intensità moderata (MICT): sottoporre il pesce a nuoto forzato contro il flusso d'acqua al 60% di Umax, come determinato nel test di capacità massima, per 35 minuti.
NOTA: Questo protocollo è stato adattato da Húngaro et al.18. Durante i primi 10 minuti, il pesce è stato acclimatato alla stessa velocità del gruppo sedentario (0,05 m/s). - Gruppo HIIT (High-Intensity Interval Training): Sottoporre il pesce a nuoto forzato alternando le velocità di nuoto: 2 minuti al 90% di Umax seguiti da 2 minuti al 30% di Umax, ripetuti per 18 minuti (9 cicli). Questo protocollo è stato adattato da Marcinko et al.19.
NOTA: Durante i primi 10 minuti del periodo di esercizio, è necessario acclimatare il pesce alla stessa velocità del gruppo sedentario (0,06 m/s). - Implementa tutti i protocolli di allenamento per 5 giorni alla settimana per un periodo di quattro settimane.
NOTA: I pesci devono essere alloggiati in acquari che offrono condizioni adeguate e devono essere introdotti nell'attrezzo per esercizi solo durante i periodi di esercizio designati. I pesci dovrebbero essere forniti di cibo tropicale in fiocchi tre volte al giorno e l'acqua negli acquari di manutenzione dovrebbe subire un cambio parziale ogni 2 giorni. - Ripetere il test di resistenza alla fine di ogni settimana, con i dati di latenza e velocità nel punto di affaticamento come indicatori dei parametri di condizionamento fisico.
- Per indurre gli effetti del sovrallenamento, aumentare settimanalmente la velocità del flusso d'acqua in base ai risultati del test di resistenza condotto dopo ogni ciclo di allenamento di 4 giorni. La durata dell'allenamento deve essere regolata per tenere conto della distanza percorsa (velocità × tempo) e queste durate devono rimanere coerenti tra i gruppi allenati.
- Regola il tempo di nuoto in risposta all'aumento del flusso d'acqua, standardizzando così il carico di allenamento tra i gruppi allenati.
5. Misure del corpo
- Anestetizzare il pesce con tricaina (p/v) allo 0,0075% per immersione per effettuare misurazioni del corpo (peso e dimensioni)20.
- Fotografa e pesa i pesci per determinare le dimensioni del corpo utilizzando il software ImageJ.
- Esprimere i dati in termini di indici di condizione corporea (peso [g]/lunghezza standard [mm]2; BMI) e punteggio della condizione corporea (BCS)20.
- Per eliminare le variazioni di dimensioni e peso causate dalla formazione delle uova, sottoporre il pesce alla riproduzione standard20, seguita da misurazioni e pesatura.
Risultati
L'apparecchio per esercizi ha dimostrato una notevole efficienza nella regolazione della velocità del flusso. Per migliorare gradualmente la velocità di nuoto, il flusso d'acqua è stato aumentato settimanalmente in modo incrementale per tutti i gruppi, ad eccezione del gruppo SED, che è stato mantenuto a una velocità di flusso costante di 0,06 m/s. In particolare, l'apparato ha consentito un notevole livello di precisione, raggiungendo regolazioni della velocità del flusso fino a 0,001 m/s. Tuttavia, il tasso di errore era del 30% a basse velocità, come 0,06 m/s. A velocità elevate, come 0,3 m/s e 0,5 m/s, il tasso di errore era del 3%-4% (Figura 2). La velocità massima raggiunta durante l'allenamento è stata di 0,4 m/s nel SED, 0,44 m/s nel MICT e 0,49 m/s nei gruppi HIIT nell'ultima resistenza.
Le prestazioni fisiche del pesce zebra sono state valutate settimanalmente utilizzando Umax nel test di resistenza. I risultati hanno rivelato miglioramenti significativi nelle prestazioni fisiche per il pesce zebra sottoposto a MICT e HIIT rispetto al gruppo SED (Figura 4). Sia il MICT che l'HIIT sono stati sottoposti alla stessa distanza percorsa durante l'allenamento; tuttavia, il gruppo HIIT ha indotto rapidi miglioramenti, con un aumento significativo dell'Umax osservato dopo sole due settimane (p = 0,0003). Durante il periodo di allenamento, il gruppo HIIT ha dimostrato un costante miglioramento settimanale del 10%, con un miglioramento complessivo di circa il 30%. Al contrario, l'allenamento MICT ha portato a guadagni più graduali, con un notevole aumento del ~10% dell'Umax registrato solo nella terza settimana di allenamento, seguito da nessun ulteriore miglioramento nella settimana successiva (p = 0,0024). Questi risultati evidenziano gli effetti differenziali dei protocolli di allenamento HIIT e MICT sulle prestazioni fisiche del pesce zebra.

Figura 1: Progettazione dell'apparato. (A) Schemi dell'apparecchio per il nuoto. Le frecce blu indicano la direzione del flusso d'acqua. Vengono rappresentate le lunghezze dei tubi corrispondenti. Le lettere rappresentano ciascun componente dell'apparecchio descritto nella Tabella supplementare 1. (B) Fotografia dell'apparecchio. Clicca qui per visualizzare una versione più grande di questa figura.
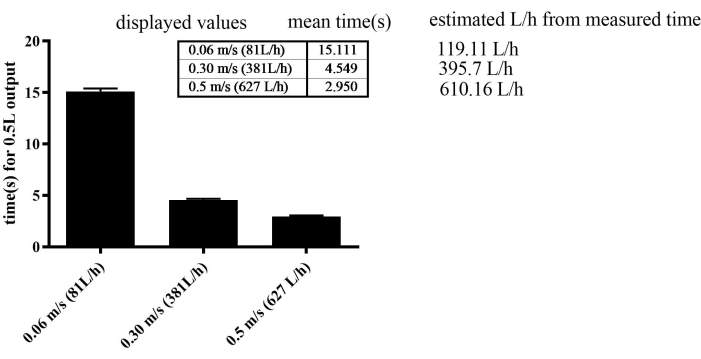
Figura 2: Taratura del sensore di flusso d'acqua misurando il tempo necessario per una portata di 0,5 L. Il SEM era 0,277 nei gruppi 0,06 m/s, 0,123 nei gruppi 0,3 m/s e 0,109 nei gruppi 0,5 m/s. Clicca qui per visualizzare una versione più grande di questa figura.
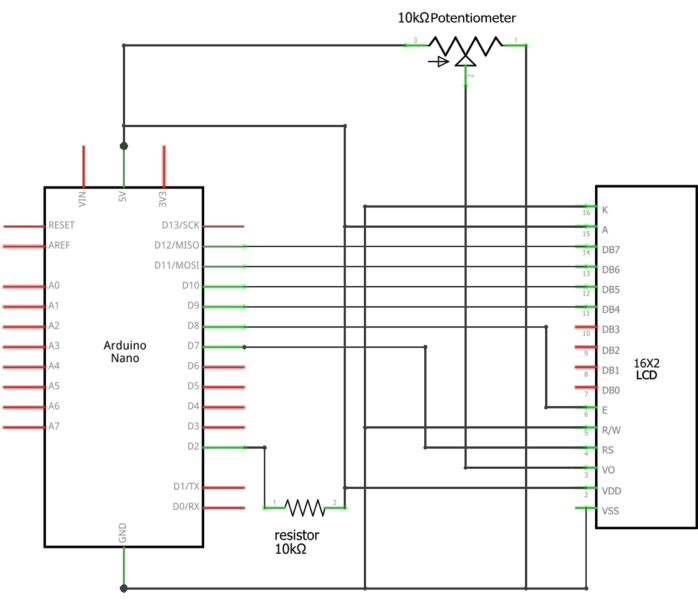
Figura 3: Schemi delle connessioni di Arduino all'LCD. I fili appropriati del sensore devono essere collegati o saldati tra il pin D2 di Arduino e la resistenza da 10 kΩ (cavo di segnale), la massa di Arduino (filo nero) e 5 V di Arduino (filo rosso). Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Le prestazioni di nuoto espresse in velocità massima di nuoto (Umax). a, b e c indicano le differenze statistiche tra le stime settimanali della capacità di nuoto all'interno di ciascun gruppo. *Indica la differenza tra i gruppi, confronto utilizzando l'analisi bidirezionale della varianza (Tukey posthoc). *p = 0,01; **p = 0,001; p = 0,0001. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Misurazioni morfologiche. (A) Indici di condizione corporea (peso [g] / lunghezza standard [mm]2; BMI). (B) Immagine rappresentativa della misurazione corporea. (C) Punteggio della condizione corporea (BCS). La barra di errore corrisponde a un intervallo compreso tra 0,026 e 0,045 per l'IMC e tra 0,4 e 0,96 per il BCS. Clicca qui per visualizzare una versione più grande di questa figura.
Tabella supplementare 1: Materiali e guida al montaggio dell'attrezzo per esercizi zebrafish. La tabella presenta lettere che si allineano con l'ordine di assemblaggio illustrato nella figura. Clicca qui per scaricare questo file.
File supplementare 1: Schizzo Arduino annotato per misurare la velocità dell'acqua. I commenti per ogni riga di codice vengono incorporati dopo le doppie barre. Clicca qui per scaricare questo file.
File supplementare 2: file Arduino, inclusi i dettagli di configurazione. Clicca qui per scaricare questo file.
Discussione
In questo studio, è stato sviluppato un sistema di esercizi innovativo ed economico ispirato al respirometro a tunnel natatorio di Loligo Systems21 e al sistema di canali22 per l'esame completo delle prestazioni di nuoto del pesce zebra. L'Umax è stato determinato aumentando sistematicamente il flusso d'acqua in fasi discrete, con incrementi di velocità che si verificano a brevi intervalli (20-30 minuti) fino a quando il pesce raggiunge l'esaurimento, che è stato caratterizzato da tre affaticamenti consecutivi o dall'incapacità di superare la corrente nel tunnel di nuoto. Queste determinazioni sono state determinanti nella progettazione di due protocolli di esercizio (MICT e HIIT). A differenza dei protocolli che prevedono durate di tappa relativamente prolungate (da una a diverse ore), la velocità del flusso d'acqua all'esaurimento è nota come velocità critica di nuoto (Ucri)12. I valori di Umax calcolati utilizzando il sistema di esercizi rientrano nell'intervallo osservato in altri studi7, confermando l'efficacia di questo apparecchio per il nuoto a tunnel per la valutazione delle prestazioni fisiche del pesce zebra. Inoltre, questo apparecchio compatto possiede la versatilità necessaria per coprire l'intero spettro delle velocità del flusso d'acqua, facilitando la personalizzazione dei protocolli di allenamento applicati.
Nello sviluppo di questo apparato, è possibile creare diversi protocolli di esercizio controllando solo la velocità del flusso d'acqua. La misurazione accurata della velocità del flusso d'acqua ha posto sfide a basse velocità, con un tasso di errore di circa il 30%. Ciononostante, la precisione è migliorata alle velocità intermedie e alte, avvicinandosi a Umax, con una misurazione della velocità più affidabile e un tasso di errore ridotto del 3%-4%. Di conseguenza, è stata identificata una limitazione nella precisione del dispositivo a basse velocità. Nonostante questa limitazione, lo studio ha rilevato che anche con una variazione di velocità di 0,02 m/s, non è stato osservato alcun impatto significativo sulla capacità fisica del gruppo SED durante l'allenamento. Ciò suggerisce che le variazioni nell'allenamento a bassa intensità potrebbero non esercitare effetti significativi sulla capacità fisica, almeno nel modello presentato in questo studio. Un'altra limitazione dell'apparato proposto è l'assenza di un sensore di ossigeno, che rende impossibile misurare il consumo di ossigeno.
Studi precedenti hanno dimostrato una notevole disparità nella velocità di nuoto tra maschi adulti e femmine di pesce zebra, con attribuzioni suggerite che includono distinzioni morfologiche, come l'aumento della circonferenza delle femmine gravide, e differenze fisiologiche, come la ridotta potenza muscolare nei pesci gravidi 5,23,24. Questa indagine ha sottoposto esclusivamente le femmine di zebrafish al regime di addestramento, riconoscendo che queste femmine sono state sottoposte a tre cicli riproduttivi prima, durante e dopo l'addestramento, precedendo costantemente le misurazioni corporee. Questo approccio strategico ha mitigato efficacemente le differenze corporee tra i sessi. Inoltre, questo studio non ha rivelato differenze percepibili nei parametri corporei tra i gruppi di allenamento (Figura 5) o quando si confrontano le condizioni pre e post allenamento nelle femmine. Sebbene non vi fosse alcun controllo per la variazione dell'età tra gli individui, è ben documentato che le prestazioni di nuoto e le richieste di energia di locomozione possono fluttuare notevolmente durante il ciclo di vita a causa dell'ontogenesi, della riproduzione e della senescenza 25,26,27. Nonostante le potenziali differenze di età all'interno di ciascun gruppo, tutti gli animali sono stati meticolosamente raggruppati in base alle dimensioni, al peso corporeo e a uno stadio adulto sessualmente maturo costante. In particolare, non sono state osservate differenze statisticamente significative tra i gruppi prima di iniziare il regime di esercizio. Di conseguenza, è stato postulato che l'aumento osservato nella capacità di nuoto può essere attribuito con sicurezza esclusivamente ai protocolli di esercizio impiegati.
Questo studio mirava a valutare l'efficacia del sistema di esercizi implementando due distinti protocolli di esercizio. Mentre il MICT prevede un regime di esercizio prolungato e continuo, l'HIIT incorpora brevi raffiche di esercizio alla massima intensità seguite da brevi periodi di recupero meno intensi. Entrambi i protocolli sono stati meticolosamente regolati per fornire carichi di allenamento equivalenti durante tutto il periodo di allenamento senza indurre esaurimento. Il gruppo SED è stato sottoposto allo stesso test di resistenza una volta alla settimana per quattro settimane, come gli altri gruppi di esercizi, ma ha mostrato un miglioramento minimo delle prestazioni. L'allenamento di resistenza è riconosciuto per migliorare la gittata cardiaca, il consumo massimo di ossigeno e la biogenesi mitocondriale28; Tuttavia, la frequenza settimanale dell'esercizio si è rivelata insufficiente per suscitare cambiamenti significativi nelle prestazioni di nuoto. Quando i pesci zebra sono stati sottoposti ad addestramento MICT, è stato osservato un notevole miglioramento delle prestazioni di nuoto dopo la terza settimana di allenamento. Tuttavia, non ci sono stati ulteriori miglioramenti nella settimana successiva. La MICT coinvolge individui che sostengono un carico di lavoro submassimale per periodi prolungati, richiedendo una potenza superiore alla media22. In particolare, il gruppo HIIT ha dimostrato il miglioramento più sostanziale, con un aumento significativo delle prestazioni evidente dopo sole due settimane di allenamento, sostenuto fino alla quarta settimana. Mentre è ben documentato che l'esercizio breve e ad alta intensità porta all'adattamento alla resistenza, il tipo di esercizio specifico responsabile dell'induzione di spostamenti muscolari fenotipici rimane un argomento di ricerca in corso28.
Divulgazioni
È essenziale chiarire che non vi sono interessi finanziari concorrenti associati alla ricerca presentata in questo manoscritto. Non sono state stabilite partnership finanziarie o affiliazioni con organizzazioni o entità che potrebbero potenzialmente influenzare o influenzare i risultati di questo lavoro. Questa affermazione serve a garantire che il processo di ricerca sia stato semplice e onesto, senza conflitti finanziari che hanno influenzato i risultati. La presentazione di questo lavoro è motivata da un'autentica passione per l'argomento, guidata esclusivamente dall'amore per il mondo accademico e dalla ricerca della conoscenza scientifica.
Riconoscimenti
La gratitudine va al Dr. Omar Mertins per aver generosamente fornito l'accesso al laboratorio per il mantenimento dei pesci e l'esecuzione dei test. Inoltre, vengono riconosciuti FAPESP, CNPq e CAPES per l'assegnazione di borse di studio a sostegno di questa ricerca.
Materiali
| Name | Company | Catalog Number | Comments |
| CPVC Female 90-Degree Elbow for Plumbing | Tigre | 22150260 | 3/4-inch |
| 24AWG Wire | Sky Cablo Store | Connection between components in the Perforated Circuit Board (1m) | |
| Acrylic pipe | The Clear Plastic Shop | 41138408 | 3/4-inch |
| Aquarium Submersible Fish Tank | Aqua Tank | 300w | |
| CPVC Pipe | Tigre | 10121787 | 3/4-inch |
| Female Threaded Gate Water Valve | Tigre | 27950310 | 3/4-inch |
| Female Threaded Globe Water Valve | Tigre | 27940510 | 3/4-inch |
| hrough-hole resistor | BXV | 10 kΩ, 0.25W t | |
| Lab Support Stand With Clamp with 30 inch rod | Masiye Labs | RSC0001 | Support the horizontal pipes |
| LCD screen | Eichip | 16 x 2, model JHD162A | |
| Male x Male Dupont Jumpers | Chyan | Connection between arduino and flow sensor (30 cm) | |
| Perforated Circuit Board single sided | KY WIN ROBOT | 5 x 10 cm | |
| Potentiometer | LUSYA | DL-ALPSA01 | 10kΩ |
| Roll of Water Blocking Tape | One World | 5603131000 | To avoid leaks |
| Silicone hose | Tigre | 14211250 | 2 cm inner |
| Solder Station | QHTITEC | EU/US PLUG | Arduine system welding |
| Solder Wire Spool | BEEYIHF | I001-A001-Set | Arduine system welding |
| Threaded Male Socket and Unthreaded Female Socket CPVC Pipe Fitting | TIgre | 35447849 | 3/4-inch |
| Tricaine (MS-222) | Sigma-Aldrich | E10521 | Anesthetic |
| UNO-R3 board UNO R3 CH340G+MEGA328P Chip 16Mhz | FSXSEMI | For Arduino UNO R3 Development board | |
| Unthreaded CPVC Tee Pipe Fitting, Female | Tigre | 22200267 | 3/4-inch |
| Unthreaded Female CPVC Socket Pipe Fitting | Tigre | 22170260 | 3/4-inch |
| Water Flow Sensor model YF-B5 | Siqma Robotics | SQ8659 | 1-25 L/min |
| Water Pump | Sunsun | Model HJ-2041, 3000L/h, 65W | |
| Water reservoir | Custom | 30 L |
Riferimenti
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflugers Arch Eur. J Physiol. 466 (9), 1673-1687 (2014).
- Nylén, E. S., Gandhi, S. M., Lakshman, R. Cardiorespiratory fitness, physical activity, and metabolic syndrome. Cardiorespiratory Fitness in Cardiometabolic Diseases: Prev. & Manag. in Clin. Pract. , Springer. 207-215 (2019).
- Cholewa, J., et al. Basic models modeling resistance training: an update for basic scientists interested in study skeletal muscle hypertrophy. J Cell Physiol. 229 (9), 1148-1156 (2014).
- Martin, B., Ji, S., Maudsley, S., Mattson, M. P. 34;Control" laboratory rodents are metabolically morbid: Why it matters. Proc Natl Acad Sci USA. 107 (14), 6127-6133 (2010).
- Palstra, A. P., et al. Swimming-induced exercise promotes hypertrophy and vascularization of fast skeletal muscle fibres and activation of myogenic and angiogenic transcriptional programs in adult zebrafish. BMC Genomics. 15 (1), 1-20 (2014).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50, 106-113 (2014).
- Usui, T., et al. The French press: A repeatable and high-throughput approach to exercising zebrafish (Danio rerio). Peer J. 2018 (1), 1-12 (2018).
- Tierney, K. B. Swimming performance assessment in fishes. J. Vis. Exp. (51), e2572(2011).
- Palstra, A. P., et al. Establishing zebrafish as a novel exercise model: Swimming economy, swimming-enhanced growth and muscle growth marker gene expression. PLoS One. 5 (12), e0014483(2010).
- Arnold, G. P. Rheotropism in fishes. Biol Rev Camb Philos Soc. 49 (4), 515-576 (1974).
- Messerli, M., et al. Adaptation mechanism of the adult zebrafish respiratory organ to endurance training. PLoS One. 15 (2), 1-20 (2020).
- Bek, J. W., De Clercq, A., Coucke, P. J., Willaert, A. The ZE-tunnel: An affordable, easy-to-assemble, and user-friendly benchtop zebrafish swim tunnel. Zebrafish. 18 (1), 29-41 (2021).
- Lucon-Xiccato, T., et al. An automated low-cost swim tunnel for measuring swimming performance in fish. Zebrafish. 18 (3), 231-234 (2021).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Depasquale, C., Leri, J. The influence of exercise on anxiety-like behavior in zebrafish (Danio rerio). Behav Processes. 157, 638-644 (2018).
- Karsenty, A. A comprehensive review of integrated hall effects in macro-, micro-, nanoscales, and quantum devices. Sensors. 20 (15), Basel, Switzerland. 4163(2020).
- Húngaro, T. G. R., et al. Physical exercise exacerbates acute kidney injury induced by LPS via toll-like receptor 4. Front Physiol. 11, 1-13 (2020).
- Marcinko, K., et al. High intensity interval training improves liver and adipose tissue insulin sensitivity. Mol Metab. 4 (12), 903-915 (2015).
- Chen, W., Ge, W. Gonad differentiation and puberty onset in the zebrafish: Evidence for the dependence of puberty onset on body growth but not age in females. Mol Reprod Develop. 80 (5), 384-392 (2013).
- Conradsen, C., Walker, J. A., Perna, C., McGuigan, K. Repeatability of locomotor performance and morphology-locomotor performance relationships. J Exp Biol. 219 (18), 2888-2897 (2016).
- Widrick, J. J., et al. An open source microcontroller based flume for evaluating swimming performance of larval, juvenile, and adult zebrafish. PLoS ONE. 13 (6), 1-14 (2018).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50 (1), 106-113 (2013).
- Hammer, C. Fatigue and exercise tests with fish. Exp Gerontol. 112 (1), 1-20 (1995).
- Takahiro Hasumura, S. M. Exercise quantity-dependent muscle hypertrophy in adult zebrafish (Danio rerio). J Comp Physiol B. 186, 603-614 (2016).
- Wang, L., et al. Effect of aerobic exercise as a treatment on type 2 diabetes mellitus with depression-like behavior zebrafish. Life Sciences. 300, 120578(2022).
- Conradsen, C., McGuigan, K. Sexually dimorphic morphology and swimming performance relationships in wild-type zebrafish Danio rerio. J Fish Bio. 87 (5), 1219-1233 (2015).
- Hughes, D. C., Ellefsen, S., Baar, K. Adaptations to endurance and strength training. Cold Spring Harb Perspect Med. 8 (6), 1-18 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon