Method Article
Un appareil d’exercice de poisson-zèbre induit par la natation pour des approches d’entraînement polyvalentes
Dans cet article
Résumé
L’appareil d’exercice conçu pour les poissons moins fortunés facilite la mise en œuvre de divers protocoles d’exercice d’intensités variables en manipulant la vitesse d’écoulement de l’eau, réalisable grâce à la rhéotaxie.
Résumé
Pour étudier de manière exhaustive les effets de l’exercice sur la santé et la maladie, les modèles animaux jouent un rôle central. Le poisson-zèbre, un organisme modèle de vertébré largement utilisé, offre une plate-forme unique pour de telles études. Cette étude a introduit le développement d’un appareil rentable adapté aux études d’exercice du poisson-zèbre en utilisant des matériaux facilement disponibles. Le dispositif est fondé sur les principes d’un tunnel de nage et englobe un réseau de tuyaux et de vannes reliés à une pompe submersible. Le débit d’eau est méticuleusement surveillé par un capteur et régulé par des vannes. Pour évaluer l’efficacité de l’appareil, deux protocoles d’entraînement ont été mis en place : l’entraînement continu d’intensité modérée (MICT) et l’entraînement par intervalles à haute intensité (HIIT). Les poissons ont été entraînés collectivement et leurs performances en natation ont été évaluées par un test d’endurance. Les deux protocoles d’entraînement ont entraîné une amélioration des performances de natation après 30 jours d’entraînement et ont induit des modifications de la réponse moléculaire à l’exercice par rapport à un groupe témoin sédentaire. Notamment, le HIIT a démontré une efficacité supérieure à celle du MICT. Le système d’entraînement du poisson-zèbre s’est avéré être un outil précieux pour les recherches en physiologie de l’exercice et renforce l’utilité du modèle du poisson-zèbre dans ce domaine.
Introduction
L’exercice physique englobe tout mouvement corporel effectué par les muscles squelettiques qui entraîne une augmentation de la dépense énergétique, l’exercice étant un sous-ensemble structuré et répétitif des activités physiques1. L’exercice, une activité multifactorielle et rentable impliquant l’ensemble du corps, apporte de nombreux avantages pour la santé, tels que la prévention du syndrome métabolique et de la sarcopénie2. Par conséquent, le domaine de la physiologie de l’exercice présente un intérêt considérable car il cherche à élucider comment le corps s’adapte au stress aigu de l’exercice, au stress chronique de l’entraînement physique et à l’impact global de l’exercice sur la santé1.
La réalisation d’études sur la physiologie de l’exercice chez l’homme peut être à la fois coûteuse et chronophage en raison des défis liés à la conception expérimentale et au suivi desparticipants3. Par conséquent, l’utilisation de modèles animaux en laboratoire a été fortement recommandée en raison de leur uniformité génétique et physiologique. De plus, dans des conditions de laboratoire contrôlées, les animaux ont généralement un mode de vie sédentaire et une consommation alimentaire réglementée4. Parmi les modèles animaux, les rongeurs ont été les plus largement utilisés dans la recherche impliquant l’exercice physique1. Cependant, le poisson-zèbre (Danio rerio ; Hamilton, 1822) est un modèle complémentaire aux souris et à d’autres espèces pour les études d’exercice 5,6,7,8.
Dans la recherche sur le poisson zèbre, l’exercice physique peut être effectué à l’aide de tunnels de nage disponibles dans le commerce ou fabriqués sur mesure. Parmi les options disponibles dans le commerce, le tunnel de type Blazka, développé par Loligo System, est le 7,9,10 le plus fréquemment utilisé. Ce système induit une nage forcée à travers une hélice couplée à un moteur électrique, générant un écoulement d’eau continu à l’intérieur du tunnel. Cette capacité de nage est enracinée dans le principe de la rhéotaxie, un comportement inné chez les poissons qui les pousse à nager contre les courants d’eau et à maintenir leur position11. La rhéotaxie permet de mesurer la vitesse critique de nage (Ucrit), représentant la vitesse maximale qu’un poisson peut maintenir pendant une durée spécifique. Cependant, il convient de noter que cet équipement, bien que précieux pour évaluer le comportement de nage et la consommation d’oxygène, a un coût important12.
Les chercheurs ont mis au point des appareils alternatifs pour exercer le poisson zèbre, souvent basés sur le mécanisme de type Blazka10,13,14 ou des mécanismes plus simples 8,15,16. Néanmoins, ces méthodes peuvent être limitées par les exigences techniques du protocole, notamment des durées prolongées, des dépenses d’équipement substantielles et des limites de débit et de précision. Par conséquent, l’objectif principal de l’étude était de concevoir un système d’exercice de poisson-zèbre abordable et convivial en utilisant des matériaux facilement disponibles, fournissant ainsi un nouvel appareil alternatif pour l’exercice physique chez les poissons. Un objectif secondaire était de mettre en œuvre des régimes d’exercice aérobique et anaérobie chez le poisson zèbre, faisant ainsi progresser l’utilisation du modèle du poisson zèbre comme stratégie d’intervention dans la recherche sur l’exercice.
Protocole
Les procédures ont reçu l’approbation préalable du Comité d’éthique de l’utilisation des animaux de l’Université fédérale de São Paulo (CEUA/UNIFESP n° 9206260521). Seules les femelles adultes de type sauvage Danio rerio, âgées de 6 mois et pesant de 2,5 à 3 g, ont été employées dans cette étude. L’équipement et les réactifs nécessaires à l’étude sont énumérés dans la table des matériaux.
1. Appareil d’exercice Zebrafish sur mesure
REMARQUE : L’appareil d’exercice a été construit sur mesure. Pour plus de détails, voir la figure 1, le tableau supplémentaire 1, le fichier supplémentaire 1 et le fichier supplémentaire 2.
- Placez une pompe submersible (N) à l’intérieur d’un réservoir d’eau (O) (≥30 L). Assurez-vous que l’eau répond aux conditions suivantes : pH de 7,2 ± 0,5 et 400 ± 50 μS, 28 ± 1 °C.
- Écoulement du tableau supplémentaire 1 et de la figure 1, connectez le tuyau (I) au tuyau en T pointé (B) et fixez un petit tuyau (G) sur le côté de B. À partir de G, établissez des raccordements au robinet à soupape (F), puis à un autre G, et dans l’ordre au coude de tuyau (A) et I, complétant ainsi le segment responsable de la régulation de la pression de l’eau dans le système. Cette régulation est réalisée par un retour vers le réservoir d’eau (O).
- Dans la section alternée de B, reliez-le à un tuyau (J), suivi des connexions à A et G. Utilisez le raccord de tuyau à emboîtement (D) pour connecter le robinet d’eau (E) à G.
- Intégrez un orifice d’entrée de poisson dans le système en connectant B à G à une extrémité et en attachant un autre G à l’extrémité opposée. Par la suite, connectez le Raccord de Tuyau à douille (C) à ce deuxième G, en établissant une séquence qui se connecte au Tuyau en acrylique (K), ce qui est crucial pour visualiser le comportement de nage.
- Pour relier K au capteur de débit d’eau (M), utilisez les tuyaux C, G et D. Connectez M à G à l’aide de D, puis intégrez A, G et H pour faciliter le retour de l’eau dans le réservoir.
REMARQUE : Insérez une moustiquaire dans le segment de tuyau court entre l’opercule et le robinet à soupape (F2) pour empêcher les poissons d’accéder à d’autres sections de l’appareil. Le robinet à soupape (F) a une double fonction. Le premier robinet à soupape (F1) contrôle le débit d’eau qui retourne dans le réservoir avant d’entrer dans le reste de l’appareil, agissant comme une soupape de régulation de la pression du système. Le robinet à soupape (F2) est un point d’entrée et de sortie pour le poisson-zèbre dans le système.
- Pour relier K au capteur de débit d’eau (M), utilisez les tuyaux C, G et D. Connectez M à G à l’aide de D, puis intégrez A, G et H pour faciliter le retour de l’eau dans le réservoir.
- Fixez un capteur de débit d’eau en aval du tuyau en acrylique.
REMARQUE : le capteur de débit doit être connecté à un écran LCD et programmé à l’aide d’un Arduino (Figure 1). Les détails de la configuration d’Arduino sont fournis dans le fichier supplémentaire 2.
2. Fonctionnement de l’appareil
- Pour introduire en toute sécurité les poissons dans le système, il est essentiel d’interrompre l’écoulement de l’eau. Pour ce faire, fermez le robinet-vanne (E) tout en gardant le robinet à soupape (F1) ouvert. Ensuite, ouvrez le robinet à soupape (F2), qui sert d’entrée au système, introduisez doucement le poisson et fermez rapidement le robinet F2. Enfin, ouvrez la valve E pour remplir la zone d’exercice avec de l’eau.
- Utilisez le robinet à soupape pour contrôler la vitesse d’écoulement, en détournant l’eau vers le réservoir si nécessaire.
- Utilisez le robinet-vanne (F2) pour un réglage précis du débit et pour gérer l’accès des poissons.
- Pour retirer le poisson à la fin de l’essai, fermez la soupape (E) après avoir observé les critères d’épuisement. Ensuite, ouvrez la valve F et faites-la pivoter de 180° par rapport à l’axe du tube acrylique ; Cela facilitera le drainage de l’eau emportant avec lui les poissons épuisés.
- Effectuez la surveillance du débit.
REMARQUE : Il est nécessaire de surveiller la vitesse d’écoulement de l’eau à travers un système qui intègre un Arduino Nano, un écran LCD 16 x 2, une résistance traversante de 10 kΩ, 0,25 W et un potentiomètre de 10 kΩ. Le capteur de débit surveille en permanence la vitesse d’écoulement de l’eau sur la base de la technologie à effet Hall17. Chaque impulsion de courant correspond à un tour du flopper du capteur, ce qui donne une fréquence (Hz) de 6,6 x Q (débit en L/min).- Connectez les fils appropriés du capteur de débit aux broches 5 V, GND et D2 de l’Arduino Nano (tableau supplémentaire 1). Chargez l’esquisse fournie (fichier supplémentaire 1) dans l’Arduino à l’aide de l’IDE Arduino. Alimentez le système via le port USB Arduino.
REMARQUE : Les mesures de débit sont affichées sur l’écran LCD 16 x 2. L’étalonnage du capteur de débit d’eau est illustré à la figure 2. Les schémas des connexions Arduino à l’écran LCD sont illustrés à la figure 3.
- Connectez les fils appropriés du capteur de débit aux broches 5 V, GND et D2 de l’Arduino Nano (tableau supplémentaire 1). Chargez l’esquisse fournie (fichier supplémentaire 1) dans l’Arduino à l’aide de l’IDE Arduino. Alimentez le système via le port USB Arduino.
3. Test d’endurance
REMARQUE : Cette étape décrit la procédure du test d’endurance pour déterminer la vitesse maximale de nage (Umax) du poisson-zèbre.
- Tout d’abord, laissez le poisson s’adapter pendant 60 minutes par jour à une faible vitesse d’écoulement de l’eau (0,06 m/s) à l’intérieur du tunnel de baignade pendant deux semaines.
REMARQUE : Après une période de préconditionnement de 24 heures, chaque poisson-zèbre subira le test de performance de natation soutenue. Le but de ce test est d’établir l’Umax de chaque poisson. - Placez le poisson-zèbre individuellement dans l’appareil.
- Conditions d’essai : Positionner le poisson contre un courant d’eau à une vitesse initiale de 0,06 m/s pendant 10 min.
- Incréments de vitesse : Augmentez le débit d’eau par étapes discrètes, avec des incréments de vitesse de 0,02 m/s se produisant toutes les minutes pendant 40 à 50 min.
- Détermination Umax : Recpod la vitesse maximale de nage (Umax) lorsque le poisson répond aux critères d’épuisement.
REMARQUE : L’épuisement est défini lorsque la première des situations suivantes est observée : (1) incapacité à maintenir sa position contre le courant d’eau pendant plus de trois cas, ou (2) incapacité à maintenir sa position pendant plus de 5 s. - Fermez la vanne (E) après avoir respecté les critères d’épuisement. Ensuite, ouvrez la valve F et faites-la pivoter de 180° par rapport à l’axe du tube acrylique. Cela facilitera le drainage de l’eau, transportant les poissons épuisés.
4. Groupes d’exercices et procédure
REMARQUE : Pour établir des protocoles d’exercice distincts, il est essentiel d’inclure un groupe sédentaire exposé à des conditions expérimentales identiques afin de comparer les effets des protocoles d’exercice, mais sans subir d’exercice de haute intensité. Il est également essentiel d’établir l’Umax car les fractions de la valeur Umax sont nécessaires pour déterminer l’intensité des protocoles d’exercice.
- Groupe sédentaire (SED) : Soumettre le poisson à une nage forcée à contre-courant de l’eau à 0,06 m/s pendant 60 min.
REMARQUE : L’appareil génère un flux d’eau continu, obligeant le poisson à nager à contre-courant selon le principe de la rhéotaxie11. - Groupe d’entraînement continu d’intensité modérée (MICT) : Soumettre le poisson à une nage forcée à contre-courant du débit d’eau à 60 % de Umax, tel que déterminé dans le test de capacité maximale, pendant 35 min.
REMARQUE : Ce protocole a été adapté de Húngaro et al.18. Pendant les 10 premières minutes, le poisson s’est acclimaté à la même vitesse que le groupe sédentaire (0,05 m/s). - Groupe d’entraînement par intervalles à haute intensité (HIIT) : Soumettre les poissons à une nage forcée en alternant les vitesses de nage : 2 min à 90% de Umax suivi de 2 min à 30% d’Umax, répété pendant 18 min (9 cycles). Ce protocole a été adapté de Marcinko et al.19.
REMARQUE : Pendant les 10 premières minutes de la période d’exercice, il est nécessaire d’acclimater le poisson à la même vitesse que le groupe sédentaire (0,06 m / s). - Mettez en œuvre tous les protocoles d’exercice 5 jours par semaine sur une période de quatre semaines.
REMARQUE : Les poissons doivent être logés dans des aquariums qui offrent des conditions appropriées, et ils ne doivent être introduits dans l’appareil d’exercice que pendant les périodes d’exercice désignées. Les poissons doivent recevoir de la nourriture en flocons de poissons tropicaux trois fois par jour, et l’eau des aquariums d’entretien doit subir un changement partiel tous les 2 jours. - Répétez le test d’endurance à la fin de chaque semaine, avec des données de latence et de vitesse au point de fatigue comme indicateurs des paramètres de conditionnement physique.
- Pour induire des effets de surentraînement, augmentez la vitesse d’écoulement de l’eau chaque semaine en fonction des résultats du test d’endurance effectué après chaque cycle d’entraînement de 4 jours. Les durées d’entraînement doivent être ajustées pour tenir compte de la distance parcourue (vitesse × temps), et ces durées doivent rester cohérentes entre les groupes exercés.
- Ajustez le temps de nage en fonction de l’augmentation du débit d’eau, uniformisant ainsi la charge d’entraînement entre les groupes d’exercices.
5. Mesures corporelles
- Anesthésier le poisson avec 0,0075 % de tricaïne (p/v) par immersion pour effectuer des mesures corporelles (poids et taille)20.
- Photographiez et pesez le poisson pour déterminer ses dimensions à l’aide du logiciel ImageJ.
- Exprimer les données en termes d’indices d’état corporel (poids [g]/longueur standard [mm]2 ; IMC) et l’évaluation de l’état corporel (NEC)20.
- Pour éliminer les variations de taille et de poids causées par la formation des œufs, soumettez le poisson à un élevage standard20, suivi de mesures et d’une pesée.
Résultats
L’appareil d’exercice a démontré une efficacité remarquable dans la régulation de la vitesse d’écoulement. Afin d’améliorer progressivement la vitesse de nage, le débit d’eau a été augmenté progressivement chaque semaine pour tous les groupes, à l’exception du groupe SED, qui a été maintenu à une vitesse d’écoulement constante de 0,06 m/s. L’appareil permettait notamment un niveau de précision remarquable, permettant des ajustements de vitesse d’écoulement aussi fins que 0,001 m/s. Cependant, le taux d’erreur était de 30 % à basse vitesse, par exemple 0,06 m/s. À des vitesses élevées, telles que 0,3 m/s et 0,5 m/s, le taux d’erreur était de 3 % à 4 % (Figure 2). La vitesse maximale atteinte pendant l’entraînement était de 0,4 m/s dans le SED, de 0,44 m/s dans le MICT et de 0,49 m/s dans les groupes HIIT lors de la dernière endurance.
La performance physique du poisson-zèbre a été évaluée chaque semaine à l’aide d’Umax dans le test d’endurance. Les résultats ont révélé des améliorations significatives des performances physiques chez les poissons-zèbres soumis au MICT et au HIIT par rapport au groupe SED (Figure 4). Le MICT et le HIIT ont été soumis à la même distance parcourue pendant l’entraînement ; cependant, le groupe HIIT a induit des améliorations rapides, avec une augmentation significative de l’Umax observée après seulement deux semaines (p = 0,0003). Au cours de la période d’entraînement, le groupe HIIT a démontré une amélioration hebdomadaire constante de 10 %, ce qui a donné lieu à une amélioration globale d’environ 30 %. En revanche, l’entraînement MICT a conduit à des gains plus progressifs, avec une augmentation notable de ~10% de l’Umax enregistrée uniquement au cours de la troisième semaine de formation, suivie d’aucune amélioration supplémentaire la semaine suivante (p = 0,0024). Ces résultats mettent en évidence les effets différentiels des protocoles d’entraînement HIIT et MICT sur les performances physiques du poisson-zèbre.

Figure 1 : Conception de l’appareil. (A) Schémas de l’appareil de nage. Les flèches bleues indiquent la direction de l’écoulement de l’eau. Les longueurs de tuyau correspondantes sont représentées. Les lettres représentent chaque composant de l’appareil décrit dans le tableau supplémentaire 1. (B) Photographie de l’appareil. Veuillez cliquer ici pour voir une version agrandie de cette figure.
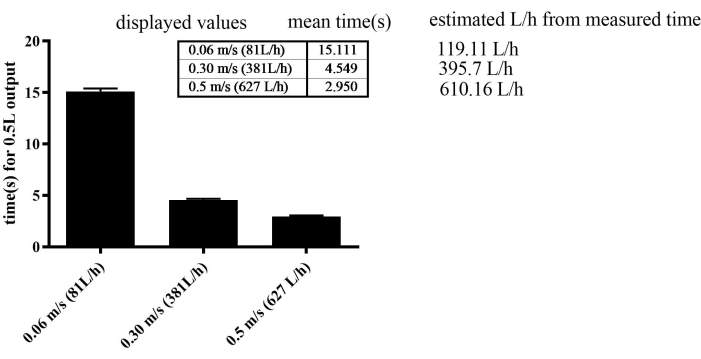
Figure 2 : Étalonnage du capteur de débit d’eau en mesurant le temps nécessaire pour un débit de 0,5 L. Le SEM était de 0,277 dans les groupes 0,06 m/s, 0,123 dans les groupes 0,3 m/s et 0,109 dans les groupes 0,5 m/s. Veuillez cliquer ici pour voir une version agrandie de cette figure.
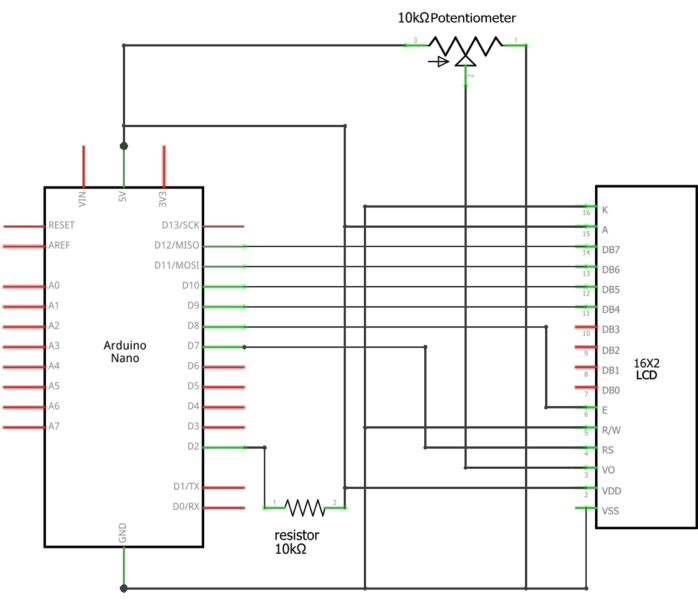
Figure 3 : Schémas des connexions Arduino à l’écran LCD. Les fils appropriés du capteur doivent être connectés ou soudés entre la broche D2 de l’Arduino et la résistance de 10 kΩ (fil de signal), la masse de l’Arduino (fil noir) et 5 V de l’Arduino (fil rouge). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : La performance en natation exprimée en vitesse maximale de nage (Umax). a, b et c indiquent les différences statistiques entre les estimations hebdomadaires de la capacité de nage au sein de chaque groupe. *Indique la différence entre les groupes, comparaison à l’aide de l’analyse de variance à deux facteurs (Tukey posthoc). *p = 0,01 ; **p = 0,001 ; p = 0,0001. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Mesures morphologiques. (A) Indices d’état corporel (poids [g] / longueur standard [mm]2 ; IMC). (B) Image représentative de la mesure corporelle. (C) Évaluation de l’état corporel (BCS). La barre d’erreur correspond à une plage de 0,026 à 0,045 pour l’IMC et de 0,4 à 0,96 pour la BCS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire 1 : Matériaux et guide de montage de l’appareil d’exercice du poisson zèbre. Le tableau comporte des lettres qui s’alignent sur l’ordre d’assemblage illustré sur la figure. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 1 : Croquis Arduino annoté pour la mesure de la vitesse de l’eau. Des commentaires pour chaque ligne de code sont incorporés après les doubles barres obliques. Veuillez cliquer ici pour télécharger ce fichier.
Fichier supplémentaire 2 : Fichier Arduino, y compris les détails de configuration. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Dans cette étude, un système d’exercice innovant et rentable a été développé en s’inspirant du respiromètre à tunnel de nage de Loligo Systems21 et du système de canal22 pour l’examen complet des performances de nage du poisson-zèbre. L’Umax a été déterminé en augmentant systématiquement le débit d’eau par étapes discrètes, avec des augmentations de vitesse se produisant sur de courts intervalles (20-30 min) jusqu’à ce que le poisson atteigne l’épuisement, qui était caractérisé par trois fatigues consécutives ou l’incapacité de surmonter le courant dans le tunnel de nage. Ces déterminations ont joué un rôle déterminant dans la conception de deux protocoles d’exercices (MICT et HIIT). Contrairement aux protocoles impliquant des durées d’étape relativement longues (allant d’une à plusieurs heures), la vitesse d’écoulement de l’eau à l’épuisement est connue sous le nom de vitesse critique de nage (Ucri)12. Les valeurs Umax calculées à l’aide du système d’exercice se situaient dans la plage observée dans d’autres études7, confirmant l’efficacité de cet appareil de nage en tunnel pour évaluer les performances physiques du poisson-zèbre. De plus, cet appareil compact possède la polyvalence nécessaire pour couvrir tout le spectre des vitesses d’écoulement de l’eau, facilitant ainsi la personnalisation des protocoles d’entraînement appliqués.
Dans ce développement d’appareil, il est possible de créer différents protocoles d’exercice en contrôlant uniquement la vitesse d’écoulement de l’eau. La mesure précise de la vitesse d’écoulement de l’eau a posé des défis à basse vitesse, ce qui a entraîné un taux d’erreur d’environ 30 %. Néanmoins, la précision s’est améliorée à des vitesses intermédiaires et élevées, proches de Umax, avec une mesure de vitesse plus fiable et un taux d’erreur réduit de 3 % à 4 %. Par conséquent, une limitation de la précision du dispositif à basse vitesse a été identifiée. Malgré cette limitation, l’étude a révélé que même avec une variation de vitesse de 0,02 m/s, aucun impact significatif sur la capacité physique du groupe SED pendant l’entraînement n’a été observé. Cela suggère que les variations de l’entraînement de faible intensité peuvent ne pas exercer d’effets significatifs sur la capacité physique, du moins dans le modèle présenté dans cette étude. Une autre limitation de l’appareil proposé est l’absence de capteur d’oxygène, ce qui rend impossible la mesure de la consommation d’oxygène.
Des études antérieures ont démontré une disparité notable dans la vitesse de nage entre les poissons-zèbres mâles adultes et les femelles, avec des attributions suggérées incluant des distinctions morphologiques, telles que l’augmentation de la circonférence des femelles gravides, et des différences physiologiques, telles que la réduction de la puissance musculaire chez les poissons gravides 5,23,24. Cette étude a exclusivement soumis les femelles du poisson-zèbre au régime d’entraînement, reconnaissant que ces femelles ont subi trois cycles de reproduction avant, pendant et après l’entraînement, précédant constamment les mesures corporelles. Cette approche stratégique a permis d’atténuer efficacement les différences corporelles entre les sexes. De plus, cette étude n’a révélé aucune différence perceptible dans les paramètres corporels entre les groupes d’entraînement (Figure 5) ou en comparant les conditions avant et après l’entraînement chez les femmes. Bien qu’il n’y ait pas eu de contrôle pour la variation de l’âge entre les individus, il est bien documenté que les performances de nage et les demandes d’énergie de locomotion peuvent fluctuer considérablement tout au long du cycle de vie en raison de l’ontogenèse, de la reproduction et de la sénescence 25,26,27. Malgré les différences d’âge potentielles au sein de chaque groupe, tous les animaux ont été méticuleusement regroupés en fonction de leur taille, de leur poids corporel et d’un stade adulte sexuellement mature. Notamment, aucune différence statistiquement significative n’a été observée entre les groupes avant de commencer le régime d’exercice. Par conséquent, il a été postulé que l’amélioration observée de la capacité de natation peut être attribuée avec certitude uniquement aux protocoles d’exercice utilisés.
Cette étude visait à évaluer l’efficacité du système d’exercice en mettant en œuvre deux protocoles d’exercice distincts. Alors que le MICT implique un régime d’exercice soutenu et continu, le HIIT comprend de courtes périodes d’exercice d’intensité maximale suivies de brèves périodes de récupération moins intenses. Les deux protocoles ont été méticuleusement ajustés pour fournir des charges d’entraînement équivalentes tout au long de la période d’entraînement sans induire d’épuisement. Le groupe SED a subi le même test d’endurance une fois par semaine pendant quatre semaines, comme les autres groupes d’exercices, mais a montré une amélioration minimale des performances. L’entraînement d’endurance est reconnu pour améliorer le débit cardiaque, la consommation maximale d’oxygène et la biogenèse mitochondriale28 ; Cependant, la fréquence hebdomadaire des exercices s’est avérée insuffisante pour provoquer des changements significatifs dans les performances de natation. Lorsque les poissons-zèbres ont été soumis à l’entraînement MICT, une amélioration notable des performances de nage a été observée après la troisième semaine d’entraînement. Cependant, il n’y a pas eu d’autre amélioration au cours de la semaine suivante. Le MTPI implique que les individus supportent une charge de travail sous-maximale pendant de longues périodes, ce qui nécessite une puissance de sortie supérieure à la moyenne22. Plus particulièrement, le groupe HIIT a démontré l’amélioration la plus substantielle, avec une augmentation significative des performances apparente après seulement deux semaines d’entraînement, maintenue jusqu’à la quatrième semaine. Bien qu’il soit bien documenté qu’un exercice court et de haute intensité conduit à l’adaptation de l’endurance, le type d’exercice spécifique responsable de l’induction de mouvements musculaires phénotypiques reste un sujet de recherche en cours28.
Déclarations de divulgation
Il est essentiel de préciser qu’il n’y a pas d’intérêts financiers concurrents associés à la recherche présentée dans ce manuscrit. Aucun partenariat financier ou affiliation avec des organisations ou des entités n’a été établi qui pourrait influencer ou biaiser les résultats de ce travail. Cette déclaration sert à garantir que le processus de recherche a été simple et honnête, sans qu’aucun conflit financier n’influence les résultats. La présentation de ce travail est motivée par une véritable passion pour le sujet, motivée uniquement par un amour pour le milieu universitaire et la poursuite de la connaissance scientifique.
Remerciements
Nous remercions M. Omar Mertins d’avoir généreusement fourni l’accès au laboratoire pour l’entretien des poissons et l’exécution des tests. De plus, des reconnaissances sont accordées à la FAPESP, au CNPq et au CAPES pour l’octroi de bourses de soutien à ces recherches.
matériels
| Name | Company | Catalog Number | Comments |
| CPVC Female 90-Degree Elbow for Plumbing | Tigre | 22150260 | 3/4-inch |
| 24AWG Wire | Sky Cablo Store | Connection between components in the Perforated Circuit Board (1m) | |
| Acrylic pipe | The Clear Plastic Shop | 41138408 | 3/4-inch |
| Aquarium Submersible Fish Tank | Aqua Tank | 300w | |
| CPVC Pipe | Tigre | 10121787 | 3/4-inch |
| Female Threaded Gate Water Valve | Tigre | 27950310 | 3/4-inch |
| Female Threaded Globe Water Valve | Tigre | 27940510 | 3/4-inch |
| hrough-hole resistor | BXV | 10 kΩ, 0.25W t | |
| Lab Support Stand With Clamp with 30 inch rod | Masiye Labs | RSC0001 | Support the horizontal pipes |
| LCD screen | Eichip | 16 x 2, model JHD162A | |
| Male x Male Dupont Jumpers | Chyan | Connection between arduino and flow sensor (30 cm) | |
| Perforated Circuit Board single sided | KY WIN ROBOT | 5 x 10 cm | |
| Potentiometer | LUSYA | DL-ALPSA01 | 10kΩ |
| Roll of Water Blocking Tape | One World | 5603131000 | To avoid leaks |
| Silicone hose | Tigre | 14211250 | 2 cm inner |
| Solder Station | QHTITEC | EU/US PLUG | Arduine system welding |
| Solder Wire Spool | BEEYIHF | I001-A001-Set | Arduine system welding |
| Threaded Male Socket and Unthreaded Female Socket CPVC Pipe Fitting | TIgre | 35447849 | 3/4-inch |
| Tricaine (MS-222) | Sigma-Aldrich | E10521 | Anesthetic |
| UNO-R3 board UNO R3 CH340G+MEGA328P Chip 16Mhz | FSXSEMI | For Arduino UNO R3 Development board | |
| Unthreaded CPVC Tee Pipe Fitting, Female | Tigre | 22200267 | 3/4-inch |
| Unthreaded Female CPVC Socket Pipe Fitting | Tigre | 22170260 | 3/4-inch |
| Water Flow Sensor model YF-B5 | Siqma Robotics | SQ8659 | 1-25 L/min |
| Water Pump | Sunsun | Model HJ-2041, 3000L/h, 65W | |
| Water reservoir | Custom | 30 L |
Références
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflugers Arch Eur. J Physiol. 466 (9), 1673-1687 (2014).
- Nylén, E. S., Gandhi, S. M., Lakshman, R. Cardiorespiratory fitness, physical activity, and metabolic syndrome. Cardiorespiratory Fitness in Cardiometabolic Diseases: Prev. & Manag. in Clin. Pract. , Springer. 207-215 (2019).
- Cholewa, J., et al. Basic models modeling resistance training: an update for basic scientists interested in study skeletal muscle hypertrophy. J Cell Physiol. 229 (9), 1148-1156 (2014).
- Martin, B., Ji, S., Maudsley, S., Mattson, M. P. 34;Control" laboratory rodents are metabolically morbid: Why it matters. Proc Natl Acad Sci USA. 107 (14), 6127-6133 (2010).
- Palstra, A. P., et al. Swimming-induced exercise promotes hypertrophy and vascularization of fast skeletal muscle fibres and activation of myogenic and angiogenic transcriptional programs in adult zebrafish. BMC Genomics. 15 (1), 1-20 (2014).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50, 106-113 (2014).
- Usui, T., et al. The French press: A repeatable and high-throughput approach to exercising zebrafish (Danio rerio). Peer J. 2018 (1), 1-12 (2018).
- Tierney, K. B. Swimming performance assessment in fishes. J. Vis. Exp. (51), e2572(2011).
- Palstra, A. P., et al. Establishing zebrafish as a novel exercise model: Swimming economy, swimming-enhanced growth and muscle growth marker gene expression. PLoS One. 5 (12), e0014483(2010).
- Arnold, G. P. Rheotropism in fishes. Biol Rev Camb Philos Soc. 49 (4), 515-576 (1974).
- Messerli, M., et al. Adaptation mechanism of the adult zebrafish respiratory organ to endurance training. PLoS One. 15 (2), 1-20 (2020).
- Bek, J. W., De Clercq, A., Coucke, P. J., Willaert, A. The ZE-tunnel: An affordable, easy-to-assemble, and user-friendly benchtop zebrafish swim tunnel. Zebrafish. 18 (1), 29-41 (2021).
- Lucon-Xiccato, T., et al. An automated low-cost swim tunnel for measuring swimming performance in fish. Zebrafish. 18 (3), 231-234 (2021).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Depasquale, C., Leri, J. The influence of exercise on anxiety-like behavior in zebrafish (Danio rerio). Behav Processes. 157, 638-644 (2018).
- Karsenty, A. A comprehensive review of integrated hall effects in macro-, micro-, nanoscales, and quantum devices. Sensors. 20 (15), Basel, Switzerland. 4163(2020).
- Húngaro, T. G. R., et al. Physical exercise exacerbates acute kidney injury induced by LPS via toll-like receptor 4. Front Physiol. 11, 1-13 (2020).
- Marcinko, K., et al. High intensity interval training improves liver and adipose tissue insulin sensitivity. Mol Metab. 4 (12), 903-915 (2015).
- Chen, W., Ge, W. Gonad differentiation and puberty onset in the zebrafish: Evidence for the dependence of puberty onset on body growth but not age in females. Mol Reprod Develop. 80 (5), 384-392 (2013).
- Conradsen, C., Walker, J. A., Perna, C., McGuigan, K. Repeatability of locomotor performance and morphology-locomotor performance relationships. J Exp Biol. 219 (18), 2888-2897 (2016).
- Widrick, J. J., et al. An open source microcontroller based flume for evaluating swimming performance of larval, juvenile, and adult zebrafish. PLoS ONE. 13 (6), 1-14 (2018).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50 (1), 106-113 (2013).
- Hammer, C. Fatigue and exercise tests with fish. Exp Gerontol. 112 (1), 1-20 (1995).
- Takahiro Hasumura, S. M. Exercise quantity-dependent muscle hypertrophy in adult zebrafish (Danio rerio). J Comp Physiol B. 186, 603-614 (2016).
- Wang, L., et al. Effect of aerobic exercise as a treatment on type 2 diabetes mellitus with depression-like behavior zebrafish. Life Sciences. 300, 120578(2022).
- Conradsen, C., McGuigan, K. Sexually dimorphic morphology and swimming performance relationships in wild-type zebrafish Danio rerio. J Fish Bio. 87 (5), 1219-1233 (2015).
- Hughes, D. C., Ellefsen, S., Baar, K. Adaptations to endurance and strength training. Cold Spring Harb Perspect Med. 8 (6), 1-18 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon