Method Article
Un aparato de ejercicio de pez cebra inducido por la natación para enfoques de entrenamiento versátiles
En este artículo
Resumen
El aparato de ejercicio diseñado para peces menos afortunados facilita la implementación de diversos protocolos de ejercicio con diferentes intensidades mediante la manipulación de la velocidad del flujo de agua, alcanzable a través de la reotaxis.
Resumen
Para investigar de manera exhaustiva los efectos del ejercicio en la salud y la enfermedad, los modelos animales desempeñan un papel fundamental. El pez cebra, un organismo modelo de vertebrado ampliamente utilizado, ofrece una plataforma única para este tipo de estudios. Este estudio introdujo el desarrollo de un aparato rentable adaptado para los estudios de ejercicio del pez cebra utilizando materiales fácilmente disponibles. El dispositivo se basa en los principios de un túnel de natación y abarca una red de tuberías y válvulas conectadas a una bomba sumergible. El caudal de agua se controla meticulosamente mediante un sensor y se regula mediante válvulas. Para evaluar la efectividad del aparato, se implementaron dos protocolos de entrenamiento: entrenamiento continuo de intensidad moderada (MICT) y entrenamiento interválico de alta intensidad (HIIT). Los peces fueron entrenados colectivamente y su rendimiento en la natación se evaluó a través de una prueba de resistencia. Ambos protocolos de entrenamiento condujeron a mejoras en el rendimiento de la natación después de 30 días de entrenamiento e indujeron alteraciones en la respuesta molecular al ejercicio en comparación con un grupo de control sedentario. En particular, HIIT demostró una eficiencia superior a MICT. El sistema de entrenamiento del pez cebra demostró ser una herramienta valiosa para las investigaciones en fisiología del ejercicio y avanza aún más en la utilidad del modelo de pez cebra en este campo.
Introducción
El ejercicio físico abarca cualquier movimiento corporal realizado por los músculos esqueléticos que resulte en un mayor gasto de energía, siendo el ejercicio un subconjunto estructurado y repetitivo de las actividades físicas1. El ejercicio, una actividad multifactorial y rentable que involucra a todo el cuerpo, produce numerosos beneficios para la salud, como la prevención del síndrome metabólico y la sarcopenia2. En consecuencia, el campo de la fisiología del ejercicio tiene un interés significativo, ya que busca dilucidar cómo el cuerpo se adapta al estrés agudo del ejercicio, el estrés crónico del entrenamiento físico y el impacto general del ejercicio enla salud.
La realización de estudios de fisiología del ejercicio en humanos puede ser costosa y requerir mucho tiempo debido a los desafíos en el diseño experimental y el seguimiento de los participantes3. Por lo tanto, el uso de modelos animales en entornos de laboratorio ha sido muy recomendable debido a su uniformidad genética y fisiológica. Además, en condiciones controladas de laboratorio, los animales suelen tener estilos de vida sedentarios y una ingesta de alimentos regulada4. Entre los modelos animales, los roedores han sido los más utilizados en la investigación relacionada con el ejercicio físico1. Sin embargo, el pez cebra (Danio rerio; Hamilton, 1822) es un modelo complementario a los murinos y a otras especies para los estudios del ejercicio 5,6,7,8.
En la investigación del pez cebra, el ejercicio físico se puede llevar a cabo utilizando túneles de natación disponibles comercialmente o hechos a medida. Entre las opciones disponibles en el mercado, el túnel tipo Blazka, desarrollado por el Sistema Loligo, es el más utilizado 7,9,10. Este sistema induce la natación forzada a través de una hélice acoplada a un motor eléctrico, generando un flujo continuo de agua dentro del túnel. Esta capacidad de natación se basa en el principio de la reotaxis, un comportamiento innato en los peces que los impulsa a nadar contra las corrientes de agua y mantenersu posición. La reotaxis permite la medición de la velocidad crítica de natación (Ucrit), que representa la velocidad máxima que un pez puede mantener durante un período específico. Sin embargo, vale la pena señalar que este equipo, si bien es valioso para evaluar el comportamiento de natación y el consumo de oxígeno, tiene un costo significativo12.
Los investigadores han desarrollado aparatos alternativos para ejercitar al pez cebra, a menudo basados en el mecanismo de tipo Blazka10,13,14 o mecanismos más simples 8,15,16. No obstante, estos métodos pueden estar limitados por las demandas técnicas del protocolo, incluidas las duraciones prolongadas, los gastos sustanciales de equipo y las limitaciones en el rendimiento y la precisión. En consecuencia, el objetivo principal del estudio fue diseñar un sistema de ejercicio de pez cebra asequible y fácil de usar utilizando materiales fácilmente disponibles, proporcionando un nuevo aparato alternativo para el ejercicio físico en peces. Un objetivo secundario fue implementar regímenes de ejercicio aeróbico y anaeróbico en pez cebra, avanzando aún más en la utilización del modelo de pez cebra como estrategia de intervención en la investigación del ejercicio.
Protocolo
Los procedimientos recibieron la aprobación previa del Comité de Ética en Uso Animal de la Universidad Federal de São Paulo (CEUA/UNIFESP nº 9206260521). En este estudio solo se emplearon hembras adultas de tipo salvaje Danio rerio, de 6 meses de edad y con un peso de 2,5-3 g. El equipo y los reactivos necesarios para el estudio se enumeran en la Tabla de Materiales.
1. Aparato de ejercicio de pez cebra hecho a medida
NOTA: El aparato de ejercicio fue hecho a medida. Para obtener más información, consulte la Figura 1, la Tabla complementaria 1, el Archivo complementario 1 y el Archivo complementario 2.
- Coloque una bomba sumergible (N) dentro de un tanque de agua (O) (≥30 L). Asegúrese de que el agua cumpla con las siguientes condiciones: pH de 7,2 ± 0,5 y 400 ± 50 μS, 28 ± 1 °C.
- Flujo Suplementario Tabla 1 y Figura 1, conecte la tubería (I) al tubo en T del punto (B) y conecte una tubería pequeña (G) al lado de B. Desde G, establecer conexiones a la Válvula de Globo (F), luego a otra G, y en secuencia a la Tubería Codo (A) e I, completando así el segmento responsable de regular la presión del agua dentro del sistema. Esta regulación se logra a través de un flujo de retorno al tanque de agua (O).
- En la sección alternativa de B, conéctelo a una tubería (J), seguido de las conexiones a A y G. Utilice el accesorio de tubería de zócalo (D) para conectar la válvula de agua de compuerta (E) a G.
- Integre un puerto de entrada de peces en el sistema conectando B a G en un extremo y conectando otro G en el extremo opuesto. Posteriormente, conecte el Socket Pipe Fitting (C) a esta segunda G, estableciendo una secuencia que se conecte con el Tubo Acrílico (K), que es crucial para visualizar el comportamiento de natación.
- Para conectar K al sensor de flujo de agua (M), utilice las tuberías C, G y D. Proceda a conectar M a G usando D, y luego integre A, G y H para facilitar el regreso del agua al depósito.
NOTA: Inserte una mosquitera en el segmento corto del tubo entre la compuerta y la válvula de globo (F2) para evitar que los peces accedan a otras secciones del aparato. La válvula de globo (F) tiene un doble propósito. La primera válvula de globo (F1) controla el flujo de agua que regresa al depósito antes de ingresar al resto del aparato, actuando como una válvula de control de presión del sistema. La válvula de globo (F2) es un punto de entrada y salida para el pez cebra dentro del sistema.
- Para conectar K al sensor de flujo de agua (M), utilice las tuberías C, G y D. Proceda a conectar M a G usando D, y luego integre A, G y H para facilitar el regreso del agua al depósito.
- Conecte un sensor de flujo de agua aguas abajo de la tubería acrílica.
NOTA: El sensor de flujo debe estar conectado a una pantalla LCD y programado usando un Arduino (Figura 1). Los detalles de la configuración de Arduino se proporcionan en el Archivo Complementario 2.
2. Funcionamiento del aparato
- Para introducir los peces de forma segura en el sistema, es esencial interrumpir el flujo de agua. Para lograr esto, cierre la válvula de compuerta (E) mientras mantiene abierta la válvula de globo (F1). Posteriormente, abra la válvula de globo (F2), que sirve como entrada al sistema, introduzca suavemente el pez y cierre rápidamente la válvula F2. Finalmente, abra la válvula E para llenar el área de ejercicio con agua.
- Use la válvula de globo para controlar la velocidad del flujo, desviando el agua de regreso al depósito cuando sea necesario.
- Utilice la válvula de compuerta (F2) para un ajuste preciso del flujo y para administrar el acceso de los peces.
- Para retirar el pez al final de la prueba, cierre la válvula (E) observando los criterios de agotamiento. Luego, abra la válvula F y gírela 180° con respecto al eje del tubo acrílico; Esto facilitará el drenaje del agua que arrastra consigo a los peces agotados.
- Realice el monitoreo de flujo.
NOTA: Es necesario monitorear la velocidad del flujo de agua a través de un sistema que incorpora un Arduino Nano, una pantalla LCD de 16 x 2, una resistencia de orificio pasante de 10 kΩ de 0,25 W y un potenciómetro de 10 kΩ. El sensor de caudal supervisa continuamente la velocidad del caudal de agua basándose en la tecnología de efecto Hall17. Cada pulso de corriente corresponde a una revolución del fleje del sensor, lo que da como resultado una frecuencia (Hz) de 6,6 x Q (caudal en L/min).- Conecte los cables apropiados del sensor de flujo a los pines de 5 V, GND y D2 del Arduino Nano (Tabla complementaria 1). Cargue el boceto proporcionado (Archivo complementario 1) en el Arduino utilizando el IDE de Arduino. Alimenta el sistema a través del puerto USB de Arduino.
NOTA: Las mediciones de caudal se muestran en la pantalla LCD de 16 x 2. La calibración del sensor de flujo de agua se muestra en la Figura 2. Los esquemas de las conexiones de Arduino a la pantalla LCD se ilustran en la Figura 3.
- Conecte los cables apropiados del sensor de flujo a los pines de 5 V, GND y D2 del Arduino Nano (Tabla complementaria 1). Cargue el boceto proporcionado (Archivo complementario 1) en el Arduino utilizando el IDE de Arduino. Alimenta el sistema a través del puerto USB de Arduino.
3. Prueba de resistencia
NOTA: Este paso describe el procedimiento para la prueba de resistencia para determinar la velocidad máxima de natación (Umax) del pez cebra.
- En primer lugar, permita que los peces se adapten durante 60 minutos al día a una velocidad de flujo de agua baja (0,06 m/s) dentro del túnel de natación durante dos semanas.
NOTA: Después de un período de preacondicionamiento de 24 horas, cada pez cebra se someterá a la prueba de rendimiento de natación sostenida. El propósito de esta prueba es establecer el Umax de cada pez. - Coloque el pez cebra individualmente en el aparato.
- Condiciones de prueba: Coloque el pez contra un flujo de agua con una velocidad inicial de 0,06 m/s durante 10 min.
- Incrementos de velocidad: Aumente el flujo de agua en etapas discretas, con incrementos de velocidad de 0,02 m/s cada minuto durante 40-50 minutos.
- Determinación de Umax: Recpod la velocidad máxima de nado (Umax) cuando los peces cumplen con los criterios de agotamiento.
NOTA: El agotamiento se define cuando se observa la primera de las siguientes situaciones: (1) Incapacidad para mantener su posición contra el flujo de agua durante más de tres instancias, o (2) Incapacidad para mantener su posición durante más de 5 s. - Cierre la válvula (E) observando los criterios de agotamiento. Luego, abra la válvula F y gírela 180° con respecto al eje del tubo acrílico. Esto facilitará el drenaje del agua, arrastrando los peces exhaustos.
4. Grupos de ejercicios y procedimiento
NOTA: Para establecer protocolos de ejercicio distintos, es imprescindible incluir un grupo sedentario expuesto a condiciones experimentales idénticas para comparar los efectos de los protocolos de ejercicio, aunque sin someterse a ejercicio de alta intensidad. También es fundamental establecer la Umax porque las fracciones del valor de la Umax son necesarias para determinar la intensidad de los protocolos de ejercicio.
- Grupo sedentario (SED): Someter a los peces a nadar forzado contra la corriente de agua a 0,06 m/s durante 60 min.
NOTA: El aparato genera un flujo de agua continuo, obligando a los peces a nadar contra esta corriente basándose en el principio de la reotaxis11. - Grupo de Entrenamiento Continuo de Intensidad Moderada (MICT): Someter a los peces a nadar forzado contra el flujo de agua al 60% de Umax, según lo determinado en la prueba de capacidad máxima, durante 35 min.
NOTA: Este protocolo fue adaptado de Húngaro et al.18. Durante los primeros 10 min, el pez se aclimató a la misma velocidad que el grupo sedentario (0,05 m/s). - Grupo de entrenamiento interválico de alta intensidad (HIIT): Someter a los peces a natación forzada alternando las velocidades de nado: 2 min al 90% de Umax seguido de 2 min al 30% de Umax, repetido durante 18 min (9 ciclos). Este protocolo fue adaptado de Marcinko et al.19.
NOTA: Durante los primeros 10 min del período de ejercicio, es necesario aclimatar a los peces a la misma velocidad que el grupo sedentario (0,06 m/s). - Implemente todos los protocolos de ejercicio durante 5 días a la semana durante un período de cuatro semanas.
NOTA: Los peces deben alojarse en acuarios que proporcionen condiciones adecuadas, y solo deben introducirse en el aparato de ejercicio durante los períodos de ejercicio designados. Los peces deben recibir alimentos en copos de peces tropicales tres veces al día, y el agua de los acuarios de mantenimiento debe sufrir un cambio parcial cada 2 días. - Repetir la prueba de resistencia al final de cada semana, con datos de latencia y velocidad en el punto de fatiga como indicadores de los parámetros de acondicionamiento físico.
- Para inducir los efectos del sobreentrenamiento, aumente la velocidad del flujo de agua semanalmente en función de los resultados de la prueba de resistencia realizada después de cada ciclo de entrenamiento de 4 días. Las duraciones del entrenamiento deben ajustarse para tener en cuenta la distancia recorrida (velocidad × tiempo), y estas duraciones deben permanecer consistentes entre los grupos ejercitados.
- Ajustar el tiempo de natación en respuesta al aumento del caudal de agua, estandarizando así la carga de entrenamiento en los grupos ejercitados.
5. Medidas corporales
- Anestesiar a los peces con tricaína al 0,0075% (p/v) por inmersión para la realización de mediciones corporales (peso y talla)20.
- Fotografíe y pese a los peces para determinar las dimensiones corporales utilizando el software ImageJ.
- Expresar los datos en términos de Índices de Condición Corporal (peso [g]/longitud estándar [mm]2; IMC) y puntuación de la condición corporal (BCS)20.
- Para eliminar las variaciones de tamaño y peso causadas por la formación de huevos, someta a los peces a la cría estándar20, seguida de mediciones y pesaje.
Resultados
El aparato de ejercicio demostró una notable eficiencia en la regulación de la velocidad del flujo. Para mejorar gradualmente la velocidad de nado, el flujo de agua se incrementó gradualmente semanalmente para todos los grupos, excepto para el grupo SED, que se mantuvo a una velocidad de flujo constante de 0,06 m/s. En particular, el aparato permitía un notable nivel de precisión, logrando ajustes de velocidad de flujo tan finos como 0,001 m/s. Sin embargo, la tasa de error fue del 30% a bajas velocidades, como 0,06 m/s. A altas velocidades, como 0,3 m/s y 0,5 m/s, la tasa de error fue del 3%-4% (Figura 2). La velocidad máxima alcanzada durante el entrenamiento fue de 0,4 m/s en el SED, 0,44 m/s en el MICT y 0,49 m/s en los grupos HIIT en la última resistencia.
El rendimiento físico del pez cebra se evaluó semanalmente utilizando Umax en la prueba de resistencia. Los resultados revelaron mejoras significativas en el rendimiento físico del pez cebra sometido a MICT y HIIT en comparación con el grupo SED (Figura 4). Tanto el MICT como el HIIT se sometieron a la misma distancia recorrida durante el entrenamiento; sin embargo, el grupo HIIT indujo mejoras rápidas, con un aumento significativo en Umax observado después de solo dos semanas (p = 0,0003). Durante el período de entrenamiento, el grupo de HIIT demostró una mejora semanal constante del 10%, lo que resultó en una mejora general de aproximadamente el 30%. Por el contrario, el entrenamiento MICT condujo a ganancias más graduales, con un notable aumento de ~10% en Umax registrado solo en la tercera semana de entrenamiento, seguido de ninguna mejora adicional en la semana siguiente (p = 0,0024). Estos hallazgos ponen de manifiesto los efectos diferenciales de los protocolos de entrenamiento HIIT y MICT en el rendimiento físico del pez cebra.

Figura 1: Diseño del aparato. (A) Esquemas del aparato de natación. Las flechas azules indican la dirección del flujo de agua. Se muestran las longitudes de tubería relevantes. Las letras representan cada componente del aparato descrito en la Tabla Suplementaria 1. (B) Fotografía del aparato. Haga clic aquí para ver una versión más grande de esta figura.
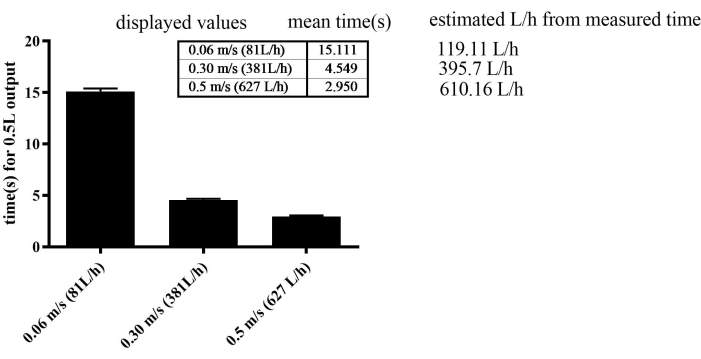
Figura 2: Calibración del sensor de caudal de agua midiendo el tiempo necesario para un caudal de 0,5 L. El SEM fue de 0,277 en los grupos de 0,06 m/s, 0,123 en los de 0,3 m/s y de 0,109 en los de 0,5 m/s. Haga clic aquí para ver una versión más grande de esta figura.
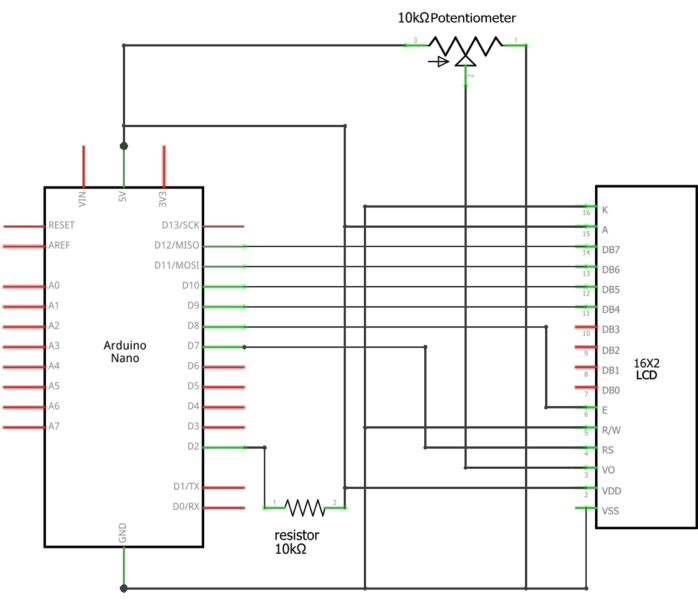
Figura 3: Esquemas de las conexiones de Arduino a la pantalla LCD. Los cables apropiados del sensor deben estar conectados o soldados entre el pin D2 del Arduino y la resistencia de 10 kΩ (cable de señal), la tierra del Arduino (cable negro) y 5 V del Arduino (cable rojo). Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Rendimiento nado expresado en velocidad máxima de natación (Umax). a, b y c indican las diferencias estadísticas entre las estimaciones semanales de la capacidad de natación dentro de cada grupo. *Indica la diferencia entre grupos, comparación mediante análisis de varianza bidireccional (Tukey posthoc). *p = 0,01; **p = 0,001; p = 0,0001. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Medidas morfológicas. (A) Índices de condición corporal (peso [g] / longitud estándar [mm]2; IMC). (B) Imagen representativa de la medida corporal. (c) Puntuación de la condición corporal (BCS). La barra de error corresponde a un rango de 0,026 a 0,045 para el IMC y de 0,4 a 0,96 para el BCS. Haga clic aquí para ver una versión más grande de esta figura.
Tabla complementaria 1: Materiales y guía de montaje del aparato de ejercicio para pez cebra. La tabla presenta letras que se alinean con el orden de ensamblaje que se ilustra en la figura. Haga clic aquí para descargar este archivo.
Archivo complementario 1: Boceto anotado de Arduino para medir la velocidad del agua. Los comentarios de cada línea de código se incorporan después de las barras diagonales dobles. Haga clic aquí para descargar este archivo.
Archivo complementario 2: Archivo de Arduino, incluidos los detalles de configuración. Haga clic aquí para descargar este archivo.
Discusión
En este estudio, se desarrolló un sistema de ejercicio innovador y rentable inspirado en el respirómetro de túnel de natación de Loligo Systems21 y el sistema de canal22 para el examen exhaustivo del rendimiento de natación del pez cebra. La Umax se determinó aumentando sistemáticamente el caudal de agua en etapas discretas, con incrementos de velocidad que ocurrieron en intervalos cortos (20-30 min) hasta que el pez alcanzó el agotamiento, que se caracterizó por tres fatigas consecutivas o la incapacidad de vencer la corriente en el túnel de nado. Estas determinaciones fueron fundamentales para el diseño de dos protocolos de ejercicio (MICT y HIIT). A diferencia de los protocolos que involucran duraciones de etapa relativamente prolongadas (que van de una a varias horas), la velocidad del flujo de agua al agotamiento se conoce como Velocidad Crítica de Natación (Ucri)12. Los valores de Umax calculados con el sistema de ejercicio se ubicaron dentro del rango observado en otros estudios7, confirmando la eficacia de este aparato de natación en túnel para evaluar el rendimiento físico del pez cebra. Además, este aparato compacto posee la versatilidad para cubrir todo el espectro de velocidades de flujo de agua, lo que facilita la personalización de los protocolos de entrenamiento aplicados.
En el desarrollo de este aparato, es posible crear diferentes protocolos de ejercicio controlando solo la velocidad del flujo de agua. Medir con precisión la velocidad del flujo de agua planteó desafíos a bajas velocidades, lo que resultó en una tasa de error de aproximadamente el 30%. No obstante, la precisión mejoró a velocidades intermedias y altas, acercándose a Umax, con una medición de velocidad más fiable y una tasa de error reducida del 3%-4%. En consecuencia, se identificó una limitación en la precisión del dispositivo a bajas velocidades. A pesar de esta limitación, el estudio encontró que incluso con una variación de velocidad de 0,02 m/s, no se observó un impacto significativo en la capacidad física del grupo SED durante el entrenamiento. Esto sugiere que las variaciones en el entrenamiento de baja intensidad pueden no ejercer efectos significativos sobre la capacidad física, al menos en el modelo presentado en este estudio. Otra limitación del aparato propuesto es la ausencia de un sensor de oxígeno, lo que hace imposible medir el consumo de oxígeno.
Estudios previos han demostrado una notable disparidad en la velocidad de nado entre el pez cebra macho adulto y la hembra, con atribuciones sugeridas que incluyen distinciones morfológicas, como el aumento de la circunferencia de las hembras grávidas, y diferencias fisiológicas, como la reducción de la producción de potencia muscular en peces grávidos 5,23,24. Esta investigación sometió exclusivamente a las hembras de pez cebra al régimen de entrenamiento, reconociendo que estas hembras se sometieron a tres ciclos de reproducción antes, durante y después del entrenamiento, precediendo constantemente a las mediciones corporales. Este enfoque estratégico mitigó eficazmente las diferencias corporales entre las personas del sexo. Además, este estudio no reveló diferencias perceptibles en los parámetros corporales entre los grupos de entrenamiento (Figura 5) o al comparar las condiciones pre y post entrenamiento en las hembras. Si bien no hubo control de la variación de edad entre los individuos, está bien documentado que el rendimiento de la natación y las demandas de energía de locomoción pueden fluctuar marcadamente a lo largo del ciclo de vida debido a la ontogenia, la reproducción y la senescencia 25,26,27. A pesar de las posibles diferencias de edad dentro de cada grupo, todos los animales se agruparon meticulosamente en función del tamaño, el peso corporal y una etapa adulta sexualmente madura consistente. Cabe destacar que no se observaron diferencias estadísticamente significativas entre los grupos antes de iniciar la pauta de ejercicios. En consecuencia, se postuló que la mejora observada en la capacidad de natación se puede atribuir con confianza únicamente a los protocolos de ejercicio empleados.
Este estudio tuvo como objetivo evaluar la efectividad del sistema de ejercicio mediante la implementación de dos protocolos de ejercicio distintos. Mientras que el MICT implica un régimen de ejercicio sostenido y continuo, el HIIT incorpora ráfagas cortas de ejercicio de máxima intensidad seguidas de breves períodos de recuperación menos intensos. Ambos protocolos se ajustaron meticulosamente para proporcionar cargas de entrenamiento equivalentes durante todo el período de entrenamiento sin inducir agotamiento. El grupo SED se sometió a la misma prueba de resistencia una vez a la semana durante cuatro semanas, al igual que los otros grupos de ejercicio, pero mostró una mejora mínima en el rendimiento. El entrenamiento de resistencia es reconocido por mejorar el gasto cardíaco, el consumo máximo de oxígeno y la biogénesis mitocondrial28; Sin embargo, la frecuencia de ejercicio semanal resultó insuficiente para provocar cambios significativos en el rendimiento de la natación. Cuando el pez cebra fue sometido al entrenamiento MICT, se observó una mejora notable en el rendimiento de la natación después de la tercera semana de entrenamiento. Sin embargo, no hubo más mejoras en la semana siguiente. La MICT implica que las personas mantengan una carga de trabajo submáxima durante períodos prolongados, lo que requiere una potencia de salida superior a la media22. En particular, el grupo HIIT demostró la mejora más sustancial, con un aumento significativo en el rendimiento aparente después de solo dos semanas de entrenamiento, sostenido hasta la cuarta semana. Si bien está bien documentado que el ejercicio corto y de alta intensidad conduce a la adaptación de la resistencia, el tipo de ejercicio específico responsable de provocar cambios musculares fenotípicos sigue siendo un tema de investigación en curso28.
Divulgaciones
Es esencial aclarar que no existen intereses financieros contrapuestos asociados con la investigación presentada en este manuscrito. No se han establecido asociaciones financieras o afiliaciones con organizaciones o entidades que puedan influir o sesgar los resultados de este trabajo. Esta declaración sirve como garantía de que el proceso de investigación fue sencillo y honesto, sin conflictos financieros que influyeran en los resultados. La presentación de este trabajo está motivada por una pasión genuina por el tema, impulsada únicamente por el amor por la academia y la búsqueda del conocimiento científico.
Agradecimientos
Se extiende su gratitud al Dr. Omar Mertins por proporcionar generosamente acceso al laboratorio para el mantenimiento de los peces y la realización de pruebas. Además, se reconocía a la FAPESP, al CNPq y a la CAPES por la concesión de becas para apoyar esta investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| CPVC Female 90-Degree Elbow for Plumbing | Tigre | 22150260 | 3/4-inch |
| 24AWG Wire | Sky Cablo Store | Connection between components in the Perforated Circuit Board (1m) | |
| Acrylic pipe | The Clear Plastic Shop | 41138408 | 3/4-inch |
| Aquarium Submersible Fish Tank | Aqua Tank | 300w | |
| CPVC Pipe | Tigre | 10121787 | 3/4-inch |
| Female Threaded Gate Water Valve | Tigre | 27950310 | 3/4-inch |
| Female Threaded Globe Water Valve | Tigre | 27940510 | 3/4-inch |
| hrough-hole resistor | BXV | 10 kΩ, 0.25W t | |
| Lab Support Stand With Clamp with 30 inch rod | Masiye Labs | RSC0001 | Support the horizontal pipes |
| LCD screen | Eichip | 16 x 2, model JHD162A | |
| Male x Male Dupont Jumpers | Chyan | Connection between arduino and flow sensor (30 cm) | |
| Perforated Circuit Board single sided | KY WIN ROBOT | 5 x 10 cm | |
| Potentiometer | LUSYA | DL-ALPSA01 | 10kΩ |
| Roll of Water Blocking Tape | One World | 5603131000 | To avoid leaks |
| Silicone hose | Tigre | 14211250 | 2 cm inner |
| Solder Station | QHTITEC | EU/US PLUG | Arduine system welding |
| Solder Wire Spool | BEEYIHF | I001-A001-Set | Arduine system welding |
| Threaded Male Socket and Unthreaded Female Socket CPVC Pipe Fitting | TIgre | 35447849 | 3/4-inch |
| Tricaine (MS-222) | Sigma-Aldrich | E10521 | Anesthetic |
| UNO-R3 board UNO R3 CH340G+MEGA328P Chip 16Mhz | FSXSEMI | For Arduino UNO R3 Development board | |
| Unthreaded CPVC Tee Pipe Fitting, Female | Tigre | 22200267 | 3/4-inch |
| Unthreaded Female CPVC Socket Pipe Fitting | Tigre | 22170260 | 3/4-inch |
| Water Flow Sensor model YF-B5 | Siqma Robotics | SQ8659 | 1-25 L/min |
| Water Pump | Sunsun | Model HJ-2041, 3000L/h, 65W | |
| Water reservoir | Custom | 30 L |
Referencias
- Seo, D. Y., et al. Humanized animal exercise model for clinical implication. Pflugers Arch Eur. J Physiol. 466 (9), 1673-1687 (2014).
- Nylén, E. S., Gandhi, S. M., Lakshman, R. Cardiorespiratory fitness, physical activity, and metabolic syndrome. Cardiorespiratory Fitness in Cardiometabolic Diseases: Prev. & Manag. in Clin. Pract. , Springer. 207-215 (2019).
- Cholewa, J., et al. Basic models modeling resistance training: an update for basic scientists interested in study skeletal muscle hypertrophy. J Cell Physiol. 229 (9), 1148-1156 (2014).
- Martin, B., Ji, S., Maudsley, S., Mattson, M. P. 34;Control" laboratory rodents are metabolically morbid: Why it matters. Proc Natl Acad Sci USA. 107 (14), 6127-6133 (2010).
- Palstra, A. P., et al. Swimming-induced exercise promotes hypertrophy and vascularization of fast skeletal muscle fibres and activation of myogenic and angiogenic transcriptional programs in adult zebrafish. BMC Genomics. 15 (1), 1-20 (2014).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50, 106-113 (2014).
- Usui, T., et al. The French press: A repeatable and high-throughput approach to exercising zebrafish (Danio rerio). Peer J. 2018 (1), 1-12 (2018).
- Tierney, K. B. Swimming performance assessment in fishes. J. Vis. Exp. (51), e2572(2011).
- Palstra, A. P., et al. Establishing zebrafish as a novel exercise model: Swimming economy, swimming-enhanced growth and muscle growth marker gene expression. PLoS One. 5 (12), e0014483(2010).
- Arnold, G. P. Rheotropism in fishes. Biol Rev Camb Philos Soc. 49 (4), 515-576 (1974).
- Messerli, M., et al. Adaptation mechanism of the adult zebrafish respiratory organ to endurance training. PLoS One. 15 (2), 1-20 (2020).
- Bek, J. W., De Clercq, A., Coucke, P. J., Willaert, A. The ZE-tunnel: An affordable, easy-to-assemble, and user-friendly benchtop zebrafish swim tunnel. Zebrafish. 18 (1), 29-41 (2021).
- Lucon-Xiccato, T., et al. An automated low-cost swim tunnel for measuring swimming performance in fish. Zebrafish. 18 (3), 231-234 (2021).
- Blazina, A. R., Vianna, M. R., Lara, D. R. The spinning task: A new protocol to easily assess motor coordination and resistance in zebrafish. Zebrafish. 10 (4), 480-485 (2013).
- Depasquale, C., Leri, J. The influence of exercise on anxiety-like behavior in zebrafish (Danio rerio). Behav Processes. 157, 638-644 (2018).
- Karsenty, A. A comprehensive review of integrated hall effects in macro-, micro-, nanoscales, and quantum devices. Sensors. 20 (15), Basel, Switzerland. 4163(2020).
- Húngaro, T. G. R., et al. Physical exercise exacerbates acute kidney injury induced by LPS via toll-like receptor 4. Front Physiol. 11, 1-13 (2020).
- Marcinko, K., et al. High intensity interval training improves liver and adipose tissue insulin sensitivity. Mol Metab. 4 (12), 903-915 (2015).
- Chen, W., Ge, W. Gonad differentiation and puberty onset in the zebrafish: Evidence for the dependence of puberty onset on body growth but not age in females. Mol Reprod Develop. 80 (5), 384-392 (2013).
- Conradsen, C., Walker, J. A., Perna, C., McGuigan, K. Repeatability of locomotor performance and morphology-locomotor performance relationships. J Exp Biol. 219 (18), 2888-2897 (2016).
- Widrick, J. J., et al. An open source microcontroller based flume for evaluating swimming performance of larval, juvenile, and adult zebrafish. PLoS ONE. 13 (6), 1-14 (2018).
- Gilbert, M. J. H., Zerulla, T. C., Tierney, K. B. Zebrafish (Danio rerio) as a model for the study of aging and exercise: Physical ability and trainability decrease with age. Exp Gerontol. 50 (1), 106-113 (2013).
- Hammer, C. Fatigue and exercise tests with fish. Exp Gerontol. 112 (1), 1-20 (1995).
- Takahiro Hasumura, S. M. Exercise quantity-dependent muscle hypertrophy in adult zebrafish (Danio rerio). J Comp Physiol B. 186, 603-614 (2016).
- Wang, L., et al. Effect of aerobic exercise as a treatment on type 2 diabetes mellitus with depression-like behavior zebrafish. Life Sciences. 300, 120578(2022).
- Conradsen, C., McGuigan, K. Sexually dimorphic morphology and swimming performance relationships in wild-type zebrafish Danio rerio. J Fish Bio. 87 (5), 1219-1233 (2015).
- Hughes, D. C., Ellefsen, S., Baar, K. Adaptations to endurance and strength training. Cold Spring Harb Perspect Med. 8 (6), 1-18 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados