Method Article
신생아 마우스의 일차 달팽이관 유모 세포의 분리 및 배양
요약
여기에서, 우리는 마우스에서 일차 달팽이관 유모 세포를 분리하고 배양하기 위한 상세한 프로토콜을 제시합니다. 처음에는 Corti의 장기를 현미경으로 신생아(3-5일령) 쥐 달팽이관에서 절개했습니다. 이어서, 세포를 효소에 의해 단일세포 현탁액으로 절단하고, 배양에서 며칠 후에 면역형광을 이용하여 확인하였다.
초록
달팽이관 유모 세포는 청각 시스템의 감각 수용체입니다. 이 세포는 청각을 담당하는 감각 기관인 코르티(Corti)의 기관에 있으며, 내이의 골미로(osseous labyrinth)에 있습니다. 달팽이관 유모세포는 해부학적으로나 기능적으로 뚜렷한 두 가지 유형, 즉 바깥쪽 유모세포와 내쪽 유모세포로 구성되어 있습니다. 둘 중 하나가 손상되면 청력 손실이 발생합니다. 특히 내부 유모 세포는 재생될 수 없으며 손상은 영구적입니다. 따라서 일차 유모 세포의 체외 배양은 달팽이관 유모 세포의 보호 또는 재생 효과를 조사하는 데 필수적입니다. 이 연구는 쥐의 유모 세포를 분리하고 배양하는 방법을 발견하는 것을 목표로 했습니다.
달팽이관 측벽을 수동으로 제거한 후, 현미경으로 달팽이관에서 청각 상피를 꼼꼼하게 절개하고, 37°C에서 10분 동안 0.25% 트립신-EDTA로 구성된 혼합물에서 배양하고, 200μL 피펫 팁을 사용하여 배양 배지에 부드럽게 현탁시켰습니다. 세포 현탁액을 세포 필터를 통과시키고, 여과액을 원심분리하고, 세포를 24웰 플레이트에서 배양하였다. 유모세포는 운동 장력에 관여하는 메카노트랜스덕션 복합체인 미오신-VIIa를 발현하는 능력과 팔로이딘을 사용한 F-액틴의 선택적 표지를 통해 확인되었습니다. 세포는 배양에서 4 일 후 >90 % 합류에 도달했습니다. 이 방법은 체외 배양 유모 세포의 생물학적 특성에 대한 이해를 높이고 달팽이관 유모 세포 배양의 효율성을 입증하여 추가 청각 연구를 위한 견고한 방법론적 기반을 구축할 수 있습니다.
서문
달팽이관 유모 세포는 소리를 감지하고 청각 신경으로 신호를 전달하는 데 중요한 역할을 합니다. 유모 세포는 척추 동물의 주요 감각 수용체로 기능하고 소리 진동을 전기 신호로 변환하는 기계론적 세포입니다. 포유류 내이의 감각 상피는 한 줄의 내부 유모 세포와 세 줄의 외부 유모 세포로 구성됩니다. 서로 다른 기본 막 영역에서 유모 세포는 서로 다른 주파수(20Hz에서 2,000Hz 사이)에서 소리를 감지합니다1. 외부 유모 세포의 기능은 포유류의 내이를 미세 조정하는 데 도움이 되는 능동적인 기계적 증폭 과정으로, 소리에 대한 높은 감도를 부여합니다. 내부 유모 세포는 소리를 감지하는 역할을 합니다. 단계적 탈분극 후, 음향 정보는 청각 신경 섬유를 통해 뇌로 전달된다2.
청력 손실은 유전적 결함, 노화, 소음 외상 또는 이독성 약물의 과도한 사용으로 인해 발생할 수 있으며, 이는 전 세계적으로 주요 건강 문제를 구성합니다 3,4. 난청은 주로 유모세포의 돌이킬 수 없는 손상으로 인해 발생한다5. 소음성 난청과 관련하여, 연구자들은 소음성 난청의 원인에 대한 몇 가지 세부 사항에 대해 합의에 도달했지만, 수많은 근본적인 메커니즘에 대한 포괄적인 이해는 부족합니다. 바깥쪽 유모세포는 특히 음향 과다 노출에 취약하다6. 기계에 민감한 달팽이관 유모 세포는 노화 관련 청력 손실에 관여합니다. 그러나 유모 세포 퇴화의 기저에 있는 분자 및 세포 메커니즘은 아직 밝혀지지 않았습니다. 분자 과정의 여러 변화는 유모세포 노화, 산화 스트레스, DNA 손상 반응, 자가포식, 유모세포 분화와 관련된 유전자의 발현 및 전사 조절 장애를 유발한다7.
내이는 신체의 가장 단단한 뼈 깊숙한 곳인 측두골에 둘러싸여 있기 때문에 실험적으로 접근할 수 없어 유모 세포 복구 및 재생 메커니즘에 대한 조사에 어려움을 겪고 있습니다. 따라서 유모 세포의 기능을 조사하기 위한 체외 배양을 확립하는 것은 내이의 재생 및 손상 메커니즘에 대한 연구에 이상적인 방법이 되었습니다. 달팽이관 기관형 배양을 준비하는 절차는 이전 연구 8,9,10에서 설명되었습니다. 전 세계 연구자들은 다양한 달팽이관 미세해부 및 표면 처리 기술을 사용하고 있습니다. 끊임없는 어려움에도 불구하고 다양한 1차 유모 세포 배양 시스템이 체외에서 성공적으로 확립되었습니다. 달팽이관 장기 배양에는 유모 세포, Deiters 세포, Hensen 세포, 기둥 세포 및 청각 신경 섬유를 포함한 다양한 세포 유형이 포함되어 있습니다. 부상 후 세포 및 분자 수준에서 유모 세포의 변화에 대한 심층적인 이해는 보다 강력한 연구 도구를 개발할 수 있게 할 것입니다. 이 연구는 신생아 마우스에서 달팽이관 기관을 분리하고 체외 연구를 위해 풍부한 유모 세포를 효소로 분리하는 단계를 입증하는 것을 목표로 했습니다. 배양된 세포의 성질은 면역형광 염색을 이용하여 확인하였다.
프로토콜
모든 동물 실험은 Xi'an Jiaotong University Committee on the Use and Care of Animals의 승인(No. 2021-847)을 받았습니다.
1. 살균 및 재료 준비
- 고온 및 고압 증기 소독을 사용하여 해부 도구를 멸균하고 50°C 인큐베이터에서 밤새 건조시킵니다.
- 10% 소 태아 혈청(FBS)과 10mg/mL 페니실린/스트렙토마이신을 함유한 배양 배지 100mL를 미리 준비합니다(FBS 10mL와 페니실린 원액 10μL를 Dulbecco's Modified Eagle Medium(EMEM) 90mL에 추가)하고 4°C에서 보관합니다.
2. 청각 상피 채취를 위한 측두골 절제 및 제거
- 총 10마리의 갓 태어난 쥐(P3에서 P5 사이의 나이)를 얼음 위에서 참수하여 안락사시킵니다. 필요한 경우 윤리적으로 승인된 대체 방법론을 사용합니다.
- 머리를 제자리에 고정하고 미세 작동 가위를 사용하여 시상 봉합사를 따라 두피를 열고 그림 1A와 같이 손가락으로 두피를 분리하여 양측으로 고정합니다.
- 작은 골막 엘리베이터를 사용하여 뇌를 제거하고 기저 두개골을 이등분합니다. 가위로 두개골을 자르고 앞으로 뒤집어 두개골을 엽니다. 가위 끝을 사용하여 뇌를 긁고 두개골 바닥을 노출시킵니다.
- 두개골 기저부의 양측 측두골을 관찰합니다(그림 1C). 가위를 사용하여 정중선을 따라 두개골 바닥을 자르고 피부를 긁어내고 불필요한 뼈를 제거합니다(그림 1D,D').
- 측두골을 보관하고 신선한 Hank's balanced salt solution(HBSS)이 포함된 35mm 멸균 페트리 접시에 옮깁니다(그림 1E).
- 두 개의 #5 뾰족한 집게를 사용하여 측두골의 잎 부분에서 수포와 주변 조직을 제거합니다(그림 1E).
참고: 이 단계에서 쥐의 측두골에 있는 뼈 미로는 완전히 석회화되지 않으며 겸자를 사용하여 쉽게 해부할 수 있습니다. - 한 손으로 집게를 잡고 측두골의 반원형 부분을 고정하고 다른 손으로 집게의 아래쪽 발을 둥근 창 틈새에 밀어 넣어 달팽이관의 측면 뼈를 스칼라 전정에서 분리합니다. OC 상피를 건드리지 않고 측두골의 페트로 부분을 조심스럽게 제거합니다. 그런 다음 달팽이관의 뼈 미로를 기저 끝에서 정점 끝까지 조심스럽게 분리하여 제거합니다(그림 1F).
- #5 뾰족한 집게를 사용하여 코티 감각 상피의 기관을 모디올러스에서 조심스럽게 미세 분리합니다(그림 1G).
- 나선형 인대를 잡고 미세 작동 겸자를 사용하여 선조체 혈관에서 조심스럽게 분리한 다음 200μL 피펫을 사용하여 깨끗한 청각 상피를 HBSS가 포함된 3mm 멸균 배양 접시로 옮깁니다(그림 1H).
- 각 동물에서 20개의 검체를 채취하고 다음 준비 단계를 위해 HBSS가 포함된 100mm 멸균 페트리 접시로 빠르게 옮깁니다(그림 1).
3. 청각 유모 세포를 얻기 위한 효소 분해
- 청각 상피를 0.25% 트립신이 함유된 신선한 DMEM 10mL에 옮기고 37°C에서 12분 동안 배양합니다.
- 200μL 피펫 팁을 사용하여 작동 현미경으로 기저층 및 기타 세포에서 유모 세포를 부드럽게 분리합니다.
- 응집을 억제하기 위해 배양 배지 10mL를 더 추가합니다.
- 70μm 필터를 통해 배양 배지의 부유 세포를 여과하고 깨끗한 50mL 튜브에 여과액을 수집한 다음 300× g 에서 5분 동안 원심분리합니다.
- 1,000μL 피펫 팁을 사용하여 위아래로 부드럽게 피펫팅하여 최소 5mL의 배양 배지에 유모 세포를 재현탁시킵니다. 거품이 생기지 않도록 하십시오.
- 미리 6웰 플레이트의 바닥에 커버슬립을 놓습니다. 세포를 계수하고 6웰 플레이트에서 106 cells/mL의 밀도로 배양합니다.
- 37°C 및 5%CO2에서 2mL의 DMEM(FBS 10%, 페니실린 100단위/mL, 스트렙토마이신 100μg/mL 포함)에서 부착 세포를 성장시킵니다.2. 매일 배양 매체를 바꾸십시오.
참고: 이 프로토콜을 사용한다고 해서 순수한 유모 세포를 얻을 수 있는 것은 아니라는 점을 언급해야 합니다. 이 1차 세포 배양 방법에 따라 유모 세포가 배양 중인 세포의 약 70%를 구성하고 양호한 상태일 수 있으므로 추가 연구를 위해 d2 또는 d3 세포를 사용하는 것이 좋습니다.
4. 면역형광 염색
- 배양된 세포를 d1에서 d6까지(하루에 웰 1개) 수확합니다. 배양액을 흡인하고 인산염 완충 식염수(PBS)로 세포를 2배 헹굽니다.
- 실온(RT)에서 15분 동안 4% 파라포름알데히드로 세포를 고정합니다.
- 고정액을 제거하고 PBS로 3 x 3분 동안 셀을 헹굽니다.
- RT에서 10분 동안 0.2% Triton X-100을 함유한 PBS로 세포를 투과시킵니다.
- PBS에서 10 % FBS로 구성된 차단 용액으로 투과화 된 세포를 RT에서 20 분 동안 배양합니다.
- 4 °C에서 밤새 anti-myosin monoclonal 항체 (PBS에서 1:200에 희석)로 세포를 염색하십시오.
- 멸균 PBS로 세포를 3배 세척하고 2차 항체(Alexa Fluor 594 goat anti-rabbit MYO7A, PBS에서 1:500으로 희석됨) 및 플루오레세인 표지 팔로이딘(Alexa Fluor 488, 세포 구조 식별용)으로 RT에서 2시간 동안 배양합니다.
- PBS로 세포를 3번 헹구어 2차 항체를 제거합니다.
- DAPI가 있는 장착 매체 1-2방울을 슬라이드에 추가하고 커버슬립을 장착한 다음 레이저 스캐닝 컨포칼 현미경 아래에 놓아 세포 사진을 캡처합니다.
5. 통계 분석
- 이원 분산 분석(ANOVA)을 수행한 후 Tukey의 사후 검정을 수행하여 시간 경과에 따른 myosin-VIIa 및 phalloidin의 회색 값 변화를 분석합니다. 문자 표시 방법을 사용하여 통계적 차이를 표시합니다.
- 추가 일원 분산 분석 후 Tukey의 사후 테스트를 수행하여 1일차부터 6일차까지의 세포 샘플 간의 팔로이딘 양성 세포 비율과 같은 날의 미오신 VII 양성 세포 비율을 비교합니다.
결과
이 프로토콜에 따라 분리된 세포에 씨앗을 뿌렸습니다. 1차 달팽이관 유모 세포 씨앗은 세포가 배양 배지에 떠 있지 않고 24시간 이내에 퍼지면 성공한 것으로 간주되었습니다. 우리는 유모 세포가 달라붙어 접시 바닥에 평평한 응집체로 퍼진 후 유모 세포의 수를 결정했습니다. 1일 후, 살아있는 유모세포를 배양접시 바닥에 단단히 부착하고 부착되지 않은 세포를 PBS로 헹궈 제거하였다. 일반적으로 세포 수는 배양 3일 후에 두 배로 증가했습니다(그림 2).
면역형광(IF)은 d6까지 myosin-VIIa와 phalloidin의 발현을 밝혔습니다(그림 3A). myosin-VIIa 회색 값과 양성 세포 비율은 시간이 지남에 따라 감소하는 반면, 팔로이딘 회색 값과 양성 세포 비율은 배양 후 d1에 비해 동일하게 유지되는 것을 관찰했습니다(그림 3B-D). 우리는 myosin-VIIa-양성 세포가 실제로 유모 세포인지 확인하기 위해 양성 대조군으로 유기 배양을 사용했습니다. 보충 그림 S1은 배양 2일 후 청각 상피에서 myosin-VIIa(녹색), phalloidin(녹색) 및 4′6-diamidino-2-phenylindole(DAPI, 파란색)의 면역형광 염색을 보여줍니다.
IF를 이용하여 얻어진 세포가 유모 세포임을 확인했습니다. 특히, 대부분의 배양된 세포는 청각 세포 마커인 myosin-VIIa(적색) 단백질에 대해 양성 염색을 보였으며 형광 현미경 아래에서도 길쭉한 모양을 보였습니다(그림 3A). 이러한 결과는 배양된 세포가 주로 유모 세포임을 시사합니다.
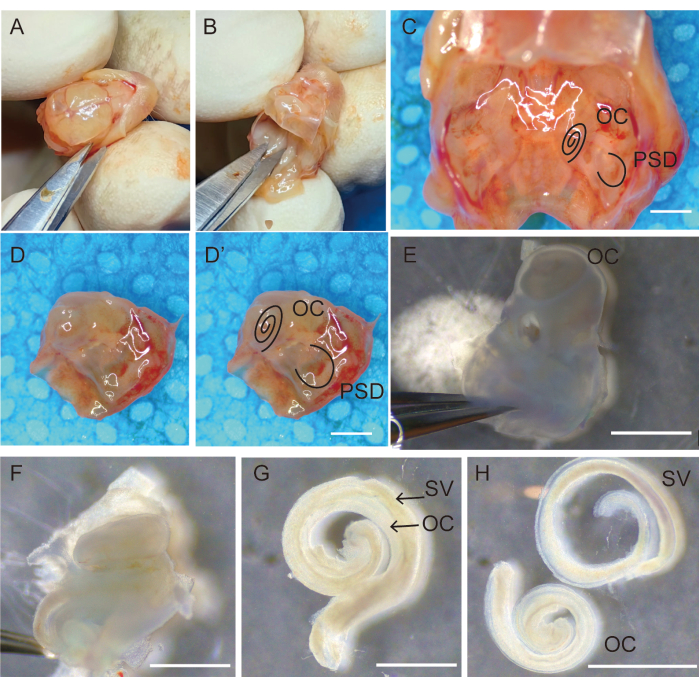
그림 1: 청각 상피 수집을 위한 측두골의 절개 및 제거. (A) 시상 봉합사를 따라 두개골을 참수하고 개방하는 단계; (B) 뇌 제거. (C) 두개골 기저부에 위치한 양측 측두골의 모습. OC 및 PSD로 표시된 측두골(D')을 둘러싼 뼈와 tissures를 제거한 후의 오른쪽 측두골(D). (E) 측두골을 신선한 Hank's balanced salt solution(HBSS)으로 옮기고 등골을 제거하고 타원형 창이 위로 향하게 놓습니다. (F) 달팽이관의 뼈 미로를 기저부에서 정점 끝까지 조심스럽게 분리하여 제거합니다. 코르티 감각 상피 기관(G)은 선조체 혈관에 부착되어 있고, (H)는 선조체 혈관에서 분리되어 있습니다. 스케일 바 = 1,000 μm (C-H). 약어: OC = 코르티 기관; PSD = 후방 반고리관; SV = 선조체 혈관. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
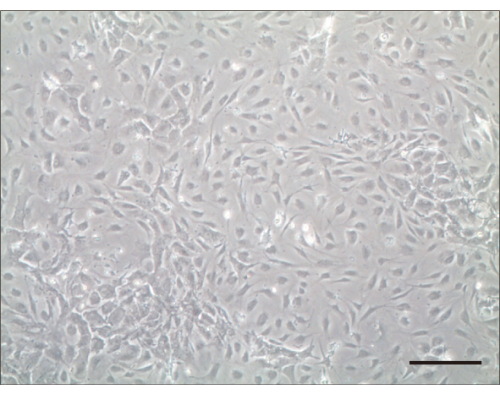
그림 2: 배양 후 4일 후의 유모 세포. 배양 후 4일 후에 광현미경 검사. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
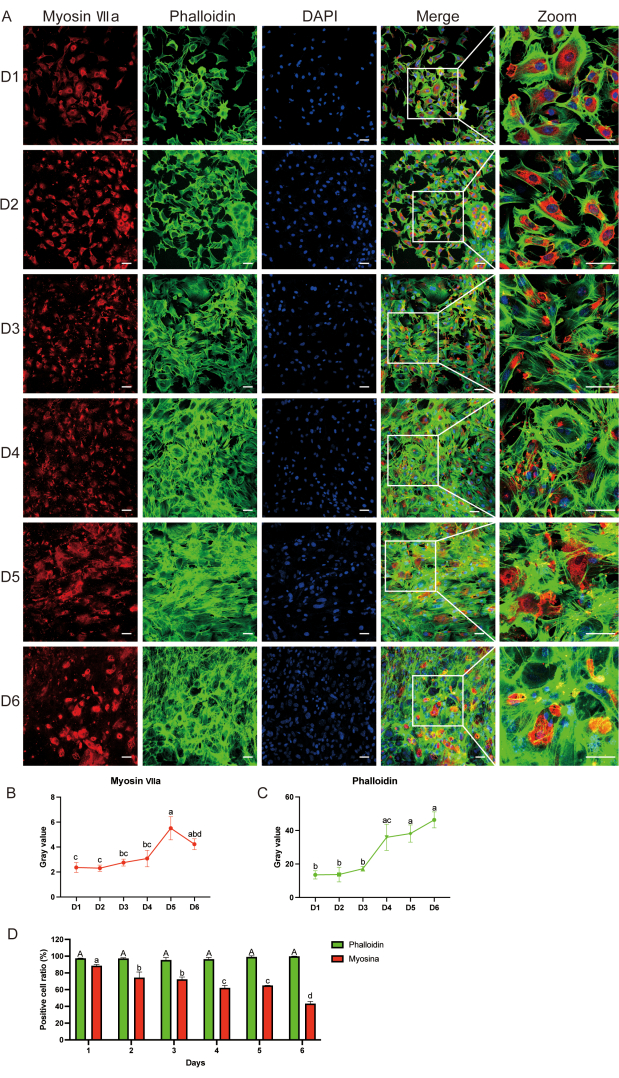
그림 3: 면역형광을 이용한 유모세포 표면 마커 검출. (A) 세포 배양 후 1일차부터 6일차까지 Myosin-VIIa(빨간색), 팔로이딘(녹색) 및 DAPI(파란색) 면역형광 염색. (나, 씨) myosin-VIIa 및 phalloidin의 회색 값 분석; 통계적 차이는 문자로 표시됩니다. (D) 1일차부터 6일차까지의 세포 샘플과 같은 날의 미오신 VII 간의 팔로이딘 양성 세포 비율 비교. 대문자는 팔로이딘에 대한 통계적 결과를 나타내는 반면, 작은 문자는 미오신 VIIa에 대한 통계적 결과를 나타냅니다. 데이터는 평균의 평균 ± 표준 오차로 표시됩니다. N = 5; 눈금 막대 = 50μm. 미오신 VIIa 및 팔로이딘의 회색 값 분석을 위해 Tukey의 사후 검정에 이어 양방향 분산 분석(ANOVA)을 수행했습니다. d1 내지 d6의 세포 샘플 간의 팔로이딘 및 미오신-VII-양성 세포 비율을 비교하기 위해 일원 분산 분석을 수행했습니다. 다른 글자는 팔로이딘 염색의 통계적 차이를 나타내는 반면, 작은 글자는 미오신 VIIa 염색의 통계적 차이를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 S1: 유기 배양에서 유모 세포 표면 마커의 면역형광 검출. myosin-VIIa(녹색), phalloidin(녹색) 및 DAPI(파란색)의 면역형광 염색은 유기 배양의 d 2에서 수행되었습니다. 눈금 막대 = 10μm. 약어: IHC, 내부 유모 세포; OHC, 외부 유모 세포; DAPI, 4′,6-디아미디노-2-페닐린돌. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 S2: 통로 유모 세포의 표면 마커의 면역형광 검출. (A) myosin-VIIa(빨간색), phalloidin(녹색) 및 DAPI(파란색)의 면역형광 염색은 통로 2 및 3에서 유기 배양물에 대해 수행되었습니다. (B) 팔로이딘 양성 세포, 미오신 VIIa 양성 세포 및 일차 세포에서 통로까지의 전체 세포 수 비교 3. N = 3; 스케일 바 = 100μm. 데이터는 평균± 표준 편차로 표시됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
HEI-OC1 세포주와 비교했을 때, 유모 세포의 1차 배양은 생체 내 세포의 생리학적 상태를 보다 정확하게 복제했습니다. 따라서 달팽이관 기관에서 살아있는 세포를 분리하고 즉시 배양하여 확립된 청각 1차 배양법은 청각 시스템에 대한 광범위한 연구에 유용한 도구로 보입니다. 특정 기술은 성공적인 문화에 매우 중요합니다. 첫째, 측두골에서 코르티 기관이 분리되는 기간을 최소화하면 유모 세포의 지속적인 활동 가능성이 높아집니다. 따라서 연구자들은 PBS에서 장기의 해부와 침지 사이의 시간 간격을 최소화해야 합니다. 우리의 실험적 관찰에 따르면, 약 2-3 시간의 지속 시간은 10 마리의 쥐를 해부하고 한 번에 20 개의 내이를 얻는 데 충분합니다. 효소 분해 과정 중에는 시간을 12분으로 제한하고 8분의 잠복기 후에 달팽이관 기관을 피펫으로 옮기는 것이 좋습니다. 장기는 약 10회의 피펫팅 주기 후에 현미경으로 관찰되었으며, 거의 모든 세포가 기저막에서 분리되었을 때 효소 분해가 중단되었습니다. 그렇지 않으면, 장기를 다시 4분 동안 인큐베이터로 되돌려 보냈다. 항생제의 선택도 중요합니다. 일부 아미노글리코시드 항생제는 이독성이 있어 유모 세포 사멸을 유발할 수 있으므로 잠재적인 오염 문제를 방지하기 위해 10mg/mL의 페니실린/스트렙토마이신을 사용하는 것이 좋습니다.
클래스 VII 미오신 (myosin)은 동물 조직에서 널리 발현되지만, 미오신 -VIIa는 내이 (inner ear)의 전정 및 달팽이관 기관의 유모 세포에서만 발현됩니다. Class VIIa 미오신 (myosin)은 유모 세포 11 (hair cells11)의 발목 연결 부위에서 입체 섬모를 상호 연결하는 데 도움이되기 때문에 입체 섬모 구조를 유지하는 데 중요한 역할을합니다. 일차 세포 배양 기간과 세포 통로 수가 증가함에 따라 미오신 -VIIa의 분해도 시간이 지남에 따라 증가한 반면, 팔로이딘은 안정적으로 유지되어 청각 세포의 기능이 시간이 지남에 따라 감소했음을 나타냅니다. 이 프로토콜의 주요 한계는 청각 세포는 6-7일 이내에만 사용할 수 있고 HEI-OC1 세포보다 성장하는 데 더 오래 걸린다는 것입니다12. 더욱이, 일차 세포는 결국 노화되어 죽는 것이 불가피하며, 제한된 성장 잠재력을 나타냅니다. 또한 유모 세포 분리 및 배양에 드는 시간과 경제적 비용이 높고 광범위한 전문 지식이 필요한 경우가 많습니다. 코르티 기관에는 내부 모발, 외부 모발 및 지원 세포를 포함한 다양한 신경 감각 세포가 포함되어 있습니다. 이 프로토콜은 시험관내에서 이러한 세포를 분리하고 배양하는 방법을 도입했습니다. 일차 세포는 myosin-VIIa 및 Sox2에 대한 염색을 통해 모발과 지지 세포를 각각 구별할 수 있습니다13,14. 바깥쪽 유모 세포와 안쪽 유모 세포는 서로 다른 기능을 수행합니다. 바깥쪽 유모 세포는 막 전위의 변화에 반응하여 길이와 강성을 빠르게 변화시키고 안쪽 유모 세포로 전달됩니다. 프레스틴(Prestin)은 바깥쪽 유모세포의 운동 단백질인 반면, Slc17a8(vGlut3)은 IHC에서 특이적으로 발현되며 시험관 내 15,16,17,18에서 내부 유모세포를 구별하는 데 사용할 수 있습니다.
유기 배양과 비교했을 때, 유모 세포의 형태는 일차 유모 세포 배양에서 크게 변화하여 형태와 기계적 전달 기능이 다릅니다. 유기 배양은 전형적인 세포 패턴, 극성, 모발 형성 및 코르티 기관 내의 신경 연결을 나타내는 3차원 1차 세포 배양입니다. 대조적으로, 일차 HEI-OC1 세포는 전형적인 다각형 모양을 가지며 2차원 배양 환경에서 정적 부착을 통해 평평하게 자랍니다19. 유기 배양액과 일차 세포는 조직에서 직접 분리되어 정상적인 세포 형태와 중요한 기능 관련 마커를 나타냅니다. 그러나 일반적으로 증식성이 높고 배양 및 형질 주입이 용이하며 수십 년 동안 유지될 수 있는 HEI-OC1 세포와 달리 이러한 세포는 수명이 유한하고 확장 용량이 제한적입니다.
일차 세포는 세포 배양에서 많은 장점이 있습니다. 일차 세포는 신체 조직에서 얻어지고 최적의 성장 조건에서 배양되기 때문에 생체 내 조직 환경을 밀접하게 모방합니다. 일차 세포를 사용하면 동물 실험에 대해 제기되는 많은 윤리적 반대를 피할 수 있으며 세포주보다 더 관련성 있는 결과를 얻을 수 있습니다. 사전 선택된 일차 세포는 생체 내에서 분자 신호 전달을 밀접하게 나타내는 적절한 모델입니다. 서로 다른 기증자의 세포는 전염증성 사이토카인에 다르게 반응합니다. 격리 및 배양 비용은 동물 모델보다 저렴하지만 종종 높습니다. 여기에 설명된 1차 유모세포 배양에 사용된 재료와 동물은 단순하고, 비용이 상대적으로 저렴하며, 시스템 작동이 쉬웠습니다. 최적의 배양 조건이 유지되지 않으면 일차 세포의 특성이 후속 절대로 변할 수 있습니다. 통로의 수가 증가함에 따라, 세포 상태도 약화되었다(보충 그림 S2). 변형 없이 천연 신체 조직에서 직접 추출했기 때문에 얻은 청각 유모 세포는 생체 내 상태와 생리학을 밀접하게 모방했습니다. 따라서 일차 유모세포는 세포 대사 및 약물 독성을 포함한 유모세포의 생리학 및 생화학을 연구하기 위한 우수한 모델 시스템을 제공합니다. 1차 세포는 체외에서 며칠 동안만 유지될 수 있지만, 유전자 형질전환 후 불멸화되고 무한정 분열되어 2차 세포주를 얻을 수 있습니다.
결론적으로, 현재 프로토콜은 미세해부와 효소 분해를 사용하여 측두골에서 청각 유모 세포를 분리하는 방법을 설명했습니다. 전체 프로토콜은 마우스 해부에서 세포 도금까지 약 3시간이 걸렸습니다. 배양된 세포는 고순도로 유지되었고 6-7일 동안 건강하게 유지되었습니다. 단 두 개의 구절로 제한되는 1차 유모세포 배양의 본질적인 한계에도 불구하고, 이 프로토콜은 간단한 방법론과 재료를 사용하여 달팽이관 유모세포에 대한 매우 효율적인 연구를 수행할 수 있는 새로운 방법을 제시했습니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 연구는 중국 국립 자연 과학 재단 (NFSC 82101224 YG)의 지원을 받았습니다
자료
| Name | Company | Catalog Number | Comments |
| 100 mm BioLite cell culture dish | Thermo Fisher Scientific | 130182 | using for culture |
| 35 mm Nunc cell culture dish | Thermo Fisher Scientific | 150318 | using for culture |
| 6-well palate | Thermo Fisher Scientific | 310109005 | using for culture |
| 70 µm cell strainers | BD Company | 352350 | using for filter |
| Alexa Fluor 488 Phalloidin | Thermo Fisher Scientific | A12379 | immunofluorescent staining |
| Anti-rabbit IgG Alexa Fluor 488 | Thermo Fisher Scientifc | A11008 | immunofluorescent staining |
| day 3-5 neonatal murine | provided by Xi'an Jiaotong University | ||
| Dulbecco’s Modified Eagle Medium | Thermo Fisher Scientific | 11965092 | using for culture |
| Fetal Bovine Serum | Thermo Fisher Scientific | 12483020 | using for culture |
| Forceps | Dumont | 5# | using for dissection |
| Leica anatomy microscope | Germany | S9i | using for dissection |
| Penicillin/streptomycin | Thermo Fisher Scientific | 15140-122 | using for culture |
| Rabbit plyclonal to Myosin VIIa | Abcam company | ab92996 | immunofluorescent staining |
| Scissor | Belevor | 10cm/04.0524.10 | using for dissection |
| Triton X-100 | Sigma Aldrich | 9036-19-5 | immunofluorescent staining |
| Trypsin | Thermo Fisher Scientific | 25200072 | using for culture |
참고문헌
- Tani, T., Koike-Tani, M., Tran, M. T., Shribak, M., Levic, S. Postnatal structural development of mammalian Basilar Membrane provides anatomical basis for the maturation of tonotopic maps and frequency tuning. Sci Rep. 11 (1), 7581 (2021).
- Goutman, J. D., Elgoyhen, A. B., Gomez-Casati, M. E. Cochlear hair cells: The sound-sensing machines. FEBS Lett. 589 (22), 3354-3361 (2015).
- Joo, Y., et al. The Contribution of Ototoxic Medications to Hearing Loss Among Older Adults. J Gerontol A Biol Sci Med Sci. 75 (3), 561-566 (2020).
- Nieman, C. L., Oh, E. S. Hearing Loss. Ann Intern Med. 173 (11), ITC81-ITC96 (2020).
- Mao, H., Chen, Y. Noise-Induced Hearing Loss: Updates on Molecular Targets and Potential Interventions. Neural Plast. 2021, 4784385 (2021).
- Morioka, S., et al. Hearing vulnerability after noise exposure in a mouse model of reactive oxygen species overproduction. J Neurochem. 146 (4), 459-473 (2018).
- Liu, H., et al. Molecular and cytological profiling of biological aging of mouse cochlear inner and outer hair cells. Cell Rep. 39 (2), 110665 (2022).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic Culture of Neonatal Murine Inner Ear Explants. Front Cell Neurosci. 13, 170 (2019).
- Ding, D., et al. Cisplatin ototoxicity in rat cochlear organotypic cultures. Hear Res. 282 (1-2), 196-203 (2011).
- Abitbol, J., et al. Cisplatin-induced ototoxicity in organotypic cochlear cultures occurs independent of gap junctional intercellular communication. Cell Death Dis. 11 (5), 342 (2020).
- Li, S., et al. Myosin-VIIa is expressed in multiple isoforms and essential for tensioning the hair cell mechanotransduction complex. Nat Commun. 11 (1), 2066 (2020).
- Kalinec, G. M., Park, C., Thein, P., Kalinec, F. Working with auditory HEI-OC1 cells. J Vis Exp. (115), (2016).
- Montgomery, S. C., Cox, B. C. Whole mount dissection and immunofluorescence of the adult mouse cochlea. J Vis Exp. (107), (2016).
- Xu, J., et al. Identification of mouse cochlear progenitors that develop hair and supporting cells in the organ of Corti. Nat Commun. 8, 15046 (2017).
- Zheng, J., et al. Prestin is the motor protein of cochlear outer hair cells. Nature. 405 (6783), 149-155 (2000).
- Ruel, J., et al. Impairment of SLC17A8 encoding vesicular glutamate transporter-3, VGLUT3, underlies nonsyndromic deafness DFNA25 and inner hair cell dysfunction in null mice. Am J Hum Genet. 83 (2), 278-292 (2008).
- Seal, R. P., et al. Sensorineural deafness and seizures in mice lacking vesicular glutamate transporter 3. Neuron. 57 (2), 263-275 (2008).
- Luo, Z., et al. Three distinct Atoh1 enhancers cooperate for sound receptor hair cell development. Proc Natl Acad Sci U S A. 119 (32), e2119850119 (2022).
- Kalinec, G., Thein, P., Park, C., Kalinec, F. HEI-OC1 cells as a model for investigating drug cytotoxicity. Hear Res. 335, 105-117 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유